黄精(Polygonatum sibiricum)是百合科黄精属多年生草本植物,以干燥根茎入药。黄精种类繁多,其中浙江地区主要以多花黄精(Polygonatum cyrtonema Hua)和长梗黄精(Polygonatum filipes Merr.)为主 [1] 。黄精药用历史悠久,被视为“长生不老和延年益寿”的传统中药,同时也是一味传统畲药和畲族人养生保健的重要药材。黄精含有多糖、甾体皂苷、黄酮、黄酮苷和生物碱等成分,其中含量最丰富的活性成分为黄精多糖,现代药理学研究表明黄精多糖具有提高免疫力、抗氧化、抗衰老、抗菌、抗病毒和抗肿瘤等多种药理作用 [2,3] 。2002 年黄精被中国卫生部列入既是食品又是药品的物品名单,是应用广泛的药食两用资源 [4] 。目前以黄精为主要原料相继研发出了黄精甜米酒复合饮料 [5] 、黄精发酵饮料 [6] 等,但作为保健功能食品开发的产品较少。
覆盆子同样是优质的药食同源药材,其未成熟果实和根均可入药,目前收录在2015 年版《浙江省中药炮制规范》中,浙江地区的品种以掌叶覆盆子(Rubuschingii Hu)为主 [7] 。覆盆子活性成分包括黄酮类、酚酸类、萜类、生物碱类,氨基酸和微量元素等,具有抗氧化、抗菌、抗炎和抗癌等药理作用 [8,9] 。覆盆子的活性成分以黄酮含量最高,具有很好的抗氧化和炎症抑制作用 [10] 。以覆盆子作为原料进行食品开发应用较广,如覆盆子浆果果酒 [11] ,蓝莓覆盆子复合饮料 [12] 等,但覆盆子与其他天然食品原料配伍开发复合保健饮料的研究却鲜有报道。
黄精和覆盆子作为药食两用之品,集药用、食用、观赏和保健于一体,开发潜力巨大、市场前景广阔,具有极高的经济价值,在功能性食品开发领域具有较大的发展潜力与广阔的市场前景 [1] 。因此,本研究以多花黄精干燥根茎和新鲜掌叶覆盆子浆果为原料,以黄精提取液和覆盆子提取液为主要成分,以黄精多糖和覆盆子总黄酮为考察指标进行黄精覆盆子保健饮料工艺研发,通过响应面优化设计摸索保健饮料配方比例,并通过体外实验开展保健饮料抗氧化功效评价。本款保健饮料的开发为更多黄精覆盆子功能性食品、保健品的开发提供了研发思路,同时也有助于黄精覆盆子产品附加值的提升,促进区域内黄精覆盆子产业的发展。
1 材料与方法
1.1 实验材料
多花黄精,购自浙江贸润科技有限公司;新鲜采摘的覆盆子,购自浙江本润生物科技有限公司;芦丁标准品(No.20220323),国药集团化学试剂有限公司;果胶酶(No.20211002),山东隆科特酶制剂有限公司;食品级柠檬酸,上海鑫泰食品配料商城;食用级木糖醇(120042604),山东华一生物 科 技;DPPH 试 剂(Phygene,20210810)、总 抗氧化能力检测试剂盒(ABTS 法,SO119),上海碧云天生物技术有限公司;总抗氧化能力检测试剂盒(FRAP,SO116),上海碧云天生物技术有限公司;PC-12 细胞,购自ATCC 细胞库;PBS 缓冲液(BL601A),Biosharp;CCK-8 试剂盒(CA1210-100),SoLarbio;DMEM 高糖培养基(BL704A),Biosharp;Dimethyl sulfoxide(D8370-100),SoLarbio 等。
1.2 实验仪器
YF103 XFB-200 粉碎机,瑞安市永立制药机械有限公司;KQ5200B 超声清洗机,昆山市超声仪器有限公司;PB-10 台式酸度计,德国Satorius 公司;DK-8D 电热恒温水槽,上海精宏实验设备有限公司;BSA224S 电子天平,德国Satorius 公司;SYNERGYH1 酶标仪,美国Biotek 公司;BB150 二氧化碳培养箱,美国Thermo 公司;DMi8 倒置荧光显微镜,德国Leica 公司;Cary 300 紫外分光光度计,美国Varian 公司;1300 Series A2 生物安全柜,美国Thermo 公司。
1.3 试验方法
1.3.1 黄精与覆盆子活性成分提取液的提取工艺
1.3.1.1 工艺流程
新鲜黄精块茎→干燥→粉碎→加水混料→超声处理→过滤去渣→黄精活性成分提取液
覆盆子鲜果→清洗切丁→打浆→酶解→加热灭酶→过滤去渣→覆盆子活性成分提取液
1.3.1.2 黄精粗多糖提取单因素试验
本实验通过苯酚-硫酸法 [13] ,以葡萄糖标准品绘制标准曲线测定黄精多糖含量,通过单因素试验考察料液比(黄精和料液的质量体积比,g/mL)、超声时间(min)、超声温度(℃)3 个因素对黄精多糖得率的影响。参数设置分别为:料液比(1:10、1:20、1:30、1:40、1:50 g/mL);超声时间(20、40、60、80、100 min);超声温度(40、50、60、70、80 ℃)。根据1.3.1.1 工艺流程进行操作,每次实验重复3 次。多糖提取得率由公式(1)计算得到:
式中:
D——多糖提取得率,%;
m1——黄精提取后测得的多糖质量,g;
m0——黄精粉末质量,g。
1.3.1.3 黄精粗多糖提取正交试验
根据单因素试验结果,以料液比(A)、超声时间(B)、超声温度(C)3 个因素作为自变量设计L9(33)正交试验,以黄精多糖指标确定黄精提取液最佳提取工艺,正交试验因素水平表见表1。
表1 黄精多糖和覆盆子黄酮提取正交实验因素水平表
Table 1 Orthogonal test factor level table of polygonatum polysaccharide and raspberry flavonoids extraction
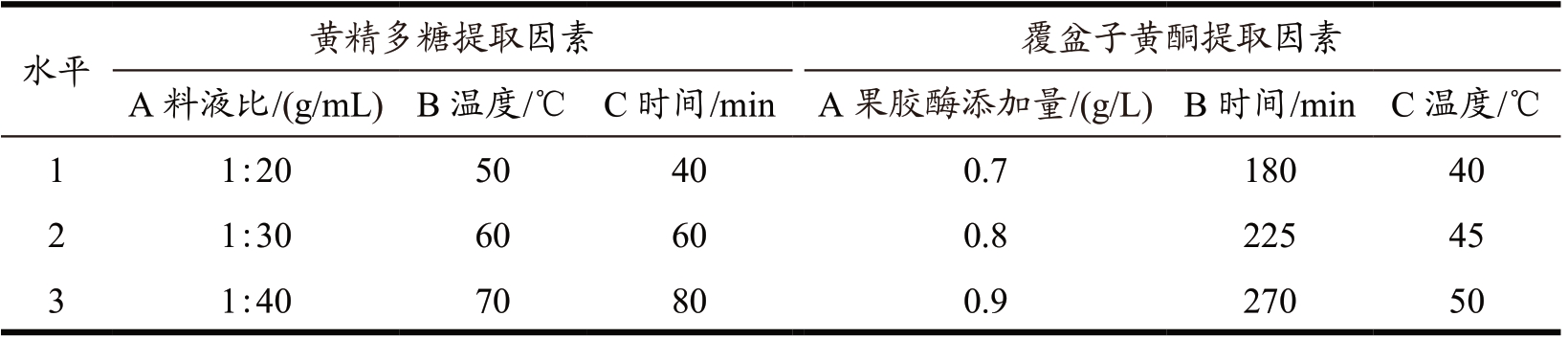
水平 黄精多糖提取因素 覆盆子黄酮提取因素A 料液比 /(g/mL) B 温度 /℃ C 时间 /min A 果胶酶添加量 /(g/L) B 时间 /min C 温度 /℃1 1:20 2 1:30 50 40 0.7 180 40 60 60 0.8 225 45 3 1:40 70 80 0.9 270 50
1.3.1.4 覆盆子总黄酮提取单因素试验
采用NaNO2-Al(NO3)3 比色法,以芦丁标准品绘制标准曲线测定覆盆子总黄酮的含量 [14] ,通过单因素试验考察果胶酶添加量(A)、酶解时间(B)、酶解最适温度(C)3 个因素对覆盆子总黄酮得率的影响。参数设置分别为:果胶酶添加量(质量浓度为0.5、0.6、0.7、0.8、0.9、1.0 g/L);酶解时间(45、90、135、225、270 min);酶解温度(30、35、40、45、50、55 ℃)。根据1.3.1.1 工艺流程进行操作,每次实验重复3 次。黄酮提取得率由公式(2)计算得到:
式中
D1——总黄酮提取得率,%;
m2——覆盆子提取后测得的总黄酮质量,g;
m——覆盆子质量,g。
1.3.1.5 覆盆子总黄酮提取正交试验
根据单因素试验结果,以果胶酶添加量(A)、酶解时间(B)、酶解最适温度(C)3 个因素作为自变量设计L9(33)正交试验,以覆盆子总黄酮指标确定覆盆子提取液最佳提取工艺,正交试验因素水平表见表1。
1.3.2 黄精覆盆子保健饮料配方优化
1.3.2.1 饮料制备工艺流程
黄精、覆盆子提取液→复配→木糖醇、柠檬酸→加热→罐装→杀菌→冷却→成品
1.3.2.2 单因素试验
采用单因素试验,根据感官评价确定各因素的最优条件 [8] 。条件设置如下:(1)黄精与覆盆子提取液的添加比例(V/V)分别为2:8、3:7、4:6、5:5;(2)木糖醇的添加量(质量浓度)分别为30、40、50、60、70 g/L;(3)柠檬酸的添加量(质量浓度)分别为0.2、0.3、0.4、0.5、0.6 g/L。根据1.3.2.1 工艺流程进行操作,每次实验重复3 次。
1.3.2.3 响应面法优化黄精覆盆子保健饮料配方
在单因素试验的基础上以黄精多糖提取液/覆盆子总黄酮提取液配比(A)、木糖醇(B)和柠檬酸(C)为自变量,以感官评价分数表为响应值,根据Box-Behnken 中心组合试验设计的原理,采用3 因素3 水平响应面法来优化黄精覆盆子保健饮料的配方,并通过Design Expert 12.0 软件进行数据分析。因素水平表参见表2,并依据饮料安全国家标准(GB 7101-2022)设定饮料感官评分标准(详见表3)。
表2 响应面实验因素和水平
Table 2 Factors and levels of response surface experiments
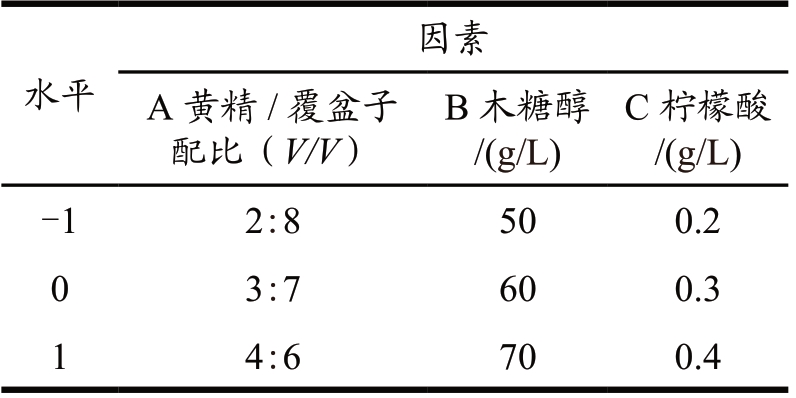
水平因素A 黄精/覆盆子配比(V/V)B 木糖醇/(g/L)C 柠檬酸/(g/L)-1 2:8 50 0.2 0 3:7 60 0.3 1 4:6 70 0.4
表3 黄精覆盆子饮料感官评价表
Table 3 Sensory evaluation criteria
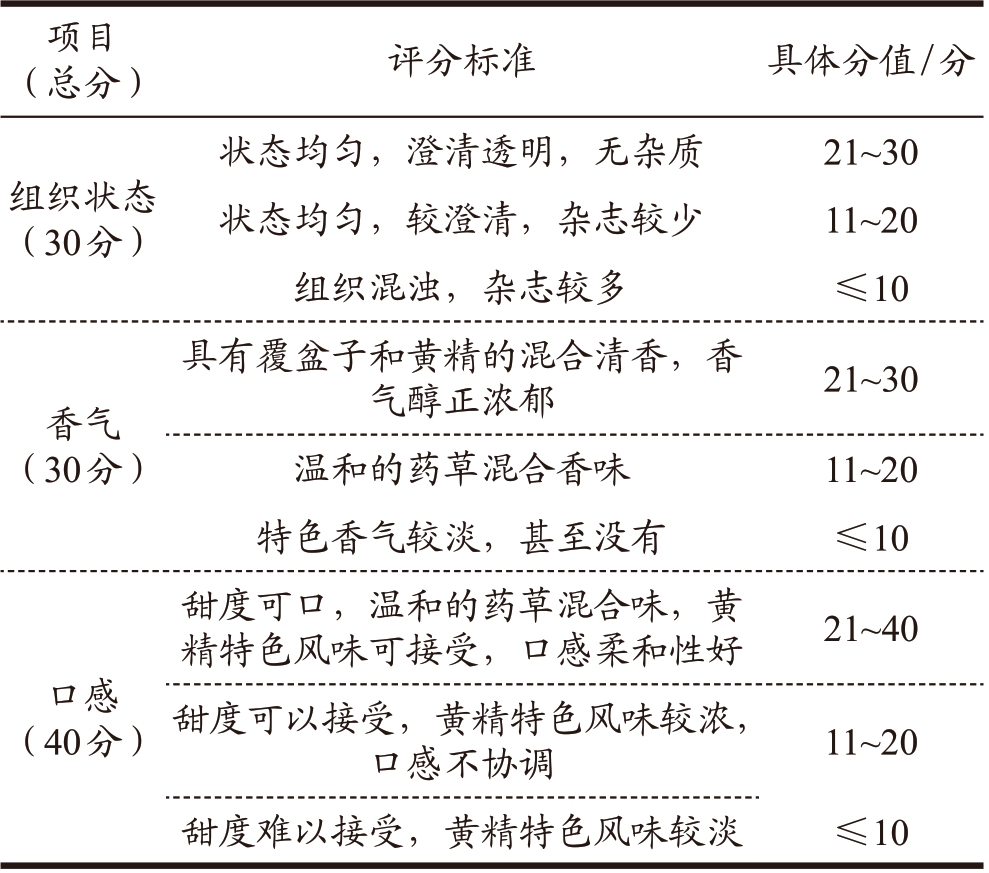
项目(总分)评分标准 具体分值 / 分组织状态(30分)状态均匀,澄清透明,无杂质 21~30状态均匀,较澄清,杂志较少 11~20组织混浊,杂志较多 ≤ 10香气(30分)具有覆盆子和黄精的混合清香,香气醇正浓郁 21~30温和的药草混合香味 11~20特色香气较淡,甚至没有 ≤ 10甜度可口,温和的药草混合味,黄精特色风味可接受,口感柔和性好 21~40口感(40分)甜度可以接受,黄精特色风味较浓,口感不协调 11~20甜度难以接受,黄精特色风味较淡 ≤ 10
1.3.3 保健饮料体外抗氧化性检测
1.3.3.1 ABTS 法测定样品总抗氧化能力
为保证样品检测的吸光值符合Trolox 标准曲线的吸光值范围,将黄精提取液中多糖的质量浓度用PBS 缓冲溶液稀释至3、4、5、6、7、8、10 mg/mL;将覆盆子提取液中总黄酮的质量浓度用PBS 缓冲溶液稀释至50、60、70、80、90、100、110 μg/mL;将黄精覆盆子保健饮料用PBS 溶液分别稀释1、2、3、4、5 倍。按照ABTS 法总抗氧化能力检测试剂盒使用说明,以Trolox 标准溶液绘制标准曲线,在734 nm 波长进行各样品吸光度测定。根据得到的Trolox 标准曲线,样品的抗氧化能力用Trolox-Equivalent Antioxidant Capacity(TEAC)来表示 [15] 。
1.3.3.2 样品DPPH 自由基清除率测定
将黄精提取液稀释至多糖质量浓度分别为4、5、6、7、8、10 mg/mL;将覆盆子提取液释至总黄酮质量浓度分别为50、60、70、80、90、100 μg/mL;将黄精覆盆子保健饮料分别稀释1、2、3、4、5 倍。参考Almusallam 等 [16] 的方法,取100 μL 样品溶液加入质量浓度为0.1 mol/L 的DPPH 100 μL(乙醇配制),混匀后37 ℃避光反应30 min,并在517 nm处测定吸光度,每个实验设置三次平行,将测得的吸光值按照以下公式计算清除率:
式中:
C——样品的DPPH 自由基清除率,%;
A1——样品加DPPH 溶液测定517 nm 波长下的吸光度;
A2——乙醇替代DPPH 测定517 nm 波长下的吸光度;
A0——乙醇替代样品测定517 nm 波长下的吸光度。
1.3.3.3 FRAP 法测定样品的总还原能力
同样的,为保证样品检测的吸光值符合FeSO4溶液标准曲线的吸光值范围,将黄精提取液中的多糖质量浓度用蒸馏水稀释至3、4、5、6、7、8、10 mg/mL;将覆盆子提取液中的总黄酮质量浓度稀释 至50、60、70、80、90、100、110 μg/mL;将黄精覆盆子保健饮料稀释1、2、3、4、5 倍。按照FRAP 法总抗氧化能力检测试剂盒说明,以FeSO4标准溶液绘制标准曲线,在593 nm 波长下进行各样品吸光度测定。总抗氧化能力根据FeSO4 标准曲线计算,采用FeSO4 标准溶液的浓度来表示 [17] 。
1.3.4 保健饮料对H2O2诱导的PC12氧化损伤细胞的抗氧化水平检测
参照Yao 等 [18] 的方法构建H2O2 诱导的PC12氧化损伤细胞模型。取处于对数生长期的PC12 细胞按照每毫升1×105 个接种到96 孔板中,37 ℃、φ=5% CO2 条件下培养24 h。将细胞分为对照组、模型组、实验组。对照组和模型组加入常规细胞培养液培养,实验组分别加入含不同浓度的等体积样品(用无血清的培养基稀释1、5、10、15、20 倍),其中黄精提取液多糖起始质量浓度为10 mg/mL,覆盆子提取液总黄酮起始质量浓度为10 μg/mL,保健饮料起始浓度为原液。37 ℃培养12 h 后,模型组和实验组分别弃去原有细胞培养液,更换含200 μmol/L H2O2 的培养液继续培养12 h。然后每孔加入CCK-8 溶液充分摇匀,避光孵育1 h 后,用酶标仪检测450 nm 波长下各孔的吸光度。按照以下公式计算出细胞增值率:
式中:
B——PC12 细胞增值率,%;
A2——加入损伤细胞样品处理后实验组450 nm 波长下的吸光值;
A0——无处理细胞的空白对照组450 nm 波长下的吸光值;
A1——经H2O2 氧化损伤的细胞的模型组450 nm 波长下的吸光值。
1.3.5 数据处理
采用SPSS 18 软件进行数据统计学分析,GraphPad Prism 6.0 进行作图、采用Design Expert 12.0 软件进行响应面设计和结果分析。三次以上独立平行实验的分析结果以均数±标准差(¯x±s)表示。P < 0.05 表示差异有统计学意义。
2 结果与讨论
2.1 黄精与覆盆子活性成分的提取
2.1.1 黄精多糖最佳单因素试验
本实验通过苯酚-硫酸法测定葡萄糖标准品含量,拟合得到线性回归方程y=1.733 2x-0.003 5,(R2=0.991),线性关系良好。根据葡萄糖标曲计算单因素试验中黄精多糖含量及得率。由图1a 可知,黄精多糖得率随着溶液的增加而升高,这是因为水含量越高,黄精粉末溶胀性也越好,有利于多糖从细胞中扩散出来 [19] ,而超声破碎有利于细胞中多糖的释放,但当水量不断增加则会增加超声破碎细胞的阻力,从而降低黄精多糖得率。因此,当料液比为1:30,超声功率为240 W,温度为60 ℃,超声处理40 min 时,黄精多糖的得率最高。由图1b 可知,随着超声时间的增加,多糖得率越高,但长时间的超声处理后多糖的糖苷键断裂增加,进而导致黄精多糖得率下降。因此,当超声温度为60 ℃,料液比1:30 条件下,超声时间为60 min 时多糖得率达到最大值。一般来说,超声温度越高,多糖提取效率越高。但过高的温度会导致水分蒸发,且会导致多糖结构的破坏,因此提取温度应控制在一定范围内 [20] 。当超声时间为40 min,料液比1:30 条件下,温度70 ℃时多糖得率达到15.52%(图1c)。
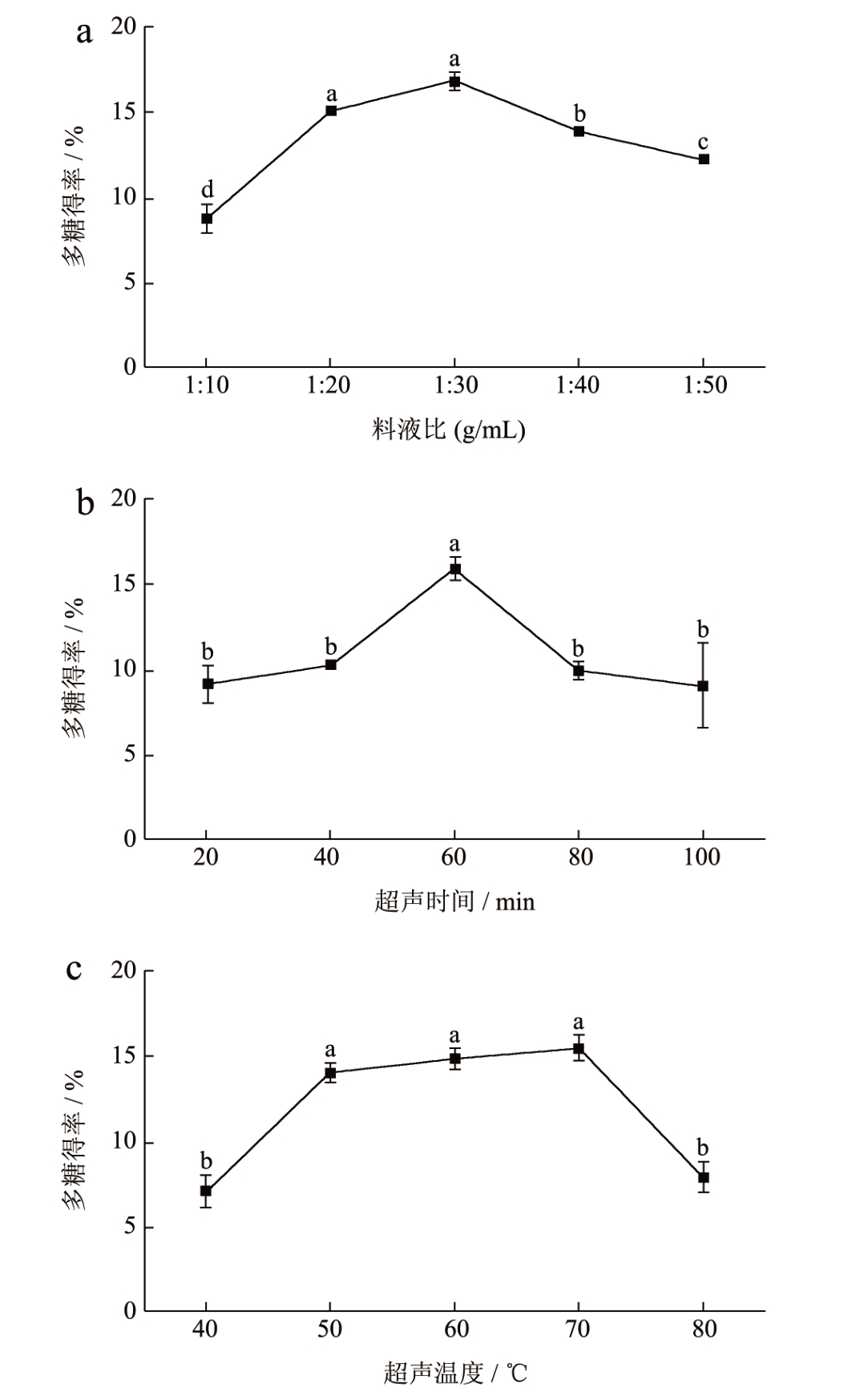
图1 黄精多糖单因素试验分析
Fig.1 Single factor experimental analysis of polygonatum polysaccaride
注:折线上小写字母不同表示差异显著(P < 0.05),下同(图2、3;图6~8)。
2.1.2 黄精多糖最佳提取工艺正交试验
根据黄精单因素试验结果,以黄精多糖得率为实验指标,选择料液比、超声时间、超声温度作为考察因素,采用L9(33)正交组合进行试验。由极差分析可知(表4),在该实验条件下黄精多糖得率的影响程度大小依次为:A(料液比)> C(超声时间)> B(超声温度),确定提取黄精多糖的最佳工艺条件为A1B2C3,即料液比(g/mL)为1:20,超声提取温度为60 ℃,超声提取时间为80 min。由表5 方差分析结果显示,各因素对黄精多糖提取并未呈现出显著性影响。通过该组合进行实验验证,最终得到黄精多糖的得率为17.94%,说明正交试验得出的最佳多糖提取工艺条件可行且稳定。本工艺提取的黄精多糖相较于董琪等 [21] 在超声波功率180 W,提取温度60 ℃,超声波时间70 min,料液比1:15 g/mL 条件下的(多糖得率为10.48%)提取效率更高,说明在一定范围内适当的提高超声功率、延长超声时间将促进黄精根茎细胞裂解,从而提高黄精多糖的得率,而料液的增加也将有助于黄精粉末中多糖的释放。
表4 黄精多糖提取正交试验结果与分析
Table 4 Results and analysis of orthogonal experiments for polygonatum polysaccharide extraction
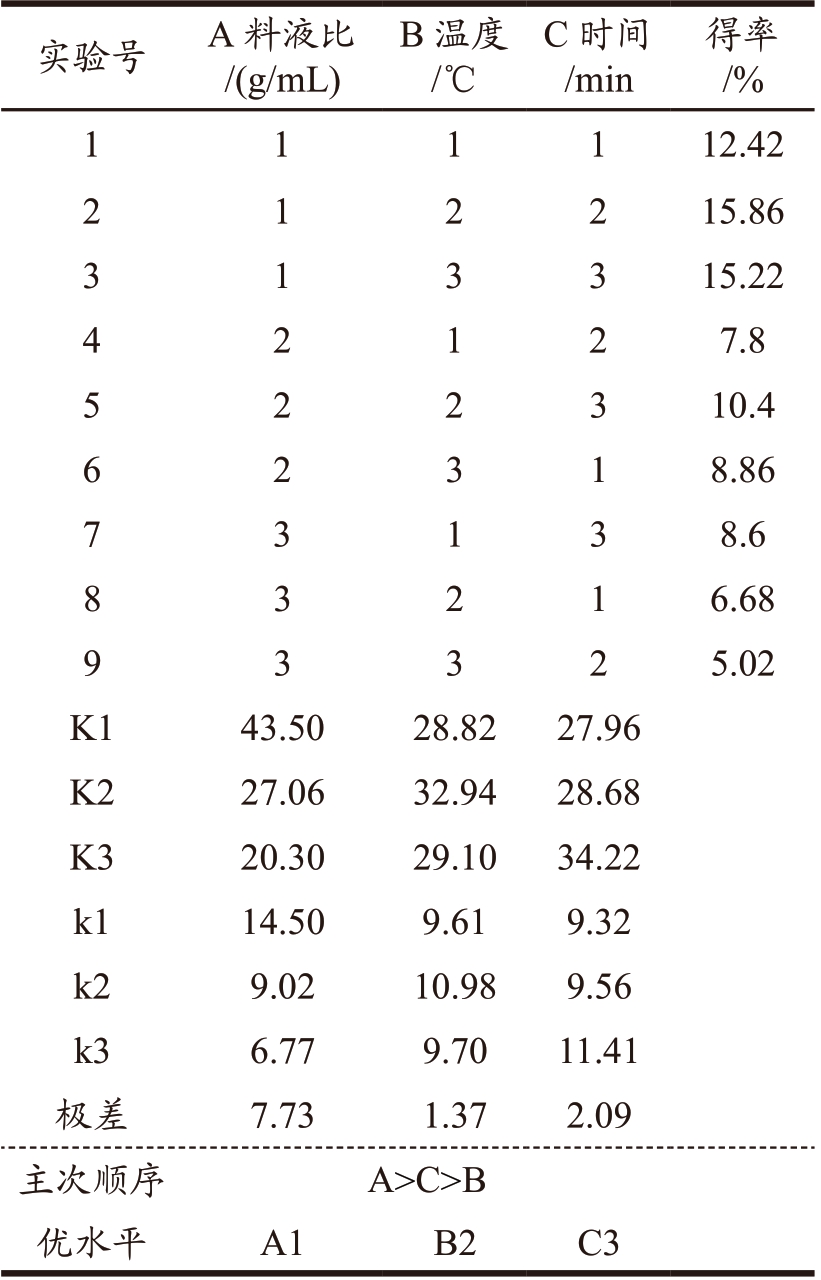
实验号 A 料液比B 温度/℃C 时间/min得率/%1 1 1 1 12.42 2 1 2 2 15.86 3 1 3 3 15.22 4 2 1 2 7.8 5 2 2 3 10.4 6 2 3 1 8.86 7 3 1 3 8.6 8 3 2 1 6.68 9 3 3 2 5.02 K1 43.50 28.82 27.96 K2 27.06 32.94 28.68 K3 20.30 29.10 34.22 k1 14.50 9.61 9.32 k2 9.02 10.98 9.56 k3 6.77 9.70 11.41极差 7.73 1.37 2.09主次顺序 A>C>B优水平 A1 B2 C3/(g/mL)
表5 黄精多糖提取正交试验结果方差分析
Table 5 Variance analysis of orthogonal experiment results for polygonatum polysaccharide extraction
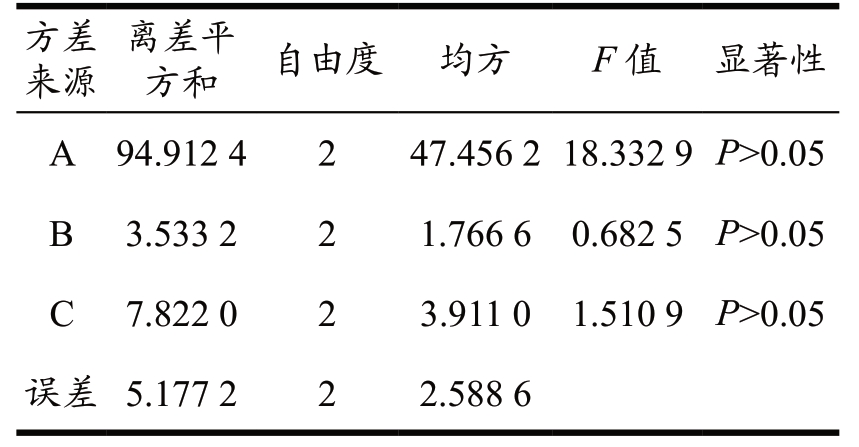
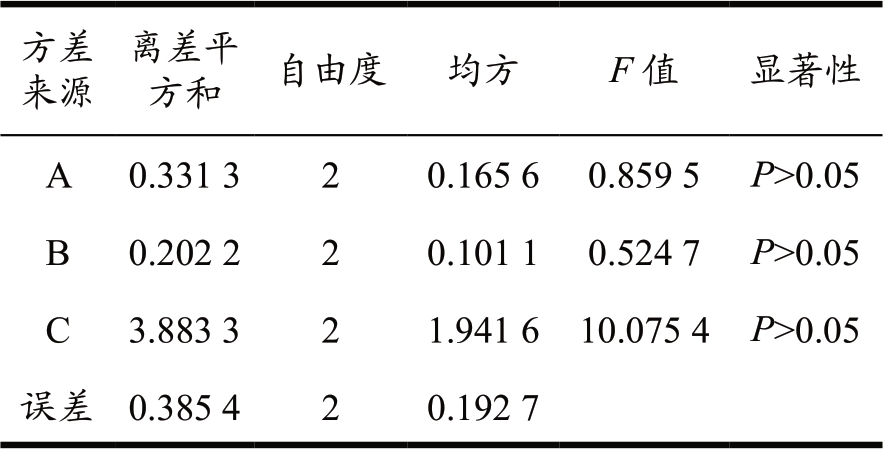
方差来源离差平方和 自由度 均方 F 值 显著性A 94.912 4 2 47.456 2 18.332 9 P>0.05 B 3.533 2 2 1.766 6 0.682 5 P>0.05 C 7.822 0 2 3.911 0 1.510 9 P>0.05误差 5.177 2 2 2.588 6
2.1.3 覆盆子总黄酮最佳单因素试验
本研究以芦丁标准品制作标准曲线得到线性回归方程y=0.885 3x-0.060 5,R2=0.993 7,说明线性关系良好。覆盆子提取液中黄酮含量根据芦丁标准曲线进行计算。果胶酶作为饮料制备常用的澄清剂,有利于果肉出汁率的提高和活性成分的释放 [12] 。由图2a 可知,随着果胶酶含量的增加,黄酮得率也随之增加,果胶酶添加量为1.0 g/L 时,覆盆子黄酮得率达到3.08%。但曲线慢慢趋于平缓,说明底物反应趋于饱和,过多果胶酶的添加将大大提升饮料开发成本。同样的,随着果胶酶酶解时间的增加,黄酮得率也随之增加。其中从90~135 min 时间段内黄酮得率提升较快,225 min 后随着酶活性降低,覆盆子黄酮得率也基本稳定(图2b)。由图2c 可知,果胶酶酶解温度对黄酮提取效率的影响较大,总黄酮得率随着酶解温度的上升呈先上升后下降的趋势,在低温范围内随着提取温度的提升,黄酮得率提升至4.01%。但随着温度升高,果胶酶失活,进而导致得率下降。
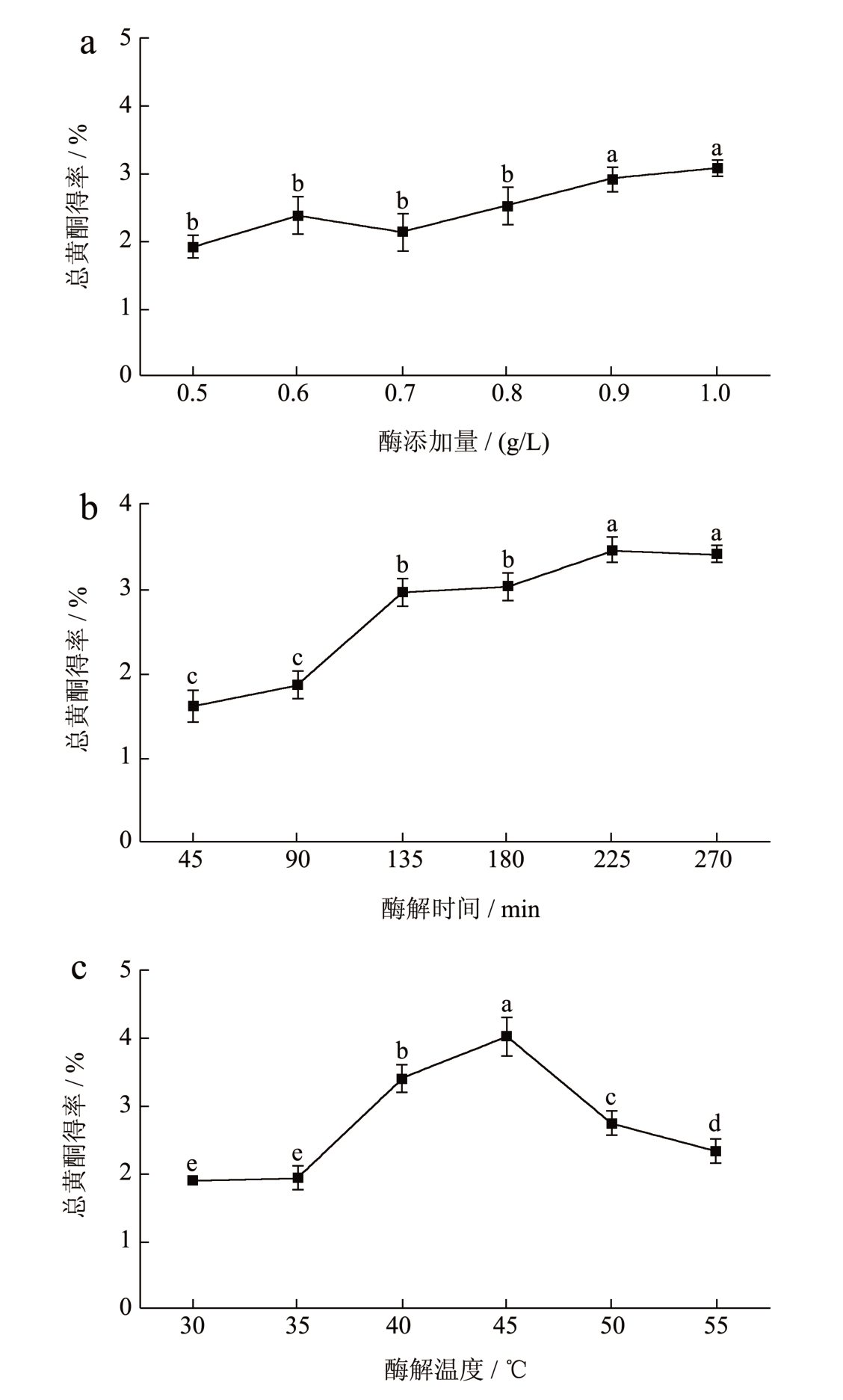
图2 覆盆子总黄酮单因素试验分析
Fig.2 Single factor experimental analysis of total flavonoids of raspberry
2.1.4 覆盆子总黄酮最佳提取工艺正交试验
由覆盆子总黄酮正交试验结果表可知(表6),通过极差分析,在该试验条件下覆盆子总黄酮提取的影响程度大小依次为C(酶解温度)> A(酶添加量)> B(酶解时间),最佳提取工艺条件为A3B2C2,即酶添加量为0.9 g/L,酶解时间225 min,酶解温度为45 ℃。由表7 方差分析结果显示,各因素对覆盆子总黄酮提取并未呈现出显著性影响。通过该组合进行实验验证,最终得到覆盆子黄酮的得率为5.36%,说明正交试验得出的最佳黄酮提取工艺条件可行且稳定。于秋菊等 [22] 采用微波辅助提取总黄酮得率为5.88%,与本研究的酶法提取效率相接近,说明采用酶法提取覆盆子总黄酮操作简单可靠。
表6 覆盆子总黄酮提取正交试验结果与分析
Table 6 Results and analysis of orthogonal experiments for raspberry flavonoids extraction
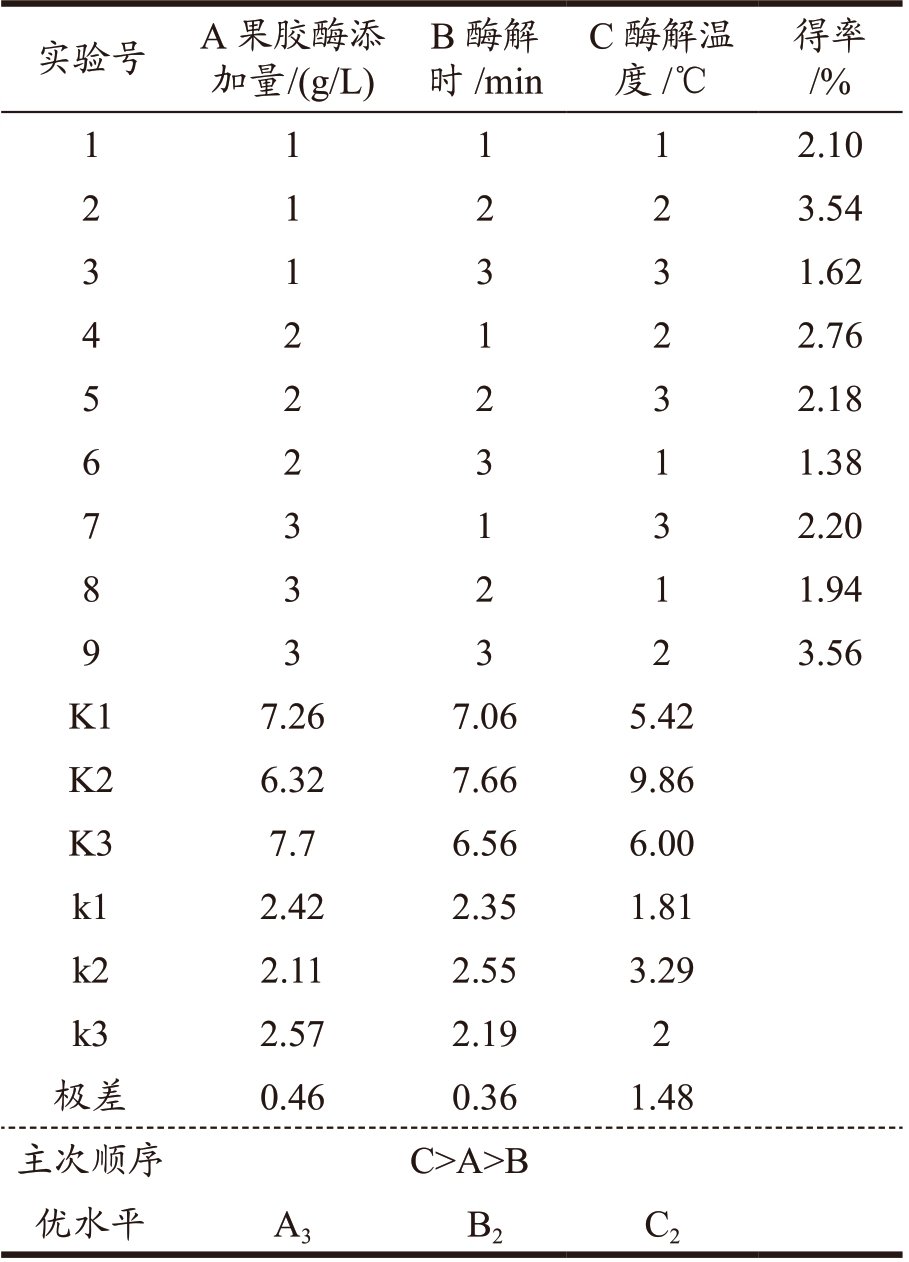
实验号 A 果胶酶添加量 /(g/L)B 酶解时/min C 酶解温度/℃得率/%1 1 1 1 2.10 2 2 2 3.54 3 1 3 3 1.62 1 4 1 2 2.76 5 2 2 3 2.18 2 6 3 1 1.38 7 3 1 3 2.20 2 8 2 1 1.94 9 3 3 2 3.56 3 K1 7.26 7.06 5.42 K2 6.32 7.66 9.86 K3 7.7 6.56 6.00 k1 2.42 2.35 1.81 k2 2.11 2.55 3.29 k3 2.57 2.19 2极差 0.46 0.36 1.48主次顺序 C>A>B优水平 A3 B2 C2
表7 覆盆子总黄酮提取正交试验结果方差分析
Table 7 Variance analysis of orthogonal experiment results for raspberry flavonoids extraction
方差来源离差平方和 自由度 均方 F 值 显著性A 0.331 3 2 0.165 6 0.859 5 P>0.05 B 0.202 2 2 0.101 1 0.524 7 P>0.05 C 3.883 3 2 1.941 6 10.075 4 P>0.05误差 0.385 4 2 0.192 7
2.2 黄精覆盆子保健饮料的工艺研究
2.2.1 单因素试验
黄精覆盆子保健饮料采用养生保健之上品黄精结合口感鲜甜的覆盆子进行工艺研制,很好的融合了两种资源的优势,饮料呈现出独特的色泽和口感,既增加了饮料的保健功效也提升了饮料的口感。如图3a 所示,当黄精与覆盆子的比例增加饮料的感官评价得分先增加后降低。当黄精覆盆子提取液配比为2:8 时,色泽鲜亮澄清,无沉淀,覆盆子果香味较浓郁,但黄精多糖的添加量太少,味道略淡,黄精提取液味道基本被掩盖。当比例为3:7 时,色泽呈现橙黄色且透亮美观,香甜浓郁,饮料的风味最好。当比例大于3:7 时,黄精汁液的味道太浓,且具有少许中药味,风味较差。因此,黄精覆盆子提取液比例为3:7 的饮料具有色泽鲜艳、风味浓郁和口感丰满的特点,为该饮料的最佳配比。木糖醇替代饮料甜味剂,可供患有糖尿病等疾病的无糖摄入患者食用 [23] ,食用范围更广泛。由图3b 可看出木糖醇赋予饮料更香甜的口感,饮料的感官评分随着木糖醇从30 g/L 增加到60 g/L而逐渐增加。当木糖醇的量为60 g/L 时,饮料具有最佳风味。当木糖醇添加量再增加时,饮料则因甜味太高而口感过腻,同时饮料中黄精多糖的味道会被掩盖。因此,当木糖醇的添加量为60 g/L 时,风味最佳。柠檬酸是黄精覆盆子保健饮料中酸味的主要来源,适量的柠檬酸会使饮料的口感变得更加柔和。如图3c 所示,随着柠檬酸以0.2 g/L 至0.6 g/L 的比例增加,饮料的感官评分首先增加后降低。当柠檬酸的用量为0.3 g/L 时,饮料的口感最佳。当柠檬酸大于0.3 g/L 时,酸度太高,饮料中黄精多糖的味道会被掩盖。因此,当柠檬酸添加量为0.3g/L 时,风味最佳。
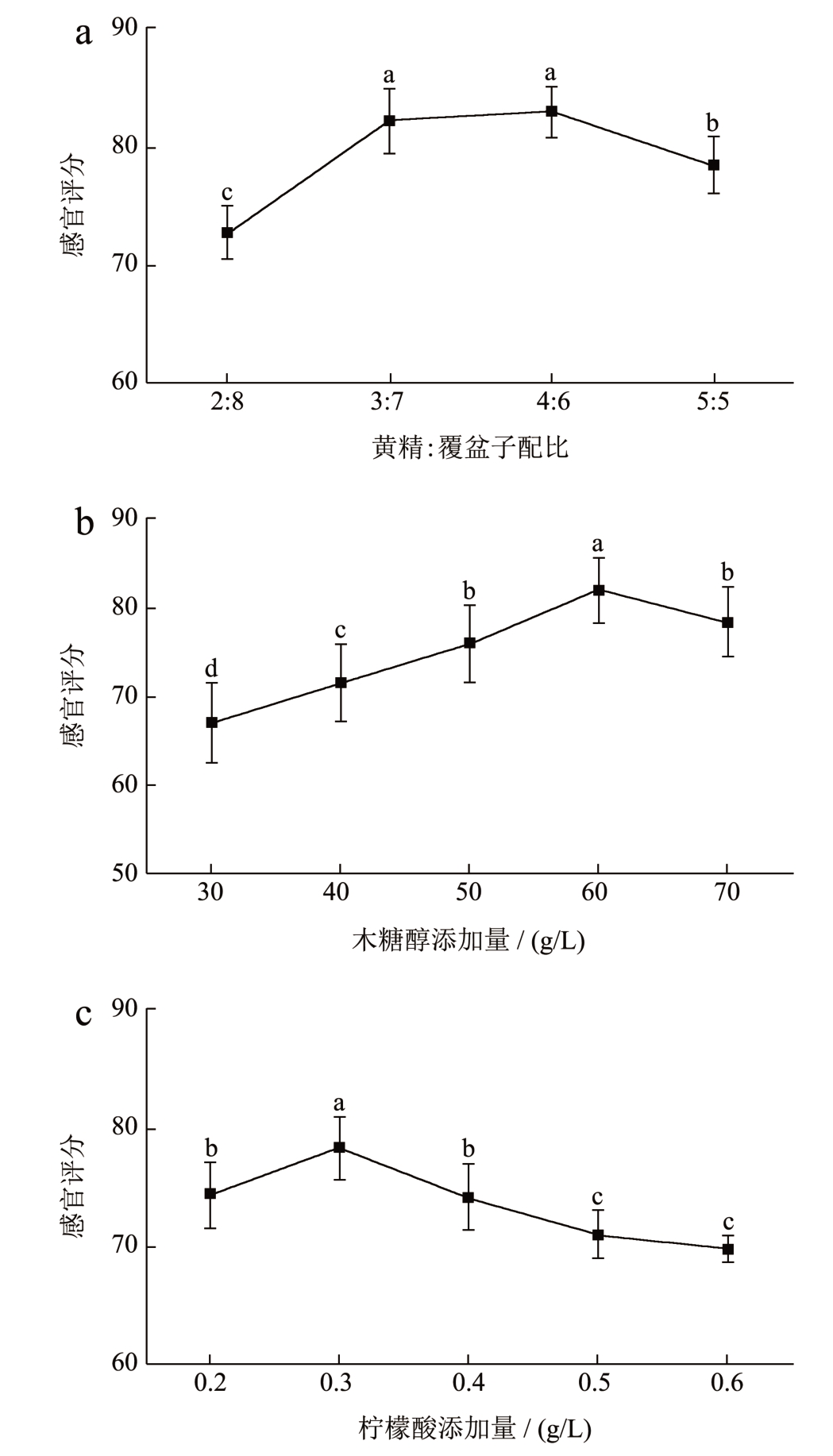
图3 黄精覆盆子饮料感官评价单因素试验分析
Fig.3 Single factor experimental analysis on sensory evaluation of Polygonatum sibiricum-raspberry beverage
2.2.2 响应面分析及方差分析
为确定黄精覆盆子保健饮料的最佳配方,本实验以感官评分为响应值,通过使用Design-Expert 12.0 软件进行实验设计,选择中心复合模型对17个测试点(包括12 个因子测试和5 个中心测试)进行3 个因子和3 个水平的响应面分析测试。实验分析方案及结果见表8。
表8 黄精覆盆子保健饮料最佳配方响应面实验设计
Table 8 Design of response surface testfor the best formula of Polygonatum sibiricum-raspberry beverage
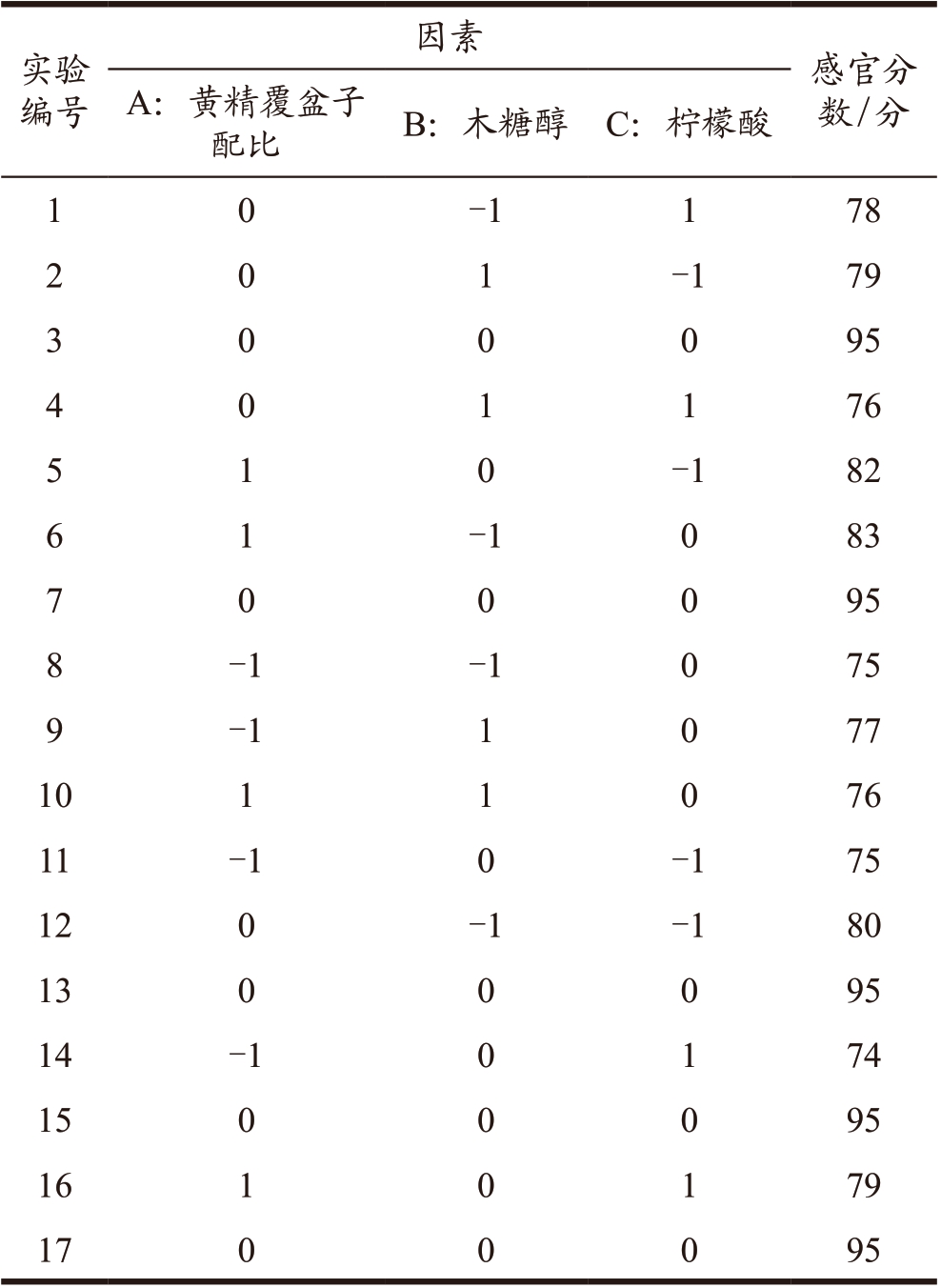
实验编号因素 感官分数 / 分A:黄精覆盆子配比 B:木糖醇 C:柠檬酸1-1 1 78 2 0 1-1 79 0 0 95 4 0 1 1 76 3 0 0 5-1 82 6 1-1 0 83 1 0 0 95 8-1 -1 0 75 9-1 1 0 77 10 1 1 0 76 11 -1 0 -1 75 12 0 -1 -1 80 13 0 0 0 95 14 -1 0 1 74 15 0 0 0 95 16 1 0 1 79 17 0 0 0 95 7 0 0
采用Design-Expert 12.0 软件对试验数据进行多元回归拟合分析,得出回归方程为:Y=95.00+2.37A-1.00B-1.12C-2.25AB-0.500 0AC-0.250 0BC-9.00A2-8.25B2-8.50C2。模型决定系数R2=0.996 7,调整决定系数R2Adj=0.992 4,预测相关系数R2Pred=0.946 9,预测相关系数和调整决定系数相接近,说明模型拟合度较好。由表9 可以看出,整体模型影响极显著(P < 0.000 1),说明黄精保健饮料的感官评分与3 个变量之间的线性关系极显著,同时失拟项不显著(P > 0.05),表明该模型在回归空间内的拟合度较好。模型一次项A、B、C 均具有极显著差异(P < 0.01),根据F 值判断,各因素对黄精覆盆子饮料的影响大小依次为A(黄精覆盆子料液比) > C(柠檬酸) > B(木糖醇)。因此,从单个因素影响来看,黄精覆盆子配比因素对饮料的感官评分影响最大。交互项AB 极显著(P < 0.01),AC、BC 不显著,而二次项A2、B2、C2 均极显著(P < 0.000 1),说明各因素对黄精覆盆子饮料的感官评分影响较大。
表9 响应面二次回归模型方差分析
Table 9 Variance analysis of response surface quadratic regression model
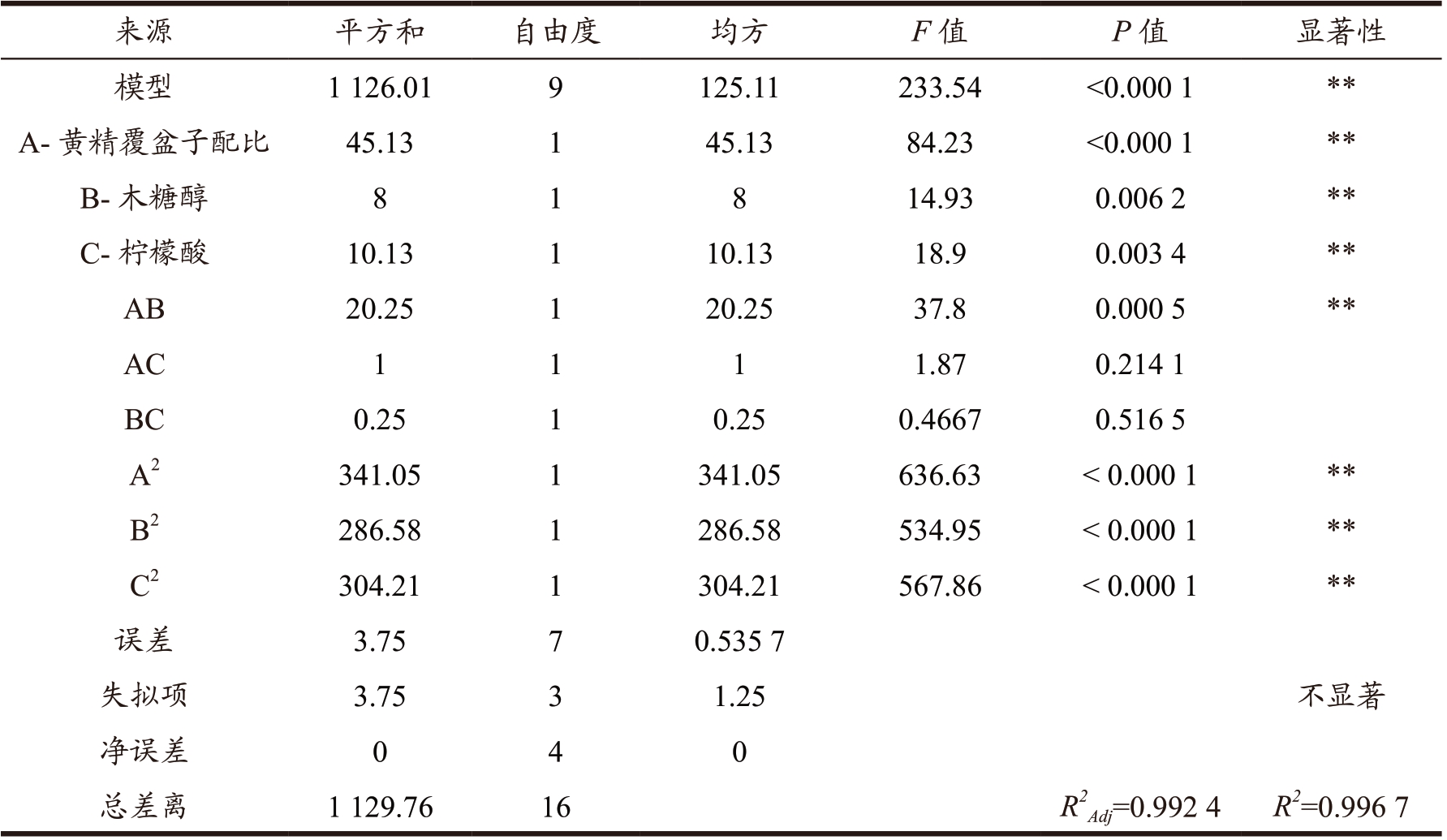
注:“*”表示显著差异(P < 0.05);“**”表示极显著差异(P < 0.01)。
来源 平方和 自由度 均方 F 值 P 值 显著性模型 1 126.01 9 125.11 233.54 <0.000 1 **A-黄精覆盆子配比 45.13 1 45.13 84.23 <0.000 1 **B-木糖醇 8 1 8 14.93 0.006 2 **C-柠檬酸 10.13 1 10.13 18.9 0.003 4 **AB 20.25 1 20.25 37.8 0.000 5 **AC 1 1 1 1.87 0.214 1 BC 0.25 1 0.25 0.4667 0.516 5 A2 341.05 1 341.05 636.63 < 0.000 1 **B2 286.58 1 286.58 534.95 < 0.000 1 **C2 304.21 1 304.21 567.86 < 0.000 1 **误差 3.75 7 0.535 7失拟项 3.75 3 1.25 不显著净误差 0 4 0总差离 1 129.76 16 R2 Adj=0.992 4 R2=0.996 7
采用Design-Expert 12.0 软件绘制三维响应面和等高线图,能够直观地反映出各因素及其相互作用对试验结果的影响(见图4)。响应曲面图可看出A(黄精覆盆子配比)、B(木糖醇)、C(柠檬酸)3 因素间均具有交互作用。当柠檬酸质量浓度为0.3 g/L 时,A(黄精覆盆子配比)与B(木糖醇)等高线图中椭圆度较大,说明AB 两因素之间交互影响显著。木糖醇质量浓度在木糖醇60 g/L 时,A(黄精覆盆子配比)和C(柠檬酸)等高线图中椭圆度较小,说明AC 两因素之间交互影响不显著。B(木糖醇)比C(柠檬酸)的等高线图的椭圆度较小且接近于圆形,说明BC 两因素之间交互作用不显著。对二次项模型进行优化后得到黄精覆盆子保健饮料的最佳工艺条件为:黄精覆盆子的比例为3:7,木糖醇60 g/L,柠檬酸0.3 g/L。
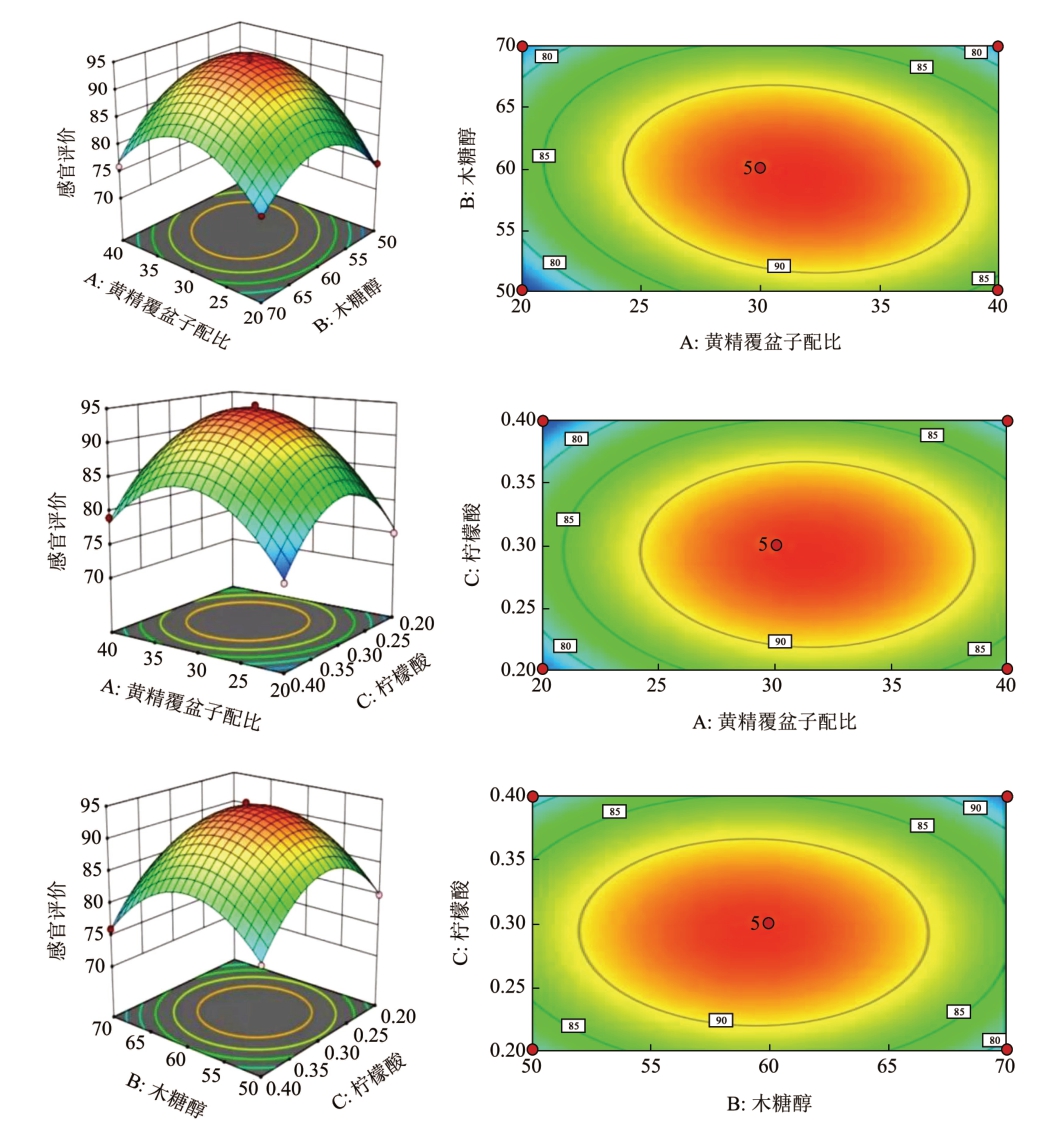
图4 各因素交互作用对饮料感官评分的响应曲面和等高线
Fig.4 Response surface diagram and contour lines of effects of interaction between each factors on sensory evaluation of beverage
为检验响应面分析结果的可靠性,按照响应面实验结果得出的最佳配比,邀请10 人进行感官评价。由图5 可知,饮料的感官评价包括饮料的组织状态、香气和口感三个方面,最终得到感官评价均值为94 分,所得值与响应面分析预测分数(95 分)接近,证明响应面建立模型所确定的黄精覆盆子饮料配方可靠稳定。
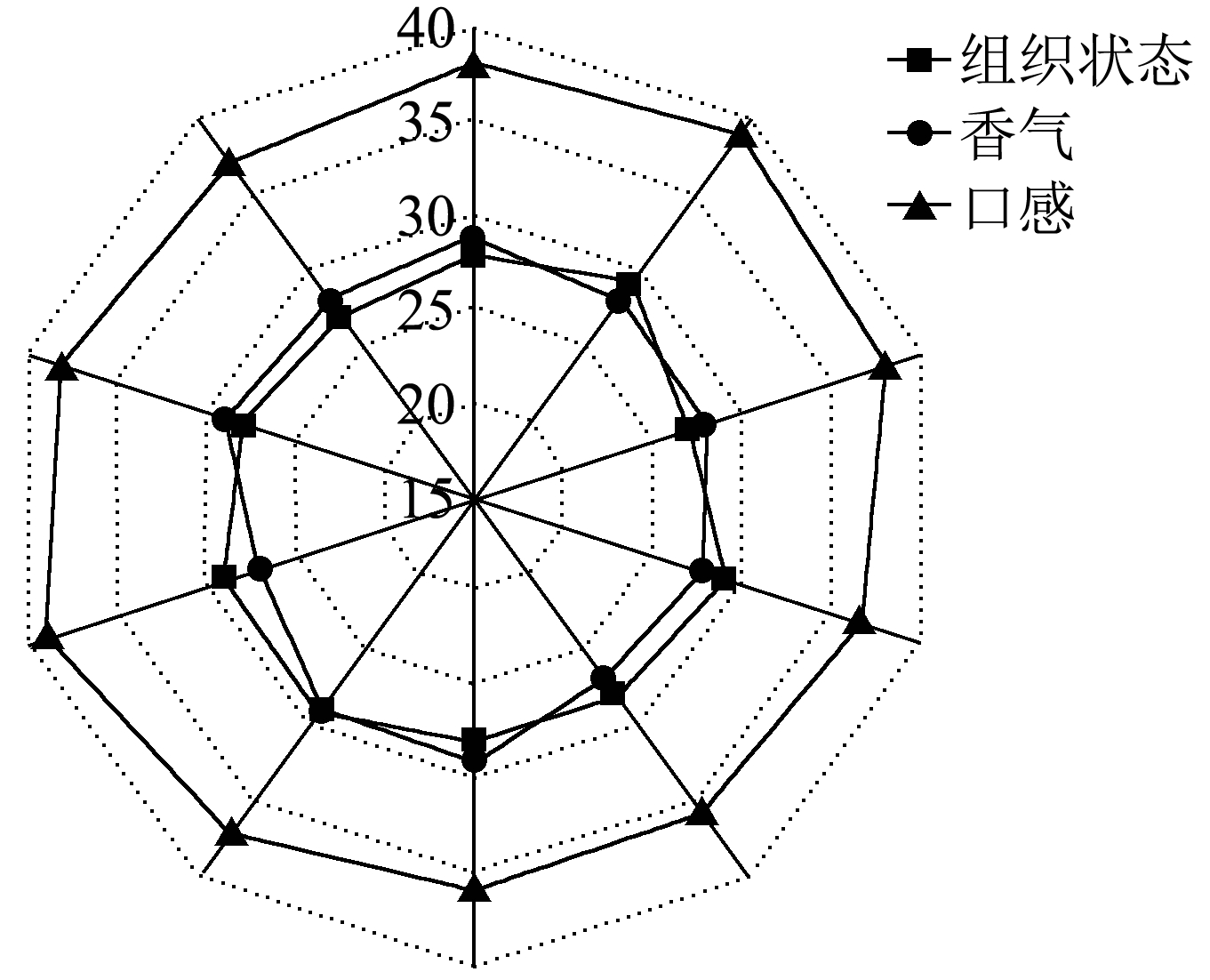
图5 饮料的感官评价
Fig.5 Sensory evaluation of beverage
2.3 体外抗氧化性测定
2.3.1 ABTS+自由基的清除能力测定结果
ABTS+自由基清除能力可采用Trolox 作为标准品进行检测,样品的抗氧化能力用Trolox-Equivalent Antioxidant Capacity(TEAC)来表示 [24] 。TEAC 值越大,说明对ABTS+自由基的清除能力越强,抗氧化能力越强。因此,采用Trolox 标准品制作标准曲线可得到线性回归方程y = -1.380 6x+1.092 1,R2=0.991 2(图6a),根据标准曲线可计算各样品的TEAC 值。如图6b、6c 所示,黄精提取液和覆盆子提取液的抗氧化能力均随着提取液中活性成分浓度的增加呈上升趋势,覆盆子黄酮的ABTS+自由基清除能力相较于黄精多糖更强,在总黄酮质量浓度为110 μg/mL 时其TEAC 值达到4.11 mmol/L。黄精覆盆子保健饮料的抗氧化能力随稀释倍数的增加呈下降趋势(图6d),黄精覆盆子原液其抗氧化能力相当于0.93 mmol/L Trolox 标准品的抗氧化能力,由此说明黄精覆盆子饮料具有较好的ABTS+自由基清除能力,且3 种样品的抗氧化作用强弱依次为覆盆子总黄酮>黄精多糖>饮料。
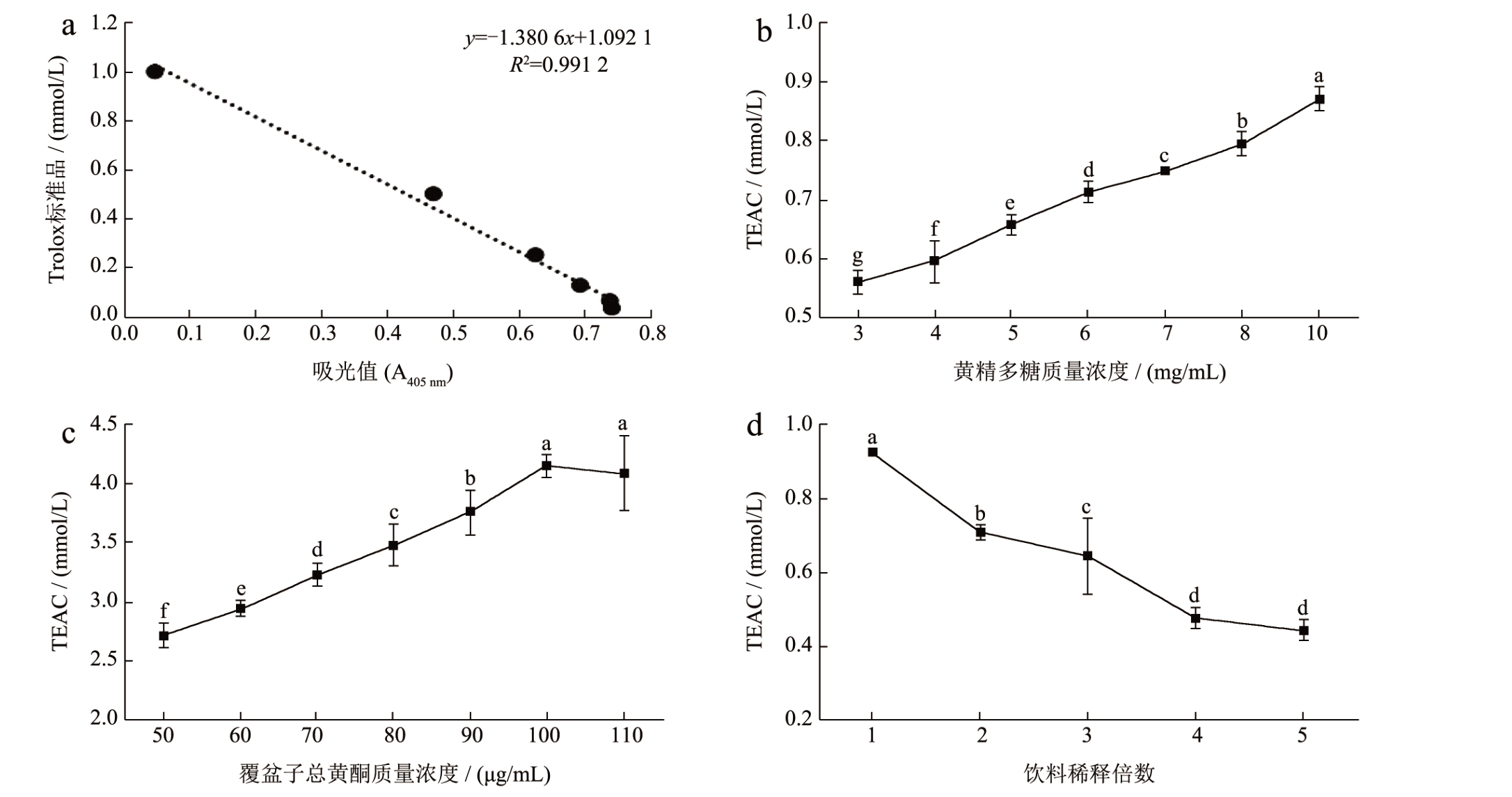
图6 3 种样品对ABTS+自由基的清除能力
Fig.6 ABTS+ scavenging capacity of three types of samples
注:(a)Trolox 标准曲线绘制;(b)黄精提取液多糖对ABTS+.的清除能力;(c)覆盆子提取液中总黄酮对ABTS+.的清除能力;(d)饮料对ABTS+.的清除能力。
2.3.2 DPPH自由基清除率测定结果
3 种样品对DPPH 自由基的清除能力如图7 所示,黄精提取液随多糖浓度的增加,其对DPPH 自由基的清除能力呈上升趋势,黄精多糖质量浓度为10 mg/mL 时,其DPPH 自由基清除率达到最大值34.51%(图7a)。而唐兰芳等 [25] 通过低共熔溶剂提取的黄精多糖在质量浓度为20 mg/mL 时,DPPH自由基的清除率为32.05%,抗氧化效果显著低于本研究结果,这可能与其溶剂提取黄精多糖的效率和多糖活性有关。而覆盆子总黄酮对DPPH 自由基清除率也随着浓度的增加而逐步上升,呈浓度依赖性,当覆盆子总黄酮质量浓度达到100 μg/mL 时,其自由基清除率达到最大值94.33%,相较于黄精多糖的抗氧化效果更显著(图7b),且优于微波辅助低共熔溶剂提取的覆盆子总黄酮的DPPH 自由基清除能力 [22] ,该差异可能是覆盆子黄酮的提取方法差异所导致,通过低温酶解的方法能较好的保持覆盆子中黄酮的结构和活性。因此由图7c 可知,由于含有丰富的覆盆子黄酮和黄精多糖,黄精覆盆子保健饮料原液对DPPH 自由基的清除率可达到79.35%。
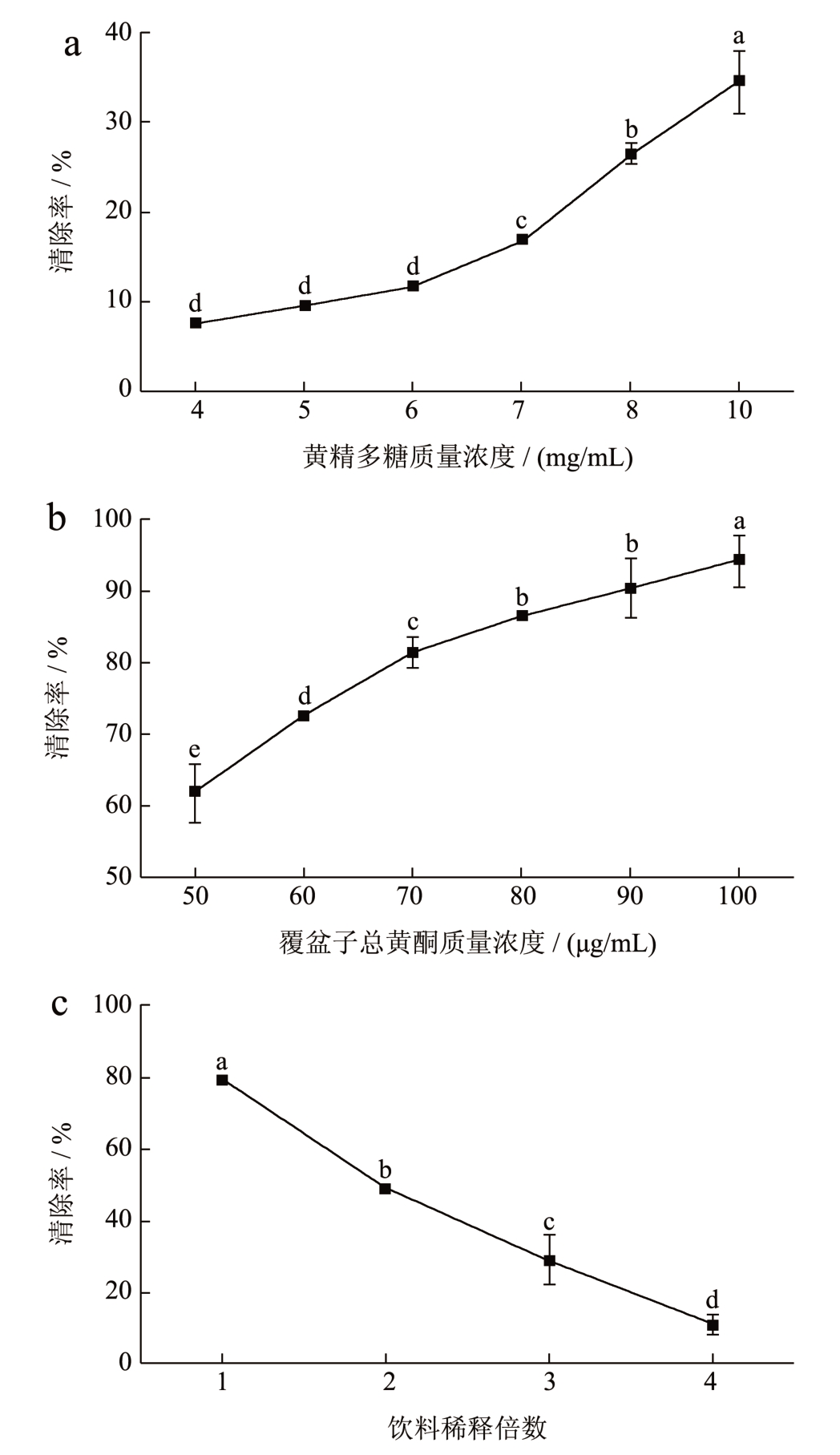
图7 3 种样品对DPPH 自由基的清除率
Fig.7 DPPH scavenging capacity of three types of samples
2.3.3 FRAP法检测饮料总抗氧化能力测定结果
对于FRAP 法检测3 种样品总抗氧化能力则采用FeSO4 标准溶液的浓度来表示。样品吸光值的高低代表着从Fe3+-TPTZ 还原出来的Fe2+-TPTZ 数量的多少。因此,样品的总抗氧化能力可根据FeSO4标准溶液绘制的标准曲线进行换算,值越大说明总抗氧化能力越强 [26] 。如图8a 所示,黄精提取液随多糖浓度的增加,其总抗氧化能力呈上升趋势,在多糖质量浓度为10 mg/mL 时抗氧化能力达到最大值0.64 mmol/L。同样的,随着覆盆子总黄酮质量浓度的不断增加,其抗氧化能力也逐步上升,在总黄酮质量浓度为110 μg/mL 时抗氧化能力达到最大值7.17 mmol/L,这说明覆盆子提取液的总抗氧化能力高于黄精提取液(图8b)。而从图8c 可看出,开发的黄精覆盆子饮料原液抗氧化能力为1.56 mmol/L FeSO4 标准当量,且随稀释倍数的增加,黄精覆盆子保健饮料的抗氧化能力呈下降趋势,由此说明黄精覆盆子饮料具有较好的抗氧化活性。
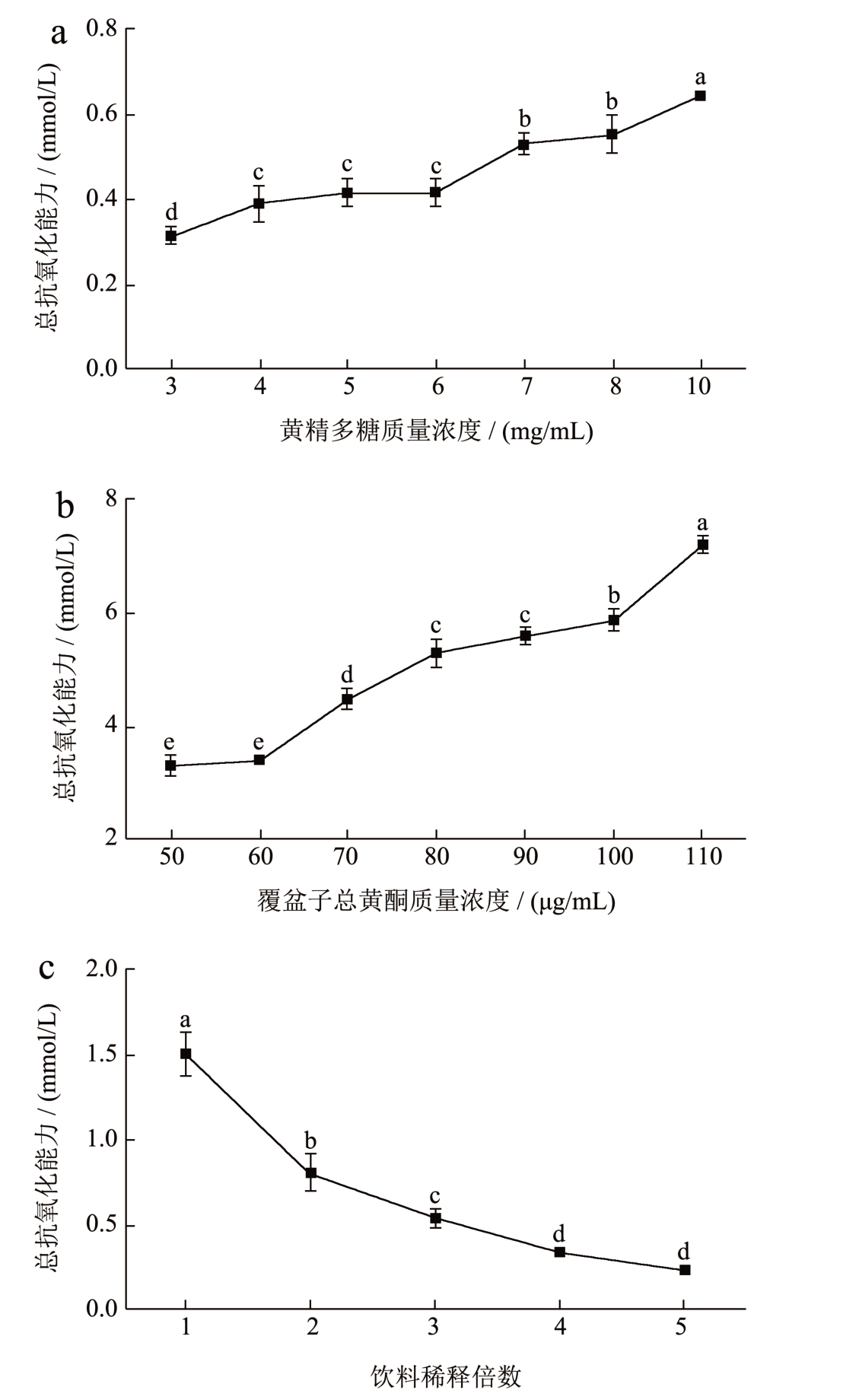
图8 3 种样品对FRAP 的总抗氧化能力
Fig.8 FRAP total antiosidant capacity of three types of samples
2.4 保健饮料对H2O2诱导的PC12氧化损伤细胞的保护作用
为从细胞水平考察黄精覆盆子饮料、黄精多糖和覆盆子黄酮的抗氧化水平,本研究采用H2O2诱导构建PC12 细胞氧化损伤模型。由图9 可见,H2O2 处理的模型组细胞存活率与对照组相比显著下降(P<0.05),而加入样品处理的实验组可显著缓解对H2O2 细胞的损伤作用。黄精提取液原液对受损细胞的修复作用效果最佳,细胞存活率为87.13%;而覆盆子提取液原液处理后,损伤细胞存活率恢复至88.65%。黄精提取液和覆盆子提取液在稀释倍数1、5、10、15 倍时,细胞增值率与模型组相比均呈显著上升趋势(P < 0.05),并且随着稀释倍数的增加,细胞增值率呈现梯度依赖性减少趋势。同样的,H2O2 处理后的模型组细胞增值率为61.55%,而黄精覆盆子保健饮料在原液和稀释5 倍条件下,其细胞存活率与模型组相比也呈显著上升水平(P < 0.05),其中饮料原液处理后的细胞增值率恢复至81.37%。由图9 可看出,3 者对受损细胞的修复作用大小为:覆盆子提取液>黄精提取液>黄精覆盆子保健饮料。因此黄精覆盆子保健饮料的抗氧化活性与饮料中覆盆子和黄精比例密切相关,但是黄精覆盆子保健饮料是否还具有其他功效还有待进一步揭示。以上结果说明3 种样品对H2O2 损伤的PC12 细胞均有较好的保护作用,这种保护作用可能是通过抑制H2O2 诱导的细胞凋亡有关。研究表明黄精多糖可通过激活PI3K/AKT 通路,调节凋亡相关蛋白Bax 和Bcl-2 的表达,从而抑制PC12 细胞凋亡 [27] 。
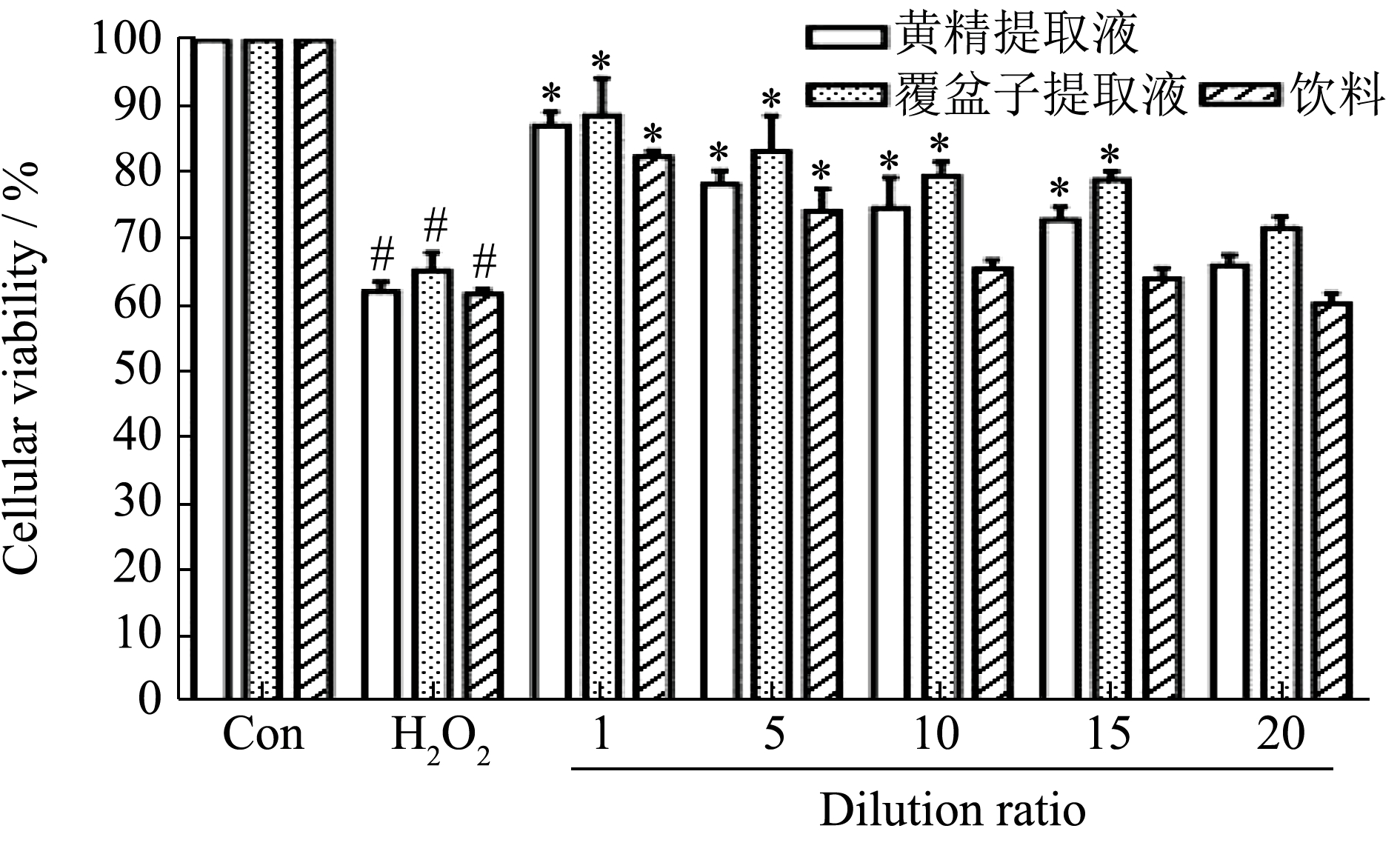
图9 3 种样品对氧化损伤PC12 细胞的存活率的影响
Fig.9 The effect of three samples on the viability of oxidatively damaged PC12 cells
注:对照组,未处理的细胞;模型组,H2O2 诱导的氧化损伤PC12 细胞。*表示与模型组比较P < 0.05;#表示与模型组比较P < 0.05。
3 结论
综上所述,黄精覆盆子饮料以黄精和覆盆子为原料进行研制,其中黄精提取液以黄精多糖含量为指标,采用超声辅助提取和正交实验设计进行提取工艺的优化确定最佳提取条件为超声温度60 ℃、超声时间80 min、料液比1:20,黄精多糖得率最高可达17.94%。而覆盆子提取液以总黄酮含量为指标,采用酶解法和正交实验设计优化提取工艺,确定最佳提取条件为:果胶酶添加量0.9 g/L、酶解时间225 min、酶解温度45 ℃,总黄酮的得率最高可达5.36%。响应面实验设计结果表明各因素对黄精覆盆子饮料的影响大小依次为A(黄精覆盆子料液比)> C(柠檬酸)> B(木糖醇),饮料的最佳配方为黄精覆盆子提取液配比3:7,木糖醇60 g/L,柠檬酸0.3 g/L,此条件下饮料感官评价得分最高(94 分)。体外抗氧化实验结果显示黄精覆盆子保健饮料对DPPH 自由基的清除率可达79.35%,对ABTS+自由基的清除能力为79.35 mmo/L Trolox 当量,FRAP 法测定的饮料原液抗氧化能力为1.56 mmo/L FeSO4 当量,说明黄精覆盆子饮料具有较好的抗氧化作用。细胞实验也进一步证实黄精覆盆子保健饮料对PC12氧化损伤细胞的抗氧化活性,能显著促进H2O2 诱导的PC12 氧化损伤细胞增值率从61.55%恢复至81.37%。总之,本黄精覆盆子饮料的研制将为新型黄精覆盆子保健食品的开发和保健功效的研究提供新思路。
[1]陈孟广,陈莉娟,朱志柳,等.景宁县黄精产业现状与发展对策 [J].浙江农业科学,2020,61(6):1054-1056,1062.
[2]GONG H, GAN XN, LI YZ, et al.Review on the genus Polygonatum polysaccharides: Extraction, purification,structural characteristics and bioactivities [J].International Journal of Biological Macromolecules, 2023, 229: 909-930.
[3]LIU D, TANG W, HAN C, et al.Advances in Polygonatum sibiricum polysaccharides: Extraction, purification, structure,biosynthesis, and bioactivity [J].Frontiers in Nutrition, 2022, 9:1074671.
[4]阙灵,杨光,李颖,等.《既是食品又是药品的物品名单》修订概况 [J].中国药学杂志,2017,52(7):521-524.
[5]张瑞宇,周文斌.天然黄精甜米酒复合饮料的研制 [J].食品与机械,2003,4:32-34.
[6]李安,袁小卓,孙亚茹,等.响应面法优选黄精发酵功能饮料的工艺和配方 [J].中国酿造,2017,36(6):187-192.
[7]浙江省食品药品监督管理局.浙江省中药炮制规范 [M].北京:中国医药科技出版社,2015.
[8]YU G H, LUO Z Q, WANG W B, et al.Rubus chingii Hu: A review of the phytochemistry and pharmacology [J].Frontiers in Pharmacology, 2019, 10: 799.
[9]SHENG J Y, WANG S Q, LIU K H, et al.Rubus chingii Hu:an overview of botany, traditional uses, phytochemistry, and pharmacology [J].Chinese Journal of Natural Medicines,2020, 18(6): 401-416.
[10]HE B H, DAI L H, JIN L, et al.Bioactive components,pharmacological effects, and drug development of traditional herbal medicine Rubus chingii Hu (Fu-Pen-Zi) [J].Frontiers in Nutrition, 2023, 9: 1052504.
[11]吴瑞红,李慧杰,孙金旭,等.响应面法优化覆盆子浆果果酒发酵工艺研究 [J].食品研究与开发,2015,36(11):102-104.
[12]戴晓晴,余振宇,水龙龙,等.蓝莓覆盆子复合饮料的研制 [J].安徽农业科学,2017,45(14):73-76,86.
[13]JIANG P F, WANG Z G, SHI G Y, et al.Development of functional compound polysaccharide beverage and research on its antioxidant and hypoglycemic activities [J].Food and Fermentation Industry, 2020, 46 (1): 197-203
[14]NGUYEN T H, NGUYEN V P, NGO M K, et al.Optimization of extraction conditions of flavonoids from celeryseed using response surface methodology [J].Journal of Food Measurement and Characterization, 2021, 15(1): 134-143.
[15]MU X Y, WANG J Y, HE H, et al.An oligomeric semiconducting nanozyme with ultrafast electron transfers alleviates acute brain injury [J].Science Advances, 2021,7(46): eabk1210.
[16]ALMUSALLAM I A, MOHAMED AI A, BABIKER E E, et al.Optimization of ultrasound-assisted extraction of bioactive properties from date palm (Phoenix dactylifera L.)spikelets using response surface methodology [J].LWT-Food Scienceand Technology, 2021, 140: 110816.
[17]LI X, QI M L, SUN X L, et al.Surface treatments on titanium implants via nanostructured ceria for antibacterial and antiinflammatory capabilities [J].Acta Biomaterialia, 2019, 94:627-643.
[18]YAO H, ZHANG X, WEI G, et al.Protective effects of the vetiaflavone on H2O2-induced PC12 cells injury via improving oxidative stress and mitochondrial dysfunction [J].Latin American Journal of Pharmacy, 2017, 36(9): 1821-1826.
[19]MIMAKI Y, SATOU T, KURODA M, et al.New steroidal constituents from the bulbs of Lilium candidum [J].Chemical& Pharmaceutical Bulletin, 1998, 46(11): 1829-1832.
[20]刘笑焱.芝麻仁细胞壁多糖在焙烤过程中的降解研究 [D].郑州:河南工业大学,2023.
[21]董琪,李娜,刘露,等.超声波辅助提取黄精多糖工艺优化及抗氧化活性研究 [J].安徽科技学院学报,2021,35(5):83-88.
[22]于秋菊,耿凤英,张磊磊.微波辅助低共熔溶剂提取覆盆子总黄酮的工艺优化及活性研究 [J].中国食品添加剂,2023,34(2):43-51.
[23]谢煜敏,李晓敏,刘洪霞,等.人参黄精枸杞提取液活性研究及其饮料感官优化 [J].食品与发酵科技,2023,59(2):65-71.
[24]李卓俊.雌雄毛白杨和银杏HPLC指纹图谱和抗氧化活性的比较 [D].北京:中国中医科学院,2023.
[25]唐兰芳,王锋,苏小军,等.低共熔溶剂提取对黄精多糖性质及抗氧化活性的影响 [J].食品与发酵工业,2021,47(11):151-157.
[26]LIU X, WANG Y, GE W, et al.Spectrum-effect relationship between ultra-high-performance liquid chromatography fingerprints and antioxidant activities of Lophatherum gracile Brongn [J].Food Science & Nutrition, 2022, 10(5): 1592-1601.
[27]ZHANG H X, CAO Y Z, CHEN L X, et al.A polysaccharide from Polygonatum sibiricum attenuates amyloid-β-induced neurotoxicity in PC12 cells [J].Carbohydrate Polymers, 2015,117: 879-886.