蓝靛果(Lonicera caerulea L.var. edulis)是一种天然野生浆果,富含花青素、酚酸、黄酮、维生素C 等多种生物活性物质,具有很好的抗炎、抗氧化、治疗糖尿病等作用,被定义为“药食同源”水果 [1] 。蓝靛果果酒是以蓝靛果为原料的酒类制品,可将20 g/L 葡萄糖转化成1 vol%酒精 [2] ,同时生物发酵可产生多种人体必需氨基酸以及大量生物活性物质,具有改善视力、预防和治疗心血管疾病、抗癌、提高免疫力等多种功效 [3] 。但蓝靛果果酒中有机酸含量过高,导致口感较差,对其品质及市场发展产生不良影响。蓝靛果果酒中主要的有机酸为柠檬酸与苹果酸 [4] ,其中高水平的柠檬酸则会导致细胞外酸中毒及抑制人牙龈成纤维细胞的蛋白质合成,苹果酸则具有强烈辛酸味的双羧基酸,过量会导致尖锐的酸涩感 [5] 。因此,蓝靛果果酒降酸成为亟待解决的问题。
目前,主要的降酸方法为化学降酸、物理降酸和生物降酸,其中化学降酸应用较为广泛但易残留矿物质,影响果酒感官特性;物理降酸效果甚微,且成本较高 [6] 。因此,能够有效降酸并提高品质的生物降酸,成为果汁、果酒降酸的首选方法。例如Zhong 等 [7] 通过分离筛选得到一株毕赤酵母JT-1-3,可有效降解猕猴桃酒中柠檬酸。Jiang 等 [8] 从红树莓果中分离得到菌株Issatchenkia terricola WJL-G4,使红树莓汁中柠檬酸含量从22.80 g/L 降低到6.20 g/L。Peinado 等 [9] 证明菌株Schizosaccharomyces pombe 可将葡萄酒中苹果酸转化为乙醇,从而达到降酸的目的。Mónaco 等 [10] 分离得到菌株Pichiakudriavzevii ÑNI15,并证实该菌株有效降解葡萄酒中苹果酸,同时还能够改善葡萄酒的感官属性,增加其果香。
本研究拟从蓝莓、西梅、葡萄及蓝靛果中分离纯化酵母菌,以耐酸性能、降酸性能、发酵特性及耐受性为筛选指标,得到性状优良的耐酸、降酸酵母菌。分析该菌株发酵蓝靛果果酒的理化特性,并探究对其感官品质的影响。以期为改善蓝靛果果酒口感、提升蓝靛果果酒品质、促进蓝靛果果酒产业发展提供菌种资源,并为后续实际应用提供理论基础。
1 材料与方法
1.1 材料与设备
1.1.1 样品
蓝靛果样品来自黑河中俄林业科技合作园区,蓝莓(丹东H5)、西梅(欧洲李)、葡萄(新疆和田红)均购自东北林业大学水果超市。
1.1.2 培养基
YPD 培养基(m/V):酵母浸粉1%,蛋白胨2%,葡萄糖2%;固体培养基在此基础上添加琼脂2%;
柠檬酸培养基(m/V):酵母浸粉1%,蛋白胨2%,柠檬酸1%;
苹果酸培养基(m/V):酵母浸粉1%,蛋白胨2%,苹果酸1%;
酒石酸培养基(m/V):酵母浸粉1%,蛋白胨2%,酒石酸1%;
按照张二豪等 [11] 的方法配置2,3,5-氯化三苯基氯化四氮唑(2,3,5-Triphenyltetrazolium Chloride,TTC)上层培养基、TTC 下层培养基、产酯固体培养基和发酵培养基。
1.1.3 主要试剂
酵母浸粉、蛋白胨、琼脂,北京奥博星生物技术有限责任公司;酒石酸、苹果酸、柠檬酸(分析纯),天津市北联精细化学品开发有限公司;常规药品均为分析纯。
1.1.4 仪器与设备
PHS-3C 型精密pH 计,上海仪电科学仪器股份有限公司;DH6000A 恒温培养箱,天津市泰斯特公司;JYL-C91T 型榨汁机,九阳股份有限公司;TGL-16G型高速离心机,北京普析通用仪器有限公司;721 型可见光分光光度计,上海精密科学仪器有限公司。
1.2 试验方法
1.2.1 酵母菌的初步分离与筛选
1.2.1.1 酵母菌的分离
参考Jiang 等 [8] 的方法进行菌株分离实验,称取25 g 破碎打浆样品于盛有90 mL 无菌水的锥形瓶中,28 ℃摇床振荡20 min。梯度稀释后吸取0.1 mL 于YPD 固体培养基平板上均匀涂布,28 ℃下培养72 h,挑选各典型菌落,反复进行平板划线分离,得到纯化的单菌落进行保存并命名。
1.2.1.2 耐酸酵母菌的筛选
使用5 mol/L 的HCl 配置pH 值为2、3 和4 的YPD 液体培养基。各菌株以3%(V/V)的接种量接入到不同pH 值培养基中。28 ℃、150 r/min 摇床培养24 h,后通过平板计数法计算存活率 [12] 。
1.2.1.3 酵母菌降酸能力测定
将3 mL 活化菌液以4 000 r/min 离心5 min 获得沉淀,无菌盐水洗涤两次后置于生理盐水中1 h消耗残留的碳源。初始接种量为106 CFU/mL [7] 接种于柠檬酸、苹果酸、酒石酸液体培养基中,28 ℃,150 r/min 条件下震荡培养5 d。按照GB/T 12456-2021《食品安全国家标准食品中总酸的测定》采用酸碱滴定法,测定有机酸含量变化 [13] 。
式中:
A——样品的降酸率,%;
A0——未加菌液的有机酸质量浓度,g/L;
A1——加入菌液以后的有机酸质量浓度,g/L。
1.2.2 酵母菌发酵特性测定
1.2.2.1 发酵性能测定
将活化菌种按1%(V/V)的接种量接种于含有20 mL YPD 液体培养基和杜氏小管的试管中,28 ℃培养8 d。根据杜氏小管发酵法观察各菌株产气量与产气速率,每12 h 记录一次二氧化碳的重量损失 [14] 。
1.2.2.2 产H2S能力测定
在含有铋作为指示剂的Biggy 琼脂上测试选定菌株的H2S 产量。将活化后的菌株接种于培养基上,26 ℃下孵育3~5 d,通过评估菌落周围的区域颜色 [15] ,测定其H2S 产量。
1.2.2.3 产酯能力测定
将活化后的菌株接种到产酯培养基上,28 ℃培养48 h,菌落呈黄色越深,产酯能力越强。
1.2.2.4 产乙醇能力测定
将活化后的菌株接种到TTC 下层培养基。28 ℃培养48 h 后倒入上层培养基,避光保持2 h,比较菌株颜色 [14] ,颜色越红,产乙醇能力越强。
1.2.2.5 产β-葡萄糖苷酶能力测定
根据Son 等 [12] 的方法稍作修改,各菌株产β-葡萄糖苷酶能力通过p-NPG 法进行测定。菌株过夜培养后,于4 ℃、8 000 r/min 离心10 min,取上清液(粗酶液)。每100 μL 上清液中加入200 μL 的35 mmol/L p-NPG 溶液混匀,37 ℃保温30 min,加入2 mL 浓度为1 mol/L 的Na2CO3 终止液,在405 nm 波长处测定OD 值。得到标准曲线为y=9.635 6x,相关系数R2=0.998 7。
1.2.3 酵母菌耐受性测定
1.2.3.1 葡萄糖耐受性测定
将菌株以3%(V/V)的接种量接入到添加葡萄糖质量浓度为50、100、150、200、250、300 g/L的YPD 液体培养基中,28 ℃恒温培养48 h。测定其在600 nm 波长处的吸光度以确定菌株的葡萄糖耐受性。
1.2.3.2 酒精耐受性测定
将菌株以3%(V/V)的接种量接入到酒精体积分数分别为0%、4%、8%、12%、16%、20%的YPD 液体培养基内,28 ℃恒温培养48 h。测定其在600 nm 波长处的吸光度以确定菌株的乙醇耐受性。
1.2.3.3 SO2耐受性测定
将菌株以3%(V/V)的接种量接种到SO2 质量浓度(以偏重亚硫酸钾计)为100、200、300、400、500、600、700 mg/L 的YPD 液体培养基中,28 ℃恒温培养48 h。测定其在600 nm 波长处的吸光度以确定菌株的SO2 耐受性 [7,16] 。
1.2.4 主成分分析
筛选出具有耐酸特性的酵母菌,对菌株的耐酸性能、降酸性能、产H2S、产酯、产乙醇、产β-葡萄糖苷酶能力及葡萄糖、乙醇、SO2 的耐受性指标采用SPSS 17.0 软件(美国IBM 公司)进行主成分分析,筛选得到性能最优的耐酸、降酸菌株。
1.2.5 分子生物学鉴定
使 用 酵 母DNA 试 剂 盒(Sangon Biotech,Shanghai,China)提取菌株的DNA。正向引物ITS1(5′TCC GTA GGT GAA CCT GCG G-3′)和反向引物ITS4(5′-TCC TCC GCT TAT TGA TAT GC-3′)通过聚合酶链反应(PCR)扩增rDNA 基因的ITS1和ITS2 区域。
PCR 扩增条件:94 ℃初变性5 min;94 ℃变性30 s,57 ℃退火30 s,72 ℃延伸90 s,30 个循环,最后于72 ℃延伸10 min。PCR 产物通过1%(m/V)琼脂糖凝胶电泳分离。150 V 条件下电泳20 min,凝胶在紫外线下可视化。使用搜索工具(BLAST)将最终PCR 产物的序列与GenBank 数据库中可用序列进行比较,使用MEGA 版本7 软件构建系统发育树。
1.2.6 蓝靛果果酒发酵
处理(自然解冻蓝靛果流水下清洗、挑选)→打浆→酶解(添加400 mg/L 纤维素酶、400 mg/L果胶酶,50 ℃,180 min)→调配(焦亚硫酸钠60 mg/L)→巴氏杀菌(85 ℃,20 min)→接种3%菌液(V/V)→发酵(27 ℃、15 d)市售安琪酿酒酵母SY、RW、BV818 均为活性干粉,以200 mg/L的接种量进行温水活化,接种于50 mL 蓝靛果汁中扩培24 h,最后进行接种试验。
1.2.7 蓝靛果果酒质量评价
1.2.7.1 基本理化指标测定
根据GB/T 15038-2006,采用电位滴定法测定发酵蓝靛果汁总酸度,并以柠檬酸表示,乙醇含量采用密度瓶法测定,挥发酸含量通过碱标准溶液滴定法测定。还原糖含量采用NY2742-2015《水果及制品可溶性糖的测定3,5-二硝基水杨酸比色法》测定。可溶性固形物含量(SSC)通过便携式折光仪测量。颜色密度和色调采用光谱仪分别测定样品在420、520 和620 nm 处的吸光度 [17] ,使用以下公式计算色彩密度(C1)与色调(C2)。

式中:
C1 样品的色彩密度;
C2——样品的色调;
A420——上清液在420 nm 处的吸光度;
A520——上清液在520 nm 处的吸光度;
A620——上清液在620 nm 处的吸光度。
1.2.7.2 有机酸的测定
采用高效液相色谱法测定样品中柠檬酸、苹果酸、酒石酸含量 [13] 。测定条件:色谱柱:Agilent ZORBAX Eclipse Plus C18(250 mm×4.6 mm),流动相:0.1%磷酸溶液-甲醇,体积比为97.5:2.5 的流动相等度洗脱10 min,较短时间梯度让甲醇相达到100%并平衡5min,后将流动相调整为0.1%磷酸溶液-甲醇体积比比例为97.5:2.5,平衡5 min。流量为0.5 mL/min,进样量为20 μL,柱温为40 ℃,检测波长为210 nm。
1.2.7.3 总黄酮和总酚含量的测定
采用硝酸铝显色法 [18] 评估总黄酮含量(TFC)。TFC 的结果显示为芦丁标准曲线(y=0.000 5x-0.000 2,R2=0.993 5)。
采用Folin-Ciocalteu法 [19] 测定总酚含量(TPC)。TPC 的结果显示为没食子酸标准曲线(y=0.001 9x+0.001 8,R2=0.995 1)。
1.2.7.4 总花色苷含量的测定
采用pH 示差法测定发酵蓝靛果果酒中总花色苷含量 [20] 。
1.2.7.5 感官评定
参考GB/T 15038-2006《葡萄酒、果酒通用分析方法》,培训小组由20 人组成(男女各10 人),均符合法定饮酒年龄(>18 周岁)。从口感、香气、状态、色泽和典型性共5 个指标进行感官评价,满分100 分,感官评分标准见表1。
表1 蓝靛果果酒感官评分标准
Table 1 Sensory scoring criteria for L.edulis wines

指标 评价标准 分数 / 分口感(30 分)酸甜适度、醇厚柔和、酒体完整、无异味 20~30酸甜较适度、酒体完整、无异味 10~19酸甜不协调、有苦涩味 0~9香气(20 分)香气浓郁、酒香与果香协调 15~20香气一般、酒香与果香协调 8~14有刺激性气味、酒香与果香不协调 0~7状态(15 分)清亮透明、无悬浮物、摇动无气泡 10~15清亮、较透明、略带少量悬浮物 5~9不透明、含有大量悬浮物,大量气泡 0~4色泽(15 分)呈亮红色、色泽较好、光泽度明显 10~15呈亮红色、色泽一般、光泽度一般 5~9颜色异常或褪色,光泽度差 0~4典型性(20 分)具有蓝靛果特有的风味、饱满纯正、爽口 15~20带有蓝靛果特有的风味 8~14无蓝靛果特有的风味、有酸败味 0~7
1.2.8 数据分析
使用Origin 软件制图、SPSS 17.0 软件(美国IBM 公司)进行数据分析,采用MEGA 软件构建系统发育树。每个实验重复3 次,数据用“平均值±标准差”表示,当P<0.05 时数值具有显著性差异。
2 结果与分析
2.1 酵母菌的分离与筛选
2.1.1 耐酸酵母菌筛选
从蓝莓、西梅、葡萄及蓝靛果中分离得到了32株酵母菌,对其耐酸性进行研究。由表2 可知,32 株酵母菌在pH 值为4 的条件下均可生长,其中菌株LD6 存活率最高为111.83%,菌株XM5存活率最低为27.40%。pH 值为3 条件下,差异显著(P<0.05),菌株PT4 存活率最高为112.06%,菌株LD1 存活率最低为10.30%。pH 值为2 条件下,17 株酵母菌存活率大于50%,7 株酵母菌受到抑制无法生长。因此选取在pH 值为2 条件下存活率大于50%的17 株耐酸酵母菌进行后续试验。多项研究表明,在浆果发酵过程中,低pH 值环境会抑制微生物活性,导致发酵时间延长,果酒口感变差。具有良好的耐酸性能,对于酵母菌的应用具有重要意义 [21] 。
表2 酵母菌在酸性环境下的存活率(%)
Table 2 Survival of yeast in acidic environment

注:结果以平均值±标准差表示(n=3),字母不同表示差异显著(P<0.05);—:表示未见菌株存活。
菌株编号菌株来源 pH 值4 pH 值3 pH 值2 LD1 蓝靛果 39.81±0.14n 10.30±0.07f —LD2 蓝靛果 41.80±0.57n 20.30±0.07ef 11.40±0.07i LD3 蓝靛果 102.97±1.29bc 100.44±5.66ab 86.97±1.63bcd LD4 蓝靛果 97.01±0.00efg 92.93±0.38abc 80.17±2.45e LD5 蓝靛果 99.08±1.25cdef 89.18±5.95abc 69.17±0.65f LD6 蓝靛果 111.83±0.29a 107.37±4.24ab 89.97±6.13bc LD7 蓝靛果 58.03±0.35k 26.30±0.64def —LD8 蓝靛果 97.50±2.11efg 92.12±1.37abc 70.07±0.15f LD9 蓝靛果 97.81±2.61defg 95.76±0.87abc 83.87±7.54cde LD10 蓝靛果 104.96±3.70b 107.30±1.74ab 80.67±1.35de LD11 蓝靛果 66.00±0.28j 26.30±0.35def —LD12 蓝靛果 94.96±4.80fg 89.21±3.02abc 85.67±4.16cde LD13 蓝靛果 58.5±0.49k 23.3±1.13def 10.00±0.21i LD14 蓝靛果 62.9±0.92j 18.3±0.64ef 11.20±0.14i LD15 蓝靛果100.81±1.10bcde 96.69±4.91abc 59.87±1.19g LD16 蓝靛果 97.98±0.64defg 85.72±2.81bc 66.97±0.32f LM1 蓝莓 48.60±1.84lm 23.36±1.34def —LM2 蓝莓 49.20±1.70lm 26.36±0.57def 11.26±0.42i LM3 蓝莓 50.50±1.48lm 25.03±2.83def 11.80±0.64i LM5 蓝莓 94.53±0.04gh 92.39±1.29abc 88.17±2.00bc LM6 蓝莓 104.50±1.84b 102.21±0.80ab 85.07±6.36cde LM7 蓝莓 93.91±0.94gh 83.42±0.64bc 50.17±14.30h PT1 葡萄 70.52±1.34i 36.30±0.21de —PT2 葡萄 41.27±0.71n 47.30±2.90d 11.58±0.21i PT3 葡萄 46.65±1.41m 22.35±1.08def —PT4 葡萄 102.13±6.20bcd 112.06±5.61a 108.7±3.25a XM1 西梅 51.5±0.64l 21.38±0.92ef 9.52±0.03i XM2 西梅 58.2±0.71k 25.33±0.57def 11.20±0.07i XM3 西梅 93.99±4.75gh 93.99±2.05abc 72.07±0.95f XM4 西梅 90.30±1.87h 105.20±2.04c 92.57±1.75b XM5 西梅 27.40±0.28o 11.34±1.70de —XM6 西梅 98.03±1.01defg 96.09±2.83abc 84.97±1.01cde
2.1.2 降酸酵母菌的筛选
17 株酵母菌对有机酸(柠檬酸、苹果酸、酒石酸)的降酸能力如图1 所示。在柠檬酸液体培养基中具有降酸效果的菌株有16 株,降酸率均可达60%,菌株XM4、XM3、LM5、LD3、XM6、LD5、LM6 降酸效果显著,降酸率可达90%。在苹果酸液体培养基中具有降酸效果的菌株共14株,8 株降酸率达50%,其中菌株XM4、PT4、LM5 降酸效果显著,降酸率可达到90%。对于酒石酸具有降酸效果的菌株17 株,7 株降酸率可达30%。对于三种有机酸降酸率均能达到17 株酵母菌降酸均值以上的共5 株,分别为LD3、LD4、XM6、LM5、PT4。卢思言等 [13] 从长白山蓝靛果中筛得到降酸效果良好的二孢接合酵母,其柠檬酸、苹果酸、酒石酸的降解率分别为42.60%、18.28%、13.09%,本研究筛选的菌株降酸率比之有明显提升。

图1 酵母对三种有机酸的降酸能力
Fig.1 Acid-reducing ability of yeast for three organic acids
2.2 发酵特性
2.2.1 发酵性能分析
酵母菌可利用葡萄糖进行发酵,将葡萄糖消耗、分解生成乙醇与二氧化碳,减少系统的质量,因此可以样品的失重量作为评价CO2 释放量的参数,用于评价菌株的发酵能力 [22] 。从表3 可以看出,17 株酵母菌的失重量存在显著差异(P<0.05),发酵能力也不同,菌株LD8 失重量为0.56 g,发酵能力最强。菌株PT4 与LD16 的失重量分别为0.30 g 与0.35 g,产气量仅为杜氏小管的1/4,甚至不产生气体,发酵能力最弱。48 h 内,有15 株菌株的杜氏小管中充满气体,发酵能力较强。Yin 等 [23] 以菌株发酵能力和酒精耐受性为评价指标,筛选得到一株适合酿造山楂酒的非酿酒酵母菌Meyerozyma guilliermondii。由于酿酒酵母菌的发酵能力一般强于非酿酒酵母菌,因此本实验所筛选的降酸酵母在发酵能力上,产生了较大差异。
表3 酵母菌的产气能力与失重量
Table 3 Gas production and weight loss in yeast

注:结果以平均值±标准差表示(n=3),字母不同表示差异显著(P<0.05)。-:表示不产气;+:表示产气量占杜氏管的四分之一;++、+++、++++:表示按程度递增。
酵母菌 发酵时间 /h CO2 失重量 /g 12 2 LD3 - ++ ++LD4 - + +36 48++ ++++ 0.47±0.08bcd++ ++++ 0.49±0.03ab LD5 - + ++ ++++ 0.51±0.08ab LD6 - + +++ ++++ 0.39±0.03ef LD8 - ++++ ++++ ++++ 0.56±0.06a LD9 + +++ ++++ ++++ 0.51±0.01ab LD10 - +++ ++++ ++ 0.40±0.04def LD12 - ++++ ++++ +++ 0.52±0.02ab LD15 - ++++ ++++ ++++ 0.45±0.04cde LD16 - + + - 0.35±0.01fg LM5 - ++ ++++ ++++ 0.41±0.01cdef LM6 - +++ ++++ ++++ 0.50±0.02ab LM7 + ++ ++++ ++++ 0.50±0.04ab PT4 - - - - 0.30±0.05g XM3 - - ++++ ++++ 0.49±0.01ab XM4 - - ++++ ++++ 0.48±0.05abc XM6 + +++ ++++ ++++ 0.50±0.04ab
2.2.2 酵母菌产H2S能力分析
H2S 具有大蒜味或臭鸡蛋味的不良气味,感官阈值低且难以去除,对果汁、果酒感官产生负面影响的同时还对人体有害 [24] 。
各菌株产生H2S 性能如图2 所示,菌株LD9、PT4 在BIGGY 培养基上颜色最深呈黑色,菌株LM7、XM4、LD15、XM3、LM6、LM5 呈深棕色,菌株LD5、XM6 呈棕色,以上均为高产H2S 酵母菌。菌株LD3、LD4、LD6 在培养基上呈浅棕色,为低产H2S 酵母,菌株LD10、LD8、LD12、LD16 在培养基上呈白色,为不产H2S 酵母。Šuranská 等 [15] 、Mandy 等 [25] 在筛选适宜发酵葡萄酒菌株的研究中,均将H2S 产量作为一项重要筛选标准,并验证了高产H2S 菌种会导致异味生成。因此,应选择低产与不产H2S 的酵母菌应用于后续果汁发酵中。
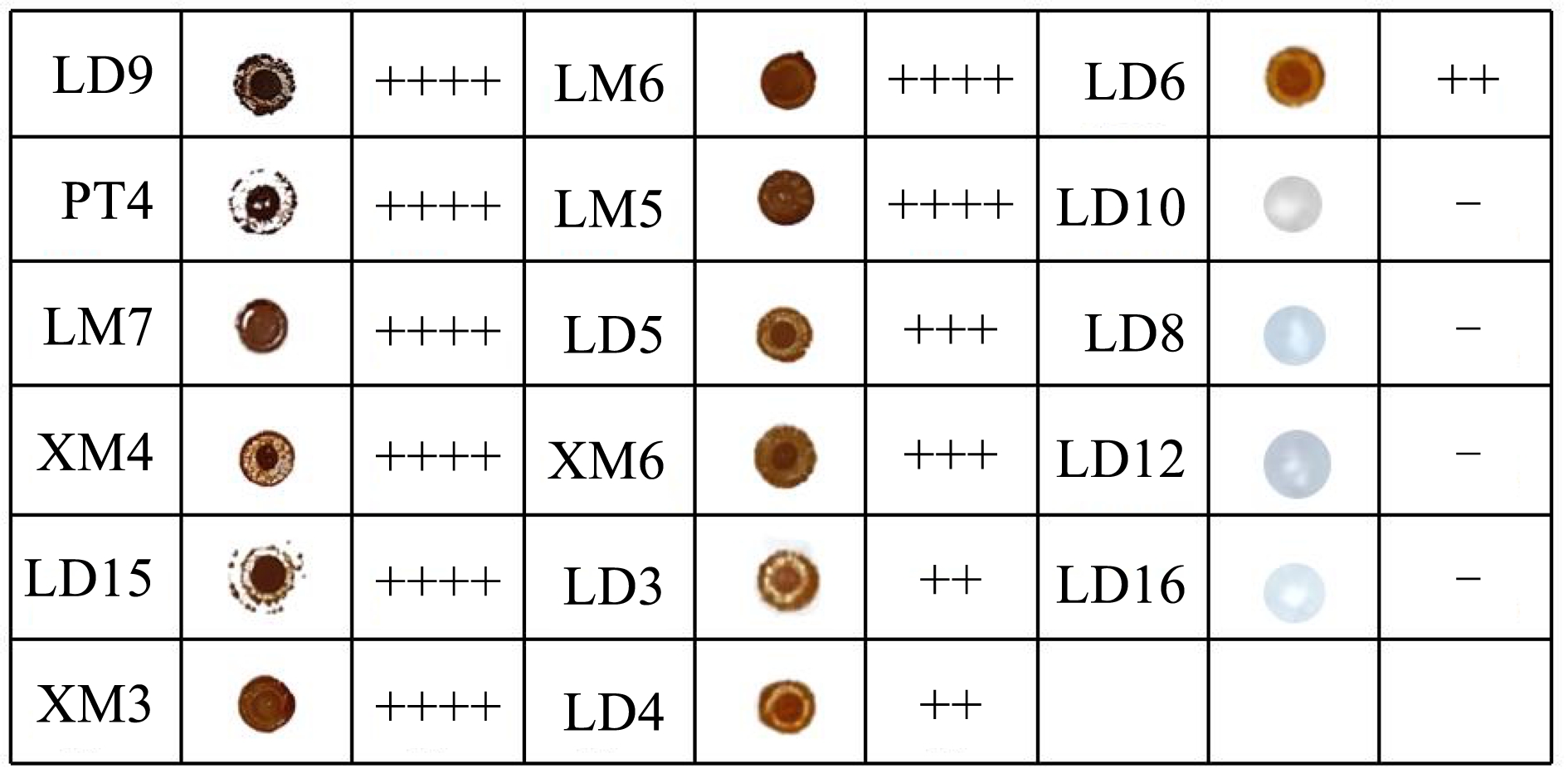
图2 17 株酵母菌在BIGGY 培养基上的显色
Fig.2 Color development of 17 strains of yeast on BIGGY medium
注:-:表示不生产;+:表示白色菌落;++:表示浅棕色;+++:表示棕色;++++:表示深棕色/黑色。
2.2.3 酵母菌产酯能力分析
产酯酵母具有降低乙醇产量和增强风味的作用,其中醇与羧酸反应形成的酯类化合物是影响果酒风味特征的重要挥发性香气化合物 [26] 。如图3 所示,17 株酵母菌中LD3、LD12、XM3、LD5、LM7、XM4、LM6、LD4、XM6 在产酯培养基上呈深黄色,其中菌株LD3 颜色最深、产酯能力最强。LM5、LD8、LD16、LD15、LDF4 呈浅黄色,产酯能力较弱。LD6、PT4、LD9 呈白色,不属于产酯酵母。在果酒发酵过程中,产酯酵母释放蛋白酶、脂肪酶和糖苷酶等功能性酶,通过糖酵解、酯化等途径降解果汁中的糖、脂肪和蛋白质,从而产生芳香族酯、醇类和萜烯等具有芳香特性的代谢产物 [27] 。Qu 等 [28] 在9 种广东酒曲中筛选得到产酯能力最强的酵母菌CM15,其发酵米酒的酯含量高、高级醇含量低,其中乙酸乙酯和乳酸乙酯含量分别增加25%和214%,证明产酯酵母可以作为一种功能微生物来提升酿造酒的感官品质。

图3 17 株酵母菌在产酯培养基上的显色
Fig.3 Color development of 17 yeast strains on esterproducing medium
2.2.4 酵母菌产乙醇能力分析
TTC 作为感光络合物,可以通过其与酵母代谢物发生反应呈现的颜色,来判断酵母菌的产乙醇能力 [11] 。如图4 所示,在TTC 培养基上,菌株LD9呈深红色,说明其产乙醇能力最高,但其产酯能力最低。菌株XM6、LD16、LD8 与LD10 在培养基上呈微红色,产乙醇能力低,菌株LDF12 在培养基上呈白色,不产乙醇。其他菌株在TTC 培养基上呈粉红色,产乙醇能力较强。酯类物质作为果酒最丰富的香气化合物,包括乙酸酯和乙酯两类,其中乙酯的生物合成受乙醇含量的影响较大,因此产酯能力高的菌种产乙醇能力一般较低 [29] 。

图4 17 株酵母菌在TTC 培养基上的产乙醇能力
Fig.4 Ethanol production ability of seventeen yeast strains on TTC medium
2.2.5 酵母菌产β-葡萄糖苷酶能力分析
β-葡萄糖苷酶在各种生物过程中发挥重要作用,可通过释放游离糖苷键,增强香气物质的产生 [30] 。如图5 所示,所筛选的17 株酵母菌均能生成β-葡萄糖苷酶,且菌株之间存在显著差异(P<0.05),有14 株菌株产酶活大于3.00 mU/mL,其中菌株LM5 产酶活为7.06 mU/mL,产酶能力最强。菌株PT4 产酶活为1.24 mU/mL,产酶能力最弱。Liu等 [31] 分离筛选得到一株高产β-葡萄糖苷酶的酵母菌Wickerhamomyces anomalus C4,并通过顶空固相微萃取(HS-SPME)法进行挥发性成分分析。与低产β-葡萄糖苷酶的市售酵母相比,C4 酵母菌可以显著增强果酒的挥发性香气丰富度和复杂性,表明具有产β-葡萄糖苷酶特性的酵母菌在果酒酿造方面具有巨大应用潜力。

图5 17 株酵母产β-葡萄糖苷酶能力
Fig.5 β-glucosidase production capacity of seventeen yeast strains
注:结果以平均值±标准差表示(n=3),图中字母表示差异显著(P<0.05),图6~8 同。
2.3 耐受性分析
2.3.1 葡萄糖耐受性
葡萄糖作为酵母菌发酵的基础原料,决定了酵母菌的生长繁殖和代谢能力,但高浓度糖溶液所形成的高渗透压环境会抑制酵母菌的生长繁殖 [32] 。如图6 所示,随着葡萄糖质量浓度增加,酵母菌株生长量呈现先增长后下降的趋势,在葡萄糖质量浓度为100 g/L 时,生长量达到最高。其中菌株LD12耐糖能力最强,在葡萄糖质量浓度为250 g/L 时生长受到抑制作用,PT4 受耐糖能力最弱,在质量浓度为100 g/L 时生长受到抑制作用。17 株酵母菌在高渗条件下均表现出良好的耐受性,在300 g/L 葡萄糖条件下依旧能够存活。徐易洁等 [33] 以葡萄糖耐受性为指标,复筛得到Wickerhamomyces anomalus酵母菌,耐糖能力较强,在葡萄糖质量浓度为150 g/L 时生长能力最强,葡萄糖浓度为300 g/L 时生长情况较差。本实验结果与之相似。蓝靛果中葡萄糖含量较低,一般为30 g/L [34] ,本实验筛选酵母菌可满足蓝靛果及其他浆果果酒发酵。

图6 17 株酵母菌葡萄糖耐受性能
Fig.6 Glucose tolerance performance of 17 strains of yeasts
2.3.2 乙醇耐受性
乙醇是酵母菌发酵代谢的产物,但高浓度的乙醇对细胞具有一定的毒害作用,甚至会杀死酵母菌 [32] 。因此具有较高的乙醇耐受性是酵母存活与发酵的一个重要特征。乙醇胁迫结果图7 表明,随着乙醇体积分数的增加,菌株生长量受到抑制作用显著(P<0.05),大多菌株可耐受乙醇体积分数为8%,适合于低醇饮品的研制。其中菌株LD15 乙醇耐受能力最强,乙醇体积分数为20%时依然能够存活。菌株LD10、LD16 不耐受乙醇,当添加乙醇体积分数为4%时菌株不生长。王晖等 [32] 从青梅发酵液中分离得到Zygosaccharomyces parabailii 酵母菌,发现其乙醇耐受性较弱,仅为3%。

图7 17 株酵母菌乙醇耐受性能
Fig.7 Ethanol tolerance performance of 17 strains of yeast
2.3.3 SO2耐受性
果酒通过添加SO2 起到抗氧化和抗菌的重要作用,但超过一定量则会引起酵母菌发酵停滞或停止。果酒中SO2 添加量通常小于0.25 g/L,最大不超过0.4 g/L,为保证发酵的正常进行,确认酵母菌对SO2 的高耐受性是十分必要的 [35] 。由图8 可知,随着SO2 浓度的增加,不同菌株对不同浓度SO2 的抗性也表现出较大的差异。菌株LD9、LD10、LD12、LD16、PT4 受抑制作用显著(P<0.05),其中菌株LD16 在700 mg/L 的SO2 浓度下无法生长。其余酵母菌株均表现出较强的SO2 耐受性,未受到明显抑制作用。卢思言等 [13] 对筛选得到的降酸菌株二孢接合酵母进行SO2 耐受性分析,发现该菌株在500 mg/L 的SO2 浓度下几乎不能存活,证明本实验分离菌株SO2 耐受性较高。

图8 17 株酵母菌SO2 耐受性能
Fig.8 SO2 tolerance performance of 17 strains of yeast
2.4 主成分分析
将17 株酵母菌的耐酸性能、降酸性能(柠檬酸、苹果酸、酒石酸)、发酵特性(产H2S、产酯、产乙醇、产β-葡萄糖苷酶)、耐受性(葡萄糖、乙醇、SO2)中共计11 个特性指标进行整理和标准化处理,进行主成分分析,筛选出性能最优的耐酸降酸菌株。
如图9 所示,优良菌株的11 个特征值中,共有4 个的数值大于1。因此,用于分析的特性指标可以简化为4 个主成分。由表4 可知,4 个主成分的方差贡献率分别为40.741%、23.071%、12.383%、9.782%。其中主成分1、2、3 的累计贡献率达到了76.194%。可以将进行分析的11 个特性简化为3 个主成分,用于解释实验的大部分信息。

图9 11 个特性指标的碎石图
Fig.9 Scree plot of 11 characteristic indicators
表4 主成分特征值及贡献率
Table 4 Eigenvalues and contribution rates of principal components to total variance

成分 特征值 方差贡献率 /% 累计方差贡献率 /%1 4.481 40.741 40.741 2 2.538 23.071 63.812 3 1.362 12.383 76.194 4 1.076 9.782 85.977
由表5 可以看出每个主成分在所分析特性上的成分载荷。第1 主成分主要对7 个特性进行解释:其成分载荷分别为对乙醇的耐受性0.929、SO2 的耐受性0.840、苹果酸降解率0.796、酒石酸降解率0.761、产乙醇能力0.730、柠檬酸降解率0.711、低产H2S 能力0.515,低产H2S 能力的表达为负向;第2 主成分主要解释4 个特性:对葡萄糖的耐受性0.924、产酯能力0.748、耐酸能力0.677、产β-葡萄糖苷酶能力0.540,其中耐酸能力的表达为负向。第3 主成分主要解释1 个特性:低产H2S 能力0.762。
表5 主成分的成分荷载矩阵
Table 5 Component loading matrix for principal components

菌株特性 成分1 2 3对乙醇的耐受性 0.929 0.092 -0.043对SO2 的耐受性 0.840 0.203 0.238苹果酸降解率 0.796 -0.320 0.294酒石酸降解率 0.761 -0.277 0.367产乙醇能力 0.730 -0.364 -0.391柠檬酸降解率 0.711 0.037 -0.043对葡萄糖的耐受性 0.004 0.924 0.043产酯能力 0.380 0.748 0.375耐酸性能 0.076 -0.677 0.361产β-葡萄糖苷酶 0.497 0.540 -0.273低产H2S 能力 -0.515 0.108 0.762
由表6 可知,综合排名前4 的菌株为LM7、LD3、LD4、LM6,得分分别为3.084、2.904、2.803、2.797,明显高于其他菌株。菌株LM7 与LM6 由于产H2S 较多,不适于蓝靛果果酒降酸应用。菌株LD3 与LD4可有效降解三种有机酸,同时具有良好的发酵性能与耐受性能,值得一提的是其低产H2S,并且高产酯与β-葡萄糖苷酶的特性为果酒发酵香气提供更多可能性,可作为潜在的耐酸降酸菌株进行后续研究。
表6 17株酵母菌的主成分得分结果
Table 6 Results of the principal component scores of 17 strains of yeasts

菌株编号 成分第1 主成分 第2 主成分 第3 主成分 总和LD3 1.192 -0.157 1.869 2.904 LD4 1.247 -0.016 1.573 2.803 LD5 1.104 0.140 0.420 1.6 LD6 0.141 -1.557 1.065 -0.3 LD8 -2.554 1.153 0.244 -1.1 64 50 57 LD9 0.331 -1.577 -2.120 -3.366 LD10 -4.972 0.086 0.258 -4.629 LD12 -2.898 1.252 1.416 -0.23 LD15 -0.738 -0.361 -1.434 -2.533 LD16 -2.823 0.890 -1.623 -3.556 LM5 2.136 -0.078 -0.598 1.460 LM6 1.489 1.468 -0.160 2.797 LM7 1.866 2.029 -0.811 3.084 PT4 -0.393 -4.805 -0.132 -5.329 XM3 1.605 1.563 -0.937 2.230 XM4 2.3 -0.099 -0.143 2.058 XM6 0.968 0.069 1.113 2.151
2.5 26S rRNA序列分析和系统发育树分析
由图10 可知,对纯化后的酵母菌株LD3 与LD4 的基因组DNA 进行PCR 扩增,进行琼脂糖凝胶电泳分析 [13] 。在紫外灯照射下的结果可知菌株LD3 与LD4 的电泳条带分别为591 bp 与589 bp。

图10 酵母菌PCR 扩增结果分析
Fig.10 Result of PCR amplify of yeast strains
将得到的基因序列与Genebank 数据库中序列进行同源性比较,使用MEGA V7.0.26 软件进行系统进化树分析 [13] 。结果如图11 所示,可判定菌株LD3 与LD4 均为季也蒙迈耶氏酵母(Meyerozyma guilliermondii)。菌 株LD3 与LD4 均 来 源 于 蓝 靛果,两菌株的菌落形态、发酵性能和耐受性能都非常接近,故判断二者为同一种菌。季也蒙迈耶氏酵母作为非酿酒酵母菌,相比传统酿酒酵母能够生成高水平的香气化合物 [23] ,在实现有效降酸的同时为果酒提供更加理想的口味。Gao 等 [36] 通过实验证明Meyerozyma guilliermondii NM218 在赤霞珠葡萄酒发酵中能够显著降低果酒总酸含量、增加香茅醇和反式橙花醇含量,增强葡萄酒的花香与果香。

图11 酵母菌株的系统进化发育树
Fig.11 Phylogenetic tree of yeast strains
2.6 蓝靛果果酒的理化特性
2.6.1 基本理化指标分析
将筛选出的季也蒙迈耶氏酵母与商业用安琪SY 酵母、安琪RW 酵母、安琪BV818 酵母分别接种于蓝靛果汁中进行纯菌发酵,进一步验证其降解有机酸的能力。蓝靛果果酒的基本理化指标见表7。季也蒙迈耶氏酵母发酵果酒的可溶性固形物与总还原糖含量分别9.95 °Brix 与4.05 g/L,显著高于其他3 组酿酒酵母菌纯发酵,适用于酿制半干型果酒,这与非酿酒酵母菌的发酵能力和代谢途径差异相关。安琪SY 酵母发酵蓝靛果果酒酒精度最高,在相同条件下,安琪SY 酵母将底物转化为酒精的能力强于其他3 种酵母菌,其中BV818 酒精度含量最低,可能是蓝靛果果汁的低酸环境对其发酵能力有所影响。
表7 蓝靛果果酒的理化指标
Table 7 Physical and chemical indicators of L.edulis wines

注:结果以平均值±标准差表示(n=3),字母不同表示差异显著(P<0.05)。
指标 蓝靛果果汁 季也蒙迈耶氏酵母 RW SY BV818 SSC /(°Brix) 15.5±0.03a 9.95±0.07b 8.03±0.04c 8.00±0.00c 8.08±0.04c总还原糖 /(g/L) 27.67±0.31a 4.05±0.34b 2.07±0.26c 2.05±0.18c 2.14±0.27c酒精度 /%vol —2.23±0.02c 2.48±0.03b 3.27±0.07a 1.98±0.06d总酸 /(g/L) 23.34±0.37d 21.46±0.20e 26.25±0.36b 25.90±0.07c 27.99±0.60a柠檬酸 /(g/L) 21.33±0.46d 19.14±0.21e 23.48±0.17b 22.46±0.24c 25.78±1.18a L-苹果酸 /(g/L) 1.28±0.05b 0.77±0.03d 0.78±0.08d 1.02±0.02c 1.47±0.07a酒石酸 /(g/L) 1.53±0.04c 1.26±0.08d 1.78±0.04a 1.65±0.06b 1.62±0.03bc挥发酸 /(g/L) —0.15±0.01c 0.36±0.02a 0.33±0.01b 0.31±0.01b总黄酮 /(mg/mL) 21.42±0.03d 22.25±0.43a 22.31±0.31a 21.89±0.86b 21.77±0.94c总多酚 /(mg/mL) 6.89±0.13b 7.43±0.31a 7.57±0.15a 6.75±0.25b 5.87±0.18c花色苷 /(mg/L) 141±4.77a 83.49±7.58c 110.04±5.21b 111.97±2.95b 106.37±6.85b色彩密度 5.82±0.05a 4.77±0.16b 5.71±0.11a 5.81±0.22a 5.75±0.31a色调 0.61±0.01a 0.49±0.00c 0.57±0.00b 0.58±0.04ab 0.57±0.04b
季也蒙迈耶氏酵母发酵果酒总酸含量为21.46 g/L,显著低于蓝靛果果汁与3 种酿酒酵母发酵得到的果酒。柠檬酸是蓝靛果中主要有机酸,季也蒙迈耶氏酵母发酵果酒柠檬酸含量显著降低,降酸率可达10.27%,3 种酿酒酵母菌发酵果酒中的柠檬酸显著增加,其中BV818 发酵果酒柠檬酸含量最多,为25.78 g/L。季也蒙迈耶氏酵母菌发酵果酒中L-苹果酸与酒石酸均显著降低,在酿酒酵母RW 与SY 发酵果酒苹果酸含量降低,酒石酸含量增加,酿酒酵母BV818 发酵果酒中苹果酸与酒石酸含量均显著增加。证明季也蒙迈耶氏酵母具有明显降酸作用,且能较好的调节发酵蓝靛果汁的口感。挥发酸也是评价果酒品质的重要指标,挥发酸含量过高会导致果酒发酵异常,在口感上带给人醋味和尖酸感。其中季也蒙迈耶氏酵母发酵果酒挥发酸含量为0.15 g/L,为发酵果酒中最低,其他3 种酿酒酵母发酵果酒的挥发酸含量高于0.31 g/L,但均符合果酒生产标准。刘小雨等 [37] 在发酵野木瓜果酒实验中发现,季也蒙迈耶氏酵母发酵果酒的总酸、挥发酸均低于市售酿酒酵母菌发酵果酒,且感官评分最高。
由表7 可知,4 种蓝靛果果酒中黄酮含量相差不大,总酚含量差异显著,其中季也蒙迈耶氏酵母与RW 酵母发酵蓝靛果果酒中多酚含量显著高于SY 与BV818 酵母发酵果酒。季也蒙迈耶氏酵母发酵果酒中花色苷含量为88.49 mg/L,显著低于3 种酿酒酵母发酵果酒。在臧伟等 [38] 的研究中,花色苷含量也呈下降趋势,这可能归因于季也蒙迈耶氏酵母的高β-葡萄糖苷酶活力,通过催化花色苷β-糖苷键断裂,生成糖和花色素,花色素很不稳定可自发转换成无色衍生物 [39] 。同时季也蒙迈耶氏酵母发酵的蓝靛果果酒颜色密度和色调也最低,主要归因于花青素、单宁等酚类物质的含量变化 [23] 。
2.6.2 感官评价
如图12 可知,4 种蓝靛果果酒的感官评价存在明显差异,其中季也蒙迈耶氏酵母发酵果酒评分最高,RW 酵母发酵果酒评分最低。在色泽与状态方面,季也蒙迈耶氏酵母发酵果酒表现最优,呈亮红色,光泽度更佳,酿酒酵母发酵蓝靛果果酒则可能因为花色苷含量高,酚类物质氧化导致酒体颜色偏深,酒体浑浊且光泽度较差。在口感方面,季也蒙迈耶氏酵母发酵果酒总糖含量、糖酸比均最高,总酸、挥发酸含量最低,总酚、黄酮含量较高,因此酒体丰满、醇厚协调、酸甜适中。3 种酿酒酵母菌发酵果酒总酚、总酸含量高、糖酸比偏低,酒体酸涩感尖锐且无典型性。在香气方面,相比于3 种酿酒酵母,非酿酒酵母菌季也蒙迈耶氏酵母在发酵过程中可产生高浓度的乙酸乙酯等香气物质,使蓝靛果果酒具有纯正怡人的果香和酒香。同时,Yin 等 [23] 研究发现季也蒙迈耶氏酵母发酵山楂酒能产生较高的主要香气物质,提升山楂酒的感官特性,并证实该菌株具有提高山楂酒品质的潜力。总体而言,季也蒙迈耶氏酵母能够有效降低蓝靛果果酒中总酸含量,起到平衡酸感并丰富香气化合物的作用,使蓝靛果果酒感官品质得到提升。
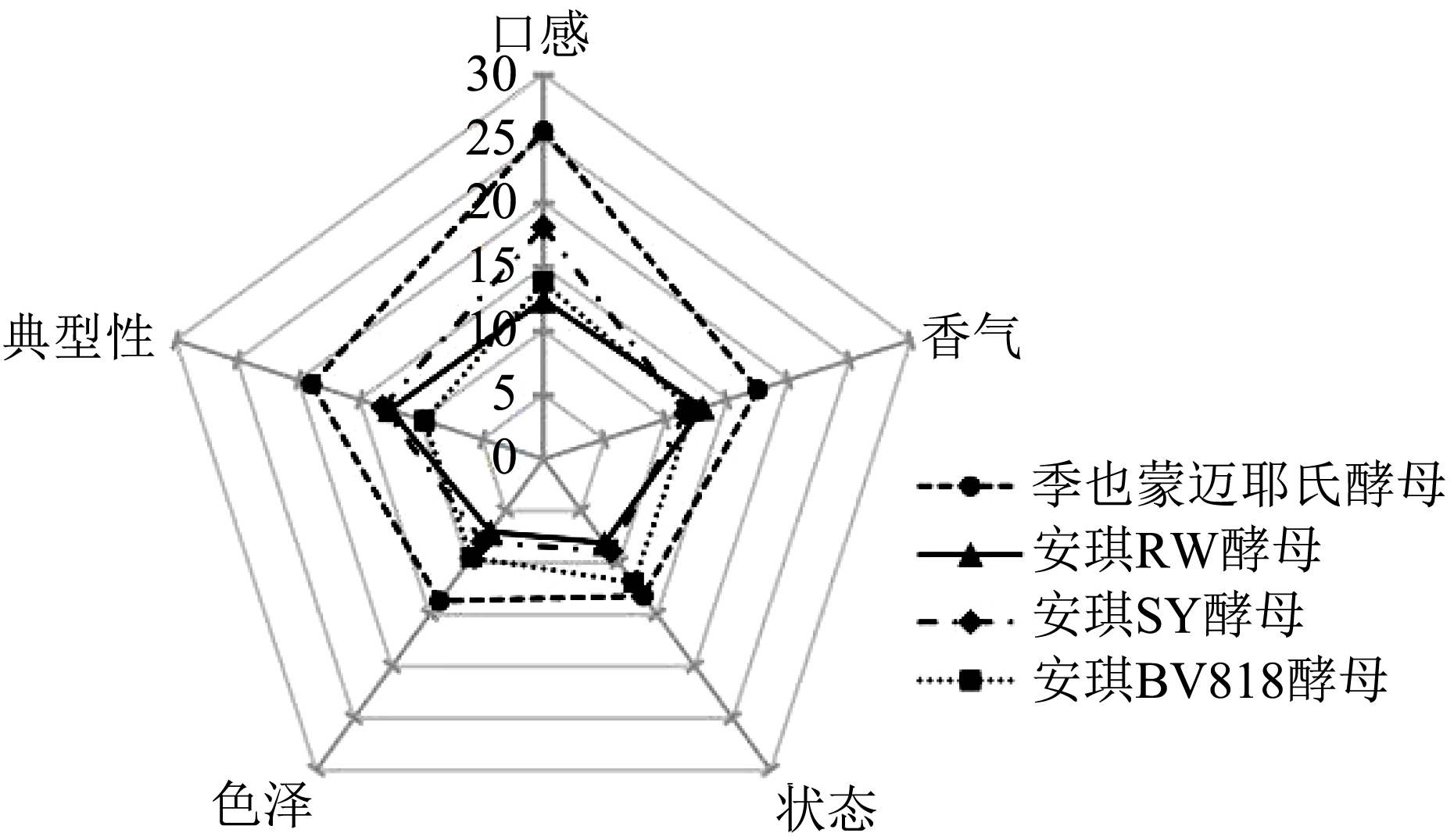
图12 4 种蓝靛果果酒的感官评价雷达图
Fig.12 Sensory evaluation radar chart of four L.edulis wines
3 结论
近年来,蓝靛果作为高酸浆果,其产品加工与功能性已有大量研究,但高酸度作为其果酒加工中的难点,严重影响产品品质,如何有效降低果酒酸度是蓝靛果果酒加工亟待解决的关键问题。本研究通过多种指标方法,综合筛选出适宜发酵蓝靛果果酒的酵母菌。通过耐酸性能与降酸性能分离出17株优势酵母,对其进行了发酵能力与耐受性的评价,并利用主成分分析进行综合评估。最后通过比较4种蓝靛果果酒的理化指标与感官特性,证明筛选得到的季也蒙迈耶氏酵母可显著降低蓝靛果果酒中总酸含量,有效平衡蓝靛果果酒酸感,对感官特性产生积极影响。综上所述,非酿酒酵母菌季也蒙迈耶氏酵母具有优良的降酸、降酸性能与较高耐受性,并且低产硫化氢、高产酯类化合物与β-葡萄糖苷酶,对于提高蓝靛果果酒品质,丰富果酒香气成分具有巨大潜力。本研究并未探明该菌株降酸路径,后续需深入探究其降酸途径与机理,为生物降酸提供一定参考。
[1]SIP S, SIP A, SZULC P, et al.Haskap berry leaves(Lonicera caerulea L.)-the favorable potential of medical use [J].Nutrients, 2022, 14(19): 3898.
[2]韩春然,毕海鑫,王鑫.发酵蓝靛果果汁酵母菌的筛选及香气成分分析 [J].食品研究与开发,2022,43(7):199-206.
[3]关莹,霍俊伟,丁健.蓝靛果忍冬酿酒工艺及稳定性研究 [J].食品工业科技,2014,35(2):206-209.
[4]JURIKOVA T, ROP O, MLCEK J, et al.Phenolic profile of edible honeysuckle berries (Genus Lonicera) and their biological effects [J].Molecules, 2011, 17(1): 61-79.
[5]TANNER G A, VIJAYALAKSHMI K, TANNER J A.Effects of potassium citrate/citric acid intake in a mouse model of polycystic kidney disease [J].Nephron, 2000,84(3): 270-273.
[6]曹颖,耿瑶,韩乃瑄,等.果酒中的有机酸及降酸策略研究 [J].食品工业科技,2023,44(14):457-464.
[7]ZHONG W, CHEN T, YANG H, et al.Isolation and selection of Non-Saccharomyces yeasts being capable of degrading citric acid and evaluation its effect on kiwifruit wine fermentation [J].Fermentation, 2020, 6(1): 25.
[8]JIANG Y, LUO T, TANG Y, et al.Isolation of a novel characterized Issatchenkia terricola from red raspberry fruits on the degradation of citric acid and enrichment of flavonoid and volatile profiles in fermented red raspberry juice [J].Food Science and Human Wellness, 2022, 11(4):1018-1027.
[9]PEINADO R A, MORENO J J, MAESTRE O, et al.Gluconic acid consumption in wines by Schizosaccharomyces pombe and its effect on the concentrations of major volatile compounds and polyols [J].Journal of Agricultural and Food Chemistry, 2004, 52(3): 493-497.
[10]DEL MÓNACO S M, BARDA N B, RUBIO N C, et al.Selection and characterization of a Patagonian Pichia kudriavzevii for wine deacidification [J].Journal of Applied Microbiology, 2014, 117(2): 451-464.
[11]张二豪,何萍,刘盼盼,等.西藏沙棘酵母菌的分离鉴定及其产香特性分析 [J].食品科学,2022,43(20):207-215.
[12]SON S H, JEON H L, YANG S J, et al.Probiotic lactic acid bacteria isolated from traditional Korean fermented foods based on β-glucosidase activity [J].Food Science and Biotechnology, 2018, 27(1): 123-129.
[13]卢思言,曾祥玉,王鑫源,等.蓝靛果中可降解有机酸的酵母菌株筛选及鉴定 [J].食品工业科技,2021,42(20):126-133.
[14]XU C, XIA H, ZHANG S, et al.Isolation, screening,identification and tolerance of yeast in cherry wine lees [J].International Journal of Food Engineering, 2020, 16(9):20190385.
[15]ŠURANSKÁ H, VRÁNOVÁ D, OMELKOVÁ J.Isolation,identification and characterization of regional indigenous Saccharomyces cerevisiae strains [J].Brazilian Journal of Microbiology, 2016, 47(1): 181-190.
[16]WANG X, WANG Z, FENG T.Screening of yeast in various vineyard soil and study on its flavor compounds from brewing grape wine [J].Molecules, 2022, 27(2): 512.
[17]CASTILLO-SÁNCHEZ J X, GARCÍA-FALCÓN M S, GARRIDO J, et al.Phenolic compounds and colour stability of Vinhão wines: Influence of wine-making protocol and fining agents [J].Food Chemistry, 2008,106(1): 18-26.
[18]LUO T, CHEN S, ZHANG H, et al.Phytochemical composition and potential biological activities assessment of raspberry leaf extracts from nine different raspberry species and raspberry leaf tea [J].Journal of Berry Research, 2020, 10(2): 295-309.
[19]CHEN W, XIE C, HE Q, et al.Improvement in color expression and antioxidant activity of strawberry juice fermented with lactic acid bacteria: A phenolic-based research [J].Food Chemistry: X, 2023, 17: 100535.
[20]刘乾坤.浸渍酶及多糖对蓝莓酒缩合单宁特性和感官品质的影响 [D].武汉:华中农业大学,2022.
[21]TIAN T, WU D, NG C T, et al.A multiple-step strategy for screening Saccharomyces cerevisiae strains with improved acid tolerance and aroma profiles [J].Applied Microbiology and Biotechnology, 2020, 104(7): 3097-3107.
[22]ARRIZON J, FIORE C, ACOSTA G, et al.Fermentation behaviour and volatile compound production by agave and grape must yeasts in high sugar Agave tequilana and grape must fermentations [J].Antonie van Leeuwenhoek, 2006,89(1): 181-189.
[23]YIN L, WANG C, ZHU X, et al.A multi-step screening approach of suitable non-Saccharomyces yeast for the fermentation of hawthorn wine [J].LWT, 2020, 127:109432.
[24]WANG C, LIU M, LI Y, et al.Hydrogen sulfide synthesis in native Saccharomyces cerevisiae strains during alcoholic fermentations [J].Food Microbiology, 2018, 70: 206-213.
[25]LIN M M-H, BOSS P K, WALKER M E, et al.Evaluation of indigenous non-Saccharomyces yeasts isolated from a South Australian vineyard for their potential as wine starter cultures [J].International Journal of Food Microbiology,2020, 312: 108373.
[26]CAI W, LI B, CHEN Y, et al.Increase the content of ester compounds in blueberry wine fermentation with the esterproducing yeast: Candida glabrata, Pichia anomala, and Wickerhamomyces anomalus [J].Foods, 2022, 11(22):3655.
[27]CHEN L, LI K, CHEN H, et al.Reviewing the source,physiological characteristics, and aroma production mechanisms of aroma-producing yeasts [J].Foods, 2023,12(18): 3501.
[28]QU C, PENG L, FEI Y, et al.Screening ester-producing yeasts to fortify the brewing of rice-flavor Baijiu for enhanced aromas [J].Bioengineered, 2023, 14(1): 2255423.
[29]王飞,王晓宇,赵擎豪,等.果酒增香酿造技术研究进展 [J].食品科学,2023,44(13):244-252.
[30]ORLIC S, VOJVODA T, BABIC K H, et al.Diversity and oenological characterization of indigenous Saccharomyces cerevisiae associated with Žilavka grapes [J].World Journal of Microbiology and Biotechnology, 2010, 26(8): 1483-1489.
[31]LIU X, LI Y, YU Z, et al.Screening and characterisation of β-glucosidase production strains from Rosa roxburghii Tratt [J].International Journal of Food Engineering, 2021,17(1): 1-9.
[32]王辉,袁婷玉,白卫东,等.青梅自然发酵液中酵母菌的分离鉴定及特性研究 [J].食品科技,2021,46(8):16-21.
[33]徐易洁,张红玉,解修超,等.甘蔗内生酵母菌的分离鉴定及发酵性能 [J].食品研究与开发,2023,44(1):159-166.
[34]包洪涛,梁敏,赵云财,等.蓝靛果营养价值及其果酒关键工艺研究进展 [J].酿酒,2020,47(2):25-30.
[35]张杰,赵洋溢,林静,等.蓝莓果酒主发酵工艺参数优化及其品质分析 [J].江西农业大学学报,2022,44(3):690-705.
[36]GAO P, PENG S, SAM F E, et al.Indigenous non-Saccharomycesyeasts with β-glucosidase activity in sequential fermentation with Saccharomyces cerevisiae: A strategy to improve the volatile composition and sensory characteristics of wines [J].Frontiers in Microbiology,2022, 13: 845837.
[37]刘小雨,李科,张惟广.纯种发酵和混菌发酵对野木瓜果酒品质的影响 [J].食品与发酵工业,2018,44(10):134-140.
[38]藏伟,刘叶,刘宇,等.本土季也蒙毕赤酵母在干红葡萄酒中试生产中的应用潜力 [J].食品科学,2023,44(18):117-125.
[39]王英,周剑忠,胡彦新,等.低活性β-葡糖苷酶酵母菌株的筛选及其在黑莓果酒发酵中的应用 [J].中国酿造,2016,35(7):102-107.