酒精性肝病(Alcoholic Liver Disease, ALD)是由于过量酗酒,酒精在肝脏中代谢不畅而引起的一种肝脏疾病;近年来,我国酗酒人数逐年上升且逐渐年轻化 [1] 。据相关文献报道美国每年死亡人数中有将近50%的人死于肝硬化 [2] ,而中国有超过20%的人口受到不同形式的肝病威胁,其中包括ALD [3] 。截止到2020 年,亚洲地区ALD 的发生率为4.81%,且男性为7.80%,高于女性的0.88%,结果显示,ALD 在肝硬化病例中的占比为12.57%,以ALD 为病因导致的肝细胞癌病例占比为8.30%,且地域不同,酒精病因导致的肝硬化和肝细胞癌的比例也存在显著差异 [4] 。减少酒精入血的浓度,加快酒精在体内的代谢,缓解醉酒的症状和通过摄入功能性制品减轻酒精对肝脏及心血管等脏器的伤害是当前主要的解酒机制 [5] 。因此,寻找具有良好的保肝活性且副作用较小的天然产物,并将其开发成具有解酒保肝功效的功能性产品对ALD 的预防和改善具有十分深刻的意义。
车前草为车前科植物车前(Plantago asiatica L.)或平车前(Plantago depressa Willd.)的干燥全草,为世界范围内应用最广泛的药食两用植物之一 [6] ,具有利尿通淋、凉血解毒、祛痰的功效,常用于治疗水肿尿少、暑湿泻痢、痰热咳嗽、吐血衄血、痈肿疮毒等症 [7,8] 。研究发现,车前草中的主要活性成分为黄酮类、苯乙酰咖啡酰糖酯类成分 [9] ,大车前苷、车前草苷D、木犀草苷属于上述两类成分的范畴 [10] ,且常以车前草中大车前苷、木犀草苷和车前草苷D 的含量来评价车前草的品质。此外,有相关文献报道车前草的提取物对肝脏具有一定的保护作用,如杨亚军等 [11] 的研究发现车前草提取物总三萜能显著降低肝损伤小鼠谷丙转氨酶(Alanine Aminotransferase, ALT)和谷草转氨酶(Aspartate Aminotransferase, AST)水平和肝组织中丙二醛(Malondialdehyde, MDA)的含量,并提高肝脏超氧化物歧化酶(Superoxide Dismutase, SOD)活性,对CC14 所致小鼠急性肝损伤具有明显的保护作用;俞亚静等 [12] 的研究表明车前草水提取物能显著降低CCl4、D-氨基半乳糖胺所致的小鼠血清AST和ALT 升高,对实验性肝损伤有明显保护作用;Abouzied 等 [13] 研究发现洋车前子乙醇提取物处理大鼠可显著减轻CCl4 的毒性作用,且肝组织病理学检查反映了洋车前子提取物对肝脏结构的保护作用。但当前现有的研究中尚缺乏车前草提取物(Plantain Extract, PE)对急性酒精性肝损伤保护作用方面的研究。
基于此,本研究实验将车前草作为原料,提取制备PE,并通过探究其对酒精诱导的急性肝损伤小鼠是否具有保护作用,以期为PE 开发成具有解酒保肝功效的功能性产品用于预防与改善急性酒精性肝损伤提供理论和实验基础。
1 材料与方法
1.1 主要材料与试剂
车前草,贵阳中药材市场;甘油三酯(Triglycerides,TG)、丙二醛(Malondialdehyde, MDA)、谷丙转氨酶(Alanine Aminotransferase, ALT)、过氧化氢酶(Catalase,CAT)、总谷胱甘肽(Total Glutathione,T-GSH)、谷草转氨酶(Aspartate Aminotransferase,AST)、超氧化物歧化酶(Superoxide Dismutase,SOD)试剂盒、总蛋白定量试剂盒,南京建成生物工程有限公司;75%(V/V)食用酒精(批号:20230103),河南汉永酒精有限公司;大车前苷(批号:AFBG1342)、木犀草苷(批号:AFBI0506)、车前草甘D(批号:AFCI0404),纯度均≥98%,成都埃法生物科技有限公司;水飞蓟宾胶囊(国药准字H20040299),天津天士力圣特制药有限公司;乙腈和甲醇为色谱纯,其余均为分析纯。
1.2 主要仪器与设备
Agilent1260 高效液相色谱仪,美国安捷伦科技公司;1500A 多功能粉碎机,永康市红太阳机电有限公司;UV-1800 紫外可见分光光度计,岛津仪器(苏州)有限公司;SCI-VS 可调式混匀仪,济南博航生物技术有限公司;HC313 型电子天平,上海花潮实业有限公司;5427R 高速冷离心机,德国Eppendor 公司;VICTOR Nivo 酶标仪,珀金埃尔默企业管理有限公司;RM2016 病理切片机,上海徕卡仪器有限公司。
1.3 试验方法
1.3.1 PE的制备
车前草干燥粉碎,过筛,以去离子水作为提取溶剂,料液比1:4(g:mL)回流提取2 次,每次1 h,合并两次滤液,将滤液减压浓缩、干燥得到PE。并对PE 中的活性成分总糖 [14] 、总酚 [15] 、总黄酮 [16] 进行测定,测得其含量占比分别为20.14%、7.27%、3.21%。
1.3.2 HPLC色谱条件
参考《中华人民共和国药典2020 版(一部)》和纪玉华等 [17] 的方法,稍加修改,色谱柱:Luna C18(2)液相色谱柱(5 μm, 250 mm×4.6 mm);流动相:乙腈(a)-0.1%甲酸溶液(b),梯度洗脱条件(0~30 min,60%~70% a;30~40 min,70%~80%a;40~50 min,80%~100% a);流量:0.3 mL/min;进样量:10 μL;检测波长:330 nm;柱温:30 ℃。
1.3.3 实验动物分组与给药
动物实验条件获得贵州医科大学动物实验伦理的认可,且符合所制定的伦理学要求,动物实验合格证编号:SYXK(贵)2023-0002,动物伦理许可文件编号:2303331。60 只SPF 级雄性昆明小鼠,质量为(20±2)g,均由重庆腾鑫生物技术有限公司提供,许可证号:SCXK(京)2019-0010,质量合格证号:110324230103244357,动物饲养的条件,温度:(22±2)℃;相对湿度:55%±5%;每天光照12 h;自由进食和饮水。实验小鼠适应性喂养7 d后,随机分为空白(NC)组、模型(MC)组、阳性(PC)组、PE 低、中、高剂量(L、M、H)组,每组10 只。
正常组与模型组每天按照10 mL/kg 灌胃去离子水;阳性组每天按照54 mg/kg 灌胃水飞蓟宾胶囊;PE 给药组以《中华人民共和国药典2020 版(一部)》车前草的人体(体质量以70 kg 计)推荐摄入量(9~30 g/d),取中值(20 g/d)的5、10、30 倍为依据,计算出每组小鼠的给药剂量。所以PE 低、中、高剂量组给药剂量分别为14.29、28.58、85.74 mg/10 g。连续灌胃21 d,从第19 天开始,每天灌胃结束,3 h 后,除正常组外,其余按12 mL/(kg·BW)灌胃52%的食用酒精,连续3 d,参考Song 等 [18] 和Li 等 [19] 的造模方法并进行改良,建立小鼠急性酒精性肝损伤模型。
1.3.4 小鼠血清及肝组织标本制备
末次灌胃体积分数为52%的食用酒精后,禁食不禁水12 h。摘眼球取血,室温静置2 h,于4 ℃,3 500 r/min 离心10 min,取上层血清进行分装,置于-80 ℃冰箱中保存备用。取血完成后将小鼠颈椎脱臼法处死,取肝组织,用提前预冷的生理盐水漂洗掉肝脏表面的血渍,用滤纸拭干,称重。每只小鼠取相同部位的肝组织置于4 wt.%多聚甲醛固定,用于病理检测;剩余肝组织分装成试剂盒测定所需质量,于-80 ℃冰箱中保存备用。
1.3.5 小鼠肝脏指数计算
参照文献 [20] ,用颈椎脱臼法处死小鼠后,解剖小鼠完整取出肝脏,放入提前预冷的生理盐水中,重复3 次将肝脏上的血渍漂洗干净,用干净的滤纸拭干表面的生理盐水,称量肝脏质量。按如下公式计算小鼠肝脏指数:
式中:
W——肝脏指数,%;
m——小鼠肝脏质量,g;
M——小鼠体质量,g。
1.3.6 小鼠生化指标测定
从-80 ℃冰箱中取出分装好的血清和肝脏组织,按试剂盒要求测定血清中的AST,ALT、TG 指标和肝组织中的T-GSH、CAT、SOD、MDA 水平。
1.3.7 小鼠肝组织病理学观察
参照文献[21] ,稍加修改,将肝组织固定24 h,经洗涤脱水、包埋、切片、苏木素-伊红(Hematoxylineosin, HE)染色后,光镜观察并拍照记录。
1.4 数据分析及处理
采用SPSS 26.0 分析数据并用GraphPad Prism 6.01 软件作图,数据结果均以“mean±SD”表示。采用单因素方差分析评估两组间的均数差异,P<0.05表示差异显著,P<0.01 表示差异极显著。
2 结果与讨论
2.1 HPLC法定量分析PE中的化学成分
运用HPLC 法,以大车前苷、木犀草苷、车前草甘D 为标准对照品,从PE 中定性分析检测到大车前苷、木犀草苷和车前草苷D 等3 种主要活性成分(如图1),并对这三种成分进行定量分析,含量分别为:大车前苷6.1 mg/g,木犀草苷1.25 mg/g,车前草苷D 1.1 mg/g,上述成分可用以评价车前草的品质。

图1 混合标准品(a)和PE 样品(b)
Fig.1 Mixed standards references (a) and PE samples (b)
注:1:大车前苷、2:车前草甘D、3:木犀草苷。
2.2 PE对小鼠肝脏指数的影响
酒精在肝脏中代谢不畅时会对肝脏造成损伤,使肝细胞呈现肿大的情况,且脂肪会在肝脏中堆积,出现代谢紊乱现象,造成肝脏整体质量和体积的增加,而肝脏肿大是ALD 临床上常见的症状 [22] ,常以肝脏指数作为反映肝脏肿大程度的指标 [23] 。由图2 能够看出,与空白组相比模型组肝脏指数显著提高21.19%,提示酒精代谢不畅对小鼠肝细胞造成损伤,诱导小鼠肝脏肿大;与模型组相比,给药组和阳性组肝脏指数显著下降13.68%、17.26%、20.18%、18.39%,且量效关系趋于正比,说明PE可以缓解小鼠肝脏受损肿大情况。
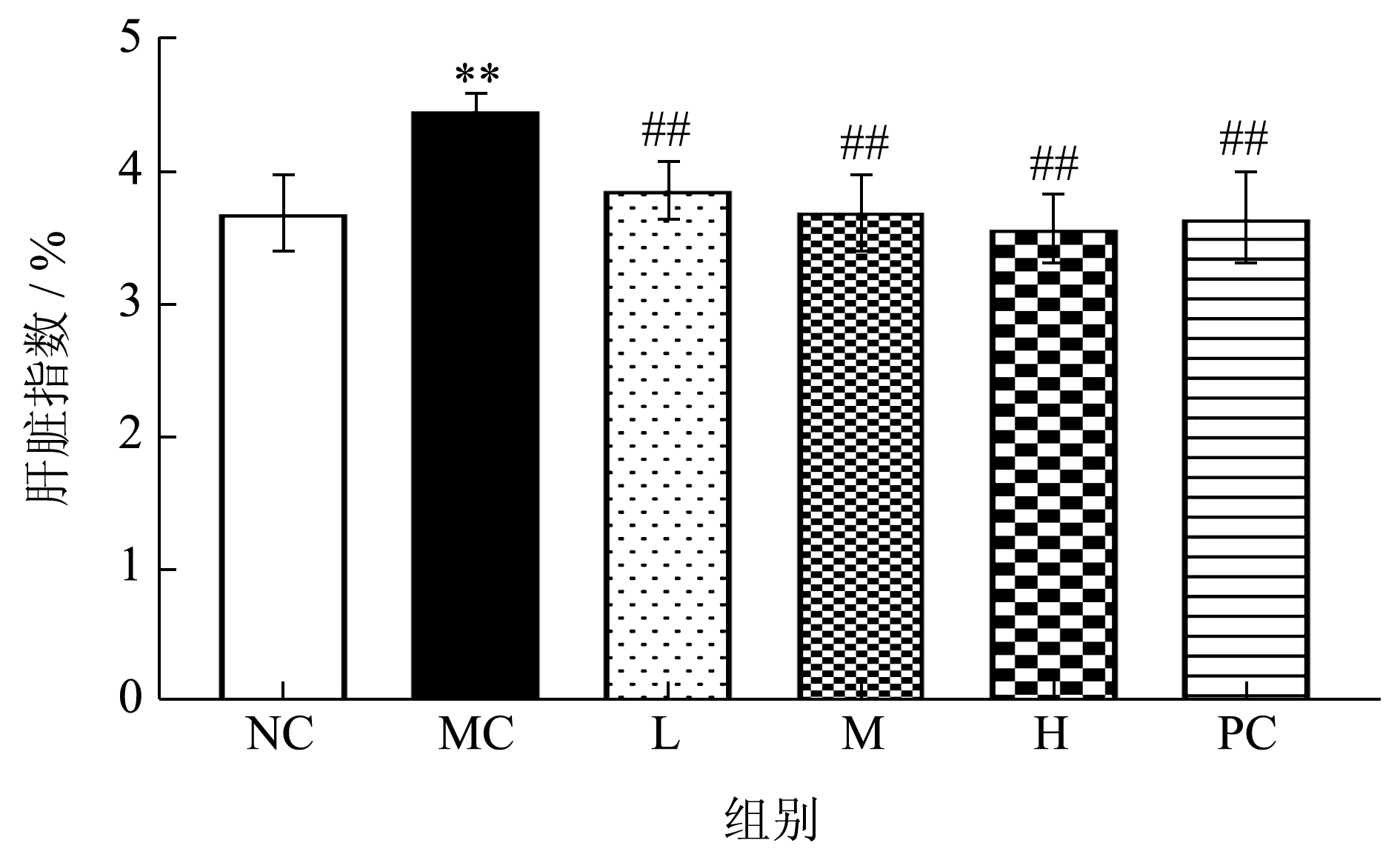
图2 PE 对酒精性肝损伤小鼠肝脏指数的影响
Fig.2 Effect of PE on liver index in mice
注:与NC 组相比,**表示P<0.01;与MC 组相比,#表示P<0.05;##表示P<0.01;NC 为空白组,MC 为模型组,L 为PE 低剂量组,M 为PE 中剂量组,H 为PE 高剂量组,PC 为阳性组,下同。
2.3 PE对小鼠血清中TG、ALT、AST水平的影响
ALD 造成血清TG 水平异常的原因主要是由于机体摄入的酒精不能被及时代谢或清除使脂质代谢紊乱,诱导脂肪变性,导致血脂转运受阻进而沉积在肝细胞中 [24] 。AST、ALT 是临床上用于评估肝功能的特征性指标 [25] ,酒精大量摄入体内后若不及时代谢,将会破坏肝细胞,使大量AST 和ALT 被释放入血,导致血清中AST 和ALT 水平显著提高 [26] 。从杨梦等 [27] 的研究可知:灌喂酒精后,模型组小鼠血清ALT、AST 水平和TG 含量较空白组均显著提高(P<0.05)。如图3,模型组的TG、AST、ALT水平显著提高79.09%、62.56%、42.29%,且显著高于空白组,提示酒精暴露可造成TG 的转运受阻,脂质代谢发生紊乱,肝细胞受损,致使血清中的ALT、AST、TG 水平升高,这与前人的研究结果基本一致;与模型组相比,阳性组的TG、AST、ALT 水平显著下降43.15%、38.22%、30%,而PE给药组的TG 显著降低24.87%、36.55%、45.69%;AST 显 著 降 低30.62%、36.03%;ALT 显 著 降 低24.36%、27.29%,呈剂量依赖性,且高剂量组的作用效果最好,说明PE 能够较好的保护肝脏受损、降低血清转氨酶和脂质在肝脏中的沉积。
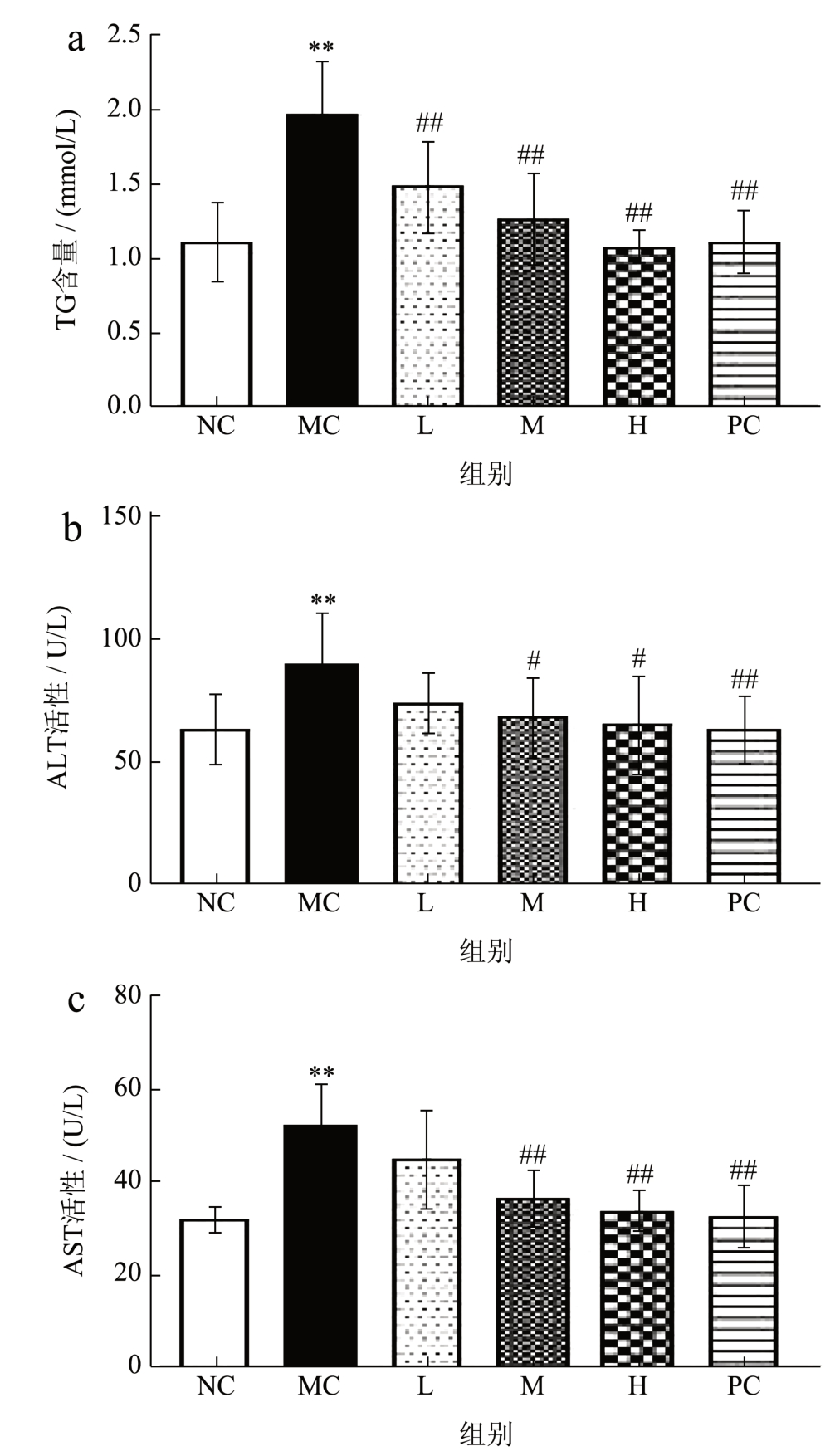
图3 PE 对小鼠血清中TG、ALT、AST 水平的影响
Fig.3 Effect of PE on the serum levels of TG, ALT and AST in mice
2.4 PE对小鼠肝组织中T-GSH、MDA、SOD、CAT水平的影响
酒精口服进入体内主要在肝脏中进行代谢,当短期内摄入过多的酒精时,其在体内代谢不充分会产生大量有害的活性氧(Reactive Oxygen Species,ROS),进而破坏机体的抗氧化防御系统,从而导致氧化应激,产生有害自由基 [28] 。CAT、GSH 和T-SOD 是机体主要的抗氧化酶,能够维持机体的氧化还原平衡,将机体有害的自由基清除 [29] 。MDA是机体中重要的脂质过氧化产物之一 [30] ,可以反映机体的脂质过氧化水平,肝细胞膜的过氧化程度和肝细胞的受损程度可以通过检测MAD 的含量间接评估 [31,32] 。如图4 可知,与空白组相比,模型组的SOD、CAT 活性和T-GSH 含量显著降低24.33%、21.64%、36.37%,MDA 含量显著升高84.85%,提示酒精的暴露使小鼠肝脏发生氧化应激,肝细胞受损,进一步证明了模型建立成功;与模型组相比,阳性组和各给药剂量组对肝组织中的生化指标都有不同程度的改善,其中使SOD 的活性显著升高14.54%、18.42%,CAT 活性显著升高4.53%、10.38%、16.36%,T-GSH 含量显著升高14.10%、19.65%、28.66%,MDA 含量显著降低25.41%、33.61%、36.89%且随着PE 剂量的增加肝组织中相应的生化指标也发生改变,呈现一定的量效关系。值得注意的是,本研究采用HPLC 法从PE 中定性检测了大车前苷、车前草甘D、木犀草苷等三种主要活性成分并对三种活性成分进行了含量测定,其中大车前苷的含量最高,且前期实验结果表明大车前苷具有较强的的抗氧化能力,可能改善酒精对肝脏产生的氧化应激反应,在保护酒精性肝损伤方面发挥主导作用。
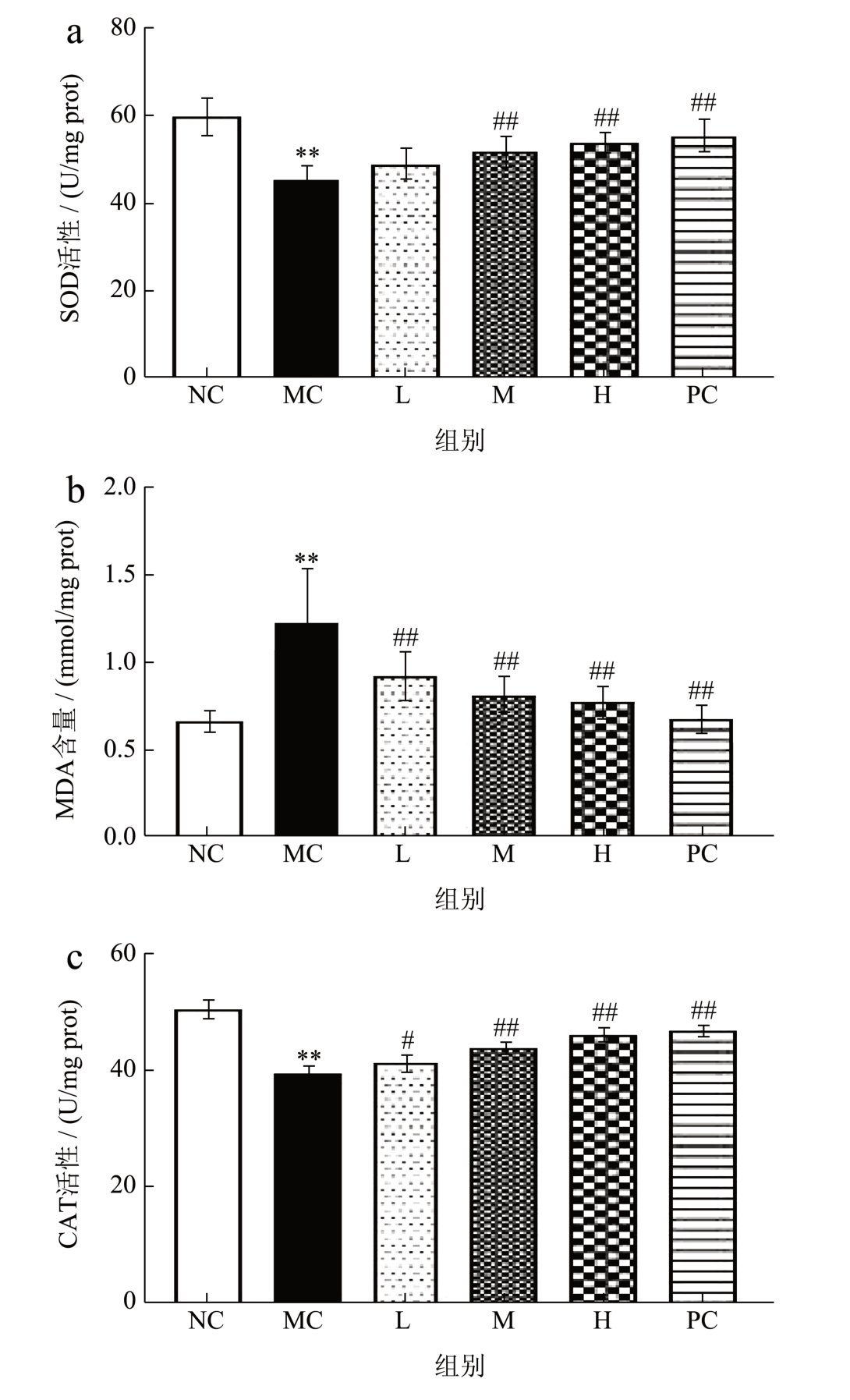
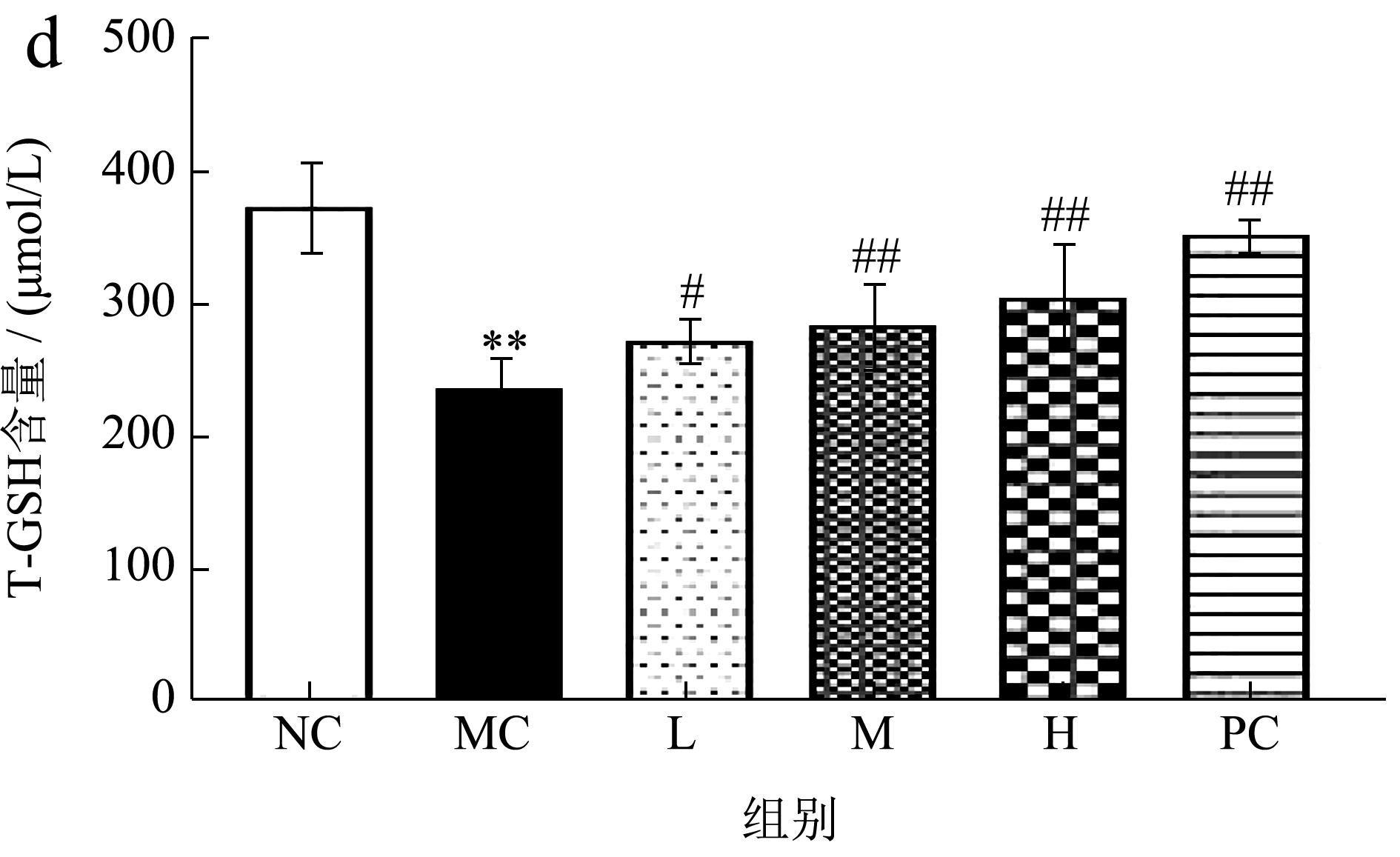
图4 PE 对小鼠肝组织中SOD、MDA、CAT、T-GSH水平的影响
Fig.4 Effect of PE on the levels of SOD, MDA,CAT and T-GSH in mouse liver tissue
2.5 PE对小鼠肝组织病理变化的影响
肝脏组织病理学是判断肝脏受损程度的金标准,在各类肝损伤模型中被广泛运用 [33] 。肝组织HE 染色病理切片可以直接观察肝组织受损情况,是评估肝脏受损的有力证据。如图5 各组小鼠肝组织病理切片,可以清晰的看到空白组小鼠的肝细胞排列较为整齐,细胞核呈圆形,核质分布均匀,核仁清晰,细胞索排列有序,未见明显异常且无水肿及炎性细胞浸润现象;而模型组小鼠肝细胞发生肿胀,细胞间的间隙变大,细胞核发生固缩,肝索排列较为紊乱,并且伴有炎性细胞浸润和肝细胞纤维化,肝组织中有大小不一的脂肪滴和空泡现象。
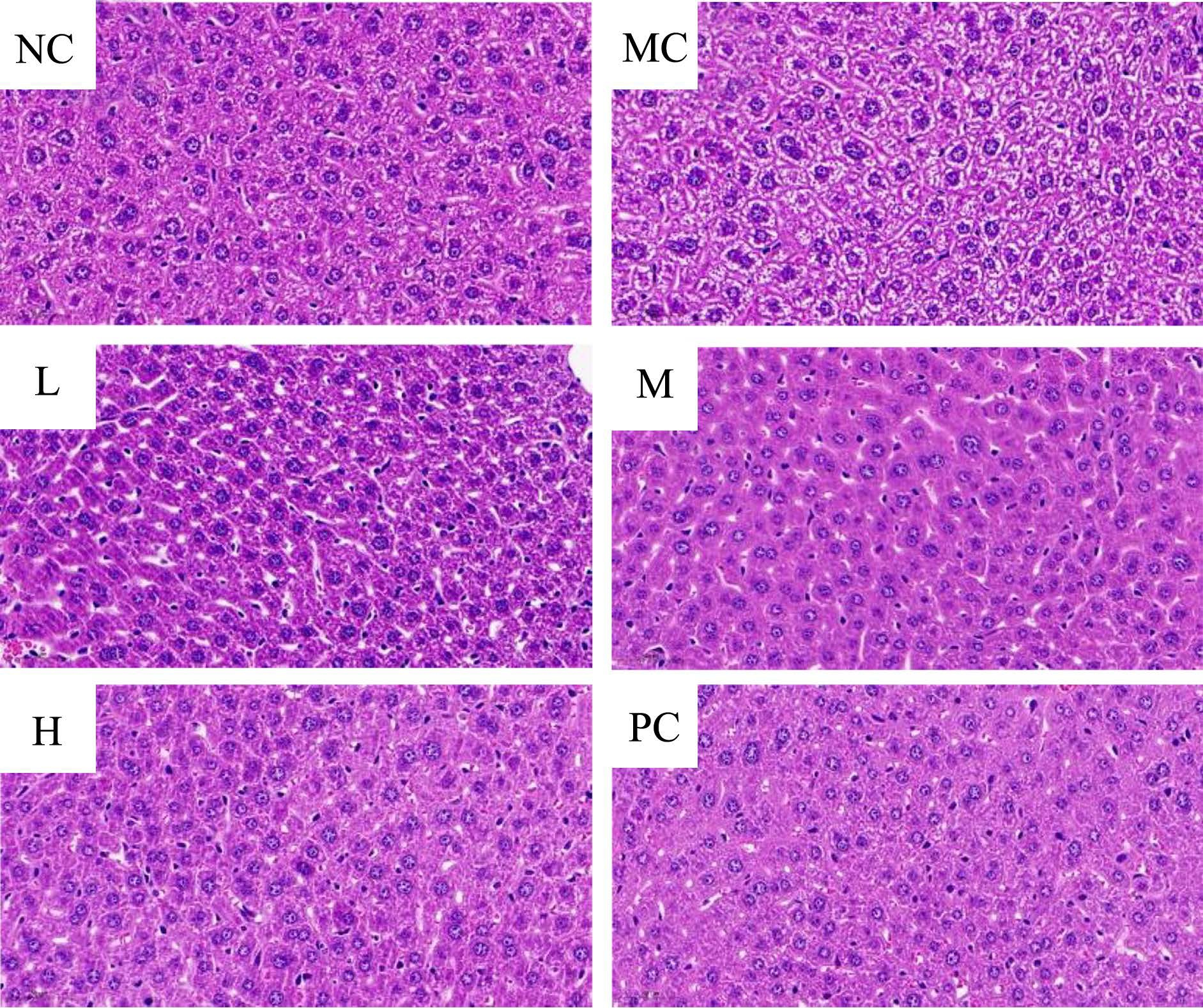
图5 PE 对小鼠肝组织病理变化的影响(10×30)
Fig.5 Effect of PE on histopathological changes in mouse liver (10×30)
注:NC:空白组;MC:模型组;L:低剂量组;M:中剂量组;H:高剂量组;PC:阳性组。
而PE 各剂量组及阳性组细胞排列比较整齐,肝细胞肿胀、变性坏死和细胞炎性浸润等情况均有不同程度的减轻,肝细胞的病理损伤均有所改善,且PE 高剂量组肝组织受损情况最小。表明PE 可缓解急性酒精对肝脏的损伤作用。
3 结论
本研究采用灌胃体积分数为52%的食用酒精诱导建立急性酒精性肝损伤模型,通过灌胃PE 进行预防性干预,并从脏器指数、血清、肝脏等生理生化指标以及组织病理切片等方面探究PE 对肝脏的保护作用,结果显示通过提前灌胃给予PE 能够使血清中ALT、AST 和TG 水平显著降低27.29%、36.03%、45.69%,使肝组织中CAT 和SOD 活性、T-GSH 含量均显著增加16.36%、18.42%、28.66%及MDA 含量显著降低36.89%,且从肝组织病理切片结果可以看出给予PE 后各组小鼠肝损伤程度均有显著改善。因此,PE 能够通过抑制血清中ALT、AST 活性和TG 的含量,改善肝功能和脂代谢;降低小鼠的肝脏指数和肝组织中MDA 含量,有效地减少脂肪在肝脏中的沉积;提高小鼠体内SOD、CAT 活性和T-GSH 含量,降低脂质过氧化程度和氧化应激反应,恢复机体的氧化与抗氧化系统的平衡,从而发挥对酒精所致急性肝损伤的保护作用。本研究为开发具有护肝醒酒作用的功能性产品奠定理论和实验基础,同时为深化车前草应用于保护肝脏方面的研究与应用扩宽了途径。但其作用机理尚未进行深入探索,因此,未来可在后续研究中增加机制探索方面的研究实验,例如炎症反应因子、免疫荧光、WB 实验(蛋白质印迹法,Western Blot)及相关通路的检测,深入阐述PE 预防和改善急性酒精性肝损伤的作用机制。
[1]WANG W J, XIAO P, XU H Q, et al.Growing burden of alcoholic liver disease in China: a review [J].World Journal of Gastroenterology, 2019, 25(12): 1445-1447.
[2]SINGAL A K, BATALLER R, AHN J, et al.ACG clinical guideline: alcoholic liver disease [J].Am J Gastroenterol,2018, 113(2): 175-194.
[3]XIAO J, WANG F, WONG N K, et al.Global liver disease burdens and research trends: Analysis from a Chinese perspective [J].Journal of Hepatology, 2019, 71(1): 212-221.
[4]曾赏,李三强,李前辉.酒精性肝病的研究进展 [J].世界华人消化杂志,2022,30(12):535-540.
[5]张鸿志,李璐,刘永明,等.解酒制品研究进展 [J].酿酒科技,2021,9:65-73.
[6]万美钰,李胜男,许亮,等.中药车前的本草考证 [J].中药材,2020,43(2):496-500.
[7]杨洋,封传华,李刚,等.车前草中总苯乙醇苷提取工艺研究 [J].中国现代中药,2018,20(1):93-97.
[8]李季平,郭婕.野生车前草总黄酮提取工艺 [J].周口师范学院学报,2018,35(2):92-94.
[9]杨亚军,周秋贵,曾红,等.车前草化学成分及新生物活性研究进展 [J].中成药,2011,33(10):1771-1776.
[10]张雪芹,曲玮,梁敬钰.车前草化学成分和药理作用研究进展 [J].海峡药学,2013,25(11):1-8.
[11]杨亚军,李庆耀,梁生林,等.车前草总三萜对四氯化碳致小鼠肝损伤的保护作用 [J].中成药,2012,34(1):140-142.
[12]俞亚静,方晶.车前草水提取物对肝脏保护作用的实验研究 [J].中国实用医药,2008,16:71-72.
[13]ABOUZIED M M, MAHMOUD S M, WAHID A, et al.A study of the hepatoprotective effect of Plantago psyllium L seed extract against Carbon tetrachloride induced hepatic injury in rats [J].Journal of Applied Biomedicine, 2020,18(2-3): 80-86.
[14]张倩茹,凌蕾,何芋岐,等.苯酚硫酸法测定苗药艾纳香中多糖含量 [J].中国民族民间医药,2019,28(14):30-32.
[15]ZITOUNI H, FAUCONNIER M L, HSSAINI L, et al.Phenols, volatile compounds, organic acids and antioxidant activity of strawberry tree (Arbutus unedo L.) fruits belonging to five genotypes growing in morocco [J].International Journal of Fruit Science, 2022, 22(1): 414-437
[16]张可青,成瑞,王建华,等.蒙药麻花头中总黄酮的超声提取及含量测定 [J].实用药物与临床,2021,24(12):1103-1106.
[17]纪玉华,魏梅,李国卫,等.不同部位车前草HPLC特征图谱的建立及多指标成分含量测定 [J].中药材,2020,43(3):660-664.
[18]SONG X H, YIN S T, HUO Y Z, et al.Glycycoumarin ameliorates alcohol-induced hepatotoxicity via activation of Nrf2 and autophagy [J].Free Radical Biology and Medicine, 2015, 89: 135-146.
[19]LI X J, MU Y M, LI TT, et al.Gynuraprocumbens reverses acute and chronic ethanol-induced liver steatosis through MAPK/SREBP-1c-dependent and independent pathways [J].Journal of Agricultural and Food Chemistry,2015, 63(38): 8460-8471.
[20]文永岚,王瑜,万科,等.刺梨酵素化果醋对小鼠急性酒精性肝损伤的改善作用 [J].现代食品科技,2023,39(4):26-32.
[21]ZOU S P , WANG Y F , ZHOU Q, et al.Protective effect of Kinsenoside on acute alcohol-induced liver injury in mice [J].Revista Brasileira de Farmacognosia, 2019,29(5): 637-643.
[22]ZHOU C Y, LAI Y L, HUANG P, et al.Naringin attenuates alcoholic liver injury by reducing lipid accumulation and oxidative stress [J].Life Sciences, 2019, 216: 305-312.
[23]WU D F, CEDERBAUM A I.Oxidative stress and alcoholic liver disease [J].Seminars in Liver Disease,2009, 29(2): 141-154.
[24]TESCHKE R.Alcoholic liver disease: Alcohol metabolism,cascade of molecular mechanisms, cellular targets, and clinical aspects [J].Biomedicines, 2018, 6(4): 106.
[25]DASGUPTA A.Chapter 5-liver enzymes as alcohol biomarkers [J].Alcohol & Its Biomarkers, 2015, 18: 121-137.
[26]TORRUELLAS C, FRENCH S W, MEDICI V.Diagnosis of alcoholic liver disease [J].World Journal of Gastroenterology, 2014, 20(33): 11684-11699.
[27]杨梦,兰岚,韦静,等.草果、菱角壳水提混合物对小鼠急性酒精肝损伤的保护作用 [J].中国中医急症,2020,29(1):22-24.
[28]CICHOZ-LACHH, MICHALAK A.Oxidative stress as a crucial factor in liver diseases [J].World Journal of Gastroenterology, 2014, 20(25): 8082-8091.
[29]YANG X S, DONG C, REN G X.Effect of soyasaponinsrich extract from soybean on acute alcohol-induced hepatotoxicity in mice [J].Journal of Agricultural & Food Chemistry, 2011, 59(4): 1138.
[30]ZHAO M, DU Y Q, YUAN L, et al.Protective effect of puerarin on acute alcoholic liver injury [J].The American Journal of Chinese Medicine, 2010, 38(2): 241-249.
[31]LIANG H W, YANG T Y, TENG C S, et al.Mulberry leaves extract ameliorates alcohol-induced liver damages through reduction of acetaldehyde toxicity and inhibition of apoptosis caused by oxidative stress signals [J].International Journal of Medical Sciences, 2021, 18(1): 53.
[32]黄小莉,朱培欣,胡远亮,等.蛹虫草多糖对急性酒精性肝损伤改善作用的研究 [J].菌物学报,2017,36(2):242-250.
[33]李园园,郝海波,刘加洪,等.益生菌补充改善吡嗪酰胺致大鼠肝损伤及肠道菌群紊乱的效果 [J].食品科学,2018,39(13):159-165.