红枣(Zizyphus jujube Mill.)是鼠李科枣属植物,被誉为“百果之王”,具有补中益气、养血安神、润肤养颜、延年养生等功效 [1] ,多糖是其主要活性成分,研究发现其具有免疫调节、抗氧化、抗肿瘤等活性 [2] 。红枣多糖的提取一直受到广泛关注,目前红枣多糖的提取研究主要包括热水提取、超声辅助提取、微波辅助提取、酶辅助提取等,但是这些提取技术存在耗时长、温度要求高、能耗高、价格昂贵等缺点 [3] 。因此,建立新型、高效、节能的红枣多糖提取方式依旧是人们研究的重点。
植物细胞在超高压状态下短时间内会产生压力差,导致其细胞结构被破坏,细胞内容物释放、细胞通透性变差,溶剂渗透性增加 [4] ,此外,植物多糖(如大枣多糖)主要存在于细胞壁或细胞质中。超高压的机械效应不仅增加了溶剂渗透,而且通过破坏细胞结构促进了内容物的释放,因此,超高压逐渐被用于植物多糖的提取。Chen 等 [5] 选用超高压制备黄茶多糖,与水提黄茶多糖相比其多糖得率和半乳糖醛酸含量更高,分子量、颗粒大小和蛋白质含量显著降低,对酒精肝损伤和脂肪肝蓄积表现出更强的治疗作用。
低共熔溶剂(Deep Eutectic Solvent, DES)是一类由一定摩尔比的氢键供体和氢键受体组成的绿色溶剂,由于自身具有热稳定、熔点低、电导率高等独特性质 [6] ,其可以作为一种提取极性和非极性组分的有效介质 [7] ,基于相似相溶原理,相较于传统的水溶剂,多糖在极性接近的低共熔体系中具有更好的溶解性 [8] 。因此,DES 逐渐被用于植物多糖的提取。Wu 等 [9] 选用氯化胆碱-乙二醇组成的低共熔体系制备荷叶多糖,与水提荷叶多糖相比其多糖得率和糖醛酸含量更高,且具有更小的分子量,由此表现出更好的体外抗氧化、降血糖和免疫调节能力。
由于红枣多糖存在于细胞壁和细胞质,其提取过程包括使其从细胞中释放,并溶于提取溶剂中。目前虽然已有利用超高压辅助提取、DES 提取植物多糖的研究,但是尚未见到将两者耦合处理提取多糖的报道,本研究拟采用超高压处理使红枣多糖从细胞中释放,同时耦合DES 提取,使红枣多糖能更好的溶于提取溶剂,从而提高其得率。
因此,本研究拟通过单因素试验和响应面优化,建立超高压耦合DES 提取红枣多糖的最优工艺;并通过分析DPPH 自由基清除率、ABTS+自由基清除率、铁离子还原能力、氧自由基抗氧化能力等指标,评价制备的红枣多糖的抗氧化活性。本研究可为红枣多糖的高效提取及开发利用提供理论依据。
1 材料与方法
1.1 材料与仪器
红枣购于天平架市场,新鲜红枣用体积分数80%乙醇浸泡72 h,去除色素、单糖和寡糖。过滤后,将残渣进行风干,直到其重量保持恒定。烘干后的枣磨成粉末,过60 目筛用作预处理材料使用。
氯化胆碱,上海麦克林生化科技有限公司;1,1-二苯-2-苦基肼(DPPH)和2,2′-联氨-双(3-乙基苯并噻唑啉-6-磺酸)二胺盐(ABTS)纯度≥ 98%,上海源叶生物科技有限公司;本研究中其他化学品均采用分析纯。
GHRH-20 热泵干燥机,广东省农业机械研究所;BS124S 分析天平,北京赛多利斯科学仪器公司;SHPP-57DZM-600 超高压设备,山西三水河科技有限公司;TD6 离心机,长沙湘智离心机仪器有限公司;Eyela-1100 旋转蒸发器和Eyela 冷冻干燥机,日本东京。
1.2 实验方法
1.2.1 DES合成及筛选
DES 合成:将氢键受体与氢键供体按一定比例混合置于反应瓶中,随后在65 ℃下旋转蒸发60 min,直至得到均匀透明的液体,将所得到的DES 溶液置于干燥器中保存备用 [10] 。
DES 筛选:为了筛选最佳的提取溶剂,选用七种不同类型的DES 浸提红枣粉,DES 组成及比例如表1 所示。提取条件:称取1.0 g 红枣粉溶于30 mL DES 溶液中,搅拌均匀后于90 ℃下浸提2 h。离心(4 000 r/min,15 min)取上清液,在不超过50 ℃的温度下减压浓缩至10 mL,用苯酚-硫酸法 [11] 测定其糖含量,计算多糖得率。
表1 不同类型DESs及比例
Table 1 Different types of DESs and their proportions

?
式中:
Y——多糖得率,%;
C——苯酚-硫酸法测定的总糖质量浓度,mg/mL;
V——溶液体积,mL;
m——红枣粉的质量,mg。
1.2.2 超高压耦合DES提取红枣多糖工艺优化
称取1.0 g 预处理红枣粉溶于30 mL DES 水溶液中,搅拌均匀后放入无菌聚乙烯袋,将袋内空气排除后密封,放入超高压装置中。在一定的压力下反应一段时间后,压力迅速释放。离心取上清液,在不超过50 ℃的温度下减压浓缩至10 mL。
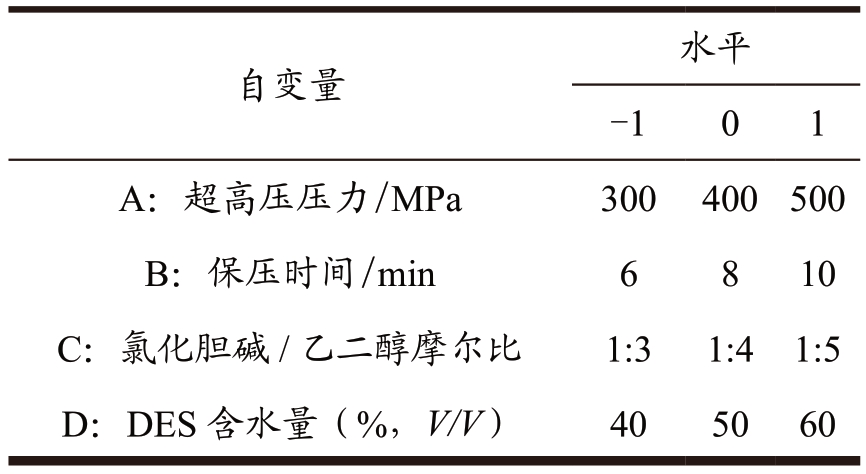
在超高压辅助DES 提取多糖的过程中,超高压压力、保压时间、DES 摩尔比和DES 含水量是主要影响因素。通过改变超高压压力(200、300、400、500 和600 MPa)、保压时间(2、4、6、8 和10 min)、氯化胆碱/乙二醇摩尔比(1:2、1:3、1:4、1:5和1:6) 和DES 含水量(30%、40%、50%、60%和70%,V/V),考察各影响因素对红枣多糖得率的影响。基于上述单因素试验结果,选用响应面法对提取过程进一步优化,根据Box-Behnken 中心组合原理(BBD),以超高压压力(A)、保压时间(B)、氯化胆碱/乙二醇摩尔比(C)和DES 含水量(D)为自变量,以多糖得率为响应值,进行四因素三水平的响应面分析,实验设计如表2 所示。再根据实验数据进行回归分析,随后,在最优条件下进行了三次验证实验,以验证实验设计的可靠性。
表2 响应面方法的自变量和水平
Table 2 Independent variables and levels of the response surface methodology
?
1.2.3 多糖制备
称取10 g 预处理红枣粉溶于300 mL DES 水溶液中,搅拌均匀后放入无菌聚乙烯袋,将袋内空气排除后密封,放入超高压装置中。在483 MPa 的压力下反应8.25 min 后,压力迅速释放。然后根据实验室前期方法处理多糖 [12] ,离心得到的上清液用无水乙醇(1:4,V/V)在4 ℃下沉淀12 h。沉淀通过离心(4 000 r/min,10 min)分离,然后用热水重新溶解到适当的体积得到红枣粗多糖。粗多糖用Sevag 试剂去除游离蛋白,脱蛋白溶液用去离子水透析3 d,再用无水乙醇(1:4,V/V)沉淀。收集沉淀物,使用冷冻干燥机在-80 ℃下冻干,得到最终的红枣多糖JP-UD。
1.2.4 多糖的抗氧化活性
1.2.4.1 DPPH 自由基清除能力
为了测定红枣多糖对2,2-二苯基-1-三硝基肼基(DPPH)自由基的清除活性,参考Zhang 等 [13] 的方法并进行适当修改。将1.0 mL 不同质量浓度的红枣多糖溶液(0.4、1.2、2.0、2.8 和3.6 mg/mL)溶于2.0 mL 体积分数95%乙醇的DPPH·(0.1 mmol/L)中,以抗坏血酸为阳性对照,混合物在室温下摇匀,避光静置30 min 后,于517 nm 处测定吸光度。每个样品进行三次重复试验。用下式(2)确定DPPH自由基清除活性的百分数,然后计算IC50 值,红枣多糖的DPPH 自由基清除能力以抗坏血酸当量表示,即计算抗坏血酸和样品的IC50 比值 [14] ,单位为mg ascorbic acid/g DW,简写为mg AA/g DW。
式中:
R1——DPPH 自由基清除率,%;
A0——空白组的吸光值(蒸馏水代替多糖溶液);
A1——样品组的吸光值;
A2——对照组的吸光值(体积分数95%乙醇代替DPPH 溶液)。
1.2.4.2 ABTS+自由基清除能力
为了评价红枣多糖对2,2′-联氨-双(3-乙基苯并噻唑啉-6-磺酸)二胺盐(ABTS)自由基的清除活性,采用了Yeung 等 [15] 的方法,并进行适当修改。7 mmol/L 的ABTS 溶液与2.45 mmol/L 的硫酸钾(1:1,V/V)在黑暗中反应12~16 h,生成ABTS自由基阳离子。用去离子水稀释ABTS 工作液,当734 nm 处吸光值为0.70±0.02 时待用。将1.0 mL多糖溶液(0.4、1.2、2.0、2.8 和3.6 mg/mL)溶于4.0 mL ABTS+·溶液后,以抗坏血酸为阳性对照,在避光条件下孵育6 min,于734 nm 处测定样品吸光值。每个样品进行三次重复试验。用下式(3)测定ABTS+自由基清除活性,并计算IC50 值,红枣多糖的ABTS+自由基清除能力以抗坏血酸当量表示,即计算抗坏血酸和样品的IC50 比值 [14] ,单位为mg ascorbic acid/g DW,简写为mg AA/g DW。
式中:
R2——ABTS+自由基清除能率,%;
A0——空白组的吸光值(蒸馏水代替多糖溶液);
A1——样品组的吸光值;
A2——对照组(蒸馏水代替ABTS 溶液)的吸光值。
1.2.4.3 铁离子还原能力(FRAP)
根据Benzie 等[16] 的报道制备FRAP 工作液,将5 μL(0.4、1.2、2.0、2.8 和3.6 mg/mL)多糖溶液与180 μL 工作溶液在室温下避光反应6 min,于593 nm处测量吸光值。采用不同浓度的FeSO4·7H2O 水溶液(100~1 500 μmol/L)构建标准曲线。根据标准曲线,计算每毫升的多糖铁离子还原能力,以不同浓度红枣多糖每毫升中所含FeSO4·7H2O 当量浓度(μmol FeE/mL)绘制图表,FRAP 值以每克红枣多糖干基中所含FeSO4·7H2O 当量表示,简写为μmol FeE/g DW 表示。
1.2.4.4 氧自由基抗氧化能力(ORAC)
ORAC 检测参考Zhang 等 [13] 的方法。以Trolox为标准化合物构建标准曲线,计算每毫升多糖的氧自由基抗氧化能力,以不同浓度红枣多糖每毫升中所含FeSO4·7H2O 当量浓度(μmol TE/mL)绘制图表,ORAC 值以每克红枣多糖干基所含的Trolox 当量表示,即μmol TE/g DW 表示。
1.3 数据处理
本实验数据以平均值±标准偏差(SD)表示。采用单因素方差分析评估显著性,组间数据在0.05水平的显著性差异通过SPSS 19.0 软件采用Duncan(D)进行分析。P 值为0.05 作为显著性的阈值。
2 结果与分析
2.1 超高压耦合DES提取红枣多糖工艺优化
2.1.1 DES类型的影响
采用7 种不同的DES 体系和热水浸提红枣多糖的得率如图1 所示。除甜菜碱-甘油外,其余DES溶剂体系的多糖得率均高于热水法,其中氯化胆碱-乙二醇组的多糖得率最高(10.68%)。此外,在DESs 中,醇基DESs 的提取效率最高,其次是羧酸基DESs 和尿素基DESs,这一结果从Shang 等 [10] 的报道中得到证实。氯化胆碱是一种含有较多烷基的季铵盐,具有疏水性质,黏度低,这有利于溶质与溶剂之间的传质;醇类物质中的醇羟基能与多糖之间形成氢键,从而提高提取速率。在此结论基础上,选择氯化胆碱和乙二醇组成的DES 溶剂体系作为红枣多糖的提取溶剂,并应用于进一步的试验。
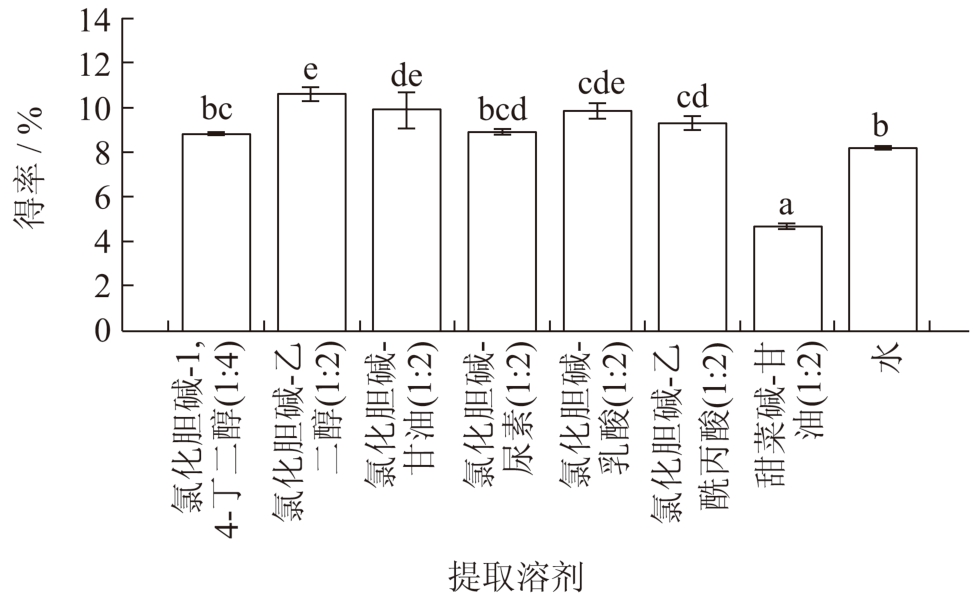
图1 不同DES 制备红枣多糖的得率
Fig.1 Extraction yield of jujube polysaccharides from different deep eutectic solvents
注:不同字母表示样品间具有显著性差异(P < 0.05),下同。
2.1.2 超高压压力的影响
超高压压力(200、300、400、500、600 MPa)对红枣多糖得率的影响如图2a 所示。当超高压压力为200~400 MPa 时,多糖得率显著增加(P < 0.05),当超高压压力为400 MPa 时,红枣多糖得率达到最大值(11.19%)。然而,当超高压压力进一步增大(400~600 MPa)时,得率会明显降低。当压力到达一定程度时,高压已经充分破坏细胞壁和细胞膜,再提高压力反而会使杂质释放而降低多糖纯度。因此,后续实验选择超高压压力为400 MPa。
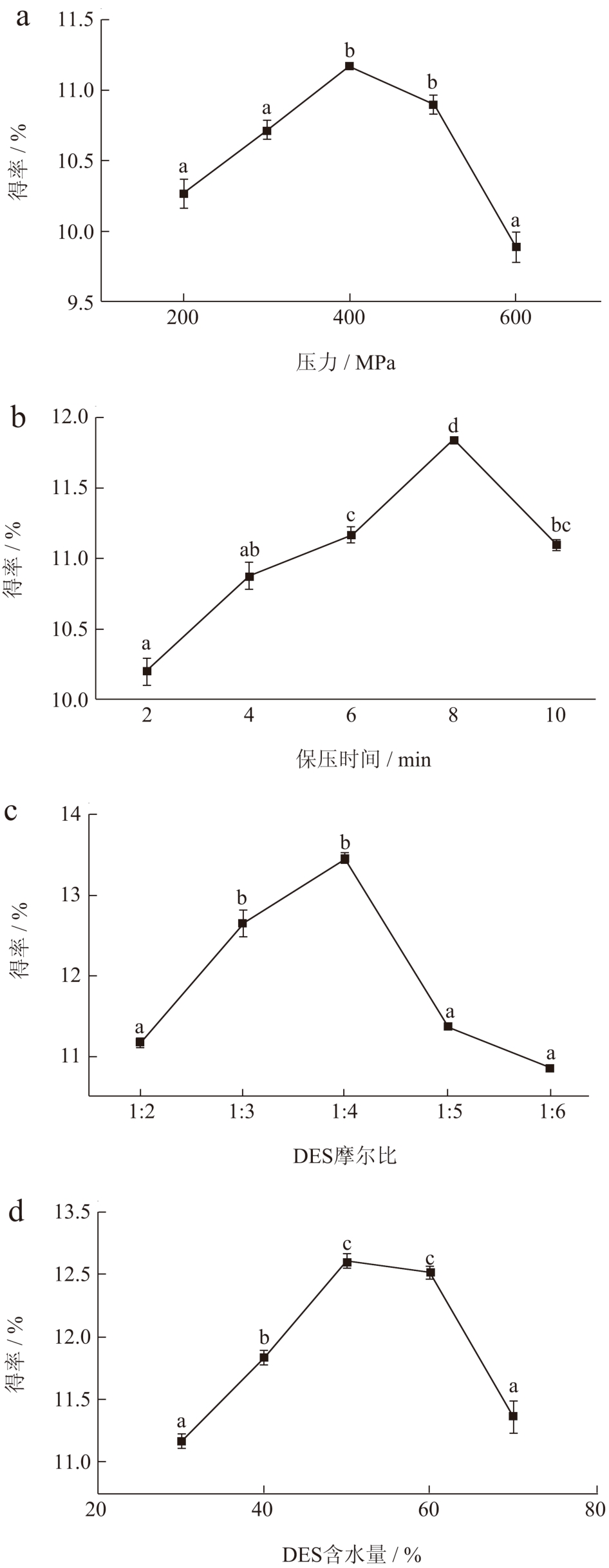
图2 不同因素对红枣多糖得率的影响
Fig.2 Effects of different factors on extraction yield
2.1.3 保压时间的影响
保压时间(2、4、6、8、10 min)对红枣多糖得率的影响如图2b 所示。多糖得率随保压时间(2~8 min)的增加而增加,当保压时间为8 min 时,得率最高(11.84%)。然而,进一步增加保压时间(8~10 min)会导致得率降低。当溶质与溶剂间达到平衡时,再延长作用时间反而会使多糖降解,降低多糖质量,造成能源损耗。因此,保压时间8 min 为最佳。
2.1.4 DES摩尔比的影响
氯化胆碱与乙二醇摩尔比(1:2、1:3、1:4、1:5、1:6)对红枣多糖得率的影响如图2c 所示。随着乙二醇比例的增加,多糖得率先升高后降低,当氯化胆碱与乙二醇的摩尔比为1:4 时,多糖得率最高(13.45%)。增大乙二醇的比例可以增强组分间的氢键作用,但过量会使组分间的范德华力、疏水力等其他相互作用增加,DES 黏度增大。因此,后续实验选择氯化胆碱与乙二醇的摩尔比为1:4。
2.1.5 DES含水量的影响
DES 含水量(30%、40%、50%、60%、70%,V/V)对红枣多糖得率的影响如图2d 所示。当DES含水量从30%增加到50%时,多糖的得率显著增加。DES 含水量为50%时,多糖得率达到最大值(12.60%)。然而,当含水量进一步增加(50%~70%)时,红枣多糖得率反而会降低。适宜的含水量可以降低DES 的黏度,增加溶质与溶剂间的传质速率,但是含水量过高会使氯化胆碱与乙二醇之间的氢键断裂,失去DES 本身的性能 [17] 。因此,认为DES含水量为50%时提取效果最佳。
2.2 响应面设计
进一步采用响应面试验优化超高压耦合低共熔溶剂提取红枣多糖的工艺,BBD 设计了29 组独立的实验组合,测定的响应值多糖得率如表3 所示。基于上述实验结果,以单因素A(超高压压力)、B(保压时间)、C(DES 摩尔比)、D(DES 含水量)为变量和Y(多糖得率)为响应值,进行多元回归分析,建立了拟合变量与响应值的二次多项式模型。得到二阶多项式方程如下:
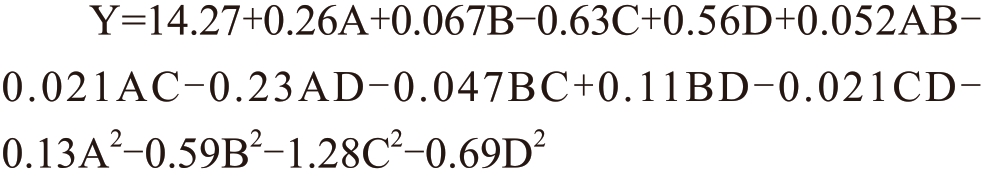
表3 响应面优化的独立实验组合以及响应值
Table 3 Independent experimental combinations and
response values for response surface optimization
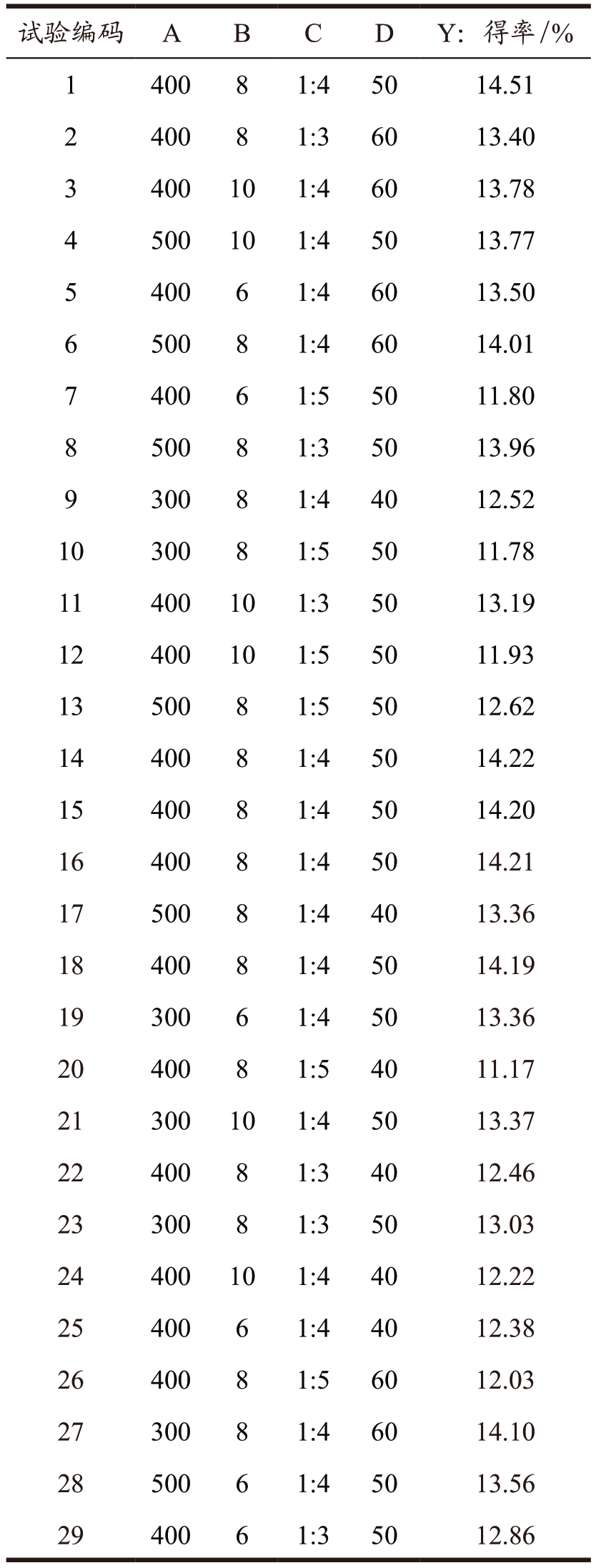
?
二次多项式模型的方差分析和显著性分析如表4 所示。结果表明,该模型P 值小于0.000 1,失拟项P 值(0.268 6)不显著表示数据精度高,二次模型的高决定系数值(R2=0.981 2)表明该模型拟合良好。调整后的决定系数(RAdj2)为0.962 4,接近R2,说明实际值与预测值高度相关。较低的变异系数(1.33%)表示标准差与均值的比值,说明实验数据具有较高的精度和可靠性。另外,相互系数在95%置信区间上也有统计学意义。线性系数(A、C、D)和二次项系数(A2、B2、C2、D2)显著影响红枣多糖得率(P < 0.05),主要影响因素依次为DES 摩尔比>DES 含水量>超高压压力>保压时间。
表4 二次模型方差分析和显著性分析
Table 4 The analysis of variance and significance analysis for the quadratic model
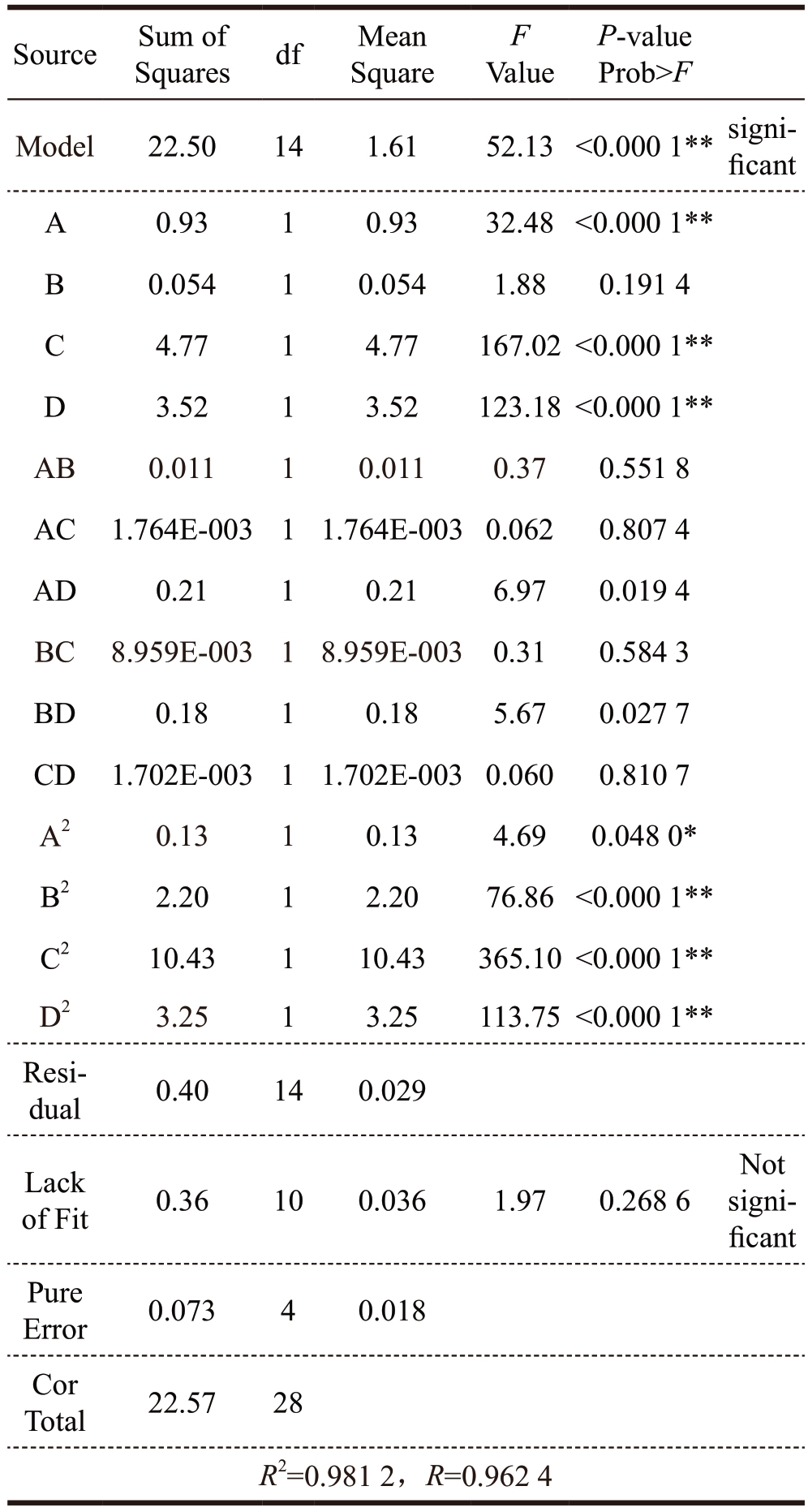
?
用二维图和三维图表示了各因素相互作用对得率的影响。如图3 所示,随着超高压压力、保压时间和DES 含水量的增加,红枣多糖得率逐渐升高,达到峰值后下降。此外,等高线图表面越陡,对响应值的影响越大。因此,DES 含水量的影响比超高压压力和保压时间的影响更显著。通过二阶多项式方程分析,得出最佳提取条件为:超高压压力为483 MPa,保压时间8.25 min,氯化胆碱/乙二醇摩尔比为1:3.75,DES 含水量为53%。在此条件下,红枣多糖实际得率为14.22%,与理论预测值14.55%相接近,表明建立的该回归模型具有较好的拟合性。Li 等 [18] 分别采用热水法和超声辅助法制备骏枣多糖,多糖得率从6.23%增加到7.95%;Berkani 等 [19] 响应面优化得到微波辅助提取红枣多糖的实际得率为13.98%;He 等 [20] 优化碱辅助提取法制备红枣多糖的得率为5.10%;靳学远等 [21] 在单因素试验的基础上,采用正交试验优化得到超高压提取红枣多糖的最佳提取参数为粉碎度60 目、料液比14 mL/g、超高压压力420 MPa、保压时间4.5 min,在此提取条件下,红枣多糖得率为4.71%。与前期报道的红枣多糖得率相比,超高压耦合DES 提取工艺实现了红枣多糖的高效制备。

图3 两因素交互作用对红枣多糖得率的影响
Fig.3 The response surface plots for the interaction effects on the extraction yield of JPs
注:(a-b)超高压压力和DES 含水量;(c-d)保压时间和DES 水含量。
2.2 抗氧化活性
不同质量浓度红枣多糖对DPPH 自由基的清除能力、ABTS+自由基的清除能力、铁离子还原能力和氧自由基抗氧化能力如图4 所示。在0.4~3.6 mg/mL的质量浓度下,红枣多糖抗氧化能力均呈剂量依赖性。当多糖质量浓度为3.6 mg/mL 时,DPPH 和ABTS+自由基的清除率最高,分别为67.68%和79.94%。此外,计算得到红枣多糖清除DPPH 自由基的半抑制质量浓度(IC50 值)为2.64 mg/mL,自由基清除能力为1.47 mg AA/g DW,而清除ABTS+自由基的IC50 值为1.31 mg/mL,自由基清除能力为10.69 mg AA/g DW(表5),由此表明,红枣多糖对ABTS+自由基的清除活性更高。此外,分析了红枣多糖的铁离子还原能力和氧自由基抗氧化能力,结果如表5 所示,在0.4~3.6 mg/mL 的质量浓度下,红枣多糖抗氧化能力均呈剂量依赖性。当多糖质量浓度为3.6 mg/mL 时,铁离子还原能力和氧自由基抗氧化能力最高,分别为167 mmol FeE/mL和130 mmol TE/mL(表5)。由此表明,红枣多糖同时具有一定程度的铁离子还原能力和氧自由基抗氧化能力,其FRAP 值和ORAC 值分别为30.43 mmol FeE/g DW 和193.67 μmol TE/g DW。
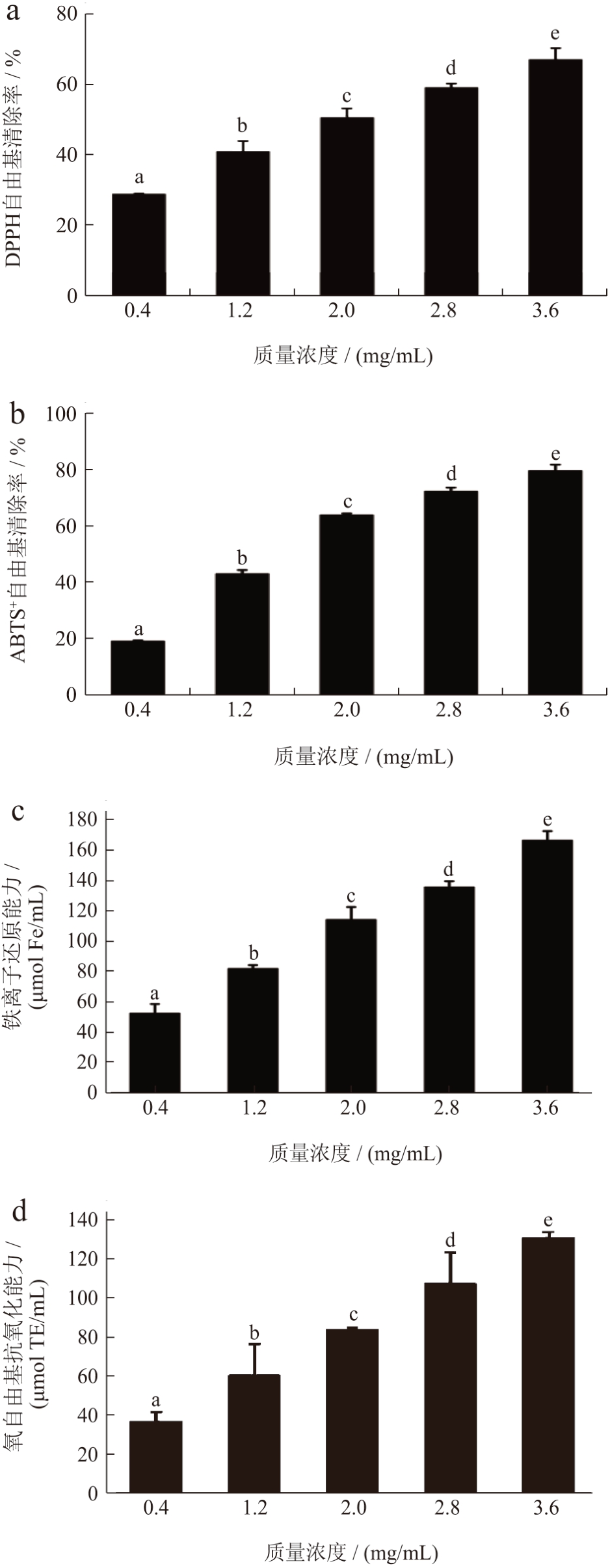
图4 不同质量浓度红枣多糖抗氧化能力
Fig.4 Antioxidant capacity of jujube polysaccharides in different mass concentrations
表5 红枣多糖的抗氧化活性
Table 5 Antioxidant activity of jujube polysaccharides

?
过量的活性氧可产生氧化应激和自由基 [22] ,参与一系列慢性疾病的病理过程。然而,单一的评价方法并不足以代表复杂的反应体系,因此选择了DPPH、ABTS+、FRAP 和ORAC 四个指标来评价红枣多糖的抗氧化活性。前期研究表明,植物多糖可以通过清除自由基来防止氧化应激 [23] ,本研究也证实了这一结论。红枣多糖均具有一定的DPPH 和ABTS+自由基清除能力,且与质量浓度呈正相关。此外,有研究发现多糖的抗氧化活性与抑制自由基链反应的还原能力有关 [24] 。因此,采用FRAP 法,通过提供单电子将Fe3+还原为Fe2+,来评价多糖的抗氧化能力。结果显示红枣多糖具有显著的FRAP活性,这可能是由于红枣多糖的糖醛酸含量丰富,含有足够的醛羟基与Fe3+反应。以上结果表明,红枣多糖具有较强的抗氧化活性,表明超高压耦合DES 提取技术具有制备高抗氧化活性多糖的潜力,红枣多糖具有作为食品开发抗氧化剂的潜力。
3 结论
本研究采用超高压耦合DES 提取红枣多糖,选用氯化胆碱和乙二醇组成的低共熔体系作为红枣多糖的提取溶剂,在单因素的基础上,建立了以超高压压力、保压时间、DES 摩尔比和DES 含水量为自变量,多糖得率为因变量的回归模型,确定超高压-低共熔提取工艺的最佳条件参数为:超高压压力483 MPa、保压时间8.25 min、氯化胆碱/乙二醇摩尔比1:3.75、含水量53%,在此条件下,红枣多糖的得率为14.42%;同时,体外抗氧化试验表明,红枣多糖对DPPH、ABTS+自由基清除能力(在IC50 值时)分别为1.47 mg AA/g DW 和10.69 mg AA/g DW,对铁离子还原能力和氧自由基抗氧化能力分别为30.43 μmol FeE/g DW 和193.67 μmol TE /g DW,表现出一定的抗氧化活性。该研究为红枣多糖的开发利用提供了新的途径。
[1] 冀晓龙,尹明松,侯春彦,等.红枣多糖提取、分离纯化及生物活性研究进展 [J] .食品工业科技,2020,41(23):346-353,58.
[2] JI X, PENG Q, YUAN Y, et al. Isolation, structures and bioactivities of the polysaccharides from jujube fruit (Ziziphus jujuba Mill.):A review [J] . Food Chemistry, 2017, 227:349-357.
[3] ZOU X, XIAO J, CHI J, et al. Physicochemical properties and prebiotic activities of polysaccharides from Zizyphus jujube based on different extraction techniques [J] . Int J Biol Macromol, 2022, 223(Pt A):663-672.
[4] XI J. Ultrahigh pressure extraction of bioactive compounds from plants-A review [J] . Crit Rev Food Sci Nutr, 2017, 57(6):1097-1106.
[5] CHEN H, HUANG Y, ZHOU C, et al. Effects of ultrahigh pressure treatment on structure and bioactivity of polysaccharides from large leaf yellow tea [J] . Food Chemistry,2022, 387:132862.
[6] GHAEDI H, AYOUB M, SUFIAN S, et al. The study on temperature dependence of viscosity and surface tension of several Phosphonium-based deep eutectic solvents [J] . Journal of Molecular Liquids, 2017, 241:500-510.
[7] CUNHA S C, FERNANDES J O. Extraction techniques with deep eutectic solvents [J] . TrAC Trends in Analytical Chemistry, 2018, 105:225-239.
[8] LING J K U, HADINOTO K. Deep eutectic solvent as green solvent in extraction of biological macromolecules:A Review [J] . Int J Mol Sci, 2022, 23(6):3381.
[9] WU D T, FENG K L, HUANG L, et al. Deep eutectic solventassisted extraction, partially structural characterization, and bioactivities of acidic polysaccharides from lotus leaves [J] .Foods, 2021, 10(10):2330.
[10] SHANG X C, CHU D, ZHANG J X, et al. Microwaveassisted extraction, partial purification and biological activity in vitro of polysaccharides from bladder-wrack (Fucus vesiculosus) by using deep eutectic solvents [J] . Separation and Purification Technology, 2021, 259:118169.
[11] DUBOIS M, GILLES K A, HAMILTON J K, et al.Colorimetric method for determination of sugars and related substances [J] . Analytical Chemistry, 1956, 28(3):350-356.
[12] 刘慧君,黄菲,张瑞芬,等.龙眼果肉多糖超微粉碎-酶解提取工艺优化及其免疫活性 [J] .中国食品学报,2020,20(3):112-119.
[13] ZHANG S, MA Q, DONG L, et al. Phenolic profiles and bioactivities of different milling fractions of rice bran from black rice [J] . Food Chem, 2022, 378:132035.
[14] YANG D, DUNSHEA F R, SULERIA H A R. LC-ESIQTOF/MS characterization of Australian herb and spices(garlic, ginger, and onion) and potential antioxidant activity [J] . Journal of Food Processing and Preservation,2020, 44(7):e14497.
[15] YEUNG Y K, KANG Y R, So B R, et al. Structural,antioxidant, prebiotic and anti-inflammatory properties of pectic oligosaccharides hydrolyzed from okra pectin by Fenton reaction [J] . Food Hydrocolloids, 2021, 118:106779.
[16] BENZIE I F, STRAIN J J. The ferric reducing ability of plasma (FRAP) as a measure of ‘‘antioxidant power’’:The FRAP assay [J] . Analytical Biochemistry, 1996, 239(1):70-76.
[17] WEI Z, QI X, LI T, et al. Application of natural deep eutectic solvents for extraction and determination of phenolics in Cajanus cajan leaves by ultra performance liquid chromatography [J] . Separation and Purification Technology,2015, 149:237-244.
[18] LI J, AI L, HANG F, et al. Composition and antioxidant activity of polysaccharides from jujuba by classical and ultrasound extraction [J] . Int J Biol Macromol, 2014, 63:150-153.
[19] BERKANI F, DAHMOUNE F, ACHAT S, et al. Response surface methodology optimization of microwave-assisted polysaccharide extraction from Algerian jujube (Zizyphus lotus L.) pulp and peel [J] . Journal of Pharmaceutical Innovation, 2020, 16(4):630-642.
[20] HE Z, ZHU Y, BAO X, et al. Optimization of alkali extraction and properties of polysaccharides from Ziziphus jujuba cv. Residue [J] . Molecules, 2019, 24(12):2221.
[21] 靳学远.超高压提取红枣多糖工艺条件的优化 [J] .江苏农业科学,2014,42(9):256-257.
[22] ZHENG C, DONG Q, CHEN H, et al. Structural characterization of a polysaccharide from Chrysanthemum morifolium flowers and its antioxidant activity [J] .Carbohydr Polym, 2015, 130:113-121.
[23] LIU W, WANG J, ZHANG Z, et al. In vitro and in vivo antioxidant activity of a fructan from the roots of Arctium lappa L [J] . Int J Biol Macromol, 2014, 65:446-453.
[24] SHAFIE M H, YUSOF R, GAN C Y. Deep eutectic solvents(DES) mediated extraction of pectin from Averrhoa bilimbi:Optimization and characterization studies [J] . Carbohydr Polym, 2019, 216:303-311.