我国是世界上蚕桑生产第一大国,每年蚕茧产量高达65 万t,其中也会产生大量的蚕蛹作为生产过程中的副产物,蚕蛹中富含丰富的蛋白质、油脂等物质,对于这些物质的利用目前主要还集中在动物的饲料当中 [1] ,但是其中所具有丰富的蛋白质是否也可以为人体所利用,近年来也有许多学者也在探究以蚕蛹蛋白作为原料通过不同的方法得到一些具有生物学活性的多肽。例如:沈圆圆等 [2] 通过纳豆液态发酵技术制备得到一种具有抗炎作用的蚕蛹肽、Wu 等 [3] 通过胃肠道蛋白酶解的方法分离纯化出一种具有血管紧张素-1 转化酶抑制作用的多肽、Luo 等 [4] 通过运用胃蛋白酶和溴素处理之后获得了一种具有DPP-IV 抑制作用的多肽。
氧化应激作为生物中最常见也无法避免的损害它与生物体的许多过程息息相关,其本质其实就是体内氧化物质与还原物质的比例失衡,氧化应激会诱发许多的疾病特别是与年龄相关的疾病 [5] 包括慢阻肺 [6] 、高血压 [7] 、阿兹海默症 [8] 等,因此如何减轻氧化应激对人体带来的损伤显得十分重要。
蚕蛹水解肽作为一种新开发的药物资源是否也具有抗氧化活性,目前已有研究表明相比中性蛋白酶木瓜蛋白酶水解蚕蛹蛋白后得到的蚕蛹肽抗氧化活性更好 [9] 、卢楠等 [10] 通过基于总还原能力的响应面实验探究了一条碱性蛋白酶酶解的工艺流程、学者李志永 [11] 通过分离纯化获得了一种具有增强免疫功能的蚕蛹肽。在此基础上能否进一步优化蚕蛹蛋白水解肽的制备流程,进一步提升其抗氧化性能使其成为一种有效、安全的食源性功能多肽是值得深入研究的。
人体内自由基的产生与清除之间存在着微妙的平衡,一旦这种平衡被打破就有可能造成一系列的机体的损害,自由基的产生同时也会引起细胞内发生一系列氧化应激现象,因此基于DPPH 和ABTS自由基清除效果的响应面实验可以更加有效的评估蚕蛹蛋白水解肽对于这一系列氧化应激损伤的缓解作用,并且通过双响应面的方式可以进一步优化已有的蚕蛹蛋白水解肽的制备工艺流程,本研究意在进一步优化蚕蛹蛋白水解抗氧化肽的制备工艺以及增强抗氧化活性,减轻生产过程中的能源消耗,增大产业效益且制备所得的蚕蛹肽也有望进一步开发其生物作用,例如抗衰老、预防老年痴呆等一系列老年疾病。
1 材料与方法
1.1 材料与试剂
蚕蛹为实验室养殖得到的桑蚕蛹;碱性蛋白酶、中性蛋白酶、木瓜蛋白酶、菠萝蛋白酶、1,1-二苯基-2-苦肼基(DPPH)、2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸(ABTS)、硫酸铜、氢氧化钠、乙酸乙酯,购于上海麦克林生化科技有限公司;D-半乳糖购于默克;肌酸激酶(CK)、过氧化物(CAT)、过氧化物歧化酶(SOD)、谷胱甘肽过氧化物歧化酶(GSH-PX)、丙二醛(MDA)及总抗氧化能力(T-AOC)试剂盒,均购自南京建成生物工程研究所。
1.2 实验动物
Spf 级Balb/c 小鼠,来源于广东省医学实验动物中心(许可证编号SCXK(粤)2019-0035)饲养于深圳大学医学部实验动物中心(许可证号SYXK(粤)2022-0302)。实验前适应性饲养一周。在试验期间小鼠被饲养于25 ℃,享受12 h 光照和黑暗,自由进食和饮水的环境中。
1.3 仪器与设备
IKA KS3000i 气浴恒温摇床,艾卡(广州)仪器设备有限公司;Eppendorf Centrifige 5424R、5810R高速离心机,艾本德(上海)国际贸易有限公司;OHAUS ST20 pH 计,奥豪斯国际贸易(上海)有限公司;Bio Tek SYNERGY HTX 酶标仪,美国Bio Tek 公司;SCIENTZ-10N 冷冻干燥机,宁波新芝生物科技股份有限公司;TUS-200P震荡型恒温金属浴,上海一恒科学仪器有限公司;MS7-HI550-Pro 恒温磁力搅拌仪,美国SCILOGEX 公司。
1.4 方法
1.4.1 脱脂蚕蛹蛋白粉的制备
取一定量的蚕蛹清洗后置于60 ℃烘干,取15 g打成粉末后加入100 mL 乙酸乙酯55 ℃下搅拌2 h后静置30 min 去除上层溶液,重复数次,直至上层清澈。将蚕蛹置于通风橱内静置使多余的乙酸乙酯挥发,挥发后加入100 mL 的纯净水用氢氧化钠调节pH值为10.0,在55 ℃下搅拌提取3 h 后12 000 r/min 离心5 min 取上清,重复两次,上清用盐酸调节pH值为4.0,置于4 ℃冰箱沉淀4 h 后12 000 r/min 离心5 min,弃上清保留沉淀。沉淀尽快用50 mL 纯净水复溶并用氢氧化钠调节pH 值为7.0,冷冻干燥。
1.4.2 蚕蛹抗氧化多肽粉末的制备工艺
准确称取一定量的脱脂蚕蛹蛋白粉,用双蒸水配制成实验所需质量分数的蚕蛹蛋白溶液,用氢氧化钠或盐酸调节溶液至所需的pH 值并置于震荡型恒温金属浴加热至设定温度后迅速加入称量好的蛋白酶进行酶解,反应对应时间后取出沸水浴灭酶10 min,产物冷却后将酶解液的pH 值调至7.0 然后以12 000 r/min 的转速离心20 min,取上清液后冷冻干燥。
1.4.3 最佳水解蛋白酶的筛选
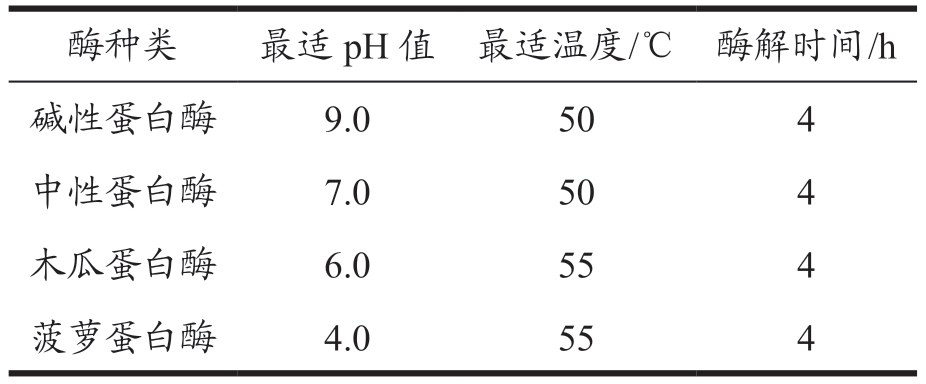
称取一定量的蛋白粉末用水配制成质量分数2%(底物质量/总质量)的溶液后加入质量分数2%(酶质量/底物质量)四种不同的蛋白酶(碱性蛋白酶、中性蛋白酶、木瓜蛋白酶、菠萝蛋白酶)在最适pH 值和温度(如表1)下按1.4.2 酶解,结束后取一定量的多肽粉末配制成0.2 mg/mL 的多肽溶液测定DPPH 和ABTS+自由基清除率,通过比较自由清除率的高低选择酶解效果最佳的蛋白酶。
表1 不同蛋白酶最佳pH值
Table 1 The optimum pH value of different proteases
?
1.4.4 单因素实验
依次评价蚕蛹蛋白质量分数(底物质量/总质量)(1%、3%、5%、7.5%)、蛋白酶质量分数(酶质量/底物质量)(1%、1.5%、2%、3%)、反应温度(40、45、50、55、60 ℃)、体系pH 值(8.0、9.0、10.0、11.0)以及酶解时间(2、3、4、5、6 h)对于蚕蛹蛋白水解肽产物抗氧化活性的影响,抗氧化能力采用体外ABTS+和DPPH 自由基清除能力(未确认最佳条件时采用中间值)。
1.4.5 响应面优化
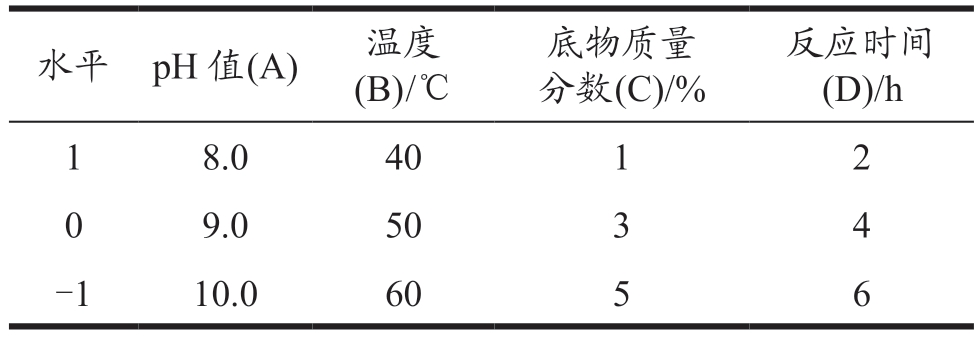
在单因素实验的基础上筛选出酶解时间、温度、底物质量分数、pH 值作为考察因素,运用Box-Behnken 设计4 因素3 水平实验,以DPPH 和ABTS+自由基清除率进行双响应值进而确定蚕蛹抗氧化肽的最佳酶解工艺,设计条件如表2 所示。
表2 响应面优化实验设计因素水平表
Table 2 Response surface optimization test factor level
?
1.4.6 体外抗氧化活性的测定
DPPH 自由基清除率测定,参照Brand-Williams等 [12] 的方法,样品组A1(样品、DPPH)、样品对照组A2(乙醇、样品)、对照组A3(乙醇、DPPH),每组4 个复孔,分别向96 孔板中加入各组相应的试剂或样品各100 µL,避光孵育后测517 nm 处吸光度。计算DPPH 自由基清除率Y。
式中:
A1——样品在517 nm 处的吸光度;
A2——样品对照组在517 nm 处的吸光度;
A3——对照组在517 nm 处的吸光度。
ABTS+自由基清除率测定,参照Li 等 [13] 的方法测定。对照组A0(PBS 和ABTS 工作液),实验组A1(样品和ABTS 工作液),在96 孔板中检测ABTS 工作液加入200 μL 外其他试剂或样品均加入50 μL,避光孵育后测734 nm 处吸光度,每组4 个复孔。计算ABTS+自由基清除率Y。
式中:
A0——对照组在734 nm 处的吸光度;
A1——实验组在734 nm 处的吸光度。
1.4.7 动物分组及造模
参照Sun 等 [14] 的方法,略有修改。40 只小鼠被随机分成4 组,分别为空白对照组、模型组、低剂量蚕蛹肽组、高剂量蚕蛹肽组,每组各10 只。除空白对照组外,其余组小鼠每天皮下注射100 mg/kg 的D-半乳糖溶液(使用生理盐水进行溶解),在此基础上,模型组每天灌胃生理盐水,低剂量组每天灌胃0.2 g/kg 的蚕蛹肽,高剂量组每天灌胃0.8 g/kg 的蚕蛹肽进行治疗。空白对照组每天皮下注射和灌胃等剂量的生理盐水。连续给药4周后眼眶取血并处死小鼠。
1.4.8 肝脏及血清生化指标检测
小鼠饲养至第五周时眼球取血,3 500 r/min 离心20 min 后,分离血清备用。处死小鼠后取部分肝脏组织,用生理盐水制备成10%的组织匀浆后用肌酸激酶(CK)、过氧化物酶(CAT)、过氧化物歧化酶(SOD)、谷胱甘肽过氧化物歧化酶(GSH-PX)及总抗氧化能力(T-AOC)试剂盒检测其在肝脏组织及血清中的含量。
1.5 数据统计与分析
所有数据均平行三次,运用Prism 9、Design Expert 13 进行数据的处理和分析。
2 结果与分析
2.1 蛋白酶的筛选
使用不同的蛋白酶酶解同一底物的时候由于不同酶之间酶切位点的不同会导致酶解后得到的多肽的结构也不尽相同,因此不同的蛋白酶水解后得到的蚕蛹肽的抗氧化活性也可能有所差异,选取实验室中常用的四种蛋白酶即:中性蛋白酶、碱性蛋白酶、木瓜蛋白酶、菠萝蛋白酶。由图1 可知碱性蛋白酶酶解得到的多肽DPPH 和ABTS+自由基清除率最高,因此选用碱性蛋白酶作为最佳酶 [10]。
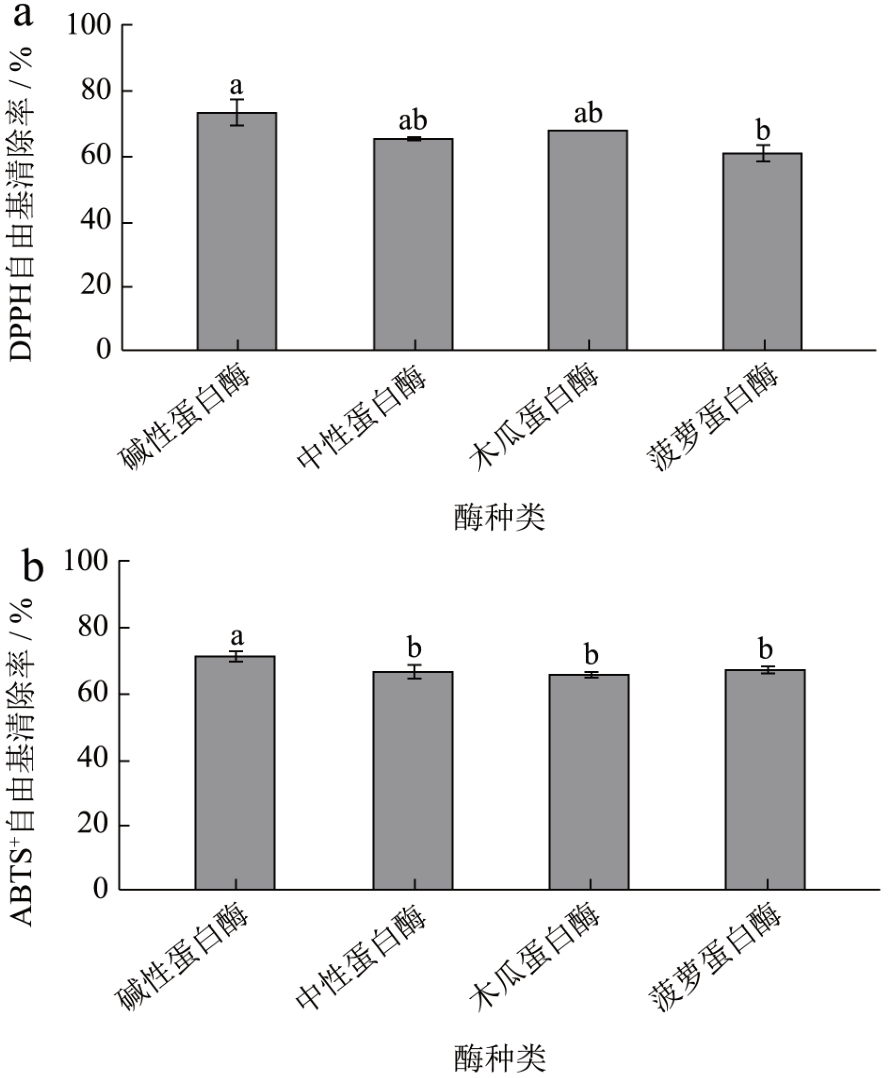
图1 不同酶对水解肽DPPH、ABTS+自由基清除率的影响
Fig.1 Effects of different enzymes on the clearance rate of hydrolyzed peptide DPPH and ABTS+
注:不同的小写字母之间表示具有显著差异(P<0.05),下图同。
2.2 单因素实验结果与分析
2.2.1 最佳pH值的确定
通过图2 可以看出随着pH 值的升高蚕蛹肽的DPPH 和ABTS+自由基清除率也在逐渐升高,在pH 值为10.0 的时候有最大值,继续增大pH 值时清除率降低。其原因是不同的pH 值对于酶解过程有着相当大的影响,不仅使酶的活性有所改变,而且还会影响蛋白质在溶液中的分散情况,不同pH值使得蛋白质在溶液中的分散程度不同、溶解不同因此在酶解过程的酶解程度也会有所区别,进而影响酶解后得到的肽的抗氧化活性 [15] ,因此选定最佳pH 值为10.0。
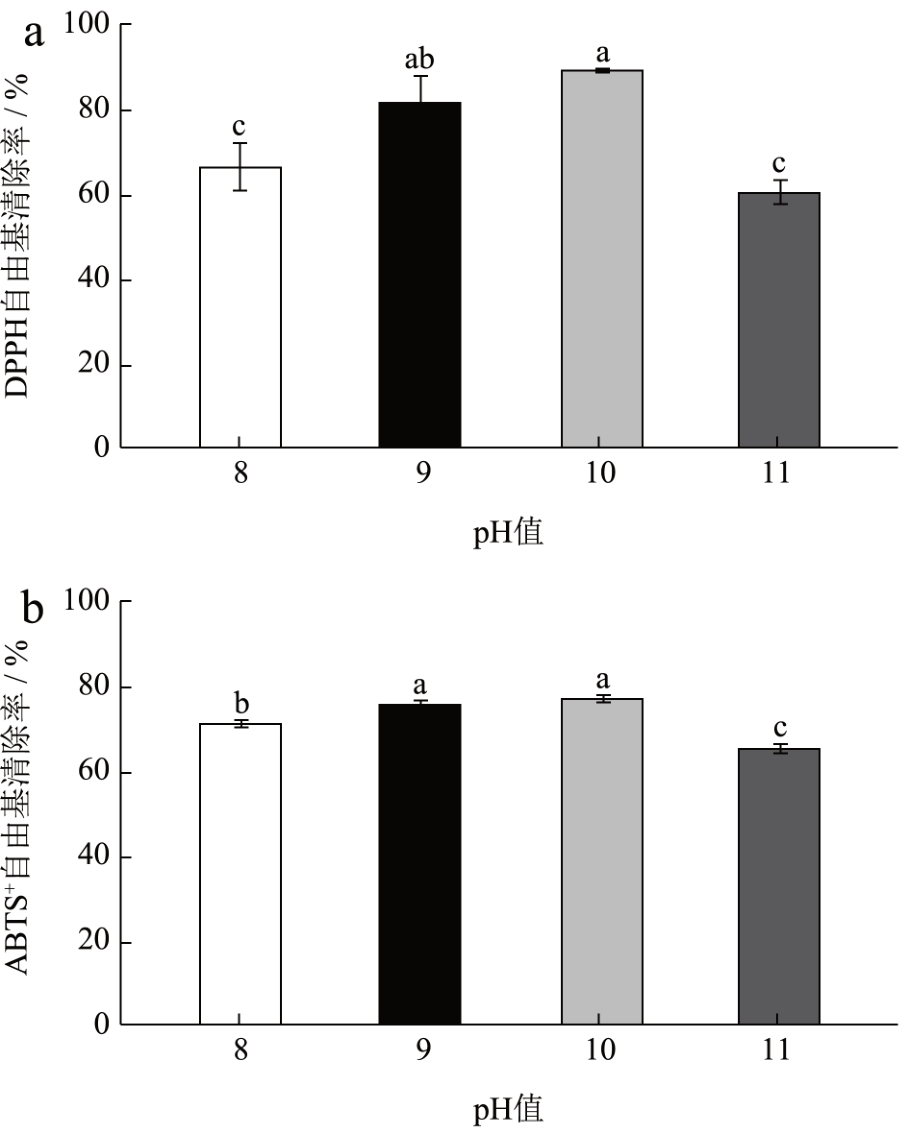
图2 不同pH 值对水解肽DPPH、ABTS+自由基清除率的影响
Fig.2 Effects of different pH values on the clearance rate of hydrolyzed peptide DPPH and ABTS+
2.2.2 最佳底物质量分数的确定
通过图3 可以发现当底物质量分数在1.0%至5.0%时酶解产物的抗氧化活性与质量分数成正相关,当底物质量分数为7.5%的时候可能由于底物质量分数过高导致酶被过多的蛋白质所包围导致其活性位点被屏蔽因此使得蛋白质未被充分酶解导致生成的多肽抗氧化活性降低 [16] 。因此最佳底物质量分数为5%。
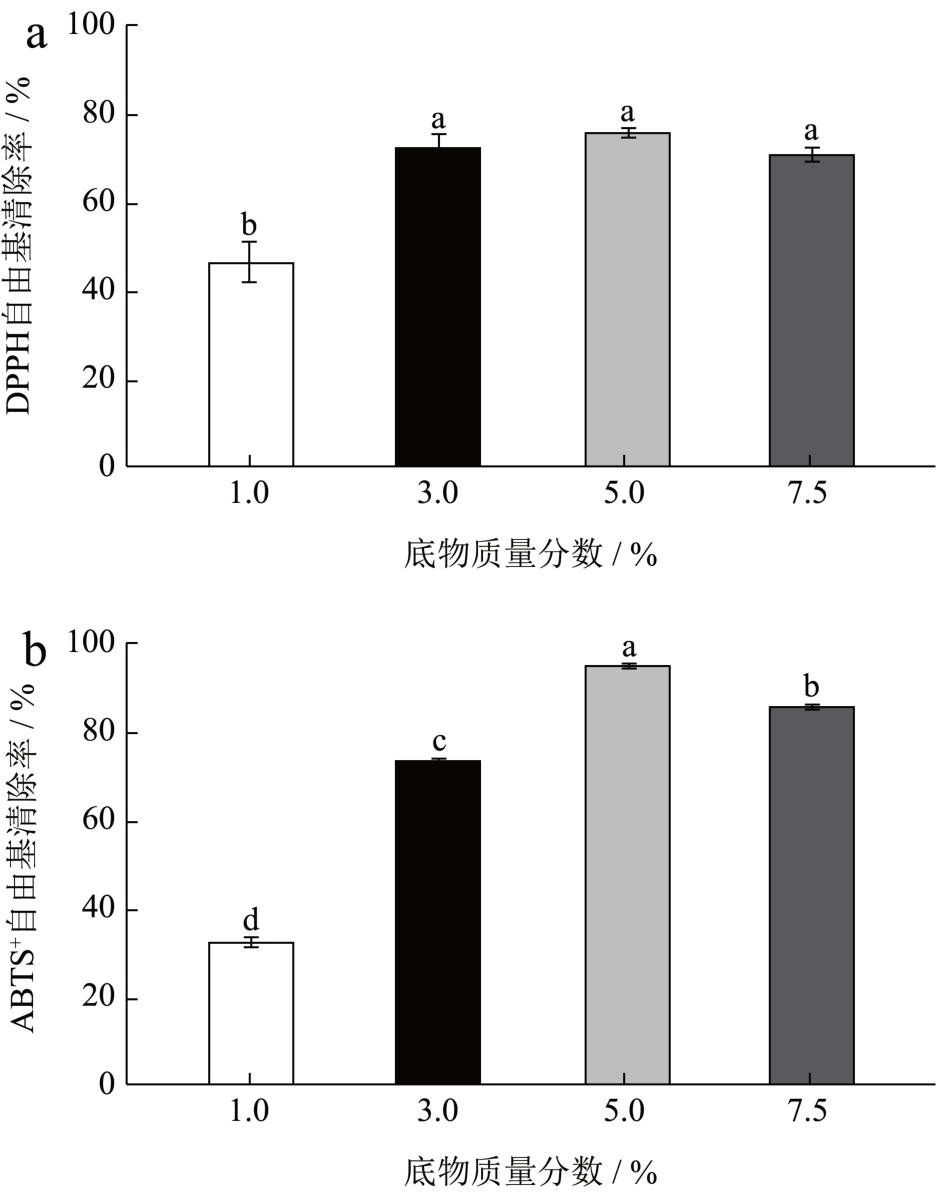
图3 不同底物质量分数对水解肽DPPH、ABTS+自由基清除率的影响
Fig.3 Effects of different substrate concentrations on the clearance rate of hydrolyzed peptide DPPH and ABTS+
2.2.3 最佳酶质量分数的确定
通过图4 可以发现随着酶质量分数的增加蚕蛹水解肽的ABTS+自由基清除率在质量分数为3.0%的时候达到了最大值,而DPPH 自由基清除率先是快速增加然后趋于平稳,这可能是因为酶已经和底物结合达到饱和因此再增加酶的量也不会对酶促反应有所帮助,综上选择酶质量分数为3.0%为最佳条件。
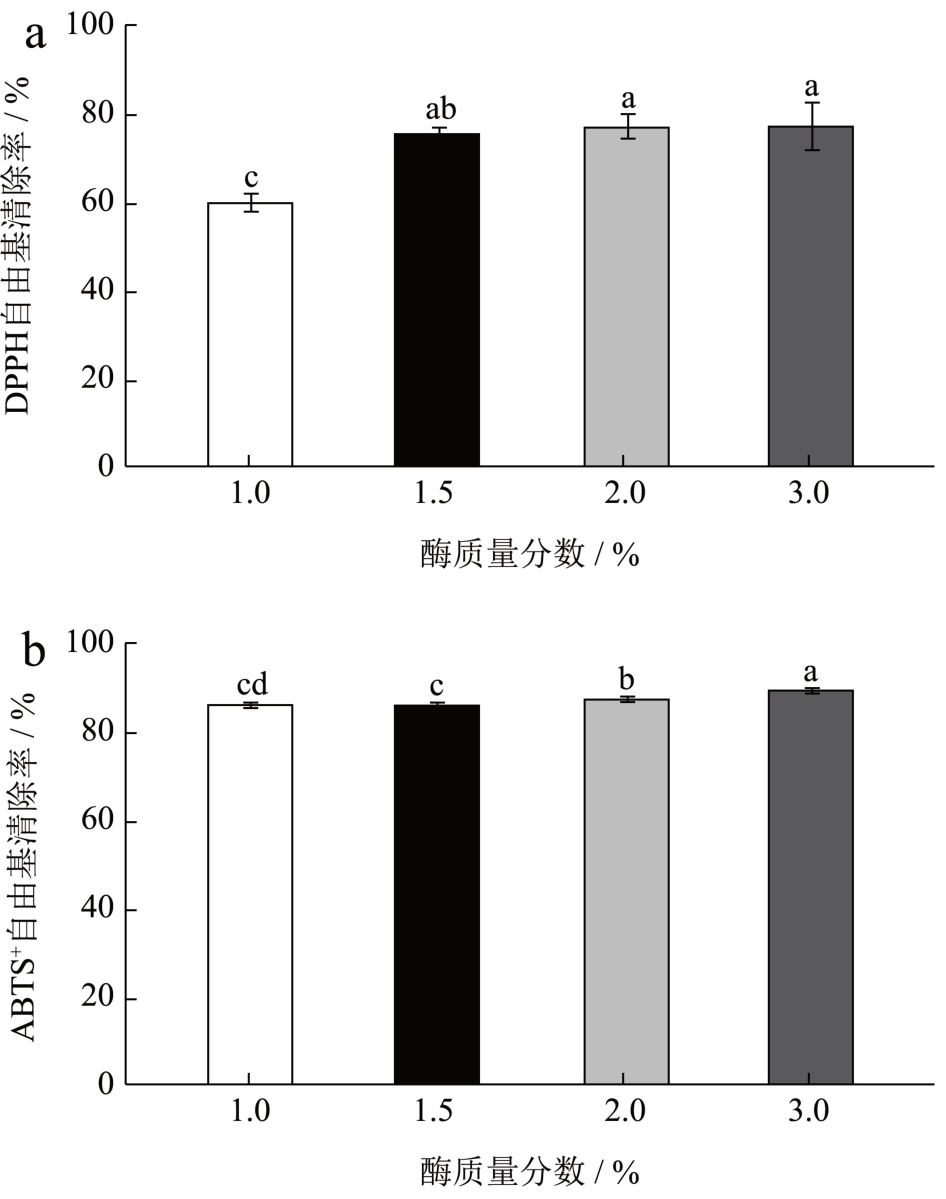
图4 不同酶质量分数对水解肽DPPH、ABTS+自由基清除率的影响
Fig.4 Effects of different enzyme concentrations on the clearance rate of hydrolyzed peptide DPPH and ABTS+
2.2.4 最佳温度的确定
由图5 可知温度从40 ℃升至60 ℃时对于水解肽DPPH 自由基清除率而言呈上升趋势并在60 ℃时达到最大值,温度的变化可能改变酶解过程中酶的活性,温度过高则会使酶失活,因此在温度达到70 ℃时水解肽的DPPH 自由基清除率发生下降究其原因可能是因为温度过高破坏了酶的结构导致酶失去活性导致水解不够彻底 [15] 。ABTS+自由基清除率则没有呈现明显温度依赖性,其原因可能是在酶解过程中活性结构反复出现又消失导致。综上选择最佳的反应温度为55 ℃。
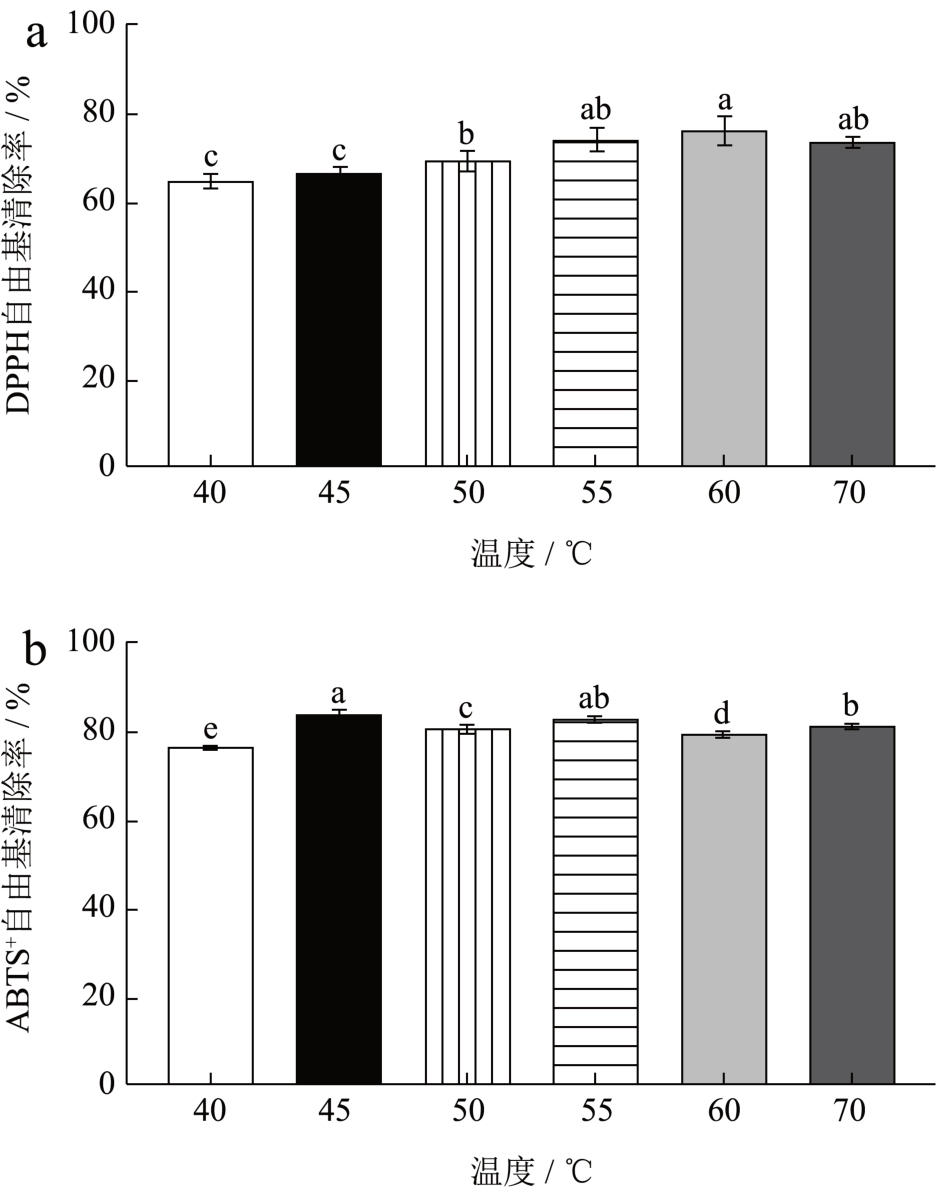
图5 不同温度对水解肽DPPH、ABTS+自由基清除率的影响
Fig.5 Effect of different temperature on the clearance rate of hydrolyzed peptide DPPH and ABTS+
2.2.5 最佳酶解时间的确定
由图6 可知蚕蛹水解肽的DPPH 自由基清除率随着时间的增加先增加后减少,在酶解时间达到4 h 的时候达到最大值。酶解时间过长会导致蛋白质被过分酶解成为氨基酸或一些短肽,从而丧失了抗氧化的活性。ABTS+自由基清除率则是呈现一种先下降再上升的趋势,其原因可能是因为酶切过程中产生了新的活性基团因此导致自由基清除率的上升,因此选择最佳酶解时间为4 h。
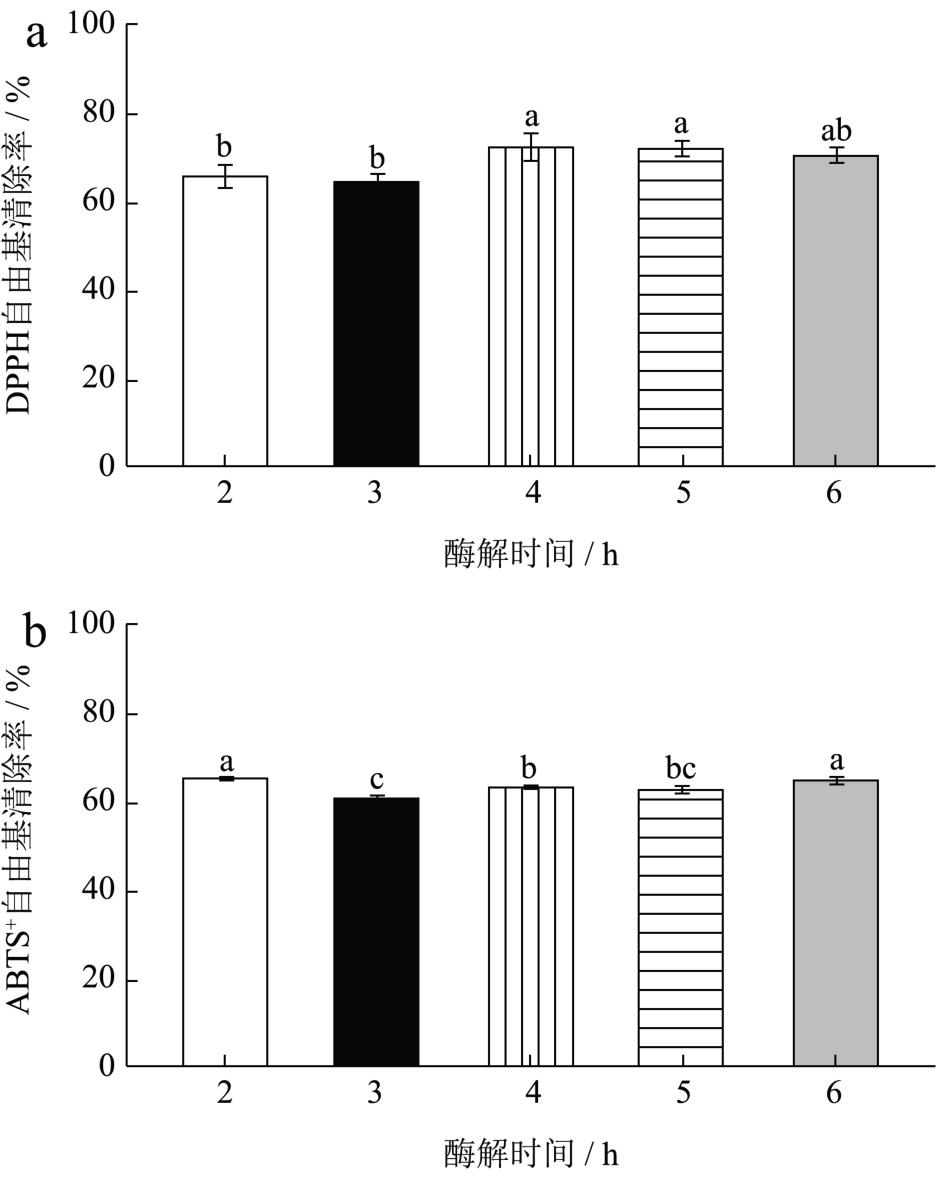
图6 不同酶解时间对水解肽DPPH、ABTS+自由基清除率
Fig.6 Effect of different enzymatic hydrolysis time on the clearance rate of hydrolyzed peptide DPPH and ABTS+
2.3 响应面分析
2.3.1 双响应面实验设计与结果
在单因素实验结果的基础上筛选了pH 值(A)、温度(B)、底物质量分数(C)、反应时间(D)作为考察的因素,以DPPH 自由基清除率和ABTS+自由基清除率作为双响应值进行响应面实验的设计和实验结果如表3 所示。
表3 响应面实验设计与结果
Table 3 Response surface test design and results
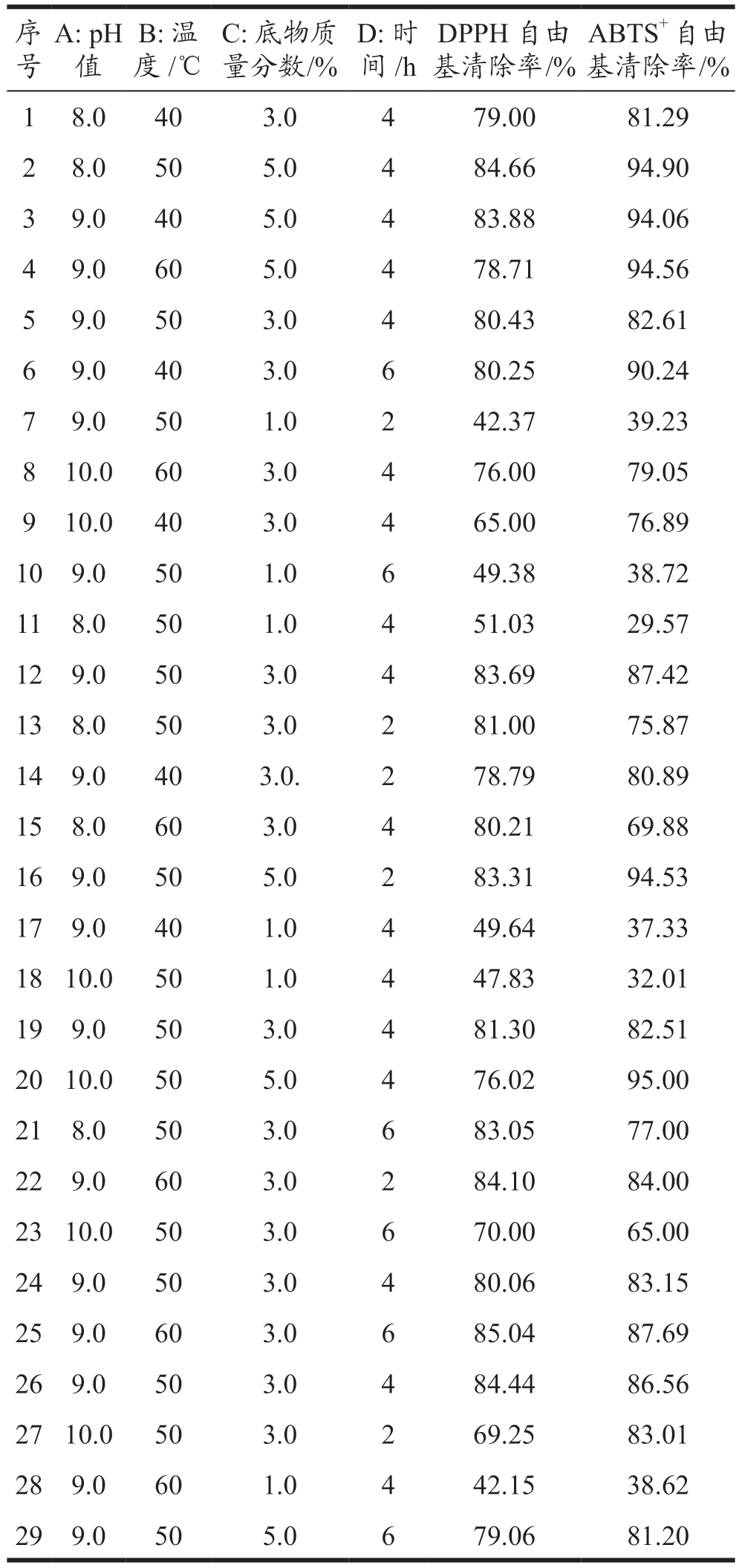
?
2.3.2 方差分析
通过Design Expert 13 软件对响应面实验进行方差分析如表4、5 所示,并得到DPPH 和ABTS+自由基清除率的回归方程。
表4 DPPH方差分析
Table 4 DPPH analysis of variance
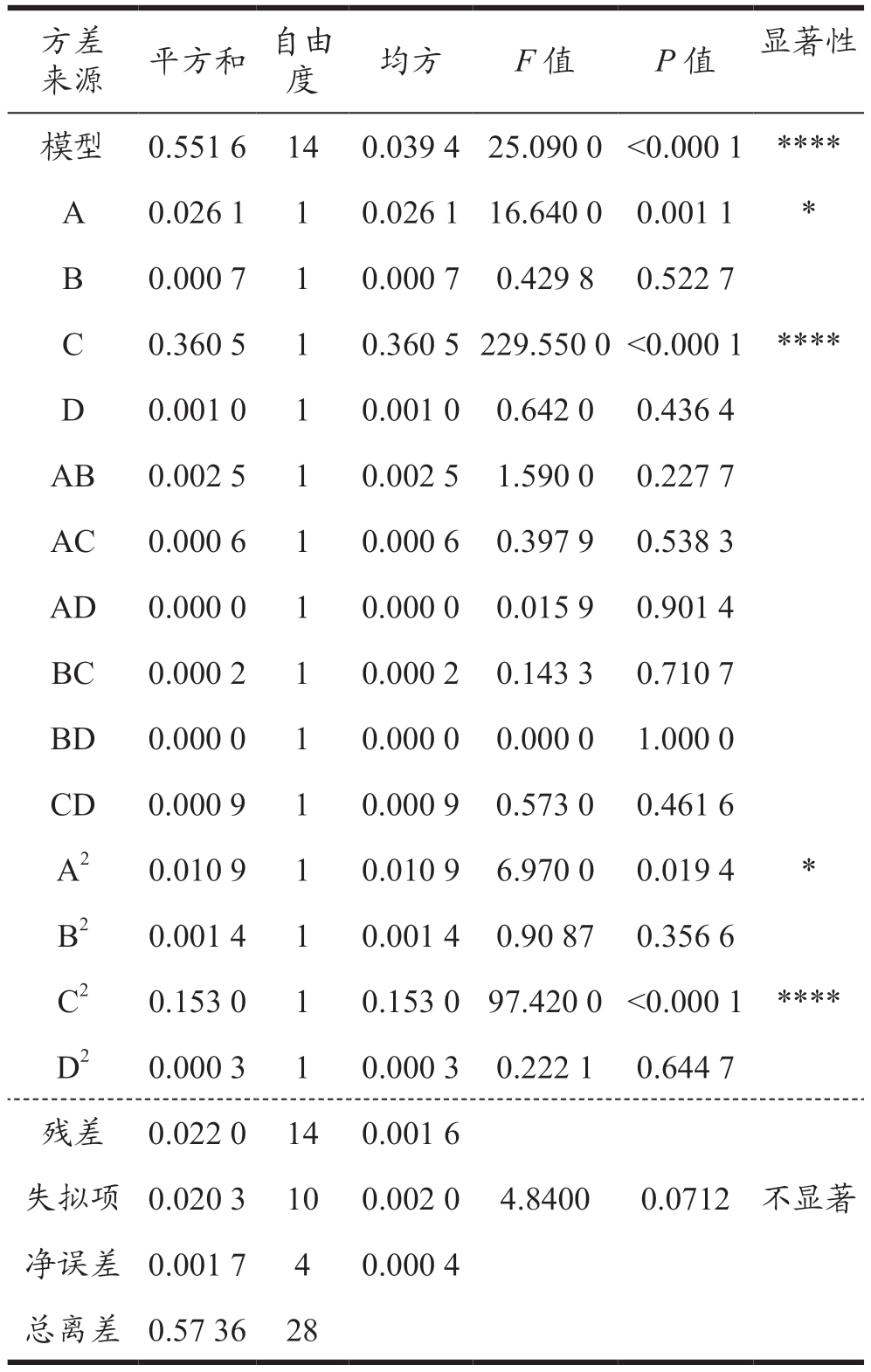
注:A=pH 值;B=温度;C=底物质量分数;D=时间,下表同。
?
DPPH 自由基清除率=0.818 0-0.467A+0.007 5B+0.173 3C+0.009 2D+0.025 0AB-0.002 5AD-0.012 5AC+0.007 5BC+0.000 0BD-0.015 0CD-0.041 1A2-0.014 8B2-0.015 36C2-0.007 3D2
ABTS+自由基清除率=0.846 0+0.001 7A-0.004 2B+0.294 2C-0.003 3D+0.032 5AB-0.005 0AC-0.047 5AD-0.002 5BC-0.012 5BD+0.000 0CD-0.071 3A2-0.002 6B2-0.165 1C2-0.006 3D2
P 值用于检验回归模型是否有效的标准,通过表4、表5 可以得到不管是DPPH· 清除率还是ABTS+· 清除率作为响应值,模型的P 值均小于0.000 1,因此可以判断实验所用的模型差异十分显著,且具有统计学意义。同时这两个模型的失拟项的P 值均大于0.05,因此可以得出该模型并未出现明显的失拟情况,再次证明模型的可用性和统计学意义。基于以上信息可以得出该模型可用于优化蚕蛹蛋白的酶解工艺以得到具有更好抗氧化活性的蚕蛹肽。在对回归方程进行分析可以发现对于蚕蛹肽的抗氧化活性而言底物质量分数的影响最为显著。
表5 ABTS方差分析
Table 5 ABTS analysis of variance
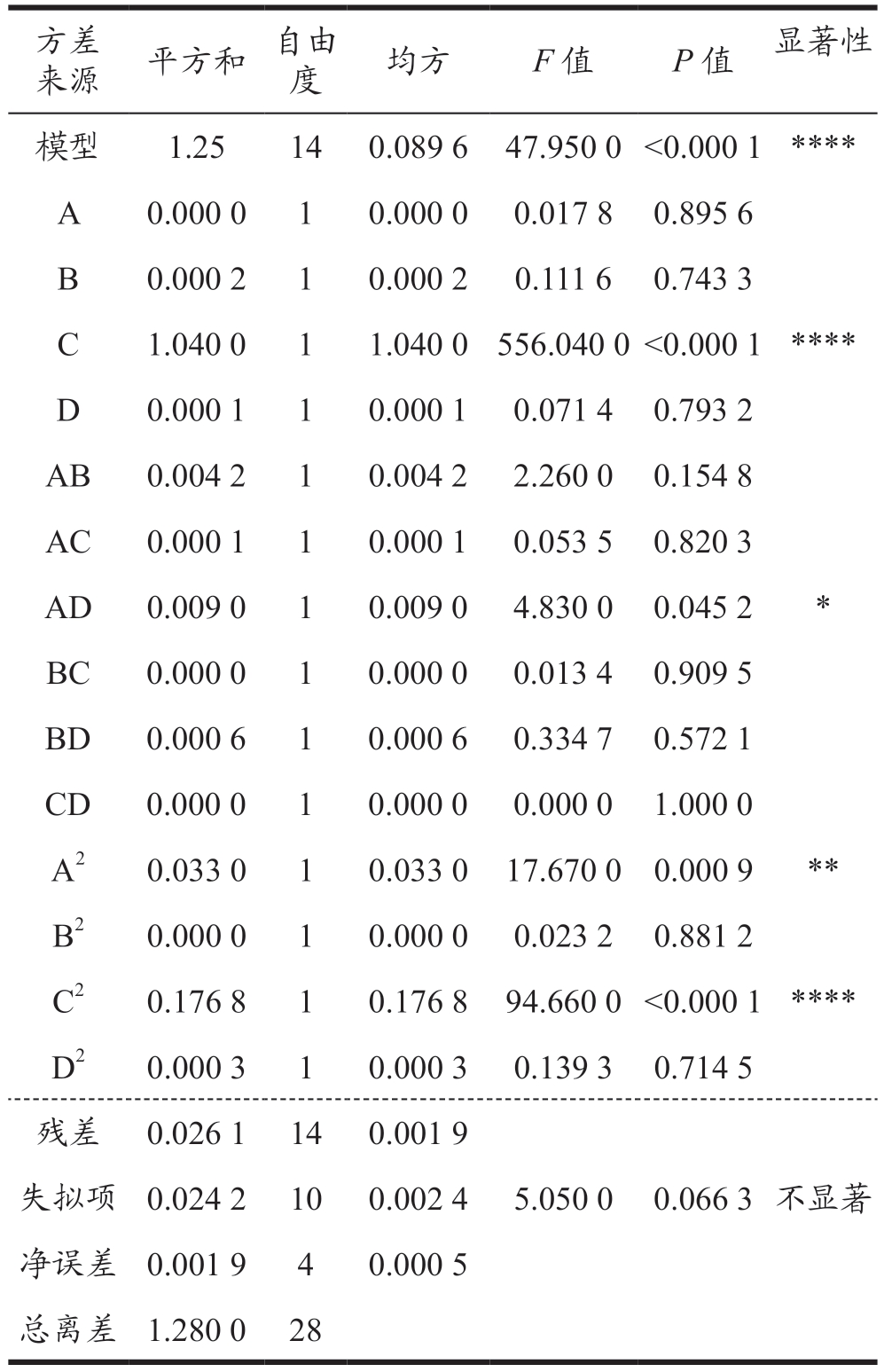
?
2.3.3 响应面及等高线分析
为了可以更加直观的反映出各个因素之间交互作用的强弱绘制出了等高线图和3D 响应面图,通过图7、图8 可以看出对于DPPH 自由基清除率而言pH 值与温度、pH 值与时间、温度与时间之间的交互作比较强,对于ABTS+自由基清除率而言pH 值与温度、pH 值与底物质量分数之间交互作用比较强。
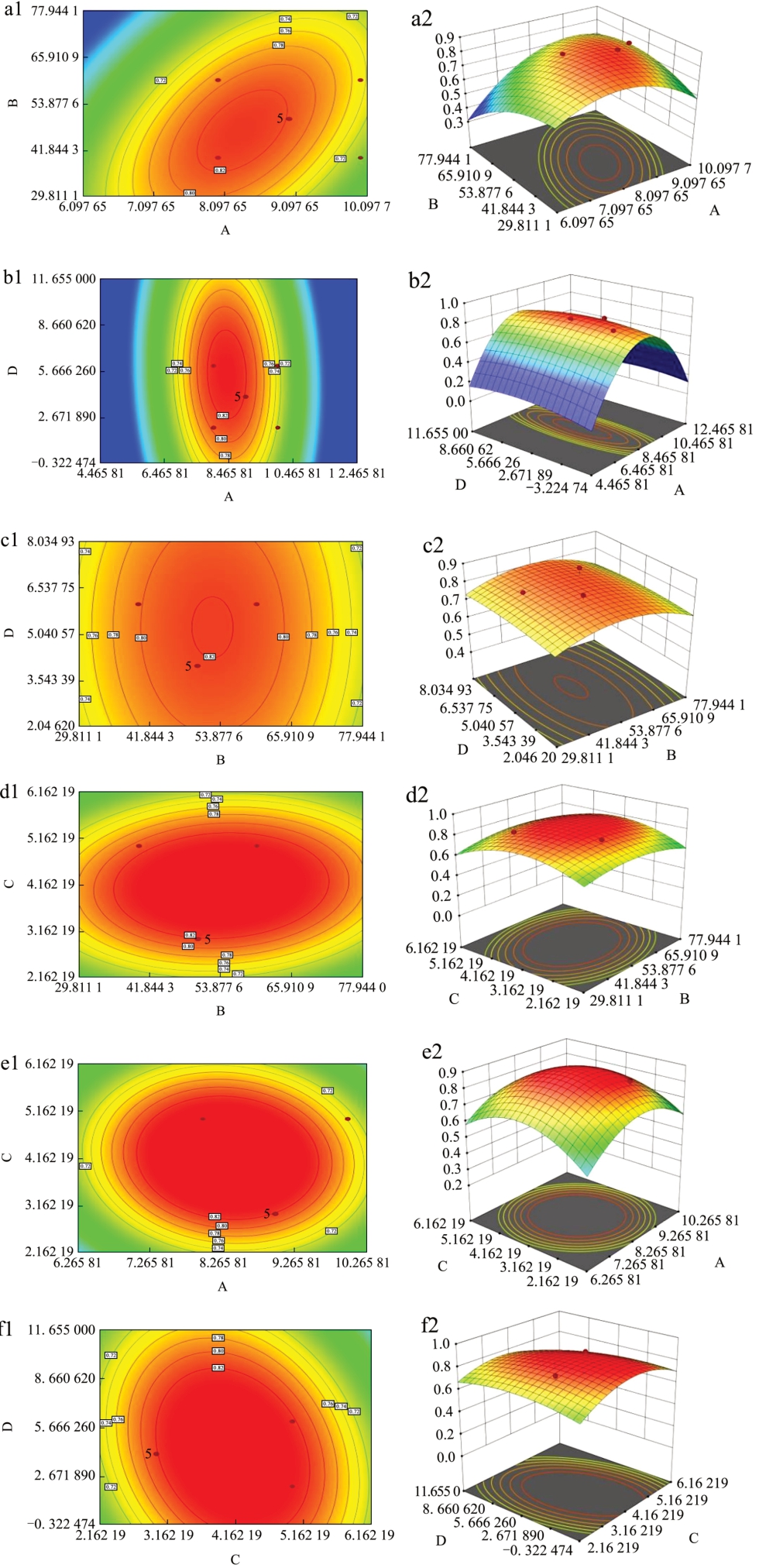
图7 DPPH 自由基清除率自由基响应面及等高线
Fig.7 DPPH response surface and contour map
注:A 为pH 值,B 为温度,C 为底物质量分数,D 为时间,下图同。
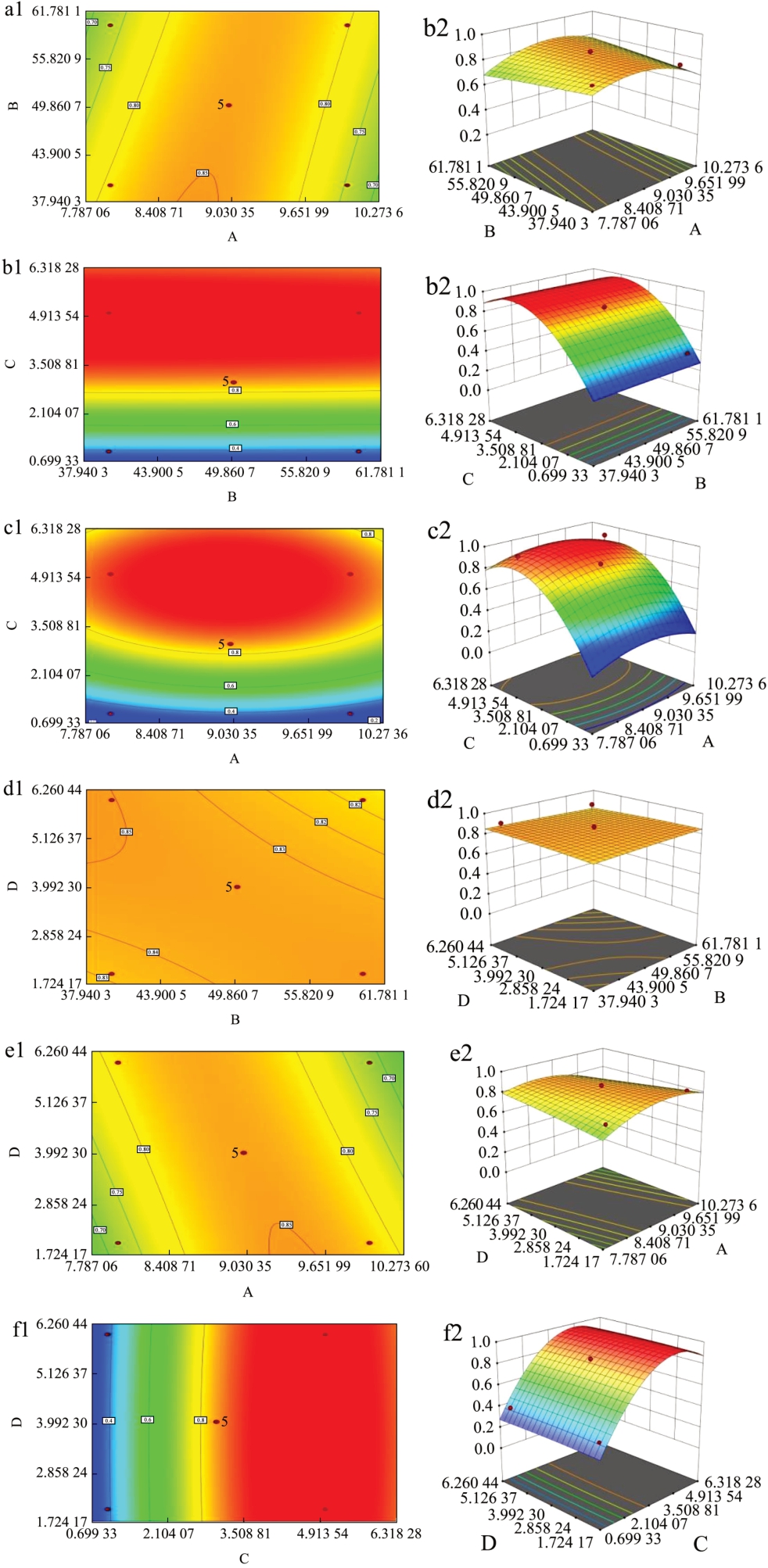
图8 ABTS+清除率响应面及等高线图
Fig.8 ABTS+ response surface and contour map
2.3.4 工艺流程最优条件的确认
将2.3.2 中得到的方程导数化后求极值(最大值)可以得到pH 值9.0、温度48 ℃、底物质量分数4.1%、反应时间2 h 此时的DPPH 和ABTS+自由基清除率的预测值分别为86.00%和96.00%,与卢楠等 [10] 的研究相比,通过双响应值的响应面分析得到的工艺流程有着相对明显的优势,反应时间从2.45 h 缩短至2 h,酶解温度从50 ℃下降到48 ℃。
2.4 蚕蛹肽体内外抗氧化活性鉴定
2.4.1 体外抗氧化活性检测与评价
通过对单因素实验结果进行分析发现DPPH 自由基清除率可以更显著的反应蚕蛹肽抗氧化活性,因此选用此指标作为蚕蛹蛋白水解肽体外抗氧化活性检测的指标。如图9 所示,使用该工艺流程制备而得的蚕蛹肽DPPH 自由基清除率为83.62%与预测值86.00%的相对误差为2.77%,这再次表明该模型可以较好的反应各因素与响应值之间的关系。同时与质量分数的Vc(0.2 mg/mL)比较发现用该方法制备的蚕蛹肽体外抗氧化活性可以达到维生素C 的89.10%。
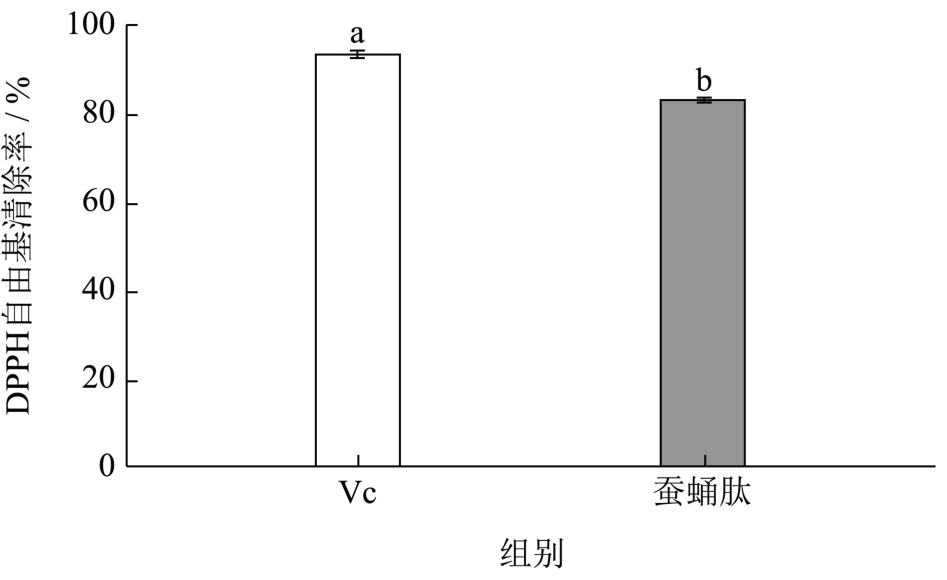
图9 蚕蛹肽体外抗氧化活性比较
Fig.9 Comparison of antioxidant activity of silkworm pupa peptide in vitro
2.4.2 小鼠血清中抗氧化酶系的影响
由表6 可以看出使用蚕蛹肽治疗的小鼠相较于模型组血清中的各项抗氧化酶系指标均得到改善,血清CK 的含量不论是在低剂量组还是高剂量组中均有显著的降低,相比模型组分别降低了39.22%和49.02%。CAT、SOD、T-AOC、GSH-PX 等指标高剂量组与模型组相比均有所上升且差异明显(P<0.05),分别上升167.04%、36.34%、36.19%、16.39%,大部分指标都能恢复到与空白组的相同水平。因此可以得出蚕蛹蛋白水解肽对于D-半乳糖所引起的氧化损伤有着一定的治疗作用。
表6 蚕蛹肽对小鼠血清中抗氧化酶系的影响(U/mL)
Table 6 Effect of silkworm chrysalis peptide on serum antioxidant enzyme system in mice
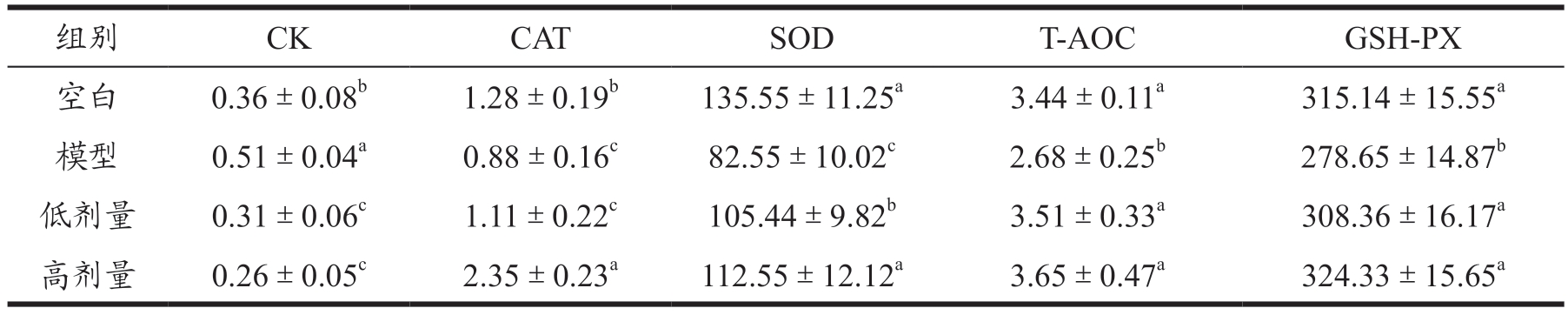
注:同列右肩不同的小写字母表示具有显著差异(P<0.05);下表同。
?
2.4.3 小鼠肝脏中抗氧化酶系的影响
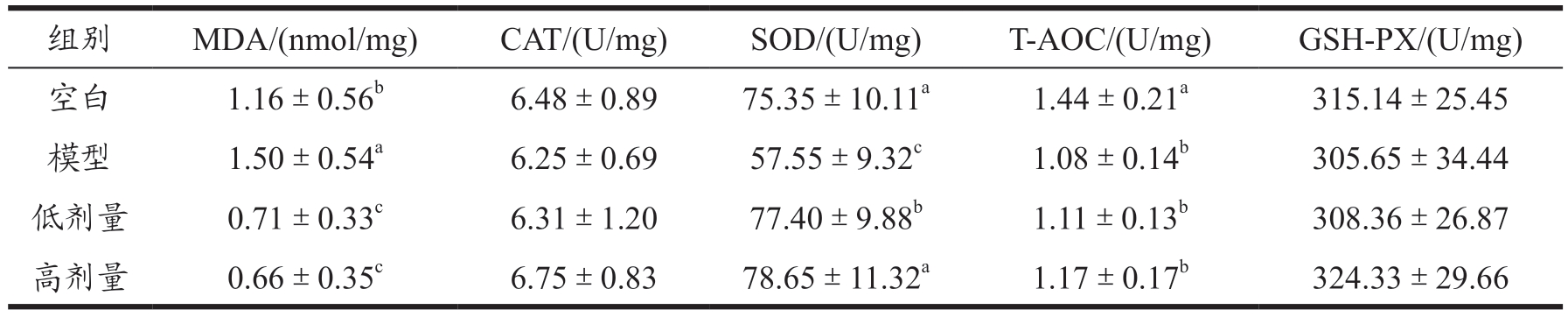
由表7 可以看出模型组小鼠肝脏中MDA、SOD 的指标与治疗组的小鼠之间均出现了显著的差异(P<0.05),与模型组相比经过低剂量和高剂量蚕蛹肽的治疗使MDA 分别降低52.67%和56.00%,使SOD 上升34.49%和36.66%,MDA 含量的变化可以反应细胞膜上脂质过氧化的程度 [17] ,因此可以得出蚕蛹肽具有恢复肝脏细胞脂质过氧化损伤的功效。与血清中CAT、GSH-PX 的影响做比较发现蚕蛹肽并不会使正常指标发生改变。因此可以得出蚕蛹肽可以缓解由于D- 半乳糖引起的肝脏细胞的脂质过氧化损伤,而不影响其他正常的生理功能,推测其原因可能是蚕蛹肽可能通过竞争受体的方式发挥作用。
表7 蚕蛹肽对小鼠肝脏中抗氧化酶系的影响
Table 7 Effect of silkworm chrysalis peptide on antioxidant enzyme system in mouse liver
?
3 结论
本实验在基于响应面的实验基础上采用了以DPPH 和ABTS+自由基清除率为指标的双响应面法作为更客观的分析方法,探讨了温度、反应时间、pH 值、底物质量分数对于碱性蛋白酶酶解蚕蛹蛋白后得到的抗氧化活性的影响,得出了最佳的酶解条件为pH 值9.0、温度48 ℃、底物质量分数4.1%、反应时间2 h、酶质量分数3.0%与现有的研究相比优化了酶解时间和酶解温度。在体外验证实验中该法制备而得的蚕蛹肽DPPH 自由基清除率达到了同质量浓度Vc 的89.10%,接着评价了其在动物体内的抗氧化活性,发现其具有明显的体内抗氧化活性,血清以及肝脏抗氧化酶系在高剂量组的蚕蛹肽治疗下各异常指标均有显著改善(与模型组相比P<0.05),且在肝脏组织中蚕蛹肽对肝脏细胞脂质过氧化累计有着消除的作用。以上研究发现为进一步开发利用蚕蛹肽提供了实验依据。
[1] 李庆荣,廖森泰,杨琼,等.一种高抗菌活性的蚕蛹粉、鱼配合饲料添加剂及制备方法和应用:中国,CN11603495 6A[P] .2023-05-02
[2] 沈圆圆,于福田,秦雅莉,等.纳豆菌液态发酵制备蚕蛹肽的工艺优化及其抗炎活性研究 [J] .食品工业科技,2022,43(3):162-71.
[3] WU Q Y, JIA J Q, YAN H, et al. A novel angiotensin-I converting enzyme (ACE) inhibitory peptide from gastrointestinal protease hydrolysate of silkworm pupa(Bombyx mori) protein:Biochemical characterization and molecular docking study [J] . Peptides, 2015, 68:17-24.
[4] LUO F L, FU Y, MA L, et al. Exploration of dipeptidyl peptidase-IV (DPP-IV) inhibitory peptides from silkworm pupae (Bombyx mori) proteins based on in silico and in vitro assessments [J] . Journal of Agricultural and Food Chemistry, 2022, 70(12):3862-3871.
[5] FORMAN H J, ZHANG H Q. Targeting oxidative stress in disease:promise and limitations of antioxidant therapy [J] .Nature Reviews Drug Discovery, 2021, 20(8):652-652.
[6] GLAVIND J, HARTMANN S, CLEMMESEN J, et al.Studies on the role of lipoperoxides in human pathology. 2. the presence of peroxidized lipids in the atherosclerotic aorta [J] .Acta Pathologica Et Microbiologica Scandinavica, 1952,30(1):1-6.
[7] TOUYZ R M, RIOS F J, ALVES-LOPES R, et al.Oxidative stress:a unifying paradigm in hypertension [J] .Canadian Journal of Cardiology, 2020, 36(5):659-670.
[8] ANSARI M A, SCHEFF S W. Oxidative stress in the progression of alzheimer disease in the frontal cortex [J] .Journal of Neuropathology and Experimental Neurology,2010, 69(2):155-67.
[9] 蔡沙,何建军,张国忠,等.蚕蛹蛋白酶解工艺及其水解产物抗氧化性 [J] .食品工业,2019,40(6):77-82.
[10] 卢楠,廖鲜艳,翁新楚,等.蚕蛹抗氧化肽的制备及其体外抗氧化活性评价 [J] .上海大学学报(自然科学版),2013,19(2):215-20.
[11] 李志永.蚕蛹蛋白免疫肽的分离纯化、结构鉴定及功能分析 [D] 镇江:江苏科技大学,2019.
[12] BRAND-WILLIAMS W, CUVELIER M E, BERSET C. Use of a free-radical method to evaluate antioxidant activity [J] . Food Science and Technology-Lebensmittel-Wissenschaft & Technologie, 1995, 28(1):25-30.
[13] LI X, LIN J, GAO Y, et al. Antioxidant activity and mechanism of Rhizoma cimicifugae [J] . Chemistry Centcal Journal, 2012, 6(1):140.
[14] SUN K, YANG P, ZHAO R, et al. Matrine attenuates D-galactose-induced aging-related behavior in mice via inhibition of cellular senescence and oxidative stress [J] .Oxid Med Cell Longev, 2018, 2018:7108604.
[15] 刘云姣,张海燕,刘淑晗,等.响应面优化南极磷虾蛋白酶解工艺及蛋白肽组分分析 [J] .现代食品科技,2019,35(1):144-151,280.
[16] 林燕,陈计峦,胡小松,等.酶解核桃蛋白制备抗氧化肽的研究 [J] .食品工业科技,2011,32(4):204-207,12.
[17] AYALA A, MUNOZ M F, ARGUELLES S. Lipid peroxidation:production, metabolism, and signaling mechanisms of malondialdehyde and 4-hydroxy-2-nonenal [J] . Oxidative Medicine and Cellular Longevity,2014, 2014:360438.