膳食多酚具有抗氧化、抗炎、抑菌等多种生物学效益,广泛存在于植源性食品中。然而,由于多酚中含有双键、酚羟基等官能团,具有捕获并清除自由基的能力,因此膳食多酚化学活跃度高、稳定性差,对光、热等环境因素敏感 [1,2] 。这种化学特性限制了膳食多酚在食品工业中的应用,为了改善膳食多酚的这一性质缺陷,乳液、纳米颗粒、脂质体等运载体系已广泛应用于膳食多酚的包封与递送,这些运载体系不仅可以增加膳食多酚的稳定性,还能提升膳食多酚的生物利用度 [3] 。在上述运载体系中,乳液体系的包封量大、损耗低且制备过程简单,因此广受青睐。虽然乳液体系有诸多益处,但乳液是一种热力学不稳定体系,在长时间贮藏下会发生破乳、分层等现象 [4] ,其次,受乳化剂性质影响,乳液的加工过程中还需要考虑温度、盐、pH 值等因素 [5] ,此外,乳液体系由流动相和分散相组成,制备后通常具有质量大、体积大、不易储存和运输等特点。因此,将荷载小分子活性物质的乳液体系进行“降体积、稳态化”将是未来食品工业的发展趋势。
静电纺丝是一种简单、高效地制备纳米纤维的手段,其设备主要由高压电源、带金属喷头的注射器、收集装置三部分构成 [6] 。其原理是利用高电压和极低电流的静电势来制造超细纤维的技术 [7] 。仪器工作时将纺丝溶液装于注射器内并置于高压电场下,高压电源的正极和负极分别与注射器针头和接受装置连接,随着注射泵的推进,液滴会从金属针里挤出,此时悬挂的液滴在高压环境下,溶液由球状被拉伸成圆锥状,而当静电斥力克服表面张力时,液滴会以丝状形态从针头喷出,并且在静电斥力的作用下被快速鞭打或快速运动,最终静电纺丝纳米纤维沉积在接受装置上 [8] 。静电纺丝所制备的纳米纤维不仅具有纤维空隙结构还具有较高的比表面积,因此,能够应用于人造皮肤、保护活性物质避免受到环境影响、药物递送及增强药物缓释性等领域中。目前,已有大量关于静电纺丝包封活性物质的相关研究,Hosseini 等 [9] 通过静电纺丝技术将活性肽封装于PVA 制备的纳米纤维中,极大地提高了材料抗氧化性;Doğan 等 [10] 利用静电纺丝技术实现了多橄榄叶中多酚物质值保护,在放置长时间后依然能够保持良好的生物活性。
目前,在食品、药品领域中常用的静电纺丝助纺剂为PUL 和PVA 两种。其中,PUL 是一种微生物类多糖,因其具有良好的溶解性、成膜性和粘性,常被用作静电纺丝制备工艺中,而PVA 则是一种可降解的生物高分子材料,具有良好的成膜性、弹性、溶胀性、化学稳定性及安全无毒等优点 [11] 。这两种助纺剂可以单独使用,也可以混合使用,有研究报道,将PUL 和PVA 按照7:3 的比例混合后进行纺丝,可显著提升所荷载茶多酚的稳定性 [12] 。
本文以两种植物来源的多酚(姜黄素、橙皮苷)为指示剂,以SBP 所构建的乳液体系对多酚进行一次包封,随后,分别以PUL 和PVA 为助纺剂,通过静电纺丝技术对荷载多酚的乳液体系进行二次包封,通过分析不同包封体系的性质以及不同包封体系中多酚抗氧化活性的变化,研究甜菜果胶构建的双重包封体系对多酚活性的影响。
1 材料与方法
1.1 试剂与试剂
甜菜果胶SBP 提取自甜菜粕、中链甘油三酯MCT,上海源叶生物科技有限公司;无水乙醇、溴化钾,广州化学试剂厂;ABTS、DPPH、聚乙烯醇(黏度45.0~55.0 mPa·s),上海麦克林生化科技股份有限公司;普鲁兰多糖、氨水,上海易恩化学技术有限公司;柠檬酸、苯甲酸钠,西陇化工股份有限公司;二氢黄酮苷(橙皮苷),上海阿拉丁生化科技股份有限公司。
1.2 仪器与设备
D-130 均质机,德国维根技术有限公司;SCIENTZ-IID 细胞破碎仪,宁波新芝生物科技有限公司;PHS-3C pH 计,仪电科学仪器股份有限公司;Varioskan LUX 全自动酶标仪,美国赛默飞世尔科技公司;SS-2535H 静电纺丝仪器,永康乐业科技发展有限公司;JDF05 桌面型静电纺丝机,湖南长沙纳仪仪器有限公司;TENSOR 27 傅里叶红外光谱仪,Bruker 6130 能谱仪,德国Bruker 公司,道一B60F 光学显微镜,广州道一科学技术有限公司;Mettler TGA/DSC3+差示扫描量热仪,瑞士梅特勒托利多科技;Zetasizer Nano ZS 马尔文激光粒径仪,英国马尔文仪器有限公司;HAAKE MARS III 模块化高级流变仪,美国赛默飞世尔科技公司;3H30RI 冷冻高速离心机,湖南赫西仪器装备有限公司。
1.3 实验方法
1.3.1 乳液的制备
取适量SBP 粉末溶解于含有0.1%的苯甲酸钠溶液中,配成1.5 wt.%的水溶液,取适量姜黄素溶解于MCT 中配成0.1%的油相,水油两相以9:1(m/m)比例混合后再加入0.05 wt.%橙皮苷,随后在均质(12 000 r/min,3 min)和超声(262 W,9 min,5 s开/5 s 关)下制备成乳液,放于4 ℃冰箱备用,10 h 内测定完成相关指标。
1.3.2 乳液粒径电位的测定
粒径和电位的测量参考Kharat 等 [13] 的研究,并进行了一些修改。使用纳米粒度仪(Malven Mastersizer,NE)测量乳液液滴的粒径大小及分布。乳液样品用去离子水稀释100 倍,加入1 mL 稀释液于纳米粒度仪样品池中,测定其粒径平均大小。电位测试的样品与前面粒径检测的样品稀释操作一致,取相同体积稀释后的乳液样品1 mL 放置于电位池中测定。测试温度25 ℃,样品测定前仪器的平衡时间为120 s,每个样品重复测量3 次,每一组样品重复测量三次。
1.3.3 乳液的抗氧化
ABTS+自由基清除实验参考王鑫磊等 [14] 的方法,并做了部分修改,具体操作如下:用去离子水配置7 mmol/L 浓度的ABTS 水溶液及2.45 mmol/L的过硫酸钾水溶液,两者混合后在室温下避光保存12 h,使用前使用去离子水稀释ABTS 溶液使得其吸光度在0.7±0.05。随后样品和ABTS 水溶液按照1:4 的比例混合,在避光处反应30 min 后于734 nm处在全自动酶标仪下测定其吸光值;去离子水替代ABTS 溶液作为空白。样品在实验前用去离子水稀释了100 倍。
式中:
C1——ABTS+自由基清除率,%;
A1——实际样品的吸光值;
A0——空白样品的吸光值。
DPPH 自由基清除实验参考王鑫磊等 [14] 的方法,并做了部分修改,具体操作如下:称取适量的DPPH 粉末配成0.1 mmol/L 的DPPH 乙醇溶液,在避光环境中反应2 h。取1mL 乳液和1 mL 的DPPH乙醇溶液混合均匀后,避光反应30 min。随后离心后取上清液于517 nm 处在全自动酶标仪测定其吸光度值,计算公式如下所示:
式中:
C2——DPPH 清除率,%;
A2——样品加DPPH 醇溶液的吸光值;
A1——样品加乙醇的吸光值;
A0——DPPH 加乙醇的吸光值。
1.3.4 乳液的电导率和流变学测试
乳液电导率的测定参考杜震等 [7] 的方法,通过电导率仪在室温下测定纺丝溶液的电导率。乳液的流变学性质测试参考Li 等 [15] 的方法,并进行了一些修改,具体操作如下:使用模块化高级流变仪,配置平行板(P60 TiL,直径60 mm,间隙尺寸1 mm),测量乳液的流变特性,流变仪的剪切速率范围设置为0.01~100 s-1,操作温度设定为25 ℃,测定了乳液的稳定剪切粘度用η (Pa·s)表示。
1.3.5 乳液纳米纤维的制备
PUL 纳米纤维的制备参数如下:将10 mL 含有20 wt.%普鲁兰多糖的乳液置于JDF05 桌面型静电纺丝机上进行静电纺丝。随后在温度30.9~35.4 ℃,湿度23%~32%,电压16 kV,泵流速0.2 mL/h,收集转速30 mm/s,往返距离130 mm,喷丝口距离接收板距离16 cm 的条件下用油纸滚动接收待纺丝溶液。
PVA 纳米纤维的制备条件:先将聚乙烯醇和去离子水混合后在60 ℃条件下加热制备成透明的15 wt.%聚乙烯醇溶液。随后将聚乙烯醇溶液和乳液按照2:1(m/m)的比例混合,随后在温度25 ℃,湿度20%~30%,正电压:20 kV,负电压:-20 kV,泵流量0.2 mL/h,收集转速30 mm/s,往返距离130 mm,喷丝口距离接收板距离16 cm 的条件下将10 mL 纺丝溶液置于JDF05 桌面型静电纺丝机上进行静电纺丝,用油纸滚动接收待纺丝溶液。
1.3.6 乳液和膜的紫外光照稳定性
样品的紫外光稳定性参考Wang 等 [16] 的研究,并做出适当修改,具体操作如下:将乳液和纳米纤维置于紫外光(20 W)下照射6 h,每2 h 取一次样并检测不同样品的抗氧化性。
1.3.7 纳米纤维的抗氧化测试
纳米纤维的抗氧化性能通过DPPH 和ABTS+自由基清除实验测定,方法参考Zhang 等 [17] 的研究,并做出适当修改,具体操作如下:取3 mL 0.1 mmol/L的DPPH 乙醇溶液与10 mg/mL 膜溶液在暗处反应30 min,离心后取上清液在517 nm 测得吸光值。ABTS+自由基清除实验和DPPH 类似,4 mL 的ABTS 工作液和膜溶液反应10 min,离心后取上清液在734 nm 处测得吸光值。

式中:
C3——纳米纤维的自由基清率,%;
A1——空白对照的吸光值;
A2——膜对自由基清除的吸光值。
1.3.8 纳米纤维的傅里叶红外光谱测试
FT-IR 的测试方法参考Zhang 等 [17] 的研究,并做出些许修改,具体操作如下:取适量纳米纤维按照1:150(m/m)的比例和溴化钾混合研磨成粉末。在15 MPa 的压力下把粉末挤压成半透明的圆片。傅里叶吸收光谱仪采用4 cm-1 分辨率扫描,扫描区间为4 000~400 cm-1,扫描频率为32 次。
1.3.9 纳米纤维的扫描电镜分析
从各组纳米纤维上剪取面积为5 mm×5 mm 的小块样品,经喷金处理后通过场发射扫描电子显微镜(SEM)在10 kV 电压下观察纳米纤维的微观形貌,使用Image J 软件测量不同纳米纤维的直径,取其算术平均值,同时分析直径分布。
1.3.10 纳米纤维的热重分析
在50 mL/min 的氮气流下,将3~5 mg 的纳米纤维块放置于铝坩埚中,用Mettler TGA/DSC3+差示扫描量热仪对样品进行扫描,以10 ℃/min 的速率等速升温,从30 ℃加热到800 ℃,得到曲线图。
1.3.11 数据统计与分析
本研究中,除特殊声明外,每个实验均进行了3次重复。采用SPSS 19.0 统计分析系统进行统计学分析,数据以平均值±标准偏差的形式呈现,P<0.05代表差异显著。另外,采用Origin 2021 和Image J图像分析软件生成所需图表。
2 结果与讨论
2.1 乳液的理化性质
2.1.1 乳液的粒径、电位、微观形貌及抗氧化活性
SBP 乳液的外观如图1a 所示,经过超声均质后,在肉眼观察下,荷载姜黄素-橙皮苷的乳液质地均匀,未观察到明显分层的现象,乳液呈现为黄色的非牛顿流体状,该颜色是由姜黄素导致的。新鲜制备的乳液粒径为597.17 nm、PDI 小于0.3(表1),表明该乳液具有良好的分散性。从图1b可知,乳液的在显微镜下呈现为大小不一的分散球形,无聚集体,乳液液滴的粒径分布呈现为单峰分布,这与动态光散射测试结果一致。
表1 乳液的粒径、zeta电位、PDI及电位值
Table 1 Particle size, zeta potential, PDI and potential value of emulsion

注:SBP-Cur-Hes-O/W:甜菜果胶-姜黄素-橙皮苷乳液。
?
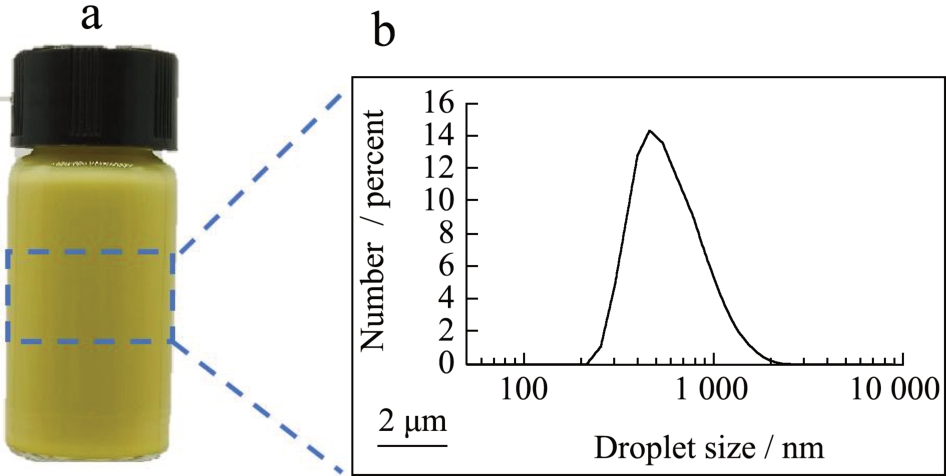
图1 乳液显微镜及粒径分布图
Fig.1 The microscope images and particle size distribution of emulsion
新鲜制备的乳液电位值为-22.77 mV,高于大部分多糖所制备的乳液,这表明该乳液体系内的静电斥力较低,在贮藏期间内乳液可能会因为范德华力、重力等作用导致液乳液体系中出现聚集、聚并或絮凝等现象导致乳液失稳。为探究乳液体系对多酚稳定性的保护作用,对乳液进行了6 h 的紫外灯照射,结果如表2 所示,在紫外光照射6 h 条件下后,乳液对ABTS+自由基的清除率从40.23%下降至30.48%(P<0.05),对DPPH 自由基的清除率从60.28%下降至45.26%(P<0.05)。这些结果表明,由甜菜果胶所形成的乳液界面层对紫外光的抵抗效果较差,这是由于甜菜果胶的水合粒径通常较小,在油滴表面形成的界面膜通常不超过200 nm [18] ,因此,其无法提供足够的空间位阻抵抗紫外线对乳液中姜黄素和橙皮苷的破坏。
表2 乳液的自由基清除率
Table 2 The free radical scavenging rate of emulsion
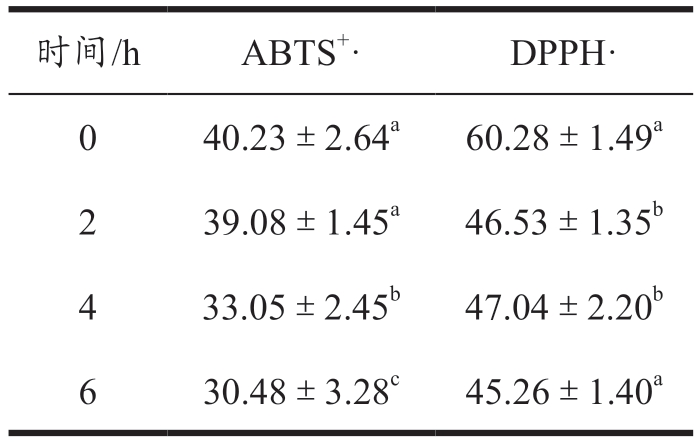
注:同列右肩不同的小写字母表示具有显著差异(P<0.05)。下表同。
?
2.1.2 乳液及纺丝液的电导率和流变性性质
有研究表明,纳米纤维纺丝之前的纺丝液流变学性质是判断其可否成功纺丝的关键因素 [7] ,PuNFs纺丝液和PvNFs 纺丝液的粘度主要由PUL 和PVA贡献,多糖和聚合物溶液的粘度会影响纺丝液中聚合物分子的交联程度 [8] ,此外,纺丝液的电导率也会对纺丝产生重要影响 [19] 。表3 和图2 展示了纳米纤维纺丝液的电导率和表观粘度,通常情况下,纺丝溶液有着更高的电导率及更低的粘度。随着剪切速率增加,纳米纤维纺丝液的表观粘度减小,表现出了非牛顿流体的剪切稀化性质,在检测中PuNFs纺丝液的表观粘度始终大于PvNFs 纺丝液的表观粘度,而PuNFs 纺丝液的电导率始终小于PvNFs 纺丝液。上述结果说明,PvNFs 纺丝液拥有的较高的电导率意味着射流上的电荷密度更多,在电场中受到的电场力增大,而较低的粘度则可以使纺丝液在喷丝的过程中更容易克服表面张力,有助于形成直径更小的纳米纤维 [20] 。
表3 纺丝液的电导率
Table 3 The conductivity of spinning solution

注:PuNFs 纺丝液:普鲁兰多糖制备的纺丝液,PvNFs纺丝液:聚乙烯醇制备的纺丝液。
?
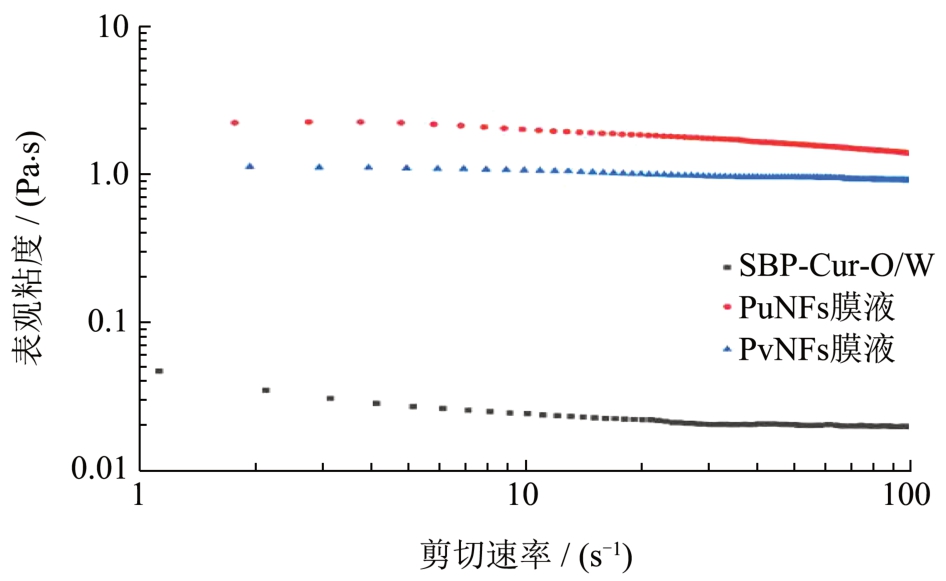
图2 乳液及纺丝液的表观黏度
Fig.2 The apparent viscosity of emulsion and spinning solution
2.2 纳米纤维性质的表征
2.2.1 纳米纤维的微观形貌
如图3 所示,在肉眼观察下,PuNFs 呈现薄而多孔的网状结构,且能观察到明显的黄色,而PvNFs 则表面平滑、质地柔软、几乎观察不到孔隙结构,颜色呈淡黄色。通过电镜对纳米纤维放大2 000 倍、5 000 倍和20 000 倍的进行观察,结果表明,两种助纺剂所制备的纳米纤维都呈现出多孔的三维网状结构,未发现明显黏连或团聚物,表明乳液在静电纺丝过程中被成功包封,然而,从图4b 中可观察到部分纳米纤维上存在纺锤状结构,这部分纺锤状结构可能是由于纺丝过程中乳液液滴未被充分拉伸或拉伸力不足所形成的 [21] 。使用Image J 对纳米纤维的直径进行数据分析,结果表明PuNFs 纳米纤维的平均直径为137.17 nm,主要分布在110~150 nm 之间。而PvNFs 纳米纤维的平均直径为89.07 nm,主要分布在50~130 nm 之间。该结果与2.1.2 所预测的结果一致,说明PvNFs 纺丝液的高导电率和低粘度可以使其受到更强的拉伸力从而抵抗溶液本身的变形阻力,形成更细的纳米纤维。另一方面,PuNFs 中存在大量的纺锤体使得所统计的平均直径更大。

图3 PuNFs(a)和PvNFs(b)的外观图
Fig.3 Physical image of PuNFs (a) and PvNFs (b)
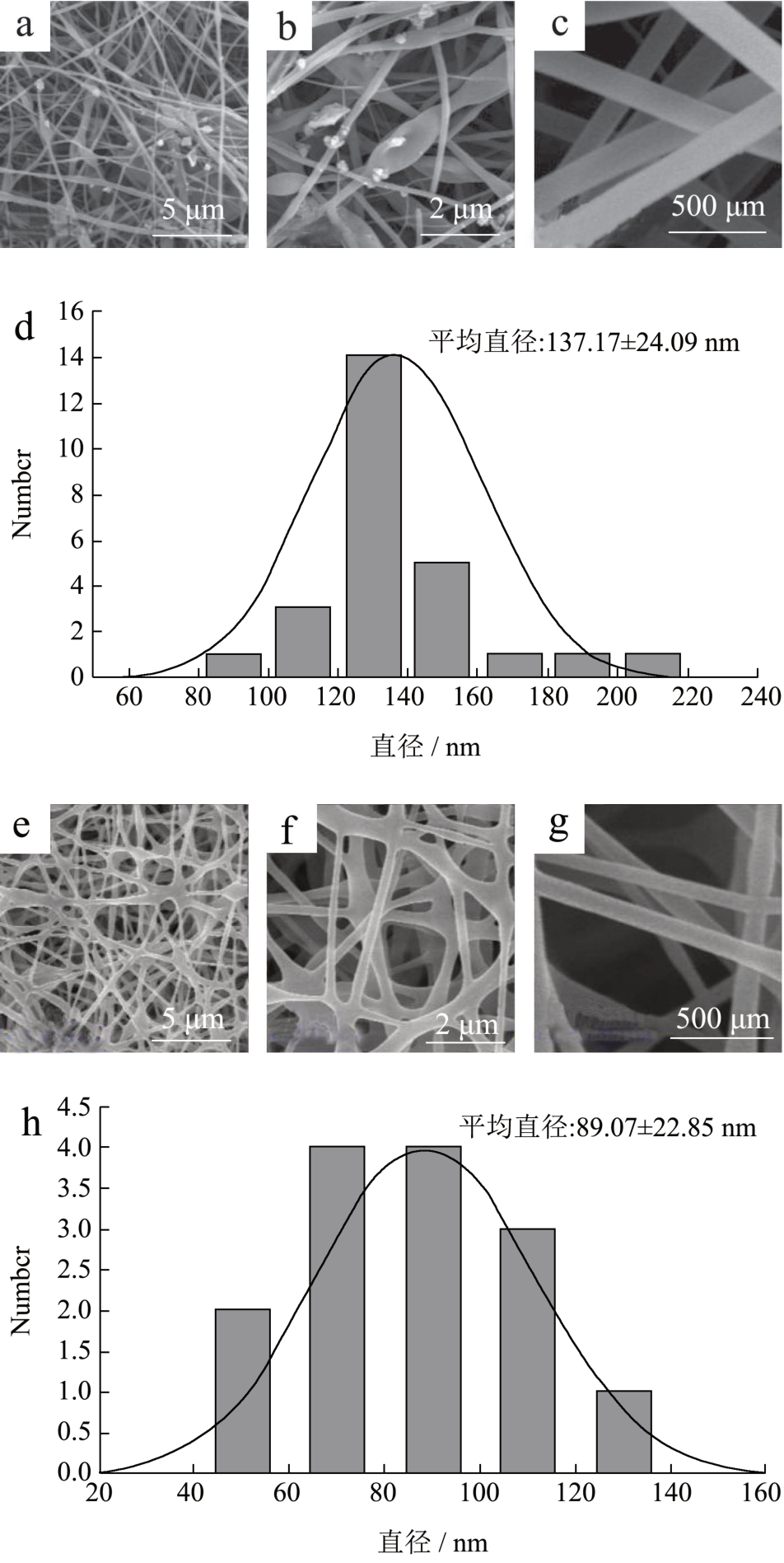
图4 PuNFs(a,b,c,d)和PvNFs (e,f,g,h)制备纺丝膜放大2 000、5 000 和20 000 倍的扫描电镜和直径分布图
Fig.4 SEM of PuNFs (a, b, c, d) and PvNFs (e, f, g, h)films magnified by 2 000, 5 000, 20 000 times and their diameter distribution
2.2.2 紫外光对纳米纤维抗氧化性质的影响
将纳米纤维置于紫外光照下处理6 h,其对ABTS+和DPPH 自由基的清除率变化如表4 所示。结果表明,纳米纤维在紫外灯照射处理后,对自由基的清除能力无显著影响(P>0.05),这说明乳液体系使用PUL 和PVA 作为助纺剂制备成纳米纤维后,PUL 和PVA 对紫外光有一定屏蔽作用,能够保护纤维内部封装的活性物质。纳米纤维的自由基的清除能力比乳液体系更强,这可能是由于PUL 和PVA 的添加所致,因为PUL 和PVA 的分子结构中均含大量羟基,具备提供电子捕获自由基的能力。
表4 PuNFs和PvNFs在6 h内的ABTS+和DPPH自由基清除率
Table 4 ABTS+ and DPPH free radical clearance of different samples within 6 h
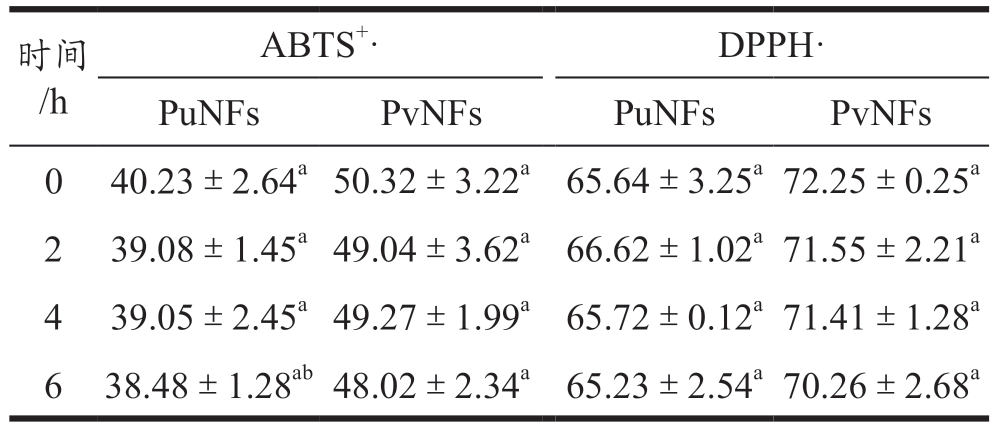
注:PuNFs:普鲁兰制备的纳米纤维,PvNFs:聚乙烯醇制备的纳米纤维。
?
2.2.3 纳米纤维的傅里叶红外光谱图
如图5 所示,SBP 谱图中在1 630 cm-1 出现的是游离羧基的红外吸收 [22] ,与SBP 相比,以PUL为助纺剂制备的纳米纤维红外图谱中并未出现新的吸收峰生成,说明PUL 与SBP 并未以任何形式的共价方式结合。如图3 所示,SBP、PUL、PVA 及两种纳米纤维在3 200~3 400 cm-1 之间都有吸收峰,该吸收峰是由于-OH 伸缩振动产生的吸收峰,与SBP 和PUL 相比,PuNFs 的-OH 伸缩振动峰的波数由3 440 cm-1 和3 443 cm-1 向低波数3 435 cm-1 移动,这充分表明了纳米纤维中SBP 和PUL 分子之间的氢键作用力增强;此外,样品在2 900~2 930 cm-1之间也有-CH2 和C-H 的对称和反对称伸缩振动的吸收峰 [23] 。如图5 所示,PUL 加入后,并未导致PuNFs 红外吸收峰形发生明显变化,在2 925 cm-1附近PuNFs 的红外吸收峰比PUL 和SBP 有更强,表明在该波数附近谱带和聚合物链中甲基的C-H 伸缩振动有关,该结果也表明纳米纤维形成后PUL 和SBP 之间的氢键加强 [24] 。PUL 在924 cm-1 和851 cm-1处分别对应的是α-1,4-糖苷键和α-1,6-糖苷键的吸收峰 [25] ,而PuNFs 和PvNFs 中分别检测到了PUL中糖苷键的特征峰和PVA 的红外特征峰,说明这两种物质在纳米纤维中几乎未被掩盖,即它们可能以“外壳”的形式存在于纳米纤维的表面。理论上来说,SBP在纳米纤维体系中,应当被包封在助纺剂中,然而,从图5 可以观察到SBP 在1 630 cm-1 附近的O-C-O 键伸缩振动峰,这说明部分乳液中的SBP 在纺丝的过程中也参与了纳米纤维“外壳”的形成过程,最直观的表现是,有部分乳液液滴以纺锤体的形式悬挂在纳米纤维上,说明乳液体系在该过程中界面已经遭受了一定程度的破坏。在PvNFs 中观察到的-OH 特征峰也从3 440 cm-1 附近移动到3 226 cm-1 波数段且变得宽而强,2 920 cm-1 处出现的-CH2 的吸收峰都表明了氢键在纳米纤维的形成过程中起到了重要作用 [26] 。
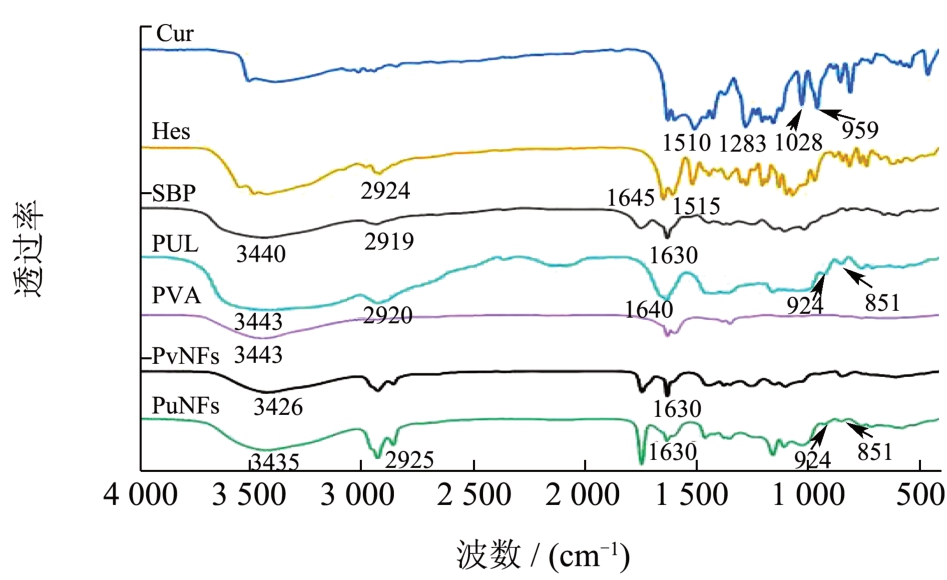
图5 各组分的红外光谱图
Fig.5 FT-IR of each component
姜黄素在1 510 cm-1 处的特征峰表示C=O 及苯环振动、在1 283 cm-1 和1 028 cm-1 处表示芳香环的拉伸振动和甲氧基C-O 的拉伸振动,在959 cm-1处表示芳香环中C-H 的振动 [27] 。橙皮苷在1 645 cm-1处的特征峰表示C=O 的拉伸振动、1 515 cm-1 处表示C=C 的拉伸振动 [28,29] 。在PuNFs 和PvNFs 的红外吸收峰中均不能观察到姜黄素和橙皮苷的特征峰,这表明姜黄素和橙皮苷被成功包封在纳米纤维体系中。
2.2.4 纳米纤维的热稳定性
TG 曲线通常用来表征样品的热稳定性。图6a为PuNFs 的TG 曲线,在初始阶段(30~100 ℃),当温度达到60 ℃时,纳米纤维质量损失主要是来源于纳米纤维中水分的蒸发;在第二阶段(100~250 ℃)时,质量有轻微的变化,这可能是由于在183 ℃时熔化后的姜黄素和橙皮苷等小分子物质在该温度上部分蒸发导致了体系的质量损失 [30] ,这与李婷等 [31] 的研究结果相似。在第三阶段(250~350 ℃)为膜质量损失的主要阶段,热重曲线剧烈下降主要是聚合物的广泛热降解所致,其中,姜黄素在温度超过254 ℃时,会大量分解挥发 [27] ,当温度达到316 ℃时,曲线下降得最快,这可能是因为普鲁兰多糖的质量损失在270~340 ℃温度区间,普鲁兰分子链的热降解所致 [32] 。在第四阶段期间(350~800 ℃),纳米纤维的质量损失主要是由于乳液-普鲁兰多糖纳米纤维结构的破坏和有机骨架的分解,在这个阶段姜黄素也达到了最大降解率 [33] ,此外在420 ℃出现的吸热峰也有可能来自酚类中化学键(C-O,C-C,C=O)的大量断裂 [34,35] 。
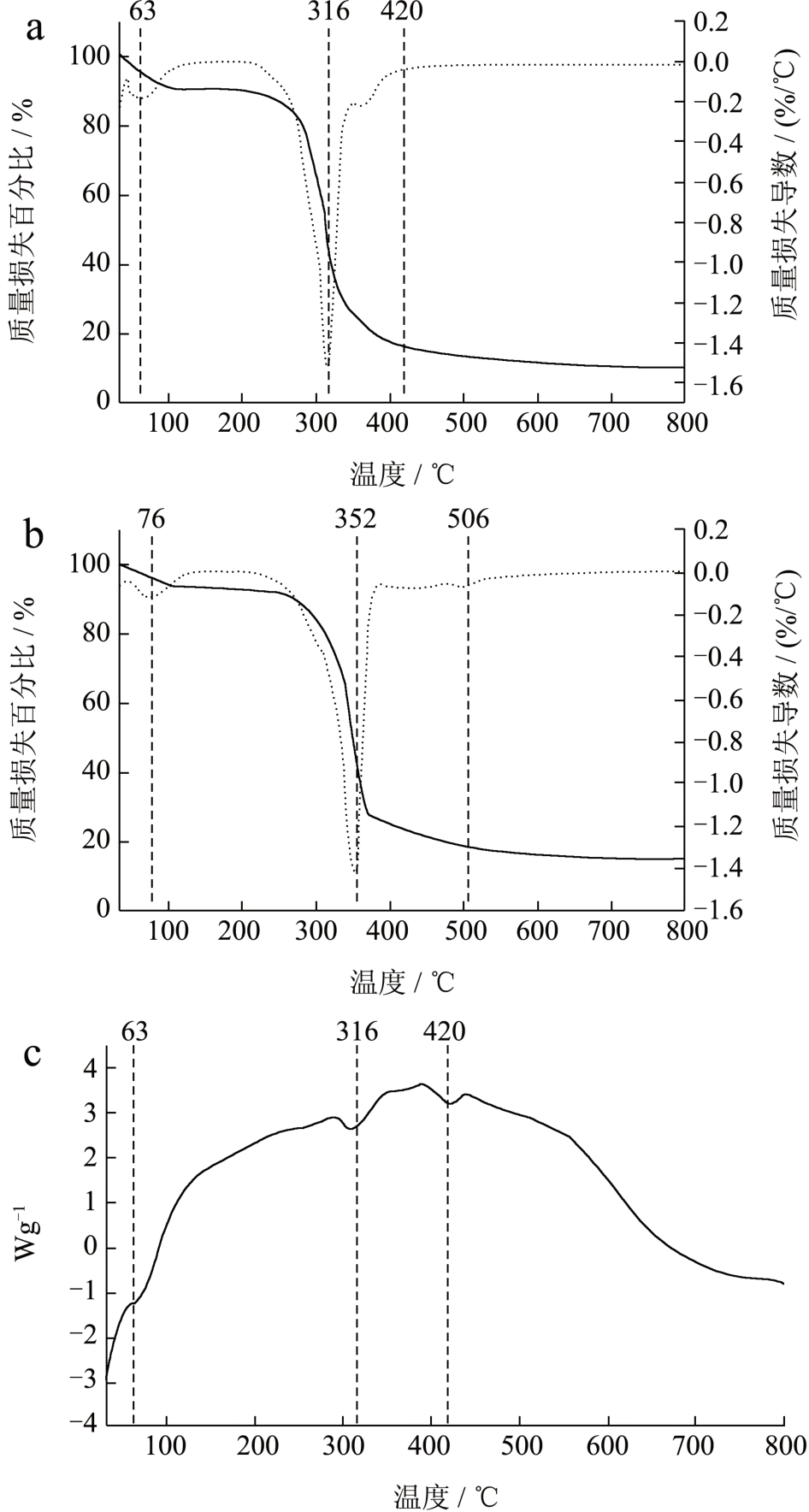
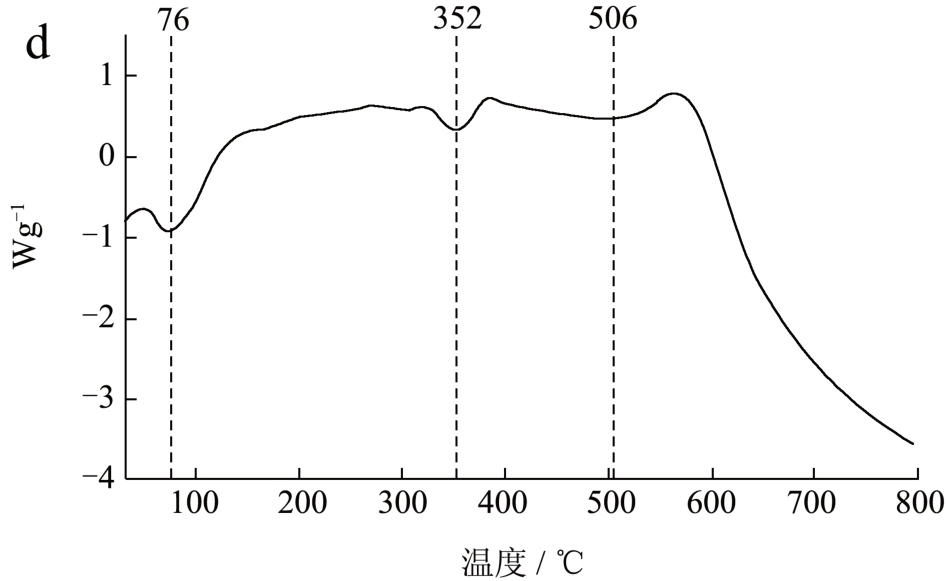
图6 PuNFs(a,b)和PvNFs(c,d)的热重和DSC
Fig.6 TG and DSC of PuNFs (a, b) and PvNFs (c, d)
图6b 为PvNFs 的TG 曲线,在该膜中质量损失主要阶段发生在352 ℃,在该温度下PVA 分子结构中侧链羟基消除反应会引起分子内和分子间的脱水,而当温度达到400 ℃以上时PVA 主链断裂 [36] 。在质量损失的各阶段中,PvNFs 质量损失的温度均要高于PuNFs,这表明使用PVA 作为助纺剂赋予了纳米纤维更强的热稳定性。
图6c 和6d 为PvNFs 和PuNFs 的热流图,在检测温度范围内观察到了PuNFs 有两个吸热峰,分别在63、310 和420 ℃,这些吸热峰的产生可能是样品从固体向熔融状态的转变 [37] 。在PvNFs 的热流图中可观察到,纳米纤维的吸热峰向更高温度的方向所移动,这可能是因为PvNFs 分子间相互作用力更强,使得纳米纤维中各分子的移动受阻,导致PvNFs 的熔融温度增大。
3 结论
通过两步法制备了SBP-Cur-Hes-O/W 乳液,向乳液中分别加入PUL 和PVA 两种助纺剂,通过静电纺丝技术将乳液制备成纳米纤维。研究结果表明,新鲜乳液液滴呈现为单峰分布且粒径为597.17 nm,在6 h 紫外光处理后,乳液的ABTS+自由基清除率从40.23%下降到30.48%(P<0.05),DPPH 自由基清除率从60.28%下降到了45.26%(P<0.05),说明乳液在体系对紫外光抵抗能力较弱,无法有效保护所荷载的多酚。利用静电纺丝将乳液制备成纳米纤维后,所荷载的多酚光稳定性得到了显著提升,在6 h 紫外光处理后,其自由基清除率无显著性变化(P>0.05)。
PUL 和PVA 两种助纺剂可从外观到性质对纳米纤维产生差异,如纺丝膜溶液粘度、电导率及膜直径、稳定性方面。PvNFs 膜溶液的粘度小于PuNFs 膜溶液,而电导率相反,溶液中高电荷量使得PvNFs 溶液在电场中能够被拉伸得更细,故相比于PuNFs(直径137.17 nm),PvNFs 拥有更小的纤维直径(直径89.07 nm)。通过TG 和DSC 曲线得知纳米纤维在温度不断升高的过程中,PuNFs 的吸热峰出现在63、316 及420 ℃处,均低于PvNFs 的吸热峰温度,这表明由PVA 制备的纳米纤维拥有更好的热稳定性。本文研究了基于甜菜果胶构建的膳食多酚双重包封体系及其对膳食多酚活性的影响,为纳米纤维在食品中的应用提供了重要的理论基础和科学依据。
[1] YU C Y, WANG D, YANG Z B, et al. Pharmacological effects of polyphenol phytochemicals on the intestinal inflammation via targeting TLR4/NF-κB signaling pathway [J] . International Journal of Molecular Sciences,2022, 23(13):6939.
[2] 黎欢.基于热凝胶膳食多酚载体的构建及其益生活性研究 [D] .无锡:江南大学,2023.
[3] KAN G Y, ZI Y, LI L, et al. Curcumin-encapsulated hydrophilic gelatin nanoparticle to stabilize fish oil-loaded Pickering emulsion [J] . Food Chemistry:X, 2023, 17:100590.
[4] 李亚凯,周存六,李锐,等.珠蛋白水解物对肌球蛋白大豆油乳液理化性质的影响 [J] .合肥工业大学学报(自然科学版),2024,47(2):275-282.
[5] YE A Q, SINGH H J F B. Formation of multilayers at the interface of oil-in-water emulsion via interactions between lactoferrin and β-lactoglobulin [J] . Food Biophysics, 2007,2:125-132.
[6] 曹倩.聚合物固态电解质的静电纺丝制备与表征 [D] .西安:西安工业大学,2023.
[7] 杜震.静电纺OS淀粉/普鲁兰多糖纳米纤维膜的制备及其性能研究 [D] .济南:齐鲁工业大学,2023.
[8] 王鸣,李冬月,冷欣阳,等.基于静电纺丝技术的锂离子电池硅碳复合负极材料的应用进展 [J] .高分子通报,2024,1-13.
[9] HOSSEINI S F, NAHVI Z, ZANDI M J F H. Antioxidant peptide-loaded electrospun chitosan/poly (vinyl alcohol)nanofibrous mat intended for food biopackaging purposes [J] . Food Hydrocolloids, 2019, 89:637-648.
[10] DOĞAN G, BAŞAL G, BAYRAKTAR O, et al. Bioactive sheath/core nanofibers containing olive leaf extract [J] .Microscopy Research and Technique, 2016, 79(1):38-49.
[11] 王礼,杨光,杨波,等.海藻酸钠微球的制备优化及其吸附模型 [J] .食品与生物技术学报,2023,42(8):103-111
[12] 王司雯.普鲁兰多糖基静电纺丝纳米纤维膜的制备及性能研究 [D] .渤海:渤海大学,2019.
[13] KHARAT M, ZHANG G, MCCLEMENTS D J. Stability of curcumin in oil-in-water emulsions:Impact of emulsifier type and concentration on chemical degradation [J] . Food Research International, 2018, 111:178-186.
[14] 王鑫磊.荷载姜黄素Pickering乳液的制备及其对乳化肠品质的影响研究 [D] .沈阳:沈阳农业大学,2023.
[15] LI X L, LIU W J, XU B C, et al. Simple method for fabrication of high internal phase emulsions solely using novel pea protein isolate nanoparticles:Stability of ionic strength and temperature [J] . Food Chemistry, 2022, 370:130899.
[16] WANG Y, SUN R, XU X, et al. Structural interplay between curcumin and soy protein to improve the watersolubility and stability of curcumin [J] . International Journal of Biological Macromolecules, 2021, 193:1471-1480.
[17] ZHANG X, CHEN X, DAI J, et al. Edible films of pectin extracted from dragon fruit peel:Effects of boiling water treatment on pectin and film properties [J] . Food Hydrocolloids, 2024, 147:109324.
[18] LIN J W, YU S J, AI C, et al. Emulsion stability of sugar beet pectin increased by genipin crosslinking [J]. Food Hydrocolloids, 2020, 101:105459.
[19] CELEBIOGLU A, TEKANT D, KILIC M E, et al. Orally fast-disintegrating resveratrol/cyclodextrin nanofibrous films as a potential antioxidant dietary supplement [J] .ACS Food Science & Technology, 2022, 2(3):568-80.
[20] LIN L, GU Y, CUI H. Novel electrospun gelatinglycerin-ε-Poly-lysine nanofibers for controlling Listeria monocytogenes on beef [J] . Food Packaging and Shelf Life, 2018, 18:21-30.
[21] 徐波.基于乳液静电纺丝载药纳米纤维膜的制备及药物释放性能研究 [D] .芜湖:安徽工程大学,2023.
[22] 刘战朋.甜菜果胶结构-乳化性关系及油水界面吸附行为的研究 [D] .广州:华南理工大学,2019.
[23] 成刚刚.出芽短梗霉普鲁兰多糖提取工艺优化及食品保鲜膜开发 [D] .天津:天津科技大学,2022.
[24] 沈艺.含丁香精油乳液的普鲁兰-明胶膜的制备及其在冷鲜牛肉的保鲜应用 [D] .合肥:合肥工业大学,2022.
[25] WEN J X, YU Q Z, XIN X J, et al. Preparation and characterization of pea protein isolate-pullulan blend electrospun nanofiber films [J] . International Journal of Biological Macromolecules, 2020, 157:641-647.
[26] 焦文娟,黄华丹,叶铠雯,等.基于没食子酸-花色苷指示膜的制备及其在基围虾鲜度指示中的应用 [J] .现代食品科技,2023,39(11):127-134.
[27] FU D W, FU J J, LI J J, et al. Efficient encapsulation of curcumin into spent brewer’s yeast using a pH-driven method [J] . Food Chemistry, 2022, 394:133537.
[28] SULAIMAN G M, WAHEEB H M, JABIR M S, et al.Hesperidin loaded on gold nanoparticles as a drug delivery system for a successful biocompatible, anti-cancer, antiinflammatory and phagocytosis inducer model [J] .Scientific Reports, 2020, 10(1):9362.
[29] ALI S H, SULAIMAN G M, AL-HALBOSIY M M, et al.Fabrication of hesperidin nanoparticles loaded by poly lactic co-Glycolic acid for improved therapeutic efficiency and cytotoxicity [J] . Artificial Cells, Nanomedicine, and Biotechnology, 2019, 47(1):378-394.
[30] DE MEDEIROS F G M, DUPONT S, BENEY L, et al.Efficient stabilisation of curcumin microencapsulated into yeast cells via osmoporation [J] . Applied Microbiology and Biotechnology, 2019, 103:9659-9672.
[31] 李婷,刘蕾,黄敏,等.负载姜黄素的玉米醇溶蛋白-羧甲基壳聚糖纳米复合物的制备表征、体外消化及其抗氧化活性 [J] .现代食品科技,2022,38(12):110-117.
[32] LI S, YI J, YU X, et al. Preparation and characterization of pullulan derivative/chitosan composite film for potential antimicrobial applications [J] . International Journal of Biological Macromolecules, 2020, 148:258-264.
[33] 王玉莹.去折叠态大豆蛋白包封姜黄素的效果及机制研究 [D] .长春:吉林大学,2023.
[34] 刘秋宇.迷迭香提取物在鸡油及其乳液中的抗氧化效果研究 [D] .广州:华南理工大学,2022.
[35] 姚奉奇,陶骏骏,王海晖,等.茶多酚热解特性及其反应机理研究 [J] .林产化学与工业,2017,37(5):19-27.
[36] 刘毅.静电纺明胶/聚乙烯醇功能纤维膜的制备及其性能研究 [D] .合肥:安徽农业大学,2023.
[37] 姚遥.魔芋葡甘聚糖—普鲁兰多糖复合膜制备及性能研究 [D] .武汉:湖北工业大学,2016.