特医食品全称特殊医学用途配方食品(Food for Special Medical Purposes, FSMP),是专门为满足进食受限、消化吸收障碍、代谢紊乱或者特定疾病状态人群对营养素或者膳食的特殊需要,专门加工配制而成的配方食品 [1] ,需在临床医生和营养师的指导下合理使用 [2,3] 。特医食品具有提高患者生活质量、缩短住院时间、降低医疗成本等作用 [4] 。目前,随着国内老龄化人群和慢性病患者人数的增多,中国市场对特医产品的需求正逐步增长 [5] 。
作为特医食品的一大类别 [6] ,全营养配方食品可作为单一营养来源满足具有进食和消化障碍患者的营养需求 [4] ,正逐渐成为我国特医食品的主流开发方向。乳剂型特医食品是由水与宏量、微量营养素通过混合、均质和灭菌等工艺制备的水包油(O/W)型乳化体系 [7] ,具有无需冲调、既能直接食用也能管饲使用的优势 [8] ,但其稳定性易受原料配方、加工条件和环境因素等影响 [9,10] 。特别是灭菌工艺的高温和矿物质加入导致的高离子强度极易影响乳液中起界面稳定作用的蛋白质,导致出现絮凝、乳析、聚结等失稳现象 [8,11] 。目前市场上全营养特医乳剂的蛋白来源多为酪蛋白及其盐(Casein,CS)或以酪蛋白为主要成分的牛奶蛋白,这主要源于其特殊的胶束结构 [12] ,其中的磷酸化基团簇与钙、钠等离子结合形成的纳米团簇可进一步稳定蛋白结构 [13] 。
有研究发现酪蛋白及其衍生物可能与胃肠功能障碍、炎症等疾病有关,它们在动物模型中表现出降低肠道收缩的频率和幅度、抑制淋巴细胞增殖等不良影响 [14] 。且由于摄入后消化吸收动力学较慢、血浆氨基酸利用率较低 [15] ,酪蛋白属于“慢消化蛋白”,与之相对的“快消化蛋白”乳清蛋白和大豆蛋白则可以更快地提高氨基酸水平、增加肌肉含量 [16] ,更有益于改善患者的蛋白质营养不良 [17] 。以大豆蛋白为代表的植物蛋白来源广泛、营养丰富且环境友好,具有作为特医食品原料的巨大潜力:大豆、豌豆、绿豆蛋白体外消化率 [18,19] 和可消化必需氨基酸评分(DIAAS) [20] 较高,它们还具有降血脂、调节肠道微生物等功效 [21,22] 。但目前仍少见植物蛋白为主要蛋白来源的全营养特医食品乳剂,也缺乏对不同植物蛋白在特医乳剂中的应用表现及其与动物蛋白之间差异的研究。
因此,本研究选取5 种常见的动植物蛋白为原料制备全营养特医乳剂,包括以CS 和乳清分离蛋白(Whey Protein Isolate, WPI)为代表的动物蛋白,及以大豆分离蛋白(Soy Protein Isolate, SPI)、豌豆分离蛋白(Pea Protein Isolate, PPI)、绿豆分离蛋白(Mung Protein Isolate, MPI)为代表的植物蛋白,探究灭菌热处理工艺以及维生素、矿物质等营养素的添加对乳液的影响,并选用灭菌稳定的特医乳液,采用INFOGEST 体外消化模型研究其消化行为,以探究不同蛋白配料对全营养特医乳液理化性质和消化特性的影响。
1 材料与方法
1.1 材料与试剂
酪蛋白酸钠购于Sigma 公司;乳清蛋白购于Fonterra 公司;大豆蛋白由山东御馨生物公司提供;豌豆蛋白和绿豆蛋白由烟台鼎丰生物公司提供。菜籽油购于山东鲁花公司;葵花籽油购于益海嘉里金龙鱼公司。胃蛋白酶、唾液淀粉酶以及胰液素购于Sigma 公司;胆盐购于Macklin 公司。Folin-酚试剂盒购于北京鼎国昌盛公司。游离脂肪酸(FFA)含量检测试剂盒购于Solarbio 公司。其他试剂均为分析纯,所有实验用水均为去离子水。
1.2 仪器与设备
T10 BS25 高速剪切机,德国IKA 公司;M-110-EH-30 高压微射流纳米均质机,美国Microfluidics公司;DF-101S 集热式恒温加热磁动搅拌器,巩义予华有限公司;LDZX-50KBS 立式高压蒸汽灭菌锅,上海申安医疗器械厂;Mastersize 3000 微米粒度仪,英国Malvern 公司;Nano-ZS Zeta 电位分析仪,英国Malvern 公司;MARS 60 流变仪,德国HAAKE 公司;LUMiSizer 稳定性分析仪,德国LUM 公司;UV2300 紫外可见分光光度计,上海天美科学仪器有限公司;TANKPE060 纯水机,法国Millipore 公司。
1.3 实验方法
1.3.1 全营养特医乳剂的制备
根据GB 29922-2013《食品安全国家标准特殊医学用途配方食品通则》中的营养素含量要求 [1] ,制备以CS、WPI、SPI、PPI、MPI 为蛋白原料的全营养特医食品乳剂。
特医乳液(FSMP Emulsion, FE)的制备:称量蛋白4%(m/m)(以蛋白含量计)、麦芽糊精10%(m/m)、宏量矿物质1%(m/m)、微量矿物质0.1%(m/m)、维生素 0.1%(m/m)溶于蒸馏水中,搅拌2 h 后调节pH 值至7.0。将5%(m/m)菜籽油和葵花籽油1:1(m/m)加入蛋白溶液,并在5 000 r/min 下均质2 min,再经100 MPa 微射流下处理3 次得到乳液。模板乳液(Model Emulsion, ME)的制备以等质量蒸馏水替代维生素和矿物质。未灭菌组(R)乳液添加0.04 wt.%叠氮钠,在室温下贮藏,灭菌组(S)添加等量叠氮钠后进行高温灭菌处理(121 ℃,15 min)。
1.3.2 乳液的粒径和电位
采用Malvern Mastersize 3000 微米粒度仪测定乳液的液滴尺寸,采用体积平均直径d4,3 计算粒径大小。将制备好的乳液稀释至0.1%(m/m),采用Zetasizer NanoZS 粒度ζ-电位仪测定稀释乳液的Zeta 电位值。分散颗粒折射率设定为1.473,分散介质为超纯水,折射率1.330。
1.3.3 乳液的流变性质
1.3.3.1 粘度测试
使用HAAKE MARS 60 流变仪测定乳液样品的表观粘度。选用60 mm 不锈钢平板探头,调整间隙为0.5 mm,剪切速率范围0.1~1 000 s-1,测试温度25 ℃,平衡时间60 s。上样量1.2 mL。
1.3.3.2 摩擦学性能
利用HAAKE MARS 60 流变仪与球三板摩擦附件(T-PTD 200)测定乳液样品的摩擦力学特性。设置应力值1 N,夹带速率范围0.1~100 mm/s,温度37 ℃,上样量400 μL,样品滴入三板球载具中开始测试。
1.3.4 乳液的稳定性分析
1.3.4.1 贮藏稳定性
在乳液制备完成的第1、7、14、21 和30 天,从室温下密封保存的已灭菌乳液瓶中取样,按照1.3.2和1.3.3 的方法测试样品的粒度分布以及Zeta电位变化,并拍照记录乳液第1 天和第30 天的外观。
1.3.4.2 长期分散稳定性
利用LUMiSizer 稳定性分析仪评估乳液的长期分散稳定性。用针筒取2 mL 样品,使针头紧贴侧壁将样品加入样品管,避免样品挂壁及晃动。使用时,仪器的参数设置为转速4 000 r/min、实验时间200 min、温度25 ℃、扫描间隔时间40 s。
1.3.5 INFOGEST体外模拟静态消化模型
采用INFOGEST 体外静态消化模型 [23,24] 测定乳液的胃肠消化情况并略作修改。消化前制备模拟唾液(SSF)、模拟胃液(SGF)和模拟肠液(SIF),配置成分如表1 所示,并于37 ℃保温。胃蛋白酶、胰蛋白酶及胆盐现配现用并于冰中保温。取5 mL乳液在37 ℃下保温后与SSF 混合。随后加入SGF,调节pH 值至3.0 后加入胃蛋白酶,进行胃消化0、1、5、10、30、60、90 和120 min,胃蛋白酶在体系中酶活为2 000 U/mL。胃消化结束后,调节pH 值至7.0终止反应。
表1 模拟消化液SSF、SGF、SIF成分(mmol/L)
Table 1 Compositions of simulated digestive fluids SSF、SGF、SIF
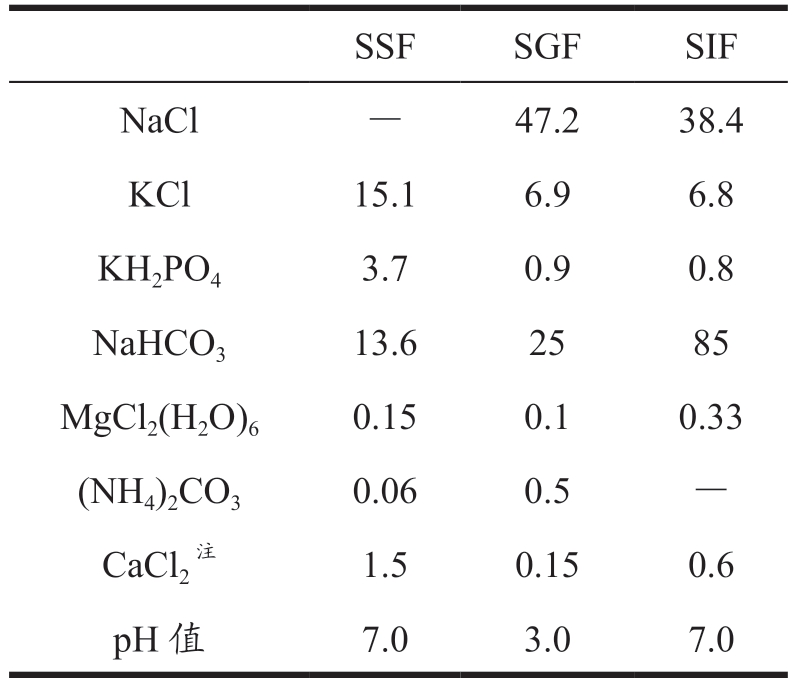
注:为防止发生聚沉,CaCl2 在体外模拟消化时加入。
?
将胃消化混合物与SIF 混合,加入10 mmol/L牛胆盐、100 U/mL(以胰蛋白酶计)胰液素,于37 ℃水浴搅拌进行肠消化0、1、5、10、30、60、90 和120 min。消化结束后,将离心管置于100 ℃沸水浴2 min 终止消化。每个时间点在同类型50 mL 离心管中进行单独消化。等质量的去离子水代替乳液样品作为空白对照。
1.3.6 消化产物的游离氨基含量
采用OPA(O-phthaldialdehyde,邻苯二甲醛)法 [25] 测定消化乳液样品中的游离氨基含量。将2 g SDS、0.16 g OPA 和0.176 g DTT、100 mL 3.81%(m/m)Na2B4O7 溶液、100 mL 蒸馏水于棕色瓶中搅拌溶解得OPA 溶液。取200 μL 适当稀释的消化乳液与1.5 mL OPA 溶液充分混合后避光反应3 min,在紫外分光光度计340 nm 下测定吸光值。以L-丝氨酸为标准物绘制标准曲线。
1.3.7 消化产物的可溶性蛋白质含量
采用TCA 法 [26] 检测可溶性蛋白的含量以表征乳液中蛋白质的消化率。取1 mL 乳液样品与1 mL 20% TCA 混合后离心(10 000 r/min,10 min),取其上清液并稀释。采用Lowry 法检测样品的蛋白含量,使用紫外分光光度计在500 nm 处测吸光度。以牛血清蛋白作为标准物稀释成不同浓度用以绘制标准曲线。
1.3.8 消化产物的游离脂肪酸分析
采用Solarbio BC0590 FFA 含量检测试剂盒测定消化乳液样品中FFA 含量。将消化产物与适量正庚烷混合,充分振荡后离心(8 000 r/min,10 min),取正庚烷相稀释20 倍在紫外分光光度计550 nm 处测试。以氯仿为标准品绘制标准曲线。根据最终消化产物游离脂肪酸的摩尔相对于初始脂肪酸的总摩尔计算FFA 释放率。
1.3.9 数据分析
使用SPSS 27.0.1 软件对数据进行统计分析。采用方差分析(ANOVA)比较所有组之间的显著性差异,数据以均值±标准差表示,P<0.05 时表示差异显著。利用Origin 2022 软件进行数据作图。
2 结果与分析
2.1 乳液的理化性质
2.1.1 乳液外观
制备了CS、WPI、SPI、PPI、MPI 的模板乳液(ME)和特医乳液(FE),并分为未灭菌组(R)与灭菌组(S),新制备的乳液外观如图1 所示。ME-R 呈乳白色,灭菌后ME-S 颜色加深呈浅棕色,这主要是蛋白质和麦芽糊精在高温下的美拉德反应所致。经过灭菌热处理后,5 种ME-S 乳液仍能保持良好性状,FE-S 组中CS、SPI、PPI 制备的乳液也无明显乳析、结块或絮凝现象。

图1 CS、WPI、SPI、PPI、MPI 在不同灭菌热处理条件下的模板乳液和特医乳液的外观
Fig.1 Photographs of CS, WPI, SPI, PPI, MPI model emulsions and FSMP emulsions under different conditions of sterilization
注:ME-R、ME-S、FE-R、FE-S 分别表示未灭菌模板乳液、灭菌模板乳液、未灭菌特医乳液、灭菌特医乳液,下同。
WPI-FE-S 呈现凝胶状,倒立不流动。这是由于WPI 极易在热处理下发生聚集反应 [27] ,其中主要成分β-乳球蛋白在离子浓度较低时由于较强的静电斥力保持稳定,但在多价离子的存在下离子与蛋白的吸附作用会导致表面电荷密度降低而增强絮凝作用 [28] ,使液体WPI 乳液变为凝胶。
灭菌前MPI-FE 即出现明显粗糙颗粒,热处理加强了絮凝作用,可以看到MPI-FE-S 中产生了大量粘附于瓶壁上的絮凝块。MPI-FE-S 与SPI-FE-S、PPI-FE-S 的乳液性状差异可能源于MPI 的球蛋白组成为较单一的8S 蛋白(约占储藏蛋白的90%),而SPI 和PPI 主要球蛋白均为7S 和11S 两种。8S 与7S 具有较高的序列同源性和结构相似性 [19] ,它们不含二硫键,仅通过非共价作用形成聚集体,变性温度低于11S 蛋白 [29] 。SPI 和PPI 中7S 和11S 形成的7S-11S 复合物有效控制了蛋白的聚集行为 [29] ,而MPI 中单一的8S 蛋白组分可能由于灭菌热处理步骤进而暴露了更多疏水结构 [30] ,在高浓度矿物质离子的环境中更易发生絮凝。
2.1.2 乳液粒径
除WPI-FE-S 凝胶外,各蛋白ME-R、ME-S、FE-R、FE-S 乳液的粒径分布中心均集中于0.1 μm(图2a)。在各ME 乳液中,CS-ME、WPI-ME、PPI-ME、SPI-ME 在热加工后粒径没有发生变化(P>0.5)。MPI-ME-R 存在两种尺寸分布差异较明显的乳滴,较大尺寸乳滴的形成可能是由于MPI 较SPI 表面疏水性低、乳化功能差而导致的 [30,31] ;乳液在热加工后曲线右移(MPI-ME-S),这是因为在高盐离子浓度下加热时乳滴之间更易发生结合导致体系尺寸增大 [28] 。
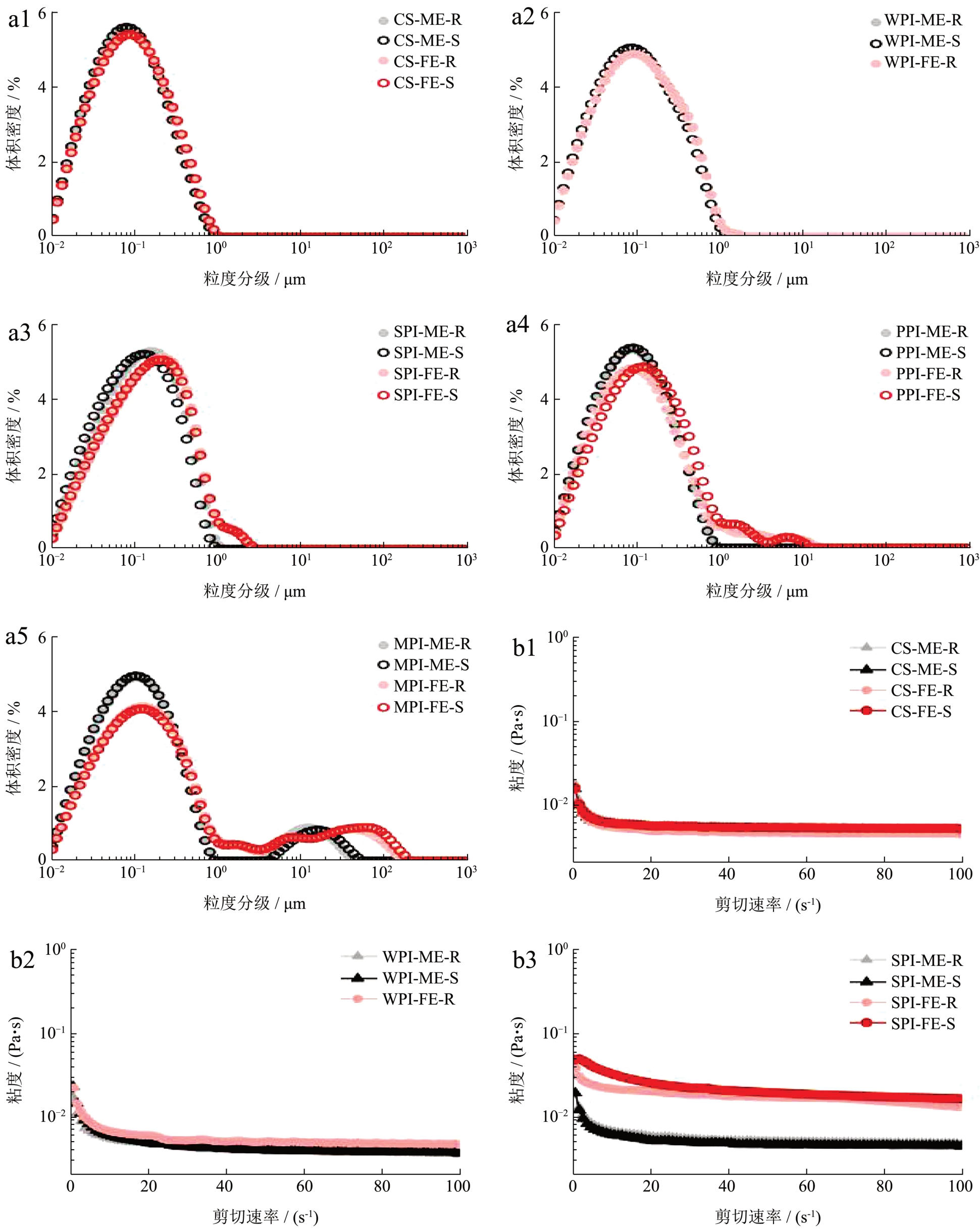
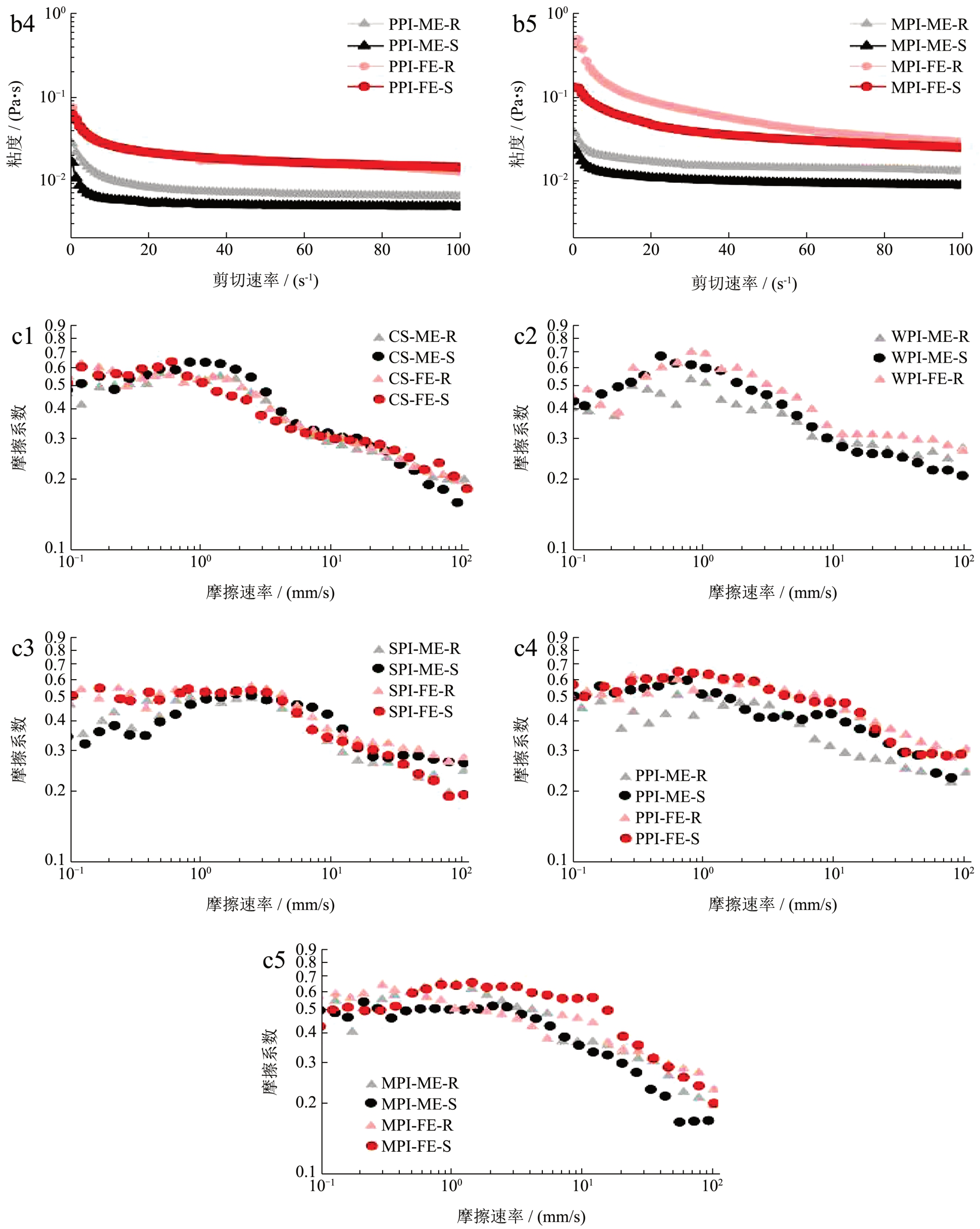
图2 CS、WPI、SPI、PPI、MPI 在不同灭菌热处理条件下的模板乳液和特医乳液的粒径(a)、粘度(b)、摩擦(c)
Fig.2 Particle size (a), viscosity (b) and friction (c) of CS, WPI, SPI, PPI, MPI model emulsions and FSMP emulsions under different conditions of sterilization
加入维生素、矿物质后,各乳液体系液滴粒径均有不同程度的增大。CS-FE-R 粒径从0.137 μm 增至0.147 μm(P<0.5),但仍保持单峰,这可能是由于酪蛋白胶束上的磷酸残基与金属离子的结合和稳定 [13] 降低了矿物质离子对乳液的影响。WPI-FER 与WPI-ME-R 的粒径差异较小,矿物质离子的添加没有直接导致WPI 乳液发生聚集。维矿的加入较显著地影响了植物蛋白乳液的粒径分布,通过电荷和疏水相互作用促进了豆球蛋白之间的分子缔合 [32] ,导致乳液中出现大液滴及少量絮凝。SPI-FE-R 粒径分布曲线在粒径分级为5 μm 左右处出现拖尾峰,主峰发生轻微右移;PPI-FE-R 出现的大尺寸液滴、团块颗粒相较SPI 更多,PPI-FE-S 在7 μm 出现多峰分布。矿物质添加后,热处理产生的强絮凝作用更加促进了WPI-FE-S 体系凝胶化 [28] 。MPI-ME-R 的粒径分布显示出现了大颗粒絮凝,这与外观结果相符合。此外,灭菌热加工对除WPI 外的特医乳液整体影响较小。
2.1.3 乳液的粘度
由图2b 可知,19 种乳液的表观粘度均随剪切速率的增大而减小,呈现剪切变稀特征,为假塑性流体。在模板乳液中,PPI-ME-R 粘度高于CS、WPI、SPI 同等条件处理的乳液,这是因为豌豆蛋白易形成高黏性乳液 [33] ;在剪切速率达到20 s-1 时,MPI-ME-R 粘度更高,约为0.11 Pa·s,这与MPI 体系发生絮凝有关 [9] 。灭菌后,在同样的剪切速率下(20 s-1),CS、WPI、SPI、PPI 的模板乳液剪切粘度约为0.005 Pa·s。加入维生素和矿物质后,CS-FE-R 的粘度几乎不发生变化,而SPI-FE-R、PPI-FE-R 在20 s-1剪切速率下的粘度上升至约0.11 Pa·s,MPI-FE-R 上升至0.12 Pa·s。在灭菌热处理后,CS、SPI、PPI 的特医乳液粘度均有不同程度的升高。MPI-FE-S 粘度的下降可能是由于大量絮凝析出影响了测试结果。
2.1.4 乳液的摩擦性质
在口腔加工过程中,摩擦学特性在人的感官知觉中发挥着主导作用 [34] ,根据呈现摩擦系数和摩擦速率关系的Stribeck 曲线,存在边界层区、混合层区和水动力层区三个摩擦层区。乳液在口腔中停留时间很短,摩擦性质主要体现在边界层区和混合层区(图2c) [35] 。对于各乳液体系,随着摩擦速率的增大,摩擦系数均降低,从边界层区的滑动面接触向接触面开始被润滑剂分开的混合层区转移。CS乳液状态稳定,灭菌前后ME 和FE 的摩擦性质相似,受灭菌高温和维矿影响较小,这与粘度数据相符合。对于另外4 种蛋白乳液,灭菌热处理工艺使乳液摩擦系数上升,维矿等营养素的添加也使摩擦系数上升,乳液顺滑程度下降。这与乳液粒径变大有关,大颗粒使乳液与摩擦板的实际接触面积减少。SPI-ME-R 和SPI-ME-S 在边界层区呈现先增加的趋势,而SPI-FE-R 和SPI-FE-S 有所差异,摩擦速率0.1 mm/s 时摩擦系数即大于0.5,随后系数基本不变。
2.1.5 乳液电位
Zeta 电位是理解和分析胶体体系稳定性的重要参数,表2 展示了19 种乳液的Zeta 电位值。5 种蛋白的ME-R 和ME-S 电位绝对值均大于30 mV,表明体系静电稳定性良好。CS-ME 和WPI-ME 在灭菌前后乳液电位没有显著差异。SPI-ME、PPI-ME、MPI-ME 在灭菌前后乳液电位存在显著差异但电位绝对值减小范围在5 mV 内。矿物质的加入显著影响了各乳液的Zeta 电位值,特医乳液较模板乳液的静电斥力明显减小,乳液稳定性降低。CS-FE-R 电位绝对值较CS-ME-R 下降了12.95 mV,SPI-FE-R、PPI-FE-R 较SPI-ME-R、PPI-ME-R 电位绝对值分别下降了8.28、7.2 mV,WPI-FE-R 和MPI-FE-R 降幅更大(14.4 和9.7 mV),这是由于矿物质引起的电荷屏蔽效应 [32] 。灭菌热处理基本不影响特医乳液的表面电势,4 种FE-R 乳液与FE-S 电位不存在显著性差异。
表2 CS、WPI、SPI、PPI、MPI在不同灭菌热处理条件下的模板乳液和特医乳液的Zeta电位(mV)
Table 2 Zeta-potential of CS, WPI, SPI, PPI, MPI model emulsions and FSMP emulsions under different conditions of terilization

注:A~C 表示同一蛋白不同加工方式的显著差异(P<0.05),a~c 表示同一加工方式不同蛋白的显著差异(P<0.05)。WPI-FE-S 在灭菌热处理后呈凝胶态,不进行电位检测。
?
2.1.6 乳液的贮藏稳定性
根据上述实验结果可知,WPI 和MPI 分别在灭菌热加工和维矿添加后发生了凝胶和絮凝现象,且由于未灭菌乳液不适宜考察常温状态下的乳液储藏稳定性,我们选取了CS、SPI、PPI 的灭菌模板乳液(ME-S)和灭菌特医乳液(FE-S)进行30 d 贮藏稳定性研究。放置30 d 后,各乳液外观颜色、状态未发生明显变化(图3a),电位也基本保持稳定(图3b)。如图3c 所示,CS-ME-S、SPI-ME-S、PPI-ME-S 粒径在一个月内未发生变化,展示出了良好的稳定性。在特医乳液中,CS-FE-S 和SPI-FE-S乳液液滴也未发生明显变化,说明乳液体系均一且稳定。而PPI-FE-S 在30 d 后分布于1~10 μm 的乳滴数量出现小幅增加,但可能由于乳液的较高粘度限制了其中颗粒的聚结,PPI-FE-S 未发生聚沉且静电斥力略有增高。综合来看,各乳液在30 d 内电位、粒径未发生明显改变,乳液状态稳定。
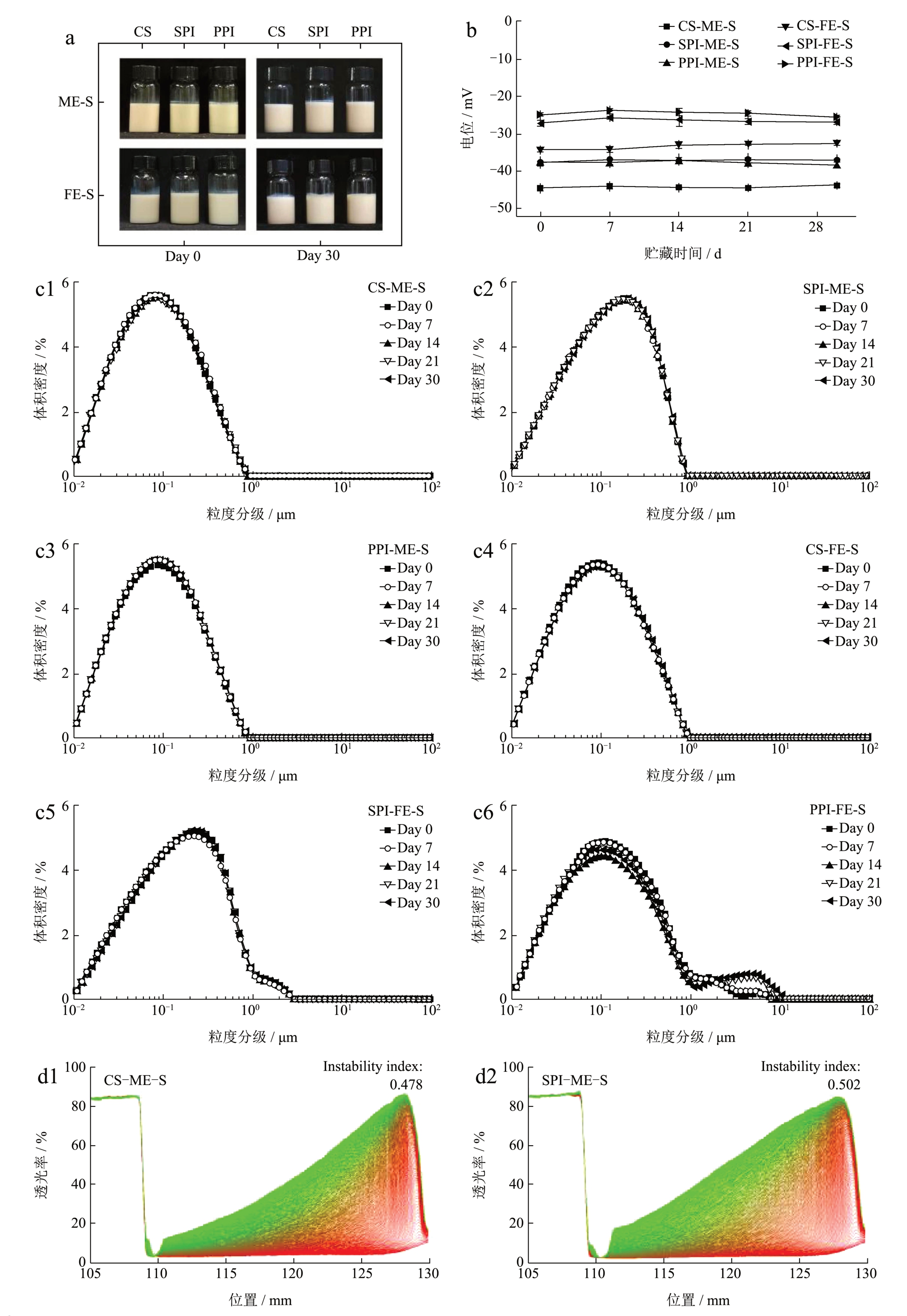
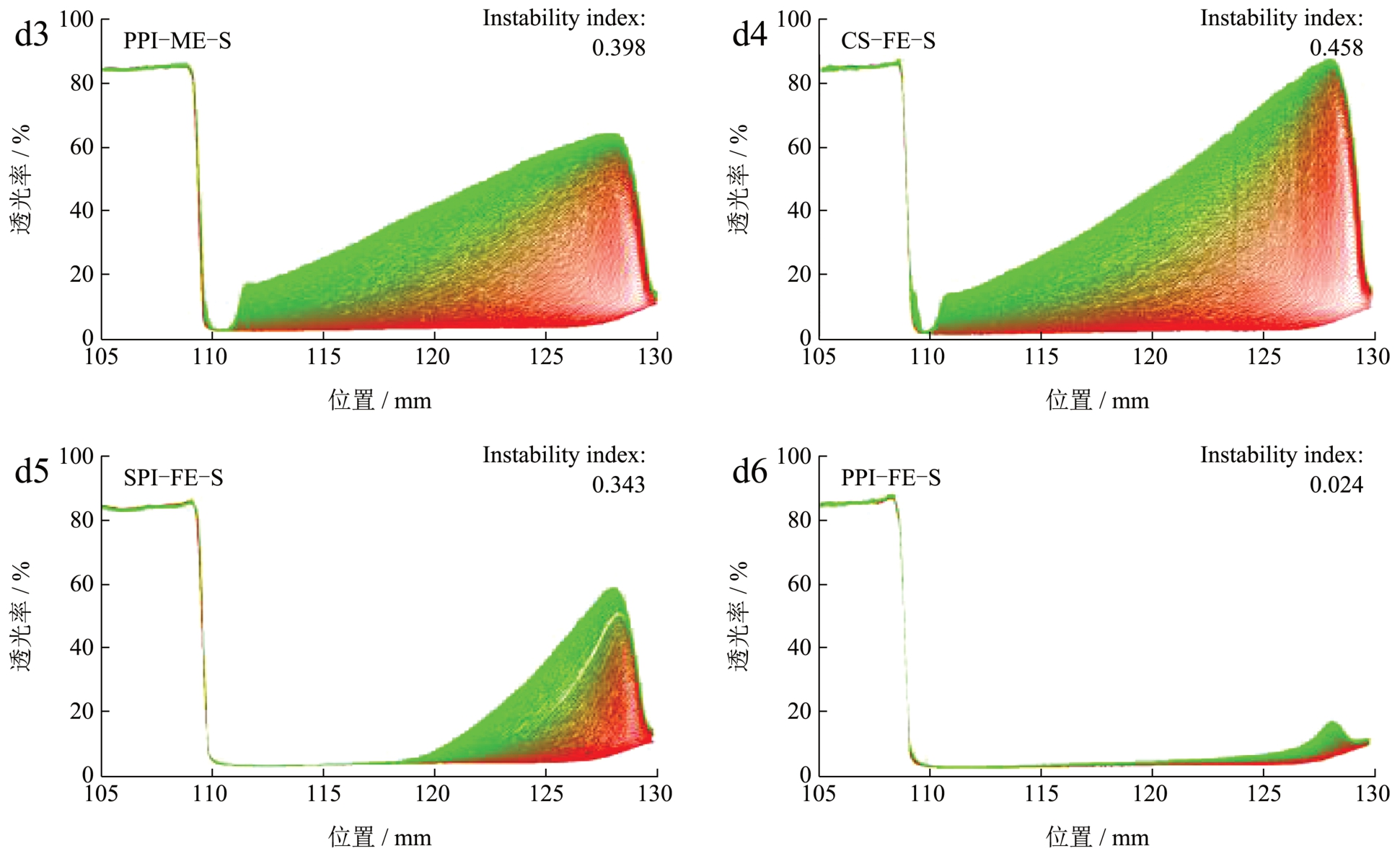
图3 灭菌CS、SPI、PPI 模板乳液和特医乳液贮藏30 d 期间的外观(a)、电位(b)、粒度(c);灭菌CS、SPI、PPI 模板乳液和特医乳液的长期分散稳定性分析(d)
Fig.3 Photographs (a), zeta-potential (b) and particle size (c) after 30 days storage of sterilized CS, SPI and PPI model emulsions and FSMP emulsions; Long-term dispersion stability (d) of sterilized CS, SPI and PPI model emulsions and FSMP emulsions
2.1.7 乳液的长期分散稳定性
LUMiSizer 是利用瞬时测量光穿过整个样品后得到消光图谱的稳定性分析仪,基于离心力诱导相分离可以直接且有效评价乳液长期稳定性 [9] 。利用该仪器模拟乳液9 个月乳析情况,得到乳液的投射剖面图和不稳定性系数(图3d),不稳定系数越小则乳液稳定性越高。实验中,样品管水平放置,即剖面图左侧为样品上部、右侧为样品底部,随着离心时间的延长,透射曲线从底部(右侧)开始逐渐增大,表明乳液开始从底部向上产生不同程度的乳析。模板乳液中,PPI 具有最高的稳定性,不稳定系数为0.398,CS 的稳定性略优于SPI;而加入维矿后的特医乳液中,SPI和PPI 的乳析较少,不稳定系数分别为0.343 和0.024,CS-FE-S 和CS-ME-S 乳液则出现类似的乳析现象。这说明SPI-FE-S 和PPI-FE-S 在高速离心下乳析较慢,具有更好的长期分散稳定性。这可能是由于较高的乳液粘度会使颗粒在连续相中运动速度下降,其中不溶性大颗粒物质的重力沉降减少,使乳液相对稳定 [36] 。
2.2 乳液的胃肠消化特性
由上述分析可知,CS、SPI、PPI 能够成功制备出具有良好热加工性和稳定性的特医乳液。选取这3 种蛋白的灭菌模板乳液和特医乳液进行体外胃肠消化性质探究。
体外模拟消化模型是一种模拟人类胃肠道消化过程的实验方法,通过模拟人体消化液的化学成分和生理特征,对食品的消化、吸收和代谢进行模拟分析。体外消化的静态模型由COSTAction INFOGEST 于2019 年发布了2.0 版本 [23] ,完善了静态体外消化模型的口、胃、肠消化液参数以及确切的组分混合配比和添加流程 [37] ,这套模型不涉及伦理问题,操作简单、相对标准化,适用于各种研究目的 [38] 。
2.2.1 乳液消化产物可溶性蛋白含量
对消化产物进行可溶性蛋白含量分析,如图4a所示,6 种乳液中的蛋白大分子随着胃消化的进行逐步降解。从可溶性蛋白含量来看,特医乳液消化速率略高于模板乳液。CS 乳液蛋白在胃消化初期的消化速率比SPI、PPI 乳液更高,这可能是由于SPI和PPI 的多聚体结构和乳液中少量的絮凝使初始消化速率较低。胃消化结束后,CS、SPI、PPI 特医乳液的可溶蛋白含量分别为12.11、11.53、10.72 mg/mL。Marta 等 [39] 使用总氨基酸分析了CS、SPI、PPI 及其它蛋白的胃蛋白消化产物,研究结果显示CS 消化产物的可溶性组分中氮含量为95.3%,高于SPI、PPI 的74.9%、91.8%。
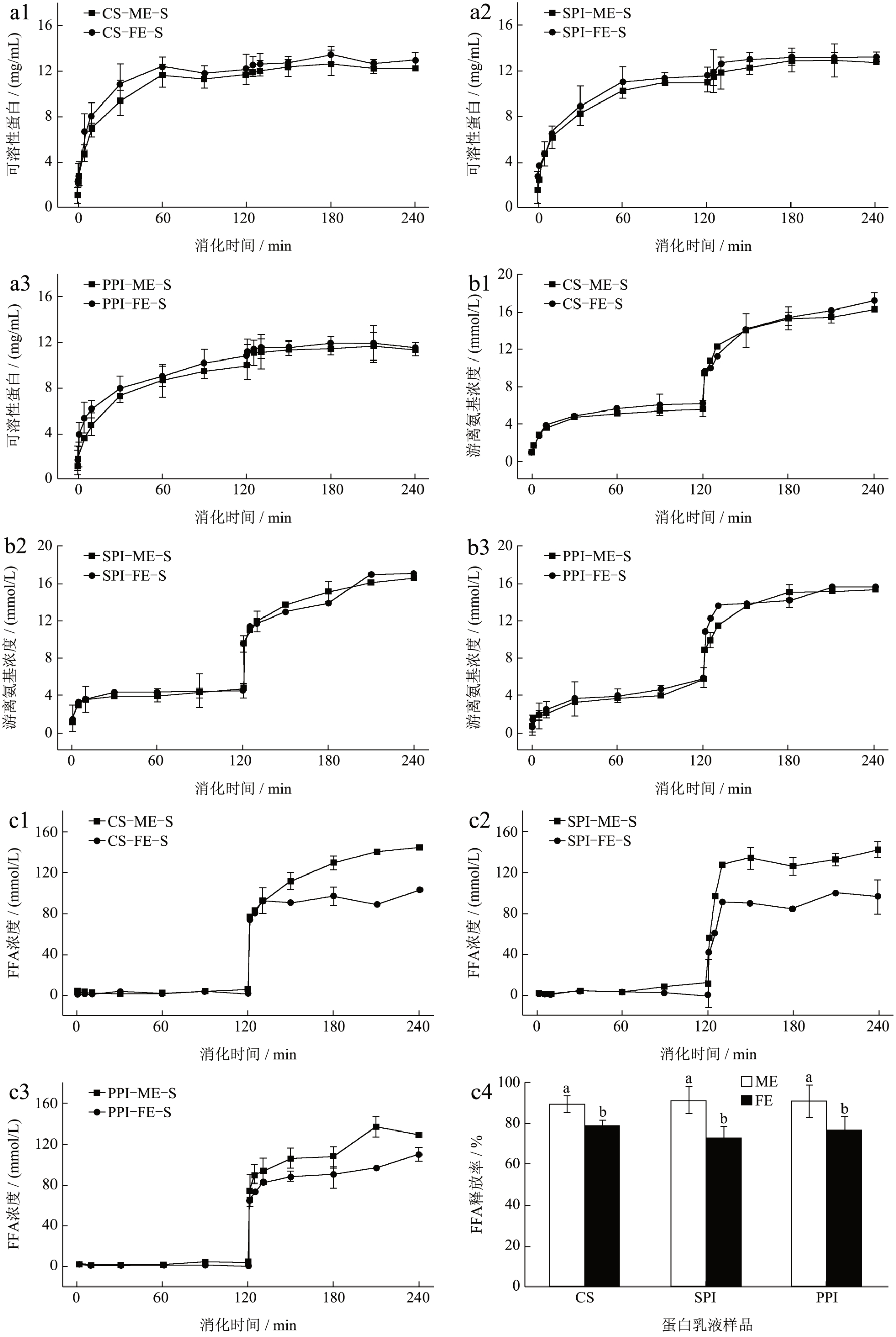
图4 灭菌CS、SPI、PPI 模板乳液和特医乳液在不同消化时间的可溶性蛋白含量(a)、游离氨基含量(b)、FFA 释放和最终产物的脂肪酸释放率(c)
Fig.4 Soluble protein content (a), free amino content (b), FFA released and its final release rate (c) of sterilized CS, SPI,and PPI model emulsions and FSMP emulsions at different digestion times
在胰液素加入后,SPI-FE-S 和PPI-FE-S 的可溶性蛋白含量分别增加4.38 和2.86 mg/mL,部分在胃消化阶段未能消化的聚集体在胰蛋白酶和胆盐的作用下断裂分解成短肽。从肠消化最终产物(240 min消化)的可溶性蛋白含量来看,各蛋白模板乳液和特医乳液差异不显著(P>0.05),维生素和矿物质的添加没有影响乳液的胃肠消化特性。PPI-FE-S 最终产物的可溶性蛋白含量比SPI-FE-S 少1.69 mg/mL,在消化体系中保留更多的不溶性部分,这可能是由于PPI 乳液粒度较大、静电稳定性较低,在胃肠消化中乳液产生的聚结可能会减缓消化 [40] 。
2.2.2 乳液消化产物的游离氨基含量
乳液中蛋白的肽键在消化蛋白酶的作用下水解释放游离氨基(-NH2),因此通过测量消化产物的游离氨基含量可以了解蛋白质的水解程度。如图4b所示,所有样品模板乳液和特医乳液在游离氨基的释放上没有明显差异。在胃消化的初始阶段,胃蛋白酶使部分蛋白水解释放出部分游离氨基,但随着胃消化的进行,氨基释放速率放缓,基本趋于最大值。胃消化阶段主要是不溶性部分转化成为可溶性部分的阶段,蛋白内部的氨基基团暴露较少。由于豆类蛋白结构交缠更紧密、乳液中聚结更多,SPI-FE-S、PPI-FE-S 在消化30 min 时游离氨基浓度达到4.23、3.47 mmol/L,随后基本保持不变,而CS-FE-S 则在60 min 时还有少量游离氨基释放,在90 min 时达到6.00 mmol/L,这与可溶性蛋白的释放速率趋势相似。
小肠中的内肽酶(胰蛋白酶)可以沿底物的一级结构在氨基酸链的中间切割肽键,因此肠消化是蛋白的主要消化阶段,乳液中的游离氨基大量释放。SPI-FE-S(21.095 mmol/L)最终产物游离氨基浓度与CS-FE-S (21.098 mmol/L)具有相当水平,且速率没有明显差异,PPI-FE-S 则较SPI-FE-S 低1.571 mmol/L。有研究发现,在肠消化阶段,SPI 蛋白粉的水解速率高于PPI 蛋白粉,SPI 乳液和PPI 乳液的水解过程相似 [41] 。这表明蛋白粉和其制备成的乳液在消化水解水平上存在差异,这可能是由于与未加工的分离蛋白相比,乳液制备涉及到的高压均质过程可能使蛋白结构展开而对消化酶更加敏感,且蛋白乳液比蛋白粉更利于消化水解 [41] 。
2.2.3 乳液消化产物的游离脂肪酸含量
脂类的消化阶段包括乳化、水解和吸收,乳液中的脂类在胃消化阶段发生部分乳化,在肠消化阶段时在胰脂肪酶和胆盐的作用下被水解为FFA [37] ,图4c 是各乳液的消化产物在静态模拟消化过程中FFA 释放曲线和最终产物的FFA 消解率。由于脂肪酶主要存在于肠道中,且在酸性的胃消化环节,酪蛋白和豆类蛋白聚集导致油滴易被困在蛋白质聚集网络中,因此脂肪的消化吸收主要在肠道进行 [20,42] 。各乳液消化产物中游离脂肪酸在胃消化阶段时释放很少;而在进入肠消化阶段后,消化产物中的游离脂肪酸含量急剧增加,在随后消化过程缓慢增加直至消化结束。这可能是因为脂肪消化酶在胆盐协同下可以快速吸附并进行水解,使FFA 释放量快速升高,但由于INFOGEST 消化体系的限制,在乳滴表面持续累积的消化产物可能限制了后续的水解 [43] 。CS-ME-S 中的脂肪随着消化时间增加逐步释放,而SPI-ME-S 中的游离脂肪含量在肠消化10 min 即达到峰值,最终FFA 释放率高于CS-ME-S。Nguyen等 [42] 研究了婴儿配方奶粉的肠消化阶段的总FFA释放量,其SPI 稳定的婴儿配方奶粉乳剂的脂解率高于乳蛋白(WPI:CS=1:1)稳定的乳剂。CS-ME-S、SPI-ME-S、PPI-ME-S 的消化最终产物FFA 释放率没有显著差异,同时由FFA 释放曲线对比可知,3 种模板乳液在消化过程中释放的游离脂肪酸含量均比特医乳液高,CS-ME-S 比CS-FE-S 多释放40.76 mmol/L,SPI与PPI该差值为31.90和19.26 mmol/L,均存在显著差异。这可能是由于矿物质的添加使乳液为高离子强度体系,导致豆球蛋白易发生不同程度的聚集 [28,32] ,使脂肪更紧地被包裹和缠绕在蛋白网络中。且高浓度盐可能通过调节蛋白的静电相互作用使FFA 释放降低 [42] 。此外,特医体系下,三种蛋白的最终产物FFA 释放率不存在显著差异。
3 结论
为了探究不同类型蛋白配料对全营养特医乳液理化性质和消化特性的影响,本文选取了CS、WPI、SPI、PPI、MPI 制备乳液,研究特医食品乳剂制备工艺中灭菌热处理、维生素和矿物质的添加对乳液特性和乳液稳定性影响。WPI 由于矿物质加剧的热反应生成凝胶,MPI 因较为简单的蛋白组分受离子强度和热灭菌影响而产生絮凝,不能制备性状良好的整蛋白特医乳剂。CS、SPI 和PPI 特医乳液具有较低的粘度和较好的口腔摩擦性质,乳液粒径、电位可以在30 d 内保持稳定,PPI-FE-S 因较高的粘度具有更好的长期分散稳定性。筛选了基于CS、SPI、PPI 的模板乳液和特医乳液进行体外胃肠消化行为的探究。CS、SPI 和PPI 特医乳液都展现了良好蛋白消化性,其中SPI 特医乳液蛋白消化表现更优,可溶性蛋白含量和游离氨基释放含量最高。本研究表明,SPI 和PPI 也可制备出稳定性优良、消化性良好的全营养特医乳液,可作为蛋白质核心配料应用于新型植物基全营养特医乳剂产品的开发。
[1] GB 29922-2013,特殊医学用途配方食品通则 [S] .
[2] SCHUEREN D V D A M. Use and effects of oral nutritional supplements in patients with cancer [J] .Nutrition, 2019, 67-68:110550.
[3] WU L, ZHANG L, ZHANG Y. A review on rules for examination of licensing criteria for producing foods for special medical purpose in China [J] . Food Science and Human Wellness, 2019, 8(2):106-114.
[4] 张春红,黄建,李乘风,等.特殊医学用途配方食品现状及前景展望 [J] .中国食品添加剂,2016,12:210-214.
[5] 陈晗琪,刘敏,余贞,等.国内外特医食品注册管理制度比对及建议 [J] .食品与机械,2023,39(11):1-6.
[6] 朱海华,葛瑞宏,马银辉,等.基于棕榈仁油的特医脂肪乳液制备及其对小鼠血脂的影响 [J] .粮油食品科技,2022,30(2):85-94.
[7] 刘媛,叶盛英,魏振承,等.宏量营养素和pH值对乳剂型特医食品基质品质的影响 [J] .食品科学,2020,41(4):23-31.
[8] EDMUNDO F L B, SAHYLIN M, GABRIEL A. Lipid emulsions in clinical nutrition:Enteral and parenteral nutrition [J] . Advances in Food and Nutrition Research,2023, 105:301-342.
[9] NIU H, WANG W, DOU Z, et al. Multiscale combined techniques for evaluating emulsion stability:A critical review [J] . Advances in Colloid and Interface Science,2023, 311:102813.
[10] 李子琰,刘媛,刘光,等.贮藏条件对全营养乳剂型特医食品品质特性和稳定性影响 [J] .食品安全质量检测学报,2021,12(3):931-939.
[11] 刘媛.乳剂型特殊医学用途配方食品的稳定性研究 [D] .广州:华南农业大学,2023.
[12] 赵新琦,陈平华,米晓磊,等.不同加工处理方式对酪蛋白胶束的影响研究进展 [J] .乳业科学与技术,2021,44(1):51-56.
[13] ANEMA S G. Heat-induced changes in caseins and casein micelles, including interactions with denatured whey proteins [J] . International Dairy Journal, 2021, 122:105136.
[14] SUN J Q, XU L M, XIA L, et al. Effects of milk containing only A2 beta casein versus milk containing both A1 and A2 beta casein proteins on gastrointestinal physiology,symptoms of discomfort, and cognitive behavior of people with self-reported intolerance to traditional cows’ milk [J] .Nutrition Journal, 2015, 15(1):35.
[15] PENNINGS B, BOIRIE Y, SENDEN J M, et al. Whey protein stimulates postprandial muscle protein accretion more effectively than do casein and casein hydrolysate in older men [J] . The American Journal of Clinical Nutrition,2011, 93(5):997-1005.
[16] TANG J E, MOORE D R, KUJBIDA G W, et al. Ingestion of whey hydrolysate, casein, or soy protein isolate:effects on mixed muscle protein synthesis at rest and following resistance exercise in young men [J] . Journal of Applied Physiology, 2009, 107(3):987-992.
[17] BOIRIE Y, DANGIN M, GACHON P, et al. Slow and fast dietary proteins differently modulate postprandial protein accretion [J] . Proceedings of the National Academy of Sciences, 1997, 94(26):14930-14935.
[18] NGUYEN T T P, BHANDARI B, CICHERO J, et al.Gastrointestinal digestion of dairy and soy proteins in infant formulas:An in vitro study [J] . Food Research International, 2015, 76:348-358.
[19] HOU D, FENG Q, NIU Z, et al. Promising mung bean proteins and peptides:A comprehensive review of preparation technologies, biological activities, and their potential applications [J] . Food Bioscience, 2023, 55:102972.
[20] MATHAI J K, LIU Y, STEIN H H. Values for digestible indispensable amino acid scores (DIAAS) for some dairy and plant proteins may better describe protein quality than values calculated using the concept for protein digestibility-corrected amino acid scores (PDCAAS) [J] .British Journal of Nutrition, 2017, 117(4):490-499.
[21] HAN K, LUO D, ZOU Y, et al. Modulation of gut microbiota by soybean 7S globulin peptide that involved lipopolysaccharide-peptide interaction [J] . Journal of Agricultural and Food Chemistry, 2019, 67(8):2201-2211.
[22] BLANCO MEJIA S, MESSINA M, LI S S, et al. A metaanalysis of 46 studies identified by the FDA demonstrates that soy protein decreases circulating LDL and total cholesterol concentrations in adults [J] . The Journal of Nutrition, 2019, 149(6):968-981.
[23] BRODKORB A, EGGER L, ALMINGER M, et al.INFOGEST static in vitro simulation of gastrointestinal food digestion [J] . Nature Protocols, 2019, 14(4):991-1014.
[24] LI C, YU W, WU P, et al. Current in vitro digestion systems for understanding food digestion in human upper gastrointestinal tract [J] . Trends in Food Science & Technology, 2020, 96:114-126.
[25] NIELSEN P M, PETERSEN D, DAMBMANN C.Improved method for determining food protein degree of hydrolysis [J] . Journal of Food Science, 2001, 66(5):642-646.
[26] 孙雪梅,蒋将,刘元法.脱酚及pH偏移处理对菜籽蛋白体外模拟消化的影响 [J] .食品工业科技,2019,40(16):278-284.
[27] CHEN D, LI X, ZHAO X, et al. Comparative proteomics of goat milk during heated processing [J] . Food Chemistry,2019, 275:504-514.
[28] DICKINSON E. Flocculation of protein-stabilized oil-in-water emulsions [J] . Colloids and Surfaces, B.Biointerfaces, 2010, 81(1):130-140.
[29] 郭健.大豆蛋白热聚集行为控制及其结构表征的研究 [D] .广州:华南理工大学,2012.
[30] 邓卓瑶,韩凯宁,杨晓泉.绿豆蛋白基乳液的稳定性及胃肠消化行为 [J] .现代食品科技,2022,38(12):91-100.
[31] 任思,刘丽娅,庞淑婕,等. 羧甲基纤维素钠对绿豆分离蛋白乳液稳定性的影响 [J] .食品与发酵工业,2020,46(18):41-46.
[32] LI X, CHENG Y, YI C, et al. Effect of ionic strength on the heat-induced soy protein aggregation and the phase separation of soy protein aggregate/dextran mixtures [J] .Food Hydrocolloids, 2009, 23(3):1015-1023.
[33] LU Z X, HE J F, ZHANG Y C, et al. Composition,physicochemical properties of pea protein and its application in functional foods [J] . Critical Reviews in Food Science and Nutrition, 2020, 60(15):2593-2605.
[34] ZHENG Y, BASHANDEH K, SHAKIL A, et al. Review of dental tribology:Current status and challenges [J] .Tribology International, 2022, 166:107354.
[35] 叶芸彤,梅钰琪,杨韵仪,等.用小麦醇溶蛋白/阿拉伯胶复合胶体颗粒制备植物基蛋黄酱及其性质分析 [J] .现代食品科技,2022,38(12):59-66.
[36] 黄晓玲,胡丹,邓颖诗,等.剪切工艺对特医食品全营养乳液稳定性的影响 [J] .现代食品,2023,29(17):131-136.
[37] 张铭凯,李晓雯,孟晨,等.脂质体外消化过程中氧化评价模型与检测方法研究进展 [J] .食品与生物技术学报,2022,41(6):31-40.
[38] SOUSA R, RECIO I, HEIMO D, et al. In vitro digestibility of dietary proteins and in vitro DIAAS analytical workflow based on the INFOGEST static protocol and its validation with in vivo data [J] . Food Chemistry, 2023, 404:134720.
[39] SANTOS-HERNÁNDEZ M, ALFIERI F, GALLO V, et al.Compared digestibility of plant protein isolates by using the INFOGEST digestion protocol [J] . Food Research International, 2020, 137:109708.
[40] ZEEB B, WEISS J, MCCLEMENTS D J. Electrostatic modulation and enzymatic cross-linking of interfacial layers impacts gastrointestinal fate of multilayer emulsions [J] . Food Chemistry, 2015, 180:257-264.
[41] REYNAUD Y, LOPEZ M, RIAUBLANC A, et al.Hydrolysis of plant proteins at the molecular and supramolecular scales during in vitro digestion [J] . Food Research International, 2020, 134:109204.
[42] NGUYEN T T P, BHANDARI B, CICHERO J, et al. In vitro lipolysis of dairy and soy based infant formula [J] .Food Research International, 2018, 106:696-705.
[43] 郑佳楠,刘琳,张友胜,等.三种不同EPA/DHA组成鱼油乳液的体外消化特性比较 [J/OL] .现代食品科技,1-11[2024-05-24] .