塑料制品具有成本低、强度高、耐用等优点,常用于日常生活、农业领域和包装行业[1]。塑料的种类很多,常见的有聚乙烯(Polyethylene,PE)、聚丙烯(Polypropylene,PP)、聚苯乙烯(Polystyrene,PS)、聚氯乙烯(Polyvinyl Chloride,PVC)等聚烯烃类塑料以及聚对苯二甲酸乙二醇酯(Polyethylene Terephthalate,PET)、聚氨酯(Polyurethane,PU)等聚酯类塑料。这些合成塑料分子量大、疏水性高,难以在自然环境中降解。对于这些塑料废物目前的处理途径主要是填埋和焚烧[2]。填埋会占据土地、产生渗漏液及污染地下水;焚烧会产生大量的有毒气体,包括一氧化碳、氯化氢、二氧化硫、二嗯英等。没有经过合理处理的塑料进入自然环境中,给生态环境和人类健康造成很大的威胁。
昆虫是世界上分布最为广泛,数量繁多,种类最为丰富的动物类群[3]。昆虫的肠道是微生物定殖的主要场所,肠道内的微生物具有丰富的组成结构和复杂的生物学功能[4]。肠道微生物对于宿主在营养供应、消化和吸收方面发挥着重要作用,当昆虫食物受限或碰到难以消化的食物时,微生物为宿主提供食物中得不到的营养物质,包括氨基酸、维生素和辅酶因子等,并帮助宿主完成氮、硫代谢[5]。利用昆虫、微生物、营养三者的关系,在研究昆虫及肠道微生物降解塑料时,可以将塑料作为唯一碳源,饲喂昆虫,刺激昆虫肠道微生物群发生变化,让降解塑料的菌群成为优势菌群;或对昆虫饲喂抗生素,限制昆虫肠道微生物,用塑料作为唯一碳源,饲喂昆虫,刺激昆虫分泌能降解塑料的活性物质。综上所述,研究利用昆虫肠道微生物降解塑料有可行性和必要性。
文章综述昆虫及肠道微生物降解塑料的研究现状及作用机制。根据目前的研究现状,以及塑料降解中的可能影响因素,提出昆虫及肠道微生物降解塑料的研究思路,旨在给昆虫肠道微生物降解塑料提供理论参考。
1 昆虫及肠道微生物降解塑料研究现状
在研究昆虫及肠道微生物降解塑料中,有多种昆虫幼虫通过咀嚼,依赖肠道环境降解塑料制品。如黄粉虫(Tenebrio molitor)、黑粉虫(Tenebrio obscurus)、超级蠕虫(Zophobas atratus)、印度谷螟(Plodia interpunctella)、小蜡螟(Achroia grisella)、大蜡螟幼虫(Galleria mellonella larva)等。这些昆虫在降解塑料时,将塑料作为可利用碳源,在肠道微生物群和昆虫分泌的消化酶二者共同作用下,对塑料进行生物降解。文章将从三个方面综述昆虫及肠道微生物降解塑料的发展现状,
1.1 昆虫及肠道微生物降解聚乙烯(Polyethylene,PE)研究现状
与降解PE 有关的昆虫主要是大蜡螟、黄粉虫、印度谷螟等昆虫,其中大蜡螟研究最多。在降解PE中发现昆虫的肠道微生物与降解密切相关。与PE降解相关的昆虫以及肠道微生物见表1。
表1 昆虫及肠道微生物降解PE塑料
Table 1 Insect and intestinal microbial degradation of PE plastics
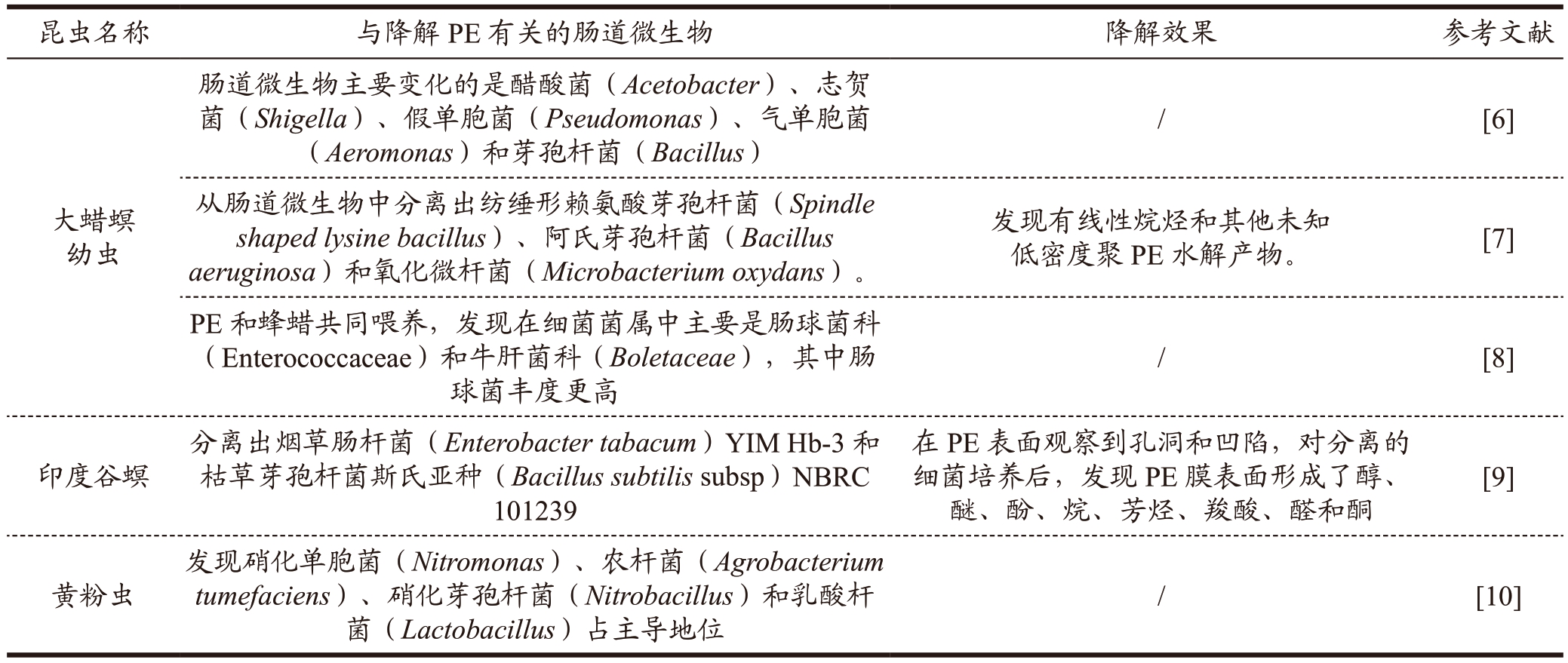
利用大蜡螟及肠道微生物降解PE 的研究较多。Cassone 等[6]用低密度PE 饲喂大蜡螟幼虫,发现在饲喂初期,大蜡螟幼虫的肠道微生物群落有明显变化。在肠道微生物菌群中变化明显的菌群有醋酸菌、志贺菌、假单胞菌、气单胞菌和芽孢杆菌。为研究低密度PE 的降解情况,Cassone 等[6]借助代谢组学,分析幼虫的粪便,发现代谢产物乙二醇,因此证明大蜡螟幼虫食用了低密度PE,并代谢降解。为证实肠道微生物与低密度PE 降解的关系,Cassone 等[6]用抗菌剂抑制幼虫肠道微生物,发现粪便中乙二醇量减少,表明微生物群对低密度PE有降解作用。用NGS 对饲喂低密度PE 的大蜡螟幼虫肠道和饥饿组幼虫肠道中的菌群进行分析,结果发现,用低密度PE 饲喂的大蜡螟幼虫肠道中大肠杆菌(Escherichia coli)、泛菌属(Pantoea spp)、伪柠檬杆菌属(Pseudocitrobacter genus)、沙门氏菌属(Salmonella)、沙雷氏菌属(Serratia)和柠檬杆菌属(Citrobacter)丰度增加,而醋酸杆菌属(Acetobacter)、阿萨氏菌属(Asaia)、葡萄糖酸杆菌属(Gluconobacter)和Swaminathania属的丰度降低。72 h 后,PE 饲喂组中气单胞菌属、Ottowia 和伯克霍尔德氏菌(Burkholderia caribensis)的丰度增加。对PE 喂养大蜡螟幼虫的肠道微生物进行体外培养,分离出不动杆菌属(Acinetobacter),由此证明此菌属与PE 生物降解相关。Montazer 等[7]用大蜡螟幼虫降解PE,从肠道中分离出纺缍形赖氨酸芽孢杆菌、阿氏芽孢杆菌和氧化微杆菌三个细菌物种。为研究微生物共协作用,在这三种微生物中,添加可生物降解低密度PE 的其他菌株:钩虫贪铜菌(Cupriavidus necator)H16、恶臭假单胞菌(Pseudomonas putida)LS46 和恶臭假单胞菌IRN22,新组成的菌群在降解低密度PE方面比单个物种更有效,用气相色谱仪分析降解产物,发现有线性烷烃和其他未知低密度聚PE 水解产物。Latour 等[8]研究用PE 和蜂蜡共同喂养大蜡螟幼虫。通过NGS、16S rRNA(16S ribosomal RNA,16S rRNA)分析显示,发现肠道微生物主要是细菌菌属中的肠球菌科和牛肝菌科,其中肠球菌的丰度更高。利用蛋白质组学对大蜡螟幼虫的肠道进行分析,确定苯乙醛脱氢酶参与了塑料的生物降解。
大蜡螟幼虫降解PE,除与肠道微生物有关外,还可能与环境因素和大蜡螟在摄食塑料中唾液分泌的蛋白质种类有关。Kundungal 等[11]用紫外线辐照预处理PE,将经紫外线辐照处理的塑料与未经处理的塑料同时饲喂大蜡螟,发现经紫外线处理后,大蜡螟幼虫对PE 消耗率增加37%。Kong 等[12]的研究表明,当大蜡螟的肠道微生物组被抑制时,大蜡螟能够继续降解PE,进而分析大蜡螟的唾液腺,发现分泌的蛋白质种类与肠道微生物没有被抑制的大蜡螟分泌的蛋白质种类有明显的不同。Peydaei 等[13]发现大蜡螟的唾液腺可能参与PE 的生物降解,用PE饲喂幼虫10 d,对幼虫的腺体进行蛋白质组学分析,结果表明蛋白质被明显诱导,能量水平发生变化,这些变化可能与脂肪酸β-氧化中,酶反应途径受到刺激有关。
通过上述的研究,昆虫肠道以及肠道微生物在降解中似乎起到尤为重要的作用,为验证肠道系统可否单独降解PE,Bombelli 等[14]将玉米螟幼虫(Corn borer Larvae)的肠道匀浆涂布在PE 薄膜表面,实验结果表明PE 薄膜的重量减少13%,用傅里叶变换红外光谱仪分析,发现光谱上出现了乙二醇的峰,Bombelli 等[14]认为幼虫肠道匀浆能够降解PE,原因可能与玉米螟以蜂蜡为食有关。Billen等[15]指出,Bombelli 实验中的PE 质量损失可能是由于清洗过程中的机械破坏造成,幼虫肠道匀浆不能单独降解PE 塑料,PE 的降解与幼虫咀嚼有关,幼虫通过咀嚼破碎聚合物,促进塑料的摄入和后期生物降解。
在研究昆虫降解PE 中,发现多种肠道微生物与PE 降解有关。利用蛋白质组学,分析昆虫的唾液腺或者腺体,发现蛋白质有明显变化,确定在PE 降解中可能有酶参与降解的过程。用昆虫降解PE,多种微生物共协,昆虫的咀嚼作用,昆虫体内分泌的酶,这些因素对降解起到积极的作用。
1.2 昆虫及肠道微生物降解聚苯乙烯(Polystyrene,PS)研究现状
与PS 降解有关的昆虫和其肠道微生物见表2。从表中可以看出,研究较多的昆虫主要是黄粉虫、大蜡螟等。
表2 昆虫及肠道微生物降解PS塑料
Table 2 Insect and intestinal microbial degradation of PS plastics
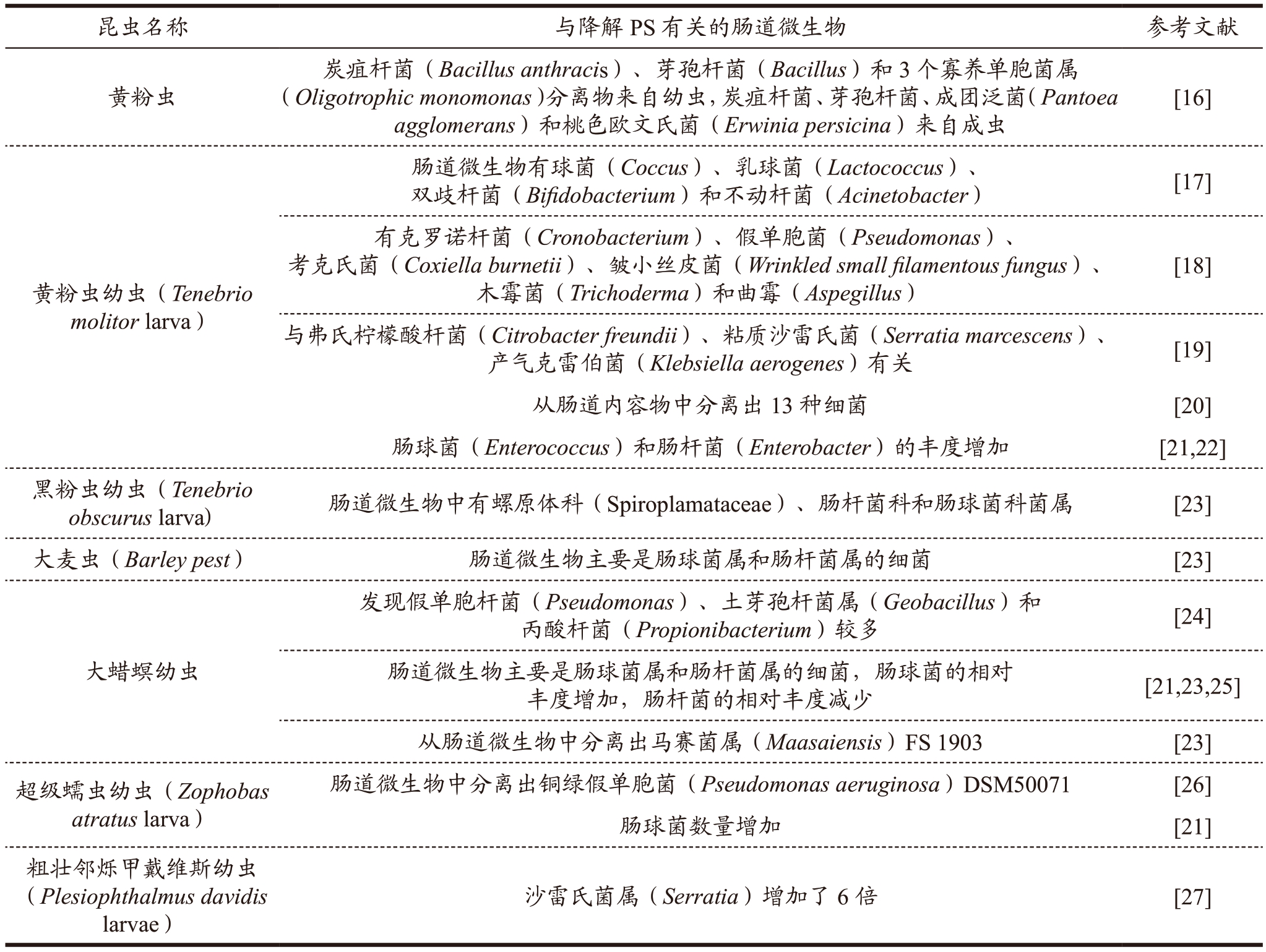
目前黄粉虫及肠道微生物降解PS 的研究较最多。为确定黄粉虫形态对摄食PS 的影响,PS 的类型对黄粉虫的影响,研究者进行了多个实验。Pea-pascagaza 等[16]研究黄粉虫成虫孵化后摄食PS的情况,实验15 d,结果发现塑料表面没有明显的变化,因此证明成虫不能以PS 为食,分析原因可能是成虫颚部结构发生变化,导致成虫不能粉碎和摄食PS。分析以PS 为唯一碳源的黄粉虫肠道微生物,发现成虫和幼虫的肠道微生物不相同,幼虫肠道微生物中有5 个菌株(炭疽杆菌、芽孢杆菌和3个寡养单胞菌属分离物),成虫肠道微生物中有4 个菌株(炭疽杆菌、芽孢杆菌、成团泛菌和桃色欧文氏菌),研究者认为幼虫与成虫消化道内的微生物差异性,可能与成虫不再食用PS 有关。最近,Bulak 等研究黄粉虫幼虫和成虫对PS 和PE 降解,饲喂58 d后,发现在幼虫和成虫共同作用下,PS 的质量下降了46.5%(m/m),PE 的质量下降了69.7%(m/m)[28]。Urbanek 等[29]研究黄粉虫肠道微生物种类是否与PS的类型有关时,结果表明用市售包装的PS 饲喂幼虫,肠道微生物中细菌数量高;用市售的PS 泡沫喂养的幼虫,肠道中的细菌数量较少,实验结果表明PS 的类型可能对摄食PS 的黄粉虫肠道微生物的种类有影响。
利用核磁共振光谱学、气相色谱—质谱联用技术和代谢组学、蛋白质组学,对黄粉虫摄食PS 的降解过程进行探索。Yang 等[30]研究黄粉虫摄食降解PS 时,用固态13C 标记追踪,借助核磁共振光谱学和同位素质谱学,发现肠道内容物中有解聚代谢物,并且标记13C 的PS 有部分代谢为CO2,剩余的标记13C 并入脂类代谢。Tsochatzis 等[31]使用气相色谱—质谱联用仪,分析黄粉虫幼虫摄食PS 过程中产生的化学物质,在幼虫肠道内容物中发现PS 单体(苯乙烯、α-甲基苯乙烯)、PS 低聚物(主要是三聚物)和脂肪酸(饱和脂肪酸,如十一烷酸、肉豆蔻酸和棕榈酸,非饱和酸,如油酸),同时也发现一些脂肪酸酯类(亚油酸甲酯、亚油酸乙酯和棕榈酸乙酯)和酰胺类(十四烷酰胺、十六烷酰胺和油酰胺),这些物质可能与某些酶的参与有关。Kosewska 等[32]对黄粉虫幼虫摄食PS 的能力进行研究,借助于蛋白质组学对结果分析,发现饲喂PS 的幼虫体内酶活性比饲喂燕麦的幼虫的酶活性高,其中β-葡萄糖苷酶和苦杏仁苷氧化发酵酶的活性最高。Tsochatzis等[33]用水和大麦麸饲喂黄粉虫幼虫,发现PS+大麦麸+水饲喂的幼虫消耗PS 量最高,降低大麦麸的添加量,PS 的消耗量增加,由此证实黄粉虫可利用PS 做碳源,利用气相色谱—质谱仪,代谢组学,在黄粉虫粪便中发现长链脂肪酸、酯和酰胺等几种化合物,这些化合物与幼虫肠道降解PS 中某些酶的活动有关。
除黄粉虫可以降解PS 外,其他昆虫如大蜡螟、黑粉虫、超级蠕虫等都在被研究降解PS 的可行性。Jiang 等[21]在研究大蜡螟、黄粉虫和超级蠕虫幼虫对PS 生物降解情况时,发现实验30 d 后,这几种昆虫对PS 消耗率不同:超级蠕虫对PS 消耗量是大蜡螟幼虫的2.5 倍,大蜡螟幼虫对PS 消耗量为黄粉虫的16.2 倍,同时在降解中发现一些裂解物,证实这三种昆虫都可以降解PS。Lou 等[24]研究大蜡螟摄食PS 的情况,表明肠道细菌群由简单的核心微生物群组成,用混合食物(塑料与蜂蜡或麦麸)饲喂大蜡螟,微生物群会发生变化,其中蜡样芽孢杆菌(Bacillus cereus)和粘质沙雷菌(Serratia marcescens)与PS 和PE 饮食明显相关,在饲喂PE 的肠道微生物组中粘质沙雷菌更为突出。用麸皮控制饮食,饲喂PS,发现假单胞杆菌、土芽孢杆菌属和丙酸杆菌较多。Zhu 等[25]用废弃电器和电子设备中的PS 饲喂大蜡螟幼虫,7 d 后,PS 质量减少13.41%(m/m)。检测剩余的PS,发现热稳定性和分子量下降,表明PS 发生了解聚(生物破碎),用NGS 分析幼虫的肠道微生物,肠球菌的相对丰度增加,肠杆菌的相对丰度减少。KIM 等进行超级蠕虫摄食PS 实验,从肠道微生物中分离出铜绿假单胞菌DSM50071,同时发现昆虫体内的S-甲酰谷胱甘肽水解酶和丝氨酸水解酶的量分别增加了2 倍和7 倍,证实丝氨酸水解酶在解聚PS 形成小分子中起重要作用[26]。Luo 等[34]研究超级蠕虫摄食PS 和PE 时,发现塑料有降解和氧化现象,饲喂塑料的昆虫肠道消化酶有变化,其中蛋白酶活性增加;同时证实以塑料加麸皮的饲喂方式喂养超级蠕虫,会增加塑料的降解率。
昆虫降解PS,降解过程不仅与昆虫肠道微生物有关,也与降解中昆虫体内的某些酶类有关。利用气相色谱-质谱联用技术,借助代谢组学,研究昆虫体内的代谢产物,证实昆虫摄食PS 后,能将PS降解为小分子[31]。同时也有研究表明,在饲喂PS的同时饲喂麸皮,会增加PS 的降解率[34]。昆虫摄食并降解塑料机制复杂,降解中需要肠道微生物参与,需要昆虫体内有活性的酶参与降解过程,研究微生物参与、活性酶参与的降解机制,进而为昆虫降解PS 提供理论支持。
1.3 昆虫及肠道微生物降解其他塑料的研究现状
利用昆虫和其肠道微生物降解其他塑料见表3。
表3 昆虫及肠道微生物降解其他塑料
Table 3 Degradation of other plastics by insects and gut microbiota

昆虫在降解其他种类的塑料时,抗生素、饥饿、昆虫自身的储存的物质等因素会影响塑料的降解率。在黄粉虫幼虫降解PVC 的实验中[35],用庆大霉素抑制肠道微生物后,降解也会停止,证实肠道微生物在降解PVC 中起关键作用。Yang 等[36]用PP饲喂黄粉虫,发现黄粉虫肠道微可以降解PP,用凝胶渗透色谱分析虫粪,发现有氧化和生物解聚现象。用庆大霉素抑制肠道微生物,PP 的解聚会被抑制,使用高通量16S rRNA 测序,发现饲喂PP 的黄粉虫幼虫中克吕沃尔氏菌属较多。Kesti 等[40]在对饲喂抗生素的米蛾幼虫(Rice moth Larvae)和未饲喂抗生素的米蛾幼虫进行对照实验时,发现饲喂抗生素的米蛾幼虫和未饲喂抗生素的米蛾幼虫在食用低密度聚乙烯(Low Density Polyethylene,LDPE)薄膜时,未饲喂抗生素组LDPE 薄膜的失重率为25%(m/m),饲喂抗生素组LDPE 薄膜的失重率为21%(m/m),因此Kesti 等[40]认为肠道微生物对LDPE 降解率影响不明显。Cassone 等[41]用LDPE 饲喂大蜡螟幼虫,研究其脂肪体(脂肪体是解毒的重要器官),与饥饿组相比,用LDPE 喂养的幼虫脂肪体大小增加3 倍,线粒体能力提高80%(m/m),因此,推定LDPE 代谢物不会阻碍脂肪体的代谢,但是研究表明,LDPE 或其代谢物会损坏幼虫对饥饿的生理反应。用LDPE 饲喂幼虫,幼虫体内饱和脂肪酸总量明显降低,与饲喂蜂巢的幼虫相比,喂养LDPE 的幼虫和饥饿的幼虫都缺少糖和氨基酸这些可溶性代谢物。此研究表明塑料饮食可以为大蜡螟幼虫提供一些能量,但同时由于缺乏必要的营养物质,不能促进生存和生长。Bozek 等[42]研究黄粉虫对PVC 生物降解,认为昆虫中储存的脂质和碳水化合物量可以维持以塑料为日粮的基本代谢,因此幼虫可以在纯塑料食物中生存,但体重不断下降。
在研究昆虫降解PP、PVC 等塑料中,采用多种技术手段分析实验结果。在超级蠕虫对PP 的降解中,用凝胶渗透色谱分析虫粪,发现对PP 的降解有限,用热重分析仪分析虫粪,有残留PP,也有降解产物[36]。Lee 等[37]从超级蠕虫肠道中分离出降解塑料的微生物,16S rRNA 测序分析确定这些分离物为铜绿假单胞菌,利用元素组成分析,发现此菌在PS 表面有氧信号,后将此菌分别接种在含有PP 和PE 的液体培养基中,发现PE 表面有氧信号,PP 表面的氧信号弱,这些现象表明铜绿假单胞菌可以降解PP、PE、PS,但是对PP 的降解效果最差,进一步实验明确与降解有关的酶是铜绿假单胞菌分泌的丝氨酸水解酶(Serine hydrolase)。
昆虫及肠道微生物降解塑料,昆虫会对降解塑料的种类进行选择,黄粉虫降解PS、PP、PVC 的研究较多,大蜡螟降解PE、LDPE、PS 等的研究较多,超级蠕虫降解PS、PP 研究较多,昆虫对塑料种类的选择性,可能与昆虫肠道微生物种类不同有关。在降解中发现不同种的昆虫降解同种塑料时,从肠道微生物中筛选出的降解菌株不同,说明在昆虫肠道中能降解塑料的微生物有多种,将来研究从不同昆虫中筛选出的可以降解塑料的微生物,后将这些不同源不同种的微生物共协对塑料进行降解,让肠道微生物降解塑料实际应用更近一步。
研究昆虫及肠道微生物降解塑料时,利用NGS技术,通过16S rRNA 基因、18S rRNA 基因或其他标记基因和基因组区域的分析,分析肠道微生物群落的变化;利用气相色谱—质谱仪、凝胶渗透色谱仪等技术,结合蛋白质组学、代谢组学,研究降解产物的分子结构。多组学、多技术共协为研究昆虫及微生物降解塑料的机制提供理论和技术支持。
2 昆虫及肠道微生物降解塑料的作用机制
昆虫及肠道微生物对塑料的降解机制并不明确,许多研究认为,降解的初始阶段是氧化和破坏环状结构。研究黄粉虫降解PS 时,Yang 等[30]提出可能的降解机制,首先,聚合物通过咀嚼分解成更小的颗粒,增大塑料的接触面,有利于微生物和胞外酶的作用;其次,摄入的颗粒被肠道微生物群分泌的细胞外酶降解成小分子物质,然后被肠道微生物群或幼虫生物降解矿化成CO2,物质中的碳元素同化到生物质中;最后,残留的碎片和其他中间产物从幼虫的粪便排出。
基于代谢组学和色谱分析,Wang 等[43]提出大蜡螟肠道中两条可能降解PS 的代谢途径:苯乙烯氧化为苯乙醛途径,4-甲基苯酚转换为4-羟基苯甲醛再转换为4-羟基苯甲酸酯途径,这些代谢途径需要不同宿主内源酶[细胞色素P450s、烷烃羟化酶(Alkane Hydroxylase)、单氧酶(Monooxygenase)和环羟基化二加氧酶(Cyclohydroxylated Dioxygenase)]参与。Zhe 等[44]研究草地贪夜蛾(Nocturnal grasshopper Moth)幼虫摄食PVC 时,提出克雷伯氏菌属(Klebsiella)EMBL-1 通过二氯化、氧化、解聚和生物矿化的亚合成途径生物降解PVC。研究饲喂PS 的大蜡螟肠道内容物[36],发现PS 塑料在肠道中是通过两种途径解聚:苯酚-4-羟基苯甲醛-4-羟基苯甲酸甲酯途径和氧化苯乙烯-苯乙醛途径。在超级蠕虫、黄粉虫和大蜡螟幼虫降解PS 的比较实验中,超级蠕虫幼虫会将PS 降解为低分子量化合物,而黄粉虫会破坏苯环结构,从而解聚PS[23]。Zhong 等[45]研究黄粉虫幼虫降解LDPE、PS 泡沫时,用凝胶渗透色谱证实LDPE、PS 泡沫的解聚和氧化,利用转录组学,在饲喂LDPE 组中,发现水解酶(Hydrolysis Enzyme)(作用于酯键、糖和C-N 键)上调,这种现象可能与PE 降解生成的长链醇、长链C-C 或C-N 连接的羧酸或长链脂肪酸有关。在饲喂PS 泡沫组中,发现与糖、肽键和酸酐裂解有关的转录物增加,这些产物可能与能量供应有关(ATP 依赖反应)。因此Zhong 等认为塑料生物降解的原因是由远端聚合物骨架的细胞外解聚酶的扩散引起,脂肪酸代谢参与了塑料中间物的降解,在PS 降解过程中,中间产物则可作为幼虫的碳源。
在研究降解机制中,研究者们认为昆虫体内的酶与塑料的降解有密切关联。如在昆虫肠道微生物降解PE 时,角蛋白酶(Keratinase)、水解酶、脂肪酶(Lipase)和酯酶对PE 降解起重要作用[46]。ZHANG 等从大蜡蛾的肠道内容物中分离出一种能降解PE 的真菌,命名为可降解PE 的黄曲霉真菌PEDX3(PE-degrading fungus Aspergillus flavus,PEDX3)[47],从PEDX3 筛选出两株漆酶多铜氧化酶(Laccase-like Multicopper Oxidases,LMCOs),认为这LMCOs 是PE 降解的关键酶。RESTREPOFLREZl 等认为微生物分泌的胞外酶是降解的重要因素,因为这些胞外酶可以降低塑料表面的疏水性[48]。同时,在降解塑料中,漆酶,锰过氧化物酶(Manganese Peroxidase),木质素过氧化酶(Lignin Peroxidase)这些酶可能会降解高密度聚乙烯(High Density Polyethylene,HDPE)[46]。Bilal 等[49]认为漆酶有催化HDPE 生物氧化的潜在能力。BRANDON 研究发现喂食PS 和PE 的面包虫(Mealworm)中肠道中发现柠檬酸杆菌酶(Citrobacillus Enzyme)[50],分析发现其中几种柠檬酸杆菌酶可以降解苯二胺。
在昆虫在降解塑料中,不仅与昆虫体内的酶有关,也可能与昆虫体内其他物质有关。Anja 等[19]认为黄粉虫在降解塑料时,分泌一种或多种乳化因子(30~100 ku),昆虫的肠道微生物分泌的乳化因子(小于30 ku)能够促进PS 的解聚。降解的机制是黄粉虫分泌乳化因子,乳化因子增强塑料的亲水性,肠道微生物开始降解塑料。实际上,降解塑料的过程是黄粉虫肠道微生物和宿主共同作用的结果。Urbanek 从能降解PS 的黄粉虫肠道中筛选出几种微生物:粘质沙雷氏菌、克雷伯氏菌和铜绿假单胞菌,对这几种菌单独培养后,发现对PS 没有降解能力[28]。这也表明,这些菌株可能需要黄粉虫分泌的某种因子来降解塑料。
通过目前的研究进展,昆虫降解塑料时,其降解机制可能分为如下几步:第一步昆虫咀嚼粉碎塑料,第二步昆虫咀嚼中分泌乳化因子,第三步昆虫体内的胞外酶定植在塑料表面切开塑料聚合链,第四步昆虫体内胞内酶的参与将塑料长链切开变为短链,第五步完成降解。
3 展望
单独使用昆虫及肠道微生物降解塑料的应用性受限,在实际应用中可将影响塑料降解的紫外线、pH 值、温度、机械粉碎和能够改变塑料疏水性的物质等多因素共协,提高降解率,进而增加昆虫及肠道微生物应用可行性。分析昆虫及肠道微生物降解塑料的研究现状,结合影响塑料降解的多因素,提出昆虫及肠道微生物降解塑料的可行思路。
思路一、从现有能够降解塑料的昆虫中筛选降解率高的昆虫,从昆虫肠道分离可降解塑料的微生物菌株,富集菌株,制作菌球,配合紫外线、pH、温度、机械粉碎和能够改变塑料疏水性的物质,提高塑料降解率。
思路二、利用NGS、气相色谱—质谱联用技术、凝胶渗透色谱仪等技术,结合蛋白质组学、代谢组学、转录组学等组学,研究昆虫肠道微生物降解塑料的关键节点和蛋白质,降解时酶的触发机制,昆虫摄食塑料时内分泌调控机制,异源异属的微生物共协降解机制,为昆虫及肠道微生物降解塑料提供研究思路。
综上所述,未来通过建立更多分离培养方法,借助低成本测序,微生物组大数据,利用人工智能对微生物大分子挖掘和验证,PICRUST 预测分析软件等,以期在昆虫及肠道微生物降解塑料研究方面取得突破,让昆虫及肠道微生物降解塑料离实际应用更近一步。
[1] MOHARIR RV,KUMAR S.Challenges associated with plastic waste disposal and allied microbial routes for its effective degradation: A comprehensive review [J].Journal of Cleaner Production,2019,208: 65-76.
[2] RU JK,HUO YX,YANG Y.Microbial degradation and valorization of plastic wastes [J].Frontiers in Microbiology,2020,11: 442.
[3] BASSET Y,CIZEK L,CUENOUD P,et al.Arthropod diversity in a tropical forest [J].Science,2012,338(6113):1481-1484.
[4] 魏舸,白亮,曲爽,等.昆虫共生微生物在病虫害和疾病控制上的应用前景 [J].微生物学报.2018,58(6):1090-1102.
[5] MORAN NA,PLAGUEl GR,SANDSTRM JP,et al.A genomic perspective on nutrient provisioning by bacterial symbionts of insects [J].Proceedings of the National Academy of Sciences of the United States of America,2003,100(Suppl 2): 14543-14548.
[6] CASSONE B J,GROVE H C,ELEBUTE O,et al.Role of the intestinal microbiome in low-density polyethylene degradation by caterpillar larvae of the greater wax moth,Galleria mellonella [J].Proceedings of the Royal Society B-biological Sciences,2020,287: 20200112.
[7] MONTAZER Z,NAJAFI M B H,LEVIN D B.In vitro degradation of low-density polyethylene by new bacteria from larvae of the greater wax moth,Galleria mellonella [J].Canadian Journal of Microbiology,2021,67(3): 249-258.
[8] LATOUR S,NOEL G,SERTEYN L,et al.Multi-omics approach reveals new insights into the gut microbiome of Galleria mellonella (Lepidoptera: Pyralidae) exposed to polyethylene diet [J].BioRxiv,2021,4: 446152.
[9] MAHMOUD E A,AL-HAGAR O E A,EL-AZIZ M F A.Gamma radiation effect on the midgut bacteria of Plodia interpunctella and its role in organic wastes biodegradation [J].International Journal of Tropical Insect Science,2021,41: 261-272.
[10] PRZEMIENIECKI S W,KOSEWSKA A,CIESIELSKI S,et al.Changes in the gut microbiome and enzymatic profile of Tenebrio molitor larvae biodegrading cellulose,polyethylene and polystyrene waste [J].Environmental Pollution,2020,256:113265.
[11] KUNDUNGAL H,GANGARAPU M,SARANGAPANI S.Role of pretreatment and evidence for the enhanced biodegradation and mineralization of low-density polyethylene films by greater wax worm [J].Environmental Science &Technology,2021,42(5): 717-730.
[12] KONG H G,KIM HH,CHUNG JH,et al.The Galleria mellonella hologenome supports microbiota-independent metabolism of long chain hydrocarbon beeswax [J].Cell Reports,2019,26: 2451-2464.
[13] PEYDAEI A,BAGHERI H,GUREVICH L,et al.Impact of polyethylene on salivary glands proteome in Galleria melonella Comp Biochem physiol [J].Genomics,Proteomics&Bioinformatics,2020,34: 100678.
[14] BOMBELLI P,HOWE C J,BERTOCCHINI F.Polyethylene bio-degradation by caterpillars of the wax moth Galleria mellonella [J].Current Biology,2017,27: R292-R293.
[15] BILLEN P,KHALIFA L,VAN GERVEN F,et al.Technological application potential of polyethylene and polystyrene biodegradation by macroorganisms such as Mealworms and Wax moth larvae [J].Science of the Total Environment,2020,735: 139521.
[16] PEA-PASCAGAZA P M,LOPEZ-RAMREZ N A,BALLENSEGURA M A.Tenebrio molitor and its gut bacteria growth in polystyrene (PS) presence as the sole source carbon [J].University Science,2020,25: 37-53.
[17] LOU Y,LI YR,LU BY,et al.Response of the yellow mealworm (Tenebrio molitor) gut microbiome to diet shifts during polystyrene and polyethylene biodegradation [J].Journal Of Hazardous Materials,2021,416: 126222.
[18] CUCINI C,LEO C,VITALE M,et al.Bacterial and fungal diversity in the gut of polystyrene-fed Alphitobius diaperinus(Insecta: Coleoptera) [J].Animal Geneties,2020,17-18:200109.
[19] BRANDON AM,GARCIA AM,KHLYSTOV NA,et al.Enhanced bioavailability and microbial biodegradation of polystyrene in an enrichment derived from the gut microbiome of Tenebrio molitor (Mealworm Larvae) [J].Environmental Science &Technology,2021,55: 2027-2036.
[20] YANG Y,YANG J,WU WM,et al.Biodegradation and mineralization of polystyrene by plastic-eating mealworms:Part 2.Role of gut microorganisms [J].Environmental Science&Technology,2015,49: 12087-12093.
[21] JIANG S,SU TT,ZHAO JJ,et al.Isolation,identification,and characterization of polystyrene-degrading bacteria from the gut of Galleria mellonella (Lepidoptera: Pyralidae) Larvae [J].Frontiers in Bioengineering and Biotechnology,2021,9:736062.
[22] JIANG S,SU TT,ZHAO JJ,et al.Biodegradation of polystyrene by Tenebrio molitor,Galleria mellonella,and Zophobas atratus larvae and comparison of their degradation effects [J].Polymers,2021,13: 3539.
[23] PENG B-Y,CHEN Z,CHEN J,et al.Biodegradation of polystyrene by dark (Tenebrio obscurus) and yellow (Tenebrio molitor) mealworms (Coleoptera: Tenebrionidae) [J].Environmental Science &Technology,2019,53: 5256-5265.
[24] LOU Y,EKATERINA P,YANG SS,et al.Biodegradation of polyethylene and polystyrene by greater wax moth larvae (Galleria mellonella L.) and the effect of codiet supplementation on the core gut Microbiome [J].Environmental Science &Technology,2020,54,2821-2831.
[25] ZHU P,PAN XS,LI XW,et al .Biodegradation of plastics from waste electrical and electronic equipment by greater wax moth larvae (Galleria mellonella) [J].Journal of Cleaner Production,2021,310: 127346.
[26] KIM H R,LEE H M,YU H C,et al.Biodegradation of polystyrene by Pseudomonas sp.isolated from the gut of superworms (larvae of Zophobas atratus) [J].Environmental Science &Technology,2020,54: 6987-6996.
[27] WOO S,SONG I,CHA H J.Fast and facile biodegradation of polystyrene by the gut microbial flora of plesiophthalmus davidis larvae [J].Applied and Environmental Microbiology,2020,86(18): e01361-20.
[28] BULAK P,PROC K,PYTLAK A,et al.Biodegradation of different types of plastics by Tenebrio molitor insect [J].Polymers 2021,13: 3508.
[29] URBANEK A K,RYBAK J,WROBEL M,et al.A comprehensive assessment of microbiome diversity in Tenebrio molitor fed with polystyrene waste [J].Environmental Pollution,2020,262: 114281.
[30] YANG Y,YANG J,WU W M,et al.Biodegradation and mineralization of polystyrene by plastic-eating mealworms:Part 1.Chemical and physical characterization and isotopic tests [J].Environmental Science &Technology,2015,49:12080-12086.
[31] TSOCHATZIS E,LOPES JA,GIKA H,et al.Polystyrene biodegradation by Tenebrio molitor larvae: identification of generated substances using a GC-MS untargeted screening method [J].Polymers,2021,23: 1-12.
[32] KOSEWSKA O,OLSZTYN MI,KOSEWSKA A,et al.Alternative ways of foamed polystyrene recycling using insects as an element of sustainable development [J].Economic Science for Rural Development,2019,52(9-10): 45-52.
[33] TSOCHATZIS ED,BERGGREEN IE,NRGAARD JV,et al.Biodegradation of expanded polystyrene by mealworm larvae under different feeding strategies evaluated by metabolic profiling using GC-TOF-MS [J].Chemosphere,2021,281:130840.
[34] LUO LP,WANG YM,GUO HQ,et al.Biodegradation of foam plastics by Zophobas atratus larvae (Coleoptera: tenebrionidae)associated with changes of gut digestive enzymes activities and Microbiome [J].Chemosphere 2021,282: 131006.
[35] PENG B-Y,CHEN Z,CHEN J,et al.Biodegradation of polyvinyl chloride (PVC) in Tenebrio molitor (Coleoptera:tenebrionidae) larvae [J].Environment International,2020,145: 106106.
[36] YANG SS,DING MQ,HE L,et al.Biodegradation of polypropylene by yellow mealworms (Tenebrio molitor) and superworms (Zophobas atratus) via gut-microbedependent depolymerization [J].Science of the Total Environment,2021,756: 144087.
[37] LEE H M,KIM H R,JEON E,et al.Evaluation of the biodegradation efficiency of four various types of plastics by Pseudomonas aeruginosa isolated from the gut extract of superworms [J].Microorganisms,2020,8: 1-12.
[38] PALACIO-CORTES AM,HORTON A A,NEWBOLD L,et al.Accumulation of nylon microplastics and polybrominated diphenyl ethers and effects on gut microbial community of Chironomus sancticaroli [J].Science of the Total Environment,2022,832: 155089.
[39] SALAZAR-SANCHEZ,M DELR,RODRGUEZHERRERA R,et al.Intestinal microbiome changes of Ulomoides dermestoides (Chevrolat,1878) fed with a film based on thermoplastic cassava starch and polylactic acid [J].Environmental Quality Management,2022,32(1): 413-424.
[40] KESTI SS,THIMMAPPA SC .First report on biodegradation of low density polyethylene by Rice moth larvae,corcyra ephalonica (staintion) [J].The Holistic Approach to Environment,2019,9 (4): 79-83.
[41] CASSONE B J,GROVE H C,KURCHABA N,et al.Fat on plastic: metabolic consequences of an LDPE diet in the fat body of the greater wax moth larvae (Galleria mellonella) [J].Journal of Hazardous Materials,2021,425: 127862.
[42] BOZK M,HANUS-LORENZ B,RYBAK J.The studies on waste biodegradation by Tenebrio molitor [J].E3S Web Conferences,2017,17: 136342411.
[43] WANG S,SHI W,HUANG ZC,et al.Complete digestion/biodegradation of polystyrene microplastics by greater wax moth (Galleria mellonella) larvae: direct in vivo evidence,gut microbiota independence,and potential metabolic pathways [J].Journal of Hazardous Materials,2022,423:127213.
[44] ZHE Z,PENG H,YANG DC,et al.Polyvinyl chloride biodegradation fuels survival of invasive insect larva and intestinal degrading strain of Klebsiella [J].BioRxiv,2021,5:462898.
[45] ZHONG Z,NONG W,XIE YC,et al.Long-term effect of plastic feeding on growth and transcriptomic response of mealworms (Tenebrio molitor L.) [J].Chemosphere,2022,287: 132063.
[46] NOVOTN C,ERBANOV P,SEZIMOV H,et al.Biodegradation of aromatic-aliphatic copolyesters and polyesteramides by esterase activity-producing microorganisms [J].International Biodeterioration and Biodegradation,2015,97: 25-30.
[47] ZHANG JQ,GAO DL,LI QH,et al.Biodegradation of polyethylene microplastic particles by the Fungus aspergillus flavus from the guts of wax moth Galleria mellonella [J].The Science of the Total Environment,2020,704(20): 135931.
[48] RESTREPO-FLREZl J-M,BASSI A,THOMPSON MR.Microbial degradation and deterioration of polyethylene-areview [J].International Biodeterioration and Biodegradation,2014,88: 83-90.
[49] BILA M,RASHEED T,NABEEL F,et al.Hazardous contaminants in the environment and their laccase-assisted degradation-a review [J].Environmental Management,2019,234: 253-264.
[50] BRANDON AM,GAO SH,TIAN RM,et al.Biodegradation of polyethylene and plastic mixtures in mealworms (Larvae of Tenebrio molitor) and effects on the gut microbiome [J].Environmental Science &Technology,2018,52: 6526-6533.