真菌毒素是真菌如曲霉菌、青霉菌、交链孢、镰刀菌等在温润潮湿的环境下生长产生的一类代谢产物,通常存在于谷物、水果、饲料等农产品及加工产品中[1,2]。目前已发现的真菌毒素有400 多种,毒性较强的有黄曲霉毒素类、赭曲霉毒素类、脱氧雪腐镰刀菌烯醇类及展青霉素等,具有致癌、致畸和致突变等危害[3-5]。我国仅规定了水果及其制品中展青霉素的限量为50 μg/kg[6],对于龙眼及其制品等热带水果中真菌毒素的限量未做要求。龙眼的产地主要集中在温暖潮湿的南部,如广东、广西、海南等。由于龙眼属热带水果,在生长、运储和加工等过程中易受到微生物病原菌的侵染[7-9],产生并积累各种真菌毒素。据文献报道,目前真菌毒素污染情况的研究主要集中一些常见的水果及果干,如苹果、山楂、葡萄干、龙眼干及核桃等,龙眼及其制品中真菌毒素污染研究较少。Tournas等[10]研究发现,葡萄和苹果在低温贮存时产生交链孢酚单甲醚和链格孢霉毒素,且随着贮藏时间的延长,毒素逐渐累积;Wei 等[11]从葡萄及其制品等中检出赭曲霉毒素A,含量为0~10.14 μg/kg;王玉娇[12]研究发现,桂圆干(龙眼干)中检出黄曲霉毒素B2、黄曲霉毒素G2、玉米赤霉烯酮、白僵菌毒素等,其中黄曲霉毒素类检出率最高为46.7%。
目前,真菌毒素的检测方法有高效液相色谱法(HPLC)[13]、薄层色谱法(TLC)[14]、高效液相色谱-串联质谱法(HPLC-MS/MS)[15,16]等。HPLC 法需要柱后或者柱前衍生,前处理步骤复杂,检测灵敏度不高;薄层色谱法较单一,不能同时检测多种真菌毒素,且定量不够准确;HPLC-MS/MS 具有高分辨率、高灵敏度,可同时检测多种真菌毒素,逐渐成为真菌毒素主流的分析方法。尽管已经有很多学者建立了对水果及其制品中真菌毒素的HPLC-MS/MS检测方法,但是前处理技术还不够简便,高效液相压力较小,无法实现短时间内同时检测40 种以上真菌毒素,基于此,本文建立了超高效液相色谱-串联质谱法(UPLC-MS/MS)检测龙眼及其制品中多种真菌毒素的高通量检测方法,该方法前处理简便,在12 min 内可同时分析44 种真菌毒素及18 种真菌毒素同位素内标,共计62 种目标物。本文应用建立的方法对17 批次龙眼及其制品中44 种真菌毒素进行检测,并采用风险商(HQ)对其进行膳食暴露风险评估,以期服务监管,指导消费者合理饮食,把控热带果蔬中真菌毒素产生的源头。
1 材料与方法
1.1 仪器与试剂
AB SCIEX Triple Quad 4500 超高效液相色谱-串联质谱仪(ESI 电喷雾离子源),美国AB SCIEX公司;Mettler XS204 型十万分之一分析天平,美国Mettler Toledo 公司;Hettich 302R 高速冷冻离心机,德国Hettich 公司;BC-1000 多管涡旋混合器,中国深圳逗点生物技术有限公司;SK8200B 超声仪器,上海科导超声仪器有限公司。
甲醇、乙腈(LC/MS 级),美国Merck 公司;甲酸(LC/MS 级),美国ACS 公司;PSA、C18(粒径40~60 μm),美国Agela Technologies 公司;WatersPRiME HLB(200 mg,6 mL),美国Waters公司;44 种真菌毒素标准品和18 种同位素内标见表1(纯度均大于99.0%),天津阿尔塔有限公司、青岛Pribolab 公司、美国O2Si 公司、美国CATO 公司;实验用新鲜龙眼及部分龙眼干购自本地超市和农贸市场;部分龙眼干及龙眼果酱等购自淘宝商城,产地主要为海南、广东和福建。粉碎后于-20 ℃保存。
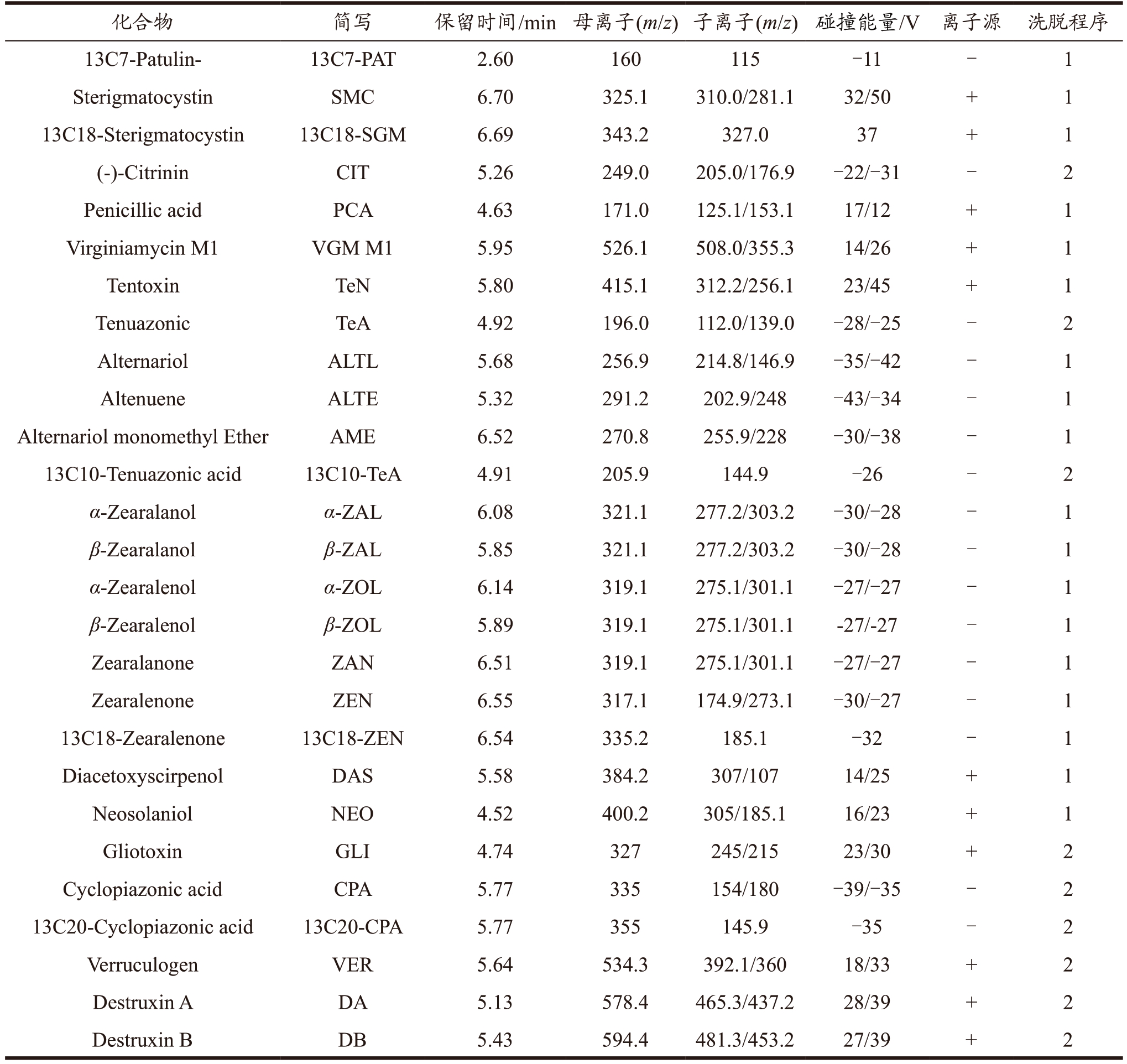
表1 真菌毒素及同位数内标的质谱参数
Table 1 MS/MS spectrometry parameters for mycotoxins and internal standards
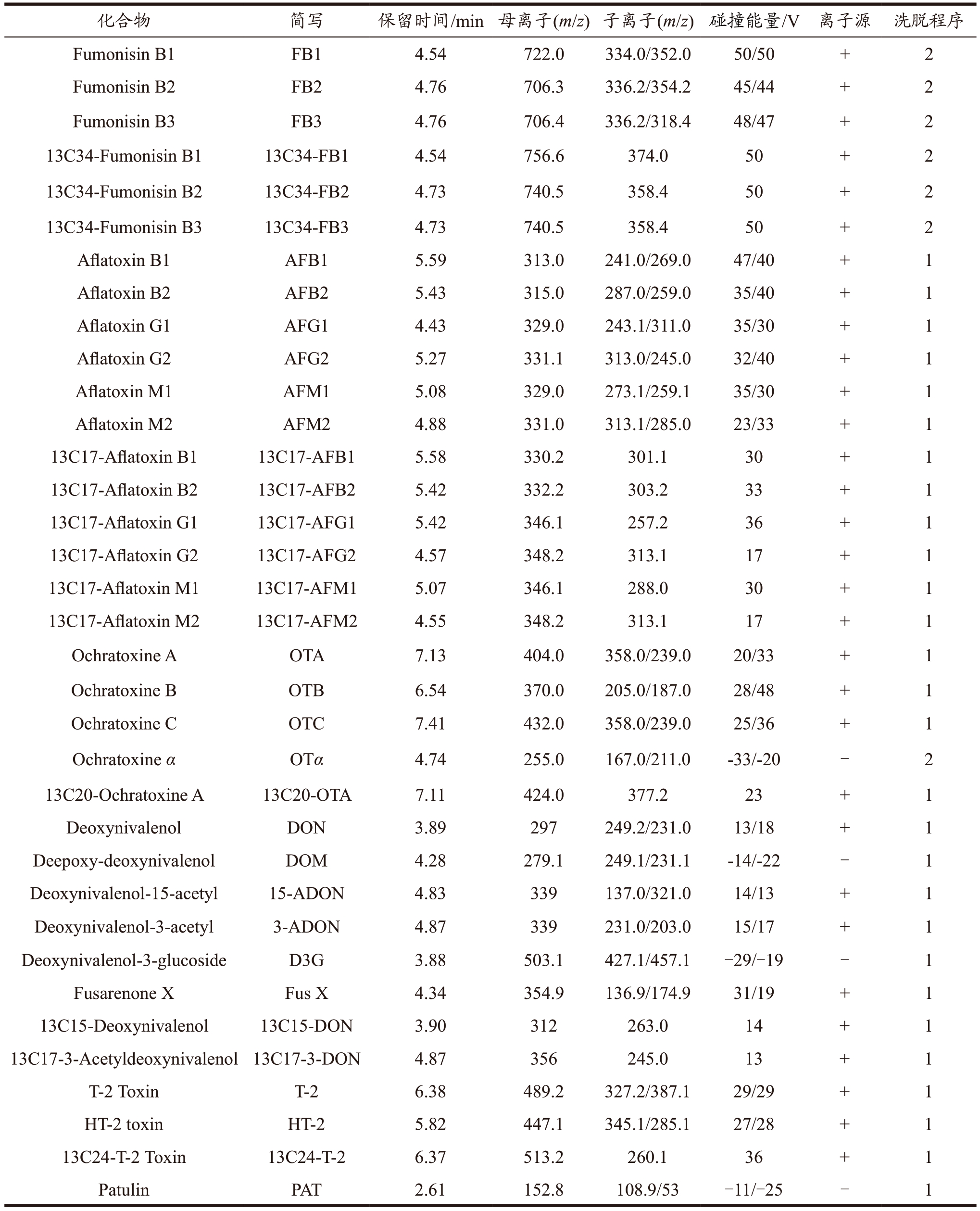
续表1
1.2 实验方法
1.2.1 标准工作溶液的配制
分别称取或吸取44 种真菌毒素标准品适量,用乙腈配制成质量浓度分别为400 ng/mL(伏马毒素B1~B3,脱氧雪腐镰刀菌烯醇、去环氧脱氧雪腐镰刀菌烯醇、15-乙酰基脱氧雪腐镰刀菌烯醇、3-乙酰基脱氧雪腐镰刀菌烯醇、脱氧雪腐镰刀菌烯醇-3-葡萄糖苷、镰刀菌烯醇、展青霉素)、100 ng/mL(赭曲霉毒素A、B、C、α)、50 ng/mL(黄曲霉毒素B1~M2)、200 ng/mL(其他真菌毒素)的混合标准使用溶液,于-20 ℃保存。
分别称取或吸取18 种同位素内标标准品适量,用乙腈配制成质量浓度分别为10 ng/mL(黄曲霉毒素B1~M2 内标)、100 ng/mL(其他内标)的混合内标使用溶液。
1.2.2 样品前处理
称取2 g 经粉碎均匀的试样于离心管(50 mL)中,加入400 μL 混合内标使用溶液,混匀,静置15 min,加入10 mL 的80%乙腈水溶液(V/V,含1%乙酸),涡旋混匀10 min,超声提取10 min,离心5 min(10 000 r/min),吸取全部上清液至分散固相萃取管中(200 mg PSA+200 mg C18),立即摇匀并涡旋10 min,离心5 min(10 000 r/min),吸取5 mL 上清液,于40 ℃下氮气吹近干,用1.0 mL 10%乙腈水溶液(V/V)溶解残渣,涡旋30 s,经有机滤膜(0.22 μm)过滤后测定,同时做空白试验。
1.3 仪器条件
质谱参数:电喷雾ESI源,离子源温度为550 ℃;电喷雾电压是4.5 kV(ESI+和ESI-);雾化气和加热气均为50 psi,气帘气为25 psi;碰撞室入口电压为10 V(ESI+和ESI-);多反应监测(SRM)扫描模式。44 种真菌毒素及18 种真菌毒素同位素内标质谱参数见表1,最佳洗脱程序见表2。
表2 梯度洗脱程序
Table 2 Gradient elution program
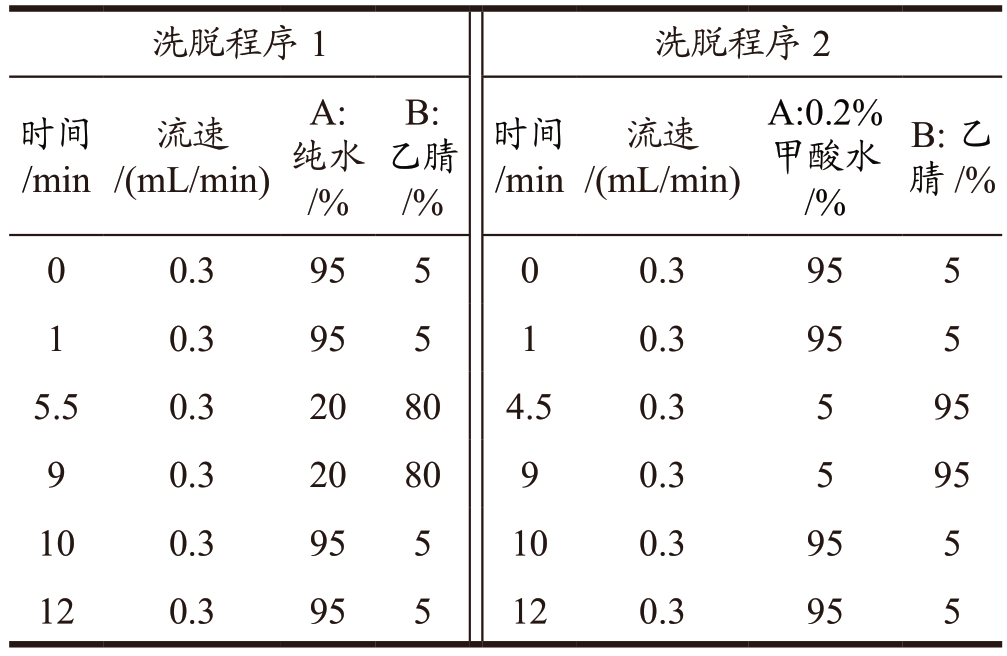
注:色谱柱Waters ACQUITY UPLC BEH C18(1.7 μm,2.1 mm×100 mm),柱温35 ℃,进样量5 μL。
1.4 提取溶剂的选择
比较80%乙腈水溶液(V/V,含1%乙酸)、1%甲酸乙腈溶液(V/V,提取溶剂2)、80%乙腈水溶液(V/V,含1%甲酸,提取溶剂3)、80%乙腈水溶液(V/V,含0.1%甲酸,提取溶剂4)4 种提取溶剂提取效果。以龙眼为基质,通过回收率比较4种提取溶剂对44 种真菌毒素的提取效果及基质干扰影响,确认最佳的提取溶剂。
1.5 净化方式的选择
比较2.0 g 无水MgSO4+0.5 g NaCl(净化方式1)、200 mg PSA+200 mg C18(净化方式2)、WatersPRiME HLB(净化方式3)、未加净化剂(即取5 mL 提取液直接氮吹后复溶,净化方式4)。以龙眼为基质,通过回收率比较4 种净化方式对44种真菌毒素的净化效果及基质干扰影响,确认最佳的净化方式。
1.6 膳食风险评估
本文采用风险商(HQ)法对龙眼及其制品中部分真菌毒素进行膳食暴露风险评估。HQ 指通过膳食摄入某有害物质的安全风险的大小,即表示为通过食用龙眼及其制品摄入真菌毒素每日摄入估计量EDI(Estimated Daily Intake)与每日最大耐受摄入量PMTDI(Provisional Maximum Tolerable Daily Intake)之比[17]。当HQ<1 时,表示无风险;当HQ>1 时,表示有风险,且HQ 数值与风险成正比。

式中:
A——风险商(HQ);
B——每日摄入估计量(EDI);
D——每日最大耐受摄入量(PMTDI);
C——样品中真菌毒素污染的平均含量,μg/kg;
K——人均日消费量,g/d;
E——体质量,kg。
2 结果与讨论
2.1 色谱柱的筛选
选择Waters ACQUITY UPLC BEH C18(2.1 mm×100 mm,1.7 μm)、PhenomenexLuna Omega Polar C18(2.1 mm×100 mm,1.6 μm)、PhenomenexKinetex XB C18(2.1 mm×100 mm,1.7 μm)、Waters BEH HILIC(2.1 mm×100 mm,2.7 μm)和Waters HSS T3(2.1 mm×100 mm,1.7 μm)等5 款色谱柱,经过比较,结果显示,Waters ACQUITY UPLC BEH C18 色谱柱对44 种真菌毒素及18 种同位素内标的MRM 色谱峰响应及峰型等相对较好,分离效果最佳。张宇等[18]使用Waters ACQUITY UPLC BEH C18(2.1 mm×100 mm,1.8 μm)分离植物油中16种真菌毒素,分离效果、色谱峰型及响应良好;范楷等[19]使用Agilent Poroshell 120 EC-C18(3.0 mm×100 mm,2.7 mm)检测小麦、玉米、稻谷、番茄和桃等常见农产品中40 种真菌毒素,各真菌毒素的峰形区分度良好,3 个添加水平的平均加标回收率为71.8%~118.6%。说明C18 色谱柱适用于44 种真菌毒素检测。综合考虑,选择Waters ACQUITY UPLC BEH C18 色谱柱。图1为采用Waters ACQUITY UPLC BEH C18 色谱柱的44 种真菌毒素MRM 色谱图。

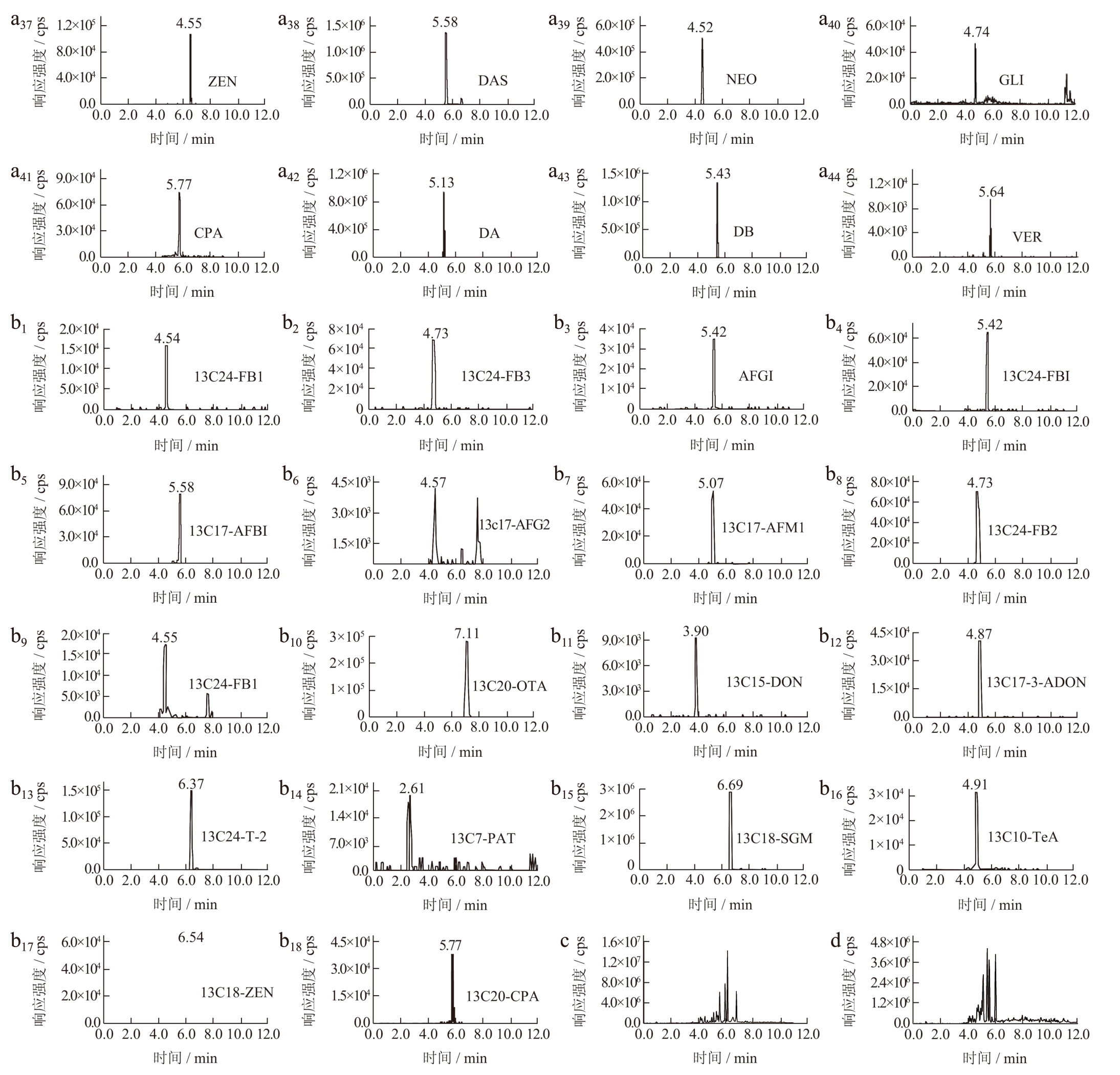
图1 (a)44 种真菌毒素MRM 图,(b)18 种内标MRM 图,(c)44 种真菌毒素在纯水-乙腈流动相体系下的总离子图,(d)44 种真菌毒素在0.2%甲酸水-乙腈流动相体系下的总离子图
Fig.1 (a) MRM chromatograms of 44 mycotoxins;(b) MRM chromatograms of 18 internal standards;(c) Ion chromatograms of 44 mycotoxins at water-acetonitrile mobile phases;(d) Ion chromatograms of 44 mycotoxins at 0.2% FA-acetonitrile mobile phases
2.2 流动相的筛选
考虑水-乙腈、0.2% FA 水溶液-乙腈、水-甲醇、0.2% FA 水溶液-甲醇、10 mmol/L 甲酸铵水溶液-乙腈、10 mmol/L 甲酸铵水溶液-甲醇等不同质量浓度和不同梯度的流动相对真菌毒素的峰型及响应的影响。结果显示,FB1、FB2、FB3 及相应同位素内标只在0.2% FA 水-乙腈流动相体系下出峰,在其他流动相条件下无响应或者峰型拖尾;OTα、CIT、TeA、GLI、CPA、VER、DA 和DB 及相应内标采用0.2% FA 水-乙腈的分离效果好,采用水-乙腈时其峰型拖尾、不对称且峰型较宽,说明这几种毒素在甲酸的加入下,其响应强度和峰型得到明显改善。其余真菌毒素采用0.2% FA 水-乙腈和水-乙腈的分离效果均好,但水-乙腈的响应强度比0.2% FA水-乙腈更高。流动相采用水-甲醇、0.2% FA 水溶液-甲醇体系时,其峰型及响应强度都不及乙腈体系,OTα、TeA、CPA、DON 等及相应同位素内标拖尾、峰型较差,FB1、FB2、FB3 及相应同位素内标峰出现分叉峰;流动相中加入甲酸铵,对大部分的真菌毒素的峰型没有起到明显作用。赵健等[20]测定小麦中伏马毒素B1 和B2、T-2、杂色曲霉毒素4 种真菌毒素时,以0.1%甲酸水-乙腈作为流动相,并发现甲醇-水和乙腈-水作为流动相时,伏马毒素B1 和素B2 等峰形较差,在流动相中加入甲酸,其峰型得到明显改善,当有机相为乙腈时,4 种真菌毒素的灵敏度和峰形均优于甲醇作流动相;综合考虑,流动相选择水-乙腈和0.2% FA 水溶液-乙腈2 个梯度进行洗脱(见图1,表1~表2)。
2.3 提取溶剂的选择
根据文献[20-23]及国标方法[24-28]等,选择4 种不同提取溶剂进行提取。根据半箱线图2,提取溶剂1(80%乙腈水溶液,含1%乙酸)回收率为72.9%~135.3%,回收率均在1.5 IQR(Interquartile Range,IQR)的界限范围内,相对集中,中位线在100%范围内,因此提取溶剂1 的回收率最好,基质干扰较小;提取溶剂2(1%甲酸乙腈溶液)的回收率11.7%~150.0%,虽然回收率主要在1.5 IQR 界限范围内,但其1.5 IQR 界限范围较宽,整体回收率偏差大,整体回收率不好;提取溶剂3(80%乙腈水溶液,含1%甲酸)的回收率为0%~288.8%,有2 个离群值,提取溶剂4(80%乙腈水溶液,含0.1%甲酸)的回收率为8.4%~344.9%,有4 个离群值;提取溶剂3 和4 回收率分散,整体回收率较差,说明基质干扰较大。栾玉静等[29]在检测常见的大米、玉米、水果等样品中15 种真菌毒素时,采用乙腈-水-甲酸(79:20:1,V/V/V)提取后,直接用5%乙酸的50:50(V/V)乙腈水溶液稀释的方法来净化,提取效果良好,样品低、高2 个添加水平的回收率为72.09%~136.58%;王蒙等[30]采用含有1%乙酸的乙腈-水(80:20,V/V)结合自制固相萃取柱(200 mg MCX+200 mg HLB,6 mL)提取检测苹果、樱桃和番茄等果蔬中痕量真菌毒素,效果良好。说明在提取体系中使用一定的乙腈水溶液,并含有一定量的乙酸,真菌毒素提取效果较好。因此,本文选择80%乙腈水溶液(含1%乙酸)作为提取溶剂。
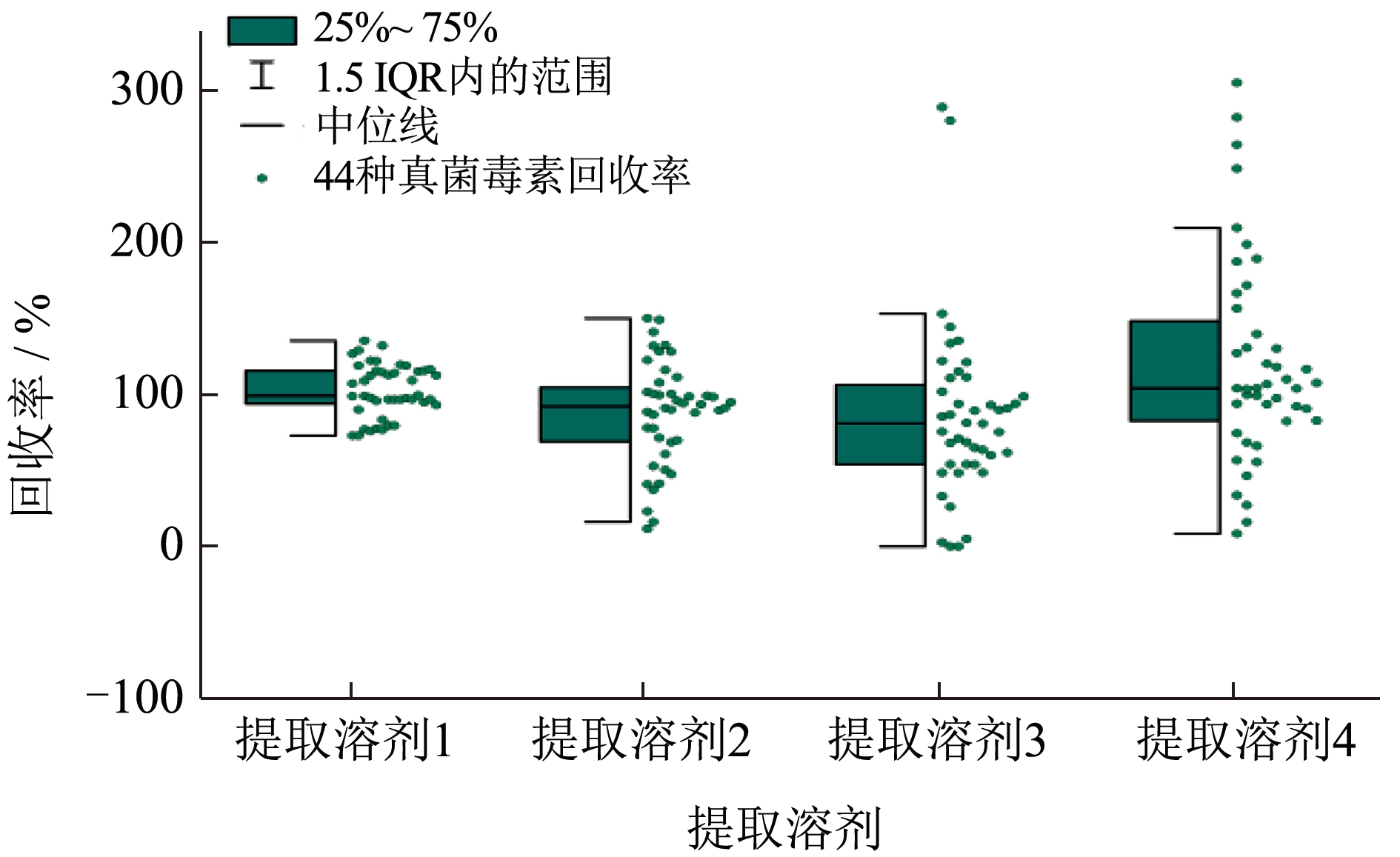
图2 4 种不同提取剂对44 种真菌毒素回收率的影响
Fig.2 Effect of 4 different extraction solvents on recovery of 44 mycotoxins
2.4 净化方式的选择
根据文献[30-32]等,选择4 种不同净化方式进行试验。根据半箱线图3,净化方式2(200 mg PSA+200 mg C18)回收率为72.0%~131.0%,回收率均在1.5 IQR 界限范围内,相对集中,中位线在100%范围内,因此使用净化方式2 净化的回收率最好;净化方式1 回收率为23.5%~204.5%,虽然回收率主要在1.5 IQR 界限内,但其1.5 IQR 界限范围较宽,回收率不好;净化方式3回收率为6.9%~221.3%,有4 个离群值,净化方式4 回收率为0%~210.2%,有2 个离群值,且其1.5 IQR 界限范围较宽,整体回收率偏差大,回收率不好。龙眼及其制品中糖、有机酸等含量较高,PSA 对具有极性的糖等有较强吸附力,C18 可用于果蔬中有机酸、糖的分析,PAS 和C18 的复合使用可有效去除龙眼及其制品中糖、有机酸等杂质,大大消除基质效应的影响,同时本文采用同位素内标法定量,显著提高44 种真菌毒素的回收率。赵健等[33]检测大米中10 种真菌毒素时,由于大米含有丰富的糖和蛋白质,样品经提取液提取后,使用80 mg PSA 进行净化,净化效果较好,10 种真菌毒素的回收率在70%~120%;瞿广胜等[34]检测豆腐、豆腐乳、小豆、黄豆等样品中6 种真菌毒素时,使用净化剂(MgSO4+PSA+C18为600 mg+400 mg+200 mg),C18 和PSA 可以去除豆类样本基质中脂质和脂肪酸,有效消除基质效应,其加标回收率为81.5%~119.6%。说明PSA 和C18可以去除样本中糖类、蛋白质、有机酸等的杂质,有效降低基质效应的影响。因此,本文选择200 mg PSA+200 mg C18 做净化试验。
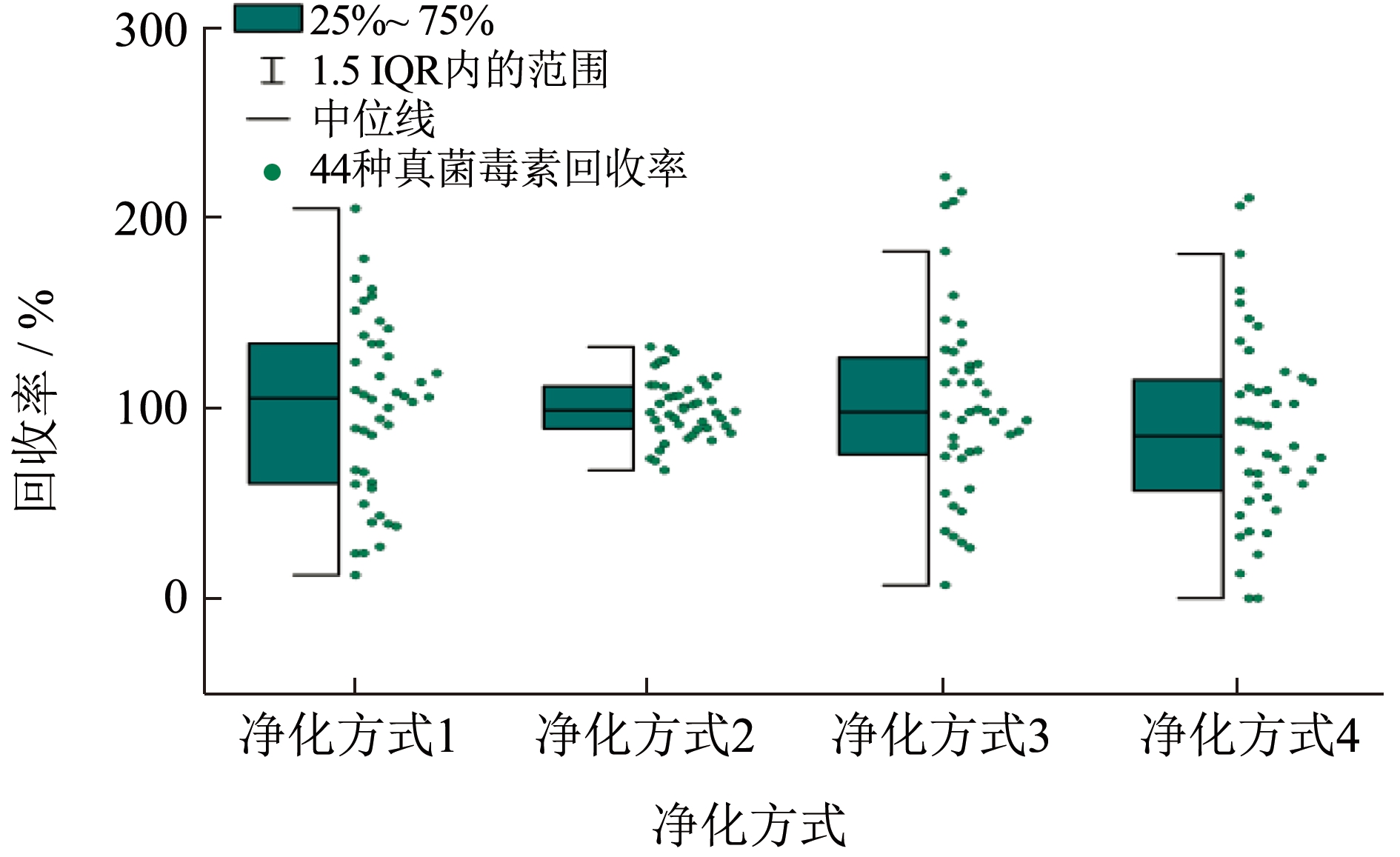
图3 4 种不同净化方式对44 种真菌毒素回收率的影响
Fig.3 Effect of 4 different purification methodson recovery of 44 mycotoxins
2.5 线性范围、检出限、定量限、精密度
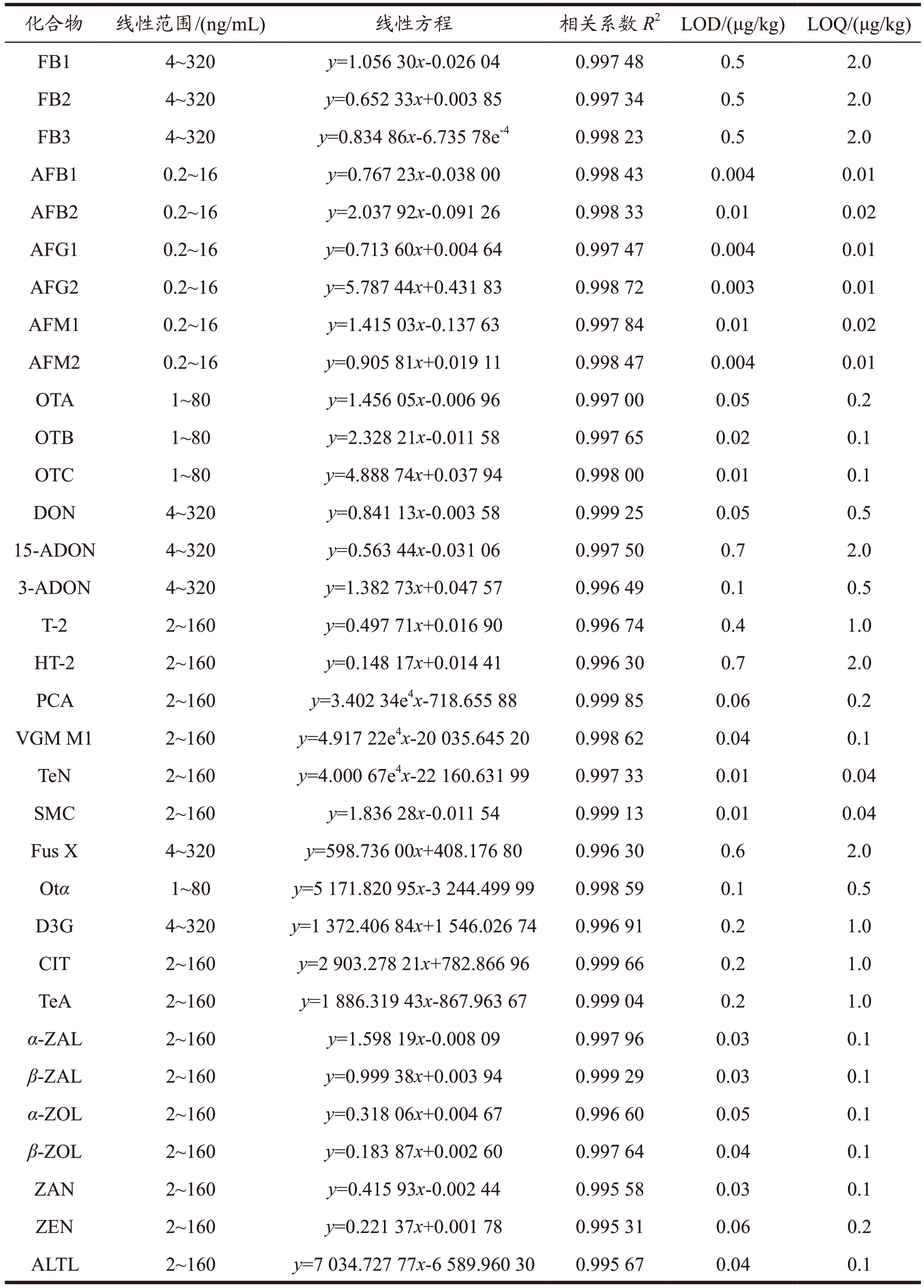
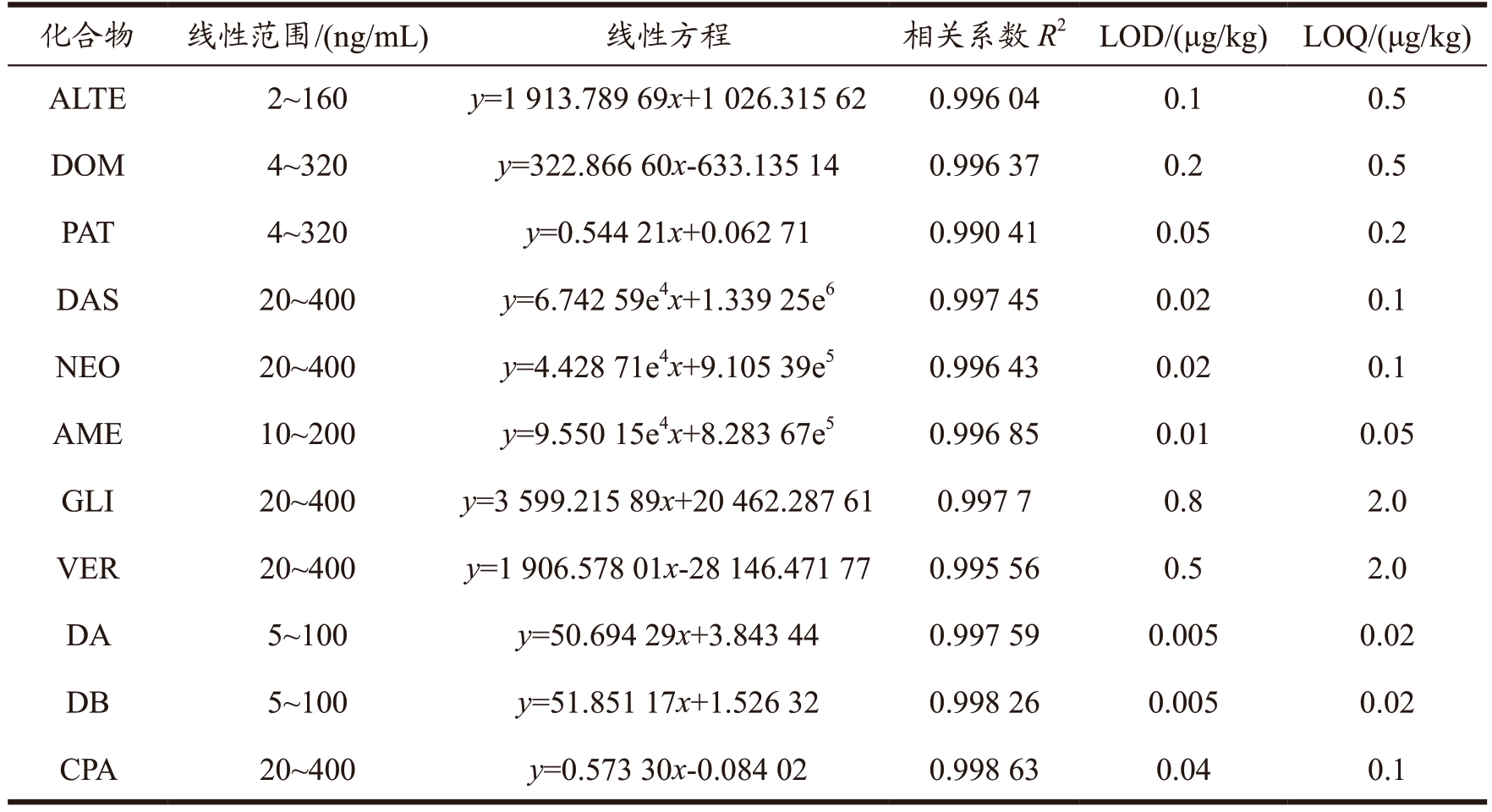
采用基于UPLC-MS/MS 最佳方法条件进行方法学研究,以真菌毒素质量浓度x 为横坐标,峰面积y 为纵坐标建立曲线,线性范围及线性关系等见表3。44 种真菌毒素的线性关系均良好,相关系数R2 ≥ 0.990 41,检出限(Limit of Detection,LOD)为0.003~0.7 μg/kg,定量限(Limit of Quantitation,LOQ)为0.01~2.0 μg/kg;本方法的检出限和定量限均低于部分标准GB 5009.240-2016、GB 5009.22-2016、GB 5009.24-2016、GB 5009.96-2016、GB 5009.111-2016、SN/T 3136-2012、GB/T 21982-2008、GB 5009.209-2016、GB 5009.185-2016 等高效液相色谱-串联质谱法规定的检出限及定量限,说明本实验优化的方法灵敏度较高。通过6 次重复性试验,方法的精密度RSD(n=6)为0.7%~9.7%,说明该方法稳定性良好。
表3 44种真菌毒素的线性范围、相关性、检出限、定量限
Table 3 Linear range,R2,LOD and LOQ of the 44 mycotoxins
续表3
2.6 加标回收结果
以龙眼、龙眼干及龙眼果酱空白样品为基质,按低、中、高3 个梯度水平的质量浓度点进行加标实验,其中FB1~FB3、DON、DOM、15-ADON、3-ADON、D3G、Fus X、PAT 等3 个质量浓度点为10、20、40 μg/kg,OTA、OTB、OTC、OTα 等3 个质量浓度点为2.5、5、10 μg/kg,AFB1~AFM2等3 个质量浓度点为1.25、2.5、5 μg/kg,其他真菌毒素3 个质量浓度点为5、10、20 μg/kg;每个样3 个平行,按照1.2.2 处理样品,结果见图4。龙眼的加标平均回收率为70.7%~119.8%,龙眼干为70.8%~117.8%,龙眼果酱为71.8%~123.6%;总体加标平均回收率在70.7%~123.6%范围,RSD 为0.1%~10%,符合样品检测要求。
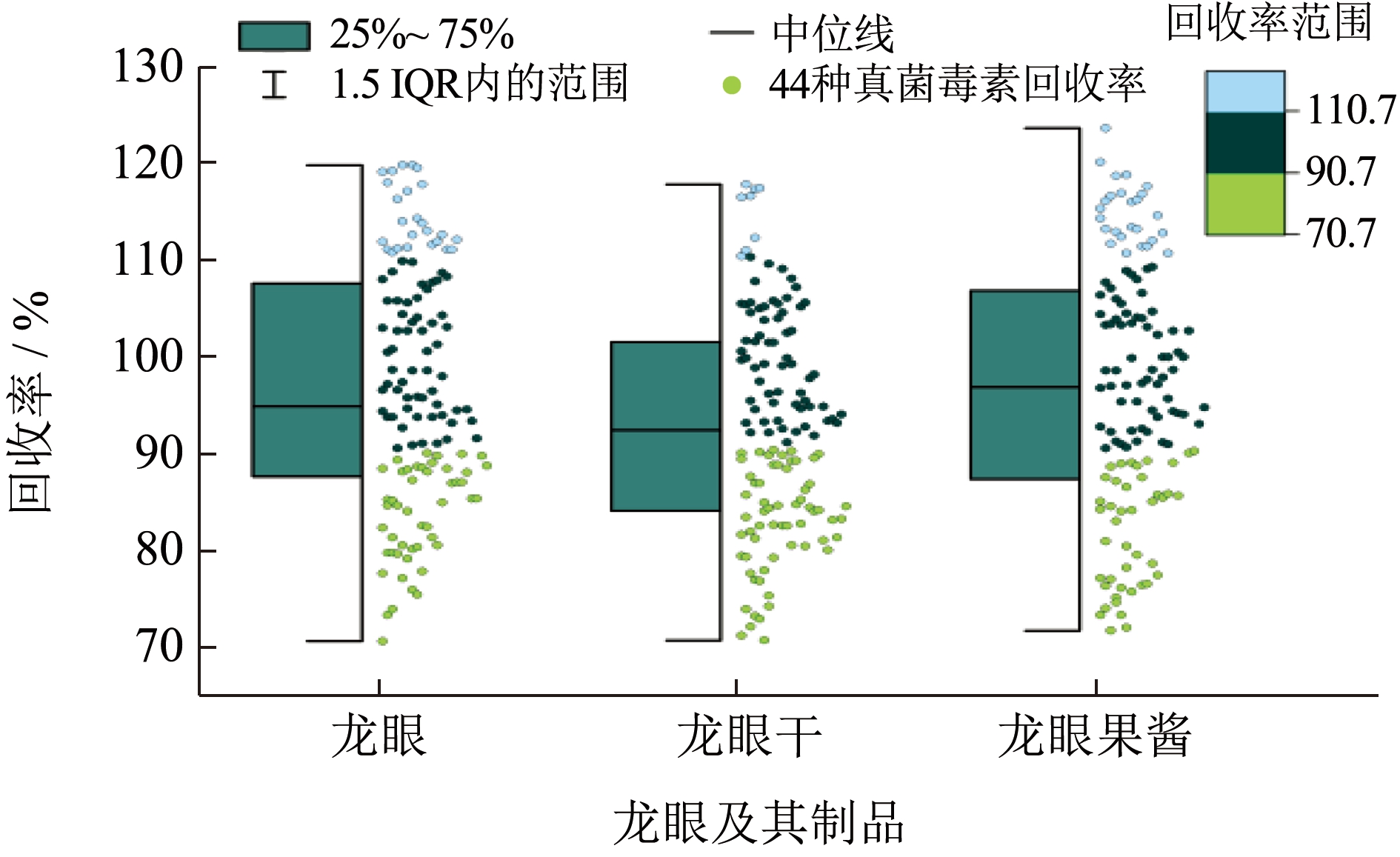
图4 3 种样品中44 种真菌毒素的加标回收实验结果
Fig.4 Experimental results of adding recovery of 44 mycotoxins from three samples
2.7 样品真菌毒素污染情况分析
对购买的17 批次龙眼及其制品中44 种真菌毒素进行检测,结果见表4,每个样品均有20 种以上真菌毒素不同程度检出,阳性率为100%。龙眼及其制品中检出含量较高的真菌毒素为15-ADON、Fus X、PAT、TeA 等,潜在风险也较高,其中龙眼干中检出的15-ADON含量最高为7 473.0 μg/kg,龙眼、龙眼干及龙眼果酱等每个样品中44 种真菌毒素总和的平均含量分别为2 240.3、2 735.1、387.1 μg/kg。同时,龙眼制品中检出的真菌毒素种类比新鲜龙眼多,表明龙眼制品特别是龙眼干比新鲜龙眼更容易受到真菌感染和霉菌毒素污染。
表4 龙眼及其制品中44种真菌毒素检出情况
Table 4 The situation of 44 mycotoxins were detected in longan and its products
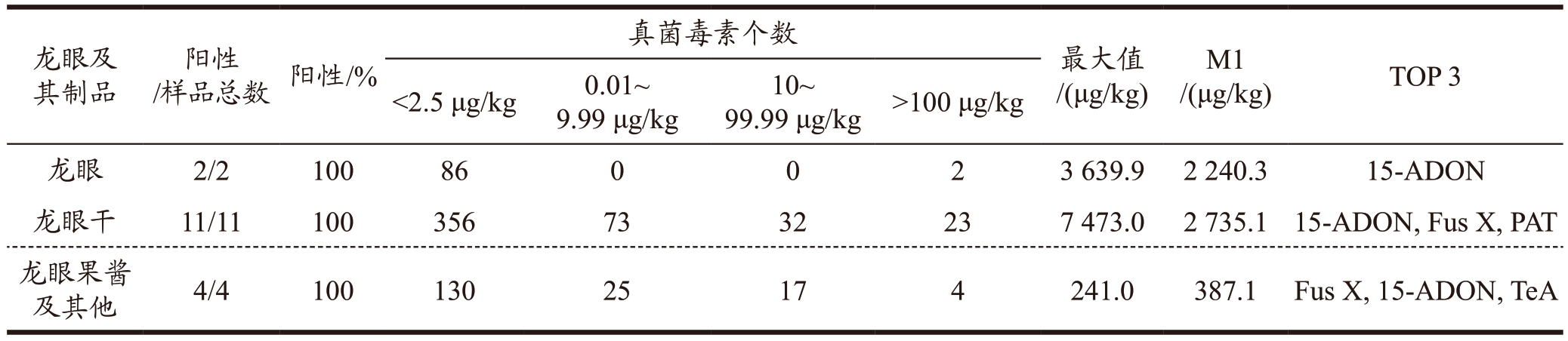
注: M1:每个样品中44 种真菌毒素总和的平均含量;TOP 3:含量较高的3 类毒素。
2.8 膳食暴露风险评估
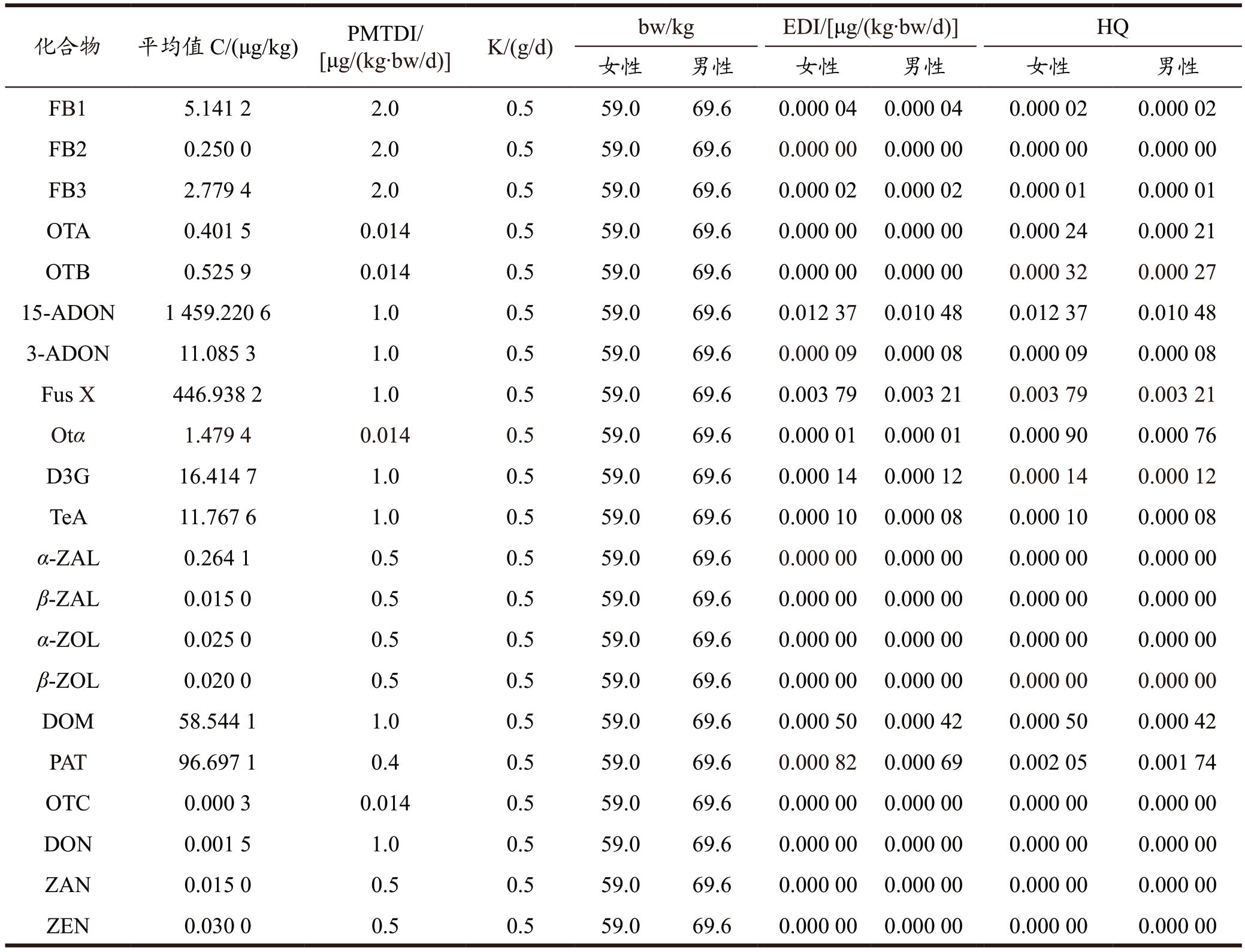
据报道,我国居民水果及水果制品的消费量为0.5 g/d[12] ;根据《中国居民营养与慢性病状况报告(2020 年)》我国18 岁及以上居民成年男性和女性的体重bw 分别为69.6 kg 和59.0 kg。样品中真菌毒素污染的平均含量C 为所有样品的真菌毒素污染值计算所得,其中未检出和小于检出限的样品污染值按1/2 检出限计算,小于定量限的样品污染值按1/2 定量限计算;部分真毒毒素PMTDI 值尚未被确立,采用每天1.0 μg/ (kg.bw)或与同族(已报道的PMTDI)相同的PMTDI[35-38]来评估分析其膳食暴露风险。
通过表5 膳食暴露风险评估结果,龙眼及其制品中21 种真菌毒素的EDI 为每天0~0.012 37 μg/(kg.bw),中国消费者食用龙眼及其制品而摄入的21 种真菌毒素的风险商值HQ 为0~0.012 37,HQ 均低于1,说明没有风险,对人体健康威胁性较小。15-ADON、Fus X、PAT、TeA 等,在龙眼及其制品中平均污染水平高于其他真菌毒素,说明在龙眼生长、贮藏及加工过程中,这4 类真菌毒素为主要污染毒素,应受到关注,同时由多种真菌毒素污染引起的协同毒性作用也不容忽视。Ji 等[17]使用HQ 法对龙眼干中展青霉素进行膳食暴露风险评估,结果显示,21批次龙眼干中19批次样品均检出展青霉素,最大值为194.3 μg/kg,平均值为68.4 μg/kg,HQ 为0.001 4,对人体健康威胁性较小,本文评估结果与其一致。通过风险评估结果性别差异分析显示,女性对21 种真菌毒素的膳食摄入水平整体高于男性,但是差别不显著。
表5 中国消费者对真菌毒素的膳食暴露风险评估
Table 5 Dietary exposure assessment of mycotocxins consumption for Chinese consumers
3 结论
本文建立了UPLC-MS/MS 测定龙眼及其制品中44 种真菌毒素的高通量检测方法,采用正负离子多反应监测扫描模式,内标法定量分析。结果表明,44种真菌毒素的线性关系均良好(R2 ≥ 0.990 41),检出限为0.003~0.7 μg/kg,定量限为0.01~2.0 μg/kg。该方法的精密度RSD(n=6)为0.7%~9.7%,低、中、高3 个梯度水平的回收率为70.7%~123.6%。该方法的前处理步骤简单、快速,适用于龙眼及其制品中多种真菌毒素的分析检测。
本文通过建立的UPLC-MS/MS 法对17 批次龙眼及其制品中44 种真菌毒素进行检测,结果显示每个样品均有20 种以上真菌毒素不同程度检出,阳性率为100%。龙眼及其制品中检出含量较高的真菌毒素为15-ADON、Fus X、PAT、TeA 等,说明在龙眼生长、贮藏及加工过程中,这4 类真菌毒素为主要污染毒素,应受到关注。通过对21 种真菌毒素膳食暴露风险评估,结果显示中国消费者食用龙眼及其制品而摄入的HQ 为0~0.012 37,HQ均低于1,说明没有风险,对人体健康威胁性较小。但是仍需加强日常监管,消费者在食用时因尽量选择保质期新,未存在霉斑的龙眼干等,且在加工过程中应当采用防霉手段进行处理。
[1] ZHANG Z Q,NIE D X,FAN K,et al.A systematic review of plant-conjugated masked mycotoxins: Occurrence,toxicology,and metabolism [J].Critical Reviews in Food Science &Nutrition,2020,60(9): 1523-1537.
[2] ALNABI D I B A,ALSHAWI S G,ALYOUNIS Z K,et al.Heavy metal in the soil-grain-food path: an overview of the role of Mycotoxins in potential hazards associated with animal products [J].Food Science and Technology,2022,42: e111921.
[3] YANG Y,LI G L,WU D,et al.Recent advances on toxicity and determination methods of mycotoxins in foodstuffs [J].Trends in Food Science &Technology,2020,96: 233-252.
[4] FAN K,XU J J,JIANG K Q,et al.Determination of multiple mycotoxins in paired plasma and urine samples to assess human exposure in Nanjing,China [J].Environmental Pollution,2019,248: 865-873.
[5] PONGPRAKET M,POAPOLATHEP A,WONGPANIT K,et al.Exposure assessment of multiple mycotoxins in black and white sesame seeds consumed in Thailand [J].Journal of Food Protection,2020,83(7): 1198-1207.
[6] GB 2761-2017,食品中真菌毒素限量 [S].
[7] 潘姝历.水果中重点真菌毒素的高灵敏度光谱学检测技术研究 [D].重庆:西南大学,2018.
[8] 薛华丽,毕阳,宗元元,等.果蔬及其制品中真菌毒素的污染与检测研究进展 [J].食品科学,2016,37(23):285-290.
[9] 谢汉忠,黄玉南,李君,等.葡萄及其制品中真菌毒素研究进展 [J].农学学报,2017,7(12):70-75.
[10] TOURNAS V H,SYACK M E.Production of alternariol and alternariol methyl ether by Alternaria alternata grown on fruits at various temperatures [J].Journal of Food Protection,2001,64(4): 528-532.
[11] WEI D,WU X,XU J,et al.Determination of Ochratoxin A contamination in grapes,processed grape products and animal-derived products using ultra-performance liquid chromatography-tandem mass spectroscopy system [J].Scientific Reports,2018,8(1): 2051.
[12] 王玉娇.坚果和干果真菌毒素污染及风险评估研究 [D].北京:中国农业科学院,2018.
[13] MARINA A,MIHAIU M,MIHAIU R,et al.Monitoring of mycotoxins in feed for dairy cows and swine from Muntenia region,Romania [J].Bulletin of University of Agricultural Sciences and Veterinary Medicine Cluj-Napoca Veterinary Medicine,2019,76(2): 215-221.
[14] AGRIOPOULOU S,STAMATELOPOULOU E,VARZAKAS T.Advances in analysis and detection of major mycotoxins in foods [J].Foods,2020,9(4): 518.
[15] LACINA O,ZACHARIASOVA M,URBANOVA J,et al.Critical assessment of extraction methods for the simultaneous determination of pesticide residues and mycotoxins in fruits,cereals,spices and oil seeds employing ultra-high performance liquid chromatography-tandem mass spectrometry [J].Journal of Chromatography A,2012,1262: 8-18.
[16] WANG W,ZHANG Q,MA F,et al.Simultaneous determination of aflatoxins,fumonisin B1,T-2 and cyclopiazonic acid in agri-products by immunomagnetic solidphase extraction coupled with UHPLC-MS/MS [J].Food Chemistry,2022,1: 378.
[17] JI X F,LI R,YANG H,et al.Occurrence of patulin in various fruit products and dietary exposure assessment for consumers in China [J].Food Control,2017,78: 100-107.
[18] 张宇,李俊玲,王书舟,等.同位素稀释-超高效液相色谱串联质谱法快速测定植物油中16种真菌毒素 [J].中国卫生检验杂志,2021,31(16):1921-1926.
[19] 范楷,唐占敏,聂冬霞,等.超高效液相色谱串联质谱法测定常见农产品中40种真菌毒素 [J].食品安全质量检测学报,2020,11(19):7020-7029.
[20] 赵健,陈国,章豪,等.UPLC-MS/MS测定小麦中八种除草剂和真菌毒素 [J].湖北农业科学,2020,59(21):140-143.
[21] 曾宪冬,柳洁,曾灼祥,等.同位素稀释-液相色谱/串联质谱法测定粮食产品中多组分真菌毒素 [J].职业卫生与病伤,2020,6(35):365-371,374.
[22] 黎思乐,赵美平,容顺,等.不同前处理方法对山药中13种真菌毒素检测的影响 [J].现代食品,2021,16:188-194,198.
[23] 丘福保,卢丽明,林胜军,等.超高效液相色谱-串联质谱法测定谷物制品中18种真菌毒素 [J].粮食与食品工业,2020,27(5):64-71.
[24] GB 5009.240-2016,食品中伏马毒素的测定 [S].
[25] GB 5009.22-2016,食品中黄曲霉毒素B族和G族的测定 [S].
[26] GB 5009.24-2016,食品中黄曲霉毒素M族的测定 [S].
[27] GB 5009.118-2016,食品中T-2毒素的测定 [S].
[28] GB 5009.96-2016,食品中赭曲霉毒素A的测定 [S].
[29] 栾玉静,黄健,王瑞花,等.王芳琳同位素内标-高效液相色谱-串联质谱法检测常见食品样品中15种真菌毒素 [J].食品安全质量检测学报,2021,12(10):3970-3983.
[30] 王蒙,姜楠,韦迪哲,等.自制固相萃取柱-超高效液相色谱-串联质谱法同时测定果蔬中的8种真菌毒素 [J].食品科学,2016,37(10):213-218.
[31] 刘文静,黄彪,傅建炜,等.超高效液相色谱-串联质谱法同时测定陈年老茶中16种真菌毒素残留 [J].食品科学,2021,42(2):299-305.
[32] 刘笑笑,丁辉,吴福祥,等.杂质吸附固相萃取-液相色谱串联质谱法同时测定粮食中15种真菌毒素 [J].粮油食品科技,2021,29(1):155-167.
[33] 赵健,吕燕,许秀琴,等.一种基于超高效液相色谱串联质谱同时测定大米中10种真菌毒素和杀鼠剂的检测方法术 [J].浙江农业科学,2020,61(7):1410-1413.
[34] 瞿广胜,李显娱,徐林,等.QuEChERS-UPLC-MS/MS法测定豆类及制品中6种真菌毒素 [J].贵州农业科学,2021,49(6):99-107.
[35] Food and Agriculture Organization of the United Nations and Word Health Organizaion.Safety Evaluation of Certain Contaminants in Food.Prepared by the 44 th Meeting of the Joint FAO/WHO Expert Committee on Food Additives(JECFA) [M].Geneva: 1995.
[36] Food and Agriculture Organization of the United Nations and Word Health Organizaion.Safety Evaluation of Certain Contaminants in Food.Prepared by the 53 th Meeting of the Joint FAO/WHO Expert Committee on Food Additives(JECFA) [M].Geneva: 1999.
[37] Food and Agriculture Organization of the United Nations and Word Health Organizaion.Safety Evaluation of Certain Contaminants in Food.Prepared by the 56 th Meeting of the Joint FAO/WHO Expert Committee on Food Additives(JECFA) [M].Geneva: 2001.
[38] Food and Agriculture Organization of the United Nations and Word Health Organizaion.Safety Evaluation of Certain Contaminants in Food.Prepared by the 72 th Meeting of the Joint FAO/WHO Expert Committee on Food Additives(JECFA) [M].Geneva: 2017.