莓茶,学名显齿蛇葡萄,为葡萄科蛇葡萄属的一种多年生落叶藤本植物[1],因其茶叶产品表面覆盖一层“白霜”,故称“莓茶”。在我国湖南、湖北、贵州、广西等省份均有分布,其中湖南省野生及人工种植莓茶集中在湘西土家族苗族自治州和张家界市,拥有“溪洲莓茶”“永顺莓茶”等标志性农产品[2]。莓茶作为一种药理作用丰富的药食两用植物,最初作为一剂能够清热解毒、杀菌消炎的草药应用于民间。现代研究发现,莓茶中的功效作用主要依赖于其富含的黄酮类化合物,不同种植地区、不同品种的莓茶总黄酮含量略有差异,但一般在30%~40%之间[3,4],是目前发现的植物中黄酮含量最高,尤其是二氢杨梅素含量最高的植物,被誉为植物中的“黄酮之王”。药理研究表明,莓茶的药理作用包括:抗氧化[5-7]、保肝护肝[8,9]、抗瘤抗癌[10-12]、抑菌抗炎[13,14]等。因此,莓茶叶在医学、精细化工等领域具备良好的应用前景。
至今为止,莓茶的应用局限于茶饮保健行业[15],每年四月中旬,采摘新梢嫩芽制作为代用茶产品,剩余大量老叶等资源无法得到充分利用,且莓茶叶黄酮具备的抑菌、抗氧化、抗炎、抗敏等功效未得到充分展现。目前关于莓茶叶中黄酮的研究主要集中于提取与成分分析,对莓茶黄酮抗氧化性及稳定性鲜有报道。本文考察水提法莓茶叶黄酮的抗氧化作用与稳定性,考察莓茶叶黄酮对DPPH、ABTS+自由基的清除能力,并测定不同光照、pH 值、金属离子、氧化剂还原剂、水溶性高分子物质对莓茶叶黄酮稳定性的影响,以期为莓茶叶黄酮进一步的开发和利用提供支撑。
1 材料与方法
1.1 材料与设备
过60 目筛的干燥莓茶叶粉末,莓茶叶产自湖南省张家界区;DPPH(99%)、ABTS(98%),上海易恩化学技术有限公司;H2O2、HCl、NaOH、Vc、NaCl、KCl、MgCl2·6H2O、CuCl2·2H2O、AlCl3·6H2O、FeCl3·6H2O、无水Na2SO3、羧甲基纤维素钠、卡拉胶、环糊精、聚乙二醇均为国产分析纯。
UP 系列超纯水机,上海力辰邦西仪器科技有限公司;BSA224S 型电子分析天平,赛多利斯科学仪器有限公司;普析通用TU-1901 型紫外可见分光光度计,北京普析通用仪器有限责任公司;福洋牌F-060SD 型超声波清洗机,深圳福洋科技集团有限公司;ZF-20D 型暗箱三用紫外分析仪,上海科升仪器有限公司;1510 型酶标仪,赛默飞世尔科技公司。
1.2 试验方法
1.2.1 莓茶叶黄酮的提取及测定
1.2.1.1 莓茶叶黄酮的提取方法
取适量干燥莓茶原料,用粉碎机粉碎至粉末,过60 目筛,得到莓茶粉末,取定量莓茶粉末于磨口锥形瓶,按固液比(g:mL)1:30 的比例加入超纯水,装上回流冷凝管,冷凝管通水进行冷却,防止温度升高时水分挥发,影响提取效果,在提取温度60 ℃条件下进行超声提取1.5 h,提取液抽滤,用超纯水定容至100 mL,得到莓茶叶黄酮水提液粗品作为待测液。
1.2.1.2 莓茶叶黄酮的检测方法
参考文献[16,17],以二氢杨梅素为基准物质,采用紫外分光光度直接检测法,检测莓茶叶黄酮含量。
标准曲线的绘制:用超纯水配置0.00~40.00 μg/mL系列二氢杨梅素标准溶液,利用紫外可见光分光光度计,在290 nm 的波长下测定吸光度,以吸光度值(A)为纵坐标,二氢杨梅素溶液质量浓度(C,μg/mL)为横坐标,得到标准曲线方程,发现在0.00~40.00 μg/mL 内,吸光度与二氢杨梅素质量浓度呈良好的线性关系,可应用于莓茶叶黄酮含量测定,如图1 所示。
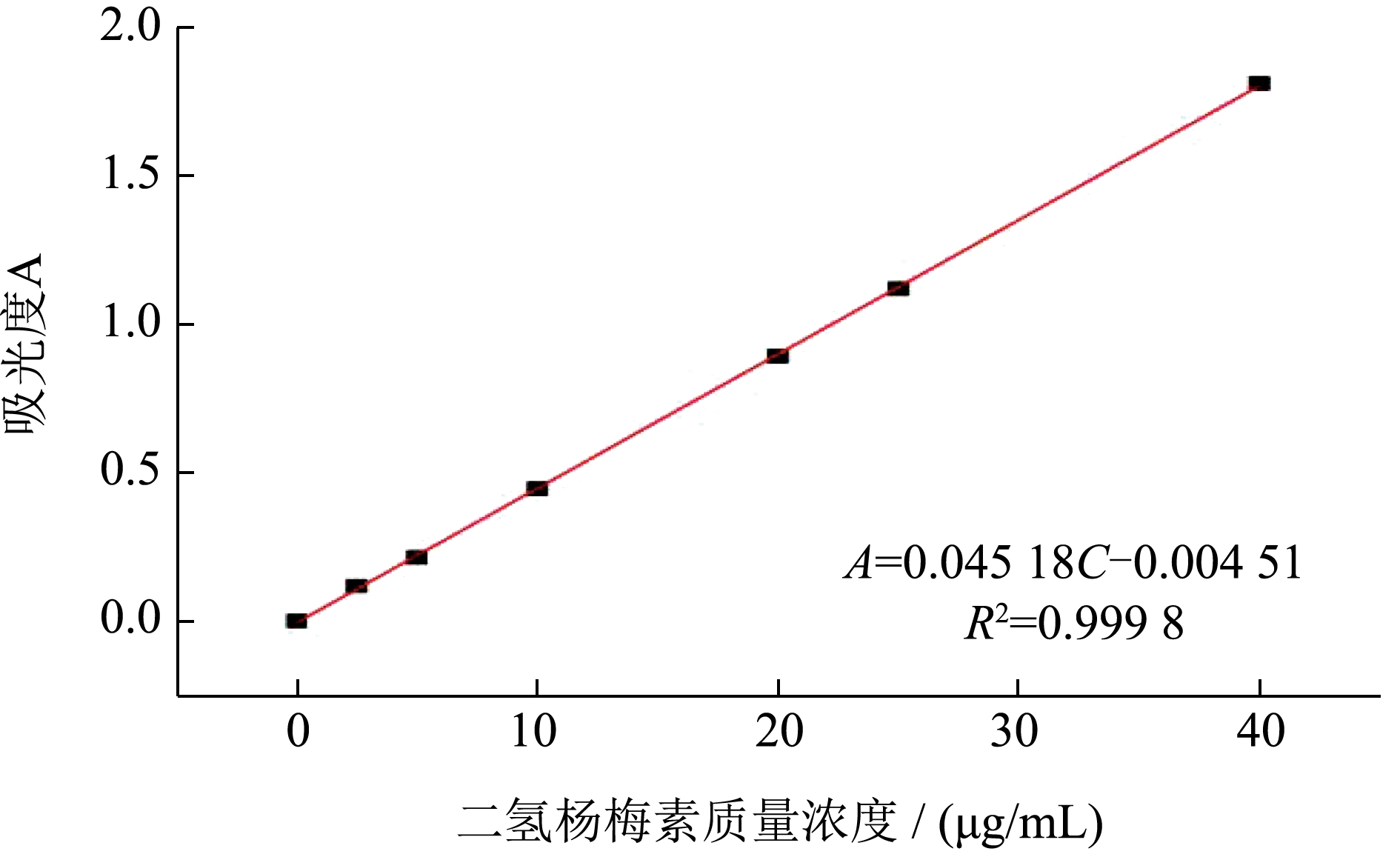
图1 二氢杨梅素标准曲线
Fig.1 standard curve of dihydromyricetin
样品溶液的检测:准确吸取50 μL 待测提取液,用超纯水定容至10 mL,摇匀后,将待测液放入已经校准过基线的紫外分光光度仪中,在290 nm 处测量吸光度,记录数据,根据二氢杨梅素标准曲线的回归方程计算出莓茶叶提取液中总黄酮含量(以二氢杨梅素含量计)。
1.2.2 莓茶叶黄酮的抗氧化性试验
1.2.2.1 DPPH自由基清除能力
参照文献[18]方法,加以改进。DPPH 溶液配制:称取2.00 mg DPPH 溶解于无水乙醇,定容至50 mL。
莓茶叶黄酮水提液的配制:取总黄酮质量浓度(以二氢杨梅素计)为2.12 mg/mL莓茶黄酮水提液,稀释水提液至不同倍数备用。
对照品Vc 溶液的配制:配制质量浓度5.00~10.00 μg/mL 范围的Vc 水溶液,配制好的溶液避光保存。
DPPH 自由基清除率的测定:在96 孔板中按文献[19]取液,混合液室温避光反应30 min,用酶标仪在517 nm 下测吸光度,计算抑制率,试验做三次平行实验,取平均值。
DPPH 自由基清除率计算公式如下:
式中:
S1——DPPH 自由基清除率,%;
A0——空白组(DPPH 溶液+超纯水);
A1——实验组(莓茶叶黄酮水提液+DPPH);A2——样品背景组(无水乙醇+莓茶叶黄酮水提液)。
1.2.2.2 ABTS+自由基清除能力
参照文献[20]方法,加以改进。ABTS 溶液配制:称取38.40 mg 的ABTS 用超纯水溶解,定容至10 mL。称取6.70 mg 的过硫酸钾(K2S2O8)用超纯水溶解,定容至10 mL。1:1 混合均匀后避光冷藏放置12 h,得到ABTS 母液,实验时用超纯水稀释。
莓茶叶黄酮水提液的配制:取总黄酮质量浓度(以二氢杨梅素计)为2.12 mg/mL莓茶黄酮水提液,稀释水提液至不同倍数备用。
对照品Vc 溶液的配制:配制质量浓度5.00~10.00 μg/mL 范围的Vc 水溶液,配制好的溶液避光保存。
ABTS+自由基清除率的测定:在96 孔板中按文献[19]取液,混合液室温避光反应30 min,用酶标仪在734 nm 下测吸光度,计算抑制率,试验做三次平行实验,取平均值。
ABTS+自由基清除率(S,%)计算公式如下:
式中:
S2——ABTS+自由基清除率,%;
A0——空白组(ABTS 溶液+超纯水);
A1——实验组(莓茶叶黄酮水提液+ABTS);
A2——样品背景组(超纯水+莓茶叶黄酮水提液)。
1.2.3 莓茶叶黄酮的稳定性试验
1.2.3.1 不同光照对莓茶叶黄酮稳定性的影响
取一定体积莓茶黄酮水提液,瓶装密封,分别放置于室外自然光、室内自然光、室内避光及254 nm 紫外光照下室温保存,分别于0~30 d 时取样,用超纯水稀释至一定倍数,在紫外分光光度计下测定吸光度,记录数据变化,用吸光度变化量比较不同光照条件下对莓茶叶黄酮的稳定性。
1.2.3.2 pH值对莓茶叶黄酮稳定性的影响
取0.10 mol/L 的HCl 溶液和0.10 mol/L 的NaOH 溶液,配置成7 种不同的pH 值溶液,取不同pH 值溶液1.00 mL,分别加入莓茶黄酮水提液5.00 mL,超纯水定容至10 mL(此时pH 值:2.0~12.0),20 ℃恒温保存,分别于0~15 d 时取样,用超纯水稀释至一定倍数后,在紫外分光光度计下测定吸光度,记录数据变化,用吸光度变化量比较不同pH 值下莓茶叶黄酮的稳定性。
1.2.3.3 不同金属离子对莓茶叶黄酮稳定性的影响
分别配制0.10 mol/L 的NaCl、KCl、MgCl2、CuCl2、AlCl3、FeCl3 溶液,各取1.00 mL,分别加入莓茶黄酮水提液5.00 mL,超纯水定容至10 mL,20 ℃恒温保存。分别于0~15 d 时取样,用超纯水稀释至一定倍数后,在紫外分光光度计下测定吸光度,记录数据变化,用吸光度变化量比较不同金属离子对莓茶叶黄酮的稳定性影响。
1.2.3.4 氧化剂、还原剂对莓茶叶黄酮稳定性的影响
氧化剂:取莓茶黄酮水提液5.00 mL,分别加入质量分数为10%的H2O2 溶液0.20~2.00 mL,超纯水定容至10 mL,20 ℃恒温保存,分别于0~7 d 时取样,用超纯水稀释至一定倍数后,在紫外分光光度计下测定吸光度,记录数据变化,用吸光度变化量比较氧化剂对莓茶叶黄酮的稳定性影响。
还原剂:取莓茶黄酮水提液5.00 mL,分别加入质量分数为10%的Na2SO3 溶液0.20~2.00 mL,超纯水定容至10 mL,20 ℃恒温保存,分别于0~7 d时取样,用超纯水稀释至一定倍数后,在紫外分光光度计下测定吸光度,记录数据变化,用吸光度变化量比较还原剂对莓茶叶黄酮的稳定性影响。
1.2.3.5 水溶性高分子物质对莓茶叶黄酮稳定性的影响
取质量浓度0.25~2.00 g/L 的羧甲基纤维素钠(Carboxymethyl Cellulose,CMC)、卡拉胶、β-环糊精、聚乙二醇1.00 mL,加入莓茶黄酮水提液5.00 mL,超纯水定容至10 mL,20 ℃恒温保存,分别于0~15 d时取样,用超纯水稀释至一定倍数后,在紫外分光光度计下测定吸光度,记录数据变化,用吸光度变化量比较水溶性高分子物质对莓茶叶黄酮的稳定性影响。
1.2.4 数据分析
采用SPSS 25 进行数据分析,结果用平均值表示,并用Origin 软件对数据制图。
2 结果与讨论
2.1 莓茶叶黄酮的抗氧化作用
由图2 可知,莓茶叶黄酮能很好的清除DPPH、ABTS+自由基,其自由基清除能力与黄酮含量呈正相关性,且莓茶叶黄酮对DPPH、ABTS+自由基的清除效果均优于对照组Vc 水溶液,对DPPH、ABTS+自由基清除的IC50 分别为3.09、1.43 μg/mL,Vc 水溶液对DPPH、ABTS+自由基清除的IC50 分别为6.24、5.80 μg/mL。表明莓茶叶黄酮有着很好的抗氧化作用。
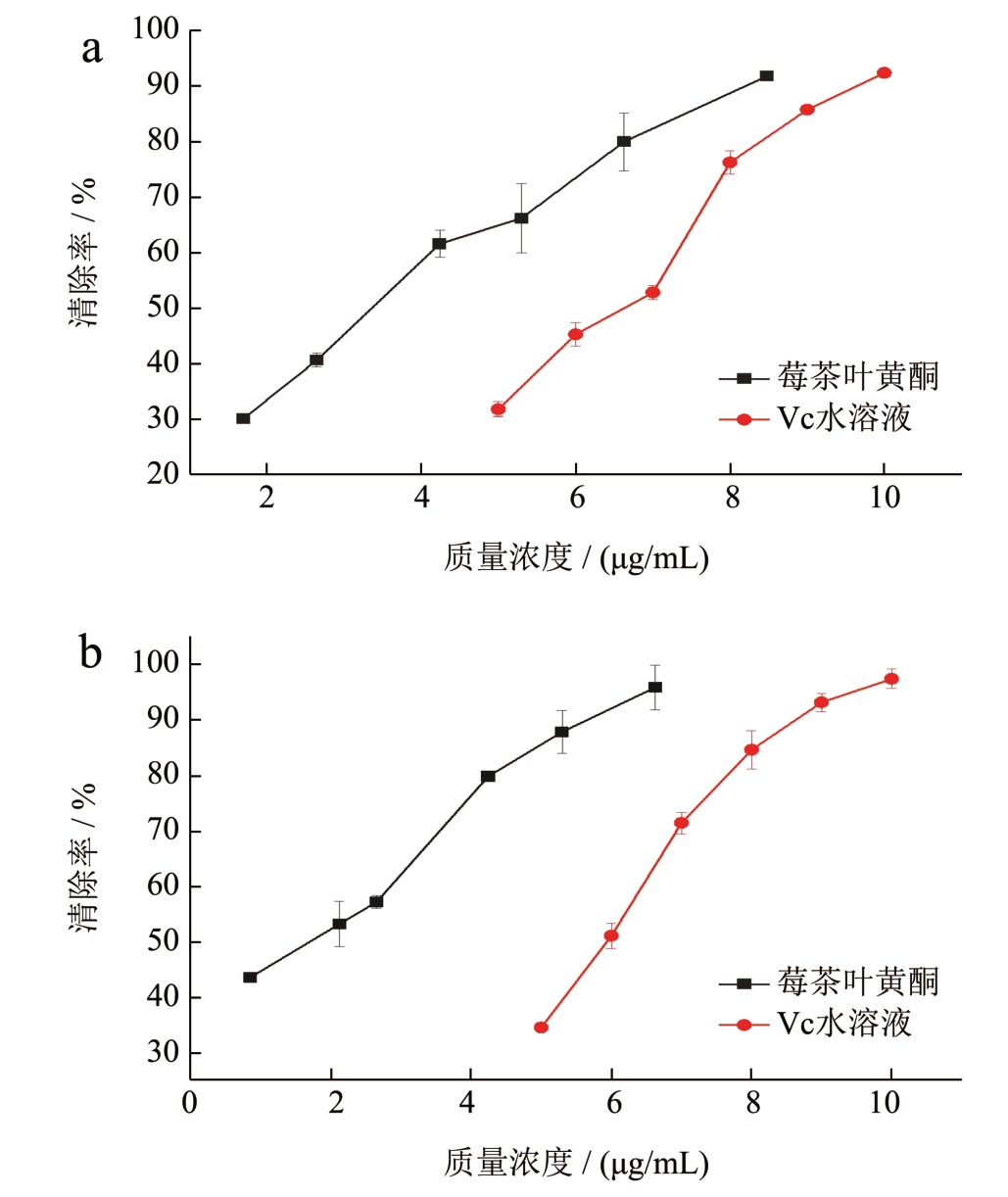
图2 莓茶叶黄酮、Vc 水溶液对DPPH(a)和ABTS+(b)的清除能力
Fig.2 The scavenging ability of Mei-tea (Ampelopsis grossedentata)flavonoids and Vc aqueous solutions on DPPH (a) and ABTS+ (b)
2.2 莓茶叶黄酮的稳定性
2.2.1 不同光照对莓茶叶黄酮稳定性的影响
由图3 可知,不同光照下莓茶叶提取液中总黄酮稳定性随存放时间变化规律一致,均为存放时间越长,吸光度越低,且随着存放时间的延长,吸光度趋于稳定。不同光照对提取液中总黄酮稳定性的影响顺序为:254 nm 紫外光照>室外光>室内自然光>室内避光,表明光照在一定程度上可以促进提取液中黄酮类化合物发生降解或氧化,使其稳定性变差。HIND 等也发现黄酮对紫外线敏感,具有一定光敏性[21]。因此为保证莓茶叶黄酮的长期稳定存放,在贮存时,建议避免阳光直晒。
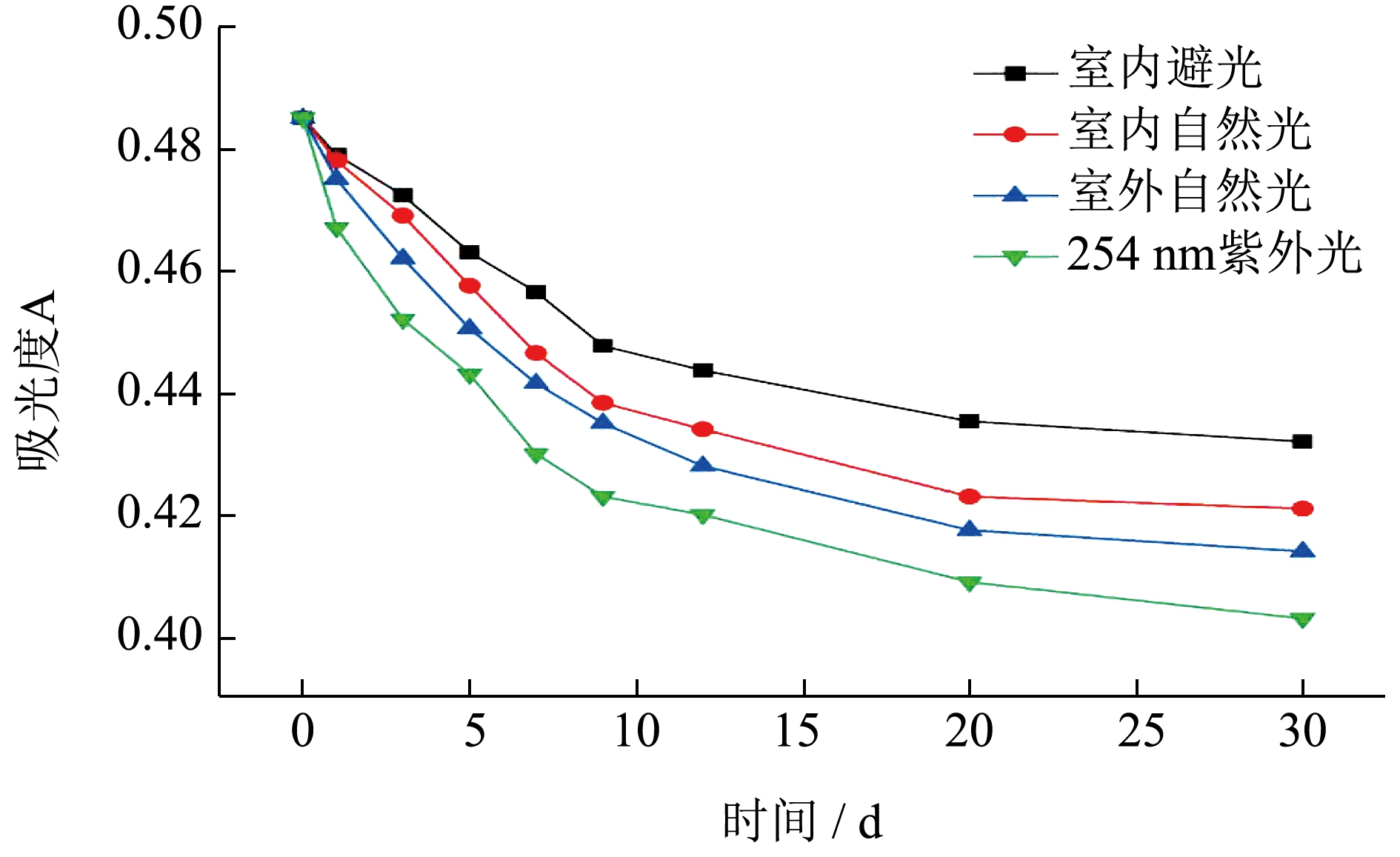
图3 不同光照对莓茶叶黄酮稳定性的影响
Fig.3 Effect of different illumination on the stability of flavonoids in Mei-tea (Ampelopsis grossedentata)
2.2.2 不同pH值对莓茶叶黄酮稳定性的影响
由图4 可知,长时间贮存时,pH 值越大越不利于莓茶叶黄酮的稳定性,实验发现,在酸性条件下(pH 值≤4.0),黄酮成分较稳定,pH 值越大,莓茶叶黄酮吸光度变化量越大。由于黄酮成分本身化学结构含有酚羟基,显酸性,因此在酸性条件下更能稳定存在[22],随着环境溶液pH 值的增大,黄酮成分的分子结构变得不稳定。何桂霞等[23]研究发现,莓茶中主要黄酮成分二氢杨梅素在pH值≥9.0 的条件下会立即发生反应从而氧化变黄,证实了在碱性环境会对莓茶叶黄酮的化学结构造成破坏。因此,在实际操作中时应避免莓茶叶黄酮在碱性条件下生产贮存。
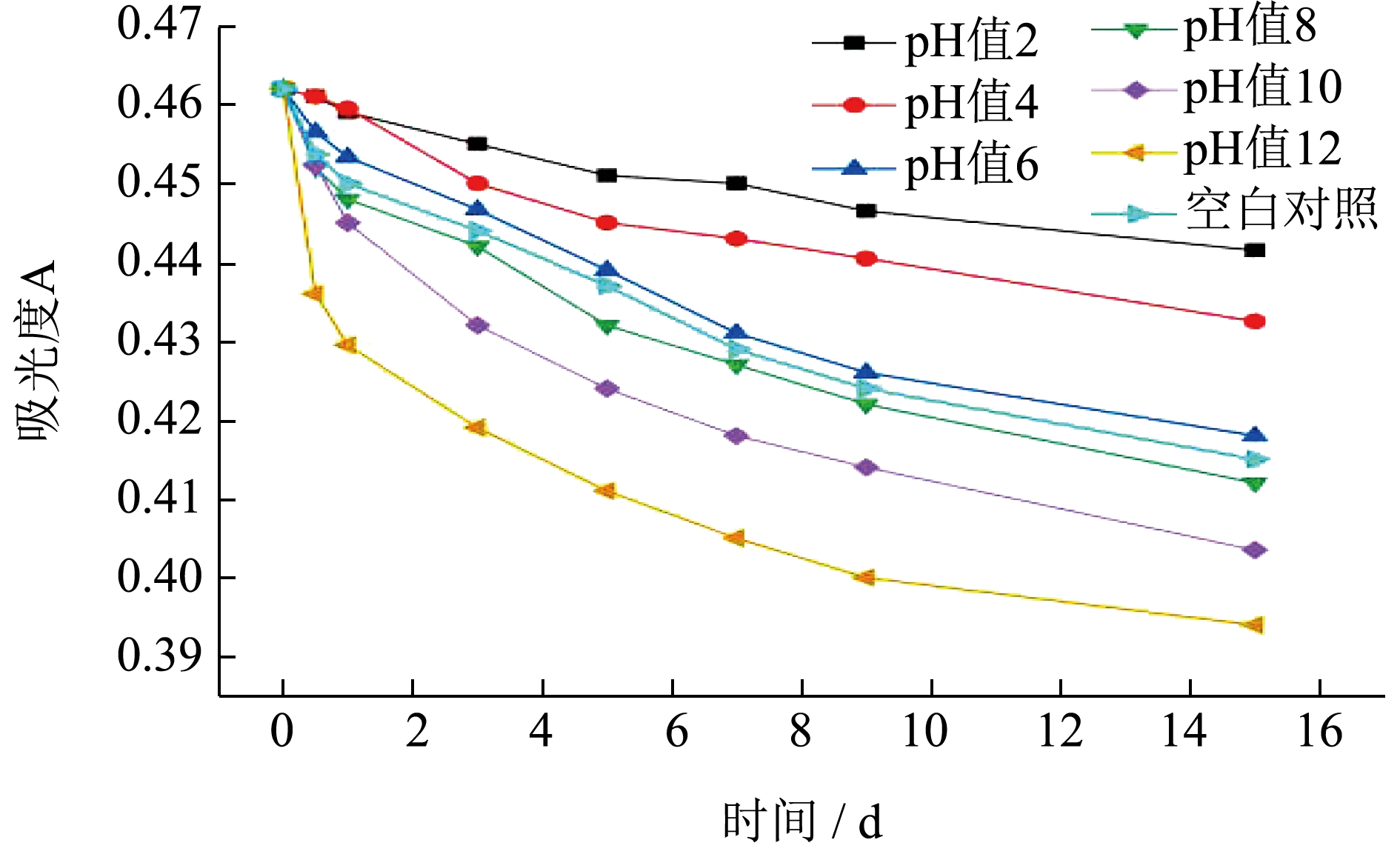
图4 不同pH 值对莓茶叶黄酮稳定性的影响
Fig.4 Effect of different pH values on the stability of flavonoids in Mei-tea (Ampelopsis grossedentata)
2.2.3 不同金属离子对莓茶叶黄酮稳定性的影响
由图5 可知,随着时间变化,Na+、K+离子对莓茶叶黄酮的稳定性基本没有影响,且与空白对照相比吸光度变化量更小。Mg2+、Al3+离子对莓茶叶黄酮影响较小与空白对照接近,表明这些金属离子对莓茶叶黄酮的稳定性影响不大,而添加了Cu2+、Fe3+金属离子的提取液出现大量沉淀,其吸光度大幅降低。主要原因可能是Cu2+、Fe3+为过渡金属离子,而过渡金属离子是许多自由基产生的诱导剂,催化脂质的过氧化发生。黄酮作为一种天然抗氧化成分,能够通过螯合金属离子起到抗氧化作用。Mira等[24]研究了黄酮类化合物还原铁和铜离子的能力及其构效关系,发现Cu2+、Fe3+能与黄酮的邻二酚羟基官能团结合,形成不溶性络合物。因此,Cu2+、Fe3+对莓茶叶黄酮稳定性影响最大。
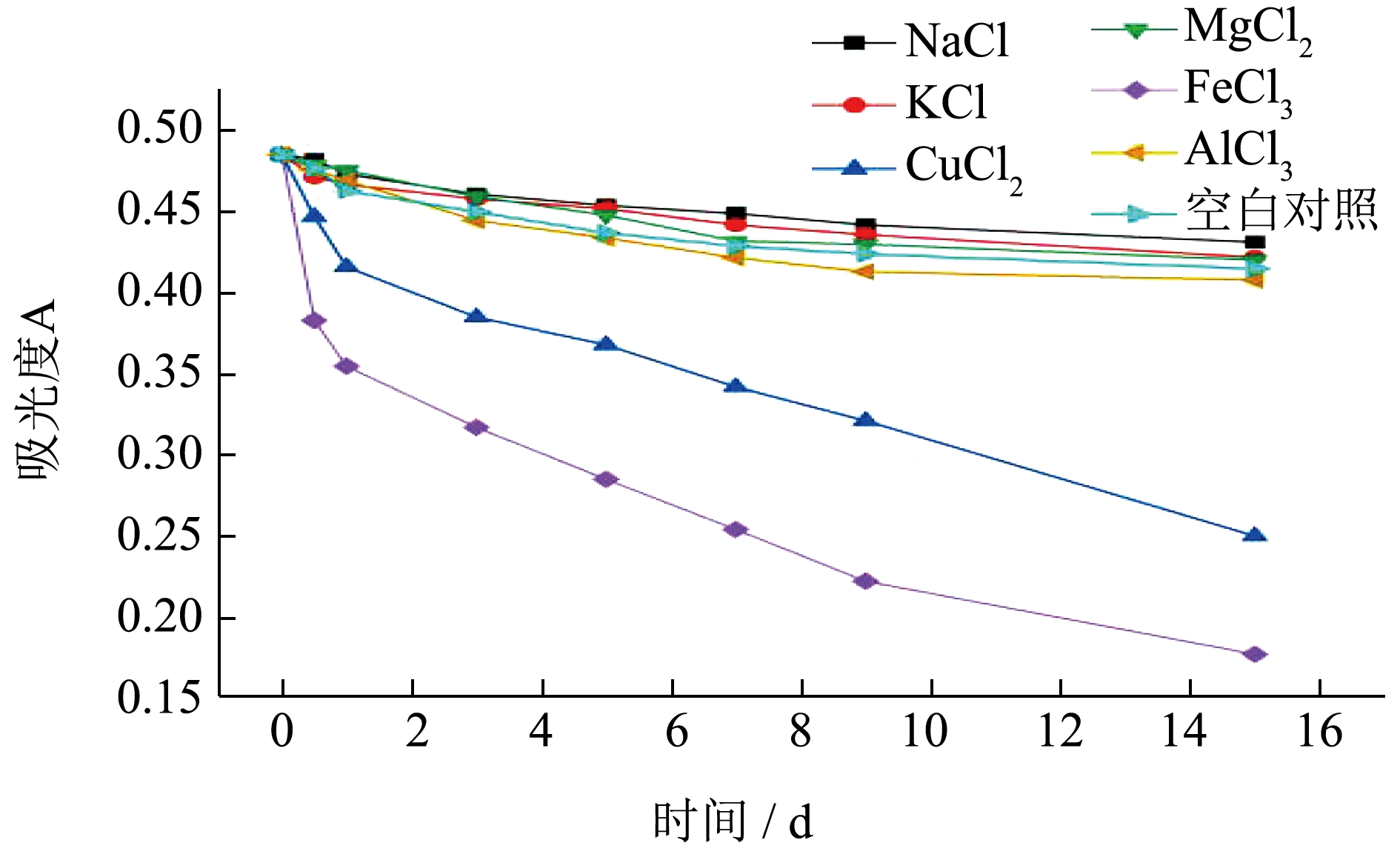
图5 不同金属离子对莓茶叶黄酮稳定性的影响
Fig.5 Effect of different metal ions on the stability of flavonoids in Mei-tea (Ampelopsis grossedentata)
2.2.4 氧化剂、还原剂对莓茶叶黄酮稳定性的影响
由图6 可知,随着加入H2O2、Na2SO3 质量分数的增大,莓茶叶黄酮的吸光度也随之下降。而H2O2 质量分数的增大时,莓茶叶黄酮的吸光度下降变化较小,表明莓茶叶黄酮的结构及含量基本不受氧化剂H2O2 的影响,莓茶叶黄酮具备较好的抗氧化性。还原剂Na2SO3 对莓茶叶黄酮结构有着极大的破坏性[22],表现为添加了Na2SO3 的莓茶叶黄酮吸光度在3 h 内急剧下降,且加入的Na2SO3 质量分数越大,下降越多。表明Na2SO3 对莓茶叶黄酮稳定性有很大的影响,因此莓茶叶黄酮在生产、储存过程中都要避免与还原剂接触。
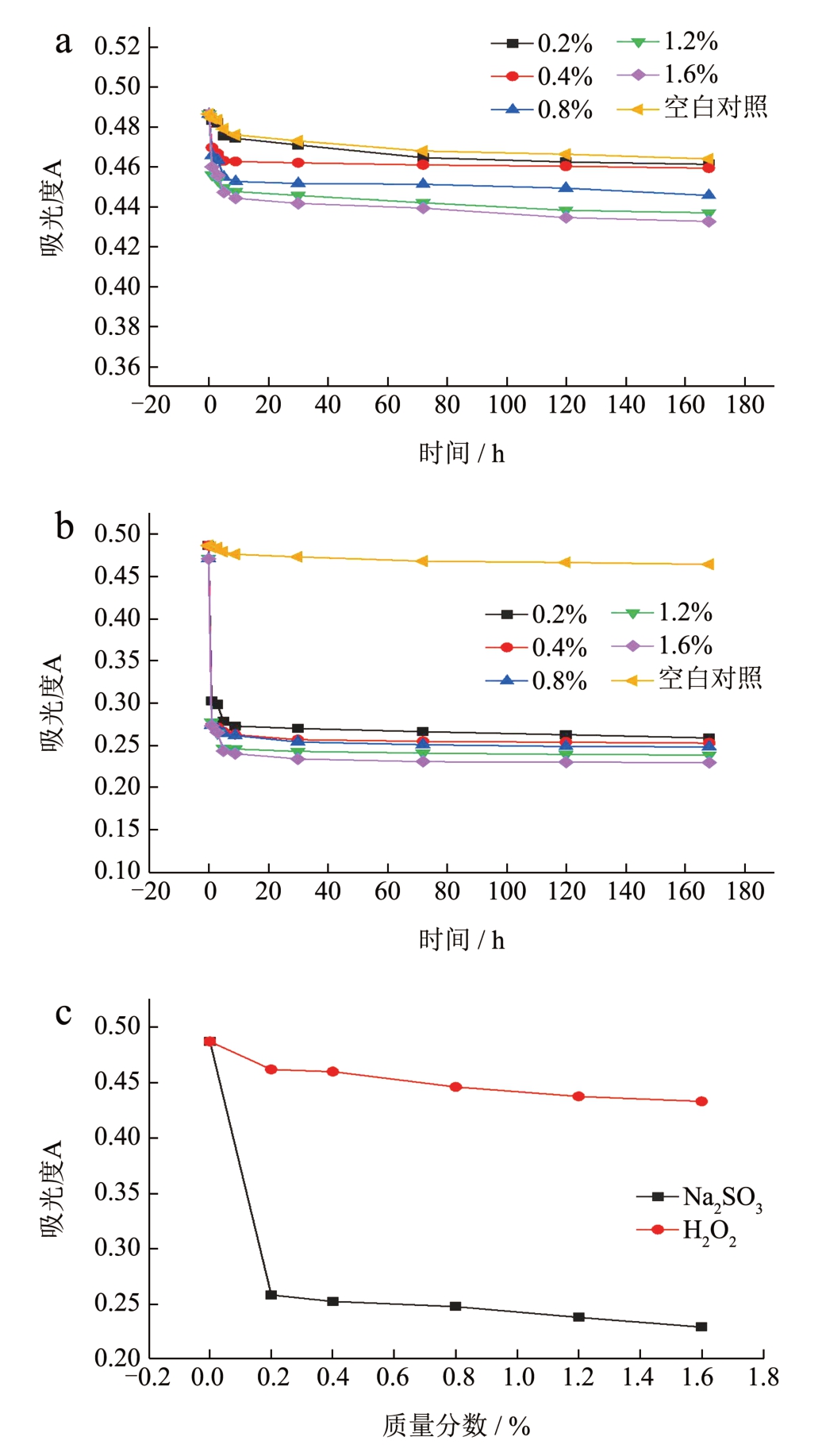
图6 不同质量分数的H2O2(a)和Na2SO3(b)对莓茶叶黄酮稳定性的影响;168 h 时不同质量分数的H2O2、Na2SO3 对莓茶叶黄酮稳定性的影响(c)
Fig.6 Effect of different mass fractions of H2O2 (a) and Na2SO3 (b)on the stability of flavonoids in Mei-tea (Ampelopsis grossedentata),Effect of different mass fractions of H2O2 and Na2SO3 on the stability of flavonoids in Mei-tea (Ampelopsis grossedentata) at 168 h (c)
2.2.5 水溶性高分子物质对莓茶叶黄酮稳定性的影响
由图7 可知,水溶性高分子对莓茶叶黄酮有一定的保护作用,且随着水溶性高分子质量浓度的增加,其对莓茶叶黄酮稳定性的保护作用也在不断增强,在相同质量浓度时,聚乙二醇保护效果最好,CMC 保护作用最差,其原因可能是加入水溶性高分子后,对莓茶叶黄酮起到了包覆作用,降低了黄酮分子与氧气的接触面积,保护黄酮不被氧化。同时也增加了体系的粘度,导致体系中氧含量下降,从而提高了莓茶叶黄酮稳定性[25]。王晓云等[26]发现环糊精能对莓茶叶黄酮起到包合作用,且包合过程为自发进行。
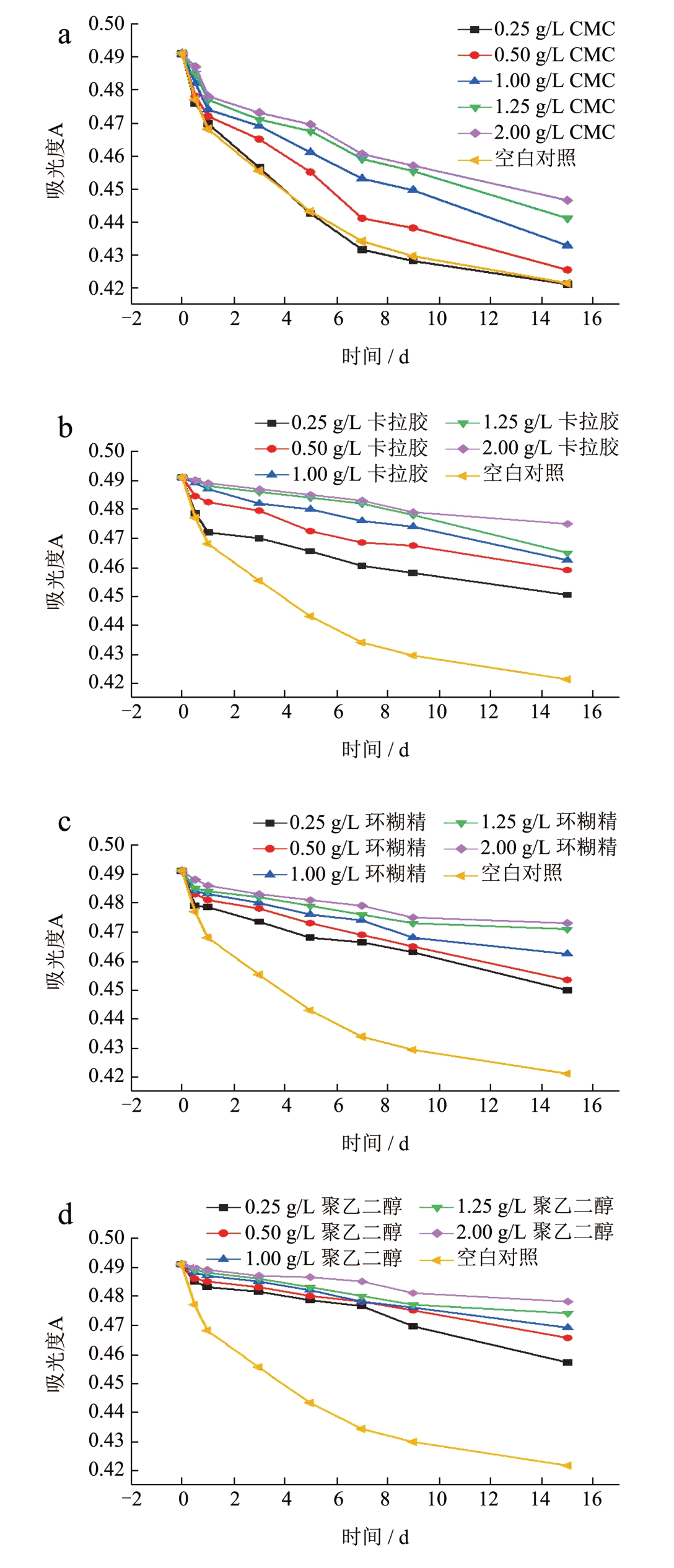
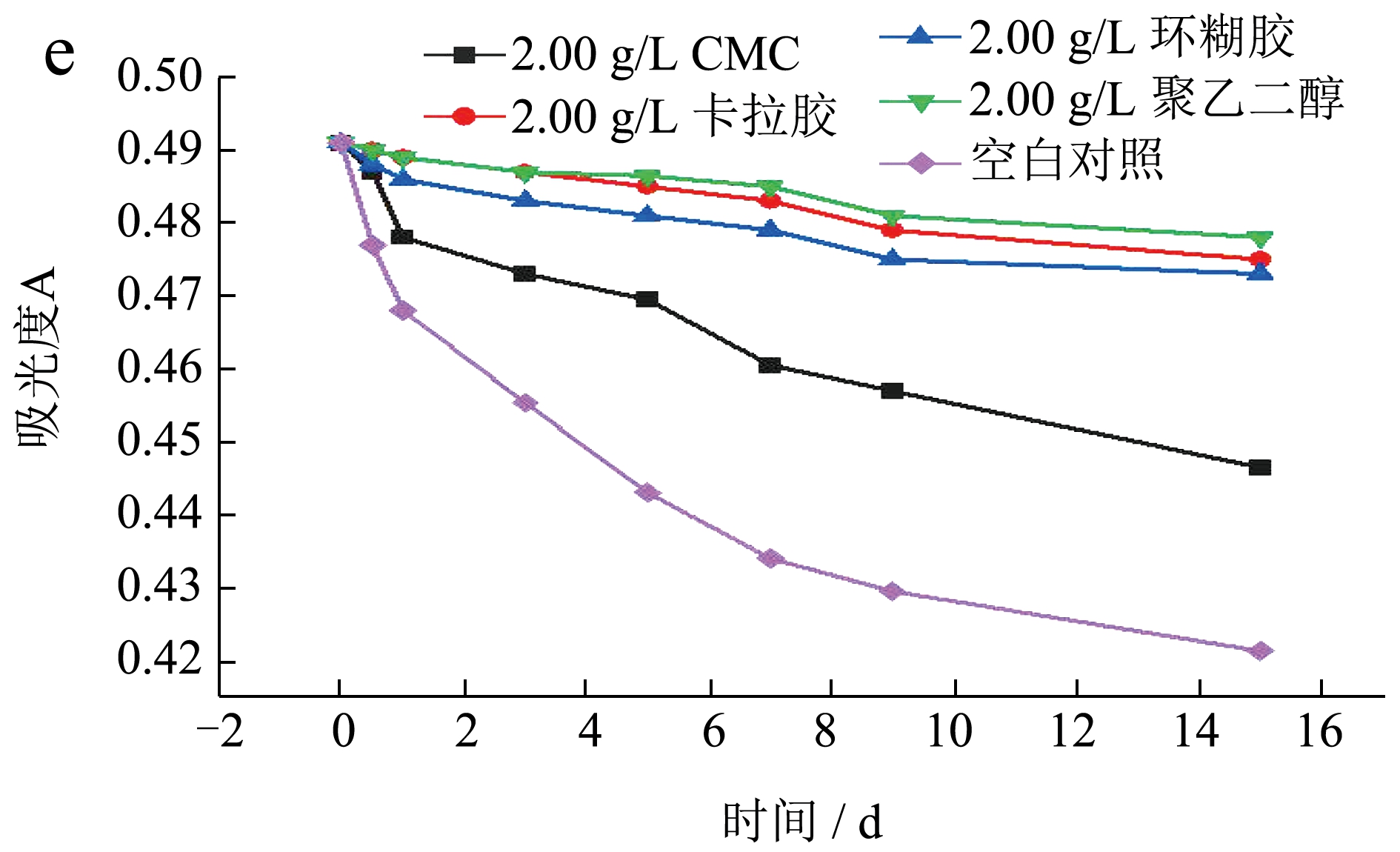
图7 不同质量浓度CMC(a)、卡拉胶(b)、环糊精(c)、聚乙二醇(d)对莓茶叶黄酮稳定性的影响;2.00 g/L 质量浓度下不同高分子物质对莓茶叶黄酮稳定性的影响(e)
Fig.7 Effect of different mass concentrations of CMC (a),carrageenan (b),cyclodextrin (c) and polyethylene glycol(d) on the stability of flavonoids in Mei-tea (Ampelopsis grossedentata),Effect of different polymer substances on the stability of flavonoids in Mei-tea (Ampelopsis grossedentata)at a mass concentration of 2.00 g/L (e)
3 结论
本文对莓茶叶水提液中黄酮抗氧化作用及稳定性进行研究。抗氧化性试验发现,莓茶叶黄酮提取液具备很好的抗氧化性,对DPPH、ABTS+自由基的清除能力均优于Vc 水溶液对照,其IC50 分别为3.09、1.43 μg/mL。稳定性试验发现,莓茶叶黄酮长时间放置自身易氧化分解,且在生产贮存过程中应避免阳光直晒,放置在阴凉处保存;避免接触Na2SO3 等还原剂及过碱成分,防止黄酮成分被破坏;Na+、K+、Mg2+、Al3+等离子对莓茶叶黄酮稳定性影响较小,而Cu2+、Fe3+等则能影响其稳定性;水溶性高分子能对莓茶叶黄酮起到一定的保护作用,其中以聚乙二醇保护效果最优。本文为莓茶叶黄酮的应用和储存提供了理论基础,并在提升莓茶产业经济效益方面有着重要的研究意义。
[1] 卢良军,刘宇知,田文萍,等.张家界莓茶发展综述 [J].农业与技术,2020,40(4):29-32.
[2] 吕传汉.湖南省永顺县莓茶产业发展与脱贫攻坚的应用 [J].世界热带农业信息,2022,1:70-71.
[3] 冯湘沅,杨琦,谢纯良,等.莓茶多酚、黄酮、黄酮醇类组分含量及抑菌分析 [J].食品研究与开发,2022,43(19):79-86.
[4] 何桂霞,裴刚,杨伟丽,等.HPLC测定藤茶不同采收时期及不同部位的二氢杨酶素含量 [J].中成药,2004,26(3):210-212.
[5] JIA C,LI J,ZHANG M,et al.Antioxidant properties of the extracts of vine tea (Ampelopsis grossedentata) with the different color characteristics and inhibition of rapeseed and sunflower oil oxidation [J].LWT-Food Science and Technology,2020,136: 110292.
[6] HUANG H C,LIAO C C,PENG C C,et al.Dihydromyricetin from Ampelopsis grossedentata inhibits melanogenesis through down-regulation of MAPK,PKA and PKC signaling pathways [J].Chemico-Biological Interactions,2016,258: 166-174.
[7] XIN M,MA Y,LIN W,et al.Use of dihydromyricetin as antioxidant for polypropylene stabilization [J].Journal of Thermal Analysis and Calorimetry,2015,120(3): 1741-1747.
[8] CHEN Y J,SONG H Y,ZHANG Z W,et al.Extracts of vine tea improve diet-induced non-alcoholic steatohepatitis through AMPK-LXRαsignaling [J].Frontiers in Pharmacology,2021,12: 711763.
[9] GUO L,ZHANG H,YAN X.Protective effect of dihydromyricetin revents fatty liver through nuclear factor-κB/p53/B-cell lymphoma 2-associated X protein signaling pathways in a rat model [J].Molecular Medicine Reports,2018,19(3): 1638-1644.
[10] ZUO Y,XU Q,LU Y,et al.Dihydromyricetin induces apoptosis in a human choriocarcinoma cell line [J].Oncol Lett,2018,16(4): 4229-4234.
[11] ZUO Y,LU Y,XU Q,et al.Inhibitory effect of dihydromyricetin on the proliferation of JAR cells and its mechanism of action [J].Oncol Lett,2020,20(1): 357-363.
[12] LU C J,HE Y F,YUAN W Z,et al.Dihydromyricetinmediated inhibition of the Notch1 pathway induces apoptosis in QGY7701 and HepG2 hepatoma cells [J].World J Gastroenterol,2017,23(34): 6242-6251.
[13] LIANG H,HE K,LI T,et al.Mechanism and antibacterial activity of vine tea extract and dihydromyricetin against Staphylococcus aureus [J].Scientific Reports,2020,10(1):21416.
[14] CUI S M,LI T,LIANG H Y,et al.Antibacterial activities and mechanisms of vine tea extract and 2R,3R-Dihydromyricetin on Escherichia coli [J].Lwt-Food Sci Technol,2021,146: 113393-113403.
[15] 吴斯聪,林木雄,向华,等.藤茶产品线上市场调查研究 [J].安徽农学通报,2021,27(3):123-127.
[16] 秦亚茹,张友胜,张凯,等.藤茶总黄酮检测方法的对比研究 [J].现代食品科技,2019,35(12):302-309,188.
[17] 刘建兰,于华忠,高梦,等.藤茶总黄酮和二氢杨梅素的提取检测研究进展 [J].广东农业科学,2013,40(19):90-93.
[18] 王荣,罗倩,冯怡.DPPH、ABTS和FRAP微量法测定山奈酚的抗氧化能力 [J].广州化工,2021,49(3):58-59,63.
[19] 刘科梅,聂挺,潘栋梁,等.量子化学计算研究4种黄酮类天然抗氧化物清除自由基活性的构效关系 [J].南昌大学学报(理科版),2016,40(3):250-256.
[20] 伍佑辉,蒋新元,倪丹,等.表面活性剂对鞣花酸的增溶及其抗氧化性能研究 [J].应用化工,2022,51(10):2884-2888,2893.
[21] HIND C,IRINA I,CEDRIC P,et al.The photostability of flavanones,flavonols and flavones and evolution of their antioxidant activity [J].Journal of Photochemistry &Photobiology,A: Chemistry,2017,336: 131-139.
[22] 冯靖,彭效明,李翠清,等.银杏叶黄酮的抗氧化性及其稳定性研究 [J].食品科技,2019,44(4):244-249.
[23] 何桂霞,裴刚,李斌,等.二氢杨梅素的稳定性研究 [J].中国新药杂志,2007,22:1888-1890.
[24] MIRA L,FERNANDEZ M T,SANTOS M,et al.Interactions of flavonoids with iron and copper ions:amechanism for their antioxidant activity [J].Free Radical Research,2003,36(11): 1199-1208.
[25] 陈惠芳,蒋新元,陈介南,等.不同介质溶液对维生素C稳定性的影响研究 [J].日用化学工业,2018,48(8):444-449.
[26] 王晓云,姜子涛,李荣.环糊精及其衍生物与天然抗氧化剂杨梅素的包合作用研究 [J].食品科学,2008,5:125-128.