银耳又名雪耳、白木耳或银耳子等,是真菌门担子菌纲银耳目银耳科银耳属真菌银耳(Tremella fuciformis Berk.)的子实体,性平味甘,具有滋阴润燥、润肺养胃的功效[1]。银耳富含蛋白质、脂肪、多糖和多种矿物质等,其中银耳多糖是最主要的生物活性物质[2]。银耳多糖是一种主要以甘露糖为主链的酸性杂多糖,质量分数占干重的70%~75%,具有抗肿瘤、抗氧化、抗衰老、免疫调节、降血糖及降血脂等作用[3,4]。
皮肤是人体最大的器官,但其长期暴露在紫外线、化学物等环境中。多环芳烃是大气中广泛存在的有致癌、致畸和遗传毒性的污染物[5]。苯并 [a]芘(Benzo [A]Pyrene,BaP)16 种母体多环芳烃中最具致癌性的化合物,被国际癌症研究中心列为I 类致癌物[6]。BaP 通过激活芳烃受体(Aryl Hydrocarbon Receptor,AhR)途径具有毒理学作用,具有浓度依赖性和光依赖性细胞毒性,并介导细胞线粒体的损伤和细胞内活性氧水平的增加[7]。浓度达到20 μmol/L 的BaP 处理人胎儿促性腺激素释放激素原代神经元细胞24 h 后,会诱发明显的细胞毒性[8]。BaP 来自有机物质的不完全燃烧,其中室内吸烟、采暖以及烹饪是室内BaP 浓度升高的主要因素[9]。除了肺部吸收,皮肤也能大量吸收代谢BaP[10]。皮肤老化是由遗传背景、激素、时间等内部因素和污染、紫外线照射等外部因素作用下的过程[11]。外因作用下主要引起胶原蛋白和弹性蛋白纤维的改变。因此,在皮肤抗衰老时,考虑BaP 暴露对皮肤代谢的影响十分必要。
银耳多糖的抗衰老机制已有较多研究[12-16],但在污染物BaP 作用下银耳多糖的抗衰老作用还未知。衰老的潜在生理原因之一是氧化应激诱导的损伤,清除活性氧和氮物种可能有利于预防和缓解衰老[17]。因此,本实验以银耳多糖为材料,测定了其体外的抗氧化活性,研究了在BaP 诱导下银耳多糖对体外培养的人皮肤成纤维细胞相关蛋白的基因表达及蛋白表达的影响,并探讨了其作用机制及途径,以期为银耳多糖的抗衰老机制提供更丰富的实验依据,为其在具有抗老化活性的功能护肤品的应用提供经验和数据。
1 材料与方法
1.1 材料与设备
1.1.1 实验材料与试剂
人皮肤成纤维细胞(Human Foreskin Fibroblasts,HFF-1)购自中国科学院典型培养物保藏委员会细胞库;苯并 [a]芘(BaP),中国阿拉丁;朵状干银耳,产自福建古田。苯酚、硫酸、邻苯三酚等化学试剂均为分析纯。
1.1.2 主要仪器设备
Beta 1-8 LD plus 冻干机,德国Christ 公司;DJ-04 粉碎机,上海淀久有限公司;H1850R 台式离心机,湖南湘仪实验室仪器开发有限公司;SQP电子天平,赛多利斯科学仪器(北京)有限公司;DK-8D 电热恒温水浴锅,上海一恒科技有限公司;Enspire 多功能酶标仪,美国PerkinElmer 公司;CFX96 Touch 实时荧光定量PCR 仪,美国Bio-Rad公司;RE 52-99 旋转蒸发仪,上海亚荣生化仪器厂;CLM-170B-8-NF 细胞培养箱,新加坡ESCO 公司;BSC-1304 ⅡA2 生物安全柜,苏净安泰公司;ICS5000 离子色谱仪,Thermo Fisher Scientific。
1.2 方法
1.2.1 银耳多糖的提取制备
将干燥银耳粉碎过60 目筛,按照1:50(g:mL)料液比加入超纯水,在80 ℃下水浴搅拌提取3 h。4 000 r/min 离心15 min 得上清液,上清液浓缩至适量体积,加入4 倍体积φ=95%的乙醇,在4 ℃过夜醇沉,过滤得到的沉淀用Sevage 法与三氯乙酸法结合脱蛋白,超纯水透析,冻干,得银耳多糖,以此为实验原料。
通过苯酚硫酸法测定总糖含量,Bradford 法测定蛋白质含量,采用斐林试剂、氯化铁试剂、碘-碘化钾试剂及全波长扫描分析多糖的纯度。
通过离子色谱法测定单糖组分。多糖经三氟乙酸水解后分析。采用Dionex™ CarboPac™ PA20(150 mm×3.0 mm,10 μm)液相色谱柱;流动相A(H2O),流动相B(0.1 mol/L NaOH),流动相C(0.1 mol/L NaOH,0.2 mol/L NaAc),流速0.5 mL/min;柱温为30 ℃;洗脱梯度:0 min A 相/B 相/C 相(95:5:0,V/V/V),26 min A 相/B 相/C 相(85:5:10,V/V/V),42 min A 相/B 相/C 相(85:5:10,V/V),42.1 min A 相/B 相/C 相(60:0:40,V/V/V),52 min A 相/B 相/C 相(60:40:0,V/V/V),52.1 min A 相/B 相/C 相(95:5:0,V/V/V),60 min A 相/B 相/C相(95:5:0,V/V/V)。13 种单糖标准品为参照(Fuc、Rha、Ara、Gal、Glc、Xyl、Man、Fru、Rib、Gal-UA、Gul-UA、Glc-UA、Man-UA)。
1.2.2 银耳多糖的抗氧化活性
1.2.2.1 DPPH自由基清除率
取不同质量浓度的2 mL 多糖液(0.02、0.04、0.06、0.08、0.10 mg/mL)和2 mL 的DPPH(0.3 mmol/L)溶液,摇匀混合,避光条件下静置30 min,在517 nm 处测得吸光度值A1;取2 mL 的无水乙醇和2 mL 的多糖溶液,经相同步骤,在517 nm 处测得其吸光值为A2;取2 mL 的无水乙醇和2 mL 的DPPH 自由基溶液,同上步骤,在517 nm 处测得的吸光度值为A0[18]。平行做3 次试验,按照以下公式(1)进行计算:
式中:
E——自由基清除率,%;
A1——实验组吸光度值;
A2——无显色试剂组吸光度值;
A0——无多糖对照组吸光度值。
1.2.2.2 羟基自由基清除率
取等体积FeSO4(7.5 mmol/L)、H2O2(7.5 mmol/L)、水杨酸(7.5 mmol/L,用无水乙醇溶解)溶液0.6 mL和多糖液2 mL 混匀后,于37 ℃水浴30 min。测定在510 nm 下的吸光值为A1;用0.6 mL 超纯水代替上述0.6 mL H2O2,测得的吸光值为A2;用2 mL 超纯水代替2 mL 多糖溶液,测得的吸光值为A0[18]。做三次平行,按照公式(1)进行计算。
1.2.2.3 超氧阴离子自由基清除率
取2 mL 的多糖液加入4.5 mL pH 值为8.2 的Tris-HCl 缓冲液,混匀后25 ℃水浴15 min,加入0.2 mL 25 ℃预热的2 mmol/L 邻苯三酚溶液,摇匀后置于25 ℃中反应5 min,再加入0.2 mL 8 mmol/L HCl 终止反应。在320 nm 波长处测吸光度值A1。A2:用超纯水代替邻苯三酚溶液测吸光度;A0:用超纯水代替多糖液测吸光度值[18]。做三次平行,按照公式(1)进行计算。
1.2.3 银耳多糖对成纤维细胞的相关影响
实验通过BaP 刺激成纤维细胞,将银耳多糖作用于该成纤维细胞,再检测细胞外基质相关基因(Collagen I、Collagen III、Elastin、MMP-1)及蛋白(Collagen I)的表达情况,评估银耳多糖的体外抗衰功效。
1.2.3.1 多糖毒性分析
将银耳多糖样品稀释成不同质量浓度(0.005~50 mg/mL),同溶剂对照一起,分别处理对数生长期的成纤维细胞24 h,采用亚甲基蓝法[19]测定。
1.2.3.2 基因检测
(1)给药
设置实验组与对照组,按照一定的细胞密度进行6 孔板接种,每孔加入2 mL 培养液,37 ℃ CO2孵箱,培养过夜;实验组细胞用BaP(20 μmol/L)刺激并加上不同质量浓度的银耳多糖(0.1、50、100 μg/mL),对照组添加相应溶剂的培养液,给药完毕后,37 ℃,5%(体积分数)CO2 孵箱,培养24 h[9]。
(2)基因检测
培养结束后,弃上清,每孔加入1 mL RNA iso Plus(TaKaRa),收集细胞裂解液;按照RNA iso Plus 试剂说明书(TaKaRa)进行RNA 提取;按照反转录试剂盒操作说明书(TaKaRa)进行RNA 反转录,并在此基础上,对选定的细胞外基质相关基因(GAPDH、Collagen I、Collagen III、Elastin、MMP-1)进行qRT-PCR 检测。
1.2.3.3 蛋白检测
Collagen I 检测,细胞用BaP(20 μmol/L)刺激并加上不同剂量的银耳多糖样品(0.1、50、100 μg/mL)处理24 h 后收集上清培养基,利用Elisa 试剂盒检测人I 型胶原蛋白(Collagen-I)含量。
1.2.4 统计学方法
实验数据处理采用Excel 和SPSS 25.0 软件,三个独立实验中获得的数据以“平均值±标准偏差”表示。多组间比较采用ANOVA 单因素方差分析。以P<0.05 认为差异具有显著性差异,有统计学意义。
2 结果与讨论
2.1 银耳多糖的成分分析
由葡萄糖标准曲线的线性回归方程y=3.386 2x-0.002 3(R2=0.999 2)计算得银耳多糖总糖含量为99.96%,由蛋白质标准曲线的线性回归方程y=3.590 4x+0.009 1(R2=0.997 4)计算得银耳多糖蛋白质含量为0.12%。斐林试剂、氯化铁试剂和碘-碘化钾试剂反应均呈阴性,说明多糖不含还原糖、酚类及淀粉。图1 中1 g/L 质量浓度的银耳多糖全波长扫描图显示,仅在256 nm 处有弱吸收峰,而280 nm 处无蛋白质特征吸收峰,表明多糖不含或含极少量蛋白质,与Bradford 法测得结果较一致。如图2 所示,银耳多糖的单糖组分摩尔比为葡萄糖(Glc):果糖(Fuc)=99.36:0.64。文献表明,银耳多糖的主要单糖是甘露糖[3],但图2 显示本实验提取的多糖中主要单糖是葡萄糖。吴振亚[20]提取得到三种均一的银耳多糖,TF-PA 与TF-PB 主要由葡萄糖构成,TF-PC 主要由阿拉伯糖和葡萄糖组成,其摩尔比为1.05:1。因此推测单糖组成的差异与提取方式有较大关系,其中pH 值对提取多糖中的单糖组成影响较大。
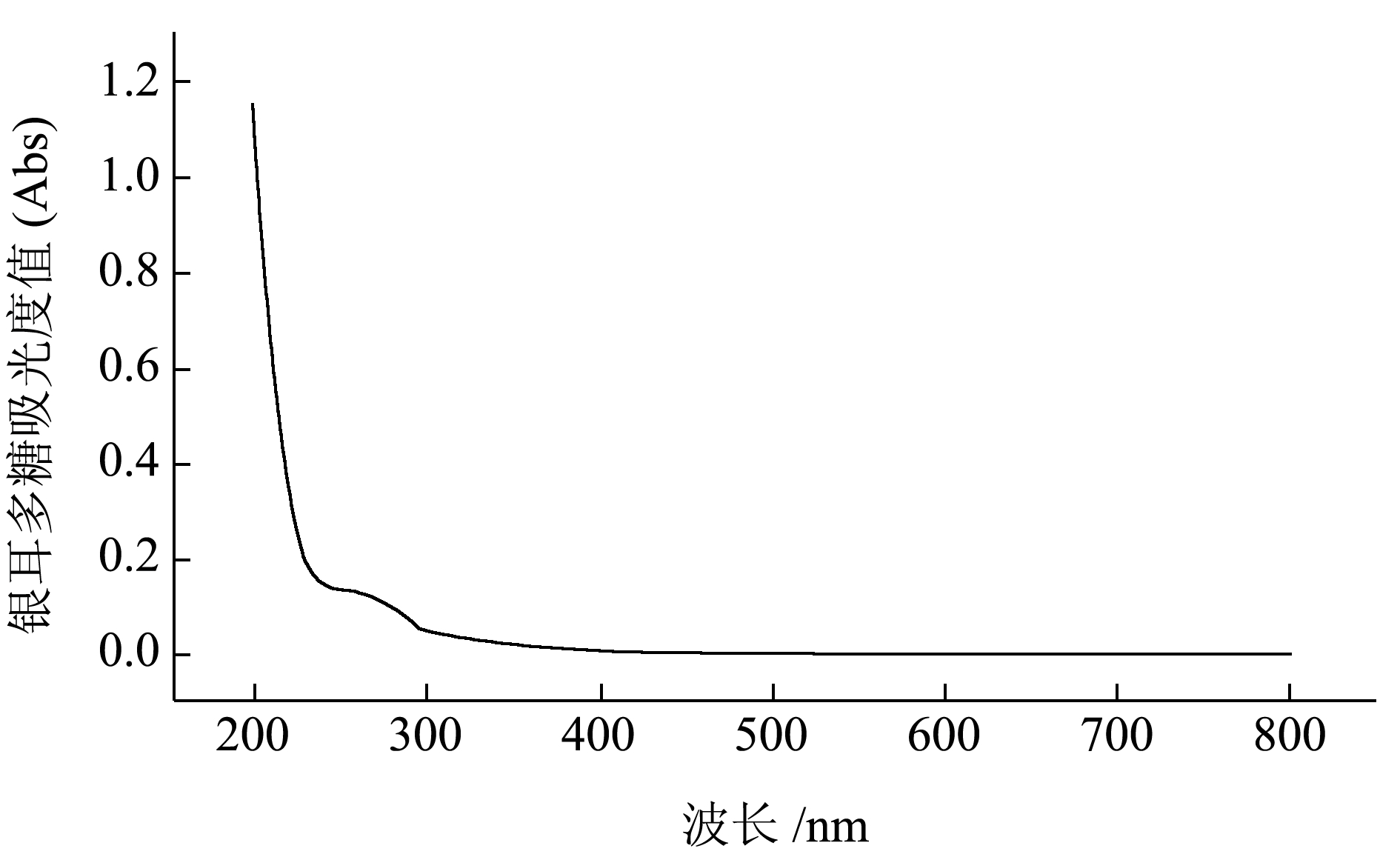
图1 全波长扫描图
Fig.1 Full wavelength scan
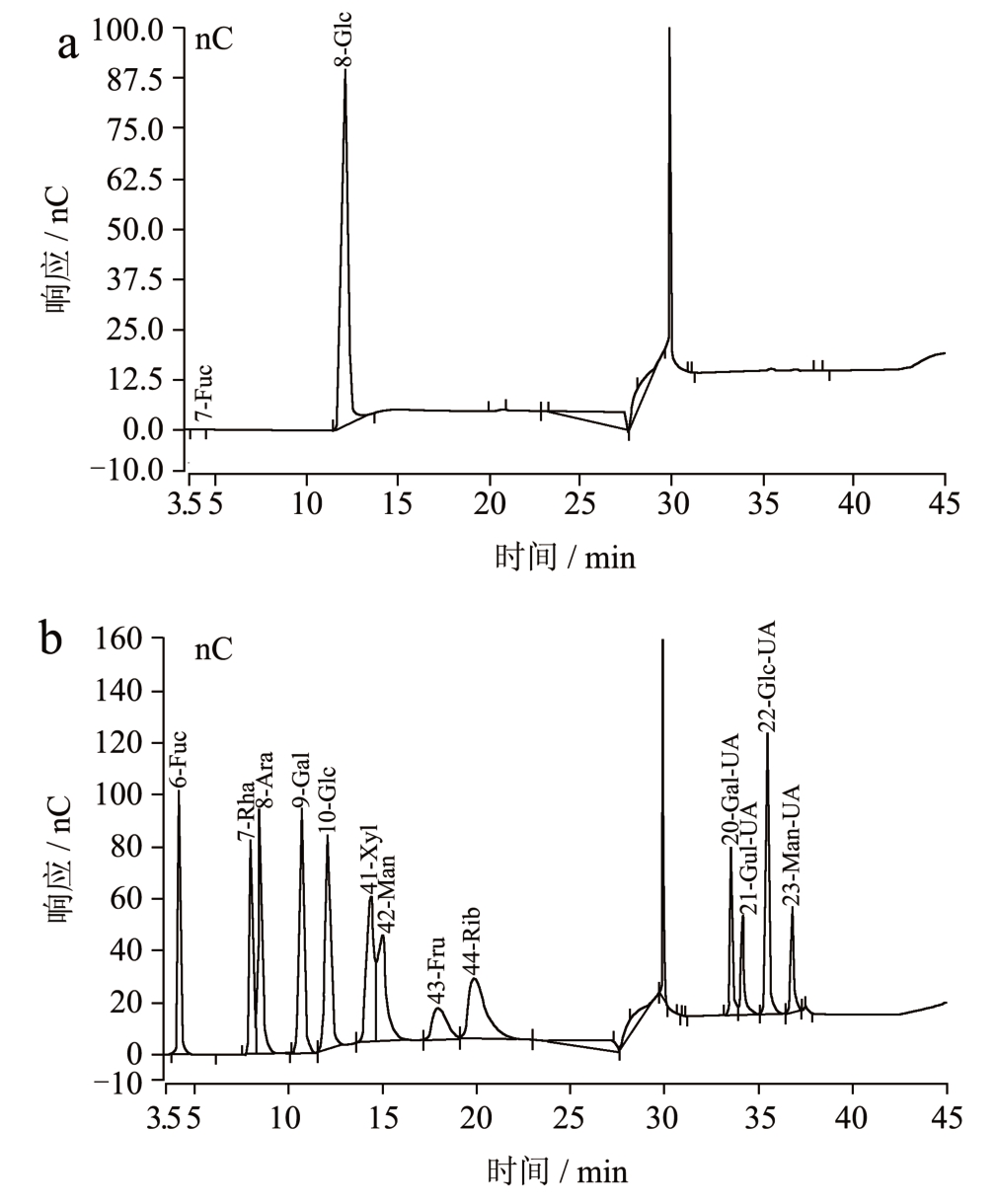
图2 银耳多糖的单糖组分
Fig.2 Monosaccharide fractions of Tremella polysaccharide
注:a:银耳多糖;b:标准品。
2.2 抗氧化分析
1,1-二苯基-2-三硝基苯肼(1,1-Diphenyl-2-Picrylhydrazyl Radical,DPPH)是一种有稳定的氮中心的自由基,常用于检验体外抗氧化效果。由图3a 可知,在测定的质量浓度范围内,多糖对DPPH 自由基的清除能力呈现出剂量依赖性。多糖质量浓度在1 mg/mL 时DPPH 清除率最高达50.10%,IC50 为1.09 mg/mL。
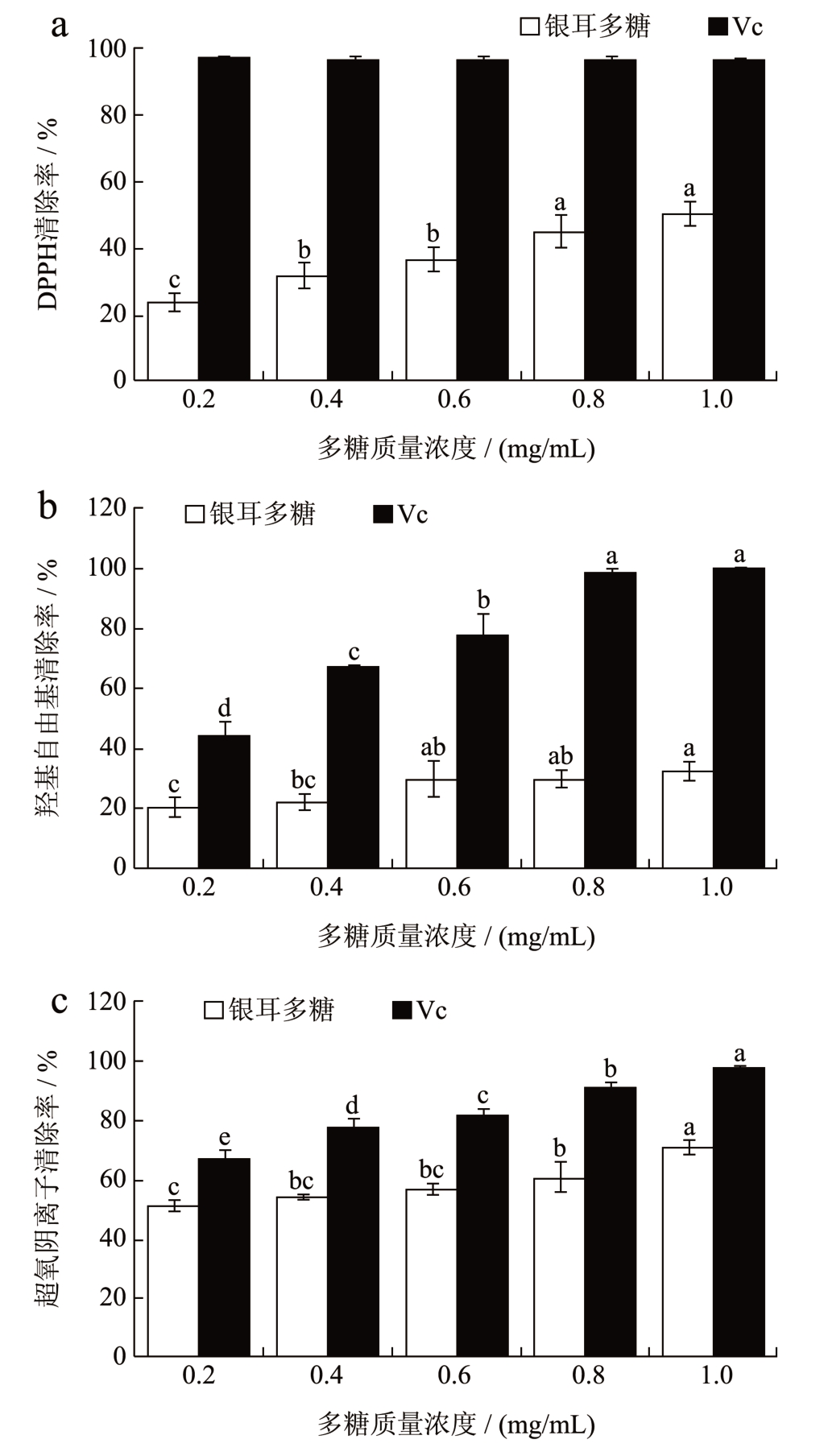
图3 抗氧化活性
Fig.3 Antioxidant activity
注:a:DPPH 自由基清除率;b :羟基自由基清除率;c:超氧阴离子自由基清除率。
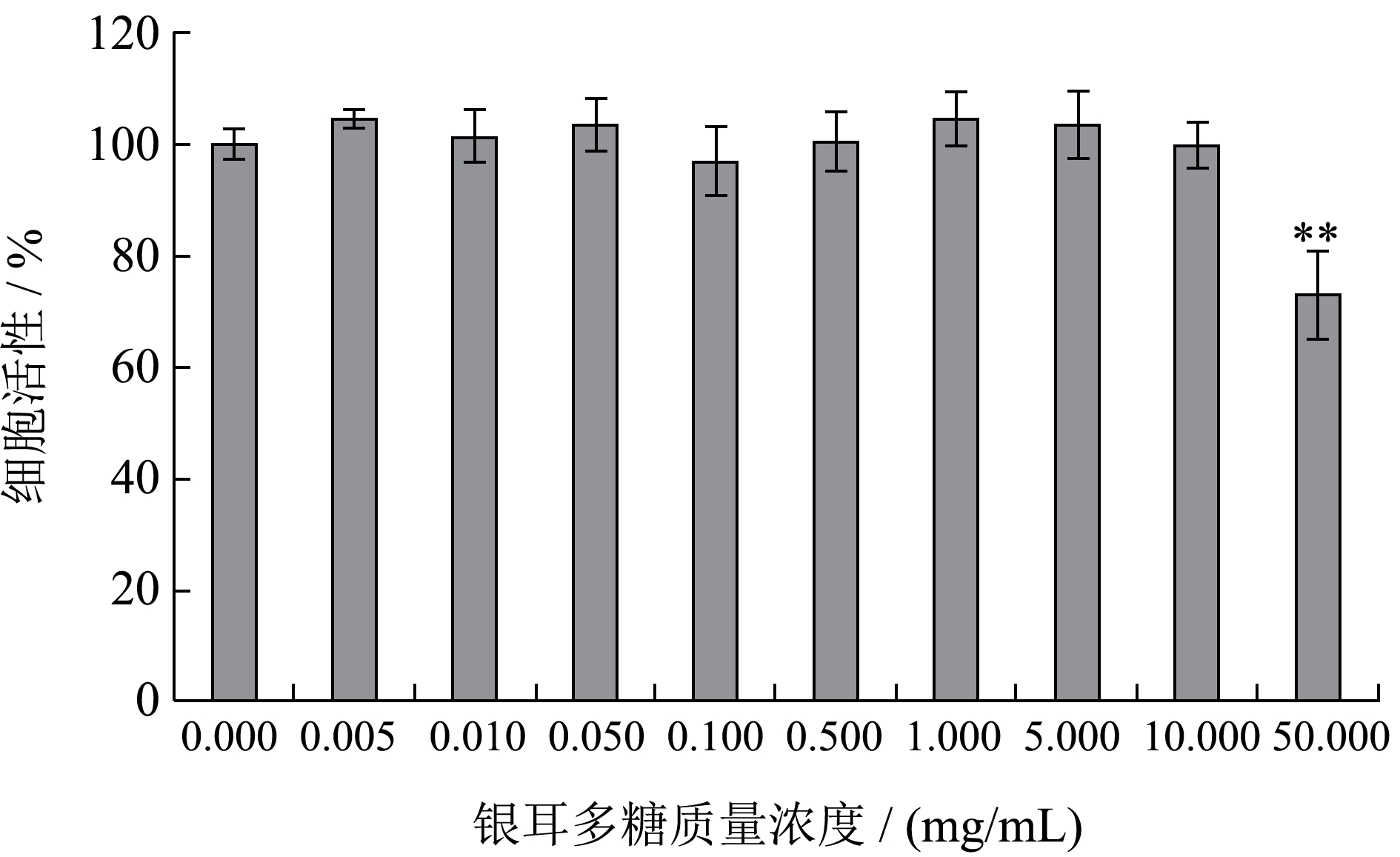
图4 细胞毒性实验
Fig.4 Cytotoxicity assay
注:**表示P<0.01。
羟基自由基具有强氧化剂作用,可导致膜质过氧化和细胞损伤。由图3b 可观察到银耳多糖清除羟基自由基的能力与质量浓度呈正相关,其质量浓度达到1 mg/mL 时,羟基自由基清除率达32.69%。经SPSS 回归计算得银耳多糖IC50 为5.79 mg/mL,抗坏血酸(Vc)IC50 为0.25 mg/mL。
超氧阴离子自由基在德纳姆·哈曼的氧化损伤理论中被确定为老化和辐射损伤的主要因素,它可以直接与某些氨基酸和蛋白质的Fe-S 基团反应,或者可以进一步反应形成羟基自由基,导致不加选择的蛋白质组和基因组损伤,这反过来导致蛋白质体内平衡的破坏和DNA 修复故障[21]。图3c 中数据说明多糖在一定程度上能有效清除超氧阴离子自由基,且清除率表现出质量浓度依赖性。多糖质量浓度1 mg/mL 时超氧阴离子自由基清除率为70.28%,其IC50 为0.23 mg/mL,Vc 的IC50 为0.13 mg/mL。
2.3 多糖毒性分析
从图数据可知,银耳多糖质量浓度不高于10 mg/mL 时,细胞存活率为96.74%~104.73%,表明多糖对细胞活性没有显著影响,无细胞毒性。50 mg/mL 银耳多糖作用下细胞活性显著下降至72.97%,具有损伤效应,可能原因是高糖环境抑制了细胞增殖[22]。
2.4 银耳多糖对相关基因表达的影响
以甘油醛-3-磷酸脱氢酶(Glyceraldehyde-3-Phosphate Dehydrogenase,GAPDH)为内参,分析不同浓度银耳多糖处理对BaP 刺激下基因表达的影响。结果表明:20 μmol/L BaP 能显著刺激四种基因的表达(P<0.05),再添加低浓度的银耳多糖(0.1 μg/mL),基因表达量与空白对照结果无明显差异,与BaP 作用组有显著性差异,表明多糖可显著恢复BaP 对细胞的影响。随银耳多糖质量浓度增大,BaP 刺激下的胶原蛋白Collagen I、Collagen III 和弹性蛋白Elastin 基因表达量呈现浓度依赖性增大,Collagen I 基因表达量最高增至1.26 倍(与空白组比较)。BaP 刺激下MMP-1 基因表达量增大,但无浓度相关性,50 μg/mL 银耳多糖能诱导其表达量增加1.69 倍,100 μg/mL 银耳多糖能诱导其表达量增加1.34 倍。
银耳多糖的抗衰老机制已有大量研究。银耳多糖可通过抗氧化、下调细胞负调控因子p21 的转录和表达,增加小鼠皮肤中羟脯氨酸含量(从而促进胶原蛋白的合成)及增强免疫功能而抗衰老[12] ;能促进成纤维细胞去乙酰化酶Sirtuin1(SIRT1)的表达,然后通过下调p16、p21、p53 和Capsase-3 的表达以及激活细胞外调节蛋白激酶(Extracellular Regulated Protein Kinases,ERK)和蛋白激酶B(Protein Kinase B,Akt)来调节细胞衰老和存活[13] ;通过激活上调Kelch 样ECH 相关蛋白1(Kelch-Like ECH-Associated Protein 1,Keap1)-核转录因子E2 相关因子2(Nuclear Factor Erythroid 2 Related Factor 2,Nrf2)途径抑制紫外线A 段(UVA)诱导的人真皮成纤维细胞的光损伤[14] ;提高人永生化角质形成细胞(HaCaTCell)被UVB 照射后降低的细胞活力[15]。上述研究表明,银耳多糖对胶原蛋白的表达有促进作用,这与图5 的结果相符。推测银耳多糖在抑制BaP 影响的基础上可浓度依赖性地促进胶原蛋白基因的表达[16]。
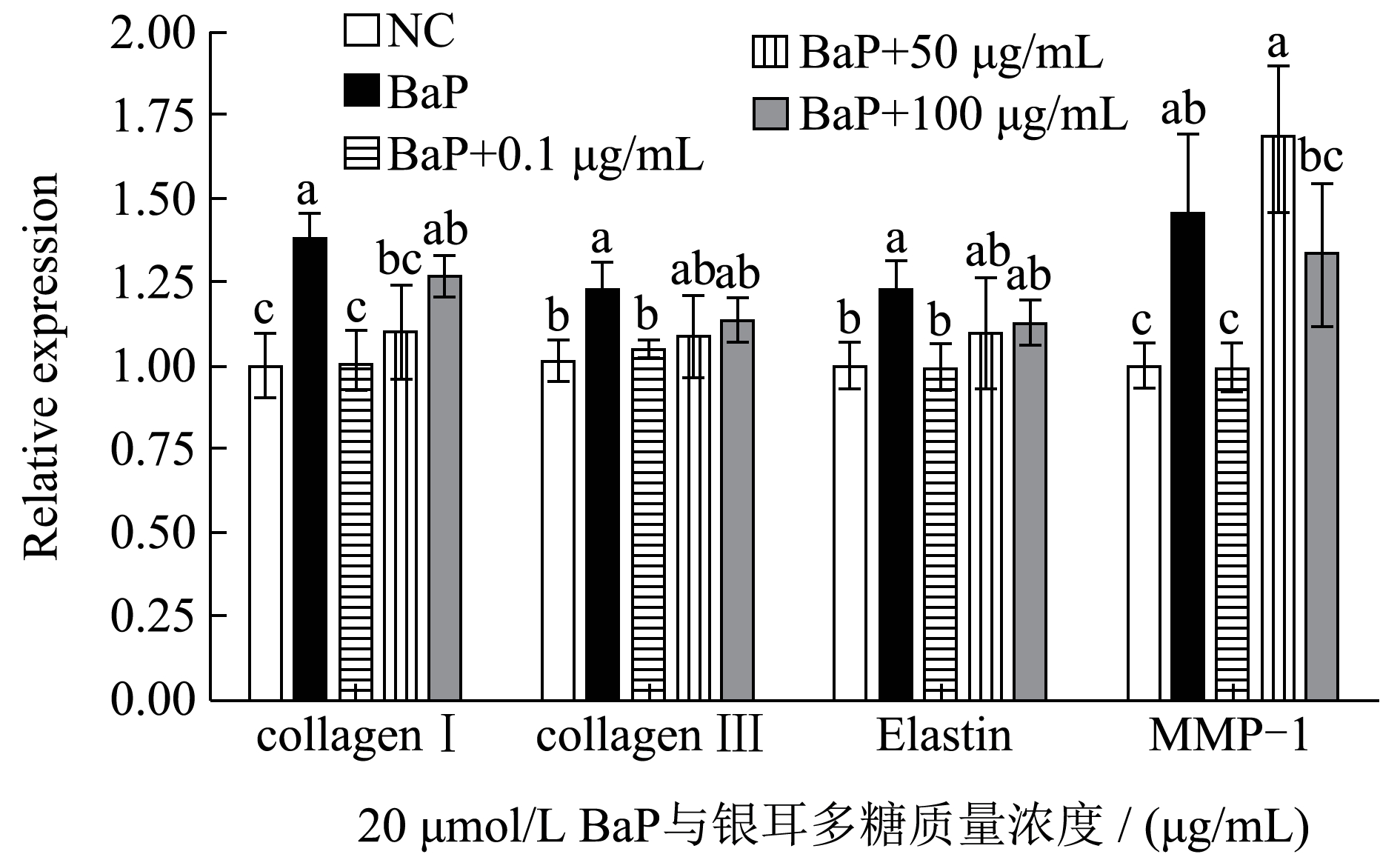
图5 银耳多糖对基因表达的影响
Fig.5 Effects of Tremella polysaccharides on gene expression
图5 数据表明,BaP 刺激能引起基因的表达增强,这与低水平BaP 胁迫刺激微生物代谢现象相似,低水平BaP(0.1 mg/kg)应激刺激下蚯蚓肠道微生物代谢增大1.74 倍[23]。高超等也发现BaP 诱导会激活Caspase 蛋白,导致细胞质细胞色素c(Cytochrome C,Cyt c)显著升高,线粒体Cyt c 降低[24]。可能机制是BaP—作为芳烃受体(Aryl Hydrocarbon Receptor,AhR)的经典外源配体,通过和AhR 结合,激活受体并诱导其启动子AhR 具有高亲和力的靶基因的表达[25]。现阶段研究发现,BaP 暴露会诱发肺上皮细胞氧化应激及炎性因子分泌,激活核因子κB(Nuclearfactorkappa-B,NF-κB)和AhR 信号通路,进而诱发炎症反应[24]。炎症与炎症介质如促炎细胞因子、基质金属蛋白酶(MMPS)和一氧化氮等的表达相关,其中慢性炎症通过导致氧化损伤、DNA 损伤、干细胞衰老从而加速衰老。实验中也发现BaP 暴露诱导了MMP-1 的分泌,而且,在此基础上添加50 μg/mL 银耳多糖在更大程度上促进了MMP-1 的表达。但10 mg/mL 水母雪莲多糖可极显著抑制MMP-1 的产生[26]。这说明在BaP 暴露下,多糖的浓度对其抗衰老作用有重要影响。
2.5 银耳多糖对Collagen-1蛋白含量的影响
通过不同处理的培养基中胶原蛋白Collagen-1含量变化发现,BaP 处理刺激了Collagen-1 释放,达到 3.94 μg/L,而添加0.1 μg/mL 银耳多糖处理后,Collagen-1 含量降低至3.47 μg/L,与空白对照3.48 μg/L相比无明显差异,表明样品能减缓BaP 刺激。但银耳多糖含量增大,Collagen-1 蛋白含量低至3.06 μg/L。
由图5 可知银耳多糖能明显提高HFF-1 细胞中Collagen-1 mRNA 的表达水平,促进Collagen-1的合成代谢。但同时也能促进细胞中MMP-1 mRNA 的表达,导致MMP-1 的大量合成。成纤维细胞是真皮层的主要细胞,合成和分泌胶原蛋白、弹性蛋白、糖胺聚糖和糖蛋白等基质成分[27]。自然老化存在成纤维细胞释放基质金属蛋白酶(Matrix Metalloproteinase,MMP,主要释放MMP-1——被认为是导致皮肤出现皱纹等衰老症状最主要的酶)增多现象,当间质胶原酶(Matrix Metalloproteinases-1,MMP-1)过度表达时,胶原蛋白的降解将被加速,从而促使皮肤弹性下降和皱纹产生[28]。因此,推测MMP-1 的大量表达是引起图胶原蛋白含量减少的主要原因。
有研究表明BaP 作用于成纤维细胞(HFF-1 细胞)会诱导活性氧增加,引起磷脂的过氧化等氧化损伤,造成代谢紊乱,涉及甘油磷脂和谷胱甘肽代谢机制[29]。蛋白质氧化程度的增加会使蛋白质分子构象发生改变,通过细胞凋亡和蛋白质氧化途径加速细胞骨架蛋白的降解[30]。这说明BaP 刺激下的氧化应激也可能是引起胶原蛋白降解的因素。
通过对照组、BaP 组和BaP+0.1 μg/mL 银耳多糖组对比发现,银耳多糖对BaP 刺激下相关基因的表达有显著抑制作用,这在以往的研究中是未被发现的。但由于检测项目有限,不能判断银耳多糖是否能有效抑制BaP 对细胞生理活性的影响,后续可展开实验进行深入探讨。实验浓度范围内银耳多糖对BaP 刺激下胶原蛋白和弹性蛋白的表达有促进作用,但同时对间质胶原酶MMP-1 基因的表达更为显著(P<0.05)。而MMP-1 主要破坏的是胶原纤维中的Collagen I 和Collagen III[26],图6 显示在其作用下表达的I 型胶原蛋白降解。但MMP-1 基因的表达量与银耳多糖不呈浓度依赖性,后续实验可继续增大银耳多糖含量检测相关基因的表达。
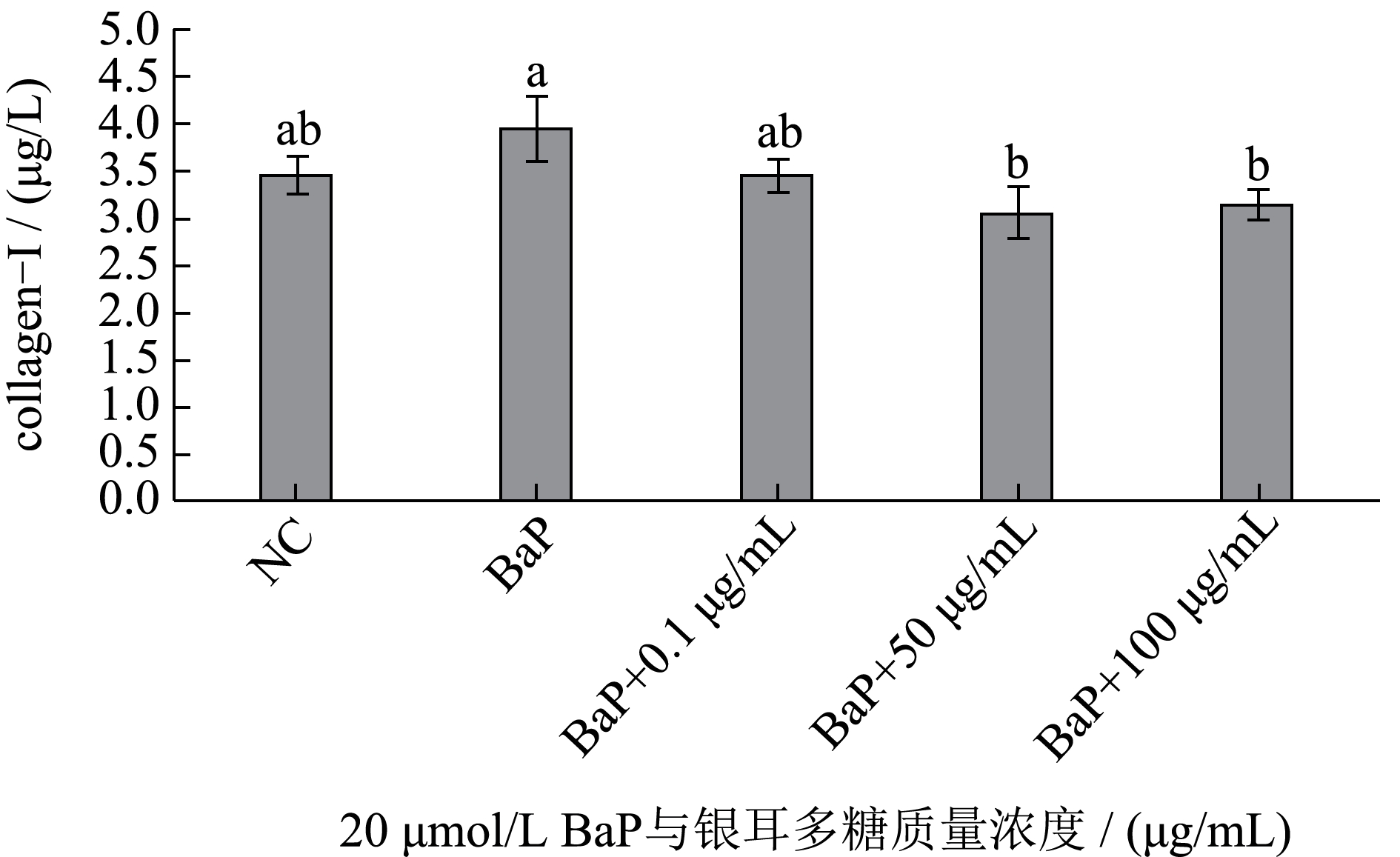
图6 银耳多糖对Collagen-1 蛋白含量的影响
Fig.6 Effect of Tremella polysaccharides on Collagen-1 protein content
3 结论
银耳多糖有一定的体外抗氧化活性,且细胞实验中10 mg/mL范围内银耳多糖没有表现出细胞毒性。BaP对成纤维细胞胶原蛋白、弹性蛋白及MMP-1等基因的表达有显著刺激作用,低质量浓度银耳多糖能有效抑制该刺激。随着多糖浓度增大,胶原蛋白Collagen I、Collagen III和弹性蛋白Elastin基因表达量呈现浓度依赖性增加。与空白对照相比,胶原蛋白Collagen-1基因表达量最高增加1.26倍,MMP-1基因表达量最高增加1.69倍。在BaP暴露环境下,尽管胶原蛋白基因表达量增加,但由于MMP-1的大量表达会降解胶原蛋白,因此100 μg/mL质量浓度范围内银耳多糖作用下胶原蛋白Collagen-1的含量表现为减少,低至3.06 μg/L(低于空白对照组3.48 μg/L)。这项研究表明银耳多糖有缓解Bap刺激细胞的作用,促进相关基因表达,为银耳多糖对BaP致衰作用的保护提供了新的依据。
[1] MA X,YANG M,HE Y,et al.A review on the production,structure,bioactivities and applications of Tremella polysaccharides [J].International Journal of Immunopathology and Pharmacology,2021,35: 1-14.
[2] WU Y J,WEI Z X,ZHANG F M,et al.Structure,bioactivities and applications of the polysaccharides from Tremella fuciformis mushroom: A review [J].International Journal of Biological Macromolecules,2019,121: 1005-1010.
[3] 董传志,龙慧,李明洁,等.不同浓度银耳多糖的体外模拟消化特性比较 [J].现代食品科技,2023,39(5):183-189.
[4] YANG D D,LIU Y,ZHANG L J.Chapter Sixteen-Tremella polysaccharide: The molecular mechanisms of its drug action [J].Progress in Molecular Biology and Translational Science,2019,163: 383-421.
[5] NGUYEN D D,MOO B C.Review on characteristics of PAHs in atmosphere,anthropogenic sources and control technologies [J].Science of the Total Environment,2017,609,31: 682-693.
[6] ADRIAN G,PEDRO J G,NUNO R.Levels,trends and health concerns of atmospheric PAHs in Europe [J].Atmospheric Environment,2014,99: 474-484.
[7] MOKRZYŃSKI K,SZEWCZYK G,SARNA T.Benzo [A]Pyrene and Benzo [E]Pyrene: photoreactivity and phototoxicity towards human keratinocytes [J].Photochemistry and Photobiology,2022,99(3): 983-992.
[8] GUARNIERI G,BECATTI M,SQUECCO R,et al.Effects of benzo [a]pyrene on the reproductive axis: Impairment of kisspeptin signaling in human gonadotropin-releasing hormone primary neurons [J].Environmental Pollution(Barking,Essex: 1987),2022,317: 120766.
[9] 冯婧宇,魏智超,魏建宏.原花青素对苯并 [a]芘神经毒性的保护作用 [J].环境与职业医学,2023,40(4):441-447.
[10] BOURGART E,BARBEAU D,MARQUES M,et al.A realistic human skin model to study benzo [a]pyrene cutaneous absorption in order to determine the most relevant biomarker for carcinogenic exposure [J].Archives of Toxicology,2019,93(1): 81-93.
[11] BOUZROUD S,El M E,SOBEH M,et al.Biotechnological approaches to producing natural antioxidants: anti-ageing and skin longevity prospects [J].International Journal of Molecular Sciences,2023,24(2): 1397.
[12] 李燕.银耳多糖的抗衰老作用及其机制研究 [D].上海:第二军医大学,2004.
[13] SHEN T,DUAN C,CHEN BD,et al.Tremella fuciformis polysaccharide suppresses hydrogen peroxide-triggered injury of human skin fibroblasts via upregulation of SIRT1 [J].Molecular Medicine Reports,2017,16(2): 1340-1346.
[14] FU H,YOU S Q,ZHAO D,et al.Tremella fuciformis polysaccharides inhibit UVA-induced photodamage of human dermal fibroblast cells by activating up-regulating Nrf2/Keap1 pathways [J].Journal of Cosmetic Dermatology,2021,20(12): 4052-4059.
[15] 于玲.银耳多糖的抗光老化作用初探 [J].福建轻纺,2022,400(9):11-14.
[16] SUWIMON J,SIRIRUK S,POLKIT S,et al.Acemannan stimulates gingival fibroblast proliferation;expressions of keratinocyte growth factor-1,vascular endothelial growth factor,and type I collagen;and wound healing [J].Journal of Pharmacological Sciences,2019,109(4): 525-531.
[17] HAN J M,WANG J,SHI H WI,et al.Ultra-small polydopamine nanomedicine-enabled antioxidation against senescence [J].Materials Today Bio,2023,19: 100544.
[18] 魏婷,郭晓萌,张焱.黑参多糖的抗氧化和抗肿瘤活性 [J].现代食品科技,2023,39(3):55-65.
[19] DANA L F,SUN J,LIU R H.A modified methylene blue assay for accurate cell counting [J].Journal of Functional Foods,2008,1(1): 109-118.
[20] 吴振亚.银耳多糖的提取纯化、理化性质及抗氧化活性研究 [D].雅安:四川农业大学,2016.
[21] GAIDAMAKOVA E K,SHARMA A,MATROSOVA V Y,et al.Small-Molecule Mn antioxidants in caenorhabditis elegans and deinococcus radiodurans supplant mnsod enzymes during aging and irradiation [J].mBio,2022,13(1): e0339421.
[22] SONG N,WANG H J,GU T T,et al.Sonic hedgehog-c-Jun N-terminal kinase-zinc finger protein Gli1 signaling protects against high glucose concentration-induced reactive oxygen species generation in human fibroblasts [J].Experimental and Therapeutic Medicine,2018,15(6): 5084-5090.
[23] XIA R,SUN M,BALCÁZAR J L,et al.Benzo [a]pyrene stress impacts adaptive strategies and ecological functions of earthworm intestinal viromes [J].Advance Online Publication,2023,17: 1004-1014.
[24] 高超,刘杰,胡峰霞.陈皮酚类化合物调控AHR和NF-κB通路抗苯并芘诱导的肺上皮细胞损伤 [J].现代食品科技,2021,37(2):36-43,274.
[25] LOU W,ZHANG M D,CHEN Q,et al.Molecular mechanism of benzo [a]pyrene regulating lipid metabolism via aryl hydrocarbon receptor [J].Lipids Health Dis,2022,21(1):13.
[26] 赵文倩.水母雪莲多糖对光老化HaCaT细胞的ERK、MMP-1表达的影响 [D].西宁:青海大学,2022.
[27] MOTTER C C,KAISER K,BALTAZAR T,et al.Evaluation of native and non-native biomaterials for engineering human skin tissue [J].Bioengineering &Translational Medicine,2022,7(3): e10297.
[28] 张丽宏,熊辉,胡中花,等.白桦脂醇对人皮肤成纤维细胞胶原蛋白及相关蛋白酶基因的调控机制研究 [J].国际中医中药杂志,2016,38(5):420-423.
[29] YANG X Y,WANG J T,WANG H C,et al.Metabolomics study of fibroblasts damaged by UVB and BaP [J].Scientific Reports,2021,11(1): 11176.
[30] 黄琳琳.基于氧化应激途径对过氧化物还原酶6调控牛肉嫩度机制的研究 [D].泰安:山东农业大学,2022.