马铃薯(Solanum tuberosum L.)是世界第四大粮食作物,全球有150 多个国家和地区种植,马铃薯在保障国际粮食安全中发挥重要的作用[1]。马铃薯富含蛋白质、碳水化合物、矿物质、多种维生素及人体必需的8 种氨基酸,尤其是花青素含量是所有粮食作物最全的,被称为地下苹果[2]。随着全球消费水平的提高,人们对马铃薯产品的需求越来越多元化,因此,马铃薯除了主食开发以外,如何增加马铃薯加工产品的附加值以满足人们的消费需求,特别是快餐和食品行业和的需求已成为马铃薯研究的热点之一[3]。彩色马铃薯是指薯皮或薯肉为粉色、红色、蓝色和蓝紫色等颜色的马铃薯[4],其除含有普通马铃薯(黄、白肉)基本营养物质外,还富含抗氧化活性物质花青素,花青素抗氧化能力是普通马铃薯的3~4 倍[5,6]。花青素具有抗氧化且对各种疾病如癌症、衰老、神经疾病等具有很好的抑制作用,并能有效抑制胶原酶、弹性酶的活性保持血管和皮肤弹性,对人体具有护肝、预防心脑血管疾病、改善视力等重要保健功能,还可以可作为医药制品、化妆品、食品的天然添加成分[7,8]。花色素苷属于类黄酮类化合物,种类的不同赋予了马铃薯块茎的不同颜色,包括红色、紫色、黑色。目前已报道自然界中花青素组分有20 多种[9,10],马铃薯中已鉴定出的花青素组分主要有天竺葵色素、矢车菊色素、芍药色素、飞燕草色素、矮牵牛色素和锦葵色素等常见的6 种[11,12]。然而,由于马铃薯种质资源多样性及染色体倍性复杂性,特别是通过有性杂交产生的不同彩色马铃薯的块茎花青素组分存在一定差异,即使是相同颜色的马铃薯由于其自身基因型的差异导致块茎花青素组分也有很大差异[13]。研究结果表明,彩色马铃薯块茎颜色由于染色体特定的基因变异而引起的,当马铃薯R 基因座上编码二氢黄酮醇-4-还原酶时,产生红色花青素(天竺葵素衍生物),而编码类黄酮-3’-5’-羟基化酶产生紫色花青素(飞燕草素、矮牵牛素和锦葵色素衍生物)[14,15]。因此,研究不同彩色马铃薯花青素组分及含量,有助于明确该品种的花青素主要组分,对彩色马铃薯花青素的提取与利用研究具有重要的意义。
由于彩色马铃薯逐渐受到市场的接受与青睐,彩色马铃薯品种选育日趋增加。欧美国家彩色马铃薯品种选育与栽培研究较早并成功应用到生产中,比如美国选育[16]出的彩色马铃薯品种的Dark Red Norland 和Red Norland,英国选育[17]出的彩色马铃薯品种King Edward、Congo Negresse 等。我国彩色马铃薯品种选育起步较晚,早期的彩色马铃薯主要黑美人,紫罗兰[18]和转心乌等品种,但近几年来相继报道了彩色马铃薯新品种的选育,如中国农业科学院蔬菜花卉研究所的选育的中薯红1 号[19],云南省农业科学院马铃薯研究所选育的紫云系列品种、红云和彩云系列品种[20],希森马铃薯产业有限公司选育的黑玫瑰、紫玫瑰,内蒙古农牧业科学院选育的红美。福建省农业科学院作物研究所于2006 年以来开展马铃薯新品种选育及配套栽培技术研究,先后选育出了闽薯1 号[21]、闽薯2 号[22]、闽薯3 号、福克212、福克76 号等新品种,为了满足市场多元化需求,近年来开展了彩色马铃薯新种选育及配套栽培技术研究,经过10 余年的工作积累,彩色马铃薯新品种闽彩薯1 号、闽彩薯2 号、闽彩薯3 号于2020 年通过国家非主要农作物品种登记,闽彩薯4 号已申请国家非主要农作物登记[23],但是关于以上4 个品种的花青素组分还不明确。本研究采用高效液相色谱和质谱联用方法(High Performance Liquid Chromatography-tandem Mass Spectrometry,HPLC-MS),对新选育的4 个彩色马铃薯新品闽彩薯1、2、3、4 号块茎花青素组分及其含量进行了分析,旨在明确4 个彩色马铃薯新品种的花青素含量,明确其花青素组分的组成及其品种之间的差异,为马铃彩色马铃薯新品种选育提供理论依据。
1 材料与方法
1.1 仪器
AgilentG6410 HPLC-MS(液相色谱-质谱联用仪),Agilent 1260 高效液相色谱仪(G1379A 脱气机,G1311A 泵,G1316A 柱温箱,G1314A VWD检测器);常州国华HH-2 数显恒温水浴锅,德国Prosense 旋转蒸发仪。
1.2 试剂
矢车菊色素-3-O-葡萄糖苷,购自国药集团;甲酸、三氟乙酸和乙腈为色谱纯,其余试剂均为分析纯。
1.3 试验材料
闽彩薯1 号、闽彩薯2 号、闽彩薯3 号和闽彩薯4 号(图1),均为福建省农业科学院作物所选育的马铃薯品种,保存于福建省农业科学院作物所马铃薯种质资源圃。
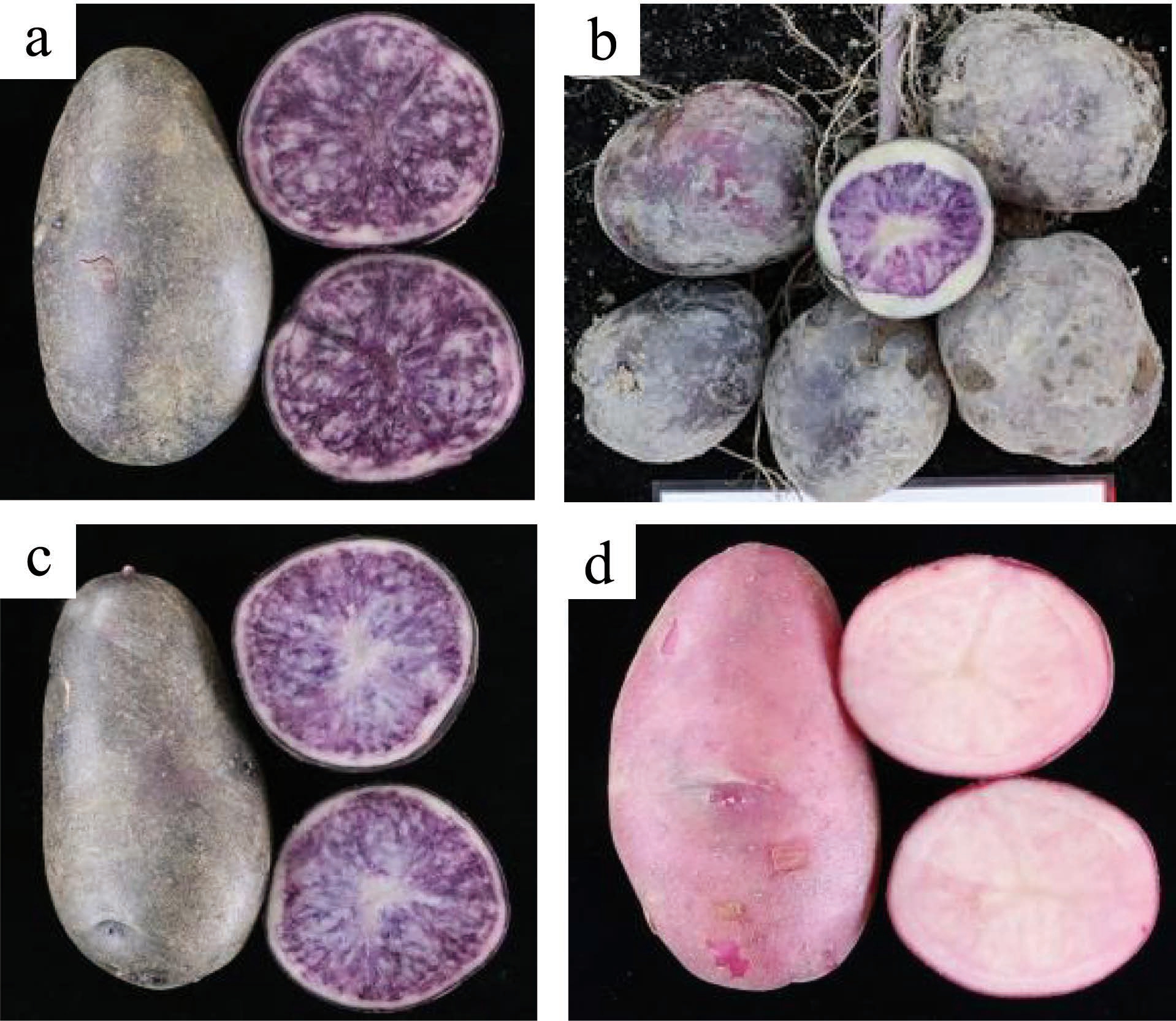
图1 供试材料的薯块特征
Fig.1 Tuber characteristics of tested materials
注:a:闽彩薯1 号;b:闽彩薯2 号;c:闽彩薯3 号;d:闽彩薯4 号。
1.4 花青素提取
收获时取新鲜马铃薯薯块(皮和薯肉),切成小块,液氮研磨成粉末,后用冷冻干燥机干燥,精确称取粉末5 g,加入pH 值3.0 的体积分数为60%乙醇溶液50 mL,置于50 ℃恒温水浴锅浸提2 h。
1.5 花青素纯化
待提取液冷却后,将提取液分装在10 mL 离心管中,4 000 r/min 离心5 min 后,取上清液经AB-8树脂吸附后用ddH2O 冲洗掉糖类等杂质,再用pH值3.0 的体积分数为60%乙醇将色素淋洗下来作为花青素纯化液,经旋转蒸发仪浓缩干燥后,溶于体积分数为1%盐酸甲醇溶液。
1.6 标准曲线制作
称取1 mg 矢车菊素-3-O-葡萄糖苷标准品溶于1 mL 的体积分数为1%盐酸甲醇溶液,然后稀释至10、20、30、40 和50 μg/mL。过0.22 μm 水系微孔过滤膜,每次进样量3 μL,每个浓度进样3 次,取3 次峰面积的平均值。以标样浓度为横坐标,峰面积为纵坐标做标准曲线。
如图2 所示,所测定的矢车菊素-3-O-葡糖苷标准品峰型单一,稳定性较好,以进样浓度为横坐标,峰面积为纵坐标,绘制标准曲线,得到线性回归方程Y=6.236 3X+3.430 2,R²=0.996,矢车菊素浓度与峰面积具有良好的线性关系。
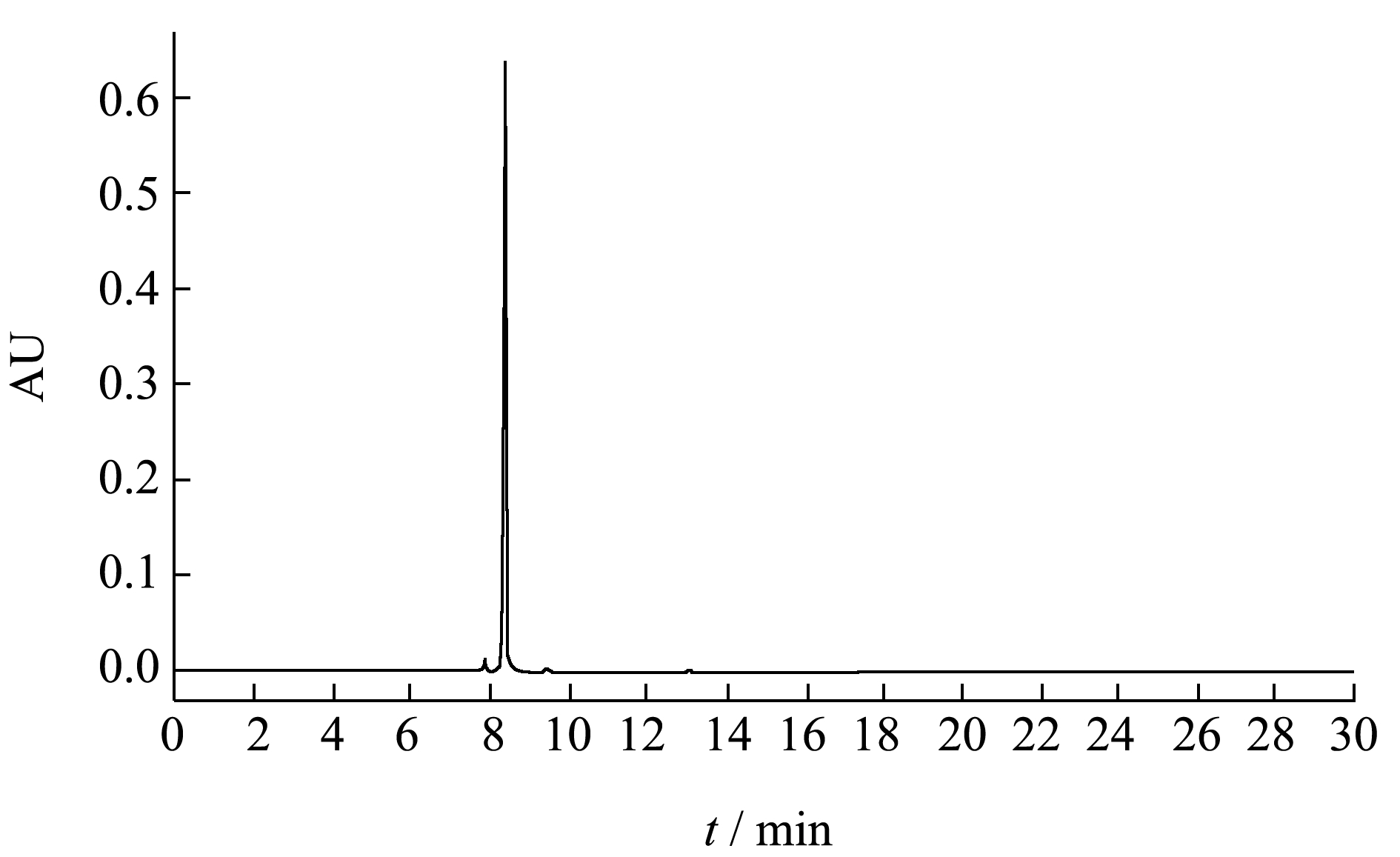
图2 矢车菊素-3-O-葡糖苷的超高效液相色谱图
Fig.2 HPLC profiles (525 nm) of Cyanidin-3-O-glucoside
1.7 HPLC-Q-TOF-MS条件
1.7.1 HPLC参数
色谱柱:Waters CORTECS C18,2.7 μm,3 mm×150 mm;柱温:30 ℃;检测器及波长:525 nm;流动相A:0.1%甲酸/水溶液(体积比),过0.22 μm水系微孔过滤膜;流动相B:0.1%甲酸/乙腈溶液(体积比);流动相流速:0.3 mL/min;进样量10 μL,梯度条件:0~3 min A 相从100%线性变化至80%,3~28 min A 相从80%线性变化至70%,28~33 min 变为0%,33~35 min 变回100%并平衡5 min,共40 min,(上述% 表示体积分数)方法参照[24]。
1.7.2 MS参数
离子源:dual ESI 源,负离子模式;干燥气温度350 ℃;干燥气流速为10 L/min;雾化气压力40 psi;Fragmentor 130 V;毛细管电压3 500 V;采集频率1 spectra/s;采集模式2 GHz 动态拓展模式;m/z 100~1 200。实验所用气体为氮气(纯度>99.9%),碰撞气为高纯氮(纯度>99.999%)。低能量扫描时碰撞能量为10 eV,中能量扫描时碰撞能量为25 eV,高能量扫描时碰撞能量为40 eV。Agilent MassHunter Qualitative Analysis B.04.00 软件(Agilent 公司)。
1.8 数据分析
采用Microsoft Office Excel 进行数据处理及分析并进行作图。
2 结果与分析
2.1 花青素的分离纯化
前人的研究表明,马铃薯花青素的主要成分是矢车菊素、飞燕草素等及其糖苷化和酰基化的衍生混合物,在酸性条件下具有较高的稳定性,在中性和碱性条件下容易降解,本试验参考前人的试验,选用pH 值3.0 的φ=60%乙醇溶液提取,选用AB-8 大孔树脂进行花青素的分离纯化。通过测定纯化前后溶液的OD 值表明花青素的提取率在85%以上。
2.2 4个彩色马铃薯花青素组成比较分析
经过液相色谱结合质谱数据分析,闽彩薯1 号薯肉花青素总有6 个组分(图3a),组分1 为矮牵牛素3-咖啡酰芸香糖苷-5-葡糖苷;组分2 为飞燕草素3-p-香豆酰基芸香糖苷-5-葡萄糖苷;组分3为矮牵牛素3-p-香豆酰基芸香糖苷-5-葡萄糖苷;组分4 为锦葵素3-p-香豆酰基芸香糖苷-5-葡糖苷;组分5 为矮牵牛素3-阿魏酰芸香糖苷-5-葡糖苷;组分6 为芍药素3-p-香豆酰基芸香糖苷-5-葡萄糖苷。其中以组分3 为矮牵牛素3-p-香豆酰基芸香糖苷衍生物含量最高,为81.66 mg/100 g FW,占花青素含量的85%,说明紫肉色马铃薯花青素组分主要为矮牵牛素的衍生物[25]。
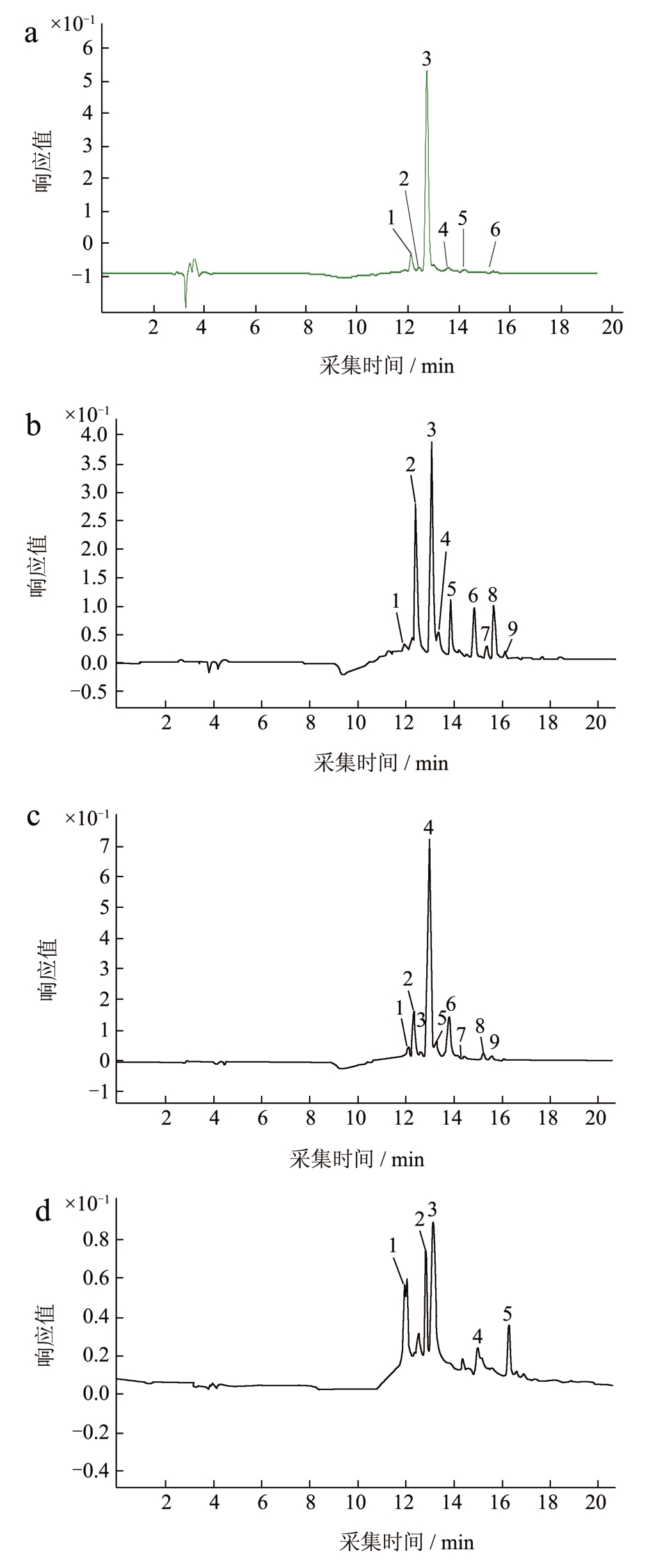
图3 闽彩薯系列马铃薯花青苷类化合物在520 nm的液相色谱图
Fig.3 Liquid chromatography (LC) chromatogram (520 nm)for the anthocyanins in extracts of purple potato Mincaishu
注:a:闽彩薯1 号;b:闽彩薯2 号;c:闽彩薯3 号;d:闽彩薯4 号。
闽彩薯2 号含有9 个花青素单体组分(图3b),其中6 个组分同闽彩薯1 号的组分相同,不同的是组分1 为飞燕草素3-芸香糖苷-5-葡糖苷,组分8 为矮牵牛素3-芸香糖苷-5-葡萄糖苷;组分9 为矢车菊素3-芸香糖苷。其组含量最高的和闽彩薯1 号相同,以矮牵牛素3-p-香豆酰基芸香糖苷-5-葡萄糖苷含量最高,为56.09 mg/100 g FW,占花青素含量的71%。
闽彩薯3 号含有10 个花青素组分(图3c),其中8 个组分与闽彩薯1 号、闽彩薯2 号相同,不同是的组分2a 为矢车菊素3-咖啡酰基芸香糖苷-5-葡萄糖苷;组分3 为矢车菊素3-p-香豆酰基芸香糖苷-5-葡萄糖苷。花青素组分同样以矮牵牛素3-p-香豆酰基芸香糖苷-5-葡萄糖苷含量最高,为86.50 mg/100 g FW,占花青素含量的61%。
闽彩薯4 号的花青素组成较少,仅有5 个花青素组分(图3d),其中,矢车菊素 3-芸香糖苷和芍药素3-p-香豆酰基芸香糖苷-5-葡萄糖苷与闽彩薯1 号、闽彩薯2 号和闽彩薯3 号相同,但其含有紫色马铃薯没有的天竺葵素苷元。组分1 为天竺葵素3-芸香糖苷;组分2 为天竺葵素3-p-香豆酰基芸香糖苷-5-葡萄糖苷;组分4 为天竺葵素3-p-香豆酰基芸香糖苷。含量最高的是矢车菊素3-芸香糖苷,为29.79 mg/100 g FW,其次是天竺葵素3-p-香豆酰基芸香糖苷-5-葡萄糖苷,含量为19.27 mg/100 g FW,分别占花青素含量的44%和28%。闽彩薯4 号的花青素组分主要为矢车菊素的衍生物,同时还发现竺葵素衍生物也是闽彩薯4 号花青素主要组分。
14 种花青素组分具体结构如图4 所示,闽彩薯系列花青素含有全部6 种花青素基本苷元,其中,10 种花青素单体为单酰基化花青素,参与修饰的酰基最多的是p-香豆酰基,其次是咖啡酰基和阿魏酰基;糖基修饰主要为葡萄糖和芸香糖(表1)。
表1 马铃薯花青素单体结构组成
Table 1 Monomer structure composition of potato anthocyanin
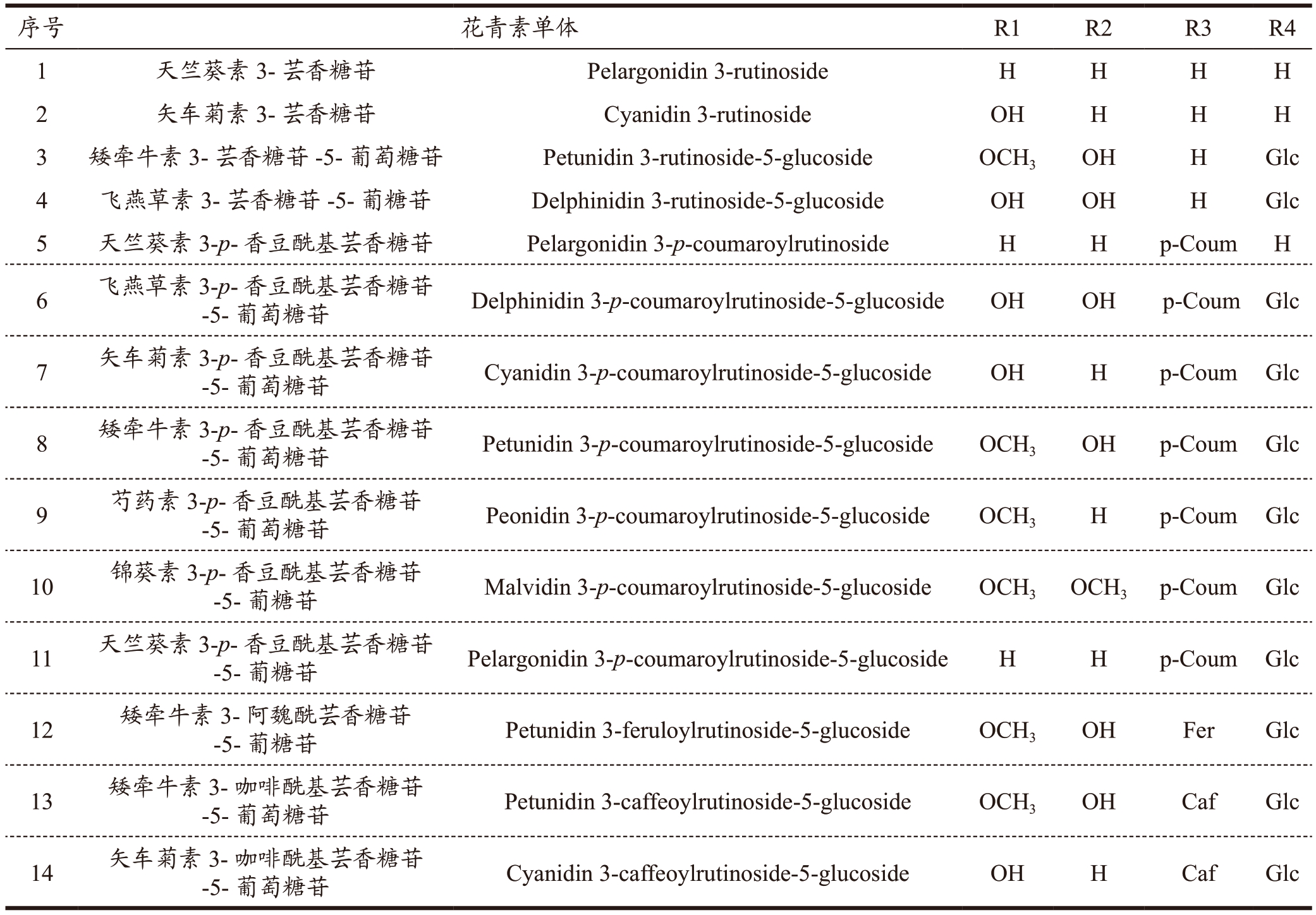
注:p-Coum 表示p-香豆酰基;Fer 表示阿魏酰基;Caf 表示咖啡酰基;Glc 表示葡萄糖苷。
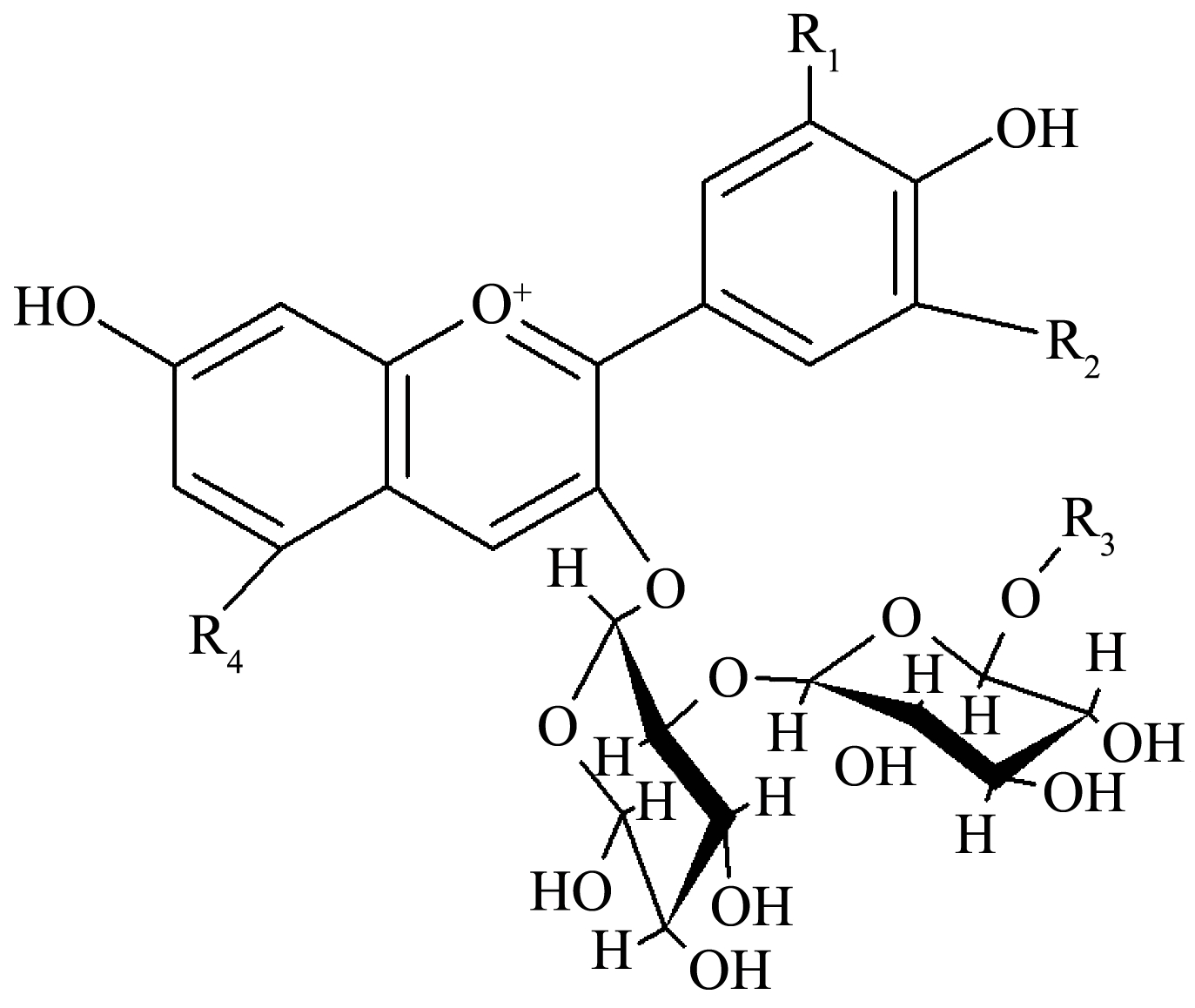
图4 马铃薯花青素单体结构
Fig.4 Structures of anthocyanidins commonly found in potato
综上,不同颜色彩色马铃薯花青素含量和组分不同,同种颜色的马铃薯花青素的含量和组分也存在一定的差异,鉴定出的红肉色马铃薯块茎的花青素组分主要为天竺葵素的衍生物,而紫肉色马铃薯块茎的花青素组分主要为矮牵牛素、芍药素和飞燕草素的衍生物,这和刘芳(2018)研究结果相同[26]。闽彩薯1 号和闽彩2 号主要为矮牵牛素衍生物,而闽彩色3 号主要为矮牵牛素、芍药素和飞燕草素的衍生物。
2.3 4个彩色马铃薯花青素含量分析
花青素总含量如图5 所示,闽彩薯1 号、闽彩薯2 号、闽彩薯3 号和闽彩薯4 号花青素含量分别为95.48、78.08、139.77、67.25 mg/100 g FW。如表2 所示,4 个品种间花青素含量达显著差异,闽彩薯3 号花青素含量最高,闽彩薯4 号花青素含量最低。
表2 HPLC-MS推测闽彩薯系列花青素单体
Table 2 LC-MS data and putative identification of anthocyanins in leaves of purple potato of Mincaishu

续表2
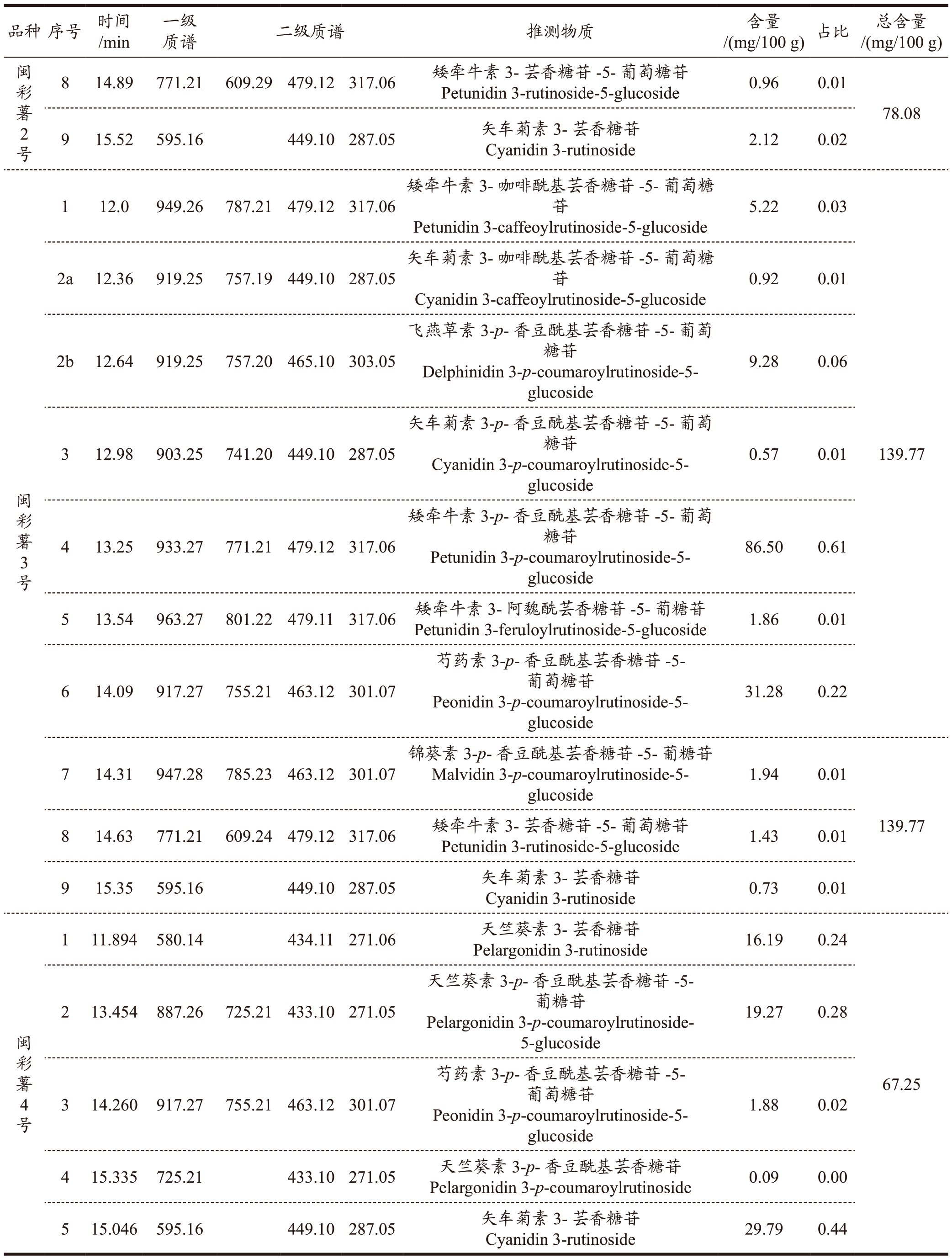
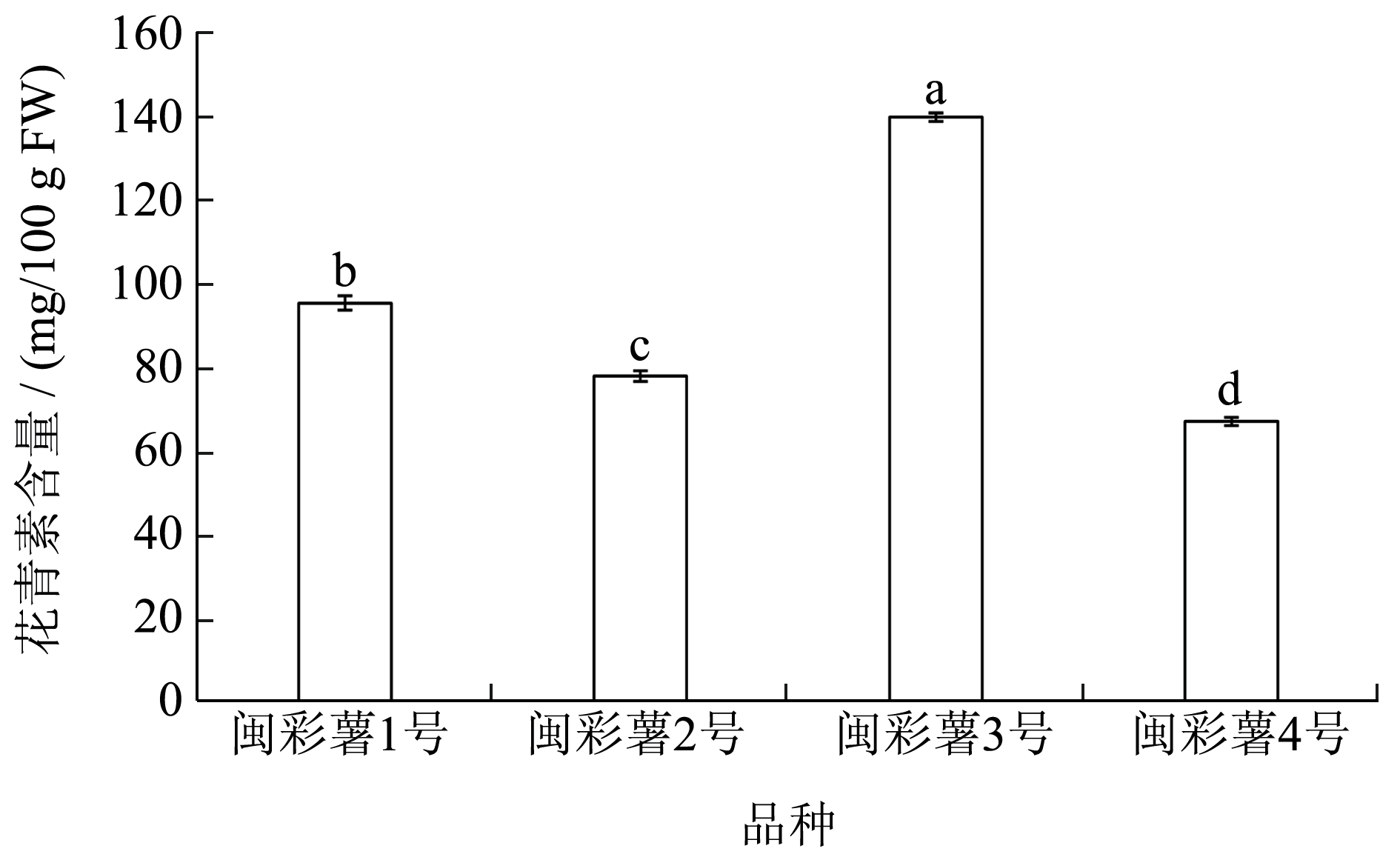
图5 4 个马铃薯品种花青素含量
Fig.5 Anthocyanidin content of four potato varieties
3 个紫色马铃薯花青素主要组分为矮牵牛素3-p-香豆酰基芸香糖苷-5-葡萄糖苷含量占组分的(61.9%~85.5%),但闽彩薯3 号主要组分还包括芍药素3-p-香豆酰基芸香糖苷-5-葡萄糖苷,其含量占比为22.4%。红肉色马铃薯闽彩薯4 号花青素主要组分含量与紫肉色品种存在较大差异,其中矢车菊素3-芸香糖苷含量为29.79 mg/100 g FW,占比44%,天竺葵素3-p-香豆酰基芸香糖苷-5-葡糖苷含量为19.28 mg/100 g FW,占比28%,天竺葵素3-芸香糖苷含量为16.20 mg/100 g FW,占比24%。
3 结论
本研究采用HPLC-MS 测定了4 个彩色马铃薯花青素组分和含量,明确了4 个彩色马铃薯花青素的主要组分以及花青素总含量。研究结果表明4 个马铃薯共含有14 种花青素组分,其中3 个紫肉色马铃薯花青素主要组分为矮牵牛素衍生物混合芍药素衍生物,红肉色马铃薯花青素主要组分为矢车菊素和天竺葵素衍生物,表明紫肉色马铃薯与红肉色马铃薯花青素组分有较大差异。花青素总含量结果表明,闽彩薯3 号花青素含量最高为139.77 mg/100 g FW,其次是闽彩薯1 号、闽彩薯2 号和闽彩薯4 号,含量分别为95.48、78.08 和67.25 mg/100 g FW。同时本研究测定4 个马铃薯品种的花青素组分含有全部6种花青素基本苷元,其中,10 种花青素单体为单酰基化花青素,参与修饰的酰基p-香豆酰基、咖啡酰基和阿魏酰基以及糖基修饰葡萄糖和芸香糖,因此,选育的4 个彩色马铃薯品种花青素结构较为稳定,可作为天然色素的重要原料及杂交育种的亲本材料。
[1] JOSHI M,FOGELMAN E,BELAUSOV E,et al.Potato root system development and factors that determine its architecture [J].Journal of Plant Physiology,2016,205(1):113-123.
[2] BABBAR N,OBEROI H S,SANDHU S K,et al.Influence of different solvents in extraction of phenolic compounds from vegetable residues and their evaluation as natural sources of antioxidants [J].Jounal of Food Science and Techology,2014,51(10): 2568-2575.
[3] BVENURA C,WITBOOI H,KAMBIZI L.Pigmented potatoes: a potential panacea for food and nutrition security and health [J].Foods,2022,11(2): 175.
[4] GUMUL D,ARECZUK A,BERSKI W,et al.Selected physicochemical properties of starch isolated from colored potatoes (Solanum tuberosum L.) as compared to starch from yellow flesh potatoes [J].Starch-starke,2022,74(3-4): 158-166.
[5] TIERNO R,LÓPEZ A,RIGA P,et al.Phytochemicals determination and classification in purple and red fleshed potato tubers by analytical methods and near infrared spectroscopy [J].Journal of the Science of Food and Agriculture,2016,96(6): 1888-1899.
[6] KRYSTYIAN M,GUMUL D,ARECZUK A,et al.Comparison of physico-chemical parameters and rheological properties of starch isolated from coloured potatoes (Solanum tuberosum L.) and yellow potatoes [J].Food Hydrocolloids,2022,131(9): 10.
[7] BURGOS G,AMOROS W,MUNOA L,et al.Total phenolic,total anthocyanin and phenolic acid concentrations and antioxidant activity of purple-fleshed potatoes as affected by boiling [J].Journal of Food Composition and Analysis,2013,30(1): 6-12.
[8] 谢婉,岳诚,鲜登宇.基于2010-2020年CNKI的研究文献分析中国彩色马铃薯研究现状 [J].中国马铃薯,2022,36(2):177-183.
[9] 殷丽琴,彭云强,钟成,等.高效液相色谱法测定8个彩色马铃薯品种中花青素种类和含量 [J].食品科学,2015,18:143-147.
[10] 蒋伟,罗晓庆,尹磊,等.彩色马铃薯种质资源的蒸食品质分析 [J].中国食物与营养,2020,2:19-24.
[11] YIN L,CHEN T,LI Y,et al.A comparative study on total anthocyanin content,composition of anthocyanidin,total phenolic content and antioxidant activity of pigmented potato peel and flesh [J].Food Science and Technology Research,2016,22(2): 219-226.
[12] 白粉娥,成宇峰.两种彩色马铃薯品种花色苷成分分析及其总抗氧化活性的比较研究 [J].保鲜与加工,2018,18(2):108-113.
[13] PEKSSA A,KITA A,KULAKOWSKA K,et al.The quality of protein of coloured fleshed potatoes [J].Food Chemistry,2013,141(3): 2960-2966.
[14] JONG W,EANNETTA N T,JONG D M,et al.Candidate gene analysis of anthocyanin pigmentation loci in the Solanaceae [J].Theoretical and Applied Genetics,2004,108(3): 423-432.
[15] ZHANG Y,CHENG S,JONG D D,et al.The potato R locus codes for dihydroflavonol 4-reductase [J].Theoretical and Applied Genetics,2009,119(5): 931-937.
[16] ANDERSEN A W,TONG C,KRUEGER D E.Comparison of periderm color and anthocyanins of four red potato varieties [J].American Journal of Potato Research,2002,79(4): 249-253.
[17] BOGUCKA B,ELZBIETA T.Effect of nitrogen and potassium fertilization on mineral and amino acid content of colored flesh potato cultivar Blue Congo [J].Journal of Plant Nutrition,2018,41(7): 856-866.
[18] 张桂芝,杨升,李洪兴.营养保健型紫皮紫肉马铃薯紫罗兰的品种选育 [J].中国林副特产,2014,5:12-14.
[19] 段绍光,金黎平,卞春松,等.特色马铃薯新品种“中薯红1号”的选育 [C]//马铃薯产业与精准扶贫2017.贵州毕节:哈尔滨地图出版社,2017:310-311.
[20] 白建明,隋启君,杨琼芬,等.彩色马铃薯新品种‘紫云1号’[J].园艺学报,2018,45(S2):2781-2782.
[21] 汤浩,梁金萍,曾军,等.马铃薯新品种闽薯1号选育及配套栽培技术研究 [J].福建农业学报,2007,2:150-153.
[22] 罗文彬,李华伟,许泳清,等.南方冬作区马铃薯新品种‘闽薯2号’ [J].园艺学报,2019,46(10):204-205.
[23] 罗文彬,李华伟,许国春,等.彩色马铃薯种质资源的引进与评价 [J].福建农业学报,2019,34(3):278-283.
[24] IERI F,INNOCENTI M,ANDRENELLI L,et al.Rapid HPLC/DAD/MS method to determine phenolic acids,glycoalkaloids and anthocyanins in pigmented potatoes(Solanum tuberosum L.) and correlations with variety and geographical origin [J].Food Chemistry,2011,125(2):750-759.
[25] 姜超,于肖夏,于卓,等.彩色马铃薯新品系花青素组分和含量的液质联用分析 [J].草业学报,2017,26(10):99-107.
[26] 刘芳.马铃薯块茎不同花色素苷转化机制研究 [D].济南:山东师范大学,2018.