阿尔兹海默症(Alzheimer’ Disease,AD)是一种常见于中老年人的神经退行性疾病,目前随着社会的发展,AD 的发病率不断上升。由于其不可逆转的原因,AD 已经成为世界上最严重的疾病之一。据统计,全世界目前有近3 000 万人罹患AD,在未来20 年这个数字可能会再翻一倍 [1]。AD 发病通常会导致患者的认知和空间记忆能力下降、脑部炎症以及睡眠障碍等多方面的疾病,这涉及到神经细胞损伤、线粒体和糖脂代谢等功能障碍,最终导致神经系统的不可逆损伤 [2]。目前对于AD 的发病机制仍然没有确切的定论,较为流行的几种假说包括淀粉样前体蛋白(Amyloid Precursor Protein,APP)异常水解形成的β-淀粉样蛋白(β-amyloid,Aβ)导致的神经毒性,tau 微管蛋白的过度磷酸化引起的神经纤维缠结(Neurofibrillary Tangles,NFT),以及胆碱能神经递质假说等 [3,4]。氧化应激损伤是导致神经元凋亡的重要原因,这是因为Aβ 沉积所形成的不溶性斑块会导致自由基的大量生成,引起线粒体功能、糖脂代谢以及其他关键的生化反应障碍 [5-7],最终导致神经元因供能不足等原因凋亡。因此,改善氧化应激损伤可能是改善AD 的重要研究方向。
越来越多的证据显示,多不饱和脂肪酸(Polyunsaturated Fatty Acids,PUFAs)与大脑部分功能有着密切联系,如突触间神经递质的传递,作为细胞膜的组成成分等 [8]。一些研究表明,诸如二十二碳六烯酸为代表的PUFAs 能够很好的缓解AD 动物模型的症状,这可能与PUFAs 优良的抗氧化能力有关 [9]。另外,在一些队列研究中也显示,中老年人群食用富含PUFAs 的食品能够显著降低认知障碍风险,体现了PUFAs 潜在的神经保护功效 [10]。这些研究说明开发富含PUFAs 相关的产品可能是未来治疗AD 的重要研究方向。
美藤果(Plukenetia volubilis)是一种原产于秘鲁的大戟科植物,在2013 年被批准为新资源食品 [11]。作为一种油料作物,美藤果种子中富含油脂、蛋白质等多种对人体有益的成分。美藤果油是从美藤果仁中提取出的食用油,其组成多为ω-3、ω-6和ω-9 多不饱和脂肪酸,以及维生素E 等多种抗氧化营养成分 [12]。前期研究显示,美藤果油能够改善大鼠的氧化应激反应标志物,改善小鼠肠道菌群紊乱等 [13],但目前对美藤果油治疗AD 的研究仍然较少。本研究旨在探讨美藤果油对Aβ25-35 诱导的AD模型细胞SH-SY5Y 的保护作用,以期开发新型缓解AD 的产品,并为其他相关的研究提供理论支持。
1 材料和方法
1.1 材料与仪器
美藤果油,普洱联众生物技术有限公司惠赠;人神经母细胞瘤细胞株(SH-SY5Y),武汉华尔纳生物科技有限公司(货号:SAc0350);Aβ25-35,上海麦克林生化科技有限公司(货号:A800621,纯度:≥97%);MEM/F12 基础培养基、非必需氨基酸(Nonessential Amino Acid,NEAA)、磷酸缓冲盐溶液(Phosphate Buffered Saline,PBS),武汉普诺赛生命科技有限公司;胎牛血清(Fetal Bovine Serum,FBS)、青链霉素(Penicillin-Streptomycin,P/S),赛默飞世尔科技有限公司;活性氧(Reactive Oxygen Species,ROS)检测试剂盒、丙二醛(Malonic Dialdehyde,MDA)检测试剂盒、超氧化物歧化酶(Superoxide Dismutase,SOD)检测试剂盒,南京建成生物工程研究所;线粒体膜电位(Mitochondrial Membrane Potential,MMP)水平检测试剂盒、BCA蛋白浓度测定试剂盒,上海碧云天生物技术研究所;CCK-8 细胞增殖检测试剂盒,白鲨生物公司。
Varioskan TM LUX 多功能酶标仪,赛默飞世尔科技(中国)有限公司;TCS SP8 激光共聚焦荧光显微镜,德国Leica 公司;分析天平,上海精天电子仪器厂;细胞恒温培养箱,北京市永光明医疗仪器厂;BD FACSCalibur 流式细胞仪,碧迪医疗器械有限公司。
1.2 实验方法
1.2.1 细胞培养
SH-SY5Y 细胞培养于特定完全培养基中,培养箱条件为37 ℃、5% CO2。每天更换培养液直至细胞密度达到70%~80%,进行传代培养,选取处于对数生长期的细胞进行实验。
Aβ25-35 寡聚体制备参照文献 [14]的方法进行,稍作修改。精确称取1 mg Aβ25-35,加入1 mL 的超纯水,配制成 1 mg/mL 的质量浓度,置于细胞培养箱中培养72 h,聚集老化形成Aβ25-35 寡聚体,并储存于-80 ℃冰箱中备用。分别称取对应质量的美藤果油,加入150 μL 细胞级二甲基亚砜(Dimethyl Sulfoxide,DMSO),以完全培养基配制成0、5、10、20、40 μg/mL 的质量浓度,现配现用。参照表1 分组方案,每组设置六个复孔。
表1 分组方案与实验流程
Table 1 Grouping scheme and experimental procedure

注:—为正常培养。
1.2.2 CCK-8法测定细胞增殖率
Aβ25-35 寡聚体用完全培养基稀释至0、20、40、60、80、100 μg/L 的质量浓度,美藤果油依照1.2.1的方法配制,将处于对数生长期的细胞接种于96孔板中培养过夜,参照表1 分别加入100 μL 上述溶液,孵育24 h。按照试剂说明书配制CCK-8 工作液。孵育结束后,每孔吸去培养基并用预热的PBS 清洗两次,随后加入100 μL CCK-8 工作液,在细胞培养箱中孵育4 h 后,在450 nm 处测定各孔吸光度值。细胞增殖率参照如下公式计算:
式中:
D——细胞增殖率,%;
A0——只含有完全培养基和CCK-8 工作液的吸光度;
A1——含有药物溶液、细胞和CCK-8 工作液的吸光度;
A2——不含药物溶液,含有细胞和CCK-8 工作液的吸光度。
1.2.3 细胞ROS测定
按照ROS 试剂盒说明书,用MEM/F12 培养基稀释荧光探针DCFH-DA 工作液。孵育结束后,收集细胞沉淀,加入2 mL 稀释好的DCFH-DA 工作液,在细胞培养箱内孵育20 min。孵育结束后,加入MEM/F12 培养基洗涤三次,采用流式细胞术在激发波长488 nm,发射波长为525 nm 处测定荧光强度。
1.2.4 细胞氧化应激及蛋白含量测定
孵育结束后,吸去上清液,在每孔加入1 mL裂解液,裂解40 min,将所有液体用移液器吸出,得到细胞破碎液。依据试剂盒说明书测定细胞破碎液中MDA、SOD 含量。
1.2.5 细胞线粒体膜电位水平测定
细胞培养结束后,收集细胞悬液。依照试剂盒说明书,用JC-1 法测定细胞线粒体膜电位。采用流式细胞术在激发波长490 nm,发射波长为530 nm处检测JC-1 单体;在激发波长525 nm,发射波长590 nm 处检测JC-1 聚合物。
1.2.6 Western blot
依照试剂盒说明书进行蛋白浓度测定以及蛋白提取,用SDS-PAGE 凝胶电泳分离蛋白后将其转移至PVDF 膜上,并加入φ=5%的脱脂牛奶封闭处理1 h。用PBST 稀释一抗后,在4 ℃下孵育过夜。孵育结束后,用PBST 洗净并加入PBST 稀释的二抗,在室温下共同孵育90 min。孵育结束后用PBST 缓冲液洗净,用ECL 化学发光液与膜孵育1 min,在凝胶成像系统中成像。以β-actin 为内参,用Image J 软件对各个条带灰度值进行数值分析。
1.2.7 流式细胞术测定细胞凋亡率
使用Annexin V-FITC/PI 细胞凋亡检测试剂盒进行检测。在细胞沉淀中加入500 μL 1X Annexin V buffer 重悬细胞,随后加入5 μL Annexin V-FITC 和5 μL 碘化丙啶染色液,轻轻混匀,在室温下避光孵育15 min,使用流式细胞术进行检测。
1.3 数据处理
使用Image J 软件对图片中荧光强度及条带灰度值进行分析,使用GraphPad Prism 8.0.2 进行统计分析,用单因素方差分析与Tukey 检验法进行组间比较。实验数据以平均值±标准差表示。与模型组比较:*P<0.05,有差异;**P<0.01,差异显著;***P<0.001,差异极显著,与空白组比较:#P<0.05,有差异,##P<0.01,差异显著,###P<0.001,差异极显著,所有实验均重复三次。
2 结果与分析
2.1 CCK-8测定各药物质量浓度对SH-SY5Y活力影响
采用CCK-8 法分别测定Aβ25-35 的造模质量浓度以及美藤果油的毒性评价。结果如图1 所示:在给予Aβ25-35 后,各组细胞活力均有一定程度的下降,其中在25 μg/L 的质量浓度下,细胞活力降至64.62%(P<0.005),因此本研究采用25 μg/L 的质量浓度处理构建AD 细胞模型。图2 显示,各剂量组美藤果油以及DMSO 均不会对细胞活力产生不利影响(P>0.05)。因此,本实验采用10、20、40 μg/mL的美藤果油处理细胞,研究美藤果油对AD 细胞的保护作用并分析是否具有质量浓度依赖性。
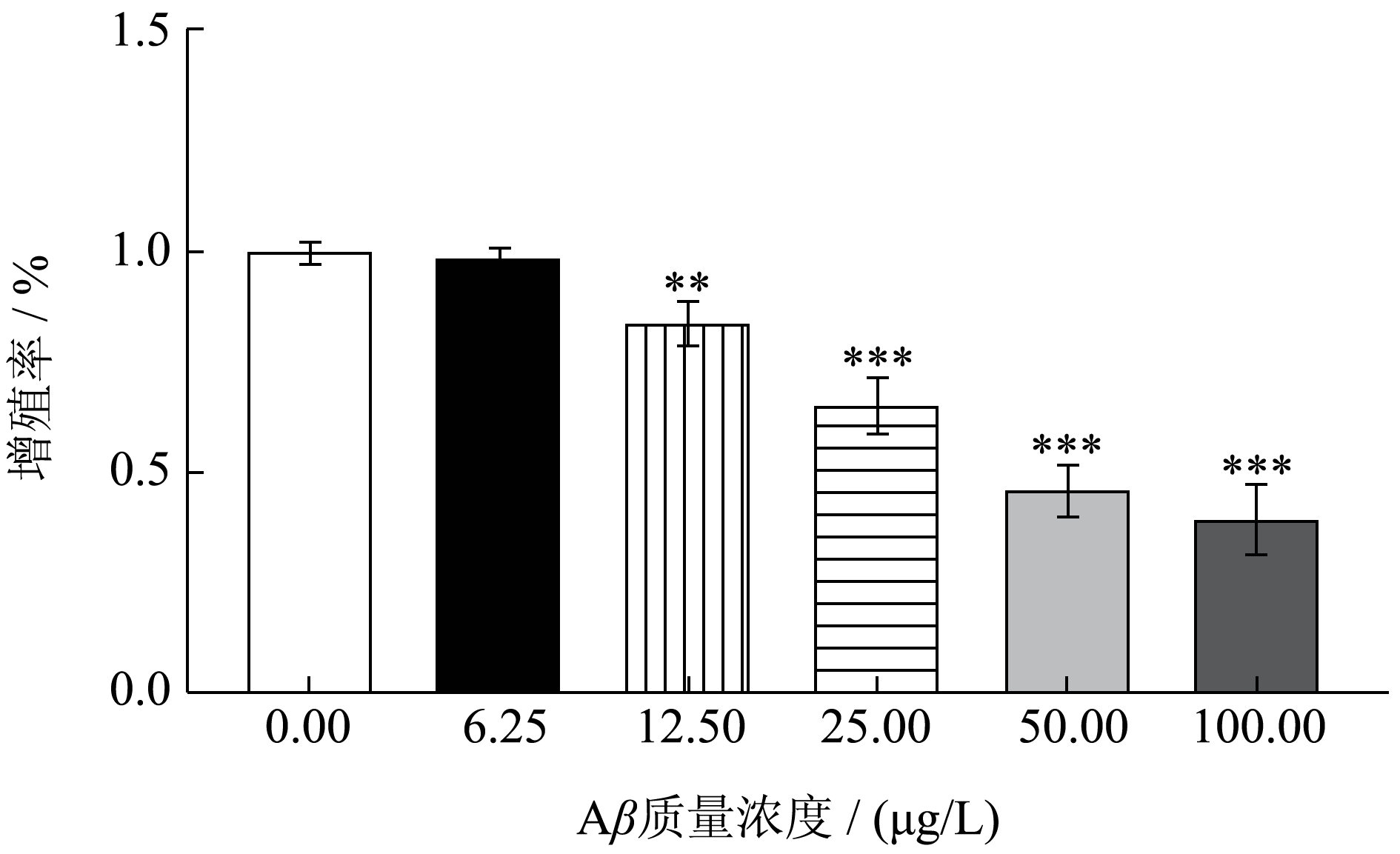
图1 不同质量浓度Aβ25-35 对SH-SY5Y 细胞活力的影响
Fig.1 Effect of different concentrations of Aβ25-35 on the viability of SH-SY5Y cells
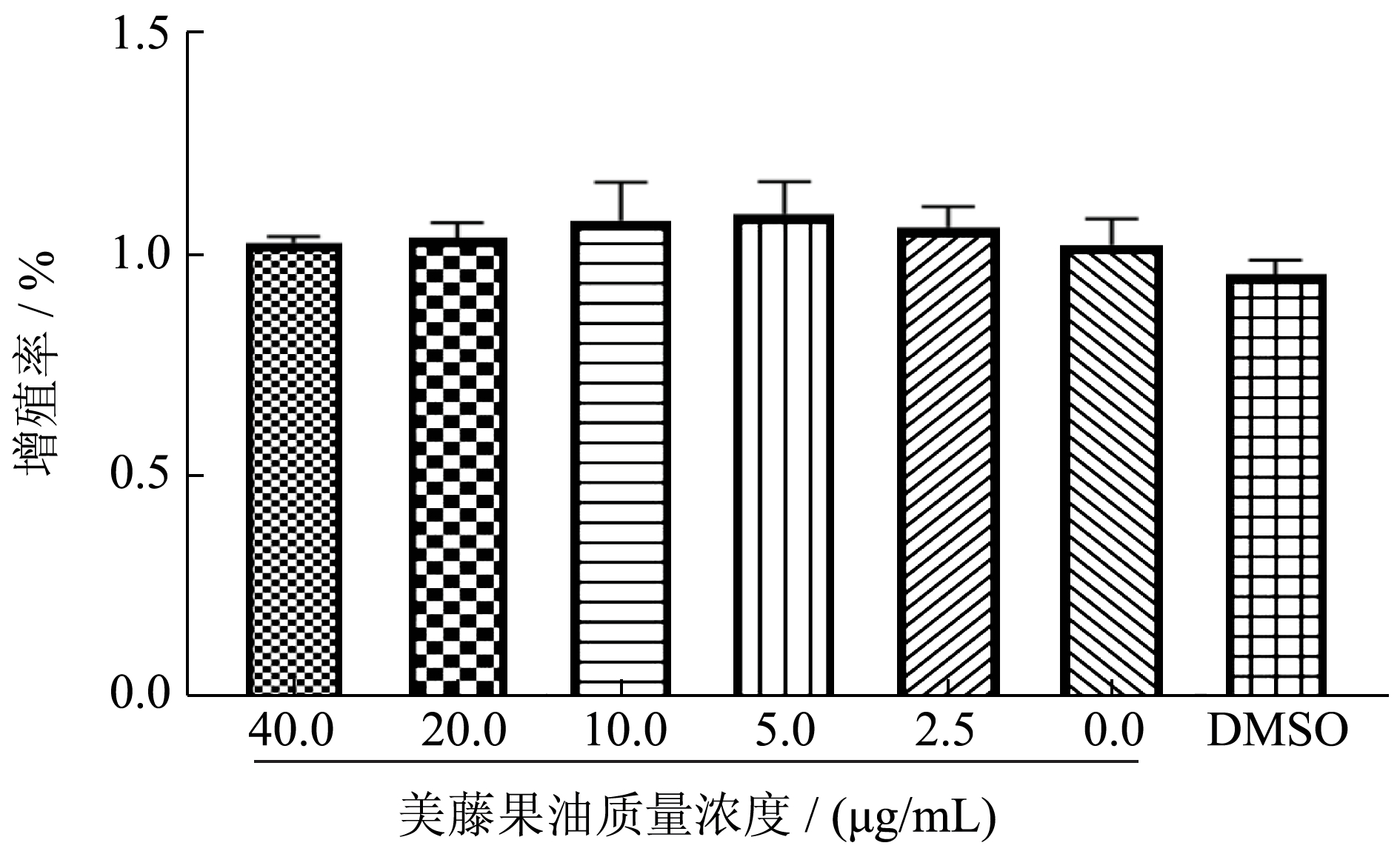
图2 不同质量浓度美藤果油和DMSO 对SH-SY5Y细胞活力的影响
Fig.2 Effect of different concentrations of Sacha inchi oil and DMSO on the viability of SH-SY5Y cells
2.2 美藤果油缓解SH-SY5Y氧化应激损伤
对各组细胞内ROS 含量采用流式细胞术分析,由图3 可知,与AD 组相比,各剂量组的ROS 荧光强度显著下降,并呈剂量依赖性。MDA与脂质过氧化程度相关,而SOD 是重要的抗氧化酶,因此采用上述指标来共同反映细胞氧化应激损伤程度。结果显示,AD 组的MDA 含量显著上升,SOD 酶活力下降,说明存在严重的氧化应激损伤,而经过美藤果油治疗后,20、40 μg/mL 剂量组MDA 含量水平分别降低了24.24%、42.73%,ROS 含量水平分别降低了15.34%、25.53%,同时SOD 的含量分别提高了20.81%、27.27%。上述结果说明美藤果油能够改善Aβ25-35 所致的SH-SY5Y氧化应激损伤。
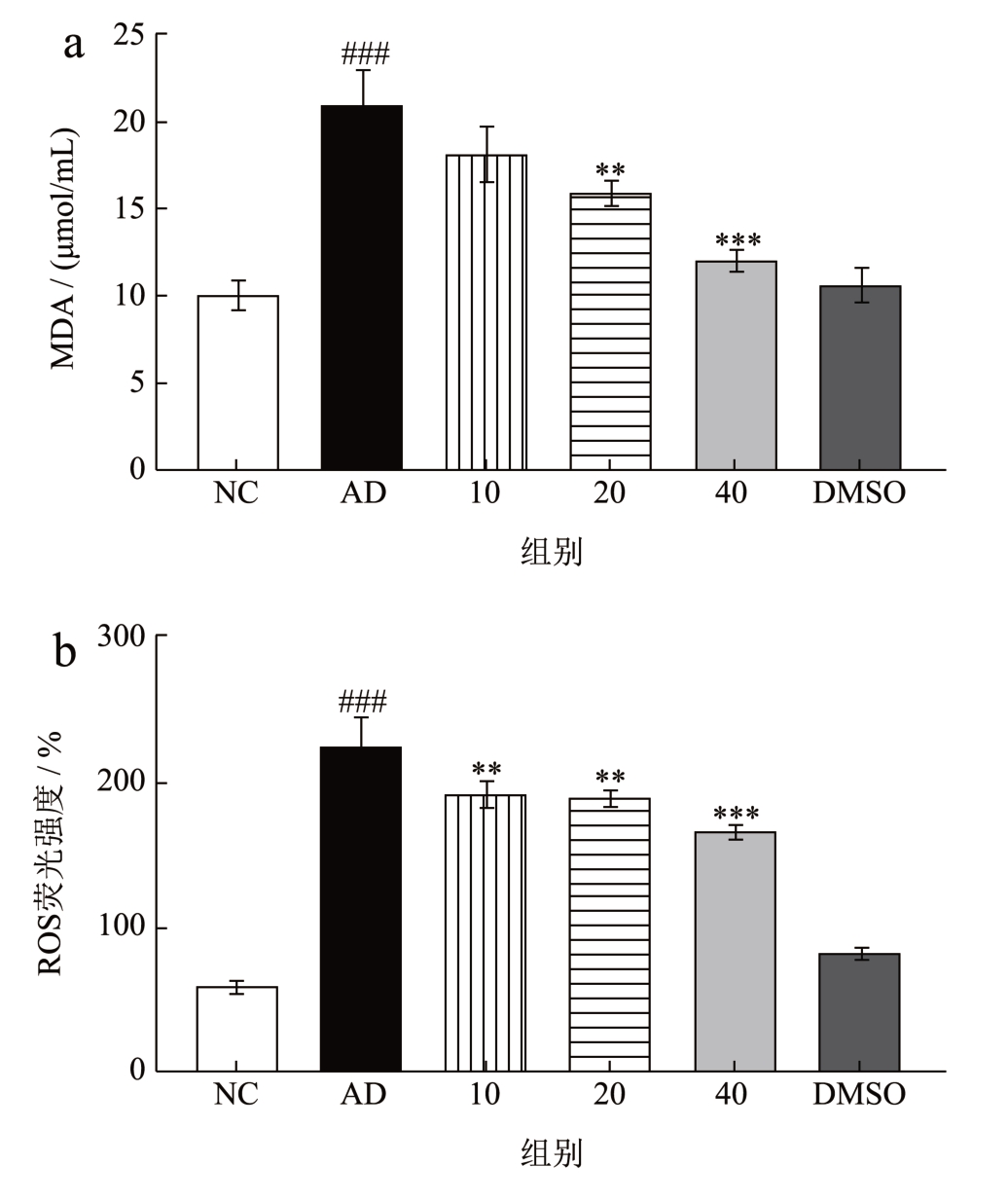

图3 不同质量浓度美藤果油对SH-SY5Y 细胞氧化应激的影响
Fig.3 Effect of different concentrations of Sacha inchi oil on oxidative stress in SH-SY5Y cells
2.3 美藤果油改善SH-SY5Y细胞凋亡
经美藤果油处理后,采用Annexin V-FITC/PI法以及JC-1 线粒体膜电位水平检测共同反映细胞凋亡情况。JC-1 荧光探针能够反映线粒体膜电位水平,当线粒体膜电位较高时,JC-1 进入线粒体基质形成JC-1 聚合物,而线粒体膜电位降低时则形成JC-1 单体,通过JC-1 聚合物与JC-1 单体含量来说明线粒体的去极化作用。各组线粒体膜电位水平如图4 所示,AD 组的线粒体膜电位下降,JC-1 聚合物水平下降,JC-1 单体水平上升。经过美藤果油治疗后,线粒体膜电位显著回升,提高了JC-1 聚合物水平,下调JC-1 单体水平,并呈现一定的剂量关系,这与细胞凋亡荧光强度(图5)结果相一致。结果显示,美藤果油能够通过回调线粒体膜电位来改善细胞凋亡。
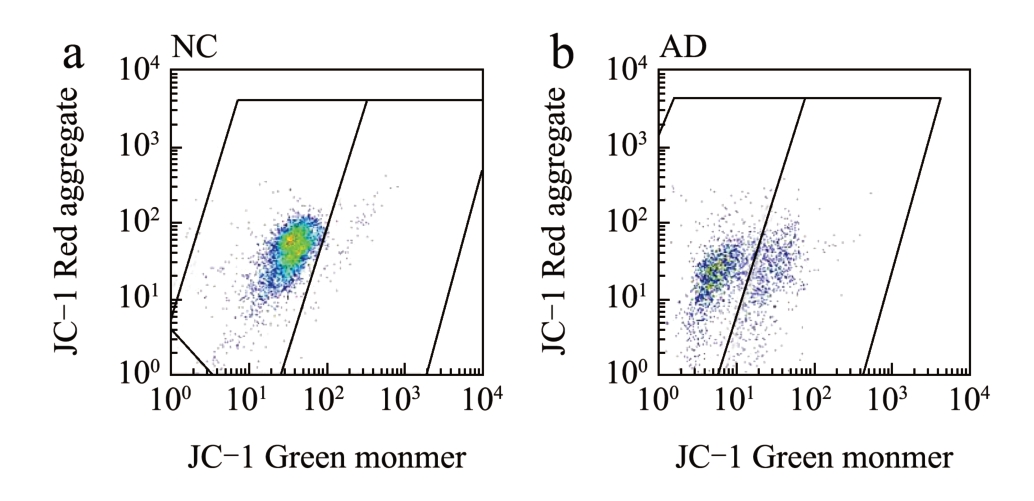
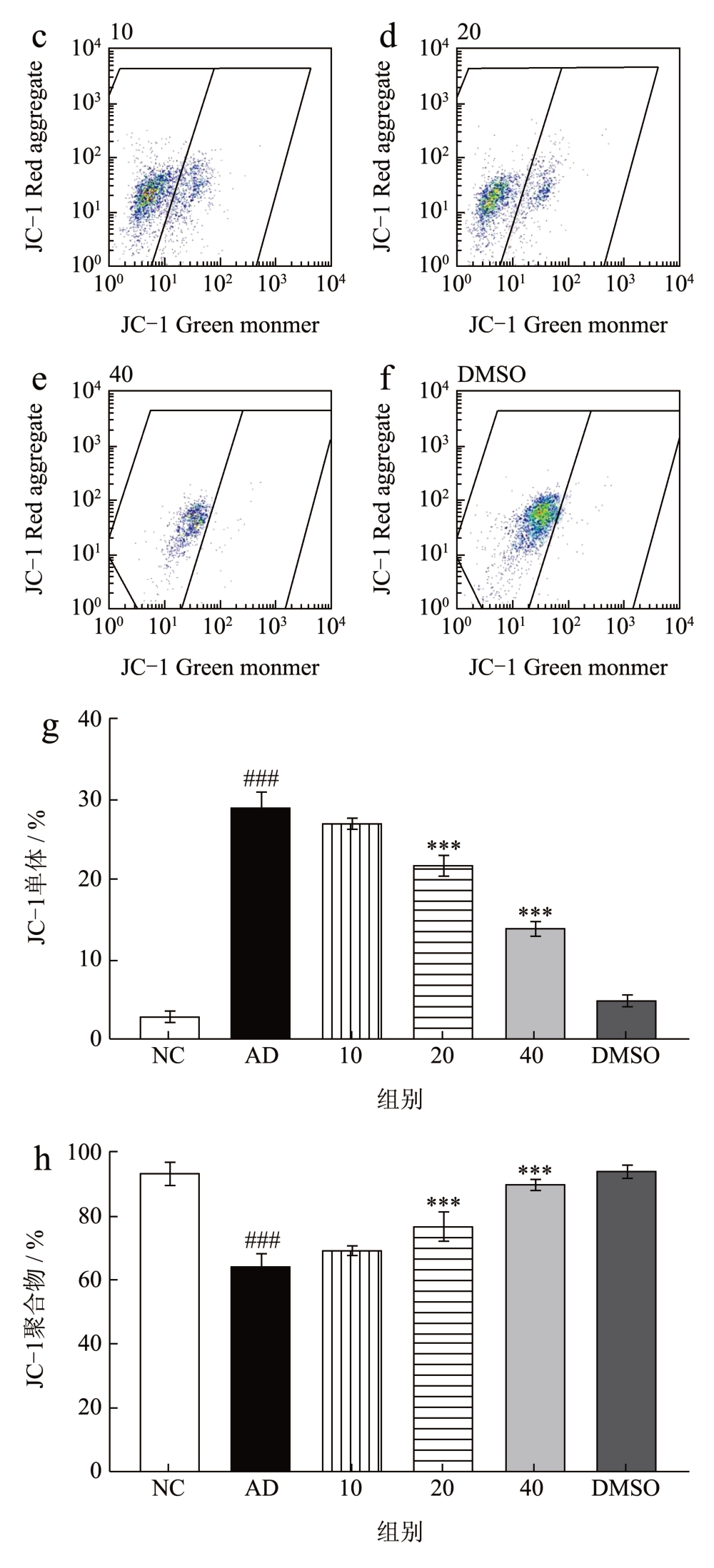
图4 不同质量浓度美藤果油对Aβ25-35 诱导损伤SH-SY5Y细胞膜电位水平的影响
Fig.4 Effect of different concentrations of Sacha inchi oil on Aβ25-35-induced damage to SH-SY5Y cell membrane potential levels
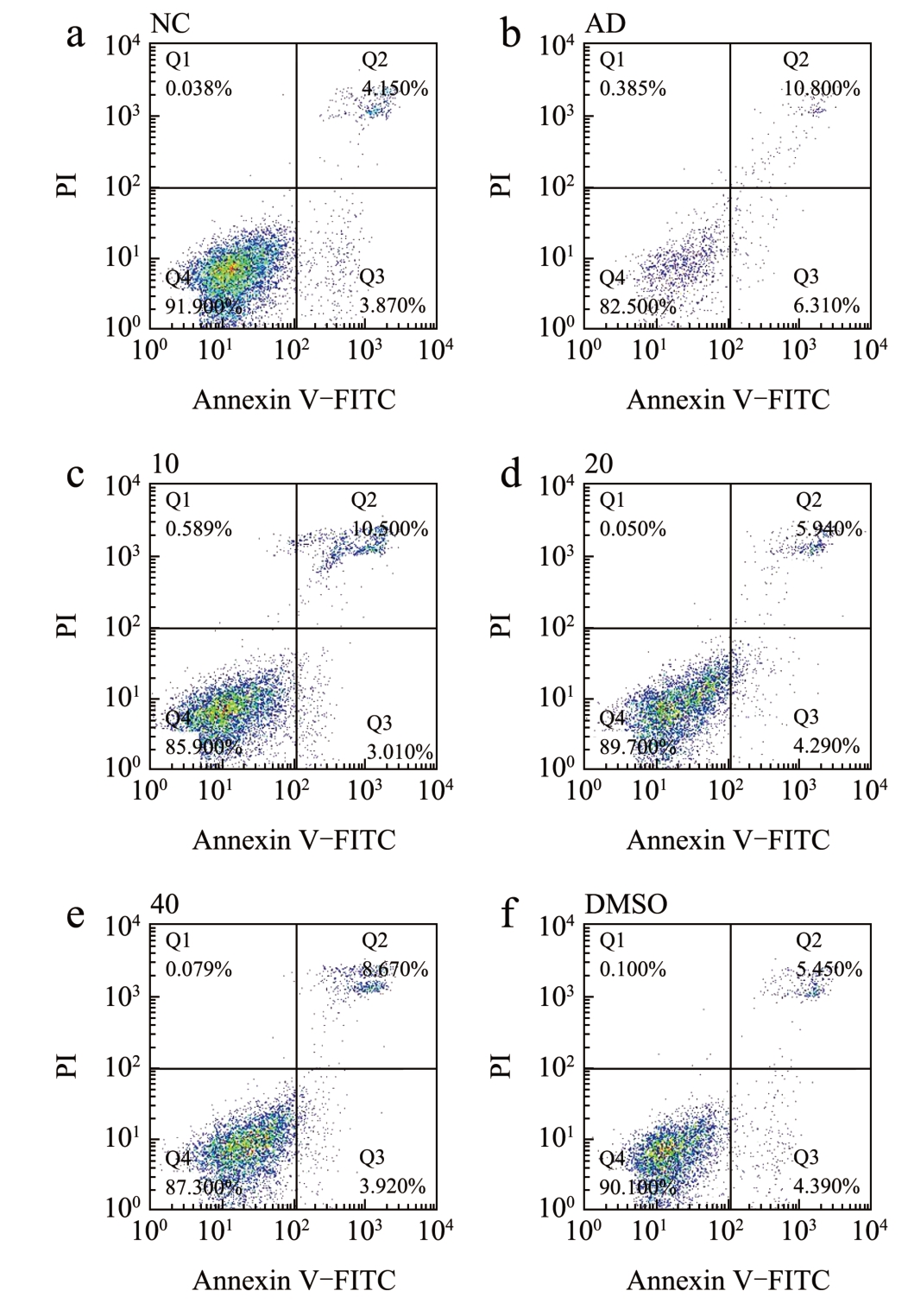
图5 不同质量浓度美藤果油对Aβ25-35 诱导损伤SH-SY5Y细胞凋亡的影响
Fig.5 Effect of different concentrations of Sacha inchi oil on Aβ25-35-induced apoptosis in damaged SH-SY5Y cells
2.4 美藤果油改善SH-SY5Y细胞氧化应激与凋亡蛋白表达水平
各剂量组细胞凋亡蛋白表达水平如图6 所示。经过25 μg/L Aβ25-35 诱导后,细胞内Bax 蛋白表达显著上升,Nrf-2、HO-1、Bcl-2 蛋白表达显著下降,这表明细胞氧化应激损伤严重,凋亡蛋白大量表达。在经过20、40 μg/mL 美藤果油剂量组预处理后,下调了Bax 蛋白表达,并显著提高了Nrf-2、HO-1、Bcl-2 蛋白表达。这些结果说明,美藤果油通过调节Nrf-2/HO-1 抗氧化通路,改善氧化应激损伤,并调节凋亡相关蛋白表达来保护细胞。

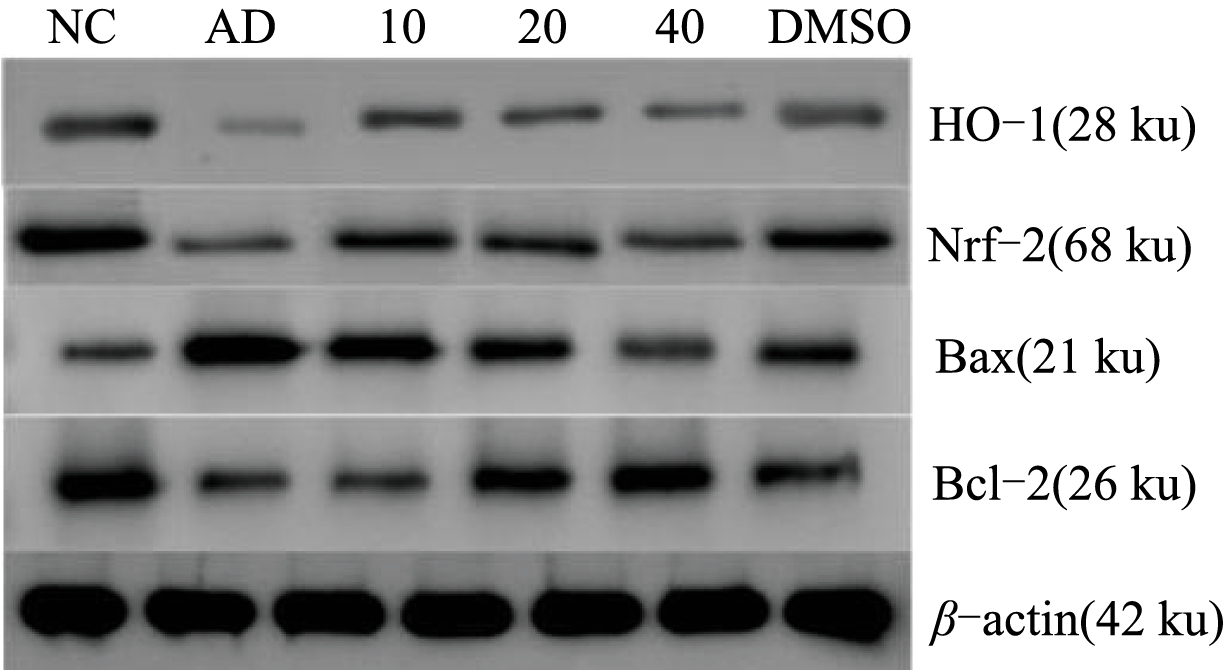
图6 不同质量浓度美藤果油对Aβ25-35 诱导损伤SH-SY5Y细胞氧化应激与凋亡蛋白表达的影响
Fig.6 Effect of different concentrations of Sacha inchi oil on the expression of oxidative stress and apoptotic protein in SH-SY5Y cells induced by Aβ25-35 damage
3 讨论
阿尔兹海默症已经成为全球最严峻的公共健康威胁之一,在用药上仍然缺乏特效药进行针对治疗。目前,临床上常用盐酸多奈哌齐片结合中草药复方来改善AD 患者的乙酰胆碱浓度水平 [15,16],但由于AD 高发、致死且无法逆转的特性,这些治疗方案仅对早期AD 患者改善相应的临床症状有一定的疗效。因此,从预防的角度来减缓AD 发病的几率可能是重要的治疗方向。本研究通过证明美藤果油能够缓解氧化应激损伤来改善Aβ25-35 诱导的AD 细胞模型SH-SY5Y,其机制可能是通过提高Nrf-2/HO-1抗氧化通路、下调凋亡相关蛋白表达逆转细胞凋亡,从而改善AD 症状。
大量研究表明,神经元的损伤与氧化应激有着密切联系,自由基通过能够诱导Aβ 的沉积并进一步促进自由基的生成,加速AD 的发病病程 [17]。牛冬冬等 [18] 研究发现少突胶质样细胞条件培养液能通过调节Sirt1/PGC-1α 通路来改善氧化应激,并显著提高SH-SY5Y 细胞活力,降低氧化应激水平并提高线粒体膜电位。本研究分析了美藤果油对Aβ25-35诱导损伤的SH-SY5Y 细胞的保护作用与抗氧化活性的关系。结果表明,采用25 μg/L 的Aβ25-35 处理SH-SY5Y 细胞24 h 后,细胞内MDA 含量水平提高,ROS 荧光强度上升,SOD 酶活力水平降低,而经过美藤果油预处理后,显著降低了细胞内MDA 和ROS 含量水平,并提高了SOD 酶活力水平,这些结果说明美藤果油能够缓解Aβ25-35 诱导的SH-SY5Y细胞氧化应激损伤。
线粒体膜电位下降是细胞凋亡的早期症状之一 [19]。线粒体作为细胞能量的主要供应场所,线粒体膜电位不仅关系到ATP 合成,而且在清除失活线粒体、维持其余线粒体活力方面起着重要作用 [20]。凋亡相关蛋白Bcl 家族与氧化还原调节因子Nrf-2通路已被证明同线粒体膜通透性密切相关 [21,22],当细胞受到刺激时,Bcl 家族蛋白结构被破坏,并大量分泌促凋亡蛋白Bax 聚集到线粒体膜上,导致线粒体膜通透性转换孔通道过度开放引起氧化应激损伤,使得Nrf-2/HO-1 通路促分泌抗氧化因子的水平下降,进一步导致细胞氧化应激损伤并最终诱导细胞凋亡。本研究结果显示,AD 组细胞中的线粒体膜电位显著下降,促凋亡蛋白Bax 表达上升,抗凋亡蛋白Bcl-2、抗氧化信号通路Nrf-2/HO-1表达下降,这与Jo 等 [23] 的研究结果相同。在给予美藤果油治疗后,各剂量组的线粒体膜电位显著上调,下调了促凋亡蛋白Bax 表达,并提高了抗凋亡蛋白Bcl-2、抗氧化信号通路Nrf-2/HO-1 的表达。这些结果说明美藤果油可能通过调节Bcl 家族蛋白表达,提高抗氧化信号通路Nrf-2/HO-1 改善细胞凋亡,达到预防AD 的目的。
近年来,膳食调节改善大脑健康已成为研究的热点,诸如地中海饮食等膳食模式已经证明对AD能够起到一定的改善作用,一项基于人群的大型研究证明了地中海饮食对大脑的长期益处,其中的重要原因则体现在所摄入的坚果、鱼类等食物中富含的PUFAs [24,25]。美藤果油作为一种优质的食用油原料,具有成熟周期短、单位面积产量高等优点 [26],这使得美藤果油具有极大的开发潜力,在日常饮食中有更好的推广性。因此通过开发美藤果油,能够进一步拓展目前食用油市场,在保健食品和医药领域具有良好的应用和发展前景。
4 结论
本研究通过Aβ25-35 诱导的AD 细胞模型,加入不同浓度的美藤果油来观察其对AD 细胞模型损伤的缓解作用,通过CCK-8 实验可知各剂量组美藤果油不会抑制细胞增殖,并采用25 μg/L 的质量浓度构建AD 细胞模型。通过对比AD 组,美藤果油各剂量组有效改善了细胞氧化应激损伤,并通过研究细胞凋亡情况、线粒体膜电位,发现美藤果油能够逆转AD细胞凋亡,这与改善凋亡相关蛋白表达情况相一致。本研究为美藤果油改善AD 提供了可行性,后续结合改善氧化应激与凋亡这一研究方向,能够通过体内实验进一步深入研究美藤果油改善AD 的机制,为发掘美藤果油产品功效开发提供理论基础。
[1] JAHN H.Memory loss in Alzheimer,s disease [J] .Dialogues in Clinical Neuroscience,2022,15(4):445-454.
[2] HADIPOUR M,MEFTAHI G H,AFARINESH M R,et al.Crocin attenuates the granular cells damages on the dentate gyrus and pyramidal neurons in the CA3 regions of the hippocampus and frontal cortex in the rat model of Alzheimer,s disease [J] .Journal of Chemical Neuroanatomy,2021,113:101837.
[3] BROSE R D,LEHRMANN E,ZHANG Y,et al.Hydroxyurea attenuates oxidative,metabolic,and excitotoxic stress in rat hippocampal neurons and improves spatial memory in a mouse model of Alzheimer,s disease [J] .Neurobiology of Aging,2018,72:121-133.
[4] STRANAHAN A M,MATTSON M P.Recruiting adaptive cellular stress responses for successful brain ageing [J] .Nature Reviews Neuroscience,2012,13(3):209-216.
[5] CADONIC C,SABBIR M G,ALBENSI B C.Mechanisms of mitochondrial dysfunction in Alzheimer,s Disease [J] .Molecular Neurobiology,2016,53(9):6078-6090.
[6] BELL S M,BARNES K,MARCO M D,et al.Mitochondrial dysfunction in Alzheimer,s Disease:abiomarker of the future? [J] .Biomedicines,2021,9(1):63.
[7] CUNNANE S C,TRUSHINA E,MORLAND C,et al.Brain energy rescue:an emerging therapeutic concept for neurodegenerative disorders of ageing [J] .Nature Reviews Neuroscience,2020,19(9):609-633.
[8] CANHADA S,CASTRO K,PERRY I S,et al.Omega-3 fatty acids,supplementation in Alzheimer,s disease:a systematic review [J] .Nutritional Neuroscience,2018,21(8):529-538.
[9] STAVRINOU P S,ANDREOU E,APHAMIS G,et al.The effects of a 6-month high dose omega-3 and omega-6 polyunsaturated fatty acids and antioxidant vitamins supplementation on cognitive function and functional capacity in older adults with mild cognitive impairment [J] .Nutrients,2020,12(2):325.
[10] PARK Y H,SHIN S J,KIM H S,et al.Omega-3 fatty acidtype docosahexaenoic acid protects against Aβ-mediated mitochondrial deficits and pathomechanisms in Alzheimer,s Disease-related animal model [J] .International Journal of Molecular Sciences,2020,21(11):3879.
[11] 谢蓝华,杨勇福,陈佳,等.美藤果油的营养特性及生理功能研究进展 [J] .中国油脂,2021,46(2):82-85.
[12] 陆智.美藤果油多不饱和甘油三酯的解析及其微乳制备研究 [D] .广州:华南农业大学,2020.
[13] LI P,HUANG J,XIAO N,et al.Sacha inchi oil alleviates gut microbiota dysbiosis and improves hepatic lipid dysmetabolism in high-fat diet-fed rats [J] .Food &Function,2020,11(7):5827-5841.
[14] 肖遥.解毒益智方对Aβ25-35致SHSY5Y细胞损伤的神经保护作用研究 [D] .长春:长春中医药大学,2021.
[15] 吕馨,蒋蒙蒙,朱梦姚,等.人参养荣汤改善阿尔兹海默症小鼠学习记忆损伤的作用 [J] .中成药,2022,44(12):3823-3829.
[16] 杨青.黄连解毒汤联合盐酸多奈哌齐治疗阿尔茨海默病(心肝火旺型)的临床疗效观察 [D] .武汉:湖北中医药大学,2020.
[17] PANZA F,LOZUPONE M,BELLOMO A,et al.Do anti-amyloid-β drugs affect neuropsychiatric status in Alzheimer,s Disease patients? [J] .Ageing Research Reviews,2019,55:100948.
[18] 牛冬冬,凌亚亭,吕孝瑞,等.少突胶质样细胞条件培养液通过调节Sirt1/PGC-1α通路改善SH-SY5Y细胞氧化应激损伤 [J] .江苏大学学报(医学版),2023,33(5):412-419.
[19] ZOROVA L D,POPKOV V A,PLOTNIKOV E Y,et al.Mitochondrial membrane potential [J] .Analytical Biochemistry,2018,552:50-59.
[20] CONNOLLY N M C,THEUREY P,ADAM-VIZI V,et al.Guidelines on experimental methods to assess mitochondrial dysfunction in cellular models of neurodegenerative diseases [J] .Cell Death and Differentiation,2018,25(3):542-572.
[21] DINKOVA-KOSTOVA A T,ABRAMOV A Y.The emerging role of Nrf2 in mitochondrial function [J] .Free Radical Biology and Medicine,2015,88:179-188.
[22] ISLAM M T.Oxidative stress and mitochondrial dysfunctionlinked neurodegenerative disorders [J] .Neurological Research (New York),2017,39(1):73-82.
[23] JO C,GUNDEMIR S,PRITCHARD S,et al.Nrf2 reduces levels of phosphorylated tau protein by inducing autophagy adaptor protein NDP52 [J] .Nature Communications,2014,5(1):3496.
[24] PETERSSON S D,PHILIPPOU E.Mediterranean diet,cognitive function,and dementia:asystematic review of the evidence [J] .Advances in Nutrition,2016,7(5):889-904.
[25] 李嘉毓,张媛媛,郭琪,等.阿尔茨海默病的地中海饮食模式干预进展 [J] .现代临床护理,2021,20(7):76-81.
[26] 司茹,郑梦思,邹莉波.美藤果油辅助改善小鼠记忆的功效 [J] .食品科学,2017,38(9):202-206.