亚洲人主要以稻米为主食,其中淀粉是其含量最高的营养成分。淀粉可分为直链淀粉和支链淀粉。在人体内,淀粉酶和葡萄糖苷酶会将食物中的淀粉分解为葡萄糖,α-淀粉酶则是影响淀粉利用的关键消化酶,它可以水解淀粉内部的α-1,4-糖苷键产生糊精、低聚糖和葡萄糖,为人体提供能量 [1] 。当淀粉被消化后,血糖会快速上升,这种情况会对糖尿病患者的身体产生负面影响。因此,通过抑制α-淀粉酶活性可以有效降低淀粉消化率和葡萄糖的生物利用度,从而预防糖尿病等慢性疾病的发生 [2] 。
多酚是广泛存在于植物中的一类次生代谢产物,已被证实对人体有潜在的健康益处。其中,多酚具有重要的抗氧化活性,在维持机体正常生理功能方面起着非常重要作用。根据现代流行病学调查表明长期食用富含酚类化合物的食品可有效降低患糖尿病、肥胖症、心血管疾病以及癌症等慢性疾病的发病率 [3] 。糙米的糠肤层含有游离态和结合态阿魏酸(Ferulic Acid,FA)、没食子酸(Gallic Acid,GA)、咖啡酸等多酚类物质。已有文献报道,植物基食品原料中的多酚能有效抑制α-淀粉酶 [4],其抑制作用与其分子结构密切相关 [5] 。柴艳伟 [6] 通过研究茶多酚对α-淀粉酶的抑制,发现茶多酚能够通过非竞争性抑制α-淀粉酶的催化活性。此外,不同浓度的酚对消化的影响不同,低浓度的茶多酚对消化起到抑制作用,高浓度的茶多酚反而起到促进作用。Meng 等 [7] 研究槲皮素、杨梅素和木樨草素的酶动力学,发现3 种多酚均为α-葡萄糖苷酶的非竞争性抑制剂和α-淀粉酶的竞争性抑制剂。Andrea 等 [8] 的研究表明,原儿茶酸与淀粉的复合作用显著降低了淀粉的水解率,表明原儿茶酸对α-淀粉酶的抑制作用较强。阿魏酸和没食子酸是稻米中的多酚单体。阿魏酸被认为是一种潜在的预防结肠癌的有效成分,但其游离形式并未成功地进入肠肝循环发挥功效 [9] 。淀粉被视为一种优秀的多酚输送载体,能与多酚形成有效的递送系统,从而保持多酚的化学稳定性,提高多酚的生物利用度 [10] 。淀粉中添加植物多酚可降低人体对淀粉的吸收。Bello-Perez 等 [11] 发现阿魏酸可提高马铃薯淀粉中抗性淀粉(Resistant Starch,RS)和快消化淀粉(Ready Digestible Starch,RDS)的含量,并对某些疾病患者进行营养干预的同时可以降低血糖生成指数 [12] 。多酚类物质与马铃薯淀粉的相互作用可以降低其消化吸收速率,Deshpande等 [13] 发现马铃薯淀粉能与单宁或儿茶素形成复合物,可使马铃薯淀粉的消化受到抑制。影响马铃薯淀粉消化性最关键的两种酶是α-葡萄糖苷酶和α-淀粉酶。目前,关于淀粉-多酚之间相互作用的研究主要集中在淀粉的结构及消化特性方面,而关于复合物在不同条件下多酚的释放特性研究鲜有报道。
本文比较研究了阿魏酸和没食子酸两种多酚与大米淀粉形成复合物后,多酚对α-淀粉酶和葡萄糖苷酶的活力的影响,并深入分析了不同条件下多酚淀粉复合物中阿魏酸与没食子酸的释放特性。研究结果对多酚用于淀粉基功能食品的开发中具有指导作用。
1 材料与方法
1.1 材料与试剂
大米淀粉是分析纯,购买自美国Sigma 公司;阿魏酸和没食子酸均为分析纯,购买自上海源叶生物有限公司。猪胰α-淀粉酶、淀粉葡萄糖苷酶、福林酚、胃蛋白酶、胰酶和猪胆汁购买自美国Sigma公司;氢氧化钠、盐酸、醋酸、醋酸钠、酒石酸钠、碳酸氢钠、一水柠檬酸、二水柠檬酸钠和氯化钠购买自天津市大茂化学试剂厂;葡萄糖、3,5-二硝基水杨酸、苯酚、亚硫酸钠购买自广州齐云生物技术有限公司。
1.2 仪器与设备
GL224I 电子分析天平购买自塞多利斯科学仪器(北京)有限公司;DF-101 集热式恒温水浴锅购买自巩义市予华仪器有限责任公司;PCE-E3000 恒温水浴振荡器购买自苏州威尔实验用品有限公司;UV-1800 紫外可见分光光度计购买自日本岛津有限公司;D-37520 离心机购买自美国Thermo 公司。
1.3 实验方法
1.3.1 大米淀粉-多酚复合物在α-淀粉酶作用下的酶解率
称取样品50 mg(干基)大米淀粉(Rice Starch,RS)于离心管中,向离心管中分别添加5%、10%、15%、20%(m/m 淀粉干基)多酚并加入1 mL乙酸钠缓冲溶液中(5.0 mmol/L 氯化钙,pH 值6.9)和6 颗玻璃珠(4 mm),将混合糊液置于37 ℃ 120 r/min恒温震荡水浴20 min,加入1 mL 的被6 U/mL,pH值6.8 的醋酸钠缓冲溶液溶解后的α-淀粉酶,混匀后计时,在反应期间的各个时间段分别取出离心管(0、30、60、90、120、150、180 min),沸水浴10 min 后终止反应,置于冰上冷却,再吸取1 mL 稀释至一定浓度的混合液,测定葡萄糖含量(DNS 法)和按照公式计算淀粉的酶解率(A%),根据酶解率与反应时间的关系绘制变化曲线。
式中:
A——酶解率,%;
C——葡萄糖质量浓度,mg/mL;
V——反应体系中液体的体积,mL;
n——稀释倍数;
M——干淀粉的量,mg;
0.9——换算系数。
1.3.2 大米淀粉-多酚复合物在淀粉葡萄糖苷酶作用下的酶解率
称取样品50 mg(干基)大米淀粉(RS)于离心管中,向离心管中分别添加5%、10%、15%、20%(m/m 淀粉干基)多酚并加入1 mL 乙酸钠缓冲溶液中(pH 值4.6)和6 颗玻璃珠(4 mm),在37 ℃,120 r/min 中水浴20 min,震荡混匀,添加1 mL 的被4 U/mL(pH 值4.6)的醋酸钠缓冲溶液溶解后的淀粉葡萄糖苷酶,混匀后计时,在反应期间的各个时间段分别取出离心管(0、30、60、90、120、150、180 min),沸水浴10 min 后终止反应,置于冰上冷却,再吸取1 mL 稀释至一定浓度的混合液,测定葡萄糖含量(DNS 法)和按照公式计算淀粉的酶解率(A%),根据酶解率与反应时间的关系绘制变化曲线。
1.3.3 大米淀粉-多酚复合物的消化特性
根据Englyst 等 [14] 的方法作适当改进来测定淀粉消化率。称取样品50 mg(干基)大米淀粉(RS)于离心管中,向离心管中分别添加5%、10%、15%、20%(m/m 淀粉干基)多酚并加入2 mL 乙酸钠缓冲溶液中(5.0 mmol/L 氯化钙,pH 值5.2)和6 颗玻璃珠(4 mm)。将混合糊液置于37 ℃,120 r/min 下恒温震荡水浴20 min,加入1 mL 30 U/mL 的淀粉糖苷酶和120 U/mL 的α-淀粉酶的复合酶液,涡旋混匀,计时。在37 ℃、120 r/min 恒温震荡水浴2 h,在反应期间的某个时间段分别取样(20、120 min),于100 ℃水浴中5 min 使酶失活,取出冷却后测定葡萄糖含量(DNS 法),按下列公式分别计算快速消化淀粉(Ready Digestible Starch,RDS)、缓慢消化的淀粉(Slowly Digestible Starch,SDS)和抗性淀粉(Resistant Starch,RS)的含量:
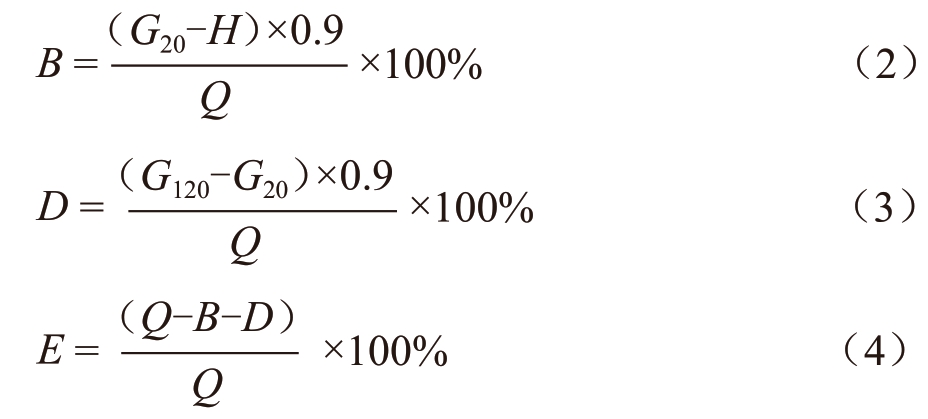
式中:
B——快速消化淀粉(RDS)含量,%;
D——缓慢消化淀粉(SDS)含量,%;
E——抗性淀粉(RS)含量,%;
G20——酶水解20 min 后上清液中葡萄糖的含量,mg;
H——酶处理之前淀粉中游离葡萄糖含量,mg;
G120——酶解120 min 后上清液中葡萄糖含量,mg;
Q——样品中总淀粉含量,mg。
1.3.4 大米淀粉-多酚复合物在不同温度和pH值条件下的释放量
对于不同温度下的释放量测定,称取样品20 mg(干基)大米淀粉(RS)于离心管中,向离心管中分别添加5%、10%、15%、20%(m/m 淀粉干基)多酚并加入2 mL 蒸馏水,涡旋混匀,分别在30、50 和80 ℃震荡水浴保温2 h。
对于不同pH 值条件下的释放量测定,将配制好的多酚淀粉复合物(样品量同上)分别用不同pH 值(2、4、6、8)的柠檬酸盐缓冲液溶解,并将混合糊液置于30 ℃,20 r/min 的水浴锅中震荡水浴120 min。然后将每个样品离心15 min(3 000 r/min),收集上清液,再将各个pH 值条件下处理的多酚复合物稀释至相同浓度,最后测定上清液中多酚的含量(福林酚法)。
1.3.5 大米淀粉-多酚复合物在模拟胃肠液条件下的释放量
参照彭善丽 [15] 的方法并略作修改,预测不同时间段食物中淀粉水解的速率。在模拟体外淀粉消化过程中,称取样品60 mg(干基)大米淀粉(RS)于离心管中,向离心管中分别添加5%、10%、15%、20%(m/m 淀粉干基)多酚并溶解于2 mL 蒸馏水配制的生理盐水,并补充至9 mL。吸取1 mL 猪胃蛋白酶液于离心管中,涡旋混匀,加入0.1 mol/L的HCl 溶液调节pH 值2.0 左右,模拟胃部环境将混合糊液置于避光条件下37 ℃的水浴锅中恒温振荡水浴,反应60 min 后,冷却10 min 以终止反应,吸取混合液2 mL 于离心管中,然后离心15 min(3 000 r/min),最后测定上清液中多酚的含量。反应结束后的消化液中加入氢氧化钠溶液(0.1 mol/L)调节pH 值至5.5 左右,再分别加入1.35 mL 的胰酶溶液和胆汁溶液,利用氢氧化钠溶液(0.1 mol/L)将pH 值调至7.2 左右,最后用生理盐水补充至反应体系15 mL。模拟小肠环境将混合液置于避光条件下37 ℃的水浴锅中水浴振荡,120 min 后,冷却10 min 以终止反应,吸取混合液2 mL 于离心管中,然后离心15 min(3 000 r/min),最后测定上清液中多酚的含量。
1.4 实验数据处理与统计分析
实验重复3 次,结果表示为平均值±标准差(Mean±SD),利用Microsoft Excel 2019 软件进行数据统计和IBM SPSS Statistics 27.0 软件进行统计分析并应用Origin 9.0 软件作图。
2 结果与分析
2.1 大米淀粉-多酚复合物在α-淀粉酶作用下的酶解率
图1 显示的是α-淀粉酶水解淀粉复合物中阿魏酸和没食子酸的过程中的酶解率情况。由图可知,从淀粉的酶解率可以看出淀粉在前30 min 内的水解率迅速上升,期间释放大量的还原糖分子。30 min 以后酶解速率缓慢上升,在1.5 h 以后趋于平缓,刘欣等 [16] 也有类似的报道,发现随着茶多酚的添加量越多,包含黑豆,黑米,黑芝麻等的黑色谷物冲调粉的淀粉水解率越低。在前半个小时内,淀粉水解增长速度最快,时间越长,淀粉水解率的增长速度趋于平缓。多酚-淀粉复合物的形成能对淀粉的水解率产生显著性影响。其中,阿魏酸和没食子酸都降低了淀粉的水解率,随着多酚添加量的增加淀粉水解率显著下降,当淀粉在前30 min 水解时,添加量为5%的阿魏酸和没食子酸分别将淀粉的酶解率从48.75%升至49.13%和51.73%,而添加量为20%的阿魏酸和没食子酸分别将淀粉的酶解率从48.75%降至43.68%和44.49%。与原淀粉相比,多酚与淀粉形成复合物后,淀粉的酶解率随着多酚添加量的增加而显著降低。
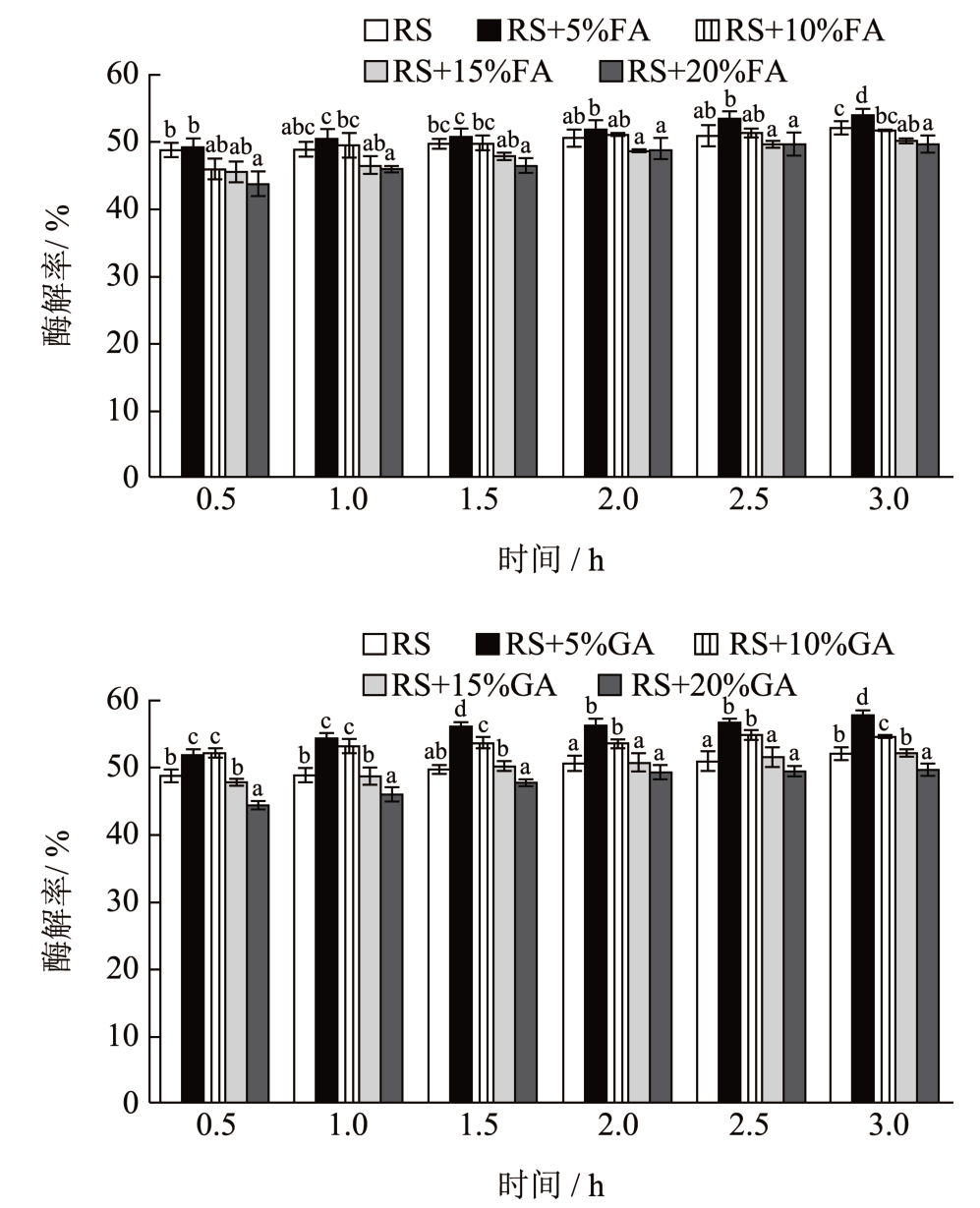
图1 大米淀粉-多酚复合物在α-淀粉酶作用下的水解情况
Fig.1 Enzymatic hydrolysis of rice starch-polyphenol complexes under the α-amylase
注:RS:大米淀粉;FA:阿魏酸;GA:没食子酸。同列中不同字母表示有显著差异(P<0.05)。下图同。
淀粉酶的活力是影响淀粉消化快慢的重要因素。有研究表明:适量的添加阿魏酸对于能够有效抑制α-淀粉酶的活力 [17],可以用作碳水化合物消化的抑制剂 [16] 。实验结果表明,多酚与淀粉形成混合物后导致淀粉的酶解率下降,推断是体系内游离的植物多酚与淀粉消化酶结合,并占据酶的活性位点,从而抑制α-淀粉酶的活性,最终导致酶解效率的降低。
2.2 淀粉葡糖苷酶对大米淀粉-多酚复合物的酶促作用
图2 显示的是淀粉葡糖苷酶水解淀粉复合物中阿魏酸和没食子酸的过程中的酶解率情况。由图2 可知,当淀粉的水解时间在0.5~3.0 h 范围内时,原粉的水解率分别为15.52%、27.05%、38.96%、47.63%、53.88%和59.04%,这意味着淀粉的水解率随着水解时间的不断延长而显著升高。可能与淀粉葡糖苷酶的酶解方式有关,因其糖化酶是从淀粉分子的非还原端切开α-1,4-糖苷键 [16],所以该酶水解产生的葡萄糖量随着时间的增加也逐渐增大。

图2 大米淀粉 -多酚复合物在淀粉糖苷酶作用下的水解情况
Fig.2 Enzymatic hydrolysis of rice starch-polyphenol complexes under the amyloglucosidase
大米淀粉-多酚复合物的酶解趋势也趋于一致,但又有所不同。其中,阿魏酸和没食子酸与淀粉形成复合物后,其酶解率都随着多酚添加量的增加而显著下降。对于阿魏酸,在淀粉水解的前1 h 内,阿魏酸淀粉复合物的水解率几乎未有变化。其原因可能是淀粉被淀粉葡糖苷酶水解从而释放出阿魏酸,而阿魏酸可能抑制淀粉葡萄糖苷酶,导致水解率降低。对于没食子酸,在淀粉水解2.5 h 前,没食子酸淀粉复合物的酶解率是比原淀粉要高的。当没食子酸的添加量为5%时,在淀粉水解的3 h 内得各个时间段,酶解率是最高的,其分别是20.15%、34.09%、46.37%、55.17%、61.39% 和65.72%。当淀粉水解3 h 时,与原淀粉相比,添加量为5%和10%的没食子酸淀粉复合物,其酶解率分别增加了6.68%和1.61%;而15%和20%的没食子酸淀粉复合物,其酶解率分别降低了0.5%和1.91%。可以推断,低浓度的大米淀粉-没食子酸复合物的酶解率显著提高,这可能是由于淀粉与没食子酸复合后形成了一种相对疏松的结构,导致酶解反应的提高。高浓度的大米淀粉-没食子酸复合物使酶解率降低,可能是释放出的没食子酸的浓度升高,抑制了淀粉葡萄糖苷酶的活性,降低了酶解率。张海凤等有研究表明 [18],没食子酸对α-葡萄糖苷酶有抑制作用,抑制葡萄糖的吸收,降低血糖指数。
2.3 大米淀粉-多酚复合物的消化特性
图3 显示的是模拟淀粉在人体胃肠道内环境的条件下,α-淀粉酶和淀粉葡萄糖苷酶水解淀粉复合物中阿魏酸和没食子酸的消化速率以及消化行为的情况。由图可知,大米淀粉-多酚复合物中的多酚含量均可以对RDS 含量、SDS 和RS 含量产生显著的影响,但影响效果有所不同。其中,阿魏酸或没食子酸的加入都降低了RDS 的含量,随着多酚添加量的增加RDS 的含量显著下降,其中,没食子酸对RDS 的影响较大,当添加量从5%~20%时,将RDS 的含量从80.76%降至64.62%。而阿魏酸对RDS 含量则是从73.06%降至69.24%,降低量略小。对于多酚的添加量对于SDS 含量和RS 含量的影响,其中没食子酸的SDS 含量从5.72%增至21.91%,RS 含量从2.67%增至11.84%,慢消化淀粉和抗性淀粉呈现显著增加的趋势;而阿魏酸的SDS 含量从15.69% 降至14.07%,RS 含量从11.26% 增至16.69%,抗性淀粉显著增加。而与原淀粉相比,低浓度的多酚-淀粉复合物使得RDS 的含量降低,可能是加速了快消化淀粉的形成,而随着增大多酚的复合浓度,抗性淀粉含量显著增加。有研究表明,淀粉-多酚包合物的抗性来源于多酚对消化酶的抑制作用和淀粉-多酚包合物中淀粉的单螺旋结构对淀粉酶的抗性 [19] 。
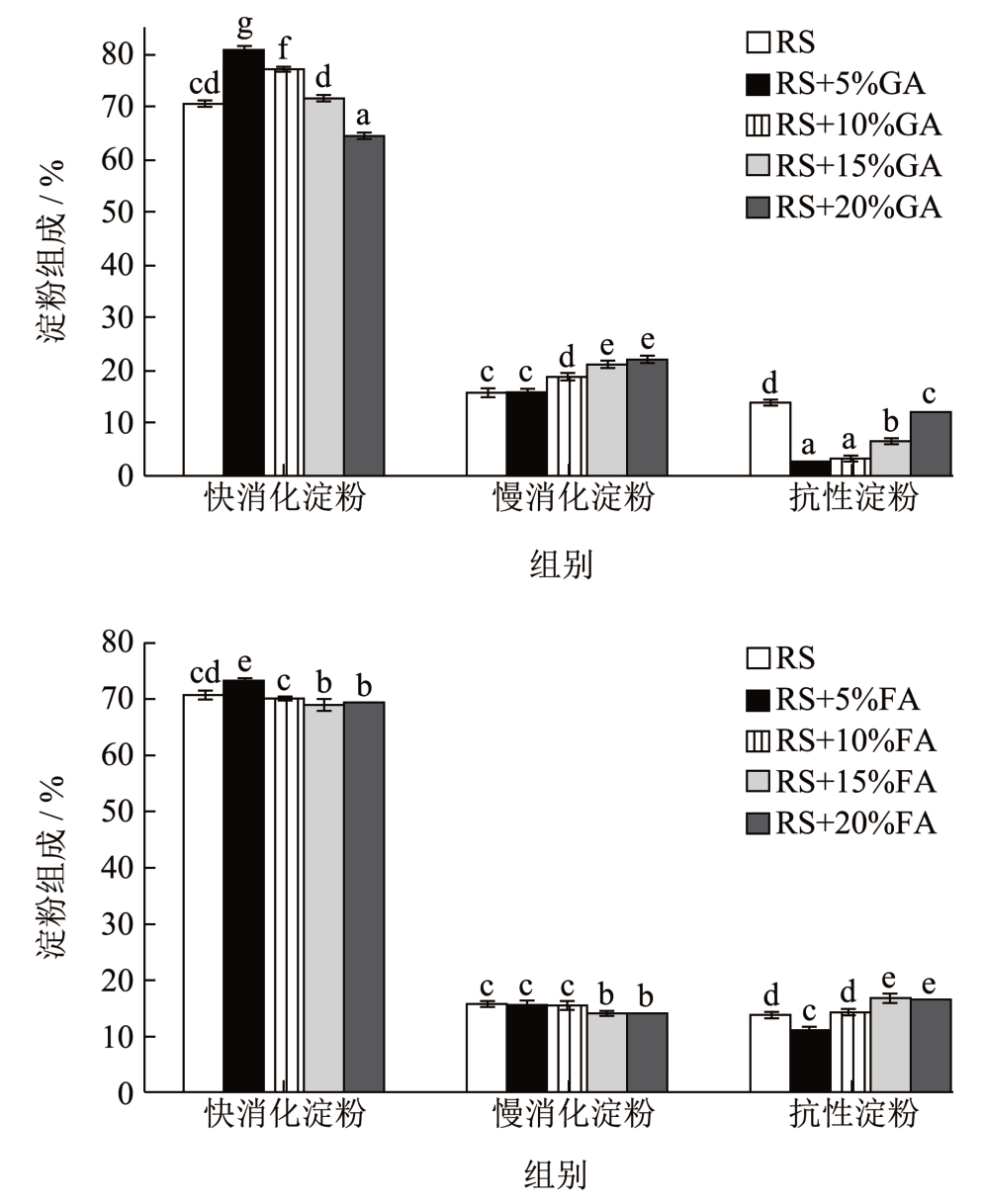
图3 不同多酚添加量的大米淀粉复合物的消化特性
Fig.3 Digestion characteristics of rice starch complexes with different polyphenol content
多酚与淀粉竞争性的结合淀粉酶而占据酶分子的作用位点,并通过非竞争性抑制的方式抑制α-淀粉酶和淀粉葡萄糖苷酶的催化活性,进而显著抑制了大米淀粉的水解 [20] 。阿魏酸和没食子酸通过结合α-淀粉酶和淀粉葡萄糖苷酶占据作用位点,抑制酶活,进而改变了淀粉各部分含量使RS 和SDS 的含量增加,RDS 的含量降低,从整体上降低淀粉的消化速率 [21] 。有研究表明 [22],茶多酚对α-葡萄糖苷酶和α-淀粉酶活性有一定的抑制作用。因此,阿魏酸和没食子酸等功能成分应根据实际需求,用于淀粉基食品体系。
2.4 大米淀粉-多酚复合物在不同温度条件下的释放量
表1 显示的是三种不同温度条件下淀粉复合物中阿魏酸和没食子酸的释放效果。由表可知,多酚-淀粉复合物中阿魏酸和没食子酸的释放量受温度的影响的变化趋势有明显的差异。其中,当处于相同温度时,没食子酸的释放量随着没食子酸的添加量的增加而呈现上升的趋势,同样阿魏酸的释放量也呈现相同的趋势。然而,当处于不同温度时,阿魏酸的释放量受温度的影响较大,相反,低浓度的没食子酸的释放量几乎不受影响,高浓度则呈现上升的趋势。具体而言,添加量为20%的没食子酸在淀粉-没食子酸复合物中,其释放量从30~50 ℃升高了8.62%;30~80℃升高了3.88%。添加量为20%的阿魏酸在淀粉-阿魏酸复合物中,其释放量从30~50 ℃升高了58.1%;30~80℃升高了131.43%。由此可以看出,不同的多酚复合物释放量受温度和多酚浓度的影响不同,对比没食子酸,显然阿魏酸受温度影响较大。以上实验结果说明,阿魏酸随着温度升高,其释放量增加,导致稳定性降低。这与Cohen 等 [23] 发现直链淀粉与染料木黄酮形成复合物后对染料木黄酮的释放速率随温度升高,同时呈现增加趋势的研究结果相符。
表1 大米淀粉-多酚复合物在不同温度条件下的释放量
Table 1 Release of phenolic acid from rice starch-polyphenols complexes atdifferent temperature (mg/g)
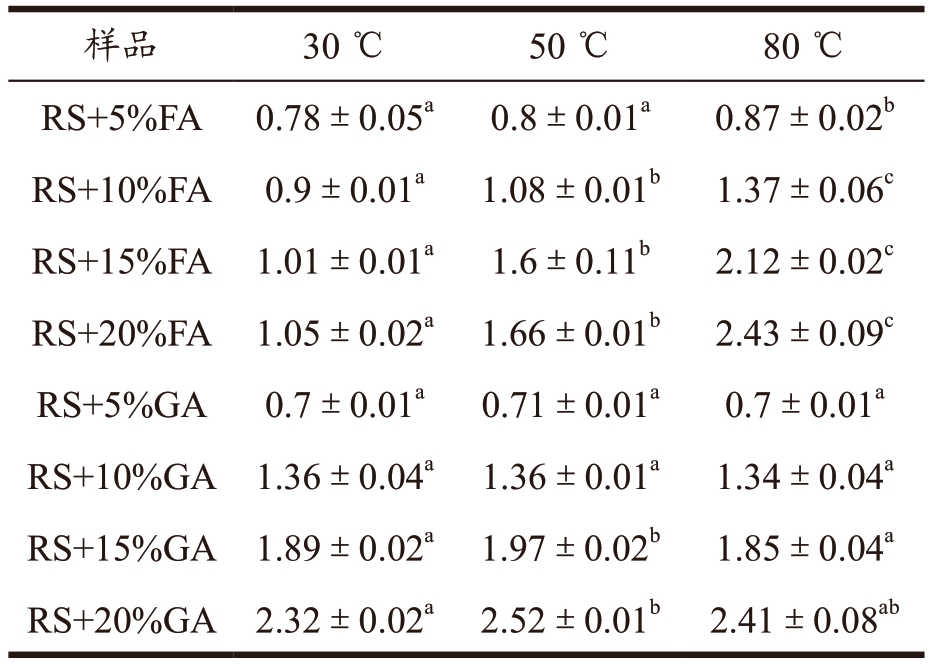
注:RS:大米淀粉;FA:阿魏酸;GA:没食子酸;同列中不同字母表示有显著差异(P<0.05)。下表同。
2.5 大米淀粉-多酚复合物在不同pH条件下的释放量
表2 显示的是不同pH 条件下淀粉复合物中阿魏酸和没食子酸的释放效果。由表可知,pH 对多酚-淀粉复合物中多酚(阿魏酸、没食子酸)的释放量的影响趋势有明显的差异。其中,当处于相同pH 值时,没食子酸的释放量随着没食子酸的添加量的增加而呈现上升的趋势,同样阿魏酸的释放量也呈现相同的趋势。然而,在不同的pH 值和阿魏酸添加量的条件下,淀粉-阿魏酸复合物的释放量分别呈现出显著差异。添加量为15%的阿魏酸,在复合物中其释放量随pH 值的升高呈现先降后升的趋势。根据实验结果,在淀粉-阿魏酸复合物pH 值小于4 的条件下表现出较低的释放量,但其体系相对稳定。随着pH 值的增加,其释放量显著增加。此外,添加量为15%的没食子酸,pH 值由2 增至6 的条件下,其释放量增加了12.43%;而当pH 值继续增至8 时,其释放量而下降了16.95%。
表2 大米淀粉-多酚复合物在pH条件下的释放量
Table 2 Release of phenolic acid from rice starch-polyphenols complexes at different pH (mg/g)

其原因可能是没食子酸在偏酸性条件下比较稳定,而在碱性条件下,结构可能被破坏,导致阿魏酸的释放量下降。由此可以看出,不同的多酚复合物释放量受pH 值和多酚浓度的影响不同,对比阿魏酸,显然没食子酸受pH 值影响较大。以上实验结果说明,低浓度的阿魏酸的释放量随pH 值的增大而呈上升趋势,而高浓度的受碱性环境影响呈下降趋势;没食子酸-淀粉复合物中没食子酸的释放量随着pH 值的增加而显著升高,当pH 值为8 时,其释放量呈下降趋势。这可能是复合物处于碱性环境,部分带电的没食子酸和淀粉分子与水之间的静电相互作用增强,而淀粉分子与没食子酸与之间的相互作用减少,结果导致溶液中游离没食子酸的含量增加 [23] 。当pH 值为8 时,由于没食子酸在碱性环境中的不稳定性 [24],可能会对其结构造成破坏,从而导致游离没食子酸的含量下降 [10] 。
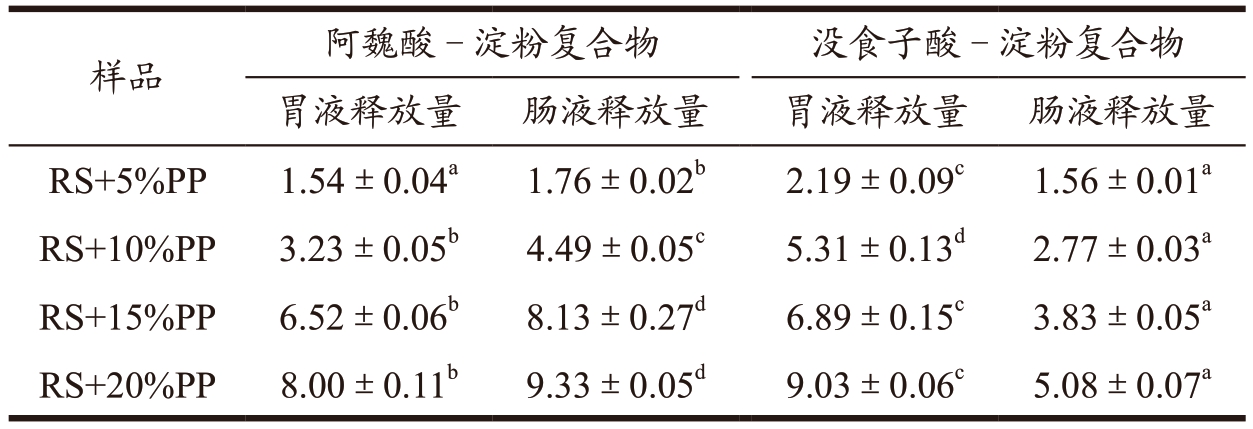
2.6 大米淀粉-多酚复合物在模拟胃肠液条件下的释放量
表3 显示的是在模拟胃肠液的条件下淀粉复合物在阿魏酸和没食子酸的释放效果。由表可知,大米淀粉-多酚复合物的胃液和肠液的释放量随着多酚添加量的增加而呈现上升的趋势。但是,阿魏酸和没食子酸在胃肠液的释放量有明显的不同。阿魏酸淀粉复合物在肠液中的释放量明显要高,复合物在胃液中释放后,进入到肠液环境中继续受到影响释放阿魏酸。而没食子酸-淀粉复合物在胃液中的释放量更为显著,进入肠液中释放量呈现出逐渐减少的趋势。由此可见,对于阿魏酸,有研究结果表明,阿魏酸与淀粉分子之间存在着一种基于氢键的相互作用,从而形成了一种结合状态 [25],但作用不大,所以阿魏酸也会受胃液环境的影响,但也会保护部分阿魏酸至小肠充分吸收。没食子酸在肠液中的释放量小,可能是由于在pH 值从2 升到7.5 的调节过程中,碱性环境对游离的没食子酸进行了破坏,导致所测得的没食子酸含量下降 [10] 。
表3 大米淀粉-多酚复合物在模拟胃肠液条件下的释放量
Table 3 Release of polyphenols from rice starch-polyphenols complexes in gastrointestinal conditions (mg/g)
3 结论
本文研究了稻米中主要单体酚阿魏酸和没食子酸与大米淀粉形成复合物后在不同条件下的释放情况。在α-淀粉酶的催化下,低添加量的阿魏酸或没食子酸淀粉提高了复合物中淀粉的水解率,而高添加量的阿魏酸或没食子酸则显著降低了复合物中淀粉的水解率。在淀粉葡萄糖苷酶的催化下,阿魏酸淀粉复合物使淀粉水解率显著降低,说明了阿魏酸淀粉复合物抑制了淀粉葡萄糖苷酶的催化活性,而没食子酸淀粉复合物使淀粉水解率显著升高。体外消化实验表明低添加量阿魏酸提高了快消化淀粉含量,高添加量阿魏酸提高了抗性淀粉含量;低添加量没食子酸提高快消化淀粉含量,降低抗性淀粉含量。不同的温度条件下的释放实验表明升高温度能够提高阿魏酸的释放量,而温度对没食子酸无较大影响。不同的pH 条件下的释放实验表明增大pH 值能够增加没食子酸的释放量,而阿魏酸的释放量则先低后高。模拟胃肠环境的条件下的释放实验表明阿魏酸在肠液环境中的释放量增加,而没食子酸的释放量降低。因此,本研究结果可为膳食多酚在淀粉基功能食品中的应用提供指导。
[1] TAN Y Q SAM K C C,ZHANG Y.Comparison of α-amylase,α-glucosidase and lipase inhibitory activity of the phenolic substances in two black legumes of different genera [J] .Food Chemistry,2017,214: 259-268.
[2] 赵二劳,赵三虎,范建凤,等.天然产物中活性成分对α-淀粉酶抑制作用研究进展 [J] .食品研究与开发,2020,41(19):199-203.
[3] RONG T.Chemistry and biochemistry of dietary polyphenols [J] .Nutrients,2010,2(12): 1231-1246.
[4] SUN L J,FREDERICK J WARREN,MICHAEL J GIDLE,et al.Mechanism of binding interactions between young apple polyphenols and porcine pancreatic α-amylase [J] .Food Chemistry,2019,283: 468-474.
[5] HUI X D,WU G,HAN D,et al.The effects of bioactive compounds from blueberry and black currant powers on the inhibitory activities of oatbran pastesgainst α-amylasy and α-glucosidase linked to type 2 diabetes [J] .Food Research Interactional,2020,138: 109756.
[6] 柴艳伟.茶多酚对高直链玉米淀粉消化性的影响及机理 [D] .无锡:江南大学,2013.
[7] MENG Y H,SU A P,YUAN S,et al.Evaluation of total flavonoids,myricetin,and quercetin from Hovenia dulcis Thunb.as inhibitors of α-amylase and α-glucosidase [J] .Plant Foods Hum Nutrition,2016,71(4): 444-449.
[8] ANDREA A,CRISTINA M.Rosell.Starch gels enriched with phenolics: Effects on paste properties,structure and digestibility [J] .LWT,2022,161: 113350.
[9] VAN HUNG P,PHAT N H,PHI N T L.Physicochemical properties and antioxidant capacity of debranched starchferulic acid complexes [J] .Starch-Stärke,2013,65(5-6):382-389.
[10] 韩雪琴.大米淀粉与食源性多酚相互作用的研究 [D] .广州:华南理工大学,2020.
[11] BELLO-PEREZ L A,FLORES-SILVA P C,AGAMAACEVEDO E,et al.Starch digestibility: past,present,and future [J] .Science of Food Agriculture,2020,100(14):5009-5016.
[12] 李驰,姚佳,韩乔,等.马铃薯淀粉消化特性及多酚对其影响研究进展 [J] .食品科技,2022,47(12):221-227.
[13] DESHPANDE S S,SALUNKHE D K.Interactions of tannic acid and catechin with legume starches [J] .Journal of Food Science,1982,47(6): 2080-2081.
[14] HANS N E,GEOFFREY J.The classification and measurement of dietary carbohydrates [J] .Food Chemistry,1996,57(1) : 15-21
[15] 彭善丽.茶多酚-OSA淀粉复合体的营养特性研究 [D] .无锡:江南大学,2017.
[16] 刘欣,何新益,王洪滨,等.茶多酚对黑色冲调粉抗氧化及淀粉消化特性的影响 [J] .食品与机械,2019,35(5):40-43.
[17] 宋媛,周池虹伶,欧仕益.三种酚酸对α-淀粉酶的抑制作用 [J] .食品与机械,2013,29(6):38-40.
[18] 张海凤,董亚琳,张琰.没食子酸对α-葡萄糖苷酶的抑制作用及其降糖机制研究 [J] .中国药业,2011,20(21):8-10.
[19] HAN X Y,WEN H L,LUO Y,et al.Effects of α-amylase and glucoamylase on the characterization and function of maize porous starches [J] .Food Hydrocolloids,2021,116:106661.
[20] ZHU F.Interactions between starch and phenolic compound [J] .Trends in Food Science &Technology,2015,43(2): 129-143.
[21] DENG N,DENG Z,TANG C,el al.Formation,structure and properties of the starch-polyphenol inclusion complex:A review [J] .Trends in Food Science &Technology,2021,112: 667-675.
[22] 柴艳伟,张根义.茶多酚对淀粉消化酶动力学的影响 [J] .食品工业科技,2013,34(10):84-88.
[23] REVITALl C,YEVGENIA O,MARINA K,et al.Structural and functional properties of amylose complexes with genistein [J] .Journal of Agricultural and Food Chemistry,2008,56(11): 4212-4218.
[24] MENDEL FRIEDMAN HELLA S.JÜRGENS.Effect of pH on the stability of plant phenolic compounds [J] .Journal of Agricultural and Food Chemistry,2000,48(6):2101-2110.
[25] HAN X Q,ZHANG M W,ZHANG R F,et al.Physicochemical interactions between rice starch and different polyphenols and structural characterization of their complexes [J] .LWT,2020,125: 109-227.