非酒精性脂肪肝病(NAFLD)是以肝细胞中脂肪过度沉积为特征的一类慢性综合征,发病率达到25.2%[1]。其中,有24%的患者从单纯性脂肪变性发展为炎性亚型的非酒精性脂肪肝炎(NASH)或肝硬化[2,3]。NAFLD 也会引起广泛的病理影响,例如胰岛素抵抗、肥胖、高血压、糖尿病和心血管疾病等[4]。
NAFLD 与高热量饮食、过量摄入脂肪、摄入添加型果糖等不良饮食习惯相关[5,6],并且肝脏中脂质代谢、氨基酸代谢和糖代谢紊乱是驱动NAFLD发展的关键因素[7-9]。通过调节肝脏代谢紊乱可能成为改善NAFLD 的重要途径。初期的NAFLD 通常是良性和可逆的,尚未有药物被明确批准用于NAFLD 且干预药物通常伴有副作用,非药物措施(健康饮食和身体活动)是行之有效的预防和治疗的方法[10]。因此,开发安全有效的膳食补充剂或特医食品将作为NAFLD 饮食干预的重要途径。
多酚是富含于水果、蔬菜、坚果和咖啡等食品中的一类天然化合物,发现可以从糖代谢、脂质代谢调节、氧化应激修饰和炎症控制作用调节NAFLD[11]。富含多酚的地中海饮食模式干预6 周后,患者肝脏脂肪变性程度降低38%[12]。葛根作为我国传统的药食同源植物,素有“北参南葛”的美誉。它富含葛根多酚(葛根素、大豆苷、葛根素木糖苷、毛蕊异黄酮等)活性成分,对保护心血管系统疾病、解酒护肝及降低血脂血糖有较好功效[13,14]。其中,葛根素是葛根的主要活性成分和质量控制标准。之前的研究表明葛根素在抗炎和改善肝脏功能方面具有优良的生物效益[15,16],可通过降低肝脂质积累和氧化应激缓解酒精或CCl4 诱导的肝损伤[17,18],而葛根素对于不良饮食下的NAFLD 影响及作用尚不明确。
为进一步研究葛根素缓解或修复不良饮食习惯(高热量饮食、过量摄入脂肪、摄入添加型果糖)造成NAFLD 的影响及作用,本研究建立了高糖高脂诱导的NAFLD 模型,探究葛根素干预NAFLD肝脏代谢的效果,为多酚干预或缓解NAFLD 的机制研究提供更多的实验依据。
1 材料与方法
1.1 实验材料
雄性C57BL/6J 小鼠,7 周龄,体质量(20±2)g,购自斯贝福(北京)生物技术有限公司(许可证号:SCXK(京)2019-0010),南昌大学动物使用许可证编号:SYXK(赣)2021-0001;小鼠维持饲料及高脂饲料购于江苏协同生物科技有限公司。D-果糖,山东百龙创园生物科技有限公司。葛根素(纯度98%),西安晋恒化工有限公司提供。罗格列酮,北京索莱宝科技有限公司。苏木精和伊红(H&E)染料、多聚甲醛,武汉仟百度生物有限公司。白细胞介素-6(IL-6)、白细胞介素-1β(IL-1β)和肿瘤坏死因子-α(TNF-α),上海酶联免疫生物科技有限公司。乙腈(LC-MS 级)、甲醇(LC-MS 级),德国默克集团。甲酸(LC-MS 级),赛默飞世尔科技有限公司。异氟烷,深圳瑞沃德生命科技有限公司。无水乙醇、氨水、二甲苯和中性树胶,国药集团化学试剂有限公司。
1.2 仪器与设备
HPLC-Q-TOF/MS,美国Absciex 公司。Phenomenex XB-C18(5 μm,250×4.6 mm),美 国Kinetex 公 司。ECLIPSE Ci 正置光学显微镜,德国Eppendorf 公司。5804R、5424R 型冷冻离心机,日本Nikon 公司。KZ-II 型高速组织研磨仪,武汉赛维尔生物科技有限公司。全自动生化分析仪,美国Beckman Coulter公司。包埋机,武汉俊杰电子有限公司。RM2016型病理切片机,上海徕卡仪器有限公司。组织摊片机,科迪仪器设备有限公司。
1.3 实验方法
1.3.1 非酒精性脂肪肝小鼠模型的建立
经过7 d 的适应性喂养,将小鼠随机分组(n=6):对照组、高脂组(高糖高脂)、阳性组(高糖高脂+罗格列酮20 mg/kg·bw)、葛根素组(高糖高脂+葛根素400 mg/kg·bw),进行为期8 周的动物实验。其中,对照组饲喂正常饲料、饮用纯净水;高脂组、阳性组、葛根素组饲喂高脂饲料(供能比为60%脂肪、20%碳水化合物、20%蛋白质),并饮用30%(m/V)果糖溶液以建立非酒精性脂肪肝模型。依据传统地中海人群总多酚摄入量统计为2 g/d[19],标准成人体质量为60 kg,基于体表面积折算法计算小鼠等效给药剂量(换算系数12.3),则小鼠给药剂量约为400 mg/kg·bw。依据地中海饮食习惯及先前的研究[12],设计每天以该剂量的葛根素进行灌胃,为期8 周;为了避免长期给药的明显毒性,阳性组小鼠仅第7~8 周以20 mg/kg 剂量[20]的罗格列酮灌胃,为期2 周。为保证实验的均一性,其他小鼠以同等体积的生理盐水灌胃。
1.3.2 肝脏组织病理检查
组织石蜡包埋切片:取出4 wt.%多聚甲醛固定的新鲜肝脏组织,在脱水机内依次以梯度乙醇进行脱水处理并用石蜡包埋,最后用病理切片机切割为4 μm 的组织切片。
H&E 染色分析:依次将石蜡切片放入二甲苯、无水乙醇、φ =95%、90%、80%、70% 乙醇进行脱蜡处理,浸入苏木素染液染切片3~8 min 再于φ=1%的盐酸酒精孵化数秒,φ=0.6%氨水返蓝数秒。随后,将组织切片入伊红染液进行染色1~3 min。染色完成后,用乙醇洗脱,中性树胶封片,于光学显微镜下观察切片并进行组织病理分析。
1.3.3 肝脏促炎因子测定
低温称取50 mg 肝脏组织,加入9 倍体积的预冷生理盐水匀浆,并在4 ℃离心(3 000 g,10 min)得到上清,随后按照酶联免疫吸附试验商业试剂盒说明书检测肝脏中的TNF-α、IL-1β 和IL-6 的浓度。
1.3.4 非靶向代谢组学分析
1.3.4.1 样品前处理
在干冰上称取肝脏组织80 mg 左右,加入200 μL预冷的纯化水和2 颗锆珠,低温研磨得到匀浆液后加入800 μL 甲醇/乙腈(1:1,V/V)提取。然后在冰水浴中超声10 min,在-20 ℃孵育过夜,然后在4 ℃,12 000 g 条件下离心15 min。取200 μL 等分上清液进行LC-MS分析。为确定分析体系的稳定性,将每个组织样品上清液20 μL 等份混合,以获得质控(QC)样品,样本分析前注入3 个空白和3 个QC 样品来平衡系统。之后每6 个样品注入QC 样品,以确定分析流程的稳定性。
1.3.4.2 UPLC-Q-TOF/MS 分析条件
色谱采集肝脏样品信息所设置的运行参数如下:柱温40 ℃,流量1 mL/min,进样体积5 μL,流动相A 为0.1%甲酸水,流动相B 为乙腈;洗脱程序为0~3 min,2%流动相B,3~26 min,95%流动相B,26~29 min,95%流动相B,29~30 min,2%流动相B,30~40 min,2%流动相B,正离子和负离子模式采用相同的洗脱程序。一级和二级质谱在Q/TOF-MS 质谱仪上进行,采用电喷雾电离(ESI)。正负离子模式gas 1 和gas 2 为55 psi,帘式气体为35 psi,离子源温度550 ℃,正负离子源气压分别为5 000 V 和-4 500 V。TOF/MS 扫描m/z 范围是50~1 200 u,TOF/MS/MS 扫描m/z 范围是30~1 200 u。在IDA 中检测 MS/MS 数据。数据采集在SCIEX OS 2.0 软件(AB SCIEX)控制。
1.3.5 数据处理
统计分析通过SPSS(版本24.0,美国IBM 公司)完成,并使用具有Duncan 检验的单向ANOVA分析进行数据分析。所有实验结果都表示为平均值±标准差(SD)。使用GraphPad Prism 8.0 实现数据可视化。代谢数据采集在SCIEX OS 2.0 软件(AB SCIEX)控制。在IDA 中检测MS/MS 数据通过SIMCA-P 14.1 软件进行代谢物注释并合并正负离子模式下的代谢物。在MetaboAnalyst 5.0(http://www.metaboanalyst.ca)上进行统计分析,采用无监督主成分分析(PCA)、监督正交偏最小二乘判别分析(OPLS-DA)来识别所研究代谢物的差异,并筛选潜在的生物标志物。特别地,应用OPLS-DA对两组代谢物的变化进行建模,并使用最佳拟合模型评估所有代谢物的投影变量重要性(VIP)。设置VIP 值及P 值筛选差异代谢物,在公开数据库HMDB 验证之后基于KEGG 数据库作代谢通路分析。
2 结果与讨论
2.1 NAFLD 小鼠体质量及肝脏组织的变化
饲喂高脂肪高果糖饮食的小鼠发生脂肪变性和脂肪性肝炎,表现出与人类NAFLD 相似的代谢特征、脂质积累和组织学改变[21]。如图1a 所示,在为期8 周的实验中,高脂组小鼠体质量呈快速上升趋势,由27.17 g 增加到了37.95 g。葛根素干预后体重下降至32.35 g,与阳性组32.73 g 几乎一致。经H&E 染色后可见(图1c),对照组小鼠肝细胞形态清晰,排列规则,紧密均一,而高脂组小鼠肝细胞出现气球样变,表现为体积增大且胞质透亮,多个肝细胞可见明显脂肪空泡,少量中性粒细胞聚集,这与Chyau 等[22]报道的NAFLD 经典病变相一致。葛根素干预后组织损伤减轻,表现为肝细胞形态清晰,排列较紧密且脂肪空泡几乎消失,未见炎性细胞聚集,表明小鼠的脂肪肝病理状态得到改善。与高脂组相比。葛根素干预后小鼠肝指数下降了14.9%(图1b)。上述结果提示,对NAFLD模型组小鼠使用葛根素干预后,可较好地降低体重和肝指数,减轻组织损伤,进而预防肝脂肪变性和NAFLD 的发生。
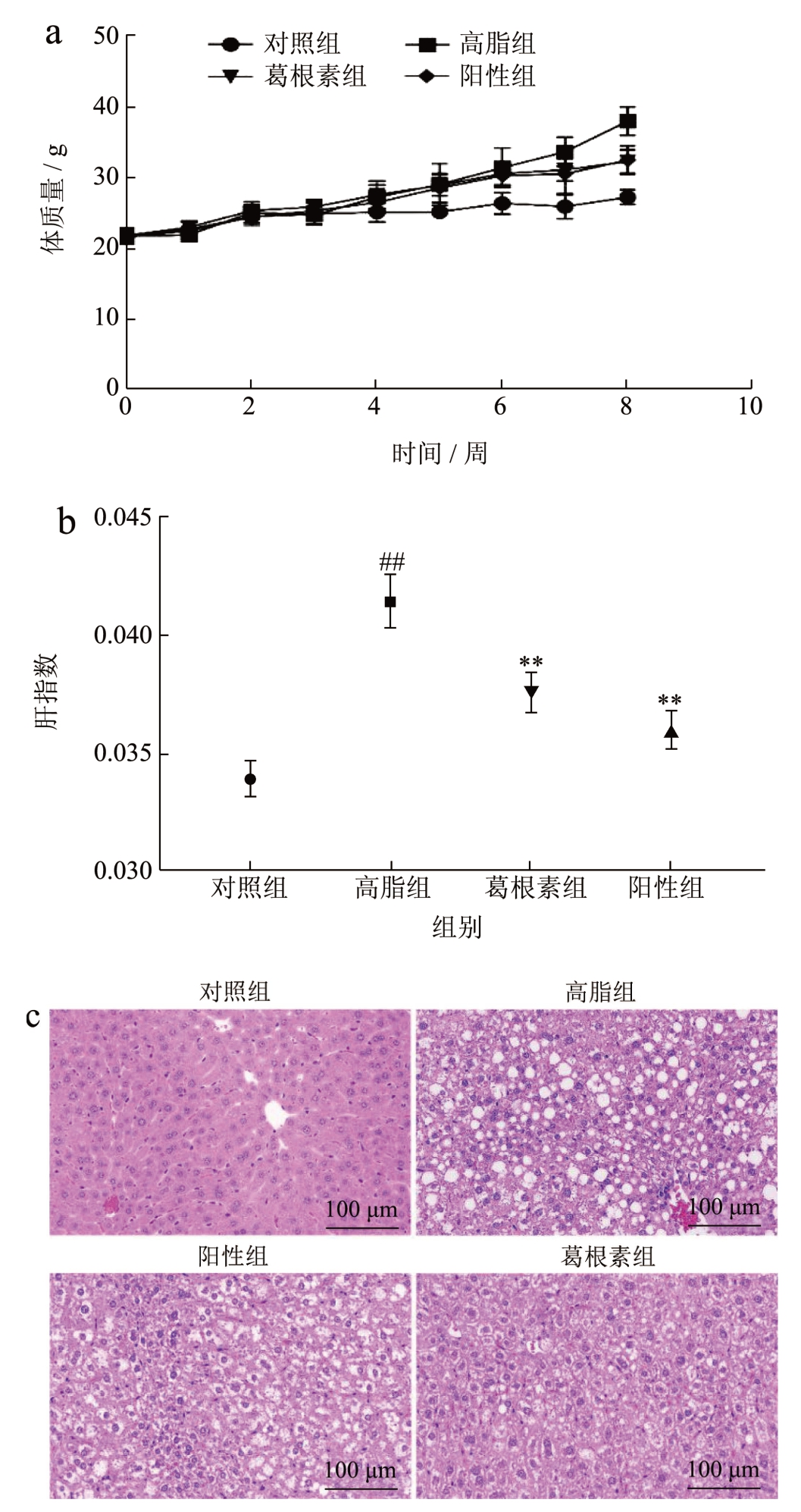
图1 葛根素对NAFLD小鼠体质量和肝脏组织的影响
Fig.1 Effects of puerarin on body weight and liver tissue of NAFLD mice
注:a 表示小鼠的体质量变化图;b 表示小鼠的肝脏指数(肝质量/体质量);c 表示小鼠肝脏组织的H&E 染色图,放大200 倍,标尺=100 μm;与正常组比较,##P<0.01;与高脂组比较,**P<0.01。
2.2 葛根素减轻NAFLD 小鼠肝脏炎症
NAFLD 的进展与全身炎症和炎症标志物的水平呈正相关。大量研究表明,果糖、饱和脂肪酸可以作为促炎因子引起代谢功能障碍并促进NAFLD发展NASH[23]。肝脏Kupffer 细胞被病原体相关模式分子(PAMP)和损伤相关模式分子(DAMP)激活诱导促炎细胞因子的释放,例如TNF-α、IL-6和IL-1β,从而活化T 细胞引发肝脏炎症[24]。如图2 所示,与对照组相比,NAFLD 模型小鼠肝组织中TNF-α、IL-6 和IL-1β 浓度分别升高了53.7%、48.5%、53.2%。相比于NAFLD 模型组,罗格列酮干预后浓度分别下降了88.6%、61.3%和64.5%。与阳性药效果相似,葛根素干预后其水平下降了62.9%、60.5%和61.0%。结果表明葛根素能够抑制肝脏炎症,在Zhou 等[11]的研究中也得出葛根素可以降低IL-18 和TNF-α 调节炎症以改善肝功能。

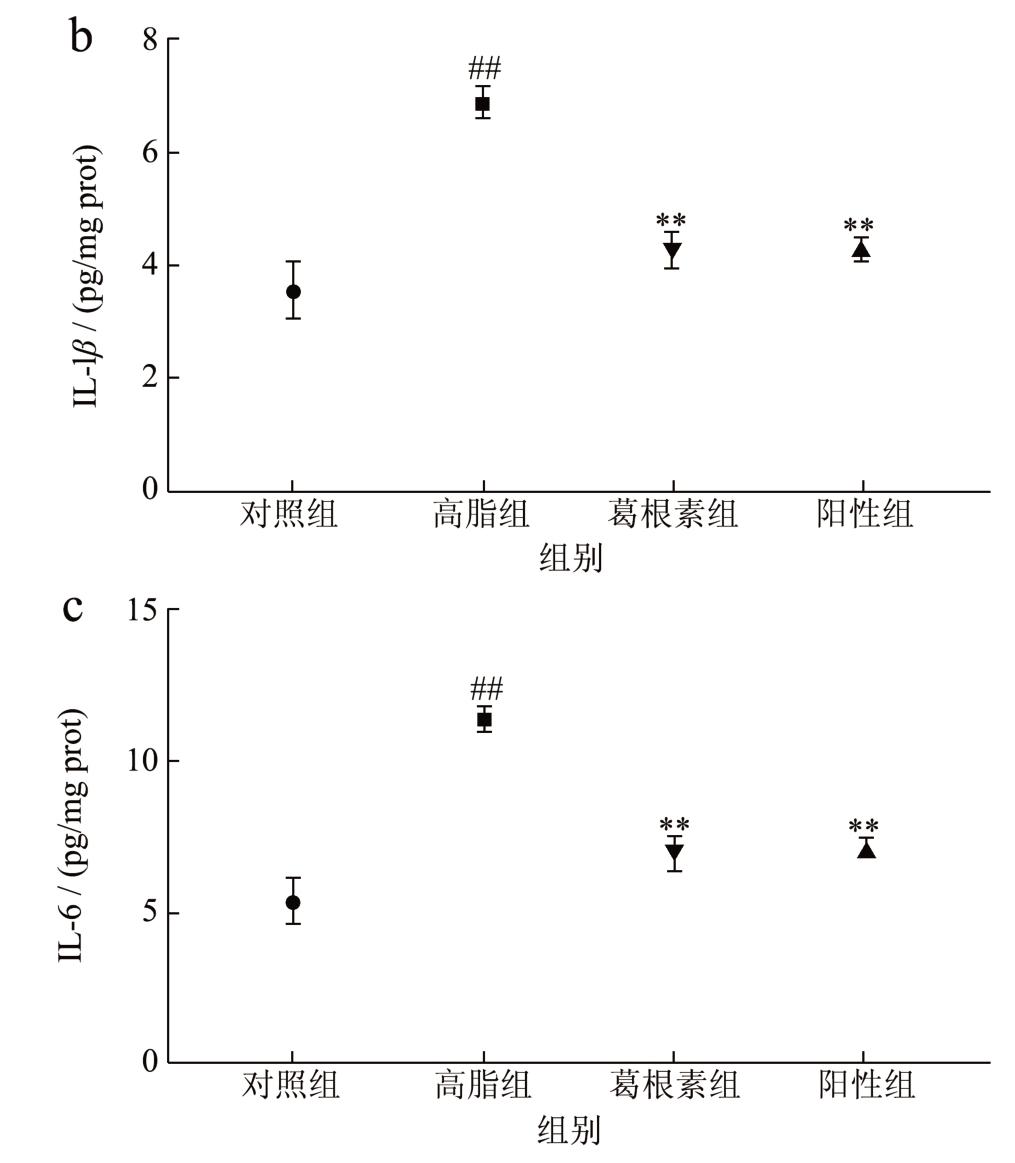
图2 葛根素对小鼠肝脏TNF-α、IL-1β、IL-6水平的影响
Fig.2 Effects of puerarin on the levels of TNF-α,IL-1β and IL-6 in liver of mice
注:与正常组比较,##P<0.01;与高脂组比较,**P<0.01。
2.3 葛根素对NAFLD 肝脏代谢物的影响
2.3.1 主成分分析(PCA)
本研究采用PCA 检测各组样本的内在聚类关系。在无监督模式下(图3),高脂组与对照组明显分离,表明两组的肝脏代谢物存在差异,小鼠NAFLD 的诱发显著改变了肝脏的代谢物。葛根素和罗格列酮的干预促使其代谢物特征远离高脂组,并向对照组靠近。结果说明各组肝脏中的代谢物均有明显差异。
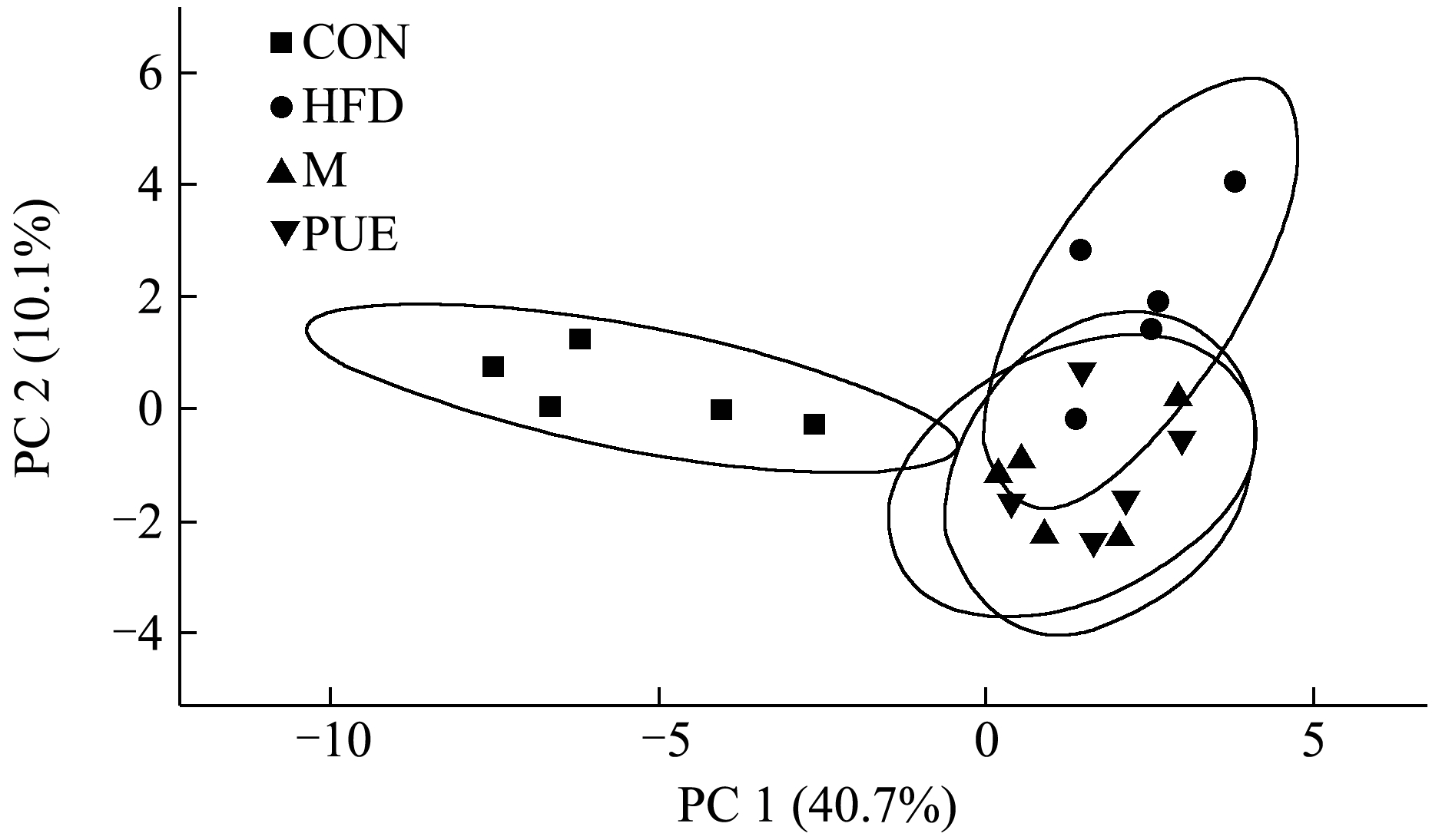
图3 PCA图
Fig.3 PCA diagram
注:CON 代表对照组,HFD 代表高脂组,M 代表阳性组,PUE 代表葛根素组。图4 同。
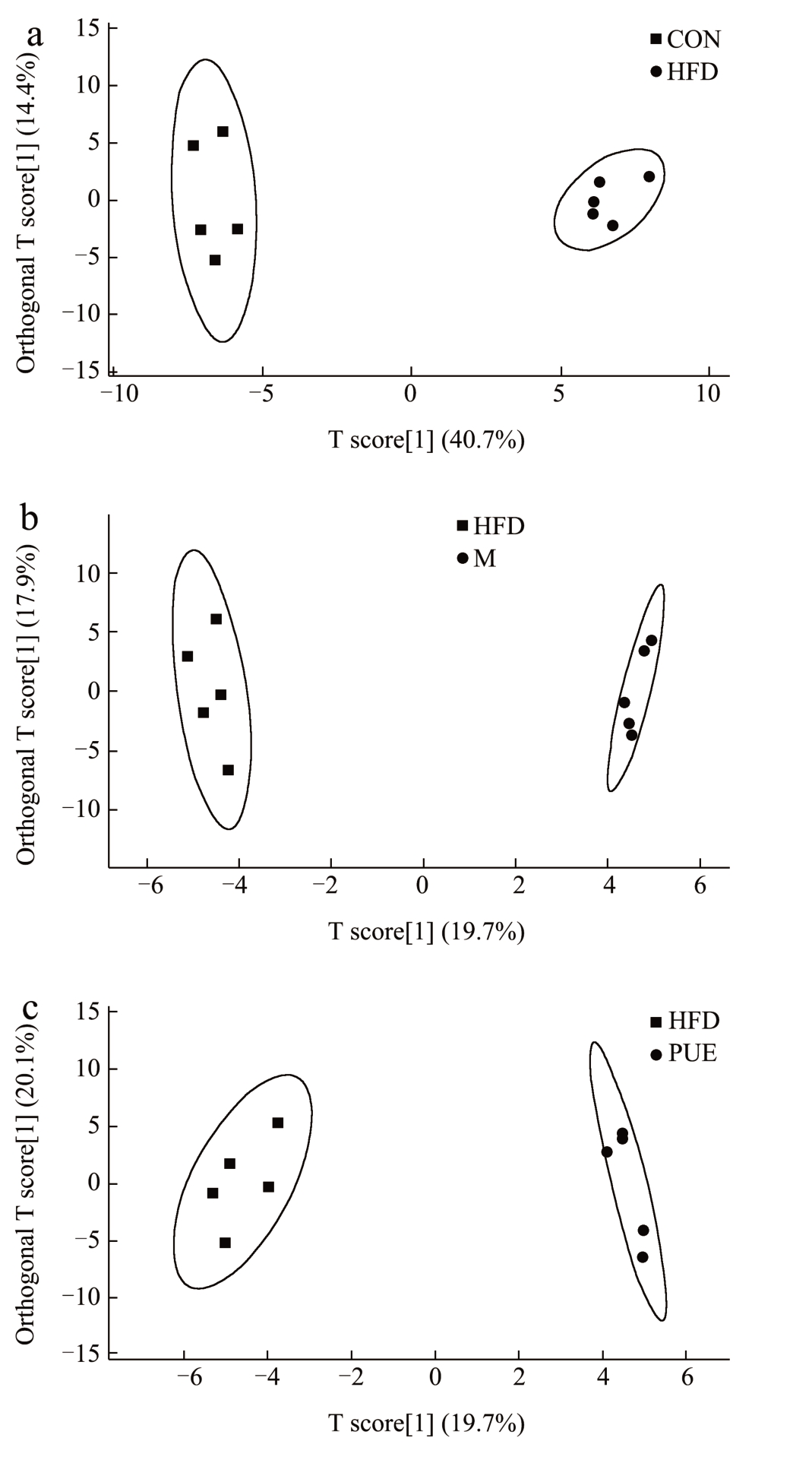
图4 OPLS-DA图
Fig.4 OPLS-DA diagram
2.3.2 正交偏最小二乘-判别检验(OPLSDA)
对具有差异特征的不同组别分别进行正交偏最小二乘判别分析(OPLS-DA,Orthogonal Partial Least Squares Discriminant Analysis),以分析各组样本间的差异。在监督模式下,OPLS-DA 显示高脂组与对照组(R2Y=0.922,Q2=0.889),M 组与HFD 组(R2Y=0.836,Q2=0.599),PUE 组与HFD组(R2Y=0.85,Q2=0.335)之间明显分离。结果表示模型具有较好的可靠性和基本的预测能力,且每两组间的代谢物具有显著差异。
2.4 筛选差异代谢物
通过变异倍数分析(FC Analysis)和T 检验对组间的差异代谢物进行筛选。设置FC 为1.2,P<0.1,VIP 值>1 筛选得到组间差异代谢物的种类及变化情况,衡量各代谢物的差异贡献度。其中,高脂组VS 对照组筛选得到25 种差异代谢物(表1),其中有9 种代谢物上调,16 种代谢物下调,涉及氨基酸代谢、糖代谢、脂质代谢及胆汁酸代谢途径。葛根素组VS 高脂组间筛选到21 种差异代谢物(表2),其中有17 种上调,4 种下调;涉及氨基酸代谢、糖代谢、维生素代谢及脂质合成途径;其中葛根素干预逆转了高糖高脂诱导的NAFLD 中油酸、L-蛋氨酸、N-甲基烟酰胺、L-天冬酰胺、L-丝氨酸、氨基己二酸和D-核糖5-磷酸等7 种差异代谢物的水平变化。肝脏为机体提供糖原及脂质的合成分解、蛋白质合成、维生素储存等合成代谢能力,葛根素可能通过调节这些代谢物所在的代谢途径以改善NAFLD。另外,与高脂组相比,阳性组有28 种差异代谢物被筛选(表3),其中有9 种代谢物上调,19 种代谢物下调,涉及氨基酸、胆汁酸和糖代谢途径。
表1 高脂组vs对照组差异代谢物种类及变化
Table 1 Types and changes of different metabolites in high-fat group VS control group
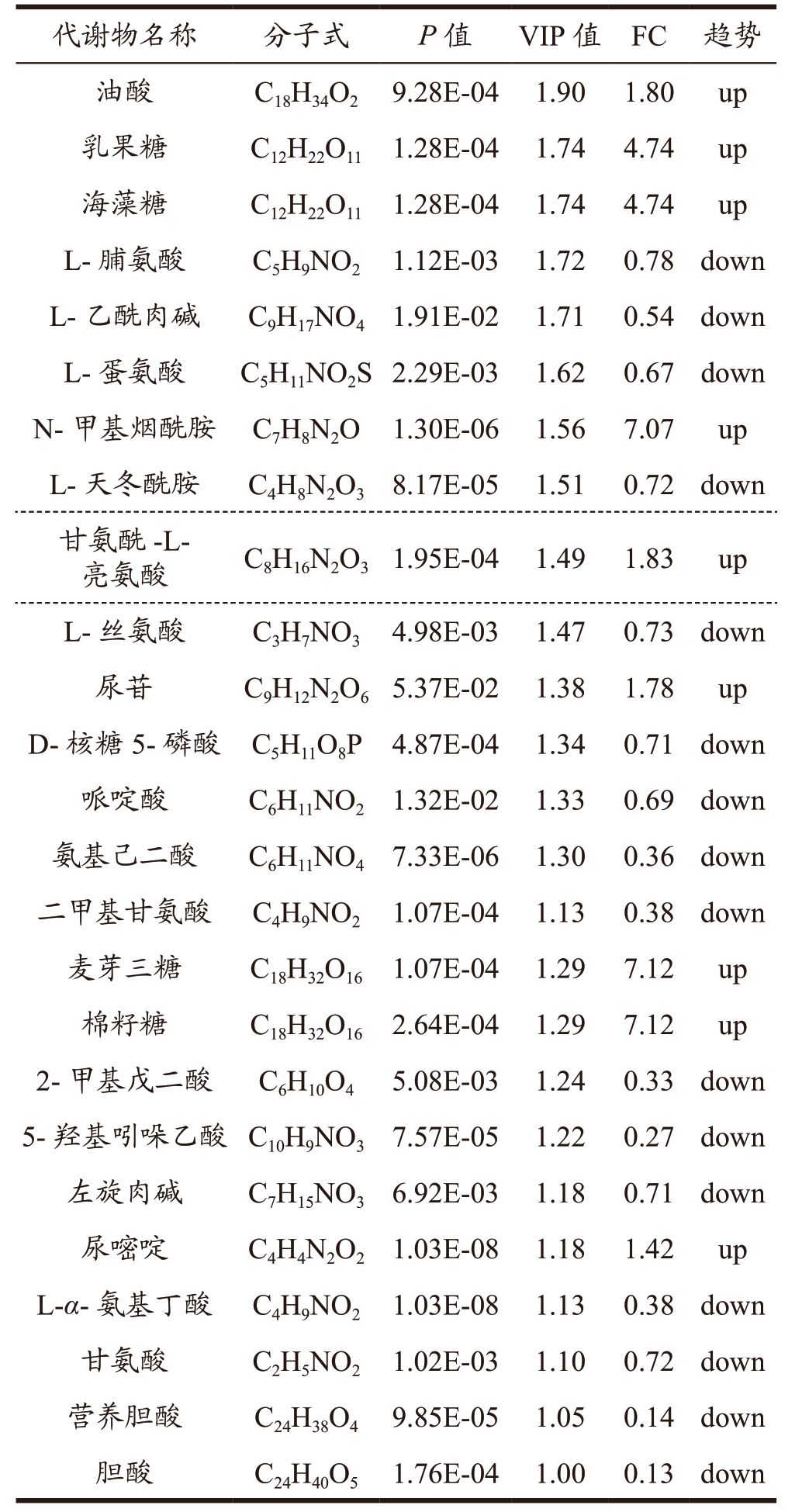
注:当VIP 值>1时认为代谢物的差异性有意义,FC 值表示倍数变化,“up”表示上调,“down”表示下调,下同。
表2 葛根素组vs高脂组差异代谢物种类及变化
Table 2 Types and changes of different metabolites in puerarin group VS high-fat group
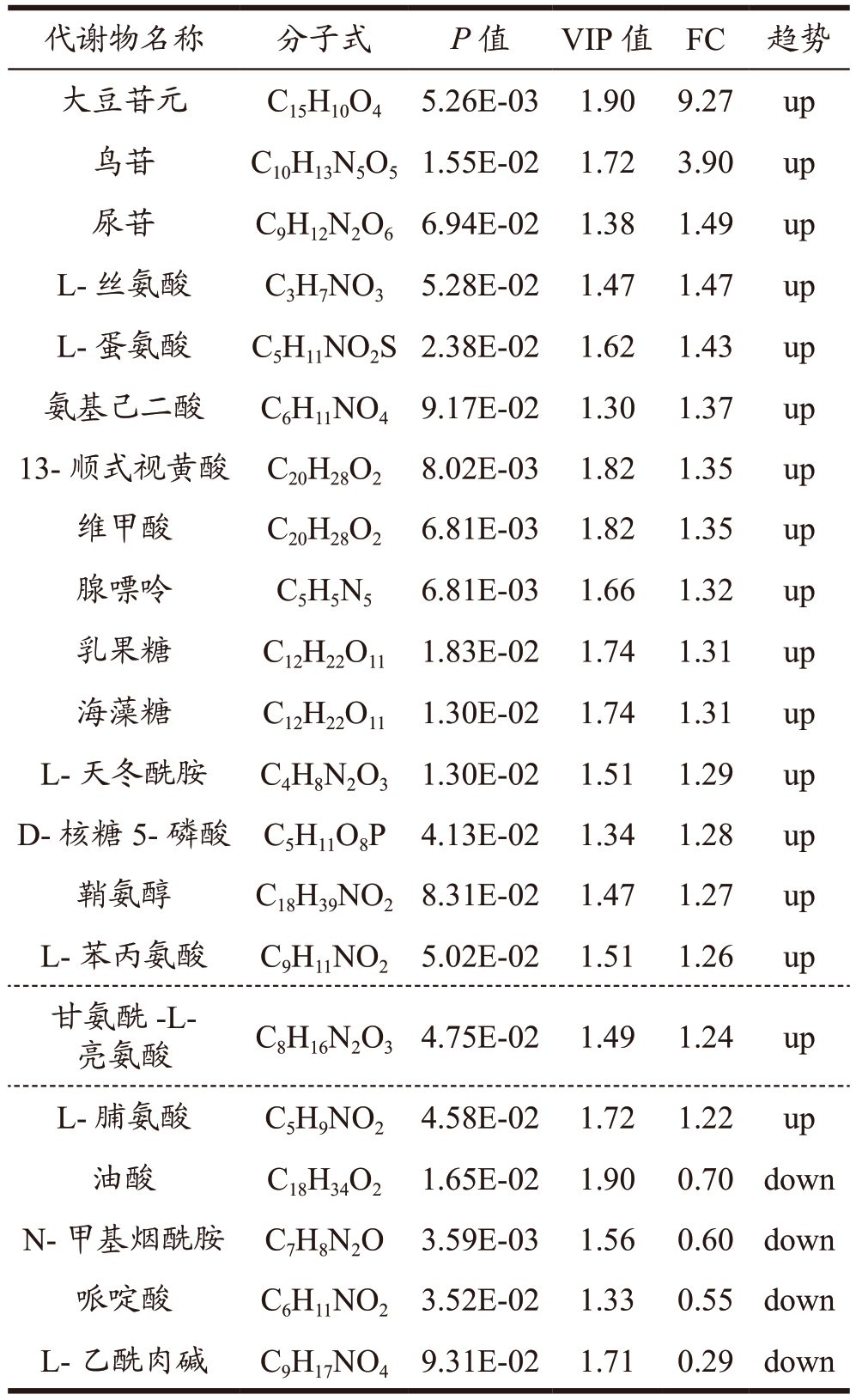
表3 阳性组vs高脂组差异代谢物种类及变化
Table 3 Types and changes of different metabolites in positivegroup VS high-fat group
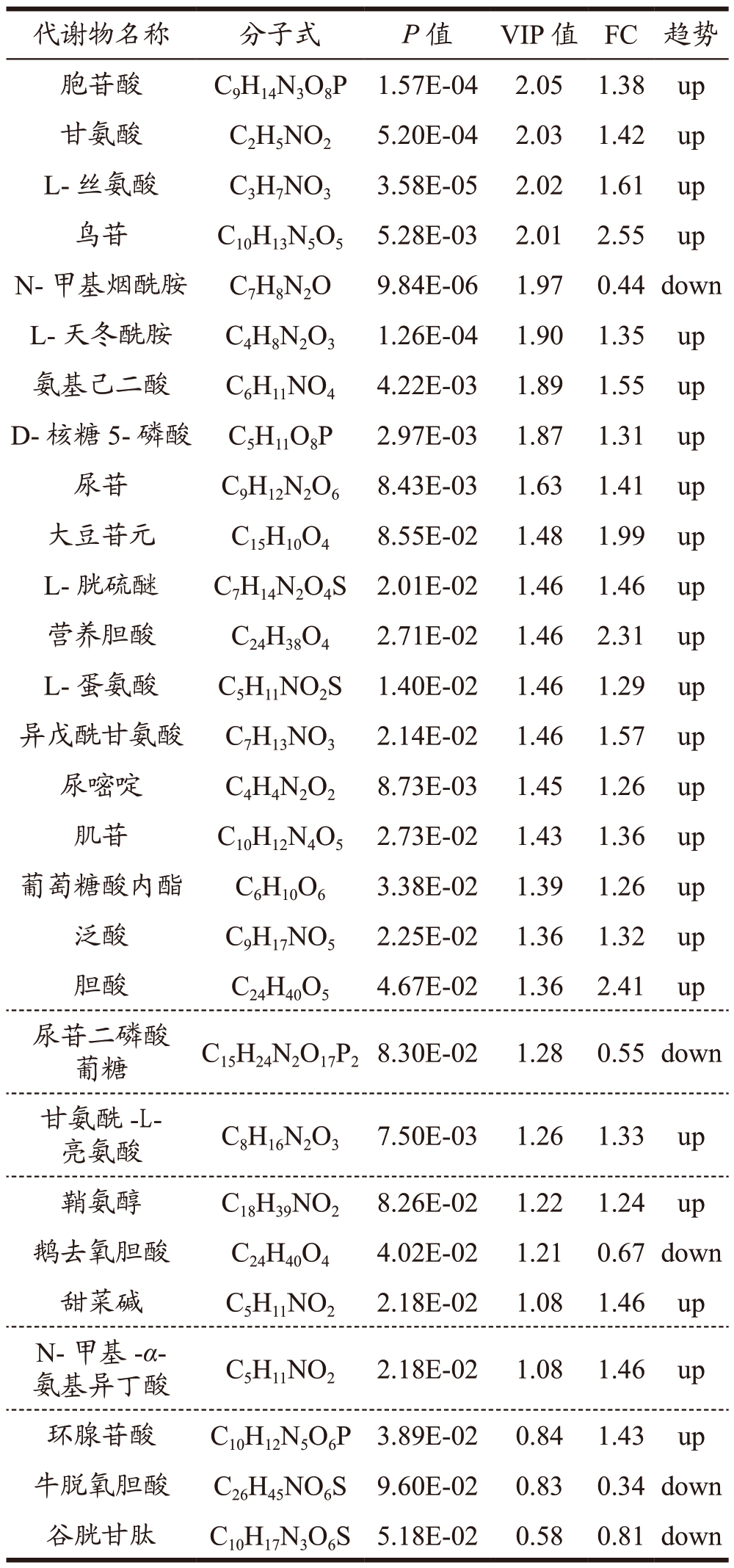
通过比较葛根素/高脂和罗格列酮/高脂的差异代谢物,发现了10 种共同的差异代谢物,分别是:L-丝氨酸、L-天冬酰胺、L-蛋氨酸、氨基己二酸、甘氨酰-L-亮氨酸、鞘氨醇、N-甲基烟酰胺、D-核糖5-磷酸、尿苷、鸟苷。本研究中葛根素和罗格列酮干预后这些代谢物水平显著提高。其中,丝氨酸可作为生物标志物,过量利用氨基酸加剧肝内脂肪的积累,其水平降低可用于早期检测非酒精性脂肪肝和非侵入性评估其组织学严重程度[25]。另外,L-丝氨酸、L-天冬酰胺、L-蛋氨酸通过参与氨基酸代谢对脂质堆积及脂质变性发挥作用[26-28]。代谢物鞘氨醇参与鞘脂降解,鞘脂水平改变干扰肝脏脂质稳态,包括肝脏脂质磷脂、二酰基甘油和胆固醇水平变化[29,30]。尽管本研究报告了鞘氨醇在NAFLD模型中变化的研究,但只有很少的研究验证。在他们的研究中指出,肝脏脂质代谢中脂肪酸(FA)和甘油三酯(TG)及胆汁酸(BA)通过代谢组学和脂质组学方法鉴定,并可能用作非侵入性诊断测试的生物标志物,在预测肝脏脂代谢方面具有更大的潜力[31]。
2.5 差异代谢物KEGG 功能注释及代谢通路分析
对筛选出的肝脏差异代谢物进行代谢通路的功能注释及通路分析(Pathway Analysis),相比于对照组,高脂组筛选的25 种差异代谢物共参与20 条代谢通路(图5)。与高脂组相比,葛根素组筛选得到21 种代谢物共参与16 条代谢途径(图6);阳性组筛选得到28 种代谢物,共参与了20 条代谢途径(图7)。
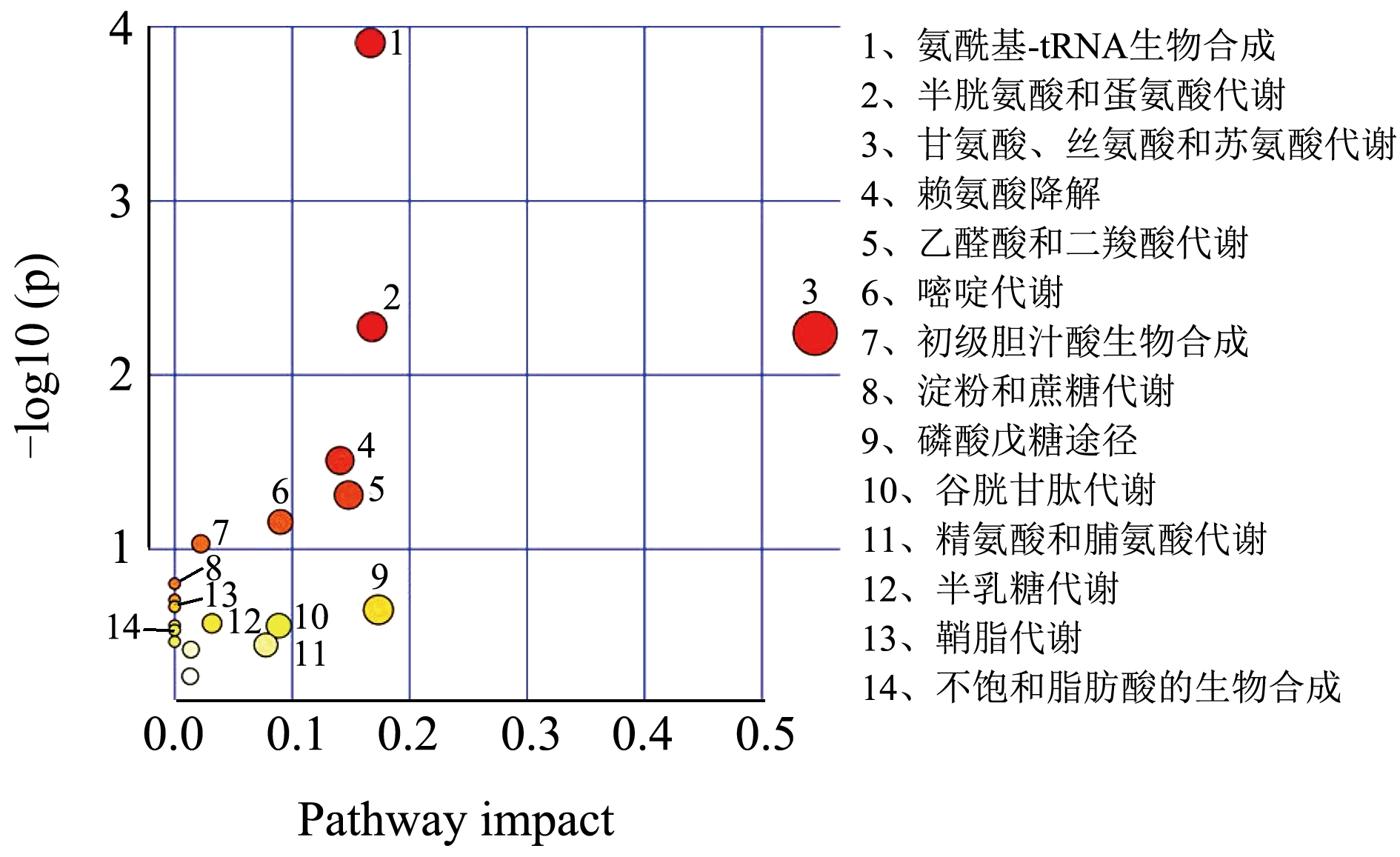
图5 高脂组vs对照组差异代谢物富集主要KEGG通路
Fig.5 Main KEGG pathway of differential metabolite enrichment in high fat group VS control group
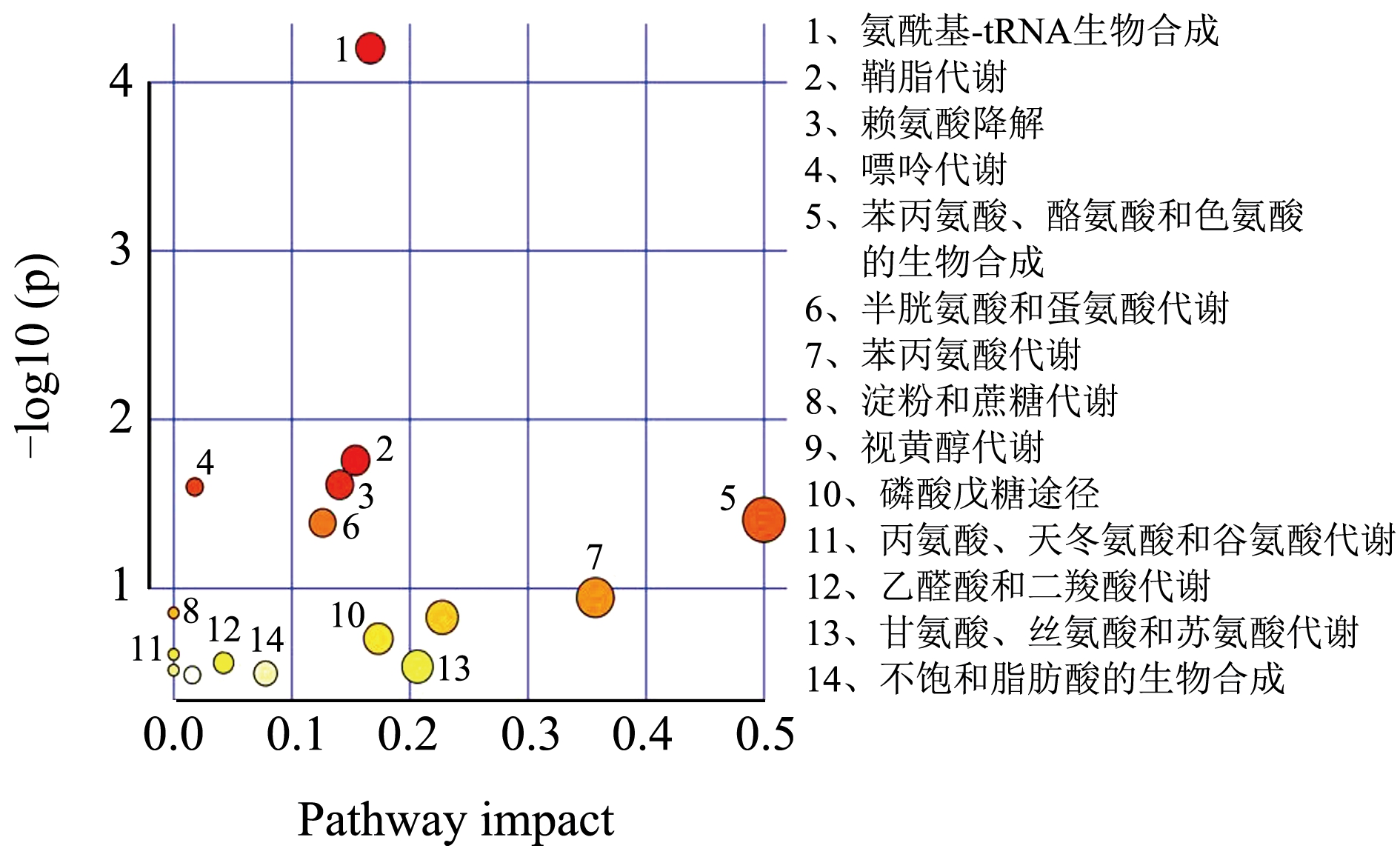
图6 葛根素组vs高脂组差异代谢物富集主要KEGG通路
Fig.6 Main KEGG pathway of differential metabolite enrichment in puerarin group VS high fat group
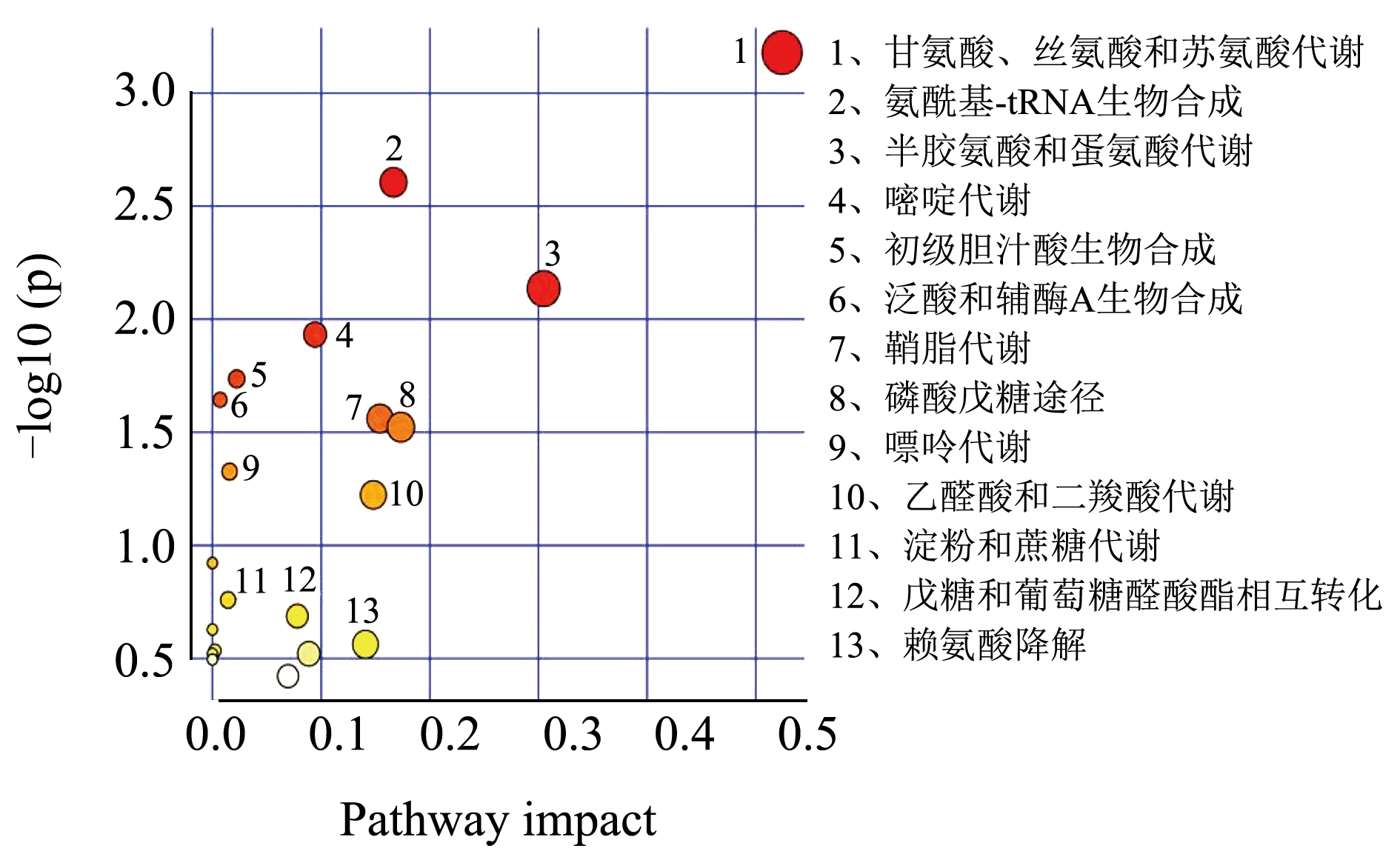
图7 阳性组vs高脂组差异代谢物富集主要KEGG通路
Fig.7 Main KEGG pathways for differentially enriching metabolites in positive group vs high fat group
肝脏代谢物涉及到多种氨基酸代谢通路,这些代谢物的升高或降低表明氨基酸代谢紊乱。在NAFLD 小鼠肝脏中L-蛋氨酸、L-丝氨酸、甘氨酸水平显著下降。研究表明L-蛋氨酸膳食通过抑制炎性细胞因子释放和脂质过氧化改善NASH 的肝脏病变[28],并调节谷胱甘肽的生物合成[32]。谷胱甘肽作为功能性食品的原料,在延缓衰老、增强免疫力、抗肿瘤等功能性食品广泛应用[33]。L-丝氨酸过度降解为脂肪从头合成提供前体物质,可能与肝脏脂质堆积有关。补充膳食L-丝氨酸可减少肝组织中的炎性细胞沉积[26]。因此,这些氨基酸代谢紊乱可引发脂质代谢障碍和肝脏炎症等促进NAFLD 的发展。脂质代谢障碍可引起苯丙氨酸、酪氨酸和色氨酸的生物合成失调,这些代谢物对免疫细胞功能的调节具有直接作用[27]。本研究中,葛根素提高了高糖高脂诱导NAFLD 中低水平的L-蛋氨酸、L-丝氨酸、L-天冬酰胺,调节了肝脏的半胱氨酸和蛋氨酸代谢,谷胱甘肽代谢,甘氨酸、丝氨酸和苏氨酸代谢,苯丙氨酸、酪氨酸和色氨酸生物合成等氨基酸代谢途径。结果提示葛根素可减轻氨基酸代谢紊乱预防NAFLD。在他们的研究中也发现,补充姜黄素可通过降低NAFLD 中高水平的生糖氨基酸和生酮氨基酸,改善小鼠肝脏代谢紊乱[34]。
肝脏中脂质的合成代谢失调引发肝脂质积聚,脂毒性已被证明会引发肝损伤、炎症和胰岛素抵抗[35]。NAFLD 小鼠中观察到油酸水平提高,胆酸、营养胆酸水平下降。油酸富集诱导肝细胞更大程度的脂质代谢失调和炎症反应,从而促进NASH 的发生[36,37]。研究报道红三叶草异黄酮具有调节脂质代谢以减少高糖高脂膳食导致的氧化损伤作用[38]。胆汁酸辅助鞘脂降解,两者代谢失调与NAFLD 患者的脂质累积有关[29]。葛根素干预后油酸水平下降为高脂组的0.7 倍,鞘氨醇水平提高1.47 倍。郭若涵等[39]报道了葛根素可以降低血清总脂肪酸含量,有效地纠正SD 大鼠紊乱的脂质代谢。与他们的结果一致,本研究葛根素可通过调节脂质代谢途径,抑制肝细胞脂质堆积而缓解NAFLD。
高糖高脂饮食诱导的NAFLD 小鼠肝细胞中的糖类(棉籽糖、海藻糖、乳果糖)含量明显升高,肝脏细胞的糖代谢发生紊乱。糖代谢途径的中间产物D-核糖5-磷酸水平降低至对照组的0.71 倍,而葛根素干预后提高至高脂组的1.28 倍。D-核糖5-磷酸参与磷酸戊糖途径(PPP)调控Treg 细胞激活和抑制功能[40],提示葛根素激活PPP 途径可能发挥免疫调节作用。另外,维生素作为酶辅因子促进细胞能量合成,嘌呤及嘧啶代谢是决定功能表现的生物学过程[41,42]。葛根素调节了肝脏代谢途径中的维生素代谢(13-顺式视黄酸、维甲酸、N-甲基烟酰胺)及嘌呤嘧啶代谢(腺嘌呤、鸟苷及尿苷)等途径,而这些物质的代谢是维护人体免疫调节、葡萄糖和脂质代谢重要生物途径[43]。
3 结论
葛根素对高脂高糖诱导的非酒精性脂肪肝模型小鼠具有明显的保护作用。肝脏代谢组学揭示了葛根素调整了高脂高糖诱导NAFLD 的肝脏代谢,主要通过恢复氨基酸代谢途径紊乱;下调油酸水平,促进鞘脂降解,改善肝脏脂质代谢。同时,葛根素调节D-核糖5-磷酸、视黄酸、维甲酸、N-甲基烟酰胺、腺嘌呤、鸟苷及尿苷的代谢水平,它们分别参与磷酸戊糖代谢、维生素、嘌呤及嘧啶代谢途径。另外,葛根素缓解了NAFLD 小鼠肝脏组织损伤,抑制肝脏组织的炎症。研究结果为开发膳食补充剂预防NAFLD 提供了新的实验依据。
[1]YE Q,ZOU B,YEO Y H,et al.Global prevalence,incidence,and outcomes of non-obese or lean non-alcoholic fatty liver disease: a systematic review and meta-analysis [J].The Lancet Gastroenterology &Hepatology,2020,5(8): 739-752.
[2]ALBHAISI S,NOUREDDIN M.Current and potential therapies targeting inflammation in NASH [J].Frontiers in Endocrinology,2021,12: 767314.
[3]SCHWABE R F,TABAS I,PAJVANI U B.Mechanisms of fibrosis development in nonalcoholic steatohepatitis [J].Gastroenterology,2020,158(7): 1913-1928.
[4]SONG C,LONG X,HE J,et al.Recent evaluation about inflammatory mechanisms in nonalcoholic fatty liver disease [J].Frontiers in Pharmacology,2023,14: 1081334.
[5]MURIEL P,LóPEZ-SáNCHEZ P,RAMOS-TOVAR E.Fructose and the liver [J].International Journal of Molecular Sciences,2021,22(13): 6969.
[6]ISHIMOTO T,LANASPA M A,RIVARD C J,et al.Highfat and high-sucrose (western) diet induces steatohepatitis that is dependent on fructokinase [J].Hepatology(Baltimore,Md),2013,58(5): 1632-1643.
[7]PIRAS C,NOTO A,IBBA L,et al.Contribution of metabolomics to the understanding of NAFLD and NASH syndromes: asystematic review [J].Metabolites,2021,11(10): 694-710.
[8]BECHMANN L P,HANNIVOORT R A,GERKEN G,et al.The interaction of hepatic lipid and glucose metabolism in liver diseases [J].Journal of Hepatology,2012,56(4): 952-964.
[9]JIAN H,XU Q,WANG X,et al.Amino acid and fatty acid metabolism disorders trigger oxidative stress and inflammatory response in excessive dietary valine-induced NAFLD of laying hens [J].Frontiers in Nutrition,2022,9:849767.
[10]张莉,李易姿,刘玉阳,等.膳食和生活方式炎症分数及其与代谢疾病研究进展[J].公共卫生与预防医学,2023,34(2):7-11.
[11]ZHOU J,ZHANG N,ALDHAHRANI A,et al.Puerarin ameliorates nonalcoholic fatty liver in rats by regulating hepatic lipid accumulation,oxidative stress,and inflammation[J].Frontiers in Immunology,2022,13: 956688.
[12]ANANIA C,PERLA F M,OLIVERO F,et al.Mediterranean diet and nonalcoholic fatty liver disease [J].World Journal of Gastroenterology,2018,24(19): 2083-2094.
[13]房伟.葛根药理作用研究进展[J].中国药物经济学,2017,12(11):159-160.
[14]陈凯,魏平慧,史琳.葛根异黄酮类成分的药理作用研究进展[J].药物评价研究,2022,45(12):2602-2610.
[15]聂晓霞,王翠香.葛根素提取物改善妊娠期糖尿病大鼠的氧化应激损伤[J].现代食品科技,2021,37(2):44-48.
[16]王双.基于网络药理学和代谢组学研究葛根素对糖尿病的保护作用及机制[D].西安:陕西科技大学,2020.
[17]MA J Q,DING J,ZHAO H,et al.Puerarin attenuates carbon tetrachloride-induced liver oxidative stress and hyperlipidaemia in mouse by JNK/c-Jun/CYP7A1 pathway[J].Basic &Clinical Pharmacology &Toxicology,2014,115(5): 389-395.
[18]TIAN L,FAN F,ZHENG S,et al.Puerarin exerts the hepatoprotection from chronic alcohol-induced liver injury via inhibiting the cyclooxygenase-2 and the 5-lipoxygenase pathway in rats [J].Complementary Medicine Research,2021,28(2): 104-113.
[19]TAGUCHI C,FUKUSHIMA Y,KISHIMOTO Y,et al.Estimated dietary polyphenol intake and major food and beverage sources among elderly japanese [J].Nutrients,2015,7(12): 10269-10281.
[20]GAO M,MA Y,ALSAGGAR M,et al.Dual outcomes of rosiglitazone treatment on fatty liver [J].Aaps Journal,2016,18(4): 1023-1031.
[21]ASGHARPOUR A,CAZANAVE S C,PACANA T,et al.A diet-induced animal model of non-alcoholic fatty liver disease and hepatocellular cancer [J].Journal of Hepatology,2016,65(3): 579-588.
[22]CHYAU C C,WANG H F,ZHANG W J,et al.Antrodan alleviates high-fat and high-fructose diet-induced fatty liver disease in C57BL/6 mice model via AMPK/Sirt1/SREBP-1c/PPARγ pathway [J].International Journal of Molecular Sciences,2020,21(1): 360-378.
[23]ROM O,LIU Y,LIU Z,et al.Glycine-based treatment ameliorates NAFLD by modulating fatty acid oxidation,glutathione synthesis,and the gut microbiome [J].Science Translational Medicine,2020,12(572): eaaz2841.
[24]BILZER M,ROGGEL F,GERBES A L.Role of Kupffer cells in host defense and liver disease [J].Liver International:Official Journal of the International Association for the Study of the Liver,2006,26(10): 1175-1186.
[25]TRICò D,BIANCALANA E,SOLINI A.Protein and amino acids in nonalcoholic fatty liver disease [J].Current Opinion in Clinical Nutrition and Metabolic Care,2021,24(1): 96-101.
[26]ZHANG Z,TESLAA T,XU X,et al.Serine catabolism generates liver NADPH and supports hepatic lipogenesis[J].Nature Metabolism,2021,3(12): 1608-1620.
[27]STRASSER B,SPERNER-UNTERWEGER B,FUCHS D,et al.Mechanisms of inflammation-associated depression:immune influences on tryptophan and phenylalanine Metabolisms [J].Current Topics in Behavioral Neuro Sciences,2017,31: 95-115.
[28]WHEELER M D,ROSE M L,YAMASHIMA S,et al.Dietary glycine blunts lung inflammatory cell influx following acute endotoxin [J].American Journal of Physiology-Lung Cellular and Molecular Physiology,2000,279(2): 390-398.
[29]JACKSON K G,WAY G W,ZHOU H.Bile acids and sphingolipids in non-alcoholic fatty liver disease [J].Chinese Medical Journal,2022,135(10): 1163-1171.
[30]BEKTAS M,ALLENDE M L,LEE B G,et al.Sphingosine 1-phosphate lyase deficiency disrupts lipid homeostasis in liver [J].The Journal of Biological Chemistry,2010,285(14): 10880-10889.
[31]MASOODI M,GASTALDELLI A,HYöTYLäINEN T,et al.Metabolomics and lipidomics in NAFLD: biomarkers and non-invasive diagnostic tests [J].Nature Reviews Gastroenterology &Hepatology,2021,18(12): 835-856.
[32]MARTINEZ Y,LI X,LIU G,et al.The role of methionine on metabolism,oxidative stress,and diseases [J].Amino Acids,2017,49(12): 2091-2098.
[33]王小巍,张红艳,刘锐,等.谷胱甘肽的研究进展[J].中国药剂学杂志,2019,17(4):141-148.
[34]魏青丽,孙润彬,阿基业,等.姜黄素对非酒精性脂肪肝小鼠代谢组学的调控研究[J].药物评价研究,2019,42(3):402-411.
[35]PAWLAK M,LEFEBVRE P,STAELS B.Molecular mechanism of PPARα action and its impact on lipid metabolism,inflammation and fibrosis in non-alcoholic fatty liver disease [J].Journal of Hepatology,2015,62(3): 720-733.
[36]RICCHI M,ODOARDI M R,CARULLI L,et al.Differential effect of oleic and palmitic acid on lipid accumulation and apoptosis in cultured hepatocytes [J]. Journal of Gastroenterology and Hepatology,2009,24(5):830-840.
[37]KWAN H Y,HU Y M,CHAN C L,et al.Lipidomics identification of metabolic biomarkers in chemically induced hypertriglyceridemic mice [J].Journal of Proteome Research,2013,12(3): 1387-1398.
[38]宁鸿珍,关维俊,刘英莉,等.红三叶草异黄酮对高糖高脂诱导脂肪肝大鼠脂质过氧化及肝功能的影响[J].食品研究与开发,2015,13:17-19,31.
[39]郭若涵,廖辉鹏,向水鑫,等.葛根素对非酒精性脂肪肝脂肪代谢的影响[J].饮食保健,2019,6(1):91.
[40]LIU Q,ZHU F,LIU X,et al.Non-oxidative pentose phosphate pathway controls regulatory T cell function by integrating metabolism and epigenetics [J].Nature Metabolism,2022,4(5): 559-574.
[41]HOSSAIN K S,AMARASENA S,MAYENGBAM S.B vitamins and their roles in gut health [J].Microorganisms,2022,10(6): 1168.
[42]YANG K,LI J,TAO L.Purine metabolism in the development of osteoporosis [J].Biomedicine &Pharmacotherapy,2022,155: 113784.
[43]CHRISTAKOS S,LI S,DE LA CRUZ J,et al.New developments in our understanding of vitamin metabolism,action and treatment [J].Metabolism: Clinical and Experimental,2019,98: 112-120.