柑橘(Citrus)是芸香科柑橘属木本植物,主要品种包括柑类(Citrus chachiensis Hort.)、橙类(Citrus sinensis (L.) Osbeck)、橘类(Citrus reticulata Blanco)、金柑类(Fortunella margarita (Lour.) Swingle)、柚类(Citrus maxima (Burm.) Merr.)、柠檬类(Citrus limon(L.) Osbeck)等。我国是柑橘的主要原产国和重要起源地,种质资源十分丰富,拥有4 000 多年的种植史。柑橘是世界第一大水果,2021 年的全球柑橘产量达1.02 亿t,其中我国产量为5 595.61 万t,占全球产量的54.86%,稳居第一 [1] 。柑橘作为常用中药材在我国已有上千年历史,富含多种天然活性成分,包括类黄酮、酚酸、柠檬苦素、香豆内脂、类胡萝卜素和果胶等。其中,柑橘黄酮作为一类植物次生代谢物,主要存在于柑橘属植物果实的外皮中(平均含量为0.7%~2.0%),分为黄酮类、黄烷酮类、黄酮醇类、黄烷酮醇类、花青素类和异黄酮类6 个亚类 [2,3] ,具有抗氧化、抑菌、抗炎、抗癌等多种功能活性,对神经保护、免疫调节、心血管疾病预防等方面有显著功效 [4,5] 。研究表明,除黄烷-3-醇外,大多数柑橘黄酮都以黄酮糖苷的形式存在,以游离型苷元存在的黄酮种类很少 [6] 。然而,糖苷型黄酮在人体内吸收和生物活性均远低于游离型,因此柑橘黄酮的应用受到了较低的溶解性和生物利用度的限制 [7,8] 。
体外发酵技术能利用微生物或酶等生物催化剂,定向修饰外源化合物的特殊结构,从而获得高溶解度、高吸收性和高活性的代谢产物。与传统的生物转化技术相比,体外发酵技术可根据黄酮类化合物的结构特征选择特定的微生物或酶进行定向水解。同时,它还可以通过体外发酵模型评估黄酮类化合物在人体内的代谢途径和潜在益生作用 [9] 。近年来,体外发酵技术已广泛运用于提升黄酮类化合物的功能活性。例如,使用商业益生菌进行单一或混合发酵、在体外消化模型中进行粪菌发酵,或使用酶法转化黄酮糖苷等 [10-12] 。微生物分泌的β-葡萄糖苷酶、β-鼠李糖苷酶、酯酶等,可以将黄酮苷转化为苷元,并通过不同代谢途径进一步降解为各类酚酸。如,黄酮醇通常在β-葡萄糖苷酶的作用下生成相应的糖苷配基,随后在邻苯二酚双加氧酶的作用下发生环裂变反应,生成羟基苯乙酸和2,4-二羟基苯甲酸,继而在儿茶酚-O-甲基转移酶的作用下进一步甲基化,生成3-甲基-4-氧代槲皮素和3-甲基槲皮素等;黄烷酮经过去糖基化反应后在黄烷酮-3-羟化酶的作用下发生环裂变,生成二氢查耳酮,随后通过CYP450 酶的去甲基化作用进一步代谢形成二氢山奈酚和二氢槲皮素等;花青素可以在花青素合成酶的作用下发生环裂变,生成槲皮素和山奈酚等黄酮醇;多甲氧基黄酮可以被双歧杆菌属(Bifidobacterium)和乳酸菌属(Lactobacillus)转化为羟基-O-去甲基橘皮素、去甲基橘皮素和3,4,5,6-四甲氧基苯甲酸等 [6,13-16] 。这些小分子代谢产物能进一步提高柑橘黄酮在人体内的吸收、代谢和生物活性。本文拟就近年来食品商业用菌、肠道菌群和酶对柑橘黄酮的生物转化途径及其不同代谢物功能活性的相关研究进行梳理,以期为深入研究柑橘黄酮的生物转化及新型功能食品开发提供理论依据。
1 柑橘黄酮的化学结构及分类
柑橘黄酮是一类广泛存在于柑橘属植物中的苯-γ-吡喃酮衍生物,其基本结构为“黄烷核”骨架(C6-C3-C6),由两个芳香环(A 环和B 环)通过线性3-碳链(C 环)连接而成 [17] 。目前,已经鉴定出超过250 种柑橘黄酮,主要根据C 环的化学性质、取代方式、酚羟基位置和数量分为黄酮类(如野漆树苷、木犀草苷和地奥司明等)、黄烷酮(如橙皮苷、橙皮素、柚皮苷和柚皮素等)、黄酮醇(如芦丁、山奈酚和槲皮素等)、黄烷酮醇(二氢槲皮素和二氢山奈酚等)、花青素(如花翠素、矢车菊素-3-O-葡萄糖苷和飞燕草素葡萄糖苷等)和多甲氧基黄酮(川陈皮素、桔皮素和5-去甲川陈皮素等)(图1) [18,19] 。柑橘黄酮大多以结合型糖苷的形式存在,主要可分为新橙皮糖苷和芸香糖苷类。根据糖基与苷元的连接方式可分为黄酮氧苷和黄酮碳苷,其中O-糖苷的含量较高而C-糖苷含量较低。此外,不同糖单元间的连接方式(如α-1,2 或α-1,6)能够在一定程度上影响柑橘果实风味。例如,味苦的新橙皮糖苷(如柚皮苷和新圣草次苷)和不苦的芸香糖苷(如橙皮苷和圣草次苷)糖基部分分别通过α-1,2 和α-1,6 糖苷键连接1 分子葡萄糖和1 分子鼠李糖 [20] 。
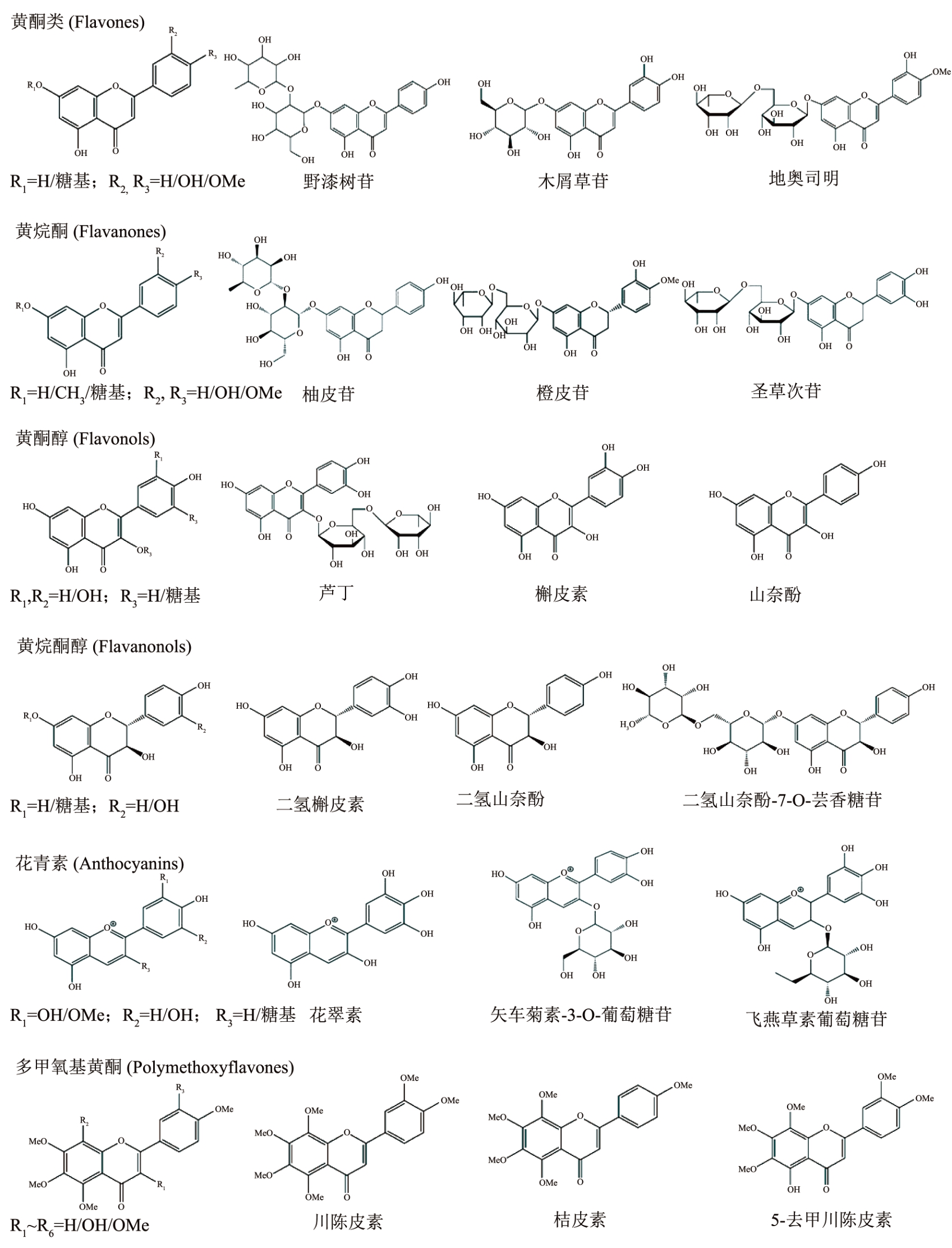
图1 柑橘黄酮的化学结构及分类
Fig.1 Chemical structures and classification of citrus flavonoids
柑橘中最主要的黄酮种类是黄烷酮和多甲氧基黄酮 [21] 。黄烷酮以2-苯基二氢色原酮为母核,在植物界中主要以配糖体形式存在,是柑橘黄酮中含量最丰富的一类,占比达95% [22] 。柑橘中最常见的黄烷酮有橙皮苷、橙皮素-7-O-葡萄糖苷、柚皮苷和柚皮素等 [23] 。不同柑橘品种和部位中黄烷酮的含量也具有很大差异,如柚类中含量最丰富的是柚皮苷 [24] ;葡萄柚中除了主要含有柚皮苷外,还有一定量的橙皮苷、圣草次苷、新橙皮苷和新圣草次苷等 [25] ;酸橙中含量最丰富的黄烷酮是柚皮苷和新橙皮苷;甜橙中则是柚皮芸香苷和橙皮苷;宽皮柑橘以橙皮苷和柚皮芸香苷为主,其中前者的含量远高于后者 [26] ;柑类中的‘瓯柑’与其他品种略有不同,主要含新橙皮苷以及一定量的香蜂草苷 [27] 。多甲氧基黄酮同样以苯色酮环为母核,其骨架上具有4 个或4 个以上甲氧基基团,是柑橘属植物的标志性化合物。目前已分离鉴定出20 余种多甲氧基黄酮,其中以川陈皮素、橘皮素以及甜橙黄酮最为常见。它们大量存在于柑橘油胞层中,而果肉或其他组织中仅有微量 [28] 。宽皮柑橘和‘瓯柑’果皮中含有较丰富的多甲氧基黄酮,而温州蜜柑中的含量较少 [29] 。
2 柑橘黄酮的体外发酵
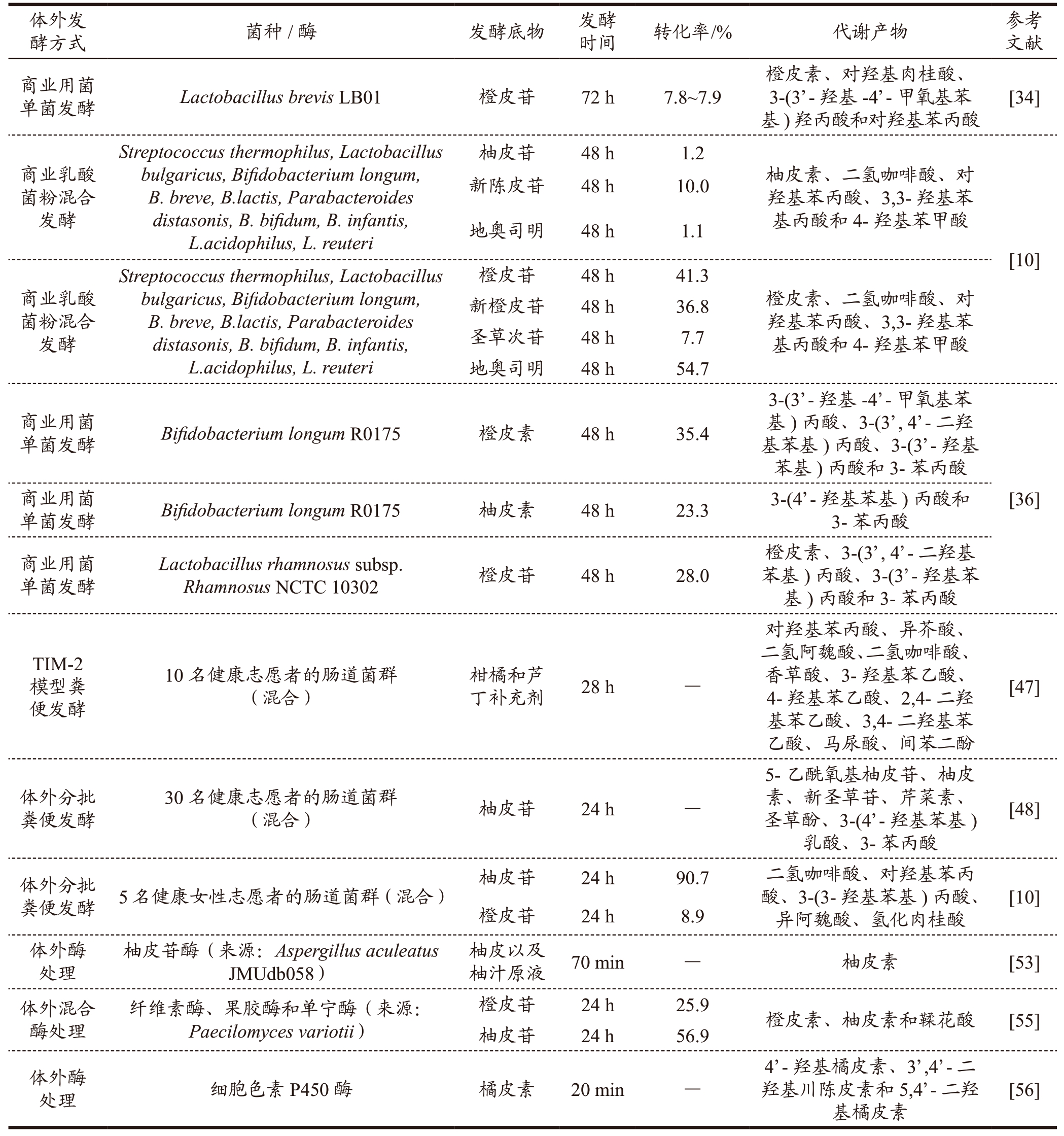
柑橘黄酮因其特殊的化学结构和代谢途径在开发利用的过程中受到许多限制。近年来,体外发酵技术逐渐成为一种重要的解决方案,通过将生物催化剂(如微生物和酶等)应用于体外环境下,模拟自然界中微生物代谢过程来实现柑橘黄酮的生产和生物转化,具有成本低、操作简单、特异性强、转化率高等诸多优势 [30] 。采用体外发酵方式生物转化柑橘黄酮不仅能够选择特定的微生物或酶进行定向水解,还可以探索黄酮类化合物在人体结构中可能的代谢途径及其益生潜能,为柑橘黄酮的生物功能研究提供更多的思路和方法。目前有许多研究针对不同的柑橘黄酮,利用体外发酵方式,探究了其相应的代谢途径和产物(见表1)。
表1 体外发酵对柑橘黄酮的转化过程和代谢产物的影响
Table 1 Effects of in vitro fermentation on the transformation process and metabolites of citrus flavonoids
?
2.1 商用益生菌对柑橘黄酮的生物转化
柑橘黄酮的生物活性主要是通过肠道菌群的代谢转化发挥作用。事实上,超过90%的天然黄酮都以糖苷的形式存在,且仅有摄入剂量的30%能够从人体胃肠道吸收并进入循环系统 [31] 。尽管经肠道菌群转化后的生物利用率和功能活性得到了提高,但仍存在含量低、体内转化不充分、个体差异大等问题,极大地限制了其临床应用 [32] 。微生物转化可通过羟基化、脱氢、O-甲基化、去甲基化、环裂变和双键还原等反应产生一系列柑橘黄酮代谢产物,使其在血浆中的浓度达到母体化合物的2~5 倍以上 [33] 。因此,利用商用益生菌对黄酮类化合物进行修饰改性并探究其生物转化途径成为近年来的研究热点 [34,35] 。相较于传统化学合成法或酶法发酵,商业用菌有更高的选择性、更优的产量和纯度、更易操作和实现大规模生产。常用于转化柑橘黄酮的商用细菌包括乳杆菌属(Lactobacillus)、双歧杆菌属(Bifidobacterium)和芽孢杆菌属(Bacillus)等,真菌主要包括链霉菌属(Streptomyces)、曲霉属(Aspergillus)和小克银汉霉属(Cunninghamella)等 [34-37] 。Guo 等 [34] 通过体外实验评估了5 种乳酸菌对橙皮苷和芸香柚皮苷的代谢能力。结果表明,L. brevis LB01 可将橙皮苷降解为橙皮素、对羟基肉桂酸、3-(3’-羟基-4’-甲氧基苯基)羟丙酸和对羟基苯丙酸。唐溶雪 [10] 利用商业乳酸菌粉(包括Streptococcus thermophilus、B. lactis和L. acidophilus 等10 种乳酸菌)进行了蜜柚、金桔和脐橙的厌氧发酵。液相色谱-飞行时间质谱分析显示,酚类化合物会经历环裂变、去甲基、脱羟基及侧链缩短等多种化学反应,近一步转化为二氢咖啡酸、对羟基苯丙酸、3,3-羟基苯基丙酸和4-羟基苯甲酸等小分子酚类化合物。Gema 等 [36] 通过体外实验检测了L. rhamnosus 和B. longum 对橙皮素和柚皮素的代谢能力。结果表明,这两种商用益生菌均能使橙皮素和柚皮素发生环裂变、去甲基化和去羟基化反应,进一步转化为生物利用率、极性和生物活性更高的苯丙酸。橘皮素和甜橙素是蜜桔或其他种类柑橘皮中目前发现的主要的两种多甲氧基黄酮,它们在A. niger 转化下能够生成含量较高的4’-羟基-5,6,7,3’-四甲氧基黄酮和4’-羟基橘皮素 [37] 。虽然商业微生物菌株的生物转化能力受到多种外界条件限制,但通过优化发酵条件、菌种筛选和代谢工程等手段,可以提高代谢物的产量和纯度,实现大规模生产,具有较高的经济效益。此外,商用微生物发酵具有环保和可持续发展的优势,可以有效避免天然资源枯竭和环境污染等问题,具有良好的应用前景 [33-35] 。
2.2 肠道菌群对柑橘黄酮的生物转化
柑橘黄酮在人体内发挥作用与肠道菌群的生物转化密切相关 [2,3,36,38] 。传统研究肠道菌群对柑橘黄酮的生物转化主要通过动物或人体模型,虽然该方法能提供精准的结果,但存在价格昂贵、操作复杂,同时还涉及伦理道德等问题。近年来,利用微生物体外转化模型模拟体内代谢过程、预测食物基质的释放等已经广泛应用到柑橘黄酮的研究中 [34,39,40] 。肠道菌群对柑橘黄酮的转化类型一般包括去糖基化、去甲基化、脱羟基化、还原以及环裂变等,其中参与O-去糖基化反应的菌群主要有双歧杆菌属(Bifidobacterium)及乳杆菌属(Lactobacillus)等;参与黄酮-C-糖苷的分解的菌群包括毛螺菌科(Lachnospiraceae)、肠球菌科(Enterococcaceae)和链球菌科(Streptococcaceae)等;参与去甲基或脱羟基化的菌群有真杆菌属(Eubacterium)、伊格尔兹氏属(Eggerthella)、乳杆菌属(Lactobacillus)、链球菌属(Streptococcus) 和梭状芽胞菌属(Clostridium)等 [41-46] 。
研究表明,柑橘黄酮的体外生物转化模型主要包括直接使用粪便匀浆或从中分离的微生物来分批试验 [36] ,以及采用更具综合性的体外模型,如第二代无溢出肠道模型(TIM-2)和人肠道菌群生态系统模拟体系 [47] 。借助这些模型研究发现,在肠道菌群发酵过程中,橙皮苷和柚皮苷首先被转化为相应的苷元(橙皮素和柚皮素)。随后,苷元型黄酮代谢为多种酚类物质,包括异阿魏酸、二氢咖啡酸、氢基肉桂酸、对羟基苯丙酸、4-羟基苯乙酸、橙皮素、间苯二酚、间苯三酚、2,4-二羟基苯乙酸、柚皮素、4-羟基苯甲酸、间苯三酚、间苯三甲酸、原儿茶酸、香兰素酸、咖啡酸、异芥酸、马尿酸等 [36,47,48] 。Chen 等通过体外发酵实验发现,柚皮苷在肠道菌群的作用下同时发生去甲基化、C 环裂解和去羟基化反应,生成5-乙酰氧基柚皮苷、柚皮素、新圣草苷、芹菜素、圣草酚、3-(4’-羟基苯基)乳酸、3-苯丙酸。大量研究表明,体外肠道菌群发酵柚皮素很可能通过环裂变反应产生3-(4’-羟苯基)丙酸,该酸被脱羟基并主要转化为3-苯丙酸。橙皮素的转化途径可能为:先经环裂变生成二氢异阿魏酸,接着去甲基化生成二氢咖啡酸,继而经过连续的脱羟基反应,依次转变为3-(3’-羟基苯基)丙酸和3-苯丙酸,并进一步转化成3’-羟基马尿酸和马尿酸。橙皮素的体外降解还产生了大量的3-苯丙酸和少量的4-羟基苯乙酸。与柚皮素的代谢产物相同,它们可以进一步转化为4’-羟基马尿酸 [6] 。因此,通过体外消化模型研究肠道菌群对柑橘黄酮的代谢转化,具有很好的生理相关性和个性化医疗潜力,有助于新型柑橘黄酮产品的研发和功能性评价,应用前景广泛。
2.3 酶对柑橘黄酮的生物转化
体外发酵转化的本质实际上是外源性底物在生物体系中酶制剂的催化作用下进行的代谢反应 [49] 。酶法转化黄酮糖苷的优势在于反应条件温和、催化效率高、选择性好、催化过程清晰和产物单一等。然而,有限的代谢产物和纯化酶的高成本使其应用受限。在商业上常通过重组和结构修饰等手段来提高酶对底物的转化效率,从而达到减少时间和降低生产成本的目的 [50] 。目前研究黄酮类化合物的酶解主要利用糖苷酶定向修饰各类糖苷键,实现由低活糖苷向高活苷元的转化。其中微生物中的主要存在的糖苷酶有β-糖苷酶、柚苷酶、橙皮苷酶、纤维素酶和果胶酶等,这些糖苷酶作用底物谱广,可同时水解多种黄酮糖苷 [51] 。研究表明,柚皮苷(苦味物质)能在柚苷酶体系中的α-L-鼠李糖苷酶的作用下被分解为柚皮素-7-O-葡萄糖苷(无苦但有涩味)和鼠李糖,再经β-D-葡萄糖苷酶降解为葡糖糖及柚皮素(无味),从而实现脱苦 [52] 。陈红等 [53] 用Aspergillus aculeatus JMUdb058 发酵得到柚苷酶,并研究其在去除柑橘果汁中的苦味方面的效果。结果显示该酶能够高效水解柑橘果汁中的柚皮苷,去除率达到了99.6%。橙皮苷酶通过裂解橙皮苷的鼠李糖基团以产生橙皮苷-7-O-葡萄糖苷来增加其亲脂性。郑美瑜等 [54] 发现经橙皮苷酶处理后的橙皮苷降解率大约为50%,而经柚苷酶处理过的柚皮苷则可以实现彻底降解,这是由于橙皮苷的水溶性远不如柚皮苷。而利用从Paecilomyces variotii 中分离出来的单宁酶能够水解柑橘中黄烷酮糖苷的酯键。Jose 等 [55] 同时采用纤维素酶、果胶酶和单宁酶从巴西柑橘渣中提取和转化柑橘黄酮,发现在40 ℃和200 r/min 条件下,使用5.0 U/mL 的纤维素酶和7.0 U/mL 的单宁酶,得到橙皮素、柚皮素和鞣花酸的最高产量分别为120、80 和11 250 µg/g。此外,可采用体外实验来评估微粒体酶在柑橘黄酮生物转化中的作用。橘皮素和细胞色素P450 酶共同放置在未诱导的和多氯联苯诱导的大鼠肝微粒体中孵育,在羟基化和去甲基化反应的作用下,发现橘皮素主要产生三种可能的代谢产物,分别是4’-羟基橘皮素、3’,4’-二羟基川陈皮素和5,4’-二羟基橘皮素 [56] 。酶法生物转化柑橘黄酮可以通过选择性酶的作用,在柑橘黄酮结构中引入不同的官能团,生成新型化合物,在食品、医药、保健品等领域具有广泛的应用前景。
3 生物转化对柑橘黄酮功能活性的影响
3.1 抗氧化活性
柑橘黄酮具有双芳环联结的基本骨架,其分子中心的α、β-不饱和吡喃酮被广泛认为是抵御机体氧化应激的关键。现代流行病学研究证实,氧化应激与诸多人体慢性疾病如心血管疾病、神经性退行疾病和癌症等的发生密切相关 [57] 。因此柑橘黄酮可以预防多种外界化学物质、氧化剂和毒素对机体造成损伤,从而降低相关疾病的发生率。研究表明,柑橘黄酮主要通过直接清除自由基、上调抗氧化酶含量以及螯合变价金属离子三种方式来实现抗氧化功能 [10] 。其抗氧化能力的大小取决于分子结构(糖苷或苷元形式)、游离的羟基以及最终酯化羟基的数量和位置等 [22] 。橙皮苷和柚皮苷是天然存在于柑橘属植物中的两类高浓度糖苷黄烷酮,当它们转变为相应的苷元形式(橙皮素和柚皮素)时才具有更高的生物利用度和功能活性。Madeira 等 [55] 研究发现橙皮素和柚皮素的体外抗氧化能力明显强于它们的糖苷形式。Ruviaro 等 [58] 采用酶法将橙皮苷和柚皮苷分别转化为对应苷元,发现其氧自由基吸收能力分别提高了180%和115%,且代谢物具有更高的抗氧化活性和氧自由基清除能力,这主要归因于去糖基化作用消除了C-7 处的芸香糖苷,从而暴露出分子中的羟基基团,实现了氢原子的转移机制。这种转化使得活跃的自由基转化为低活的酚基自由基,提升了抗氧化功效。近年来,采用微生物发酵或酶法降解来提高黄酮类化合物抗氧化活性的研究受到广泛关注 [50,53,57,59] 。Madeira 等 [60] 利用Paecilomyces variotii 菌株固态发酵橙渣,发现单宁酶和植酸酶活性经发酵后分别达到最高值5 000 和350 U/gds。同时,橙渣的ABTS 自由基清除活性在酶促作用下提高了10 倍。Nakajima 等 [61] 在橙汁和酸橙汁中加入橙皮苷酶使橙皮苷脱糖基化后得到橙皮素,使得柑橘汁的总抗氧化活性显著提高。另一项体外研究发现,大鼠血清中提取的橙皮素代谢物,显示出比橙皮苷更强的抗氧化活性 [62] 。这是由于糖基化过程可能会使黄酮类化合物的某些关键结构发生变化。一般认为,B 环上的邻苯二酚羟基可能通过氢键作用赋予芳氧基自由基更高的稳定性,并参与电子位错,对黄酮类化合物的抗氧化能力起关键作用;与酮基共轭的C-2、C-3 双键负责B 环的电子位错;C 环上的3 位和A 环上的5、7、8 位增加羟基能够使抗氧化活性得到不同程度的提升 [22] 。
3.2 抗炎活性
炎症反应是机体受到不同因素刺激后引起的一系列综合生理反应,其表现为多种促炎基因的表达和促炎介质或细胞因子的生成,如白介素1β(IL-1β)、白介素6(IL-6)和肿瘤坏死因子α(TNF-α)等。这些炎症反应最终会导致细胞和组织的损伤 [63] 。许多体外研究已经评估了柑橘黄酮及其代谢产物的抗炎活性,发现它们可以通过抑制相关炎症信号通路的激活、减少炎症靶点如B 细胞核因子κ-轻链增强子(NF-κB)、环氧化酶-2(COX-2)和一氧化氮合成酶(iNOS)的产生,降低慢性炎症标志物,发挥抗炎效果 [64] 。橙皮苷及其苷元橙皮素主要通过抑制相互作用蛋白(Txnip)或NOD 样受体热蛋白结构域相关蛋白3(NLRP3)、丝裂原活化蛋白激酶(MAPK)和NF-κB 等炎症信号通路发挥抗炎作用 [65] 。据报道,橙皮素能使抗氧化酶血红素氧化酶-1(HO-1)的表达显著上调,抑制Txnip 的活化,阻碍NLRP3 与Txnip 和下游半胱氨酸天冬氨酸酶-1(Caspase-1)、凋亡相关斑点样蛋白(ASC)的相互结合,负调控炎症小体的激活,从而降低IL-1β 表达,实现抗炎作用 [66] 。此外,HO-1 还能提高硫氧还蛋白(Trx)的表达,通过促进Trx 和Txnip 的相互结合来降低Txnip 的表达,从而实现间接减少炎症小体的装配 [67] 。李荣等 [68] 研究了7,3’-二甲氧基橙皮素在佐剂性关节炎大鼠中的抗炎作用和机理。结果显示,该物质能抑制炎症介质的释放并加快抗炎细胞因子的生成,从而缓解大鼠的继发性炎症。多甲氧基黄酮同样具有突出的抗炎活性,已被证明在炎症和免疫调节疾病中发挥作用。Li 等 [69] 通过体外脂多糖(LPS)诱导的炎症细胞模型试验,发现川陈皮素及其代谢产物3’-去甲川陈皮素、4’-去甲川陈皮素及3,4-二去甲基川陈皮素能下调iNOS和COX-2 基因的表达,并对激活蛋白-1(AP-1)和环磷腺苷效应元件结合蛋白(CREB)的激活起抑制作用。此外,川陈皮素、橘皮素及其转化产物3,5,6,7,8,3’,4’-七甲氧基黄酮能降低促炎因子(如IL-1α、IL-1β、IL-6 和TNF-α 等)的表达 [70] 。
3.3 其他活性
柑橘黄酮及其代谢物还具有抗癌、抗病毒、抑菌和降脂等诸多功效 [69-71] 。研究表明橙皮苷、橘皮素、柚皮素和川陈皮素能够在一定程度上抑制各类癌细胞如胃癌细胞、皮肤癌细胞、肝癌细胞、结肠癌细胞和乳腺癌细胞等的增殖 [71,72] 。Gao 等 [73] 研究发现,经氧化损伤的人前列腺癌细胞在DNA 修复过程中,柚皮素能显著提高其中两个关键酶(8-氧代鸟嘌呤DNA 糖基化酶1 和DNA 聚合酶β)的mRNA 表达水平,这表明柚皮素能激活DNA 修复的碱基切除途径,从而降低前列腺细胞的癌变几率,预防癌症的发生。此外,多种苷元型柑橘黄酮如橙皮素、槲皮素、川陈皮素、柚皮素以及橘皮素等均被证实能以调控细胞周期的方式抑制癌细胞的增殖 [72-74] 。橙皮素通过下调周期蛋白依赖性激酶(CDK2/4)和G1/S-特异性周期蛋白D(Cycling D)的表达量,同时上调细胞周期抑制蛋白p21 的表达,来阻滞细胞周期 [75] 。在抗病毒活性方面,黄酮苷元槲皮素和橙皮素被发现能够抑制脊髓灰质炎病毒、单纯疱疹病毒、副流感病毒和合胞病毒的感染和复制 [76] 。根据黄酮的构效关系,C-3 位羟基化是柑橘黄酮抗病毒活性的先决条件。例如,4’-羟基-3-甲氧基黄酮能够降低脊髓灰质炎病毒和鼻病毒的活性,且4’-羟基-3-甲氧基基团还被证明与甲氧基黄酮的抗小核糖核酸病毒活性有关 [77] 。据报道,一些多甲氧基黄酮能显著抑制肿瘤坏死因子-α(TNF-α)在细菌LPS 诱导下的表达。橙皮苷被发现可以减少LPS 诱导的TNF-α 的生成,从而预防感染引起的休克。此外,其代谢产物橙皮素对Salmonella typhi 和S. typhimurium 也具有一定的抗菌活性 [78] 。在预防肥胖和降脂方面,柚皮素能抑制高脂饮食造成的巨噬细胞浸润到脂肪细胞,从而抑制肥胖 [79,80] 。Sui等 [79] 发现柚皮素可以显著降低肥胖小鼠的8-异前列腺素水平、脂肪重、肝重、肝脏组织中总胆固醇和甘油三酯水平、血浆胰岛素水平以及低密度脂蛋白胆固醇水平。柚皮素通过AMPK(腺苷酸活化蛋白激酶)途径抑制了胆固醇调节元件结合蛋白(SREBP)、前蛋白转化酶枯草溶菌素9(PCSK9)和低密度脂蛋白(LDLR)的表达,从而降低肥胖小鼠的体重。Kurowska 等 [80] 研究发现高胆固醇血症仓鼠摄入含有1%的多甲氧基化黄酮饮食后,血清中总胆固醇、极低密度脂蛋白和低密度脂蛋白胆固醇的水平显著降低,血清甘油三酯水平也略微降低。多甲氧基化黄酮代谢物在肝脏中水平的升高是其发挥降血脂作用的关键原因。
4 总结与展望
柑橘黄酮来源广泛,种类丰富,可以预防和改善与氧化应激、炎症、癌细胞增殖和脂质积累等造成的健康问题。然而,大部分柑橘黄酮以与单、双、三糖结合的形式存在,其较低的溶解性和生物利用度限制了柑橘黄酮的应用。研究发现,体外转化技术不仅能对柑橘黄酮的特定分子结构进行定向修饰,改变其理化性质,提高其在人体内的吸收度,而且能通过取代基团在位置和数目上的变化,增强其部分功能活性。同时,体外生物转化技术还具有成本低、操作简单、转化率高和特异性强等诸多优点。因此,针对不同类别的柑橘黄酮,探究各类生物催化剂对其代谢途径、最终产物以及功能活性的影响具有重要意义。然而,体外生物转化技术仍然存在代谢过程中酶催化条件和稳定性有待提高、柑橘黄酮代谢物作用机制及靶向通路不够明确、代谢产物的商业化推广应用亟需拓宽等诸多问题。开展柑橘黄酮理化性质、结构特征和代谢途径研究,将有助于推动柑橘黄酮生物转化技术的发展与成熟,为其在功能食品和生物医药领域的推广应用提供新的途径。
[1] SAINI R K, RANJIT A, SHARMA K, et al. Bioactive compounds of citrus fruits: A review of composition and health benefits of carotenoids, flavonoids, limonoids, and terpenes [J] .Antioxidants, 2022, 11(2): 239.
[2] ZHANG M, ZHU S, YANG W, et al. The biological fate and bioefficacy of citrus flavonoids: Bioavailability,biotransformation, and delivery systems [J] . Food &Function, 2021, 12(8): 3307-3323.
[3] WANG M, ZHAO H, WEN X, et al. Citrus flavonoids and the intestinal barrier: Interactions and effects [J] .Comprehensive Reviews in Food Science and Food Safety,2021, 20(1): 225-251.
[4] 李阳,曹婷,安琪,等.柑橘中黄酮类化合物的提取技术,功能特性及应用研究进展 [J] .食品工业科技,2022, 43(9):439-446.
[5] MULVIHILL E E, BURKE A C, HUFF M W. Citrus flavonoids as regulators of lipoprotein metabolism and atherosclerosis [J] . Annual Review of Nutrition, 2016, 36:275-299.
[6] KAY C D, PEREIRA-CARO G, LUDWIG I A, et al.Anthocyanins and flavanones are more bioavailable than previously perceived: A review of recent evidence [J] .Annual Review of Food Science & Technology, 2017,8(1): 155.
[7] 吴方,陈桂,曹政,等.糖基化黄酮类化合物与肠道菌群的相互作用影响机体健康的研究进展 [J] .中国临床新医学,2021,14(10):970-975
[8] DIAS M C, PINTO D C G A, SILVA A M S. Plant flavonoids: Chemical characteristics and biological activity [J] . Molecules, 2021, 26(17): 5377.
[9] 薛海洁,王颖,李春.植物天然产物的微生物合成与转化 [J] .化工学报,2019,70(10):3825-3835.
[10] 唐溶雪.柑橘多酚体外发酵与生物转化应用研究 [D] .南昌:南昌大学,2021:7-15.
[11] TANG R, YU H, QI M, et al. Biotransformation of citrus fruits phenolic profiles by mixed probiotics in vitro anaerobic fermentation [J] . LWT-Food Science and Technology, 2022, 160: 113087.
[12] KIMOTO-NIRA H, MORIYA N, NOGATA Y, et al.Fermentation of Shiikuwasha (Citrus depressa Hayata)pomace by lactic acid bacteria to generate new functional materials [J] . International Journal of Food Science &Technology, 2019, 54(3): 688-695.
[13] SOVA M, SASO L. Natural sources, pharmacokinetics,biological activities and health benefits of hydroxycinnamic acids and their Metabolites [J]. Nutrients, 2020, 12(8): 2190.
[14] DUQUE-SOTO C, QUIRANTES-PINÉ R, BORRÁSLINARES I, et al. Characterization and influence of static in vitro digestion on bioaccessibility of bioactive polyphenols from an olive leaf extract [J] . Foods, 2022,11(5): 743.
[15] RECHNER A R, KUHNLE G, BREMNER P, et al. The metabolic fate of dietary polyphenols in humans [J] . Free Radical Biology and Medicine, 2002, 33(2): 220-235.
[16] ZHAO C, WANG F, LIAN Y, et al. Biosynthesis of citrus flavonoids and their health effects [J] . Critical Reviews in Food Science and Nutrition, 2020, 60(4): 566-583.
[17] 李萌茹,周玉枝,杜冠华,等.中药黄酮类化合物抗衰老作用及其机制研究进展 [J] . 药学学报,2019,54(8):1382-1391.
[18] WANG F, CHEN L, CHEN H, et al. Analysis of flavonoid metabolites in citrus peels (Citrus reticulata“Dahongpao”) using UPLC-ESI-MS/MS [J] . Molecules,2019, 24(15): 2680.
[19] SHAKOUR Z T A, FAYEK N M, FARAG M A. How do biocatalysis and biotransformation affect citrus dietary flavonoids chemistry and bioactivity? A review [J] . Critical Reviews in Biotechnology, 2020, 40(5): 689-714.
[20] 张海朋,彭昭欣,石梅艳,等.柑橘果实风味组学研究进展 [J] .华中农业大学学报,2021,40(1): 32-39.
[21] DI DONNA L, TAVERNA D, MAZZOTTI F, et al.Comprehensive assay of flavanones in citrus juices and beverages by UHPLC-ESI-MS/MS and derivatization chemistry [J] . Food Chemistry, 2013, 141(3): 2328-2333.
[22] TRIPOLI E, LA GUARDIA M, GIAMMANCO S, et al.Citrus flavonoids: Molecular structure, biological activity and nutritional properties: A review [J] . Food Chemistry,2007, 104(2): 466-479.
[23] M’HIRI N, IOANNOU I, GHOUL M, et al. Phytochemical characteristics of citrus peel and effect of conventional and nonconventional processing on phenolic compounds: A review [J] . Food Reviews International, 2017, 33(6): 587-619.
[24] 程丽萍.柑橘药用资源枳雀功能成分及药用价值挖掘与机制研究 [D] .武汉:华中农业大学,2020.
[25] 张桂伟.中国主栽葡萄柚果实不同部位酚类物质组成及其抗氧化活性研究 [D] .重庆:西南大学,2015.
[26] 黄爱华,曹骋,曾元儿,等.HPLC法测定不同规格酸橙枳实中新橙皮苷和柚皮苷的含量 [J] .药物分析杂志,2009,9:1448-1450.
[27] 朱泰霖,王慧心,陈杰标,等.不同品种柑橘果实的类黄酮分离纯化及其抗氧化活性研究 [J] .浙江大学学报(农业与生命科学版),2021,47(6):704-718.
[28] CHEN J J, ZHANG H Y, PANG Y B, et al. Comparative study of flavonoid production in lycopene-accumulated and blonde-flesh sweet oranges (Citrus sinensis) during fruit development [J] . Food Chemistry, 2015, 184: 238-246.
[29] 王岳.柑橘果实多甲氧基黄酮分离纯化及其抗氧化能力研究 [D] .杭州:浙江大学,2020.
[30] SHANU-WILSON J, EVANS L, WRIGLEY S, et al.Biotransformation: Impact and application of metabolism in drug discovery [J] . ACS Medicinal Chemistry Letters,2020, 11(11): 2087-2107.
[31] GONZALES G B, SMAGGHE G, GROOTAERT C, et al. Flavonoid interactions during digestion, absorption,distribution and metabolism: a sequential structureactivity/property relationship-based approach in the study of bioavailability and bioactivity [J] . Drug Metabolism Reviews, 2015, 47(2): 175-190.
[32] 田浩,陆露,王剑文.活性黄酮类成分生物转化的研究进展 [J] .抗感染药学,2013,10(4):246-250.
[33] NIELSEN I L F, CHEE W S S, POULSEN L, et al.Bioavailability is improved by enzymatic modification of the citrus flavonoid hesperidin in humans: a randomized,double-blind, crossover trial [J] . The Journal of Nutrition,2006, 136(2): 404-408.
[34] GUO X, GUO A, LI E. Biotransformation of two citrus flavanones by lactic acid bacteria in chemical defined medium [J] . Bioprocess and Biosystems Engineering,2021, 44(2): 235-246.
[35] BORZOVA N, GUDZENKO O, VARBANETS L. α-Lrhamnosidase from Penicillium tardum and Its Application for Biotransformation of Citrus Rhamnosides [J] . Applied Biochemistry and Biotechnology, 2022, 194(10): 4915-4929.
[36] PEREIRA-CARO G, FERNÁNDEZ-QUIRÓS B,LUDWIG I A, et al. Catabolism of citrus flavanones by the probiotics Bifidobacterium longum and Lactobacillus rhamnosus [J] . European Journal of Nutrition, 2018, 57(1):231-242.
[37] BUISSON D, QUINTIN J, LEWIN G. Biotransformation of poly methoxylated flavonoids: access to their 4’-O-demethylated Metabolites [J] . Journal of Natural Products, 2007, 70(6): 1035-1038.
[38] STEVENS Y, RYMENANT E V, GROOTAERT C, et al.The intestinal fate of citrus flavanones and their effects on gastrointestinal Health [J] . Nutrients, 2019, 11(7): 1464.
[39] LABIB S, ERB A, KRAUS M, et al. The pig caecum model: a suitable tool to study the intestinal metabolism of flavonoids [J] . Molecular Nutrition & Food Research,2004, 48(4): 326-332.
[40] BURAPAN S, KIM M, HAN J. Demethylation of polymethoxyflavones by human gut bacterium, Blautia sp. MRG-PMF1 [J] . Journal of Agricultural and Food Chemistry, 2017, 65(8): 1620-1629.
[41] BRAUNE A, BLAUT M. Bacterial species involved in the conversion of dietary flavonoids in the human gut [J] . Gut Microbes, 2016, 7: 216-234.
[42] PARAISO IL, PLAGMANN LS, YANG L, et al. Reductive metabolism of xanthohumol and 8-prenylnaringenin by the intestinal bacterium Eubacterium ramulus [J] . Molecular Nutrition & Food Research, 2019, 63: e1800923.
[43] YANG G, HONG S, YANG P, et al. Discovery of an enereductase for initiating flavone and flavonol catabolism in gut bacteria [J] . Nature Communication, 2021, 12: 790.
[44] MICHLMAYR H, KNEIFEL W. β-Glucosidase activities of lactic acid bacteria: mechanisms, impact on fermented food and human Health [J] . FEMS Microbiology Letters,2014, 352: 1-10.
[45] BRAUNE A, ENGST W, BLAUT M. Identification and functional expression of genes encoding flavonoid O-and C-glycosidases in intestinal bacteria [J] . Environ Microbiol, 2016, 18: 2117-2129.
[46] 于航,郑瑞芳,苏文灵,等.基于肠道菌的黄酮类成分代谢特征及药理学思考 [J] .药学学报,2021,56(7):1757-1768.
[47] GAO K, XU A, KRUL C, et al. Of the major phenolic acids formed during human microbial fermentation of tea, citrus, and soy flavonoid supplements, only 3,4-dihydroxyphenylacetic acid has antiproliferative activity [J] .The Journal of Nutrition, 2006, 136(1): 52-57.
[48] CHEN T, SU W, YAN Z, et al. Identification of naringin metabolites mediated by human intestinal microbes with stable isotope-labeling method and UFLC-Q-TOFMS/MS [J] . Journal of Pharmaceutical and Biomedical Analysis, 2018, 161: 262-272.
[49] 李咏梅,李晓眠,朱泽.苷类中药肠道细菌生物转化的研究进展 [J] .世界华人消化杂志,2008,16(19):2144-2148.
[50] 赵婧,王盼,刘彦楠,等.人参皂苷的定向生物转化研究进展 [J] .化工进展,2020,40(3):1238-1247.
[51] PARK C S, YOO M H, NOH K H, et al. Biotransformation of ginsenosides by hydrolyzing the sugar moieties of ginsenosides using microbial glycosidases [J] . Applied Microbiology and Biotechnology, 2010, 87(1): 9-19.
[52] RUVIARO A R, BARBOSA P P M, MACEDO G A.Enzyme-assisted biotransformation increases hesperetin content in citrus juice by-products [J] . Food Research International, 2019, 124: 213-221.
[53] 陈红,倪辉,李利君,等.棘孢曲霉固态发酵柚皮产柚苷酶及其在柑橘果汁脱苦中的应用 [J] .菌物学报,2013,32(6):1034-1045.
[54] 郑美瑜,陆胜民,陈剑兵,等.糖苷酶对橙皮苷和柚皮苷的酶解作用研究 [J] .中国食品学报,2010,1(4):141-146.
[55] MADEIRA JR J V, MACEDO G A. Simultaneous extraction and biotransformation process to obtain high bioactivity phenolic compounds from Brazilian citrus residues [J]. Biotechnology Progress, 2015, 31(5): 1273-1279.
[56] BREINHOLT V M, RASMUSSEN S E, BRØSEN K,et al. In vitro metabolism of genistein and tangeretin by human and murine cytochrome P450s [J] . Pharmacology& Toxicology, 2003, 93(1): 14-22.
[57] 蒋雪梅,陶彩云.神经退行性疾病和衰老的研究进展 [J] .现代医药卫生,2017,33(18):2802-2805.
[58] RUVIARO A R, BARBOSA P P M, MARTINS I M,et al. Flavanones biotransformation of citrus by-products improves antioxidant and ACE inhibitory activities in vitro [J] . Food Bioscience, 2020, 38: 100787.
[59] RADENKOVS V, JUHNEVICA-RADENKOVA K,GÓRNAŚ P, et al. Non-waste technology through the enzymatic hydrolysis of agro-industrial by-products [J] .Trends in Food Science & Technology, 2018, 77: 64-76.
[60] MADEIRA J V, Macedo J A, Macedo G A. A new process for simultaneous production of tannase and phytase by Paecilomyces variotii in solid-state fermentation of orange pomace [J] . Bioprocess and Biosystems Engineering,2012, 35(3): 477-482.
[61] NAKAJIMA V M, MADEIRA JR J V, MACEDO G A,et al. Biotransformation effects on anti lipogenic activity of citrus extracts [J] . Food Chemistry, 2016, 197: 1046-1053.
[62] YAMAMOTO M, JOKURA H, HASHIZUME K, et al.Hesperidin metabolite hesperetin-7-O-glucuronide, but not hesperetin-3’-O-glucuronide, exerts hypotensive,vasodilatory, and anti-inflammatory activities [J] . Food &Function, 2013, 4(9): 1346-1351.
[63] DONATO F, DE GOMES M G, GOES A T R, et al.Hesperidin exerts antidepressant-like effects in acute and chronic treatments in mice: possible role of l-arginine-NO-cGMP pathway and BDNF levels [J] . Brain Research Bulletin, 2014, 104: 19-26.
[64] ZHENG Y, ZHANG Y, LI Z, et al. Design and synthesis of 7-O-1, 2, 3-triazole hesperetin derivatives to relieve inflammation of acute liver injury in mice [J] . European Journal of Medicinal Chemistry, 2021, 213: 113162.
[65] 刘蕊,李晓丹.柑橘属黄酮类化合物橙皮苷和橙皮素的抗氧化和抗炎特性分子机制综述 [J] .中国医药导刊,2019,21(12):749-752.
[66] KIM S J, LEE S M. NLRP3 inflammasome activation in D-galactosamine and lipopolysaccharide-induced acute liver failure: role of heme oxygenase-1 [J] . Free Radical Biology and Medicine, 2013, 65: 997-1004.
[67] WANG C Y, XU Y, WANG X, et al. Dl-3-n-Butylphthalide inhibits NLRP3 inflammasome and mitigates Alzheimer’slike pathology via Nrf2-TXNIP-TrX axis [J] . Antioxidants &Redox Signaling, 2019, 30(11): 1411-1431.
[68] 李荣,李俊,石静波,等.7,3’-二甲氧基橙皮素对佐剂性关节炎大鼠免疫功能的影响 [J] .安徽医科大学学报,2012,47(9):1058-1062.
[69] LI S, SANG S, PAN M H, et al. Anti-inflammatory property of the urinary metabolites of nobiletin in mouse [J] . Bioorganic & Medicinal Chemistry Letters,2007, 17(18): 5177-5181.
[70] MANTHEY J A, GROHMANN K, MONTANARI A,et al. Polymethoxylated flavones derived from citrus suppress tumor necrosis factor-α expression by human monocytes [J] . Journal of Natural Products, 1999, 62(3):441-444.
[71] MANTHEY J A, GUTHRIE N. Antiproliferative activities of citrus flavonoids against six human cancer cell lines [J] .Journal of Agricultural and Food Chemistry, 2002, 50(21):5837-5843.
[72] MORLEY K L, FERGUSON P J, KOROPATNICK J.Tangeretin and nobiletin induce G1 cell cycle arrest but not apoptosis in human breast and colon cancer cells [J] .Cancer Letters, 2007, 251(1): 168-178.
[73] GAO K, HENNING S M, NIU Y, et al. The citrus flavonoid naringenin stimulates DNA repair in prostate cancer cells [J] . The Journal of Nutritional Biochemistry,2006, 17: 89-95.
[74] ABAZA M S I, ORABI K Y, AL-QUATTAN E, et al.Growth inhibitory and chemo-sensitization effects of naringenin, a natural flavanone purified from Thymus vulgaris, on human breast and colorectal cancer [J] . Cancer Cell International, 2015, 15(1): 1-19.
[75] 杨雪妍.柑橘黄酮抗氧化, 抗增殖及抗衰老活性研究 [D] .广州:华南理工大学,2020.
[76] MONTENEGRO-LANDÍVAR M F, TAPIA-QUIRÓS P,VECINO X, et al. Polyphenols and their potential role to fight viral diseases: An overview [J] . Science of the Total Environment, 2021, 801: 149719.
[77] GAO Z, GAO W, ZENG S L, et al. Chemical structures,bioactivities and molecular mechanisms of citrus polymethoxyflavones [J] . Journal of Functional Foods,2018, 40: 498-509.
[78] IRANSHAHI M, REZAEE R, PARHIZ H, et al. Protective effects of flavonoids against microbes and toxins: The cases of hesperidin and hesperetin [J] . Life Sciences, 2015,137: 125-132.
[79] SUI G G, XIAO H B, LU X Y, et al. Naringin activates AMPK resulting in altered expression of SREBPs, PCSK9,and LDLR to reduce body weight in obese C57BL/6J mice [J] . Journal of Agricultural and Food Chemistry, 2018,66(34): 8983-8990.
[80] KUROWSKA E M, MANTHEY J A. Hypolipidemic effects and absorption of citrus polymethoxylated flavones in hamsters with diet-induced hypercholesterolemia [J] .Journal of Agricultural and Food Chemistry, 2004, 52(10):2879-2886.