荔枝(Litchi chinensis)是一种广泛种植于全球热带至亚热带地区的水果作物,中国、泰国、印度以及越南等亚洲国家是荔枝的主要产区 [1] 。荔枝是非呼吸跃变型水果,成熟期集中,采后易腐败,不宜长期储藏 [2] 。开展荔枝加工可以缓解鲜销压力,并能够提升荔枝的经济附加值。荔枝加工主要集中于荔枝果肉,其果壳和果核则作为副产物被丢弃,造成一定的资源浪费与损失 [3] 。荔枝壳富含水溶性多糖以及黄酮、酚酸与原花青素等酚类活性物质,其中原花青素是荔枝果壳的重要活性成分,且构型以A 型为主 [4,5] 。前期研究表明荔枝壳具有抗氧化、抗炎以及美白等作用,可作为活性物质用于功能食品和日化产品开发 [6] 。
目前,原花青素传统的提取方法是乙醇浸提法,提取时间长、温度高,对原花青素的稳定性和化学组成有一定的影响,同时也会降低其生物活性 [7] 。低共熔溶剂(Deep Eutectic Solvent,DES)是由两种或以上的试剂分别以氢键供体(Hydrogenbond Donor,HBD)和氢键受体(Hydrogen-bond Acceptor,HBA)的形式在一定的温度下通过氢键作用结合形成的高粘度透亮的溶剂 [8] 。低共熔溶剂具有较强的穿透植物细胞壁能力,并且能与酚类、黄酮类物质形成氢键键合,增加生物活性物质的提取率 [9] 。此外,低共熔溶剂还能增强生物活性物质的抗菌、抗氧化等活性,改善生物活性物质的热稳定性和储藏稳定性 [10,11] 。因此,既能兼容安全性、环保性,又能保证提取效率的低共熔溶剂有望成为原花青素的理想提取溶剂 [12] 。目前,低共熔溶剂广泛应用于橄榄、马铃薯、甜菜根等原料的多酚和黄酮物质提取,而在原花青素的提取中应用还相对较少 [13] 。
本文通过对比4 种低共熔溶剂和70%(V/V)乙醇提取的荔枝壳原花青素的得率、平均聚合度、化学组成及抗氧化活性,筛选出最佳的低共熔溶剂。并进一步考察料液比、DES 摩尔比、DES 含水量、提取时间及提取温度5 个单因素对荔枝壳原花青素提取的影响,结合正交优化,明确荔枝壳原花青素的最佳提取工艺,并对提取物的抗氧化活性进行分析。旨在为荔枝壳原花青素的绿色高效提取制备和高值化利用提供理论依据和技术支撑。
1 材料与方法
1.1 主要材料与试剂
荔枝壳(妃子笑),采购于广东省广州市;氯化胆碱、1,3-丁二醇、4-二甲基氨基肉桂醛、香草醛,上海麦克林生化有限公司;尿素,天津市永大化学试剂有限公司;乳酸、甘油、无水乙醇,天津市富宇精细化工有限公司;无水甲醇,广东光华科技股份有限公司;磷酸氢二钠、亚硝酸钠,天津市福晨化学试剂有限公司;柠檬酸、过硫酸钾,天津市百世化工有限公司;福林酚试剂、荧光素钠、2,2’-偶氮二(2-甲基丙基咪)二盐酸盐(2,2’-Azobis(2-methylpropionamidine) Dihydrochloride,AAPH),美国Sigma 公司;氢氧化钠、三氯化铝(结晶),天津市大茂化学试剂厂;浓盐酸,广州化学试剂厂;2,2’-联氨-双-(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2’-Azino-bis (3-ethylbenzothiazoline-6-sulfonic Acid),ABTS),上海阿拉丁试剂有限公司;1,1-二苯-2- 苦基肼(2,2-Diphenyl-1-picrylhydrazyl,DPPH),上海源叶公司;高效液相色谱(High Performance Liquid Chromatography,HPLC) 级甲醇、乙酸和乙腈,Thermo Fisher Scientific 公司;没食子酸、低聚原花青素(UV ≥ 95%)、水溶性维生素E(Trolox)、原花青素B1、表儿茶素、芦丁、原花青素A2 以及山奈酚-3-O-芸香糖苷标准品购于上海源叶公司和Sigma 公司,其他试剂均为国产分析纯;蒸馏水。
1.2 主要仪器与设备
EYELAN-1100 旋转蒸发仪:东京理化器械株式会社;T25 digital 分散机:德国IKA 公司;Infinite M200pro 多功能酶标仪:瑞士Tecan 公司;LC-20 高效液相色谱仪、UV-1800 紫外可见分光光度计:日本岛津有限公司。
1.3 DES的制备
按照表1 的摩尔比分别称取一定质量的氢键受体和氢键供体于圆底烧瓶中,并放入在70 ℃水浴下旋蒸,直至形成透亮无晶体的粘稠溶液的状态,即得到DES-1~4。
表1 不同种类DES的配比
Table 1 Proportioning of different DESs

?
1.4 荔枝壳原花青素的提取
将1 g 荔枝壳(剪刀剪碎)分别加入30 mL 的体积分数均为70%(V/V)的DES 与乙醇溶剂当中,使其料液比为1:30(g/mL),在室温下通过8 000 r/min 分散机均质2 min 后,置于60 ℃水浴提取120 min。待提取完成后,冷却抽滤,除去荔枝壳渣,并旋蒸去除水分,最后用无水甲醇定容至50 mL,即得到荔枝壳提取液。
1.5 荔枝壳提取液组成成分测定
1.5.1 总酚的测定
采用福林酚方法 [14] 测定荔枝壳提取液的总酚含量。取125 μL 荔枝壳提取液与500 μL 蒸馏水和125 μL 福林酚试剂混匀,避光反应6 min,再加入1.25 mL 7%(m/V)的Na2CO3 避光反应90 min,在760 nm 处测其吸光值。以没食子酸为标准品制作标准曲线(0.03~0.30 mg/mL),荔枝壳提取液的总酚含量以每毫升提取液中所含没食子酸当量(Gallic Acid Equivalent,GAE)表示,即mg GAE/mL。
1.5.2 总黄酮的测定
采用NaNO2-AlCl3·6H2O-NaOH 方法 [15] 测定荔枝壳提取液的总黄酮含量。取300 μL 荔枝壳提取液与1.5 mL 蒸馏水和90 μL 5%(m/V)NaNO2试剂混匀,静置反应6 min,再加入180 μL 10%(m/V)的AlCl3·6H2O 静置反应5 min,最后加入600 μL 1 mol/L 的NaOH 和330 μL 蒸馏水后,在510 nm 处测其吸光值。以芦丁为标准品制作标准曲线(0.03~0.40 mg/mL),荔枝壳提取液的总黄酮含量以每毫升提取液中所含芦丁当量(Rutin Equivalent,RE)表示,即mg RE/mL。
1.5.3 原花青素含量的测定
采用4-二甲基氨基肉桂醛(DMAC)方法[16] 测定荔枝壳提取液的原花青素含量。取0.05 g DMAC 置于50 mL 含有12.5%(V/V)浓盐酸的70%(V/V)酸化乙醇溶液混匀,即为DMAC 反应液。依次取70 μL 荔枝壳提取液和210 μL DMAC 反应液加到96 孔板中,避光静置反应25 min,在640 nm 处测其吸光值。以酸化乙醇作试剂空白组;用无水甲醇作样品空白组。以原花青素标准品制作标准曲线(0.01~0.50 mg/mL),荔枝壳提取液的原花青素含量以每毫升提取液中所含原花青素标品当量(Procyanidins Equivalent,PE)表示,即mg PE/mL。
1.5.4 原花青素平均聚合度(mDP)的测定
根据魏冠红等 [17] 的方法测定荔枝壳提取液的平均聚合度。取一定量的荔枝壳提取液,分别用无水甲醇或者乙酸稀释至一定体积。其中用无水甲醇稀释的荔枝壳提取液来测定原花青素的质量,取0.5 mL 样液依次与3 mL 4 g/100 mL 的香草醛-甲醇溶液和1.5 mL 浓盐酸混匀,静置反应15 min,在500 nm处测其吸光值,并以无水甲醇作试剂空白组。以儿茶素标准品制作标准曲线(68.97~500.00 μg/mL),荔枝壳提取液的原花青素含量以每毫升提取液中所含儿茶素标品当量(Catechin Equivalent,CE)表示,即μg CE/mL。而用乙酸稀释的荔枝壳提取液来测定原花青素的物质的量,取1 mL 样液与5 mL 4% HCl(V/V)-0.5%香草醛(m/V)乙酸溶液混匀,静置反应5 min,在500 nm 处测其吸光值,并以0.5%(m/V)香草醛乙酸作试剂空白组。以儿茶素标准品制作标准曲线(0.07~0.35 μmol/mL),荔枝壳提取液的原花青素物质的量以每毫升提取液中所含儿茶素标品当量(Catechin Equivalent,CE)表示,即μmol CE/mL。其平均聚合度(Mean Degree of Polymerisation,mDP)计算公式为:
式中:
D ——原花青素平均聚合度(mDP);
m——原花青素的质量,μg CE/mL;
M——儿茶素的相对分子质量,为290;
n——原花青素物质的量,μmol CE/mL。
1.5.5 荔枝壳提取液中主要化学成分分析
采用HPLC 测定荔枝壳提取液中主要化学成分的组成成分及含量。色谱柱为ZORBAX SB-C18 column(250 mm×4.6 mm,5 µm);流动相A 相为0.1%乙酸水(V/V),B 相为乙腈;梯度洗脱程序如下:0~35 min,5%~32% B;35~40 min,32%~50% B;40~45 min,50%~60% B。检测波长为254 nm;流速为1 mL/min;柱温为40 ℃;进样量为10 µL。通过与原花青素B1、表儿茶素、芦丁、原花青素A2以及山奈酚-3-O-芸香糖苷等标准品的保留时间进行对比进行色谱峰的鉴定,化合物的含量则通过峰面积代入标准物质的标准曲线进行计算确定。
1.6 DES提取荔枝壳原花青素的单因素试验设计
在初始条件(料液比为1:30(g/mL)、DES 含水量为30%、DES 摩尔比为1:2、提取时间为120 min、提取温度为60 ℃)下,以提取物的原花青素含量为指标,采用控制变量法分别对料液比(1:10、1:20、1:30、1:40、1:50,g/mL)、DES 摩尔比(1:2、1:3、1:4、1:5、1:6)、DES 含水量(0%、15%、30%、50%、70%,V/V)、提取时间(30、60、90、120 min)以及提取温度(40、50、60、70 ℃)5 个因素进行单因素试验。
1.7 DES提取荔枝壳原花青素的正交试验设计
在1.6 单因素试验基础上,分别选取DES 摩尔比、DES 含水量、提取时间和提取温度,进一步研究4 个因素对荔枝壳原花青素提取含量的影响,采用L9(43)进行正交试验,因素水平见表2。
表2 正交试验因素与水平设计
Table 2 Orthogonal experimental design

?
1.8 抗氧化活性
1.8.1 ORAC抗氧化能力
根据卢琦等 [14] 的方法测定荔枝壳提取液的氧自由基吸收能力(Oxgen Radical Absorbance Capacity,ORAC)。以75 mmol/mL pH 值7.4 的磷酸盐缓冲液(Phosphate Buffered Saline,PBS)作为稀释液,将样品溶液稀释至一定体积,并取20 µL 加入黑色96 孔板中37 ℃孵育10 min,再加入200 µL 0.96 µmol/L 荧光素钠溶液37 ℃孵育20 min,最后,加入20 µL 119 mmol/L AAPH 自由基溶液(除空白孔外),并置于激发波长485 nm,发射波长520 nm 的酶标仪下测定各个孔的荧光值,每4.5 min 循环1 次,共循环35 次。以PBS 作为空白组,不同质量浓度水溶性维生素E(Trolox)标准品(6.25~50.00 µmol/L)制作标准曲线,计算提取液中的ORAC 值,结果以Trolox 当量表示,单位为µmol TE/ mL。
1.8.2 DPPH自由基清除能力
称取3.9 mg DPPH 溶解于100 mL 甲醇配制成0.1 mmol/L 的DPPH 工作液,并将样品配成不同体积的溶液。用移液枪移取100 µL 样品溶液与现配制的DPPH 工作液200 µL 充分混匀。常温避光反应30 min 后在517 nm 处测定吸光值A1(实验组),同时测定100 µL 样品溶液与200 µL 甲醇溶液的吸光值A2(实验空白组)以及100 µL 样品溶剂与200 µL DPPH 工作液的吸光值A0(空白对照组),根据以下公式(2)算出清除率(Clearance,C),结果以提取液中所含原花青素标品(Procyanidins Equivalent,PE)为当量,单位为µg PE/mL,用Graphpad Prism 7.0 软件求出IC50 值。
式中:
C1 ——DPPH 自由基清除率;
A0 ——空白对照组的吸光值;
A1——实验组的吸光值;
A2——实验空白组的吸光值。
1.8.3 ABTS+自由基清除能力
称取66.23 mg K2S2O8 溶解于100 mL 蒸馏水配制成2.45 mmol/L 的K2S2O8 溶液,再称取19.20 mg ABTS 溶解于5 mL 2.45 mmol/L 的K2S2O8 溶液制备成7 mmol/L ABTS 储备液。将适量的ABTS 储备液用10 mmol/L pH 值 8.0 的磷酸盐缓冲液稀释至在734 nm处的吸光值为(0.70±0.05),配制成ABTS 工作液。用移液枪移取不同体积的样品溶液50 µL 与现配制的ABTS 工作液200 µL 充分混匀。室温避光反应6 min 后在734 nm 处测定吸光值A1(实验组),同时测定50 µL 样品溶液与200 µL 磷酸盐缓冲溶液的吸光值A2(实验空白组)以及50 µL 样品溶剂与200 µL ABTS工作液的吸光值A0(空白对照组),根据以下公式(3)算出清除率(Clearance,C),结果以提取液中所含原花青素标品为当量,单位为µg PE/mL,用Graphpad Prism 7.0 软件求出IC50 值。
式中:
C2——ABTS+自由基清除率;
A0——空白对照组的吸光值;
A1——实验组的吸光值;
A2——实验空白组的吸光值。
1.9 数据分析
所有实验均重复三次,实验数据采用SPSS 19.0软件进行Duncan 检验和独立样本T 检验统计分析,采用Graphpad Prism 7.0 和Origin 2018 作图。定量数据采用“平均值±标准差”表示,不同字母表示存在显著性差异(P<0.05)。
2 结果与分析
2.1 DES种类筛选
不同DES 对荔枝壳多酚类物质的提取效果如表3 所示,提取液中原花青素含量DES-3>DES-2> DES-4>DES-1>70%(V/V)乙醇,其中DES-3提取的原花青素含量可达3.71 mg PE/mL,为70%(V/V)乙醇提取的1.3 倍。呈酸性的DES-2、DES-3、DES-4 比70%乙醇及碱性溶剂DES-1 拥有更高的极性,因此能与原花青素更稳定地结合,进而表现出更高的提取得率 [18] 。而DES-1 溶剂呈碱性,且原花青素在碱性条件下易降解,因此原花青素含量在四种低共熔溶剂中最低 [19] 。Zain 等 [20] 采用了6 种不同DES 提取油棕黄酮,发现氯化胆碱-丁二醇提取的油棕黄酮的含量最高。Wang 等 [21] 通过筛选9 种不同醇基、酸基与糖基的DES 提取槐花中的黄酮类物质,最终发现氯化胆碱-丁二醇为溶剂时提取槐花黄酮的效果最好。这可能因为以丁二醇为HBD 的DES 含有的羟基更多,流动性更好,且对活性物质的氢键结合作用更强的缘故 [22] 。此外,也考察了DES 提取对原花青素mDP的影响。从表3 中可以发现在DES 中,只有碱性DES-1 提取原花青素的mDP 显著低于乙醇提取。根据马烨 [23] 的研究表明,原花青素在pH 值大于7的碱性环境下的稳定性显著降低,多聚体的原花青素结构被破坏降解成低分子量物质,因而其原花青素的mDP 和提取得率都较低,所以DES-1 不适合荔枝壳原花青素的提取。
表3 不同溶剂提取荔枝壳原花青素的分析比较
Table 3 Analysis of litchi pericarp procyanidins extracted with different solvents
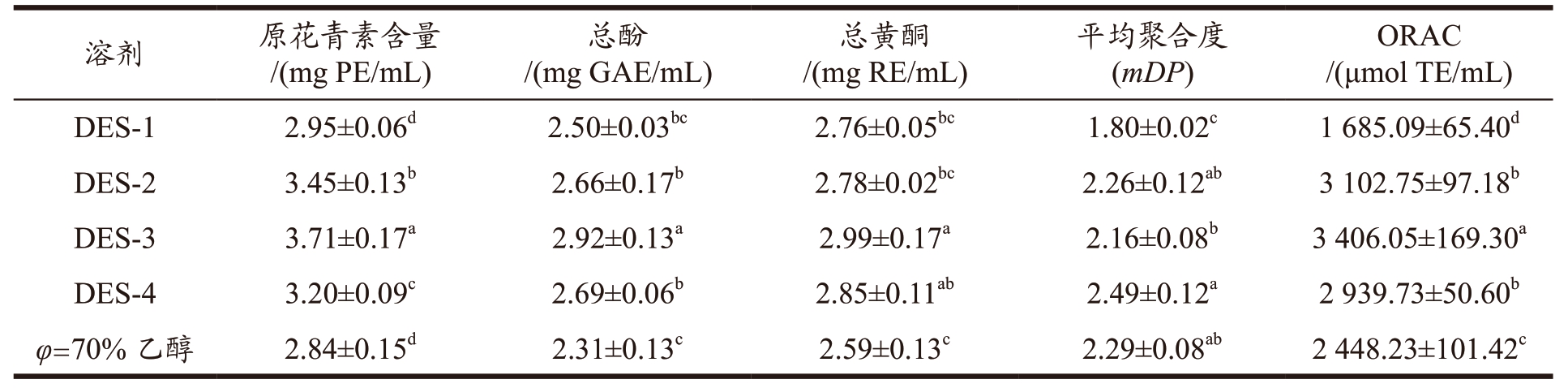
注:同列右肩不同的小写字母表示具有显著差异(P<0.05),下同;PE:原花青素当量,GAE:没食子酸当量,RE:芦丁当量,TE:Trolox 当量。
?
进一步比较了不同低共熔溶剂提取液中酚和黄酮的含量,DES-2、DES-3 和DES-4 提取液中的黄酮含量高于乙醇提取(P<0.05),而只有DES-3 提取液中的总酚含量(2.92 mg GAE/mL)显著高于乙醇提取液(P<0.05)。氧自由基清除能力结果表明三种低共熔溶剂提取液(DES-2、DES-3、DES-4)的ORAC 值显著高于乙醇提取(P<0.05),其中DES-3 的ORAC 活性最强(3 406.05 μmol TE/mL),而DES-1 的抗氧化能力显著低于乙醇提取液。结合不同溶剂提取液的原花青素、总酚、总黄酮含量和mDP 以及抗氧化活性结果可知,DES-3 最适合作为荔枝壳原花青素的提取溶剂。
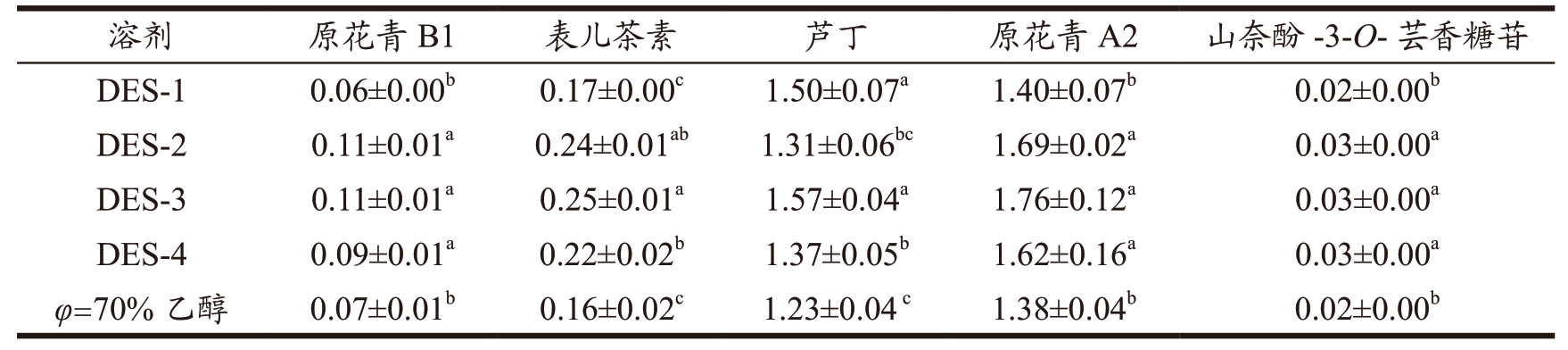
同时,通过HPLC 分析4 种DES 与70%(V/V)乙醇作为溶剂时提取物的化学组成,结果如图1 所示,4 种DES 与70%(V/V)乙醇提取物中的主要成分较为类似,主要色谱峰基本一致。通过比对酚类标准品的保留时间,鉴定出5 种单体物质,分别是原花青素B1、表儿茶素、芦丁、原花青素A2 以及山奈酚-3-O-芸香糖苷,与已报道的荔枝壳原花青素的主要化学成分结果一致 [24,25] 。进一步测定了5 种单体酚类的含量,结果表明(表4)5 种溶剂的提取物中均为原花青素A2 含量最高,其次是芦丁,山奈酚-3-O-芸香糖苷含量最少。杨丽珍 [25] 通过UPLC-Q-TOF/MS 分析鉴定出荔枝壳含有原花青素A2、儿茶素、山奈酚-3-O-葡萄糖苷、芦丁等12 种酚类物质,并也发现原花青素A2 的含量最高(96.04 mg/g)。此外,4 种DES 提取原花青素A2 与芦丁的能力都高于70%(V/V)乙醇,其中以DES-3 提取的能力最强。所以,DES-3 被选为后续的提取溶剂。
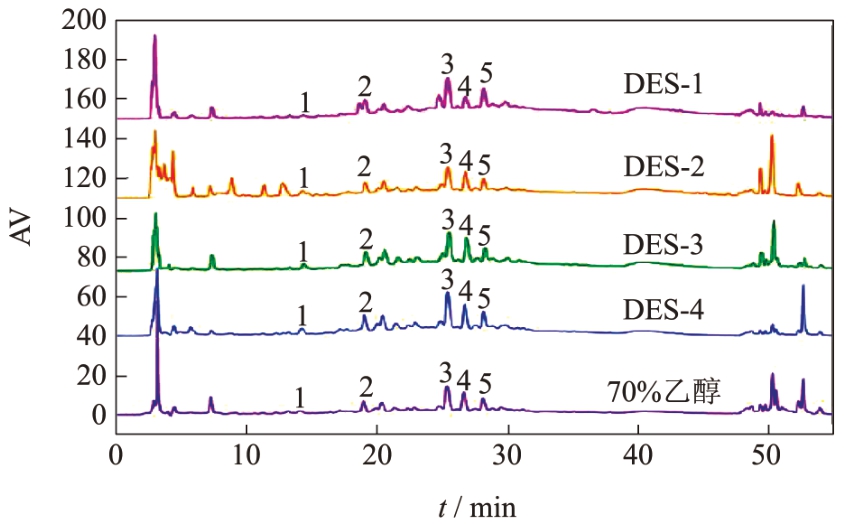
图1 不同溶剂提取荔枝壳原花青素的高效液相分析图
Fig.1 Liquid chromatogram of litchi pericarp procyanidins extracted with different solvents
注:1.原花青素B1;2.表儿茶素;3.原花青素A1;4.芦丁;5.山奈酚-3-O-芸香糖苷。
表4 不同溶剂提取荔枝壳原花青素的主要化学成分分析
Table 4 Chemical constituents of litchi pericarp procyanidins extracted with different solvents (mg/mL)
?
2.2 单因素试验结果
2.2.1 料液比对提取物中原花青素含量的影响
料液比不仅是影响提取原花青素的因素之一,还是提取工艺的成本优化的主要参数。结果如图2所示,料液比从1:10(g/mL)提高到1:30(g/mL)时,原花青素的提取含量呈增加趋势,达到显著水平(P<0.05)。但随着料液比进一步增大,荔枝壳原花青素提取含量呈下降趋势,这可能是由于过量地增加DES-3 量,DES-3 与原花青素的氢键作用减弱,反而使得原花青素提取含量下降 [26] 。但因料液比在1:20 与1:30(g/mL)的提取含量差异不显著(P<0.05),考虑成本节省,避免不必要的试剂浪费,故选择1:20 为最佳料液比。
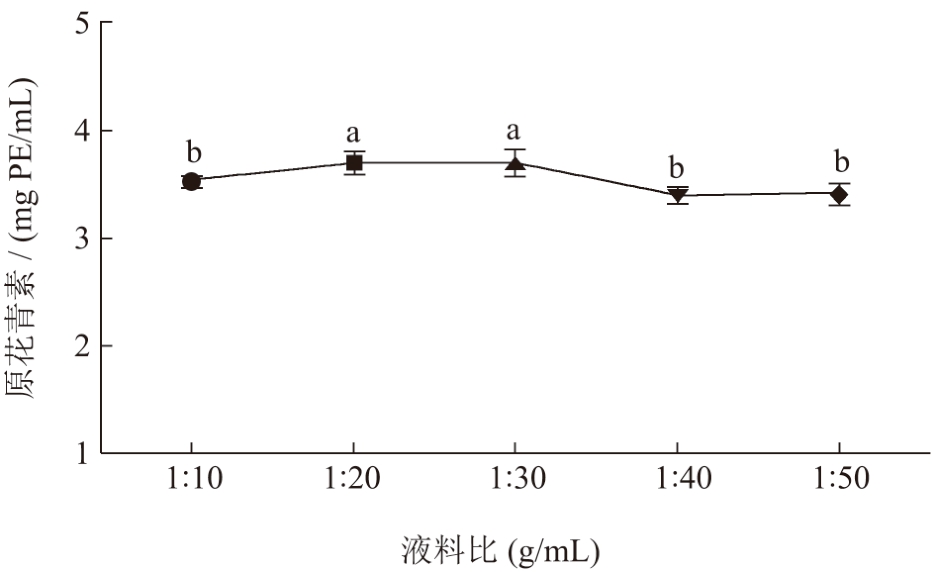
图2 料液比对提取物中原花青素含量的影响
Fig.2 Effect of material-liquid ratio on the content of procyanidins in extracts
2.2.2 DES摩尔比对提取物中原花青素含量的影响
DES 的HBD 与HBA 的选择能够直接决定其物理化学特性,所以HBD 与HBA 摩尔比能影响DES的分子性能 [27] 。如图3 所示,荔枝壳原花青素提取含量随着DES-3 摩尔比(HBA:HBD)的增加出现先上升后下降,当DES-3 摩尔比在1:4 时,荔枝壳原花青素提取含量为4.05 mg PE/mL,随着DES-3摩尔比的提高,DES-3 相互作用力的减弱,从而原花青素的提取量下降 [21] 。因此,选择DES-3 摩尔比的比值为1:3~1:5 间作为工艺优化范围。
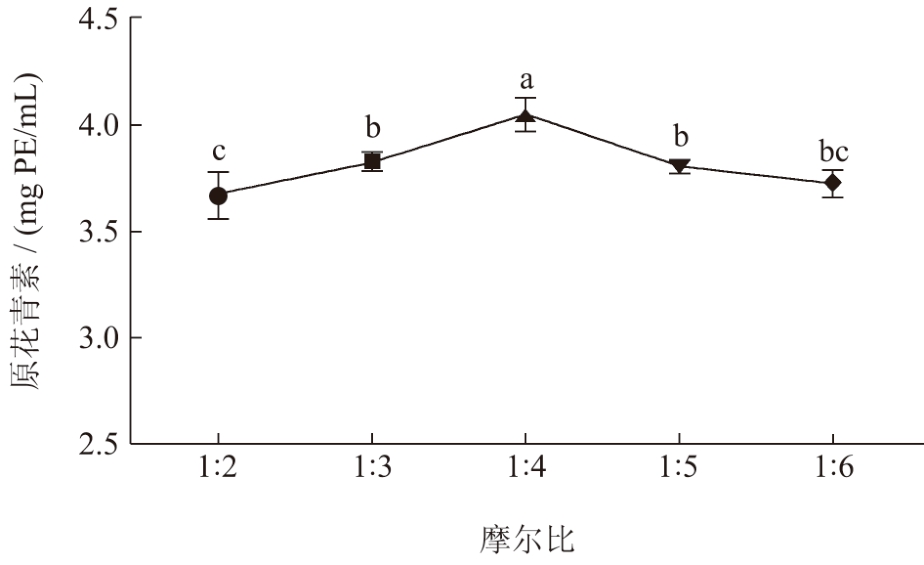
图3 DES 摩尔比对提取物中原花青素含量的影响
Fig.3 Effect of molar ratio on the content of procyanidins in extracts
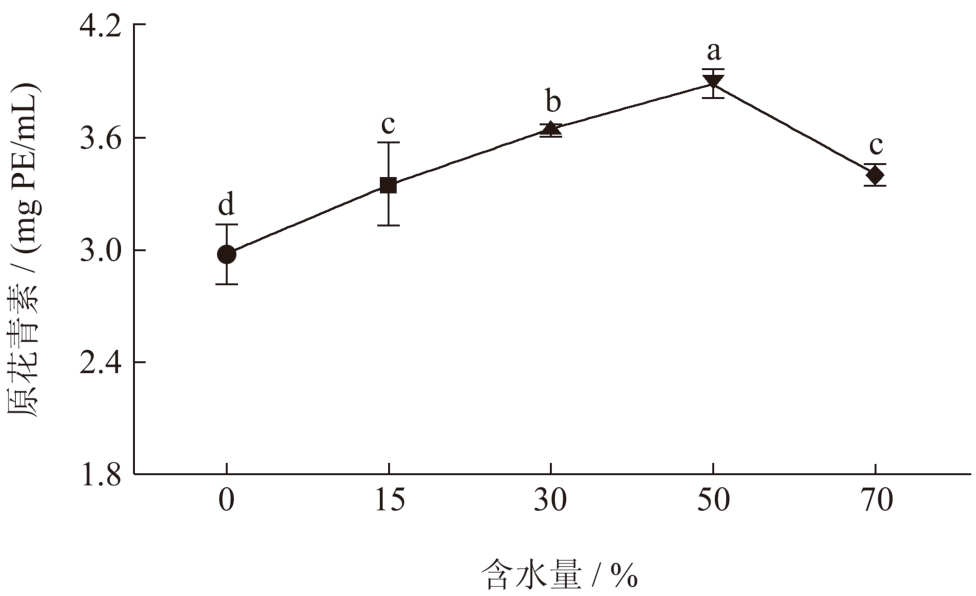
图4 DES 含水量对提取物中原花青素含量的影响
Fig.4 Effect of water content of DES on the content of procyanidins in extracts
2.2.3 DES含水量对提取物中原花青素含量的影响
DES 的含水量是影响荔枝壳原花青素提取含量的重要因素之一。DES 是具有高粘度特性的溶剂,但因其特性使之流动性差,阻碍了分子的扩散作用,从而遏制DES 与提取物之间的传质过程 [28] 。随着DES-3 含水量从0%~50%(V/V)增加,能使DES-3 的粘度降低,流动性增强,促进DES-3 与荔枝壳的传质过程,原花青素的提取率也逐渐升高至3.88 mg PE/mL [29] 。但当含水量高于50%(V/V)时,可能会削弱DES-3 组分之间的氢键作用,破坏了DES-3 的分子结构,致使荔枝壳原花青素的提取含量下降 [30] 。因此,选择DES-3 的含水量为30%~70%(V/V)作为考察水平。
2.2.4 提取时间对提取物中原花青素含量的影响
在60 min 提取时间下,随着提取时间的增加,DES-3 充分渗透于荔枝壳中,促进固液相的传质过程,而随提取时间延长,提取物和提取溶剂之间达到一定平衡 [31] 。由图5 可知,在提取时间长达60 min 时,原花青素在DES-3 的溶解度达到最大值3.96 mg PE/mL。但是,60 ℃下过长的提取时间不仅不能增加原花青素的提取含量,反而会使原有的原花青素发生分解反应,导致其含量降低 [32] 。因此,选择30~90 min 的提取时间为正交因素水平。
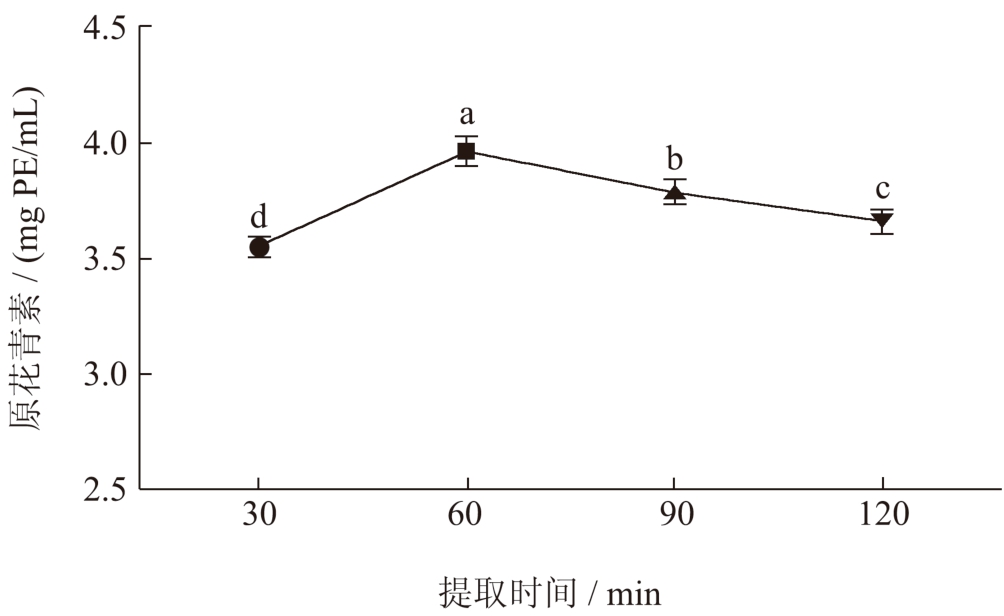
图5 提取时间对提取物中原花青素含量的影响
Fig.5 Effect of extraction time on the content of procyanidins in extracts
由图6 可知,当温度从40 ℃升高到50 ℃时,荔枝壳原花青素提取含量达到3.77 mg PE/mL,可归因于提取温度的升高能使DES-3 热膨胀,分子的动能和迁移率升高,有利于DES-3 对荔枝壳细胞的渗透以及促进与荔枝壳原花青素之间的氢键结合 [33,34] 。但温度从50 ℃到70 ℃进一步增加时,原花青素热稳定性下降,且易发生氧化反应,致使原花青素的含量下降 [35] 。
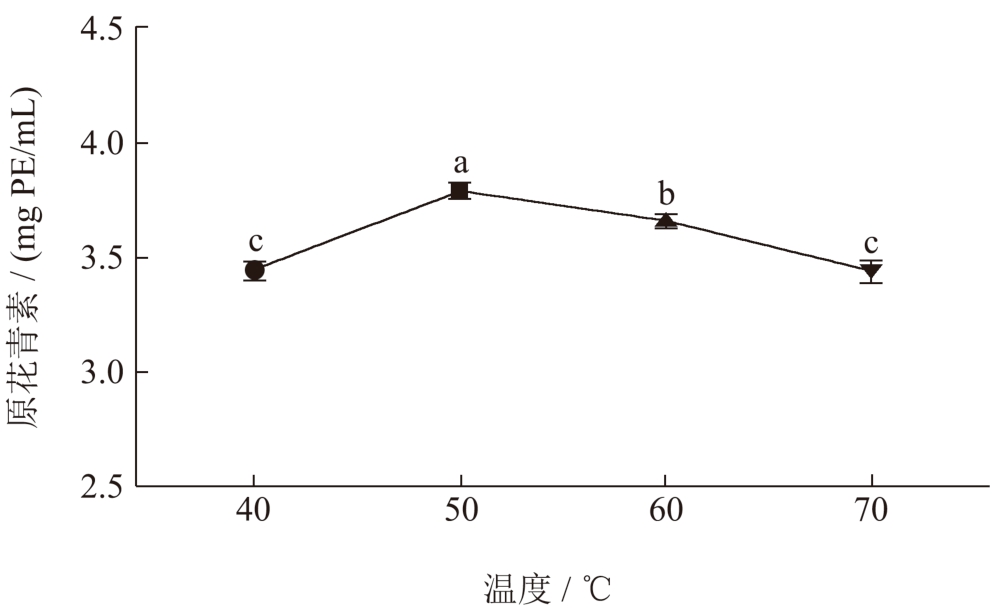
图6 提取温度对提取物中原花青素含量的影响
Fig.6 Effect of extraction temperature on the content of procyanidins in extracts
2.3 正交试验结果
DES-3 提取荔枝壳原花青素正交优化工艺如表5 所示,以原花青素含量为指标,其各个因素通过极差分析可得到影响原花青素提取量的主次顺序:B>C>D>A,即DES 含水量>提取时间>提取温度>DES 摩尔比。由表6 的试验结果方差分析可知,各个单因素(DES 摩尔比、DES 含水量、提取时间及提取温度)均对原花青素提取量有显著性影响(P<0.05)。
表5 正交试验结果
Table 5 Results of orthogonal experiment
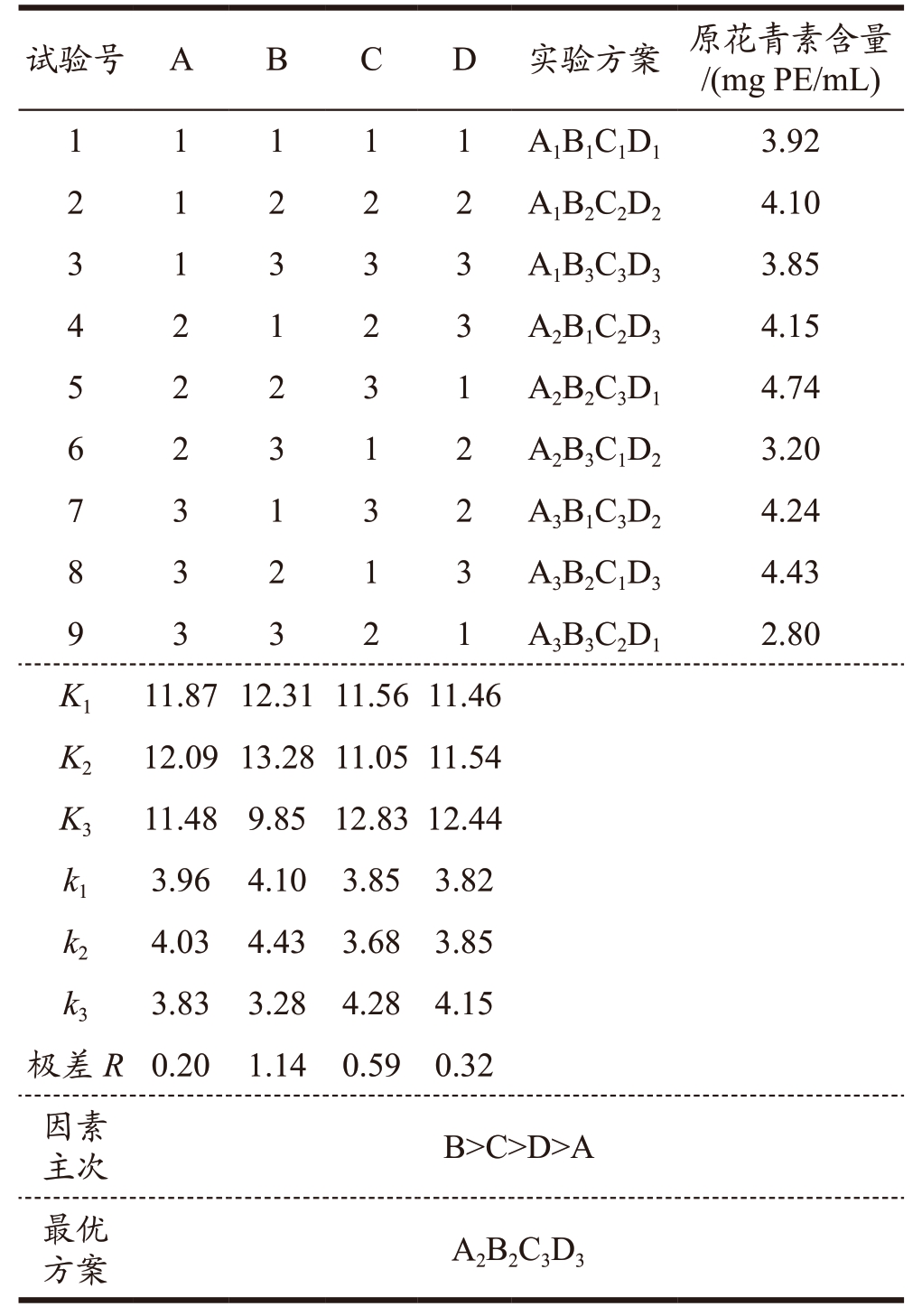
?
表6 试验结果方差分析
Table 6 Analysis of variance of orthogonal experiment results
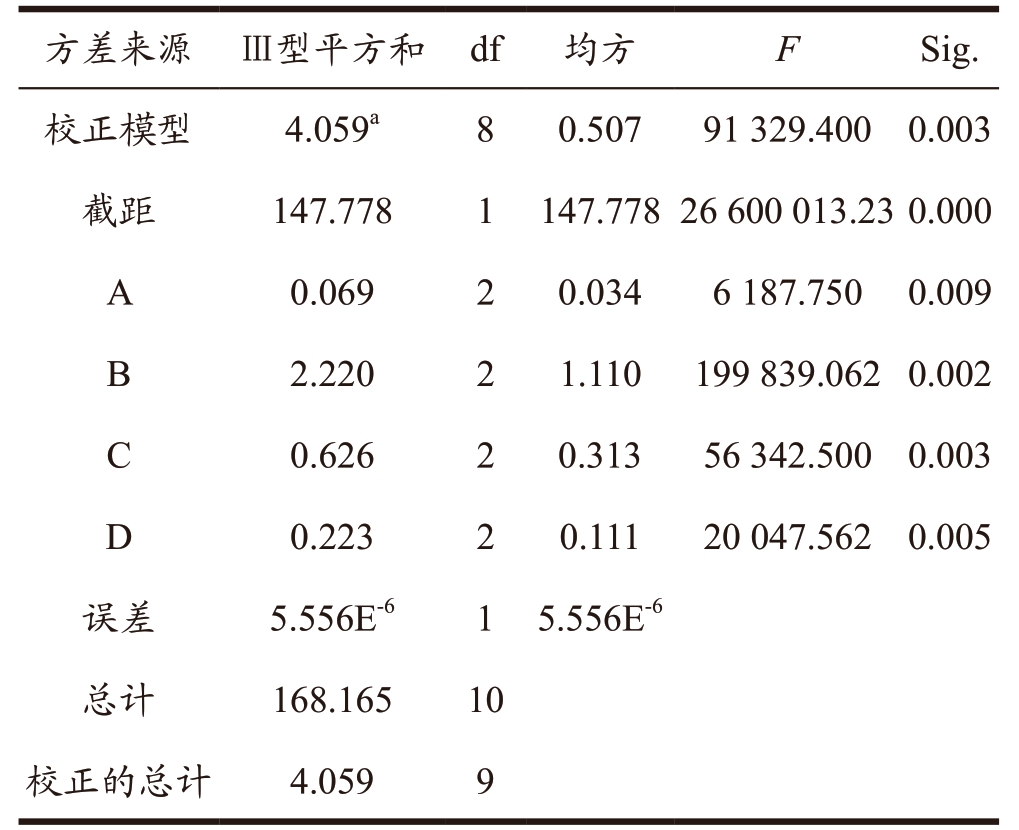
注:R2=1.000(调整后R2=1.000)。
?
2.4 验证实验
为了更深入研究正交试验结果的可靠性,将正交试验结果得到的最优工艺A2B2C3D3,即DES 摩尔比为1:4、DES 含水量为50%(V/V)、提取时间为90 min、提取温度为60 ℃,进行验证试验,并重复3 次。在此优化工艺条件下,荔枝壳原花青素提取量达到 5.07 mg PE/mL,确证为最优提取条件,故确定该条件为DES 提取荔枝壳原花青素最优提取工艺。在最优提取工艺的条件下,氯化胆碱-1,3-丁二醇提取荔枝壳原花青素含量为乙醇提取原花青素(3.61 mg PE/mL)的1.40 倍。
2.5 抗氧化活性试验结果
2.5.1 ORAC结果
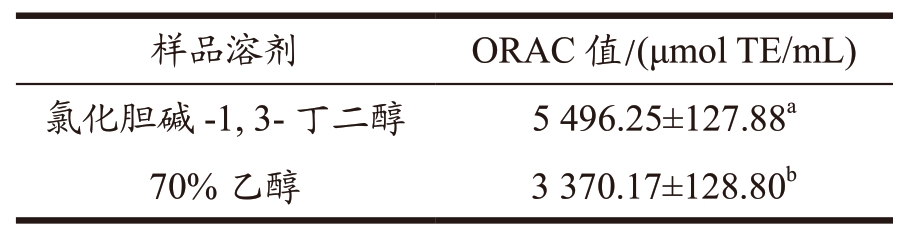
氯化胆碱-1,3-丁二醇与乙醇提取液的荔枝壳原花青素的氧自由基吸收能力(ORAC)结果如表7所示,其ORAC 值分别为5 496.25 μmol TE/mL 及3 370.17 μmol TE/mL,且前者是后者的1.63 倍,表明氯化胆碱-1,3-丁二醇提取的原花青素氧自由基吸收能力更强。
表7 荔枝壳原花青素的ORAC值
Table 7 ORAC value of litchi pericarp procyanidins
?
2.5.2 清除DPPH自由基结果
氯化胆碱-1,3-丁二醇与乙醇提取液的DPPH 自由基清除能力的结果见图7,在低质量浓度时,氯化胆碱-1,3-丁二醇提取液的DPPH 自由基清除能力显著优于乙醇提取液。而在高质量浓度时,两者的DPPH 自由基清除率皆达90%以上。两者的DPPH自由基的半清除率(IC50 值)分别为27.35 μg PE/mL与36.41 μg PE/mL,表明氯化胆碱-1,3-丁二醇提取的原花青素清除DPPH 自由基能力更强。
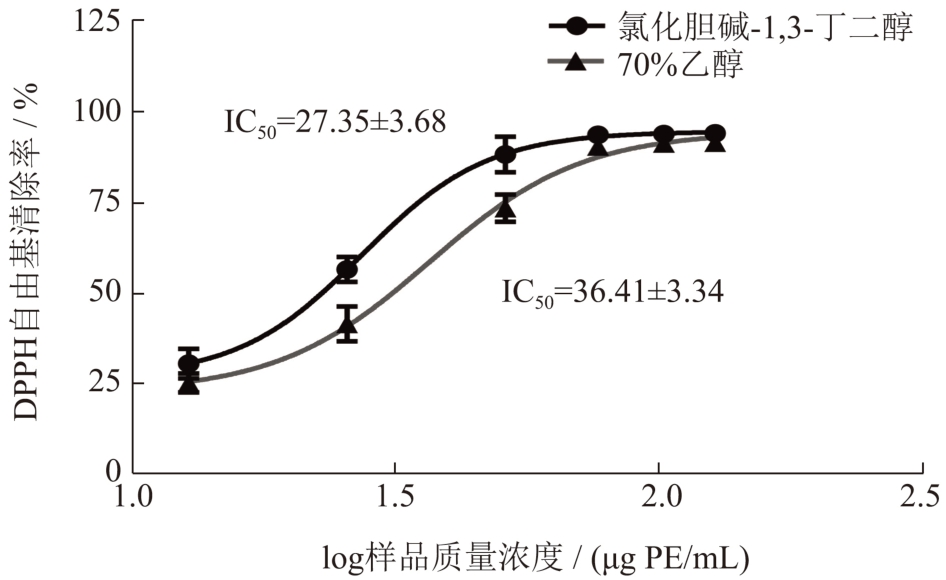
图7 荔枝壳原花青素对DPPH 自由基清除率曲线
Fig.7 DPPH free radical scavenging curve of litchi pericarp procyanidins
2.5.3 清除ABTS+自由基结果
氯化胆碱-1,3-丁二醇与乙醇提取的荔枝壳原花青素的ABTS+自由基清除能力结果见图8,结果显示,两种溶剂提取的原花青素都具有良好的ABTS+自由基清除能力,在76.72 μg/mL 时两者清除率均可达100%,其IC50 值分别在23.82 μg PE/mL 与31.56 μg PE/mL,氯化胆碱-1,3-丁二醇提取的原花青素清除ABTS+自由基能力更强。
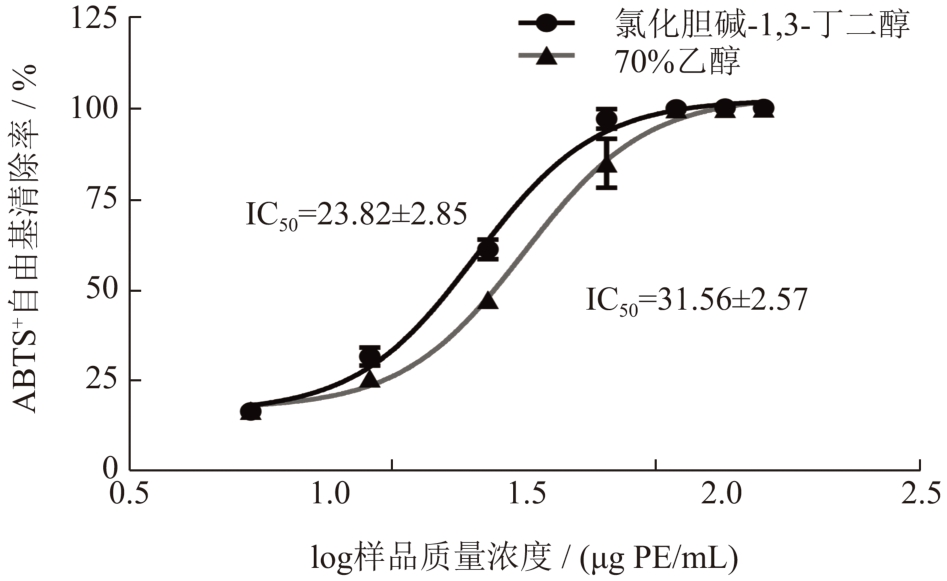
图8 荔枝壳原花青素对ABTS+自由基清除率曲线
Fig.8 ABTS free radical scavenging curve of litchi pericarp procyanidins
氯化胆碱-1,3-丁二醇提取的荔枝壳原花青素提取物具有更好的抗氧化活性,这可能与氯化胆碱-1,3-丁二醇荔枝壳提取液中总酚、总黄酮以及原花青素含量显著高于70%乙醇荔枝壳提取液有关(P<0.05)。抗氧化物质清除自由基的本质是电子的转移,即自由基从抗氧化物质上获得电子转变为中性分子的形式 [36,37] 。Mirahmadi 等 [38] 认为酚类物质的含量与自由基清除之间存在显著相关性,酚类物质含量越高,其提供电子的能力越强,即自由基清除能力也就越强。而Bu [39] 和Fu 等 [40] 研究表明,相较于传统有机试剂,低共熔溶剂提取酚类物质的能力更强,其提取物的抗氧化能力也更强。所以,氯化胆碱-1,3-丁二醇提取物的酚类物质含量越高,其抗氧化能力就越强。
3 结论
本文通过比较4 种低共熔溶剂与70%(V/V)乙醇提取法对荔枝壳提取液中原花青素含量及mDP、总酚和总黄酮含量、单体成分组成及ORAC 活性的影响,筛选出氯化胆碱-1,3-丁二醇为最佳提取溶剂。进一步考察了料液比、DES 摩尔比、DES 含水量、提取时间及提取温度5 个单因素对原花青素提取得率的影响,结合正交试验优化得到荔枝壳原花青素的最佳提取工艺:氯化胆碱-1,3-丁二醇为溶剂,料液比1:20(g/mL),溶剂摩尔比1:4,含水量50%(V/V),提取温度60 ℃,提取时间90 min。在此条件下测得的荔枝壳原花青素含量为5.07 mg PE/mL,是70%(V/V)乙醇提取液的1.4 倍。氯化胆碱-1,3-丁二醇提取物的ORAC 值以及清除DPPH 和ABTS自由基的IC50 值分别为5 496.25 μmol TE/mL、27.35 μg PE/mL 和23.82 μg PE/mL,均优于70%(V/V)乙醇提取液(3 370.17 μmol TE/mL、36.41 μg PE/mL和 31.56 μg PE/mL)。本试验为荔枝壳原花青素的绿色高效提取和高值化利用提供理论依据和技术支撑。
[1] SNEH P, MANOJ K. Litchi (Litchi chinenis) seed:nutritional profile, bioactivities, and its industrial applications[J]. Trends in Food Science & Technology, 2021, 108: 58-70.
[2] 卢素珊,涂桢楷,赵锡和,等.我国荔枝加工技术研究现状[J]. 现代农业装备,2022,43(2): 14-17,48.
[3] BANGAR S, KUMAR M, WHITESIDE S, et al. Litchi(Litchi chinensis) seed starch: structure, properties,and applications-A review [J]. Carbohydrate Polymer Technologies and Applications, 2021, 2: 100080.
[4] LIN S, WEN L R, YANG B, et al. Improved growth of Lactobacillus bulgaricus and Streptococcus thermophilus as well as increased antioxidant activity by biotransforming litchi pericarp polysaccharide with Aspergillus awamori [J].BioMed Research International, 2013, 2013: 413793.
[5] ZENG Q Z, XU Z H, DAI M R, et al. Effects of simulated digestion on the phenolic composition and antioxidant activity of different cultivars of lychee pericarp [J]. BMC Chemistry, 2019, 13(1): 27-37.
[6] LOURITH N, KANLAYVATTANAKUI M. Formulation and clinical evaluation of the standardized Litchi chinensis extract for skin hyperpigmentation and aging treatments [J].Annales Pharmaceutiques Françaises, 2010, 78(2): 142-149.
[7] 王满生,王发祥,杨晶,等.莲房原花青素提取方法、生理功能及其在食品工业中应用的研究进展[J].食品工业科技,2021,42(5): 349-356.
[8] MAXIMILIAN N, THOMAS W, SUSANNE L. Deep eutectic solvents as entrainers in extractive distillation-A review [J]. Chemical Engineering Research and Design,2022, 184: 402-418.
[9] JOAN G L, NARENDAR K, MARK J W. Deep eutectic solvents’ ability to solubilize lignin, cellulose,and hemicellulose; thermal stability; and density [J].Bioresource Technology, 2017, 238: 684-689.
[10] ZHOU P F, TANG D B, ZOU J B, et al. An alternative strategy for enhancing stability and antimicrobial activity of catechins by natural deep eutectic solvents [J]. LWTFood Science and Technology, 2022, 153: 112558.
[11] CHEN Z Q, WU K W, ZHU W Z, et al. Chemical compositions and bioactivities of essential oil from perilla leaf (Perillae folium) obtained by ultrasonic-assisted hydro-distillation with natural deep eutectic solvents [J].Food Chemistry, 2022, 375: 131834.
[12] ZHANG Q H, VIGIER K D O, ROYER S, et al. Deep eutectic solvents: syntheses, properties and applications [J].Chemical Society Reviews, 2012, 41(21): 7108-7146.
[13] ANDREA P H, MYOLANDA G F, JOSE E B, et al.Obtaining green extracts rich in phenolic compounds from underexploited food by-products using natural deep eutectic solvents [J]. Sustainable Chemistry and Pharmacy,2022, 29: 100773.
[14] 卢琦,贾栩超,邓梅,等.不同干制方式对沙田柚果渣粉活性物质的影响[J].中国农业科学,2022,55(14): 2825-2836.
[15] 赖婷,刘磊,张名位,等.不同乳酸菌发酵对桂圆肉中酚类物质及抗氧化活性的影响[J].中国农业科学,2016,49(10):1979-1989.
[16] WANG Y F, AJAY P S, WILLIAM J H, et al.Influence of degree-of-polymerization and linkage on the quantification of Proanthocyanidins using 4-Dimethylaminocinnamaldehyde (DMAC) assay [J].Journal of Agricultural and Food Chemistry, 2016, 64(11):2190-2199.
[17] 魏冠红,魏作君,苏宝根,等.测定原花青素平均聚合度的一种新方法[J].中国食品学报,2006,6(6): 112-116.
[18] YU Q, WANG F, JIAN Y T, et al. Extraction of flavonoids from Glycyrrhiza residues using deepeutectic solvents and its molecular mechanism [J]. Journal of Molecular Liquids,2022, 363: 119848.
[19] GLORIA D R, MARIA L M, MERICHEL P. Strategies for the extraction and analysis of non-extractable polyphenols from plants [J]. Journal of Chromatography A, 2017,1514(8): 1-15.
[20] MOHAMAD S C Z, JEN X Y, SOO Y L, et al.Physicochemical properties of choline chloride-cased natural deep eutectic solvents (NaDES) and their applicability for extracting oil palm flavonoids [J]. Sustainability,2021, 13(23): 12981.
[21] WANG G, CUI Q, YIN L J, et al. Efficient extraction of flavonoids from Flos sophorae immaturus by tailored and sustainable deep eutectic solvent as green extraction media[J]. Journal of Pharmaceutical and Biomedical Analysis,2019, 170: 285-294.
[22] MDASRAFUL A, GUL M, MNURUZZAMAN K, et al.Choline chloride-based deep eutectic solvents as green extractants for the isolation of phenolic compounds from biomass [J]. Journal of Cleaner Production, 2021, 309:127445.
[23] 马烨.红米原花青素的提取纯化与抗氧化活性研究[D].南昌:南昌大学,2016.
[24] 蔡灿军.不同MA包装对荔枝采后贮藏生理的影响[D].福州:福建农林大学,2020.
[25] 杨丽珍.荔枝壳多酚抑制α-葡萄糖苷酶和α-淀粉酶的作用及其机制研究[D].广州:华南农业大学,2017.
[26] ZHENG B L, YUAN Y, XIANG J L, et al. Green extraction of phenolic comounds from foxtail millet bran by ultrasonic-assisted deep eutectic solvent extraction:optimization, comparison and bioactivities [J]. LWT-Food Science and Technology, 2022, 154: 112740.
[27] ELISABETE S C F, IULIIA V V, FIGUEIREDO N, et al.Molecular dynamic study of alcohol-based deep eutectic solvents [J]. The Journal of Chemical Physics, 2021,155(6): 064506.
[28] CHUNYAN M, AATTO L, LIU C, et al. The peculiar effect of water on ionic liquids and deep eutectic solvents[J]. Chemical Society Reviews, 2018, 47(23): 8685-8720.
[29] MARIA V, JUSTYNA P W, VASIL A. The role of water in deep eutectic solvent-base extraction [J]. Journal of Molecular Liquids, 2020, 304: 112747.
[30] CAO J, CHEN L Y, LI M H, et al. Efficient extraction of proanthocyanidin from Ginkgo biloba leaves employing rationally designed deep eutectic solvent-water mixture and evaluation of the antioxidant activity [J]. Journal of Pharmaceutical and Biomedical Analysis, 2018, 158: 317-326.
[31] VOLNEI B D S, AUGUSTO T H, MARCELO T, et al.Study of extraction kinetics and characterization of proanthocyanidin-rich extract from Ceylon cinnamon(Cinnamomum zeylanicum) [J]. Journal of Food Processing and Preservation, 2021, 45(5): e15429.
[32] 都宏霞,缪领珍,胡梓恒,等.低共熔溶剂提取桂花黄酮的工艺优化[J].现代食品科技,2021,37(5): 203-211.
[33] LINA B, FELIX I D, VYACHESLAV P. Effects of temperature and water content on physicochemical properties of ionic liquids containing CrCl3· x H2O and choline chloride [J]. Journal of Molecular Liquids, 2016,223: 48-53.
[34] LIZANDRA K, DANIELLE C, NINA W, et al. Influence of temperature, water content and type of organic acid on the formation, stability and properties of functional natural deep eutectic solvents [J]. Fluid Phase Equilibria, 2019,488: 40-47.
[35] 只德贤,张妮,李建颖.微波超声协同提取白刺果原花青素工艺及抗氧化性研究[J].食品工业科技,2022, 43(13):171-179.
[36] LI X C, OUYANG X J, CAI R X, et al. 3′,8″-dimerization enhances the antioxidant capacity of flavonoids: evidence from acacetin and isoginkgetin [J]. Molecules, 2019,24(11): 2039.
[37] LI X C. Comparative study of 1,1-diphenyl -2-picrylhydrazyl radical (DPPH·) scavenging capacity of the antioxidant xanthones family [J]. Chemistry Select, 2018,3(46): 13081-13086.
[38] SEYED F, REZA N. Chemical composition, phenolic content, free radical scavenging and antifungal activities of Achillea biebersteinii [J]. Food Bioscience, 2017, 18: 53-59.
[39] BU F Z, ZHAO Y Q, LI B, et al. The effect of choline Chloridebutanediol based deep eutectic solvents on ultrasoundassisted extraction, antioxidant activity and stability of anthocyanins extracted from Perilla frutescens (L.) Britt.[J]. Sustainable Chemistry and Pharmacy, 2023, 32:101000.
[40] FU X Z, TARUN W, HE Y H, et al. UPLC-Triple-TOF/MS characterization of phenolic constituents and the influence of natural deep eutectic solvents on extraction of Carya cathayensis sarg. peels: composition, extraction mechanism and in vitro biological activities [J]. Food Chemistry, 2022,370: 131042.