石油基合成聚合物包装可以阻隔外部环境与食品之间的联系,从而减缓食品变质并延长其保质期。因其机械性能强、阻隔性高、可塑性好、成本低等优势,在食品包装领域已经有了广泛长久的应用[1]。然因石油资源的不可再生及合成聚合物产品引起的环境及健康问题,人们正在寻找合适的替代品,可生物降解的天然聚合物膜(如蛋白质、多糖和脂质等)一直是人们研究的重点[2-5]。
玉米蛋白(Zein)是一种来自玉米胚乳组织的醇溶性蛋白质,因具有无毒和生物相容的特点,被美国食品和药物管理局视为安全的食品配料。玉米蛋白具有高含量的非极性氨基酸(如亮氨酸,脯氨酸和丙氨酸等),这解释了其薄膜表面的疏水特性[6]。Argos等[7]报道了Zein 的结构模型,九个同源重复单元反平行排列,用氢键连接形成稳定的不对称蛋白分子,这使得玉米蛋白在无化学试剂的条件下轻松形成薄膜。由于良好的成膜能力和优异的水蒸气阻隔性能,Zein成为食品包装潜在可生物降解材料的优选之一。但纯玉米蛋白薄膜的柔韧性弱、脆性高、加工性能较差,限制了其在食品包装业中的应用,为了克服Zein 薄膜的不足,增塑剂如甘油、山梨糖醇、油酸、聚乙二醇或它们的混合物已被利用来提高膜的柔韧性和弹性[8-10]。然而仅通过调节增塑剂种类和比例来改善Zein 薄膜的柔韧性是不够的,仍然需要全面改善玉米醇溶蛋白膜的物化性能。
美拉德反应(Maillard Reaction,MR),也称为非酶促糖基化反应,是蛋白质或任何氨基化合物与还原糖、酮或醛的羰基发生的共价缩合反应[11],反应生成一系列复杂的产物,统称为美拉德反应产物(Maillard Reaction Products,MRPs)。与乙酰化,脱酰胺,琥珀酰化和其他可用于改善蛋白质功能特性的化学方法相反,MR 仅需可控的温湿度反应条件,不需要多余的化学物质。因而美拉德反应可能是改善食品用蛋白质功能特性最有效的方法。MRPs 可改善蛋白的溶解度、乳化性能、成膜性能、热稳定性等性能[12]。Zhang 等[13]通过静电纺丝技术制备了含有小麦面筋/玉米蛋白/木糖的纳米纤维糖化膜,结果表明美拉德反应中生成的席夫碱强化了膜的纤维网络结构,复合薄膜拉伸强度和断裂延伸率显著增加,同时糖化降低了复合膜水蒸气渗透率和溶胀比;Wang 等[14]制备了魔芋葡甘露聚糖(KGM)/玉米蛋白共混糖基化膜,与纯KGM 和Zein 膜相比,随着Zein 添加量的增加(2%~10%),膜的接触角、防潮性、机械性能、阻隔性能和热稳定性等性能均显著提高。值得一提的是,MRPs 还具有较好的抗氧化活性和抗菌性能。最近,Yu 等[15]采用超滤法从大豆水解液中分离出的蛋白肽分别与D-木糖和L-半胱氨酸在120 ℃条件下反应2 h,得到的相应美拉德反应产物DPPH 自由基清除活性均显著提高。Liu 等[16]使用干加热方法制备的乳清分离蛋白-葡萄糖偶联物表现出显着增强的还原力和ABTS 自由基清除活性,且随着反应时间的增加,抗氧化活性逐渐增强;另外,Liang 等[17]制备了质量比为1:1 的聚赖氨酸-壳聚糖糖基化产物,观察到对大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌和啤酒酵母的最强的抗菌活性。目前用于肉类及肉制品的天然生物聚合物膜多为亲水性的,因而具有较差的防潮性能及有限的保质期,且某些类别的生物聚合物还不具备成本效益[18,19]。
因此,本研究旨在制备基于玉米蛋白-大豆多糖美拉德反应产物(Zein-Soybean Polysaccharide Maillard Reaction Products,ZS-MRPs)的可降解食品包装膜,通过添加耐酸、耐热的水溶性膳食纤维大豆多糖为糖基供体,在特定的反应环境下使玉米蛋白表面引入了多羟基的大豆多糖分子来改善Zein 膜的柔韧性、机械性能和抗氧化活性。同时制备的含有MRPs 的玉米蛋白薄膜用于牛肉的保鲜,通过测定牛肉在4 ℃下储存9 d 期间过程中的菌落总数、pH、色度、TVB-N、TBARs等鲜度指标的变化,初步探究含有不同ZS-MRPs 的玉米醇溶蛋白膜对生鲜牛肉的品质的影响。
1 材料与方法
1.1 材料与试剂
牛背最长肌,购于南京市浦口区凡星集贸市场,选取新鲜的牛背最长肌,冷藏运回实验室使用,剔除表面肌膜,沿肌肉走向垂直方向切成5 cm×5 cm×2 cm大小的肉块,每块牛肉质量为(8±0.5)g,在肉样的切取过程中应避免肉眼可见的结缔组织、血管以及其他缺陷;玉米醇溶蛋白(分析纯),购于西格玛奥德里奇(上海)贸易有限公司;大豆多糖(分析纯),购于合肥博美生物科技有限公司。
1.2 仪器与设备
DF-101S 集热式恒温加热磁力搅拌器,南京文尔仪器设备有限公司;GL-20G-H 冷冻离心机,上海安亭科学仪器厂;FD-3 冷冻干燥机,北京博医康实验仪器有限公司;NS810 分光测色仪,深圳市三恩驰科技有限公司;T25 均质机,德国IKA。
1.3 实验方法
1.3.1 玉米醇溶蛋白-大豆多糖美拉德反应
称取一定量Zein 溶于磷酸缓冲液(将8.0 g NaCl、0.2 g KH2PO4、2.9 g Na2HPO4·12H2O、0.2 g KCl 按次序加入容器中,加适量蒸馏水溶解后定容至1 L,调pH 值至7.4),磁力搅拌40 min。根据预实验,Zein与大豆多糖以质量比10:1 混合获得的共聚物膜的成膜速度快,易剥离。按10:1 的比例加入大豆多糖后,继续磁力搅拌至混合均匀,冷冻干燥后在80 ℃、相对湿度79%的密闭环境中反应约3 h、5.5 h、11 h、17 h。
1.3.2 玉米醇溶蛋白-大豆多糖美拉德反应产物接枝度和溶解性的测定
通过邻苯二甲醛乙二酯(O-Phthalic Aldehyde,OPA)法测定不同美拉德反应时间的ZS-MRPs 的接枝度[20]。
采用Lowry 法[21]测定冻干的蛋白多糖混合物、不同接枝度的ZS-MRPs 的溶解性。将样品溶于超纯水中,使用UV-VIS 分光光度计测量样品在750 nm 处的吸光度,将结果与使用牛血清白蛋白制备的校准曲线进行比较。
1.3.3 玉米醇溶蛋白-大豆多糖美拉德反应产物的表征
红外光谱分析:采用KBr 压片法[22],扫描范围设定为4 000~400 cm-1。检测样品为玉米醇溶蛋白、大豆多糖、不同接枝度的ZS-MRPs。
SDS-PAGE 凝胶电泳:参照Laemmli[23]的方法。将Zein 和不同接枝度的ZS-MRPs 溶于80%乙醇,配制5 mg/mL 的蛋白溶液,7 000 r/min 离心10 min,取上清液与上样缓冲液1:1 混合,100 ℃煮沸10 min。分离胶质量分数分别为10%,进样量每孔10 μL,分别设定电压为120 V 和80 V 进行电泳。结束后用考马斯亮蓝R250 进行染色,然后用脱色液(甲醇、冰乙酸、水的体积比为1:3:6)进行脱色,更换脱色液直至条带清晰。
1.3.4 玉米醇溶蛋白基美拉德反应聚合物膜的制备
分别称取5 g 不同接枝度的ZS-MRPs,溶于48 g φ=80%乙醇溶液中,充分溶解后,加入φ=20%甘油(以ZS-MRPs 质量计),混匀后真空脱气,采用延流法将膜液倒入7 cm×16 cm 聚四氟乙烯平板模具中,60 ℃烘干2 h 后揭膜得到基于不同ZS-MRPs 的薄膜。
1.3.5 玉米醇溶蛋白基美拉德反应聚合物膜的物理性能
使用质构仪进行拉伸试验,以确定断裂伸长率(EAB)和拉伸强度(TS)。将薄膜样品(30 mm×10 mm)安装在拉伸夹钳中,夹钳之间的初始距离为25 mm,以60 mm/min 的速度拉伸,直至断裂。
1.3.6 玉米醇溶蛋白基美拉德反应聚合物膜的抗氧化性能
采用分光光度法测定了不同膜对DPPH 自由基的清除效果。所有薄膜样品(25 mg)均溶解于3 mL 乙醇中。在试管中,2.5 mL 的提取液与1 mL 0.3 mmol/L DPPH 乙醇溶液(或纯乙醇为对照)混合。避光反应30 min 后,在518 nm 处测定吸光度[24]。DPPH 清除率使用公式(1)计算
式中:
D——DPPH 清除率,%;
A0——对照吸光度;
A——样品吸光度。
1.3.7 应用牛肉的玉米醇溶蛋白基美拉德反应聚合物膜处理
制得的薄膜对折后放入处理好的牛肉样品,其余三边使用手压式热封机封口(示例见图1)。未包膜的牛肉和不同接枝度的ZS-MRPs 膜包裹处理后的牛肉,分别记为对照、ZS-MR-3 h、ZS-MR-5.5 h、ZS-MR-11 h和ZS-MR-17 h。将各处理组置于(4±0.5)℃储藏,分别测定储藏1、3、5、7、9 d 的牛肉的菌落总数、pH 值、总挥发性盐基氮、丙二醛、色度等指标。

图1 膜包裹牛肉示意图
Fig.1 Schematic diagram of film wrapped beef
注:左为对照,右为ZS-MR-17 h。
1.3.8 指标测定
1.3.8.1 储藏过程中牛肉菌落总数的测定
测定方法参照国标GB 4789.2-2016《食品安全国家标准食品微生物学检验菌落总数测定》
1.3.8.2 储藏过程中牛肉pH 值的测定
参照国标GB 5009.237-2016《食品安全国家标准食品pH 值的测定》。称取5 g 牛肉,切碎,加入45 mL超纯水,使用均质机,8 000 r/min 均质2 min,使用pH 计,测定pH 值。
1.3.8.3 储藏过程中牛肉总挥发性盐基氮的测定
挥发性盐基氮的测定方法参照国标GB 5009.228-2016《食品安全国家标准食品中挥发性盐基氮的测定》中的半微量定氮法。
称取5 g 牛肉,尽量切碎,加入45 mL 超纯水,使用均质机,8 000 r/min 均质2 min,然后将10 mL滤液加到反应管中,快速加入5 mL 氧化镁混悬液,混匀。安装接收瓶,接收蒸馏出的TVB-N。使用自动定氮进行蒸馏,时间为6 min。使用盐酸标准溶液,对三角瓶中液体进行滴定,三角瓶内蓝色液体变为红色则代表到达终点。记录消耗的盐酸体积。
1.3.8.4 储藏过程中牛肉丙二醛含量的测定
采用国标GB 5009.228-2016《食品安全国家标准食品中丙二醛的测定》中的分光光度法。
1.3.8.5 储藏过程中牛肉色度的测定
采用色度计(D65 光源,口径8 mm)测定的牛肉的L*值(亮度)和a*值(红度),测定前用标准白板对色差仪进行校正[25]。
1.4 数据分析
所有试验重复三次;数据采用IBM SPSS Statistics 26 软件LSD 事后多重比较分析进行显著性分析,数据以“平均值±标准偏差”表示(显著性水平:P<0.05);采用Origin Pro 2021 软件进行绘图。
2 结果与讨论
2.1 玉米醇溶蛋白-大豆多糖美拉德反应产物接枝度和溶解性测定
通过控制美拉德反应时间,最终得到接枝度为10.30%(反应3 h)、19.25%(反应5.5 h)、28.63%(反应11 h)、37.57%(反应17 h)的玉米醇溶蛋白-大豆多糖美拉德反应产物。由图2 可以看出,Zein 水溶液中的蛋白浓度最低,仅有0.11 mg/mL,这是由于Zein为一种疏水性蛋白,其水溶性较差。而ZS-MRPs 较Zein 的蛋白浓度显著上升(P<0.05),达到3.06 mg/mL以上,且随美拉德反应时间由3 h 延长到17 h,蛋白浓度由3.06 mg/mL 上升至3.51 mg/mL。究其原因,可能是由于在美拉德反应初期,玉米蛋白与大豆多糖的共价键合,大量的羟基被引入蛋白质表面,降低了Zein 分子表面疏水基团的比例[26],从而使Zein 的溶解性明显提高,Cheng 等[27]在大米蛋白与葡聚糖糖基化产物溶解性分析中报告了类似的结果,但由于大豆多糖是由聚半乳糖醛酸和聚鼠李糖半乳糖醛为主链的高度支化阴离子多糖,随着MR 的持续进行,体系中的还原性羰基浓度降低,空间位阻效应增加,降低了反应活性[28],从而使得反应17 h 的ZS-MRPs 溶解度较反应11 h 未有显著的变化。
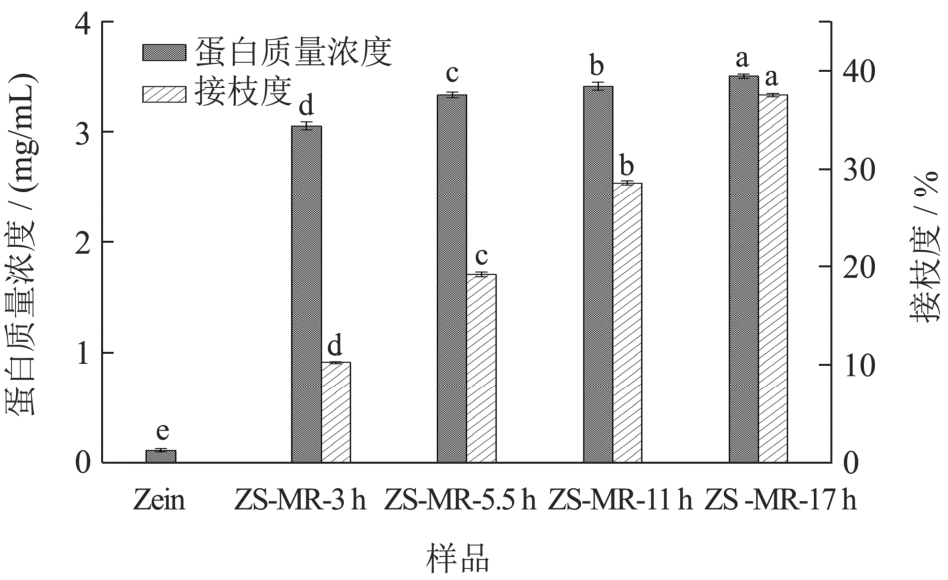
图2 不同反应时间的玉米醇溶蛋白-大豆多糖美拉德反应产物的接枝度和溶解性
Fig.2 Grafting degree and solubility of maize alcoholic protein-soybean polysaccharide merad reaction products with different reaction times
注:图中不同的小写字母表示具有显著性差异(P<0.05),图5 同。
2.2 玉米醇溶蛋白-大豆多糖美拉德反应产物的表征
2.2.1 红外光谱分析
图3 为玉米醇溶蛋白、大豆多糖及不同接枝度的ZS-MRPs 的红外光谱图。与玉米醇溶蛋白、大豆多糖的红外光谱图比较,不同接枝度的ZS-MRPs 的红外光谱图同时有玉米蛋白和大豆多糖的特征峰(图3 中左红圈标注),在1 080 cm-1 附近有新的吸收峰出现(图3 中右红圈标注),可能是美拉德反应产生了席夫碱[29]。而不同接枝度的美拉德反应产物的光谱图之间,在3 420、1 650、1 517 cm-1等处的吸收峰强度有明显变化,这可能与蛋白接枝程度有关。综上所述,通过比较不同接枝度的ZS-MRPs 的红外光谱图,证明玉米醇溶蛋白与大豆多糖之间发生了美拉德反应,且随反应时间延长,接枝程度增大。

图3 不同接枝度的玉米醇溶蛋白-大豆多糖美拉德反应产物的红外光谱
Fig.3 FT-IR of Maillard reaction products of zein and soybean polysaccharide with different degree of grafting
2.2.2 SDS-PAGE 凝胶电泳
图4 中可以看到,在20~25 ku 之间的范围内,各组均能观察到Zein 的条带。而Zein 在与大豆多糖进行美拉德反应糖基化后,在分离胶上端分子量约40~50 ku 之间有较宽条带生成,说明Zein 与多糖结合形成了分子量较大的糖蛋白接枝产物,且而随着美拉德反应时间的延长,这一区域的条带逐渐加深,说明Zein 糖基化程度逐渐增大,与接枝度增大相互映证,说明通过控制反应时间,可以获得不同接枝度的ZS-MRPs,且接枝度与反应时间正相关。
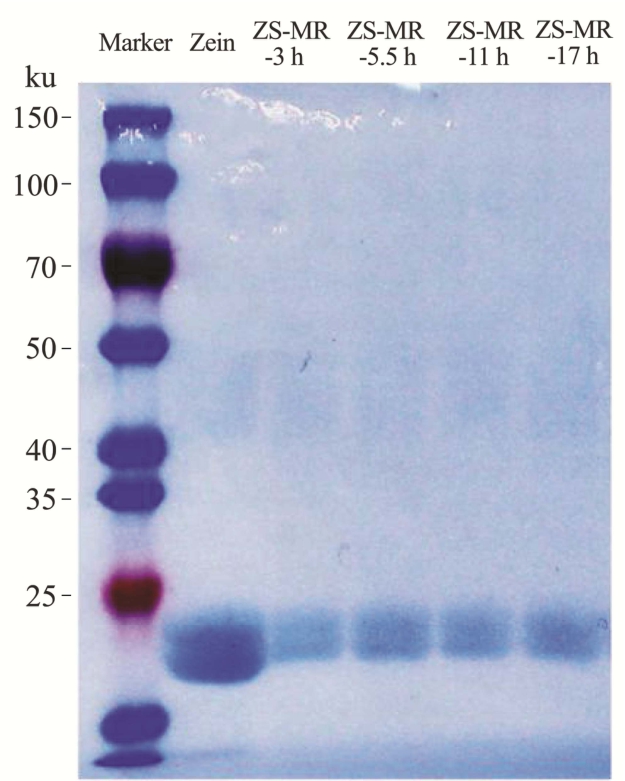
图4 不同接枝度的玉米醇溶蛋白-大豆多糖美拉德反应产物的凝胶电泳
Fig.4 Gel electrophoresis diagram of Maillard reaction products of zein and soybean polysaccharide with different degree of grafting
2.3 不同接枝度ZS-MRPs 膜的物理性能
由表1 可知,多糖蛋白混合物膜的拉伸强度和断裂伸长率均最低,这可能因为仅仅加入少量的大豆多糖而不进行美拉德反应无法改变单纯的玉米醇溶蛋白膜柔韧性差、脆性高的特点[8]。而随着美拉德反应的进行,ZS-MRPs 膜的力学性能显著改善,ZS-MR-17 h膜的拉伸强度最高,为18.33 MPa,ZS-MR-11 h 膜的断裂伸长率最高,达到113.10%。这可能因为美拉德反应生成的希夫碱增强了薄膜的柔韧性[30]。
表1 不同接枝度ZS-MRPs 膜的物理性能
Table 1 Physical properties of ZS-MRPs films with different grafting degrees
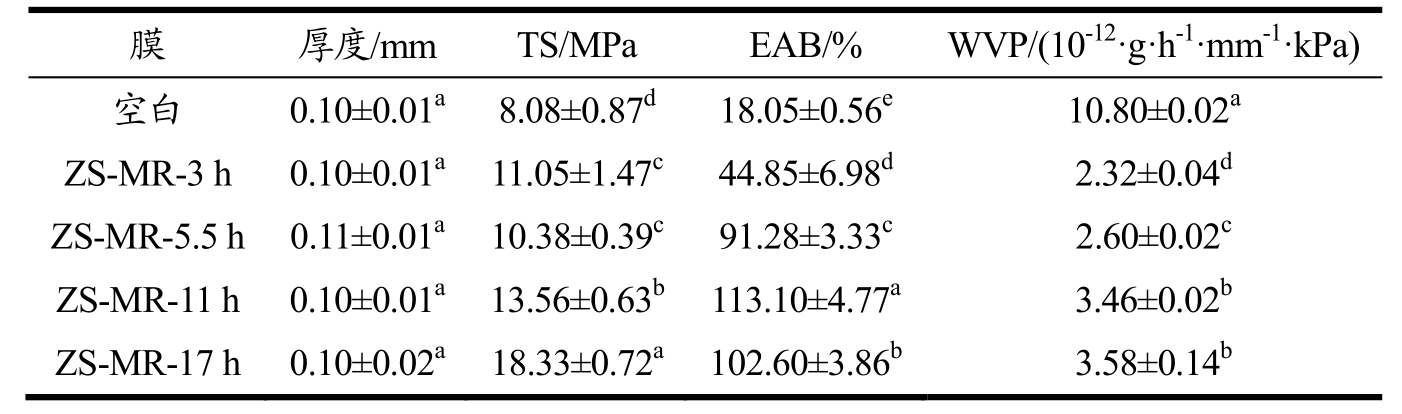
注:图中不同的小写字母表示具有显著性差异(P<0.05)。
2.4 不同接枝度ZS-MRPs 膜的DPPH 清除率
由图5 可知,蛋白多糖混合物膜的DPPH 自由基清除率较低,美拉德反应产物膜的抗氧化效果增加,表现出良好的自由基清除能力。当接枝度为28.63%时,ZS-MR-11 h 膜的自由基清除能力达到40%,随着美拉德反应时间的延长,ZS-MR-17 h 样品的自由基清除能力显著下降(P<0.05),但均显著高于未进行美拉德反应的蛋白多糖混合物膜。这与齐宝坤等[31]的实验结果相似,其将绿豆分离蛋白与葡聚糖进行糖基化反应,随着反应时间的延长,自由基清除能力也呈现出先增长后降低的趋势。当反应时间过长,长时间热处理会使蛋白质分子发生热聚集,同时由于反应生成的具有还原力的美拉德产物在长时间高温下有部分分解,导致抗氧化能力下降[32]。
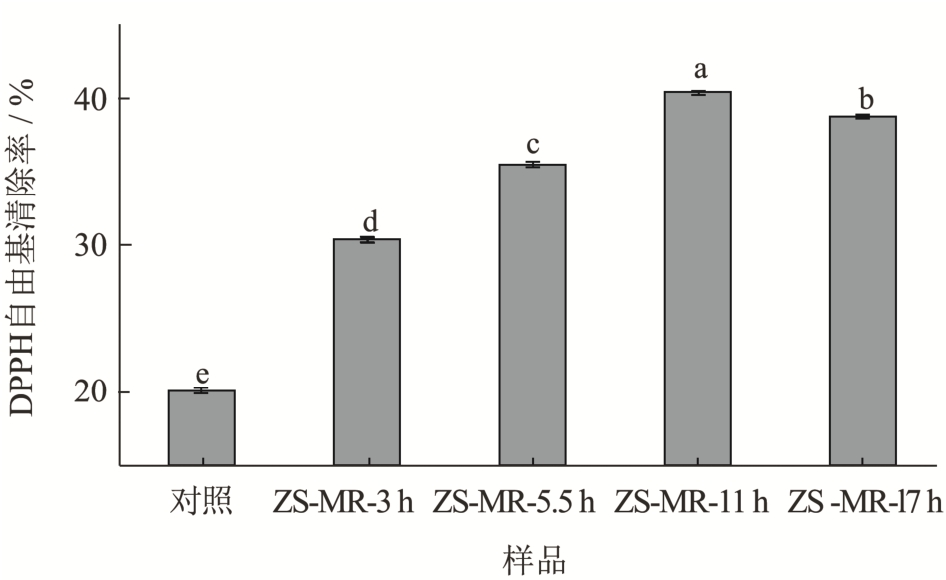
图5 不同接枝度ZS-MRPs 膜的DPPH 清除率
Fig.5 Antioxidant properties of ZS-MRPs films with different grafting degrees
2.5 不同接枝度ZS-MRPs 膜包裹处理对牛肉菌落总数的影响
微生物的大量繁殖会导致牛肉腐败变质,同时产生的有害物质会危害食用者健康,因此菌落总数是评价冷鲜牛肉质量的重要指标。通过检测菌落总数的变化,可判断冷鲜牛肉的新鲜度。从图6 可以看出,随储藏天数的增加,对照、ZS-MR-3 h、ZS-MR-5.5 h、ZS-MR-11 h、ZS-MR-17 h 五个组的牛肉菌落总数总体均呈上升趋势。在储藏3、5、7、9 d 后,对照组未包膜牛肉的菌落总数均显著高于有不同接枝度的ZS-MRPs 膜包裹处理的牛肉样品(P<0.05),储藏第9 天对照组牛肉的菌落总数达到7.55 lg CFU/g,属于变质肉,而其余各组均低于5 lg CFU/g,说明ZS-MRPs膜的包裹处理有效抑制了微生物增长。在储藏3、5、7、9 d 后,ZS-MR-17 h 的菌落总数显著低于ZS-MR-3 h、ZS-MR-5.5 h(P<0.05),说明ZS-MRPs膜的抑菌效果与其接枝度呈正相关。ZS-MR-17 h 储藏3 d 后菌落总数为3.90 lg CFU/g,低于储藏1 d 的4.04 lg CFU/g,这可能是玉米醇溶蛋白美拉德反应过程中产生了过氧化氢、烯二醇、氨基还原酮和二羰基化合物等物质通过产生活性氧,破坏细菌细胞壁,起到了抑菌作用[33,34]。
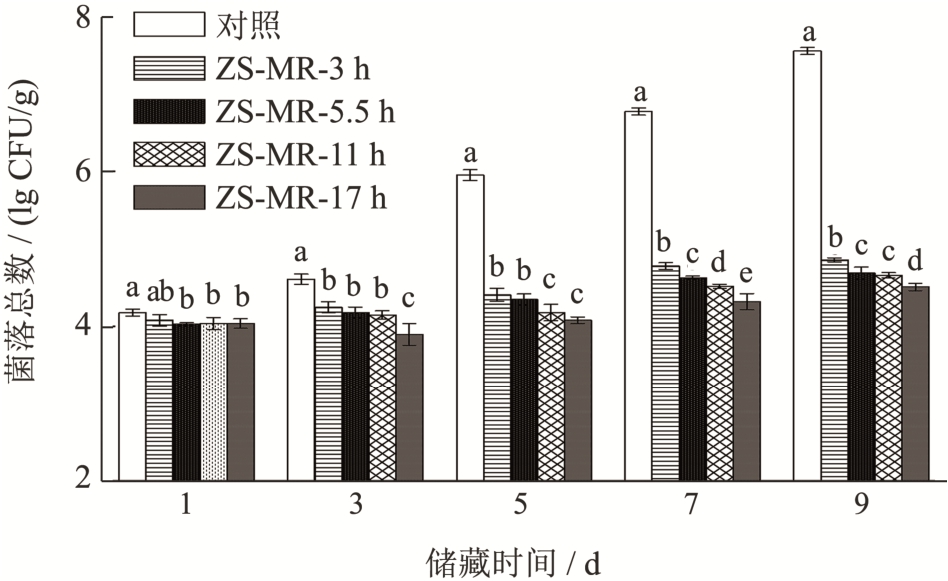
图6 不同ZS-MRPs膜包裹处理对牛肉储藏过程中菌落总数的影响
Fig.6 Effects of different ZS-MRPs film coating treatments on the total number of bacteria of beefduring storagefor 9d at 4 ℃
注:图中同一贮藏时间不同处理组之间的不同的小写字母表示具有显著性差异(P<0.05),下图同。
2.6 不同接枝度ZS-MRPs 膜包裹处理对牛肉pH 值的影响
牛肉屠宰后,由于发生糖酵解而产生大量乳酸和丙酮酸,并且在肌糖原分解完全后,肌肉纤维肉浆中的ATP 分解出磷酸,因此新鲜牛肉的pH 值为酸性。由图7 可见,储藏过程中对照组牛肉pH 值逐渐升高,在第7 天就达到了7.44,属于变质肉,可能是蛋白酶和腐败菌加速了蛋白质分解而导致的胺类和三甲胺等碱性物质释放造成的[35]。其余各组牛肉的pH 值虽也逐渐增大,但储藏9 d 时维持在5.89~6.4,说明ZS-MRPs 膜包裹处理对蛋白酶的活性和腐败菌的生长起到了抑制作用。
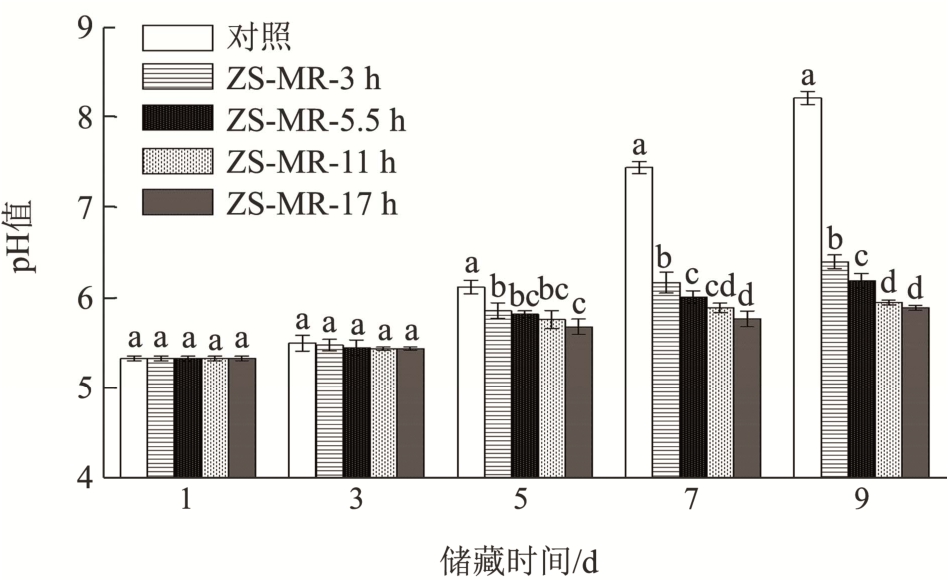
图7 不同ZS-MRPs 膜包裹处理对牛肉储藏过程中pH 值的影响
Fig.7 Effects of different ZS-MRPs film coating treatment on the pH value of bacteria in beef storage
2.7 不同接枝度ZS-MRPs 膜包裹处理对牛肉TVB-N 含量的影响
由于酶和微生物的作用,牛肉中部分蛋白质会分解产生挥发性盐基氮(TVB-N),所以TVB-N 含量是评价牛肉腐败程度的重要指标。GB 2707-2016《食品安全国家标准鲜(冻)畜、禽产品》将肉的新鲜度划分为3 个等级:TVB-N<15 mg/100 g 为一级鲜度,15 mg/100 g≤TVB-N≤20 mg/100 g 为二级鲜度,TVB-N>20 mg/100 g 为腐败肉。从图8 可知,储藏过程中各组牛肉的TVB-N 皆呈现增长趋势。在第3 天时,对照组牛肉的TVB-N 含量已达到25 mg/100 g,属于腐败肉,而经过不同接枝度的ZS-MRPs 膜包裹处理的四组牛肉,在第7 天才出现超过20 mg/100 g的腐败肉,且随接枝度增大,各组TVB-N 含量显著降低(P<0.05)。实验表明,ZS-MRPs 膜包裹处理能有效抑制牛肉中挥发性盐基氮的产生,延长牛肉的保鲜时间,且接枝度对保鲜效果有影响,随接枝度增大,保鲜效果越明显。
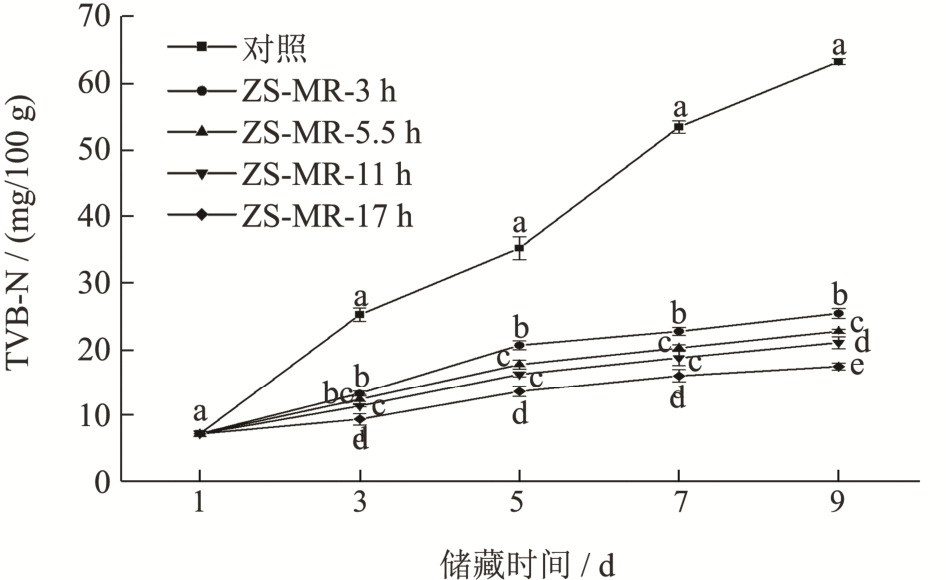
图8 不同ZS-MRPs膜包裹处理对牛肉储藏过程中总挥发性盐基氮的影响
Fig.8 Effects of different ZS-MRPs film coating treatment on the TVB-N in beef storage
2.8 不同接枝度ZS-MRPs 膜包裹处理对牛肉丙二醛含量的影响
牛肉储藏过程中脂肪的氧化会严重影响牛肉的感官和品质。而牛肉中的油脂氧化会产生丙二醛,属于硫代巴比妥酸反应物(Thiobarbituric Acid Reactive Substance,TBARs),可以因此可以通过分光光度法检测生成TBARs 含量,判断脂肪氧化程度,评价牛肉品质。
图9 是不同处理方式的牛肉在储藏过程中的丙二醛含量变化。对照组及不同接枝度ZS-MRPs 膜包裹处理的牛肉的丙二醛含量都在储藏过程中逐渐上升,但ZS-MRPs 膜包裹的牛肉的丙二醛含量均显著低于对照组(P<0.05)。且ZS-MRPs 的接枝度对脂肪氧化的抑制效果有影响,接枝度越高,抑制效果越好。储藏九天后,对照组和ZS-MR-3 h 组的牛肉的丙二醛含量分别达到1.02 mg/kg 和0.75 mg/kg,脂肪氧化严重,产生酸败气味。随美拉德时间的延长,ZS-MRPs 膜包裹的牛肉的TBARs 含量降低,这一结果与不同ZS-MRPs 膜的抗氧化性的实验结果一致。
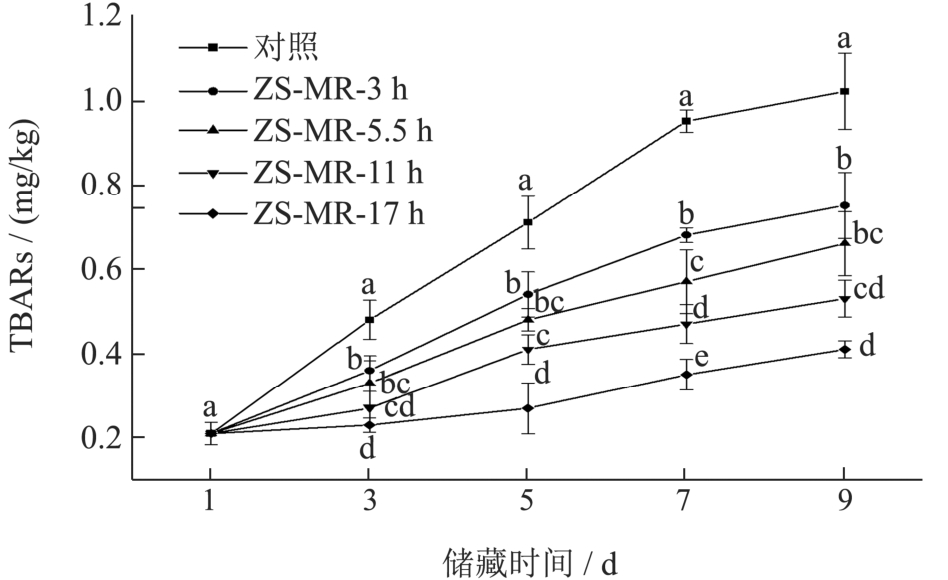
图9 不同ZS-MRPs膜包裹处理对牛肉储藏过程中丙二醛含量的影响
Fig.9 Effects of different ZS-MRPs film coating treatment on the TBARs in beef storage
2.9 不同接枝度ZS-MRPs 膜包裹处理对牛肉色度的影响
由图10a 可知,未经包膜处理的对照组和不同接枝度ZS-MRPs 膜包裹处理的牛肉在储藏过程中的L*值基本呈现出先上升后下降的趋势。储藏前期L*值增大,可能是因为牛肉蛋白质逐渐变性,使得牛肉保水性下降,水分渗出,使肉样表面反光性增强,L*值增大。储藏后期,由于肌红蛋白逐渐氧化生成高铁肌红蛋白,使肉样发暗,L*值减小[36]。储藏过程中对照组L*值由39.40 增长至43.29,始终显著高于处理组(P<0.05),这可能是因为ZS-MRPs 的抗氧化性抑制了牛肉中脂肪氧化,使水分流失减少。a*值的变化与肌红蛋白的含量和化学状态密切相关。由图10b 看出,对照组与处理组的a*值在储藏过程中呈现先升后降的趋势。贮藏前期,肌红蛋白氧化生成氧合肌红蛋白,a*值上升,贮藏后期,由于微生物代谢和脂质氧化产生自由基破坏高铁肌红蛋白还原酶,致使肉中氧合肌红蛋白逐步转变为高铁肌红蛋白,使a*值呈下降趋势[37]。储藏过程中对照组牛肉的a*值高于不同接枝度ZS-MRPs 膜包裹处理的牛肉,这可能是ZS-MRPs 抑制了氧合肌红蛋白氧化,维持了肉色稳定。图11 直观反映了储藏过程中各处理组牛肉色泽的外观变化,可以看出ZS-MRPs 膜的包裹起到了有效的保鲜和护色作用,且接枝度更高的ZS-MRPs 膜的保鲜护色作用越好。
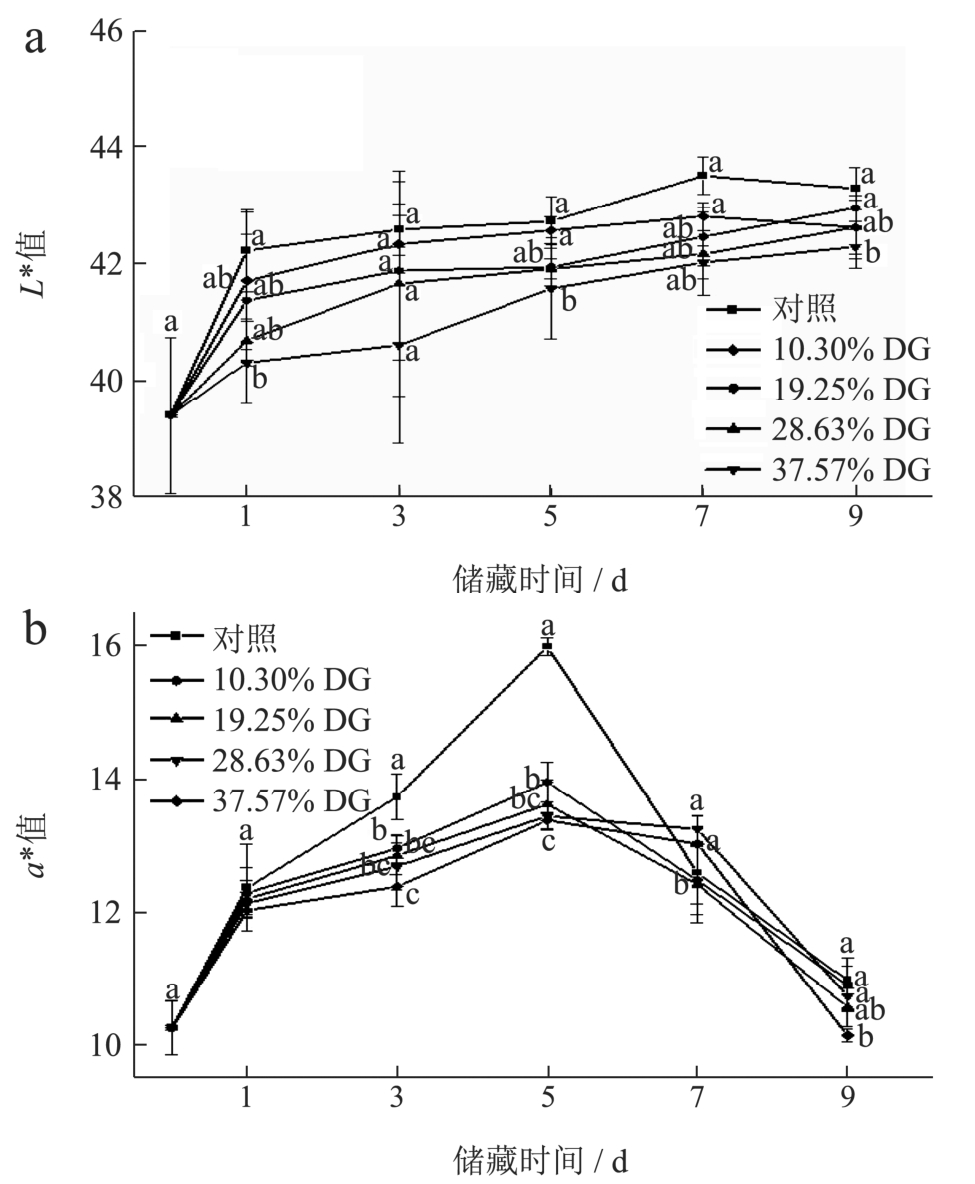
图10 不同ZS-MRPs 膜包裹处理对牛肉储藏过程中L*值(a)和a*值(b)的影响
Fig.10 Effects of different ZS-MRPs film coating treatment on the L* value (a) and a* value (b) in beef storage
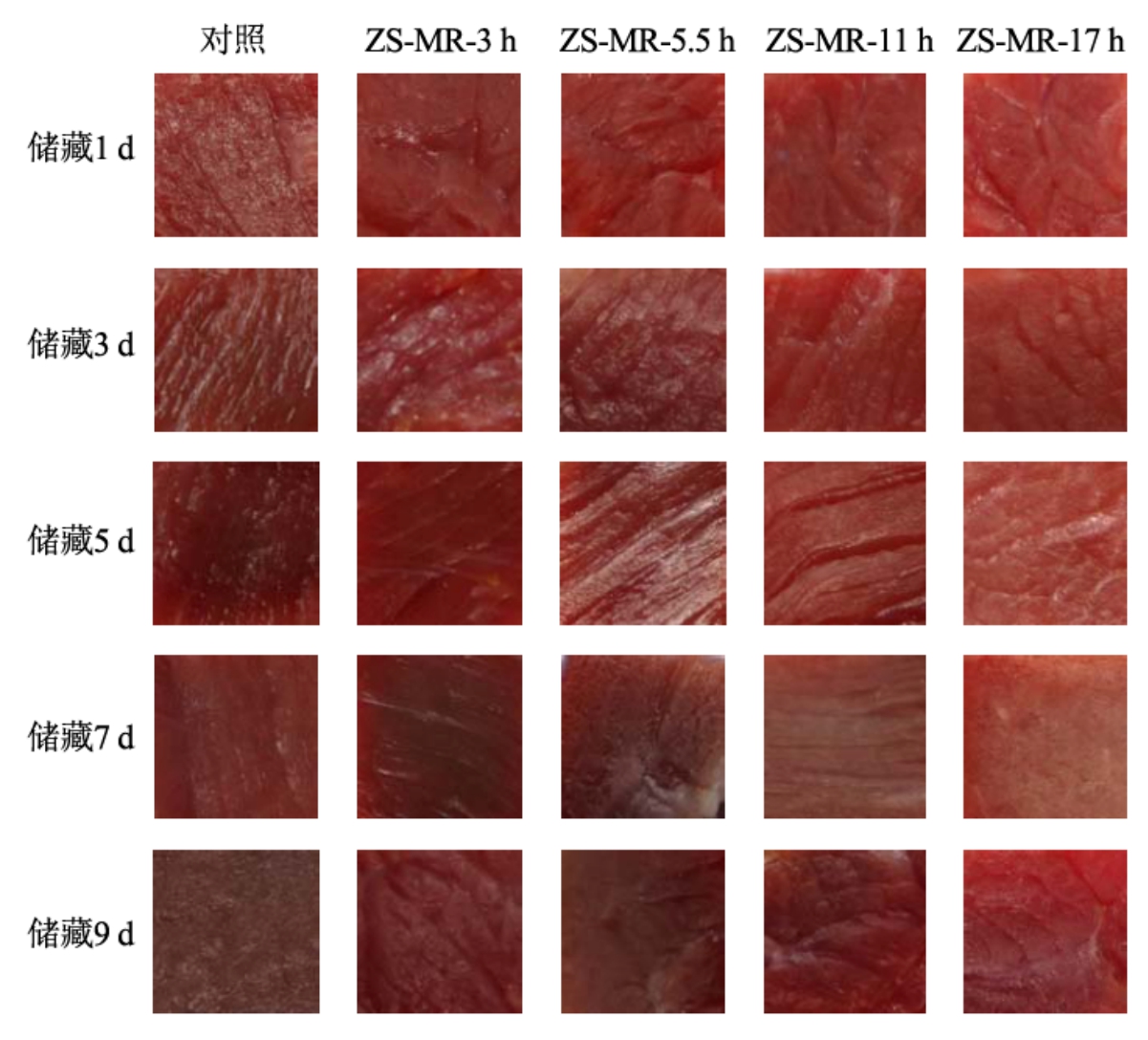
图11 储藏期间牛肉外观变化
Fig.11 Change in appearance of beef during storage
3 结论
本实验利用不同接枝度的ZS-MRPs 膜对新鲜牛肉进行保鲜处理,通过测定4 ℃储藏过程中不同处理组牛肉的鲜度指标来进行比较和分析。结果表明,与对照组相比ZS-MRPs 膜能显著减缓牛肉菌落总数、pH 值、TVB-N、TBARs 等指标的增长,起到了抑制牛肉腐败、维持牛肉色泽的保鲜效果。且接枝度从10.30%到37.57%范围内,随接枝度的增大,ZS-MRPs膜的保鲜效果更加显著。因此,ZS-MRPs 膜是一种安全绿色的保鲜手段,可以有效减缓牛肉在储藏、运输及销售过程中的腐败变质,延长牛肉保质期。
[1] Bhargava N,Sharanagat V S,Mor R S,et al.Active and intelligent biodegradable packaging films using food and food waste-derived bioactive compounds: A review [J].Trends in Food Science &Technology,2020,105: 385-401.
[2] Amiri S,Moghanjougi Z M,Bari M R,et al.Natural protective agents and their applications as bio-preservatives in the food industry: An overview of current and future applications [J].Italian Journal of Food Science,2021,331:55-68.
[3] Garavand F,Cacciotti I,Vahedikia N,et al.A comprehensive review on the nanocomposites loaded with chitosan nanoparticles for food packaging [J].Critical reviews in Food Science and Nutrition,2022,62(5): 1383-1416.
[4] 阮程程,张钰萌,熊国远,等.抗氧化可食膜在食用油和肉品保鲜中的应用[J].包装工程,2019,40(23):32-39.
[5] 赵娅英,史巧,王馨蕊,等.可食性膜在肉及肉制品保质中的应用研究进展[J].食品工业科技,2021,42(19):411-417.
[6] Chen G,Ali F,Dong S,et al.Preparation,characterization and functional evaluation of chitosan-based films with zein coatings produced by cold plasma [J].Carbohydrate Polymers,2018,202: 39-46.
[7] Argos P,Pedersen K,Marks M D M,et al.A structural model for maize zein proteins [J].Journal of Biological Chemistry.1982,257: 9984-9990.
[8] Zhang Y,Cui L,Che X,et al.Zein-based films and their usage for controlled delivery: Origin,classes and current landscape [J].Journal of Controlled Release,2015,206:206-219.
[9] Turasan H,Barber E A,Malm M,et al.Mechanical and spectroscopic characterization of crosslinked zein films cast from solutions of acetic acid leading to a new mechanism for the crosslinking of oleic acid plasticized zein films [J].Food Research International,2018,108: 357-367.
[10] Sun Y,Liu Z,Zhang L,et al.Effects of plasticizer type and concentration on rheological,physico-mechanical and structural properties of chitosan/zein film [J].International Journal of Biological Macromolecules,2020,143: 334-340.
[11] Li S,Lin J,Chen X.Effect of chitosan molecular weight on the functional properties of chitosan-maltose Maillard reaction products and their application to fresh-cut Typha latifolia L.[J].Carbohydrate Polymers,2014,102: 682-690.
[12] Zhang Q,Li L,Lan Q,et al.Protein glycosylation: a promising way to modify the functional properties and extend the application in food system [J].Critical Reviews in Food Science and Nutrition,2019 59(15): 2506-2533.
[13] Zhang Y,Deng L,Zhong H,et al.Impact of glycation on physical properties of composite gluten/zein nanofibrous films fabricated by blending electrospinning [J].Food Chemistry,2022,366: 130586.
[14] Wang K,Wu K,Xiao M,et al.Structural characterization and properties of konjac glucomannan and zein blend films [J].International Journal of Biological Macromolecules,2017,105(Pt 1): 1096-1104.
[15] Yu M,He S,Tang M,et al.Antioxidant activity and sensory characteristics of Maillard reaction products derived from different peptide fractions of soybean meal hydrolysate [J].Food Chemistry,2018,243: 249-257.
[16] Liu Q,Kong B,Han J,et al.Structure and antioxidant activity of whey protein isolate conjugated with glucose via the Maillard reaction under dry-heating conditions [J].Food Structure,2014,1(2): 145-154.
[17] Liang C,Yuan F,Liu F,et al.Structure and antimicrobial mechanism of ɛ-polylysine-chitosan conjugates through Maillard reaction [J].International Journal of Biological Macromolecules,2014,70: 427-434.
[18] Kandeepan G.Biodegradable Nanocomposite packaging films for meat and meat products: A review [J].Journal of Packaging Technology and Research,2021,5(3): 143-166.
[19] V A K,Hasan M,Mangaraj S,et al.Trends in edible packaging films and its prospective future in food: A review[J].Applied Food Research,2022,2(1): 100118.
[20] Wang L,Lei L,Wan K,et al.Physicochemical properties and biological activity of active films based on corn peptide incorporated carboxymethyl chitosan [J].Coatings,2021,11(5): 604.
[21] 王鲁慧,肖军霞,徐同成,等.湿热条件下大豆分离蛋白与葡萄糖、麦芽糖的美拉德反应[J].食品科学,2018,39(16):19-26.
[22] Zia M B,Namli S,Oztop M H.Physicochemical properties of wet-glycated soy proteins [J].LWT,2021,142: 110981.
[23] Laemmli U K.Cleavage of structural proteins during the assemblyof the head of bacteriophage T4 [J].Nature,1970,227: 680-685.
[24] Moradi M,Tajik H,Razavi Rohani S M,et al.Antioxidant and antimicrobial effects of zein edible film impregnated with Zataria multiflora Boiss.essential oil and monolaurin [J].LWT -Food Science and Technology,2016,72: 37-43.
[25] 李维正,杨丽华,韩玲,等.果胶-迷迭香精油复合膜协同冰温贮藏对牛肉保鲜的影响[J].食品与发酵工业,2021,47(20):146-151.
[26] 董潇,黄国清,肖军霞.玉米醇溶蛋白-葡萄糖美拉德反应产物制备姜黄素纳米颗粒[J].中国食品学报,2021,21(3):118-127.
[27] Tavasoli S,Maghsoudlou Y,Jafari S M,et al.Improving the emulsifying properties of sodium caseinate through conjugation with soybean soluble polysaccharides [J].Food Chemistry,2022,377: 131987.
[28] Naranjo G B,Malec L S,Vigo M.Reducing sugars effect on available lysine loss of casein by moderate heat treatment [J].Food Chemistry,1998,62(3): 309-313.
[29] Wang X,Zheng X,Liu X,et al.Preparation of glycosylated zein and retarding effect on lipid oxidation of ground pork [J].Food Chemistry,2017,227: 335-341.
[30] Soliman E A,Khalil A A,Deraz S F,et al.Synthesis,characterization and antibacterial activity of biodegradable films prepared from Schiff bases of zein [J].Journal of Food Science and Technology,2014,51(10): 2425-2434.
[31] 齐宝坤,赵城彬,杨树昌,等.绿豆分离蛋白-葡聚糖接枝反应及产物抗氧化性研究[J].中国食品学报,2018,18(12):74-80.
[32] Daglia M,Papetti A,Aceti C,et al.Isolation of high molecular weight components and contribution to theprotective activity of coffee against lipid peroxidation in a rat liver microsome system [J].Journal of Agricultural and Food Chemistry,2008,56(24): 11653-11660.
[33] Hauser C,Muller U,Sauer T,et al.Maillard reaction products as antimicrobial components for packaging films [J].Food Chemistry,2014,145: 608-613.
[34] Wuhr A,Deckert M,Pischetsrieder M.Identification of aminoreductones as active components in Maillard reaction mixtures inducing nuclear NF-κB translocation in macrophages [J].Molecular Nutrition &Food Research,2010,54(7): 1021 -1030.
[35] Arancibia M Y,Lopez-Caballero M E,Gomez-Guillen M C,et al.Chitosan coatingsenriched with active shrimp waste for shrimp preservation [J].Food Control,2015,54(1): 259-266.
[36] 郝瑞,余群力,陈颢予,等.复配天然保鲜剂结合冰温保鲜对牛肉保鲜效果的研究[J].食品与发酵工业,2020,46(16):177-182.
[37] 林娟,韩玲,陈颢予,等.甜瓜皮多酚的提取及其对牛肉保鲜效果的影响[J].食品与发酵工业,2021,47(14):168-175.