杂环胺(HAAs)是鱼肉、红肉、禽肉等高蛋白食物在热加工过程中以及一些烟草在燃烧时产生的一类多环芳香族化合物,对于人类及锯齿类动物具有致癌和致突变性。迄今为止已分离出了 20种食源性HAAs[1]。一些流行病学研究报告显示,频繁食用熟肉与结直肠癌、胰腺癌和前列腺癌风险升高之间存在一定关联[2-5]。由于人们的饮食结构和饮食习惯存在差异,且食物种类、烹制方式、加工时间、外源添加物等对熟肉中HAAs的含量影响极大[6-9]。目前无法对长期摄入的HAAs进行有效地定量评估,因而熟肉中产生的HAAs与癌症风险之间的联系也一直难以确定。目前常见的生物标记物有HAAs在尿液中的代谢物、毛发中的HAA、DNA-HAA加合物和蛋白质-HAA加合物,但尿液中的代谢物反应HAAs摄入周期有限,而毛发中的HAAs易受化学剂影响,DNA又具有自我修复能力。近年来,通过确立稳定的、长期的生物标记物对HAAs的摄入进行定量评估,以研究HAAs与癌症风险的关系备受期待。
2-氨基-1-甲基-6-苯基咪唑并[4,5-b]吡啶(PhIP)是煎烤红肉过程中产生最多的HAAs[10]。国际癌症研究机构(IARC)早已将PhIP定义为潜在人类致癌物(2B级)[11]。人体内的PhIP在细胞色素P450的作用下N-羟基化,再经II期酶的进一步激活产生nitrenium离子,然后与DNA反应诱发变异;N-羟基化的 PhIP代谢物(HONH-PhIP)也能在细胞色素P450或过渡金属的作用下氧化生成 N-亚硝化代谢物(NO-PhIP)。PhIP的N-氧化代谢物能与人血清白蛋白(HSA)34号位的半胱氨酸残基(Cys34)结合形成PhIP-HSA加合物[4,5](图1)。其中,PhIP-HSA亚磺酰胺加合物为主要的HSA加合产物,且在酸碱条件下不稳定性,易水解产生PhIP。本研究依据 PhIP在人体内的代谢途径,于体外合成PhIP-HSA加合物,通过高灵敏度的超高效液相色谱质谱联用法(UPLC-MS/MS)对PhIP-HSA加合物水解产物PhIP的定量,进而推测人血浆中的PhIP-HSA亚磺酰胺加合物的含量。以期通过人血浆中的PhIP-HSA亚磺酰胺加合物评估HAAs的摄入与相关癌症风险的关系。
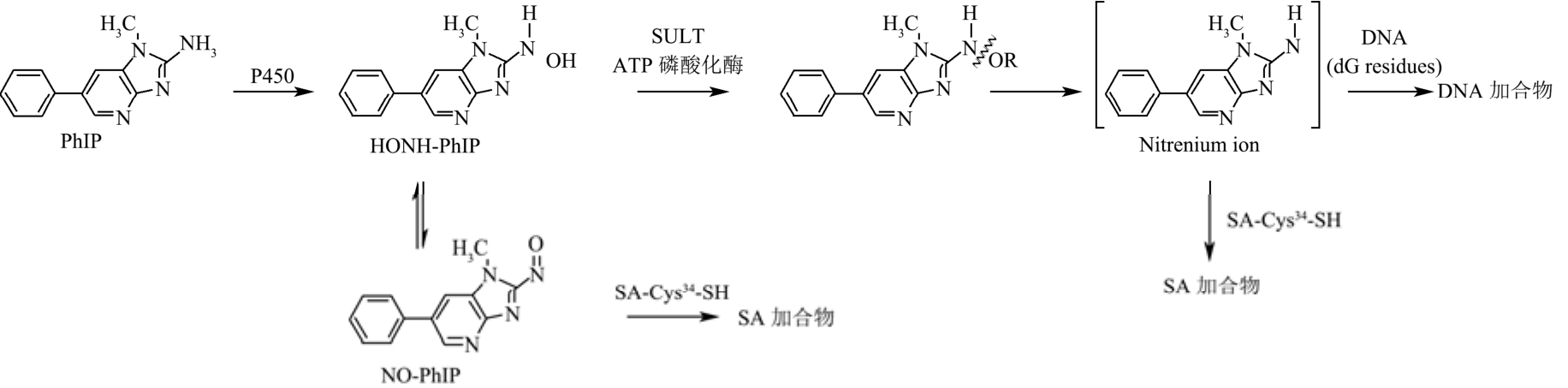
图1 PhIP人体内的代谢途径
Fig.1 Metabolic pathway of PhIP in human body
1 材料与方法
1.1 材料
1.1.1 主要材料
HRP固相萃取小柱(10 mg/1 mL)Pierce白蛋白去除树脂和Aquasil C18反相柱(2.1×150 mm,3 μm)购自美国Thermo公司。Amicon®Ultra-0.5-10 K超滤离心管购自美国Millipore公司。HiTrap Blue HP(5×1 mL)购自美国Cytiva公司。PD-10柱购自GE公司。
健康人血浆样本由南京医科大学附属苏州医院提供。
1.1.2 试剂
PhIP 及 2-氨基-1-甲基-6-苯基咪唑并[4,5-b]吡啶-d3([2H3]-PhIP,同位素纯度99%)购自加拿大Toronto Research Chemicals公司。HSA、水合肼(50%~60%)以及碳负载钯催化剂(Pd/C,10%)购自美国 Sigma公司。LC-MS级甲醇、乙腈、水和甲酸(50%)购自美国 Thermo公司。生物纯二甲基亚砜(DMSO)、色谱级乙酸、N,N-二甲基甲酰胺(DMF)和无水四氢呋喃(THF)购自阿拉丁化学试剂有限公司。
1.1.3 主要仪器设备
高效液相色谱采用美国 Thermo UtiMate 3000 UPLC系统,美国Thermo公司的Q Exactive高分辨率质谱仪,江苏海门其林贝尔仪器制造有限公司的MX-S漩涡混匀仪,上海康敏检验设备有限公司的MTC-100恒温混匀仪,上海安亭科学仪器厂TGL-16C台式离心机,ZLS-1真空离心浓缩仪,Evolution 220扫描型紫外可见分光光度计。
1.2 方法
1.2.1 人血浆中HSA的提取
1.2.1.1 HiTrap blue柱(1 mL)提取白蛋白
取200 μL 血浆与4 mL A(50 mmol/L KH2PO4,pH值7.0)在15 mL离心管中混匀,然后3 000 r/min离心5 min,取上层清液。上样前使用10 mL A液平衡HiTrap Blue小柱,然后以1 mL/min的速度上样。上样后10 mL A洗脱杂质,最后用3 mL B(50 mmol/L KH2PO4,1.5 mol/L KCl,pH值7.0)洗脱HSA,并收集。
1.2.1.2 Pierce白蛋白去除树脂提取白蛋白
取0.4 mL树脂液于微量离心柱中,12 000 r/min离心1 min,弃掉废液。向柱中加入200 μL Tris缓冲液(25 mmol/L Tris,75 mmol/L NaCl,pH值7.5),12 000 r/min离心1 min,弃掉废液。取40 μL血浆加入柱中,室温放置2 min后,12 000 r/min离心1 min,弃掉废液。加入50 μL Tris缓冲液洗脱杂质,并重复四次。最后加入200 μL B,12 000 r/min离心1 min,收集洗脱液。
1.2.1.3 Amicon®Ultra-0.5-10K 脱盐
将洗脱液移入Amicon®Ultra-0.5-10K超滤离心管中,15 000 r/min离心15 min,弃掉废液。然后用超纯水洗涤样品2次,15 000 r/min离心15 min,弃废液。收集超滤离心管里的样品,40 ℃下真空旋干。
1.2.2 PhIP-HSA亚磺酰胺加合物的酸水解
1.2.2.1 PhIP-HSA加合物的制备
PhIP-HSA亚磺酰胺加合物的制备方法参考文献并作了一定调整[12,13]。首先PhIP与NaNO2反应生成硝化代谢物(NO2-PhIP)。随后,以Pd/C为催化剂,通过还原NO2-PhIP合成HONH-PhIP。
取2 mg HSA溶于1 mL10 mM磷酸钾缓冲液(pH值 7.4),加入 30 nmol HONH-PhIP(HSA:HONH-PhIP的摩尔比=1:1)充分混合。混合液40 ℃下反应18 h。反应结束后,使用PD-10柱子去除未反应的PhIP代谢物。根据加合物在 320 nm的吸收对其进行初步定量。
1.2.2.2 PhIP-HSA亚磺酰胺加合物的酸水解
于2 mL离心管中加入75 fmol PhIP-HSA亚磺酰胺加合物和100 fmol [2H3]-PhIP。使用12 mol/L盐酸调节其盐酸浓度,然后 37 ℃下反应。反应结束后,1 mol/L NaOH调节pH值至~10,再用乙酸乙酯萃取。萃取液真空浓缩至约0.1 mL,加1 mL超纯水稀释。
1.2.2.3 PhIP的固相萃取
HRP固相萃取小柱预先用1 mL甲醇和1 mL超纯水预洗。样品以1 mL/min注入HRP小柱上后,2 mL 10%甲醇水溶液洗杂质,1 mL的甲醇洗脱PhIP并收集。洗脱液真空浓缩至全干。加入30 μL 50% DMSO复溶。
1.2.3 UPLC-MS/MS的分析
使用美国Thermo公司Hypersil GOLD C18色谱柱(2.1×100 mm,3 μm粒径)在UltiMate 3000 UPLC系统上对PhIP进行色谱分析。流动相A为φ=0.01%甲酸,5%乙腈水溶液;B为0.01%甲酸,95%乙腈。流速设置为200 μL/min,洗脱梯度:0~1 min 100% A到35% B,6 min到达100% B,并保持100% B 2 min。
使用高分辨率质谱仪Q Exactive(美国Thermo公司)在正电离模式下采集质谱。鞘气流速25 mL/min;辅助气流速15 mL/min;喷雾电压3.50 kV;毛细管温度设定为320 ℃。碰撞能为35。监测反应离子和保留时间(tR)如下:PhIP([M+H]+)m/z 225.10>210.09;[2H3]-PhIP([M+H]+)m/z 228.1>210.09,tR=5.63 min。碎片离子的m/z容差设置为5×10-6,保留时间的偏差不超过5%。
1.2.4 方法验证
检测方法在特异性、回收率、准确度、精密度和线性方面加以验证。通过监测阴性对照样品的潜在干扰离子信号,研究方法的特异性。
取 78 μg/mL的 PhIP标准储备液,用 φ=50%DMSO 配制 0.01、0.05、0.1、0.5、1、5、10 nmol/L系列浓度的PhIP标准液绘制标准曲线。
于 300 μL HSA(10 mg)水溶液中,分别加入0.20~200 fmol PhIP,其中未加PhIP的HSA样品用作阴性对照。每个浓度进行三次平行试验。于各样品中加入适量的12 M盐酸,使其终浓度为0.16 mol/L。37 ℃下水解1 h;反应完成后,1 mol/L NaOH调节pH至10,乙酸乙酯萃取。萃取液真空浓缩后,加1 mL超纯水进行固相萃取,50% DMSO复溶待测。
1.2.5 PhIP-HSA亚磺酰胺加合物的定量分析
取300 μL HSA(10 mg)水溶液,分别加入0、10、25、50、100、200 fmol PhIP-HSA 加合物和 100 fmol[2H3]-PhIP。0.16 mol/L HCl,37 ℃,水解1 h。经乙酸乙酯萃取及固相萃取后,加入30 μL 50% DMSO复溶。使用UPLC-MS/MS检测。
1.2.6 数据处理
使用Xcalibur 4.0版和Microsoft Excel进行数据处理。定量分析在选择反应监测(SRM)扫描模式下进行。
2 结果与讨论
2.1 HSA的提取方法对比
在对人血浆样本中HSA的提取对比发现,HiTrap Blue亲和柱的HSA提取量要稍高于Pierce白蛋白去除树脂的HSA提取量,大约高8%左右。而回收实验结果显示,HiTrap Blue亲和柱对HSA的回收率高于90%,实验的相对误差小于 5%。另外,HiTrap Blue亲和柱可以重复使用,在检测成本方面要远低于Pierce白蛋白去除树脂。因而在实际血浆样品处理时,选择使用HiTrap Blue亲和柱。
2.2 PhIP-HSA亚磺酰胺加合物的酸水解条件
通过调整酸水解的盐酸浓度和反应时间得出优化的酸水解条件:盐酸浓度为0.16 mol/L;反应时间:1 h。在优化的条件下,PhIP-HSA亚磺酰胺加合物的水解效率高达96%,相对偏差3.30%。重复性好。
2.3 加标回收率
由于未加 PhIP的阴性对照样品中没有检测到任何干扰信号,说明该检测方法具有特异性。样品中PhIP的量在5~200 fmol(1.12~44.80 pg)时,其回收率在57%~92%之间(表1)。PhIP的结构中含有苯环等相关官能团,在塑料离心管及玻璃进样瓶中均会发生一定的吸附。因而,当样品中PhIP处于较低含量的范围时,PhIP的吸附损耗对PhIP的回收率的影响随样品中PhIP含量的减少而逐步明显,导致PhIP的回收率随样品中 PhIP含量的减少而呈现明显的下降趋势。然而,当样品中PhIP的含量接近方法的检测限时,仪器的噪音对PhIP信号的干扰逐渐增大,PhIP的回收率呈现假增高趋势。因此,为了提高检测方法的准确性,在实际样品分析时,PhIP同位素标记的化合物[2H3]-PhIP作为内标添加到样品中对定量结果进行校正。
表1 加标回收率
Table 1 Spike recovery
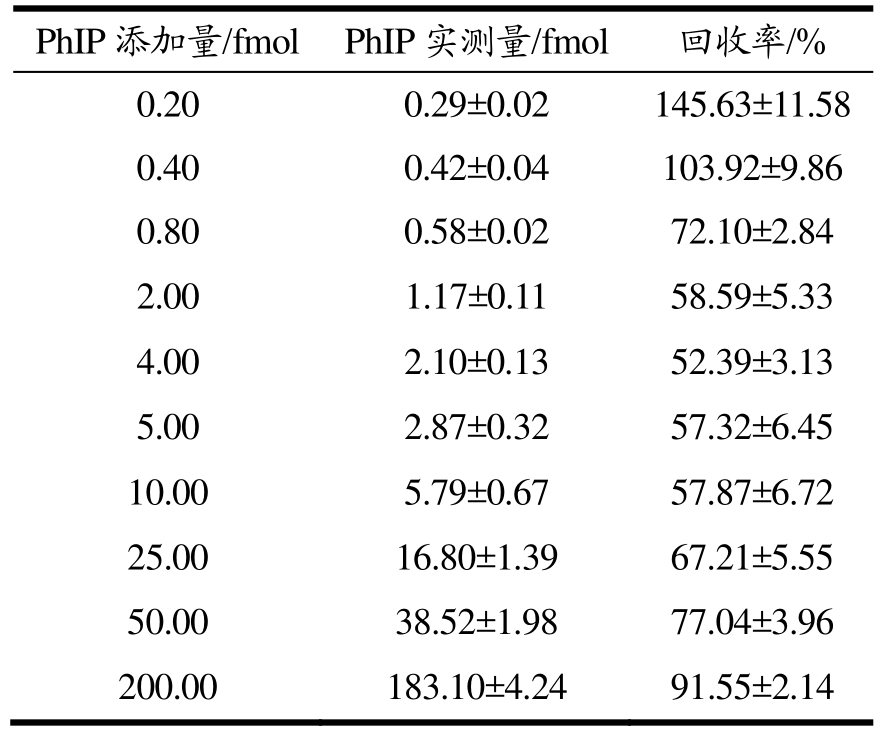
注:结果均以平均值±标准偏差表示。
PhIP添加量/fmol PhIP实测量/fmol 回收率/%0.20 0.29±0.02 145.63±11.58 0.40 0.42±0.04 103.92±9.86 0.80 0.58±0.02 72.10±2.84 2.00 1.17±0.11 58.59±5.33 4.00 2.10±0.13 52.39±3.13 5.00 2.87±0.32 57.32±6.45 10.00 5.79±0.67 57.87±6.72 25.00 16.80±1.39 67.21±5.55 50.00 38.52±1.98 77.04±3.96 200.00 183.10±4.24 91.55±2.14
根据加标数据绘制 PhIP的校正标准曲线。PhIP的含量与其定量离子的信号强度(峰面积)呈现良好的线性关系,回归方程为y=149 086x-9 903.2,相关系数 R²=1。
HiTrap Blue亲和柱对HSA的回收率>90%,且PhIP-HSA亚磺酰胺加合物的水解效率高达96%。通过信噪比3(S/N=3)和 10(S/N=10)分别对血浆中PhIP-HSA亚磺酰胺加合物的检测限和定量限进行估算,检测限低至 5×10-3 fmol/mg HSA,定量限低至1.50×10-3 fmol/mg HSA。
2.4 PhIP-HSA亚磺酰胺加合物加合物的定量分析
同日及异日分析的所有样品中内标[2H3]-PhIP的回收率均在70%~77%之间,这说明方法的重复性及精密度均良好。
不同浓度 PhIP-HSA亚磺酰胺加合物样品的UPLC-MS/MS检测结果如表2所示。PhIP-HSA亚磺酰胺加合物的含量与 PhIP的信号强度呈现线性正相关,y=1.011 7x+3.256 3,R²=0.998 7,满足定量分析标准。PhIP-HSA亚磺酰胺加合物的实际检测量与理论添加量的误差均<13%,在误差可容范围内。
表2 UPLC-MS/MS检测PhIP-HSA亚磺酰胺加合物
Table 2 Determination of the PhIP-HSA sulfinamide adduct by UPLC-MS/MS

加合物理论添加量/fmol PhIP实测量/fmol 加合物含量/fmol/mg HSA 10.00 11.11±0.84 1.11±0.08 25.00 26.87±4.77 2.69±0.48 50.00 56.19±2.52 5.62±0.25 100.00 108.15±5.95 10.82±0.60 200.00 203.48±8.11 20.35±0.81
2.5 讨论
现有流行病学研究的数据尚不足以对HAAs摄取与相关癌症之间的关系进行有效评估。食用熟肉后,其中的HAAs通过消化吸收进入血液,在酶的作用下经系列代谢与HSA结合形成加合物。因此HAA-蛋白质加合物的含量要远低于食物中HAAs的含量,因此对于检测方法灵敏度的要求要远高于检测食品中HAA的检测要求。通过选择稳定、可长期存在的HAAs生物标记物来对饮食摄入的HAAs进行定量,将有助于癌症风险的评估。目前,在研究的HAAs生物标记物较多,包括尿液中HAAs的相关代谢物、毛发中沉积的HAAs、HAAs与DNA形成加合物以及HAAs的蛋白质加合物等[14-16]。从理论上来说,选择标靶组织中 HAA-DNA加合物作为生物标记物评估HAAs的致癌风险最为直观合理。但对此类HAA-DNA加合物的研究极大地受限于人体活检标本的采集。血浆中HSA含量高3.40~5.40 g/dL,在长期摄入HAAs的情况下,血浆中形成的HAA-HSA加合物可能会在 HSA的生命周期内进行积累。因此人血中HAA-HSA加合物可能相对容易进行定量检测。
使用加速器质谱技术检测PhIP-HSA加合物的研究发现,摄入70~84 µg PhIP(相当于175 g的熟鸡肉的PhIP量)的24 h后,人血中每毫克HSA所含的加合物量在飞摩尔级(fmol)水平最高可达到20.81 fmol PhIP/mg HSA[17]。Bellamri等[10]的研究也发现,随着熟肉摄入的增加,人血中PhIP-HSA加合物的含量显著增加。同时,随着熟肉的持续食用,人血中PhIP-HSA加合物有一定程度的积累。本研究通过优化血浆中蛋白质的提取方法和酸水解条件等手段,建立了高灵敏度的血浆中PhIP-HSA亚磺酰胺加合物的 UPLC-MS/MS方法。方法在一定程度节省检测成本及检测时间的同时,可以对人血中高于5×10-3 fmol/mg HSA浓度的PhIP-HSA亚磺酰胺加合物进行有效检测,比文献检测方法的灵敏度提高了7~8倍[10]。考虑到目前血浆样本的取样量仅200 µL,如果适当增加血浆的用量至1 mL,PhIP-HSA亚磺酰胺加合物的检测限应该可以再降低5倍。在研究食物致癌物HAAs与相关癌症风险的关系时,使用该方法评估常食用熟肉的健康人及肠癌患者的HAAs摄入是较为可行的。
3 结论
本研究采用 UPLC-MS/MS技术,建立了食物致癌物HAAs与HSA形成的亚磺酰胺加合物的准确、高灵敏度检测方法。在对人血浆样本中 HSA的提取对比发现,HiTrap Blue亲和柱对HSA的回收率>90%,在盐酸浓度为0.16 mol/L,反应时间为1 h的情况下,PhIP-HSA亚磺酰胺加合物的水解效率高达 96%。样品中PhIP的量在5~200 fmol(1.12~44.80 pg)时,其回收率在57%~92%之间,PhIP的回收率随样品中PhIP含量的减少明显降低,样品中内标[2H3]-PhIP的回收率均在70%~77%。通过信噪比3(S/N=3)和10(S/N=10)分别对血浆中PhIP-HSA亚磺酰胺加合物的检测限和定量限进行估算,检测限低至5×10-3 fmol/mg HSA,定量限低至1.50×10-3 fmol/mg HSA。所以,该方法可以在节约样本的基础上具有特异性的检测 HAAs与HSA形成的亚磺酰胺加合物。
[1]Nadeem H R, Akhtar S, Ismail T, et al.Heterocyclic aromatic amines in meat: formation, isolation, risk assessment, and inhibitory effect of plant extracts [J].Foods, 2021, 10(7):1466
[2]Iwasaki M, Tsugane S.Dietary heterocyclic aromatic amine intake and cancer risk: epidemiological evidence from Japanese studies [J].Genes and Environment, 2021, 43(1):1-10
[3]Bouvard V, Loomis D, Guyton K Z, et al.Carcinogenicity of consumption of red and processed meat [J].The Lancet Oncology, 2015, 16(16): 1599-1600
[4]Marchand L L.The role of heterocyclic aromatic amines in colorectal cancer: the evidence from epidemiologic studies[J].Genes and Environment, 2021, 43(1): 20
[5]Punnen S, Hardin J, CHENG I, et al.Impact of meat consumption, preparation, and mutagens on aggressive prostate cancer [J].PLoS One, 2011, 6: e27711
[6]Suleman R, HUI T, WANG Z, et al.Comparative analysis of charcoal grilling, infrared grilling and superheated steam roasting on the colour, textural quality and heterocyclic aromatic amines of lamb patties [J].International Journal of Food Science & Technology, 2020, 55(3): 1057-1068
[7]张兰,高天丽,刘永峰,等.八种中式烹饪工艺对牛肉中多环芳烃、反式脂肪酸和亚硝酸盐的影响[J].中国农业大学,2017, 50(6):1126-1138
[8]Özsaraç N, Kolsarici N, Demirok Soncu E, et al.Formation of heterocyclic aromatic amines in doner kebab cooked with different methods at varying degrees of doneness [J].Food Additives & Contaminants: Part A, 2019, 36(2): 225-235
[9]Yao M, Khan I A, Cheng Y, et al.Effects of cooking methodsand tea marinades on the formation of heterocyclic amines and Benzo[a]pyrene in grilled drumsticks [J].Journal of Food Protection, 2020, 83(2): 365-376
[10]Bellamri M, WANG Y, Yonemori K, et al.Biomonitoring an albumin adduct of the cooked meat carcinogen 2-amino-1-methyl-6-phenylimidazo [4,5-b]pyridine in humans [J].Carcinogenesis, 2018, 39(12): 1455-1462
[11]Alaejos M S, Pino V, Afonso A M.Metabolism and toxicology of heterocyclic aromatic amines when consumed in diet: influence of the genetic susceptibility to develop human cancer.A review [J].Food Research International,2008, 41(4): 327-340
[12]PENG L, Turesky R J.Optimizing proteolytic digestion conditions for the analysis of serum albumin adducts of 2-amino-1-methyl-6-phenylimidazo [4,5-b]pyridine, a potential human carcinogen formed in cooked meat [J].Journal of Proteomics, 2014, 103: 267-278
[13]PENG L, Turesky R J.Mass spectrometric characterization of 2-amino-1-methyl-6-phenylimidazo [4,5-b]pyridine N-oxidized metabolites bound at Cys34 of human serum albumin [J].Chemical Research in Toxicology, 2011, 24(11):2004-2017
[14]彭利娟.食品致癌物杂环胺的生物标记物的研究进展[J].武汉轻工大学学报,2016,35(2):1-11
[15]Sabbioni G, Turesky R J.Biomonitoring human albumin adducts: the past, the present, and the future [J].Chemical Research in Toxicology, 2017, 30(1): 332-366
[16]Bellamri M, Walmsley S J, Turesky R J.Metabolism and biomarkers of heterocyclic aromatic amines in humans [J].Genes and Environment, 2021, 43(1): 1-32
[17]Dingley K H, Curtis K D, Nowell S, et al.DNA and protein adduct formation in the colon and blood of humans after exposure to a dietary-relevant dose of 2-amino-1-methyl-6-phenylimidazo [4,5-b]pyridine [J].Cancer Epidemiology Biomarkers & Prevention, 1999, 8(6):507-512