苹果别名平安果、超凡子,《神农本草经》上记为木柰,是蔷薇科苹果属的一种植物。苹果与葡萄、柑桔、香蕉并称世界四大水果,在中国东北、华北、华东等地区广泛栽培,也是我国产量最多、销售期最长的水果[1,2]。苹果含有丰富的营养物质,如维生素、矿物质、糖类、膳食纤维和多酚等。美国康奈尔大学的刘瑞海教授团队[3]发现在生产苹果果酱和罐装苹果过程中会造成大量的苹果果皮浪费,其通过干燥研磨可以变废为宝,并在之后的研究中表明其具有较高的多酚含量和较强的生物活性,如抗氧化和抗增殖[4]。
国际上将益生菌的定义为:活的微生物,在摄入足量时能促进宿主健康。近年来,益生菌在调节肠道菌群的基础功能上,被挖掘了更多生物活性。当今疫情大流行,研究证明,益生菌的摄入增强了严重急性呼吸系统综合征冠状病毒2型(Severe Acute Respiratory Syndrome Coronavirus Type 2,SARS-CoV2)的特异性抗体IgM 和IgG,通过与宿主的免疫系统相互作用,来改善新冠病毒患者的症状和缩短持续时间[5]。近期,幽门螺旋杆菌被美国卫生及公共服务部明确为致癌物质,其能导致胃炎、胃溃疡甚至胃癌,与心血管与代谢疾病也有一定联系[6],我国感染率接近60%。Wang等[7]使用抗生素与益生菌联合治疗,结果表明益生菌能缓解治疗后的菌群失调,加强治疗效果。
益生元能够选择性刺激肠道菌生长,解决益生菌定植难的问题,与益生菌协同发挥作用。过去的益生元是指低聚糖,而新兴的益生元拓展到了植物多糖和多酚等领域。植物提取物富含多酚,被认为是生物利用度较低的物质,但是通过肠道菌群的介导,多酚能促进益生菌的生长,经益生菌转化后的糖苷配基具有更高的生物活性,从而建立多酚与益生菌的互惠关系[8]。Zahid等[9]将苹果皮添加到益生菌的培养基中,发现其促进了干酪乳杆菌、鼠李糖乳杆菌和动物双歧杆菌的增殖,但把功劳归结于高纤维含量。而在本研究利用丙酮萃取出苹果皮提取物并将其添加到益生菌培养基中,评估发酵过程中的生物量及pH值,并分析其中多酚组分的变化,旨在探究苹果皮提取物中多酚对益生菌的益生活性和它们之间的相互作用,使其成为潜在的益生元,为具有益生特性产品的开发提供了新的思路和选择。
1 材料与方法
1.1 材料与试剂
苹果皮粉(AppleActiv™)由加拿大Leahy Orchard股份有限公司提供;低聚半乳糖(Galactooligosaccharides,GOS)从中国山东省德州市保龄宝生物有限公司购入;长双歧杆菌(BI-05)、嗜酸乳杆菌(LA-14)、副干酪乳杆菌(LPC-G110)和鼠李糖乳杆菌(LR-G14)从广东时代食品与生命健康研究所获得;多酚标准品均从上海源叶生物科技有限公司购得;所有其他化学品和溶剂均为分析级或液相级。
1.2 主要仪器设备
AL-B应用型厌氧工作站,大连速优博生物技术有限公司;雷磁PHS-3E型pH计,上海仪电科学仪器股份有限公司;752N可见分光光度计,上海仪电(集团)有限公司;Waters高效液相色谱仪,美国沃特世有限公司;Supersil ODS2色谱柱(250×4.6 mm,5 μm),大连依利特分析仪器有限公司。
1.3 苹果皮提取物的制备
参考He等[10]的方法,略有改动。
游离态的提取:准确称取苹果皮粉20.00 g,按料液比1:10(m/V)加入200 mL预冷的φ=80%冰丙酮溶液,用手持均质机均质(12 000 g,5 min),之后将混合液离心(8 000 g,20 min,4 ℃),收集上清液。以上操作重复 5~6次,直至上清液接近无色澄清为止。收集到的上清液在45 ℃下真空旋转蒸发浓缩至完全,超纯水吹打复溶,-40 ℃冰冻过夜,冷冻干燥(-50 ℃,0.04 mbar,72 h),低温密封保存。
结合态的提取:在上述提取游离酚剩余的粉渣中加入20 mL NaOH(4 mol/L)溶液,不断震荡混合完全,消化1 h后加入浓盐酸中和,并调节pH值至2.0。之后用乙酸乙酯萃取混合液中的活性物质,离心(12 000 g,10 min)收集上清液,反复萃取直至乙酸乙酯层无色透明。收集到的上清液在 45 ℃下真空旋转蒸发浓缩至完全,超纯水吹打复溶,-40 ℃冰冻过夜,冷冻干燥(-50 ℃,0.04 mbar,72 h),低温密封保存。
1.4 总酚含量的测定
总酚含量的测定按照福林酚法[11]进行。吸取待测液和福林酚试剂各200 μL,混合均匀,室温避光静置5 min,加入2 mL m=7% NaCO3溶液,用超纯水补充反应体系至4 mL,震荡,避光静置90 min,760 nm处测定吸光值。按照标准曲线 Y=5.115×X+0.071 67(R2=0.999 3),以没食子酸为当量(Gallic Acid Equivalent,GAE),计算苹果皮多酚的总多酚含量。
1.5 总黄酮含量的测定
总黄酮含量的测定按照亚硝酸钠-硝酸铝法[12]进行。吸取0.5 mL待测液与4.5 mL 30%乙醇、0.3 mL m=5%NaNO2溶液混合均匀室温下避光静置 6 min,再加入4 mL 1.0 mol/L NaOH,充分振荡,避光静置15 min,测定510 nm处吸光值。按照标准曲线Y=1.589X-0.001 8(R2=0.999 6),以儿茶素为当量(Catechin Equivalent,CE),计算苹果皮多酚总黄酮含量。
1.6 多酚组分液相色谱分析
多酚组分分析采用高效液相色谱法(High Performance Liquid Chromatography,HPLC)[13]。色谱柱为反相C18(250×4.6 mm,5 μm),采用梯度洗脱,流动相A(0.1%三氟乙酸水溶液)与B(乙腈),洗脱程序如表1;柱温设定为35 ℃,检测波长设定为280 nm,检测进样量为10 μL。各组分含量根据标准曲线计算。
表1 洗脱程序
Table 1 Elution procedure
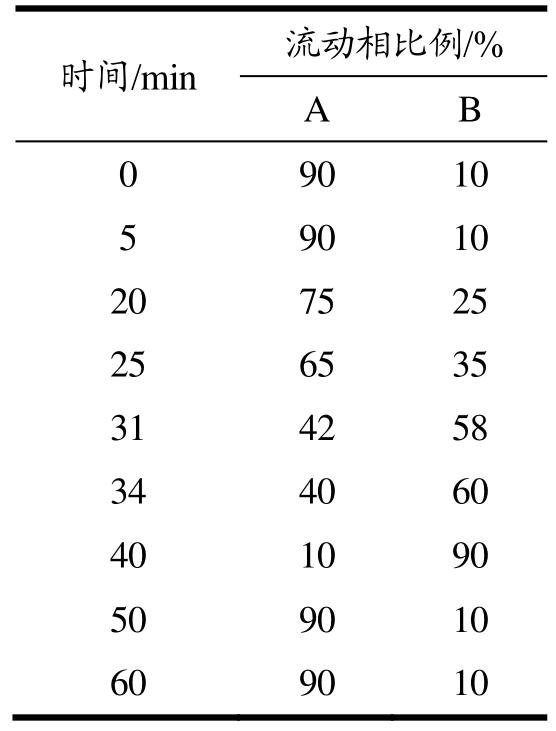
时间/min 流动相比例/%A B 0 90 10 5 90 10 20 75 25 25 65 35 31 42 58 34 40 60 40 10 90 50 90 10 60 90 10
1.7 体外培养益生菌
蛋白胨酵母葡萄糖(Peptone Yeast Extract Glucose,PYG)肉汤培养基(1 000 mL配方):20 g蛋白胨、5 g 葡萄糖、10 g 酵母浸粉、0.08 g NaCl、0.008 g CaCl2、0.008 g MgSO4、0.08 g K2HPO4、0.4 g NaHCO3、0.5 g L-半胱氨酸盐,在121 ℃条件下灭菌20 min,无菌条件下加入4 mL氯化血红素(5 mg/mL,0.5 g氯化血红素溶于 1 mL 1 mol/L NaOH,加超纯水定容至100 mL)、1 mL VK1(10 mg/mL,1 g VK1加无水乙醇定容至100 mL),在厌氧工作站中除氧,备用。
基础培养基(1 000 mL配方):2.0 g酵母浸粉、2.0 g蛋白胨、0.1 g NaCl、0.04 g KH2PO4、0.04 g K2HPO4、0.01 g CaCl2、0.01 g MgSO4·7H2O、2.0 g NaHCO3、0.5 g L-半胱氨酸盐、0.5 g 猪胆酸盐、2.0 mL Tween 80,在121 ℃条件下灭菌20 min,无菌条件下加入 4 mL氯化血红素(5 mg/mL)、1 mL VK1(10 mg/mL),在厌氧工作站中除氧,备用。
长双歧杆菌,嗜酸乳杆菌,副干酪乳杆菌和鼠李糖乳杆菌在PYG肉汤培养基中培养至稳定期,然后将100 μL培养物加入含有5%(m/V)苹果皮提取物(APE组)或低聚半乳糖(GOS组,阳性对照)的9.9 mL新鲜基础培养基中。不再另外添加任何碳源的基础培养基为空白对照(Blank组)。在厌氧工作站中于37 ℃下孵育24 h。于0、2、3、4、6、8、12和24 h,取出样品立即冰水浴5 min之后分成两部分。一部分用于测定pH值和生物量(OD600 nm,发酵液的光密度值可用于测量发酵液中的细菌数量)。将另一部分以8 000 r/min离心10 min,并通过0.22 μm膜过滤后续进行HPLC。
1.8 数据处理
所有试验数据¯x±sd(n=3)表示,采用SPSS 21.0进行数据处理,GraphPad Prism 9进行作图,以p<0.05为统计学差异。
2 结果与讨论
2.1 苹果皮提取物的多酚组分分析
2.1.1 苹果皮多酚的总酚及总黄酮含量
从苹果皮粉中得到提取物,其中游离态得率为22.5%、结合态得率为0.84%,两者相差26倍。测得游离态、结合态中的总酚分别为11.06、0.11(mg GAE/g,RDW),总黄酮含量分别为 9.38、0.07(mg CE/g,RDW),两种酚类的两种物质含量相差100多倍。结合态提取物得率太低,考虑到之后试验的提取物的用量,结合态提取物不再进行后续试验,文章中的苹果皮提取物(APE)均指苹果皮中的游离态提取物。国内研究苹果果皮的较少,将其分为游离态和结合态的更少。颜源凤等[14]提取了国内嘎啦果、红蛇果和红富士三个品种的多酚,发现果皮中的多酚含量远高于果肉和果核。孙华迪等[15]优化了超临界 CO2萃取工艺对红富士苹果皮中的多酚进行提取,最大含量为7.89 GAE mg/g。
表2 苹果皮提取物的总酚及总黄酮含量
Table 2 Total phenol and total flavonoid content of apple peel polyphenol
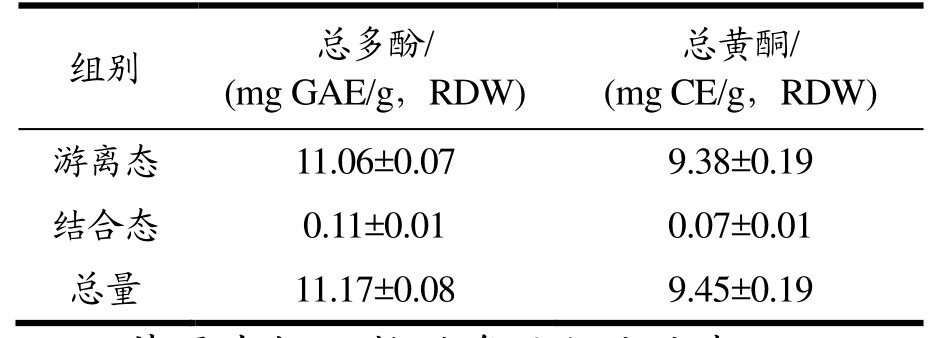
组别 总多酚/(mg GAE/g,RDW)总黄酮/(mg CE/g,RDW)游离态 11.06±0.07 9.38±0.19结合态 0.11±0.01 0.07±0.01总量 11.17±0.08 9.45±0.19
2.1.2 苹果皮提取物的多酚组分分析
从图1和表3可以看出,APE的HPLC色谱图中的峰 1-13根据保留时间和标准品分别鉴定为没食子酸、绿原酸、香草酸、咖啡酸、表儿茶素、表没食子儿茶素没食子酸酯(Epigallocatechin Gallate,EGCG)、芦丁、金丝桃苷、异槲皮苷、阿魏酸、槲皮苷、二氢黄酮苷和根皮苷。与之前报导的一样,苹果皮中含有大量的生物活性物质,通常以糖苷结合键的形式存在[16]。其中,根皮苷、金丝桃苷和槲皮苷是APE中的主要植物化学成分,其含量分别为 515.54、530.06、459.04 mg/100 g。根皮苷通过与核转录因子Nrf2的结合,能显著缓解小鼠力竭运动引起的疲劳[17]。金丝桃苷对预防和治疗肥胖症具有有益作用,低剂量可以抑制 3T3-L1前脂肪细胞分化成的成熟脂肪细胞前期脂肪的生成,而高浓度则可以在后期减少脂肪的积累[18]。槲皮苷具有抗凝血活性,可以成为治疗血栓性疾病的有效药物[19]。丰富的多酚组成使苹果皮提取物拥有丰富的生物活性。
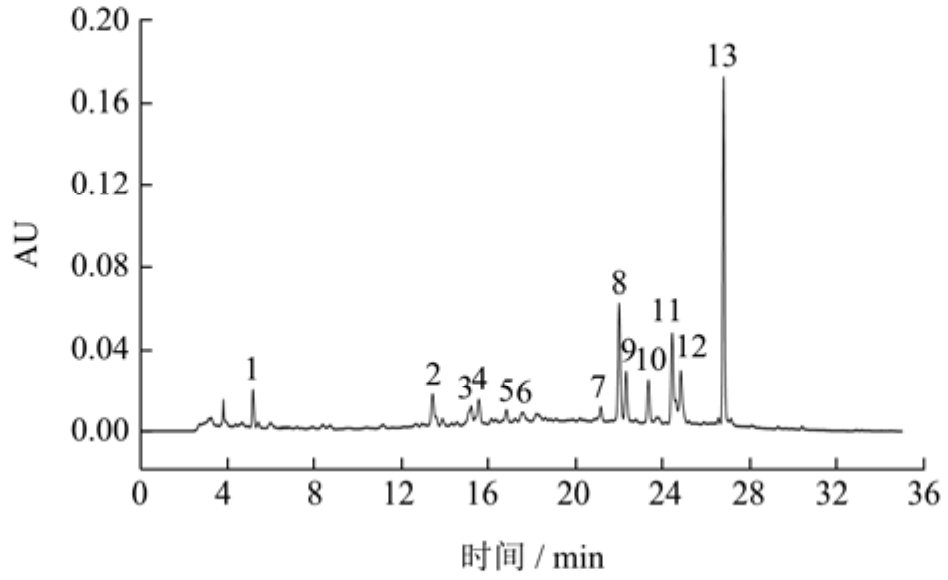
图1 苹果皮提取物的高效液相色谱图
Fig.1 High performance liquid chromatogram of apple peel extract
表3 苹果皮提取物的多酚组分含量
Table 3 Polyphenol fraction content of apple peel extract
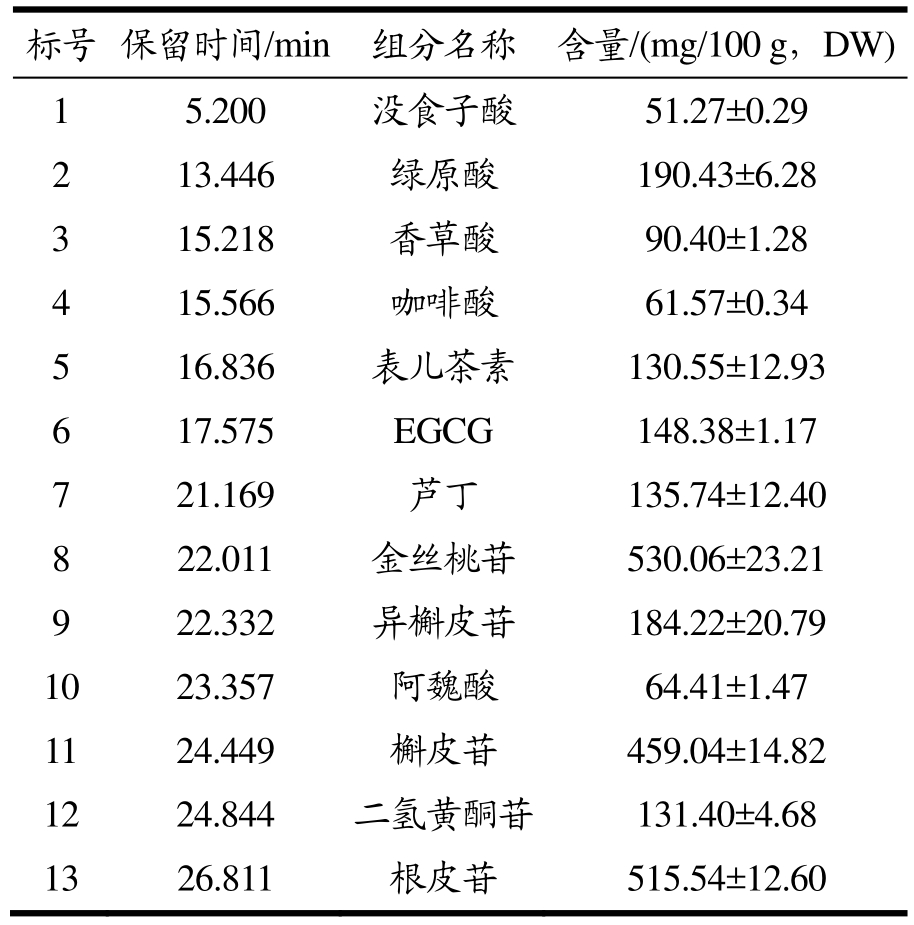
标号 保留时间/min 组分名称 含量/(mg/100 g,DW)1 5.200 没食子酸 51.27±0.29 2 13.446 绿原酸 190.43±6.28 3 15.218 香草酸 90.40±1.28 4 15.566 咖啡酸 61.57±0.34 5 16.836 表儿茶素 130.55±12.93 6 17.575 EGCG 148.38±1.17 7 21.169 芦丁 135.74±12.40 8 22.011 金丝桃苷 530.06±23.21 9 22.332 异槲皮苷 184.22±20.79 10 23.357 阿魏酸 64.41±1.47 11 24.449 槲皮苷 459.04±14.82 12 24.844 二氢黄酮苷 131.40±4.68 13 26.811 根皮苷 515.54±12.60
2.2 苹果皮提取物的益生活性
双歧杆菌和乳酸杆菌因其优异的抗氧化、抗炎和抗肥胖特性而成为具有代表性的益生菌[20,21]。本研究选择长双歧杆菌(Bifidobacterium longum,BL)、嗜酸乳杆菌(Lactobacillus acidophilus,LA)、副干酪乳杆菌(Lactobacillus paracasei,LP)和鼠李糖乳杆菌(Lactobacillus rhamnosus,LR)进行体外培养,通过测定其发酵过程中的生物量和pH值来评估苹果皮提取物对益生菌的影响。
2.2.1 益生菌发酵过程中生物量的变化
如图2所示,与Blank组相比,在BL、LA、LP和LR的培养基中补充APE或GOS在不同程度上刺激了益生菌的生长。APE组中长双歧杆菌、嗜酸乳杆菌和副干酪乳杆菌的生物量在前0~3 h期间缓慢增加,而在4~6 h期间显著增加(p<0.05),在12 h后生物量变化非常小,最终OD600 nm值稳定在1.1左右。GOS组中的BL、LA和LP的生物量在整个试验过程中持续增加。蒋玉兰等[22]发现低浓度的茶多酚促进保加利亚乳杆菌的生长。Molan等[23]在短双歧杆菌的培养基中添加了水溶性的蓝莓多酚,菌株的生物量显著增加。然而,鼠李糖乳杆菌生长较慢,最终生物量少于其他菌株,这可能是由于益生菌利用碳源的能力取决于其底物偏好和酶对复杂碳源的水解催化能力。此外,鼠李糖乳杆菌对多酚更敏感,低浓度的多酚容易起到抑制生长的作用[24]。结果显示,益生菌在添加了苹果皮提取物的培养基中适应期较短,迅速进入生长期,生长速度快,在12 h后进入稳定期,说明益生菌能够以苹果皮提取物作为碳源维持生命繁殖、生长代谢。
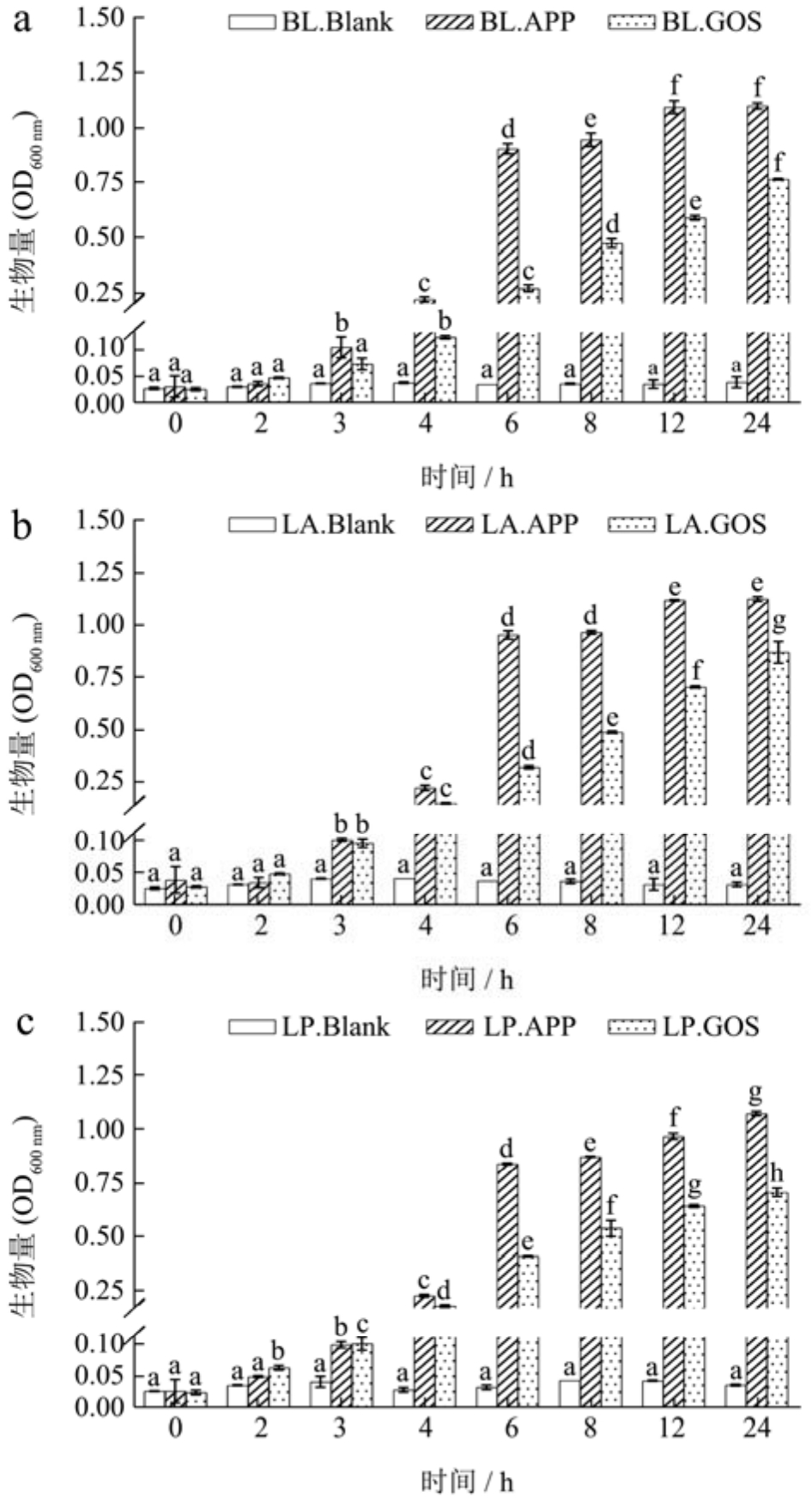
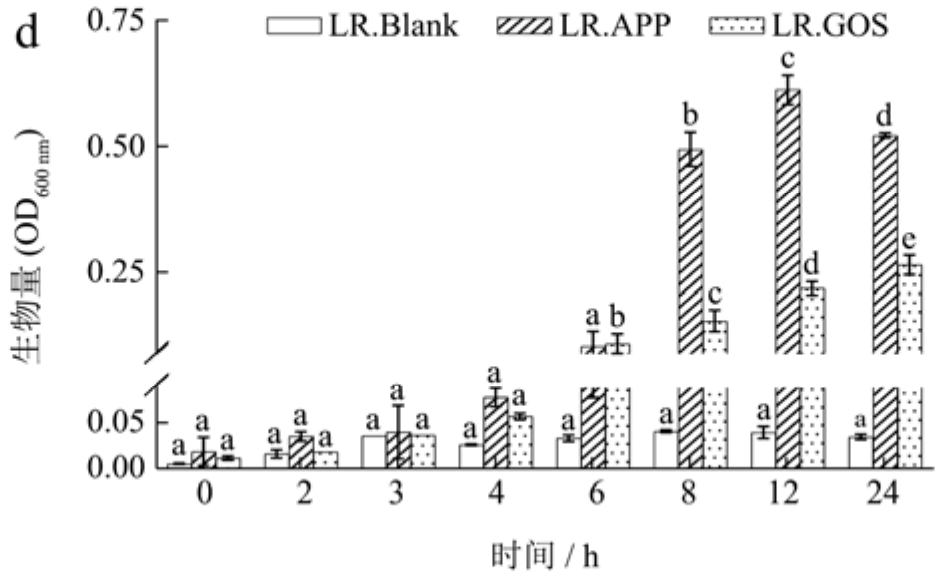
图2 益生菌发酵过中生物量的变化
Fig.2 Changes in biomass during probiotic fermentation
2.2.2 益生菌发酵过程中pH值的变化
从图3可以看出,在发酵的24 h期间,Blank组中四种益生菌的pH值几乎没有变化(p>0.05),始终维持在7.00~6.80左右。发酵时间从0 h至6 h,APE组中BI、LA、LP和LR的pH值分别从7.0左右下降至5.40、5.13、4.92和6.13,GOS组中的pH值下降至5.32、4.85、4.76和6.15,各组均存在显著差异性(p<0.05)。鼠李糖乳杆菌在生长量增加不明显的同时,代谢产酸量也较少。发酵12 h后,APE组pH值分别下降至4.10、3.98、4.02和4.61,GOS组4.08、3.98、3.98和4.80,前后变化显著(p<0.05)。发酵结束时,APE组 pH值最终分别达到 3.88、3.66、3.68和4.16,GOS组的变化相似。益生菌产生有机酸会降低肠道环境pH值,对其竞争对手产生不利影响,并降低病原体引起肠道感染的风险[25]。国内多利用整果榨汁进行发酵,如杨琦等[26]利用植物乳杆菌发酵蓝莓鲜榨汁、高振鹏[27]发酵乳杆菌发酵苹果果汁,结果发现酸度增加。在本研究中明确苹果皮多酚提取物作为菌株代谢底物,增强了益生菌代谢活性,成为益生活性的促进剂。
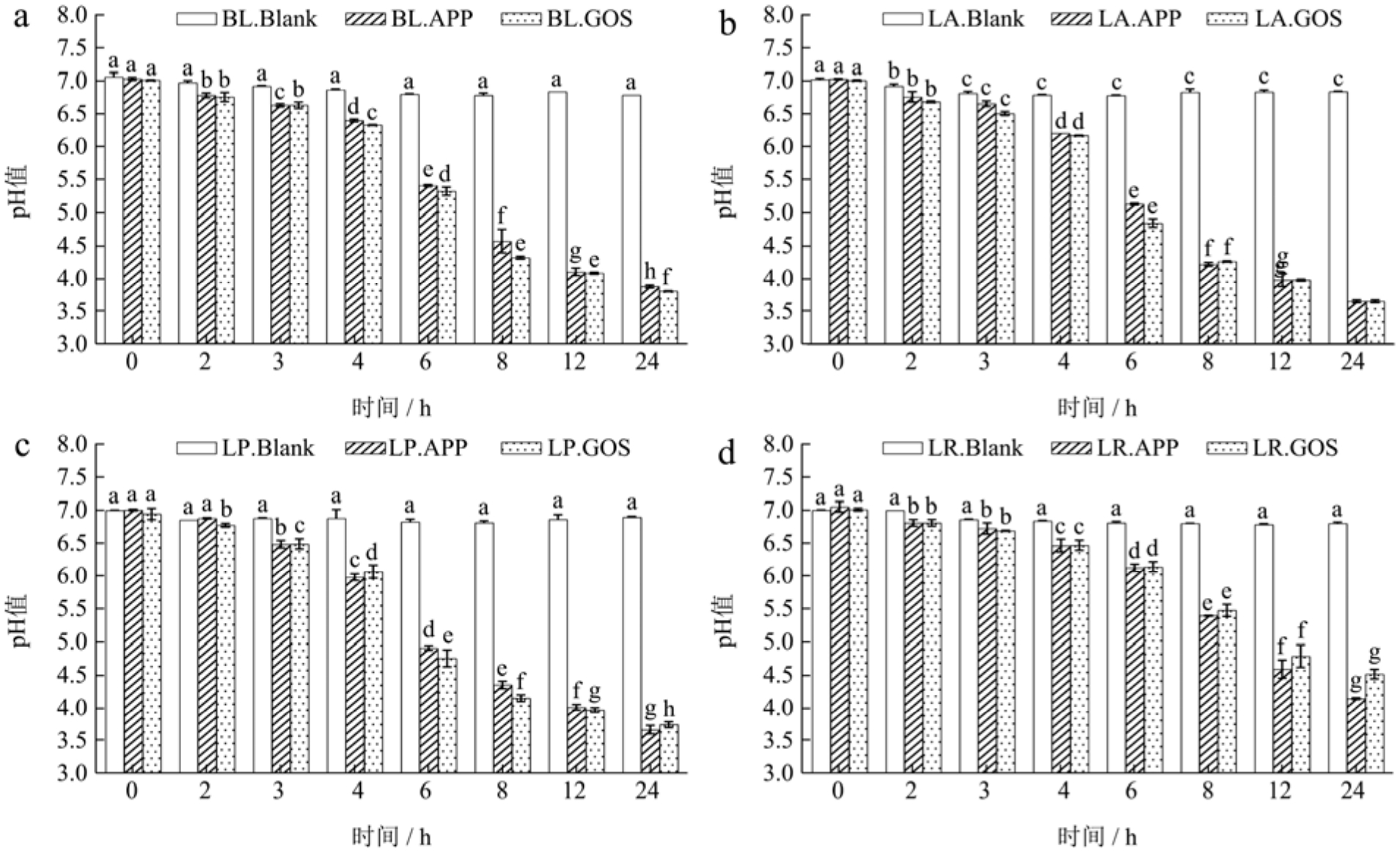
图3 益生菌发酵过程中pH值的变化
Fig.3 Changes in pH value during probiotic fermentation
2.2.3 益生菌发酵过程中多酚组分的变化
为了分析发酵过程中益生菌对苹果皮提取物中多酚的利用情况,我们通过HPLC测定了不同时间点发酵上清液中的多酚组分。如图4所示,在24 h的发酵过程中,槲皮素、金丝桃苷和芦丁的含量都发生了变化,其中最显著的变化来自根皮苷。通过四种益生菌的发酵,根皮苷的含量随时间的延长从0.024 1 mg/mL分别下降到0.001 6、0.002 6、0.003 3和0.024 0 mg/mL。根皮苷在苹果皮中含量丰富,是属于二氢查尔酮的根皮素的葡萄糖苷[28]。先前的研究表明,乳酸杆菌和双歧杆菌能够产生多种水解酶,如β-葡萄糖苷酶和α-半乳糖苷酶[29]。这些酶有助于糖苷键的裂解,从而释放相应的糖苷和酚类糖元[30]。正如预期的那样,在3 h时,发酵液中检测到根皮素。Chang等[31]发现与根皮苷相比,根皮素能通过NF-κB和MAPK信号通路降低炎症因子(IL-6、TNF-α、iNOS和COX-2)的水平,对脂多糖刺激的巨噬细胞具有更高的抗炎活性。说明经过肠道益生菌的生物转化,生成了更具活性的形式(苷元)。
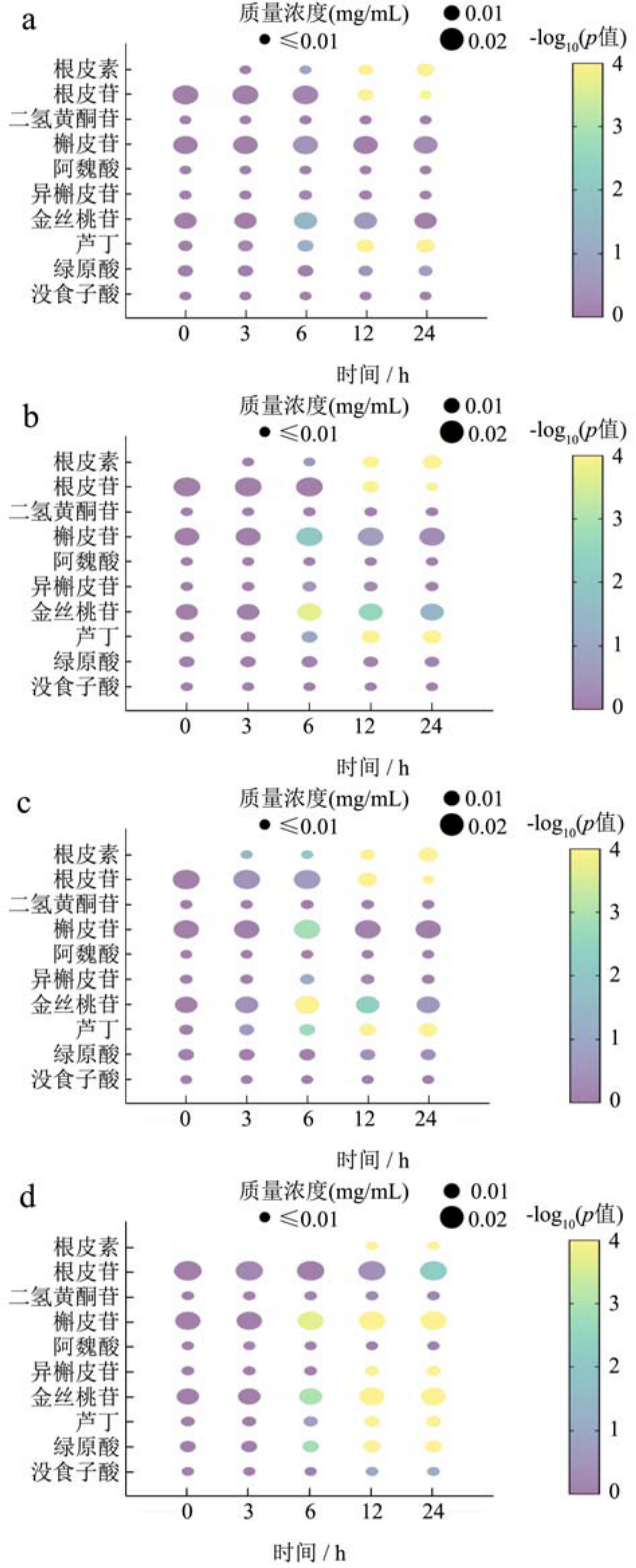
图4 益生菌发酵过程中多酚组分的变化
Fig.4 Changes in polyphenol fractions during probiotic fermentation
注:a、b、c、d分别指长双歧杆菌、嗜酸乳杆菌、副干酪乳杆菌和鼠李糖乳杆菌。
随着对植物提取物及多酚研究的不断深入,人们逐渐认识到其益生活性。富含多酚的番荔枝提取物能促进干酪乳杆菌的增殖[32],绿茶中的EGCG有利于双歧杆菌和嗜酸乳杆菌的生长[33]。市面上还出现了一些多酚与益生菌相结合的产品,其中最成熟的就是酸奶。Walter等[34]将黑杨和蒿柳的多酚提取物添加到酸奶中,可缩短发酵时间并提高其抗氧化活性,生咖啡提取物应用于酸奶也得到同样的效果[35]。此外,在多酚存在的情况下,乳酸菌可确保更高浓度的乳酸,同时稳定植物提取物,提高其生理活性[36]。综上所述,开发多酚作为益生元的市场前景广阔。
3 结论
本研究经过高效液相色谱法分析,苹果皮提取物中共检测得到13种酚类物质,分别是没食子酸、绿原酸、香草酸、咖啡酸、表儿茶素、EGCG、芦丁、金丝桃苷、异槲皮苷、阿魏酸、槲皮苷、二氢黄酮苷、根皮苷,其中金丝桃苷含量最高。苹果皮提取物显著刺激了长双歧杆菌、嗜酸乳杆菌、副干酪乳杆菌和鼠李糖乳杆菌四种益生菌的生长,益生菌通过代谢多酚产酸来降低了发酵液pH值(ΔpH=3.15、3.38、3.34、2.90),在此过程中根皮苷成为首选的底物被水解成更具活性的根皮素。结果表明,苹果皮提取物与益生菌建立了良好的互惠关系,能成为可利用的益生元,从而促进宿主肠道及整体健康,对苹果加工副产物的综合利用、开发益生活性的功能产品提供了理论基础。后续的研究将基于体内实验聚焦肠道菌群,全方位地深入揭示苹果皮提取物与益生菌相互作用的分子机制。
[1]陈静,宋烨,周大森,等.我国苹果产业地方标准统计分析[J].北方园艺,2022,5:140-145
[2]谭琨,査思含,霍伟,等.1980-2018年中国苹果生产及其需水量时空演变特征研究[J].中国农业资源与区划,2022:1-12
[3]Rupasinghe H P V, Wang L, Huber G, et al.Apple peels as a value-added food ingredient in a model muffin system [J].Canadian Journal of Plant Science 2006, 86(5): 1430-1431
[4]Wolfe K, Wu X Z, Liu R H.Antioxidant activity of apple peels [J].Journal of Agricultural and Food Chemistry, 2003,51(3): 609-614
[5]Gutierrez-Castrellon P, Gandara-Marti T, Abreu A, et al.Probiotic improves symptomatic and viral clearance in Covid19 outpatients: a randomized, quadruple-blinded, placebocontrolled trial [J].Gut Microbes, 2022, 14(1): e2018899
[6]Malfertheiner P, Link A, Selgrad M.Helicobacter pylori:perspectives and time trends [J].Nature Reviews Gastroenterology & Hepatology, 2014, 11(10): 628-638
[7]Wang Z J, Chen X F, Zhang Z X, et al.Effects of anti-Helicobacter pylori concomitant therapy and probioticsupplementation on the throat and gut microbiota in humans[J].Microbial Pathogenesis, 2017, 109: 156-161
[8]Banerjee A, Dhar P.Amalgamation of polyphenols and probiotics induce health promotion [J].Critical Reviews in Food Science and Nutrition, 2019, 59(18): 2903-2926
[9]Zahid H F, Ranadheera C S, Fang Z, et al.Utilization of mango, apple and banana fruit peels as prebiotics and functional ingredients [J].Agriculture, 2021, 11(7): 584
[10]He X, Liu R H.Phytochemicals of apple peels: isolation,structure elucidation, and their antiproliferative and antioxidant activities [J].Journal of Agricultural and Food Chemistry, 2008, 56(21): 9905-9910
[11]Zitouni H, Fauconnier M L, Hssaini L, et al.Phenols, volatile compounds, organic acids and antioxidant activity of strawberry tree (Arbutus unedo L.) fruits belonging to five genotypes growing in morocco [J].International Journal of Fruit Science, 2022, 22(1): 414-437
[12]Liu W, Dun M, Liu X, et al.Effects on total phenolic and flavonoid content, antioxidant properties, and angiotensin I-converting enzyme inhibitory activity of beans by solid-state fermentation with Cordyceps militaris [J].International Journal of Food Properties, 2022, 25(1): 477-491
[13]Li Q, Chang X X, Wang H, et al.Phytochemicals accumulation in Sanhua plum (Prunus salicina L.) during fruit development and their potential use as antioxidants [J].Journal of Agricultural and Food Chemistry, 2019, 67(9): 2459-2466
[14]颜源凤,王晓纯,李晓翠,等.不同苹果中果皮、果肉、果核多酚物质的提纯与比较[J].江西化工,2018,6:136-137
[15]孙华迪,赵瑞香,冉军舰.响应面法优化超临界 CO2萃取苹果皮多酚的工艺及抗氧化性研究[J].食品工业,2012,33(6):72-75
[16]Riceevans C A, Miller J, Paganga G.Antioxidant properties of phenolic compounds [J].Trends in Plant Science, 1997, 2(4):152-159
[17]Ma C, Deng Y, Xiao R, et al.Anti-fatigue effect of phlorizin on exhaustive exercise-induced oxidative injury mediated by Nrf2/ARE signaling pathway in mice [J].European Journal of Pharmacology, 2022, 918: 174563
[18]Berkoz M.Effect of Hyperoside on the inhibition of adipogenesis in 3t3-L1 adipocytes [J].Acta Endocrinologica-Bucharest, 2019, 15(2): 165-172
[19]Oh T W, Do H J, Jeon J H, et al.Quercitrin inhibits platelet activation in arterial thrombosis [J].Phytomedicine, 2021, 80:153363
[20]Yao S Y, Zhao Z X, Wang W J, et al.Bifidobacterium longum:Protection against inflammatory bowel disease [J].Journal of Immunology Research, 2021, 2021: 8030297
[21]Kim H, Jeong Y, Kim J E, et al.Anti-obesity potential of Lactobacillus spp.isolated from infant feces [J].Biotechnology and Bioprocess Engineering, 2021, 26(4): 575-585
[22]蒋玉兰,王彬,毛银,等.茶多酚对保加利亚乳杆菌生长的影响[J].中国茶叶加工,2012,2:45-48
[23]Molan A L, Lila M A, Mawson J, et al.In vitro and in vivo evaluation of the prebiotic activity of water-soluble blueberry extracts [J].World Journal of Microbiology & Biotechnology,2009, 25(7): 1243-1249
[24]Rua J, Lopez-Rodriguez I, Sanz J, et al.Improving functional properties of "Piel de Sapo" melon juice by addition of a Lippia citriodora natural extract and probiotic-type lactic acid bacteria[J].LWT - Food Science and Technology, 2018, 96: 75-81
[25]Van Zyl W F, Deane S M, Dicks L M T.Molecular insights into probiotic mechanisms of action employed against intestinal pathogenic bacteria [J].Gut Microbes, 2020, 12(1): 1831339
[26]杨琦,谢纯良,周映君,等.益生菌发酵蓝莓的体外抗氧化活性分析[J].食品与发酵工业: 2022,48(9):112-116
[27]高振鹏,宋杨,张美娜,等.益生菌发酵苹果汁过程中总酚酸变化与动力学研究[J].农业机械学报,2019,50(11):350-356
[28]Zhang X Y, Chen J, Yi K, et al.Phlorizin ameliorates obesity-associated endotoxemia and insulin resistance in high-fat diet-fed mice by targeting the gut microbiota and intestinal barrier integrity [J].Gut Microbes, 2020, 12(1): e1842990
[29]Hur S J, Lee S Y, Kim Y C, et al.Effect of fermentation on the antioxidant activity in plant-based foods [J].Food Chemistry,2014, 160: 346-356
[30]Martins S, Mussatto S I, Martinez-Avila G, et al.Bioactive phenolic compounds: Production and extraction by solid-state fermentation.A review [J].Biotechnology Advances, 2011,29(3): 365-373
[31]Chang W T, Huang W C, Liou C J.Evaluation of the anti-inflammatory effects of phloretin and phlorizin in lipopolysaccharide-stimulated mouse macrophages [J].Food Chemistry, 2012, 134(2): 972-979
[32]Meza-Gutiérrez N N, Magallón-Servín P, Balois-Morales R, et al.Growth promoting activity of Annona muricata L.leaf extracts on Lactobacillus casei [J].2022, 11(5): 581
[33]Tu L J, Sun H J, He S D, et al.Isolation of epigallocatechin gallate from green tea and its effects on probiotics and pathogenic bacteria [J].Current Topics in Nutraceutical Research, 2019, 17(1): 69-77
[34]Walter M, Brzozowski B, Adamczak M.Effect of supercritical extract from black poplar and basket willow on the quality of natural and probiotic drinkable yogurt [J].Animals, 2021,11(10): 2997
[35]Pimpley V A, Maity S, Murthy P S.Green coffee polyphenols in formulations of functional yoghurt and their quality attributes [J].International Journal of Dairy Technology, 2022, 75(1): 159-170
[36]Piekarska-Radzik L, Klewicka E.Mutual influence of polyphenols and Lactobacillus spp.bacteria in food: a review [J].European Food Research and Technology, 2021, 247(1): 9-24