蛋白质在日常营养膳食中不可或缺,由于其分子结构的复杂性,研究蛋白质分子的多尺度结构与蛋白质功能活性的关系,对揭示蛋白质功能特性的变化规律,以及食品性状与感官特性间的影响至关重要。
莲子是中国特有的种子资源和经济作物[1],每年产量以10%~15%增长,占国际贸易量的90%以上。福建主产区种植的“建莲”营养全面[2],富含优质蛋白质[3],研究表明莲子蛋白质占莲子总质量的14%~17%,最高可达25%,氨基酸组成种类齐全[4]。国内外研究学者对莲子蛋白的分离以及结构进行了相关研究,发现莲子含有约19.85%的基于干重的蛋白质,并且与FAO/WHO模式相比显示出均衡的氨基酸组成,具有与大豆相似的营养特性[2]。唐佩华等[3]对广昌白莲蛋白的组成、品质等进行了研究,发现白莲中清、球蛋白含量占70%以上,且氨基酸含量均衡。李向红等[5]在前期研究基础上,使用常规碱提获取莲子蛋白,得到蛋白提取率为78.93%,蛋白等电点在4.5左右。苏贝[6]对比不同方法提取湘莲蛋白,并分析了不同提取方式莲子蛋白质理化功能特性的异同。Zeng等[7]采用Osborne法对湘莲莲子蛋白进行分离,并结合傅里叶变换红外光谱(Fourier Transform Infrared Reflection,FT-IR)和紫外可见光谱(Ultraviolet Visible,UV)对蛋白加以结构研究。另有研究学者分析了莲子蛋白组成等,并对莲子蛋白进行了物理与酶法的改性处理[8-9]。目前与莲子蛋白相关的研究相对缺乏,尤其是关于“建莲”不同蛋白组分的结构表征及其理化性质的系统研究。基于莲子蛋白的营养特性。本研究以莲子中不同组分蛋白(分离蛋白、清蛋白、球蛋白、醇溶蛋白、谷蛋白)作对比,从蛋白提取、理化特性、多尺度结构等差异性进行分析;阐明莲子蛋白理化特性与多尺度结构间的构效关系。
1 材料与方法
1.1 材料与试剂
莲子,福建闽江源绿田实业投资发展有限公司;大豆油,福州市永辉超市(大儒世家店);NaOH、HCl、无水乙醇、NaCl,均为光谱纯,国药集团化学试剂有限公司;磷酸氢二钠、磷酸二氢钠、溴化钾,均为光谱纯,阿拉丁(上海)生化科技股份有限公司。
1.2 仪器与设备
FE28 pH计,梅特勒-托多利仪器(上海)有限公司;L8900全自动氨基酸分析仪,日本Hitachi高新技术公司;F-7000荧光分光光度计,日本Hitachi公司;Malvern Zetasizer Nano ZS90电位分析仪,英国Malven公司;Mastersizer 3000激光粒度仪,英国Malven公司;Nanodrop 2000c型超微量紫外分光光度计,美国Themo Fisher Scientific公司;TENSOR II傅里叶红外光谱分析仪,德国Bruker公司;Jasco-815圆二色谱仪,日本Jasco公司。
1.3 试验方法
1.3.1 莲子分离与分级蛋白的制备
莲子粉→加去离子水→0.5 mol/L NaOH调pH值9.0→4 000 r/min离心8 min→收集上清液→0.5 mol/L HCl调pH值4.9→4 000 r/min离心8 min→收集沉淀→复溶水洗至中性→真空冷冻干燥→莲子分离蛋白(Lotus Seed Protein Isolate,LSPI)
参考Sun等[10]的方法并修改。
莲子粉→加去离子水→4 000 r/min离心10 min→收集上清液(清蛋白Lotus Seed Albumin,LSA)、沉淀→加NaCl→4 000 r/min离心10 min→收集上清液(莲子球蛋白Lotus Seed Globulin,LSGlo)、沉淀→加体积分数70%乙醇→4 000 r/min离心8 min→收集上清液(莲子醇溶蛋白Lotus Seed Prolamin,LSP)、沉淀→0.5 mol/L NaOH调pH值9.0→4 000 r/min离心10 min→收集上清液→0.5 mol/L HCl调pH值4.9→离心→4 000 r/min离心8 min→复溶水洗至中性→真空冷冻干燥→莲子谷蛋白(Lotus Seed Glutein,LSGlu)
1.3.2 基础指标
水分含量测定参照GB/T 5009.3-2016[11],采用直接干燥法;灰分含量测定:参照GB/T 5009.4-2016[12],采用重量法;蛋白质含量测定:参照GB/T 5009.5-2016[13],采用凯氏定氮法;脂肪含量测定:参照GB/T 5009.6-2016[14],采用索氏抽提法;淀粉含量测定:参照GB/T 5009.9-2016[15],采用酸水解法。
1.3.3 理化特性
1.3.3.1 等电点
将蛋白稀释至浓度为1 mg/mL,用0.01 mol/L HCl或NaOH将蛋白溶液调至不同pH值3.6、3.8、4.0、4.2、4.4、4.6、4.8、5.0、5.2、5.4、5.6,在不同pH值下沉淀蛋白,待静置一段时间后,8 000 r/min离心10 min,上清液在紫外280 nm测定,吸光度最小的即为莲子蛋白的等电点。
1.3.3.2 溶解度
调蛋白质量浓度为1 mg/mL,室温下磁力搅拌60 min,用NaOH或HCl调溶液pH值至7.0,3 600 r/min离心20 min,收集上清液。取5 mL上清液采用凯氏定氮法测定蛋白含量。
1.3.3.3 乳化特性
参考Xiong等[16]的方法稍作修改。配制浓度10 mg/mL溶液,加入大豆油10 mL,10 000 r/min乳化2 min,乳化后吸取乳液50 μL,加入0.1% SDS约5 mL,在紫外500 nm测定吸光值A0。待静置10 min,再次吸取乳液,测定吸光值A10。
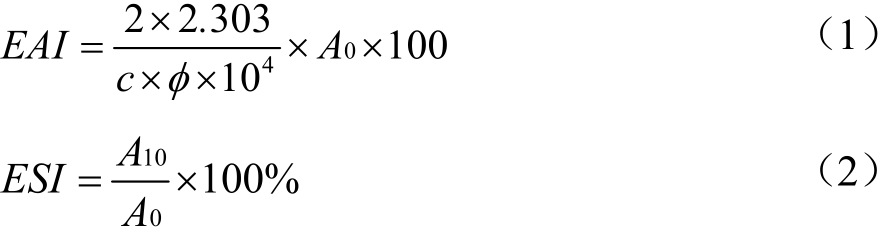
式中:
EAI——乳化性,m2/g;
ESI——乳化稳定性,%;
φ——油相体积分数;
c——初始蛋白质质量浓度,mg/mL。
1.3.4 粒径与电位
配制蛋白样品浓度1 mg/mL,分散剂为Water,分散剂折射率1.330,采用Nanoseries ZS电位测定仪测定蛋白溶液电势。测定温度为25 ℃,pH值7.0。
1.3.5 SDS-PAGE凝胶电泳与分子量分布
取蛋白样品2 mg,加入1×Loading buffer,按照试剂盒说明操作。参考Rutkevicius等[17]的方法并稍作修改。将蛋白用磷酸盐缓冲液(2% SDS,pH值7.0)溶解配制成5 mg/mL的分散液,4 ℃条件下8 000 r/min离心10 min后取上清液用0.22 μm微孔滤膜过滤并用体积排阻色谱测定和分析。标准蛋白及各蛋白样品在相同色谱条件下进行体积排阻色谱分析(SEC-HPLC)。
1.3.6 巯基、二硫键与表面疏水性
配制蛋白溶液,依次加入β-巯基乙醇、尿素、TCA等溶液水浴,高速离心10 min除去有机相。溶解在磷酸盐缓冲液中,再加入DNTB水浴,高速离心。紫外412 nm测定吸光度,以13 600 M-1cm-1消光系数计算总巯基(-SH)浓度。蛋白溶液溶解于EDTA、甘氨酸、SDS等磷酸盐缓冲液中,高速离心10 min,取5 mL上清液加入0.1 mL Ellman试剂中,紫外412 nm处测定吸光度并计算游离巯基。总巯基和游离巯基浓度计算公式如下。
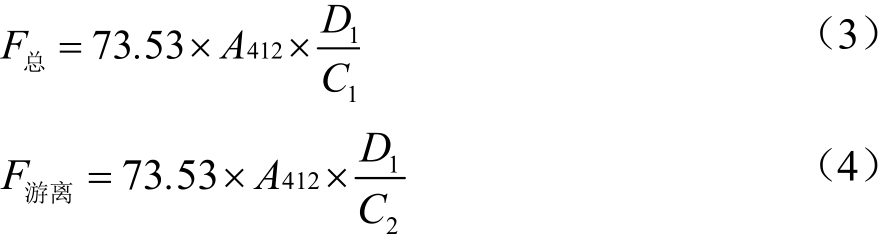
式中:
F总——总巯基(-SH)浓度,μmol/g;
F游离——游离巯基浓度,μmol/g;
73.53——Ellman试剂的摩尔消光系数,106/(1.36×104)=73.53;
D——稀释系数(D1=2.03);
C——样品蛋白质的最终质量浓度,mg/mL。
二硫键浓度的计算方法见公式(5)。
式中:
F——二硫键(-S-S-)浓度,μmol/g。
此外,配制蛋白质量浓度范围0.05~10.8 mg/mL,并加入ANS作为荧光探针测定表面疏水性,激发波长390 nm,扫描范围400~600 nm,狭缝宽度为5 nm,计算荧光强度对蛋白质质量浓度的初始斜率,作为蛋白质表面疏水性指数(H0)。
1.3.7 莲子蛋白分子特性
1.3.7.1 内源荧光光谱
参考Maria等[18]的方法并作修改。配制蛋白溶液并稀释,激发波长290 nm,扫描范围240~480 nm,扫描速率1200 nm/min。测定蛋白的三级结构。
1.3.7.2 紫外分光光度(UV)
配制蛋白溶液并稀释,扫描范围200~400 nm,扫描速率50 nm/min,在石英比色皿中测定吸光度。
1.3.7.3 圆二色光谱(Circular Dichroism,CD)
参考Erickson等[19]的方法并作修改。配制蛋白溶液并稀释,扫描速度2 s/min,扫描范围190~250 nm。通过Dichro Web网站Contin程序分析蛋白质二级结构并进行计算。
1.4 数据处理
各组实验数据平行测定均3次,p<0.05被认为数据之间具有显著差异;研究结果采用Origin 8.5软件作图,微观结构图由系统自带。
2 结果与分析
2.1 莲子主要成分及不同莲子蛋白组分含量
莲子中主要成分为碳水化合物71.12%、莲子蛋白16.14%、其他为水分、灰分、少量脂肪等。莲子分级蛋白中清蛋白含量占比最多为55.05%,其次为谷蛋白占24.70%,球蛋白与醇溶蛋白分别占5.58%和0.05%。蔡联辉等[20]研究发现,“湘莲”中含有清蛋白41.58%、球蛋白26.58%、醇溶蛋白6.0%、谷蛋白18.0%。这种分级蛋白含量上的差异性可能是因为“湘莲”与福建“建莲”的种质资源不同。也有可能是因为莲子在采收与贮藏的不同时期,淀粉、蛋白质等含量均会有不同的变化,因而会产生一定的差异性。
2.2 溶解度与乳化特性
不同莲子蛋白(清蛋白、球蛋白、醇溶蛋白、谷蛋白)的溶解度与乳化特性对比如下表1所示。
表1 不同莲子蛋白理化特性对比
Table 1 Comparison of physicochemical properties of different lotus seed proteins

注:上标同行不同字母表示不同样品具有差异显著性(p<0.05)。
指标 LSPI LSA LSGlo LSP LSGlu溶解度/% 15.58±0.99d 51.88±3.26a 42.47±2.51ab 5.46±0.32e 10.61±0.65de乳化性/% 82.35±5.51a 56.25±2.98ef 50.00±2.78f 51.17±3.46f 52.94±3.45f乳化稳定性/% 96.02±5.65bc 99.99±5.88a 99.99±6.03a 98.98±6.46ab 99.99±6.84a
评价蛋白质功能特性之一的指标是溶解度,间接反映出蛋白质分子结构的改变情况,以及蛋白质分子的电荷和疏水性的平衡[21]。如表1所示,清蛋白51.88%与球蛋白42.47%的溶解性比莲子分离蛋白15.58%的溶解性更加优异,而醇溶蛋白与谷蛋白的溶解性相比莲子分离蛋白更差。这个结果与方菲菲[22]的研究结论有差异性,可能是因为选择的莲子品种不同。江西广昌的“通芯白莲”与福建的“建宁白莲”氨基酸组成还存在较大差异。此外,课题组前期实验表明[23],虽然在莲子分离蛋白中清蛋白含量占50%以上,但莲子蛋白中疏水性氨基酸占比在35%左右,且其中谷氨酸含量最高。这也是莲子蛋白溶解性较差的原因之一。蛋白质溶解性也影响蛋白质的其他功能特性,诸如乳化性与乳化稳定性。由表1可知道莲子蛋白的乳化性强弱依次为:分离蛋白>清蛋白>谷蛋白>醇溶蛋白>球蛋白,除分离蛋白外,莲子分级蛋白相互间差异较小,乳化稳定性几乎无显著差异(p<0.05)。而分离蛋白、分级蛋白的溶解度与乳化性不同,可能是因为蛋白的理化特性与蛋白本身的物理特性相关,且受到蛋白中氨基酸残基以及所带电荷与分布状况影响。莲子分离蛋白中分子内部疏水基团暴露,溶解性增强,提高了蛋白质的乳化能力。而球蛋白分子空间结构的作用力和化学键较弱,阻碍了油水界面上起到保护作用界面膜的形成,导致油滴表面的保护层变薄,小油滴逐渐聚集成大颗粒
[24],从而引起乳化性和乳化稳定性降低。
2.3 等电点、电位与粒径
由图1a可知,莲子分离蛋白、清蛋白、球蛋白、醇溶蛋白、谷蛋白的等电点分别为:4.9、4.8、5.0、4.8和4.9。张羽等[25]对“通芯白莲”中莲子蛋白进行研究,得到莲子总蛋白的等电点为4.5;徐虹等[26]对莲子红皮蛋白进行研究,得到蛋白等电点为4.9;李向红等[5]对“湘莲”中莲子蛋白与磨皮粉进行研究,得到莲子蛋白质的等电点为4.5;Zeng等[7]对“湘莲”中莲子分级蛋白进行了研究,发现等电点为4.9。这些实验均表明,莲子蛋白质的等电点范围在4.5~5.0之间,但由于品种或种质资源不同,莲子蛋白质的等电点有一定区别。
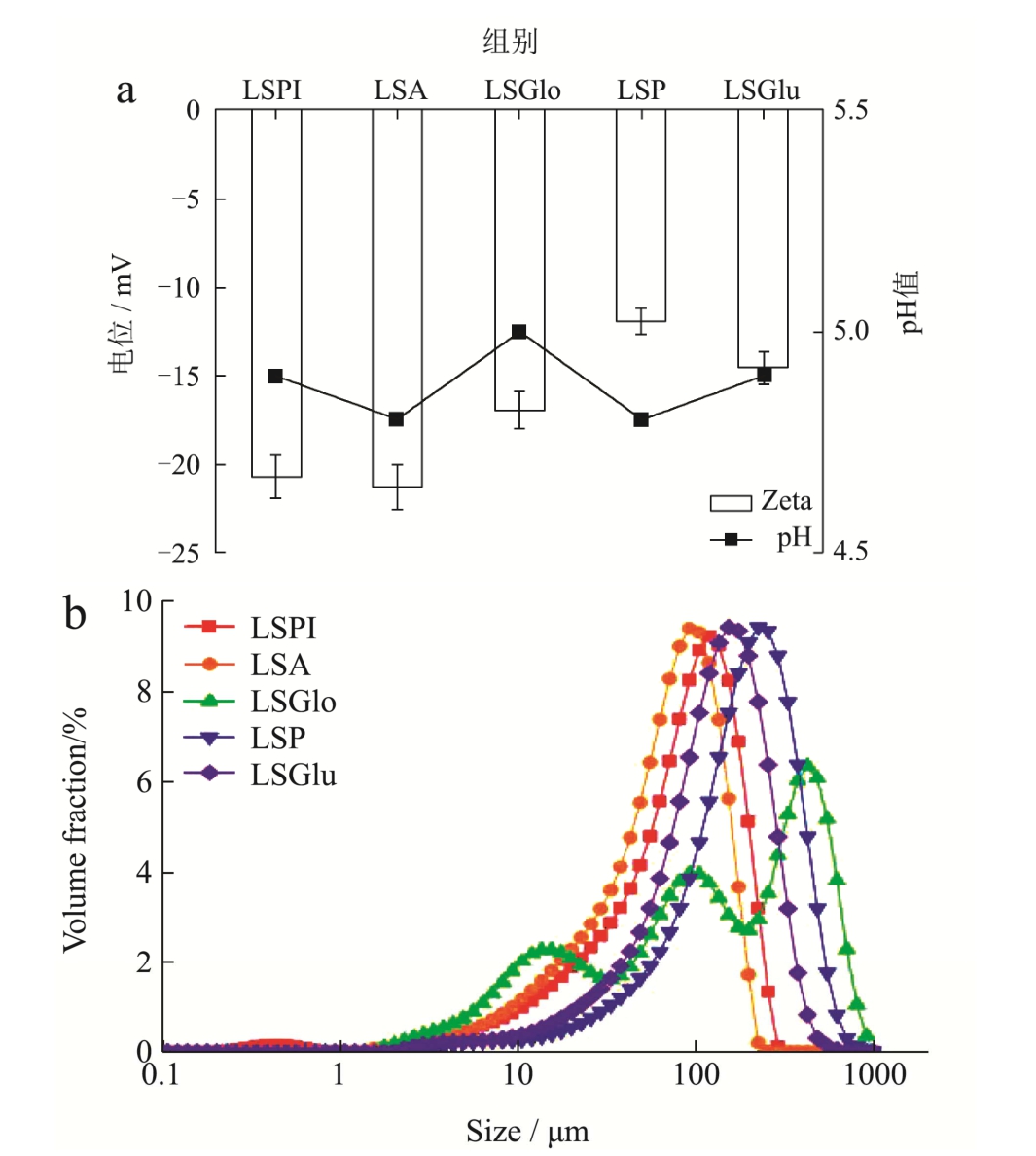
图1 不同莲子蛋白电位、pH值与粒径
Fig.1 Potential, pH value and particle size of different lotus seed proteins
Zeta电位一般表示样品在液体中表面所带有的静电荷的电位,是颗粒间相互排斥或吸引力强度的度量。由图1a可知,莲子清蛋白的Zeta电位绝对值最高,这可能与其结构中含有较多的极性键有关[23]。结合d4,3、d3,2可以发现(表2),莲子分离蛋白与清蛋白的粒度值分别为93.07 μm与75.47 μm,粒径分布宽度基本一致,且均呈单峰分布(图1b所示),说明莲子蛋白颗粒大小集中且尺寸相近,更易形成稳定体系。d4,3能够体现粒度的均一性,而D50数据则表明颗粒的中位径,说明有半数粒度小于或大于这个粒度标准,与d4,3结合可看出,D50与d4,3较一致,说明颗粒大小比较均一。结合溶解度数据(表1)可发现,清蛋白具有更高的溶解性。而球蛋白的粒径呈未完全分开的多峰状态(图1b),说明粒度分布较大且分布不均匀,液滴为多分散性并且颗粒尺寸相差较大,处于一种不稳定状态(与图1a中Zeta电位中电位绝对值低的结论一致)。溶液体系的稳定性主要取决于颗粒的粒度和表面所带电荷量,一般认为高电荷、小粒径的溶液体系相对更稳定。综合上述分析发现,莲子分离蛋白与清蛋白可能具有更好形成乳液的特性,因而表现出绝对值较高的电位、较小的粒径,以及较好的溶解性与乳化性。
表2 不同莲子蛋白粒径分析(μm)
Table 2 Particle size analysis of different lotus seed proteins (μm)
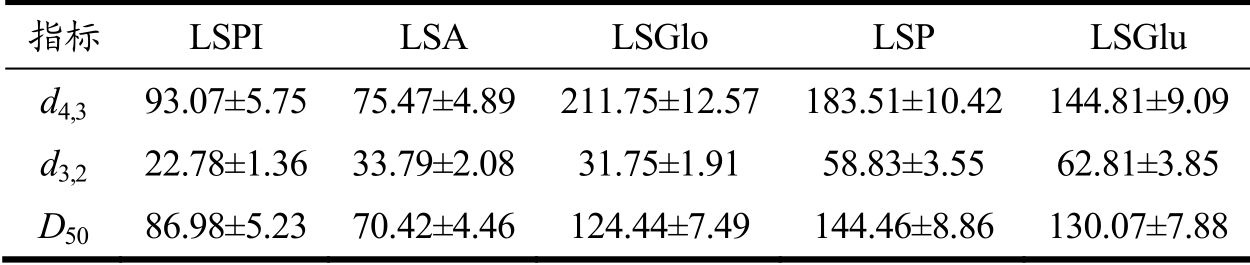
注:d4,3为体积平均径,d3,2为表面积平均径,D50为中位(中值)径。
指标 LSPI LSA LSGlo LSP LSGlu d4,3 93.07±5.75 75.47±4.89 211.75±12.57 183.51±10.42 144.81±9.09 d3,2 22.78±1.36 33.79±2.08 31.75±1.91 58.83±3.55 62.81±3.85 D50 86.98±5.23 70.42±4.46 124.44±7.49 144.46±8.86 130.07±7.88
2.4 分子量与凝胶电泳
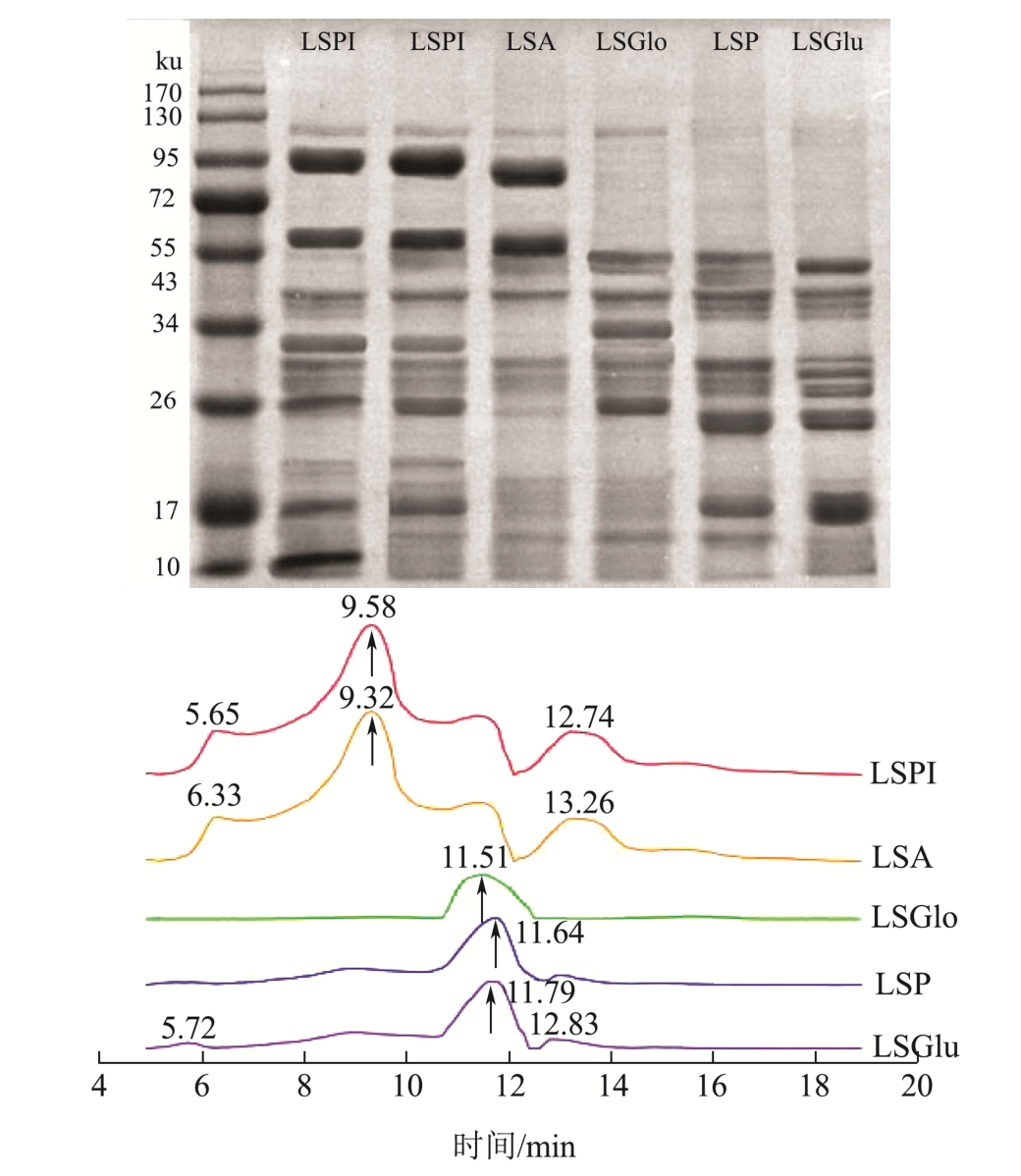
图2 不同莲子蛋白分子量
Fig.2 Molecular weight of different lotus seed proteins
由图2可见,莲子蛋白主要集中在10~26、34~55和95~130 ku之间。谱带数目和分子量完全相同,电泳条带的强弱存在较大差异,区别在于其含量的高低。在95~130与10~20 ku的蛋白质含量逐渐变少。在10~55 ku处,清蛋白、球蛋白与其他蛋白在含量上有所不同。而莲子分离蛋白在95~130 ku处与醇溶蛋白、谷蛋白不同,这可能是因为其中含有多种蛋白,其氨基酸含量也存在差异性。由体积排阻色谱法可以按分子大小顺序进行分离。蛋白(可溶性部分)的洗脱峰集中于9~12 min之间,保留时间6 min左右的吸收峰为蛋白质聚集体,15 min后的吸收峰归属为解离出的小分子多肽[2 7]。莲子分离蛋白的最大洗脱峰在9.58 min,峰面积约占85%,分子质量约130 ku。说明分离蛋白主要以120~140 ku的聚合体形式存在,这与上述SDS-PAGE分析具有一致性。球蛋白的信号峰较弱,表明其含量很低,分子质量对应为26~55 ku。谷蛋白的信号峰强度较强(与球蛋白相比),说明其含量较大,对应分子质量约为10~26 ku。
这与张羽[26]在分离提取莲子水溶、盐溶、酸溶、碱溶蛋白得到的十几种亚基基本相吻合,与唐佩华[3]研究的广昌白莲盐溶球蛋白也有一致性。但不同的是,张羽[26]选用的莆田莲子水溶性蛋白更多,而唐佩华[3]选用的广昌白莲则盐溶性蛋白更多。莲子小分子量的蛋白的减少,可能是由于巯基交联形成二硫键,将小分子量蛋白转变为大分子量蛋白。但由于大分子量蛋白与淀粉形成复合体,溶解性降低,不易被完整提取,因而大分子量的可溶性蛋白含量也降低。这与分子量的分析具有一致性。
2.5 表面疏水性指数(H0)、巯基(-SH)、二硫键(-S-S-)
蛋白质的溶解性和表面疏水性显著影响着蛋白质其他功能性质的发挥[28]。图3a、3b中莲子清蛋白的表面疏水性指数(H0)值与-S-S-含量最低,醇溶蛋白与谷蛋白的-S-S-值最高,谷蛋白的-SH与-S-S-分别为16.18 μmol/g和9.14 μmol/g,莲子分离蛋白、清蛋白(球蛋白)中游离巯基含量最高。-S-S-的含量对蛋白质的溶解性与疏水性有一定影响。蛋白乳化性的强弱与其空间结构有关,表面疏水性高且电势较低(图3a),将使其更容易在溶液中或在界面处发生蛋白聚集[29,30]。因而莲子分离蛋白与清蛋白的乳化性较好与表面疏水性低和电位低有关。蛋白表面的疏水性氨基酸较多,这容易引起溶液的絮凝沉淀,而液滴表面固体颗粒大小分布、极性、微观形貌等因素均对溶液稳定有影响[31]。因此球蛋白的粒径呈未完全分开的多峰状态(图1b),可能也与表面疏水性有关(图3a)。结合上述理化特性、电位、粒径等分析可以发现,清蛋白与球蛋白的亲水性更强,醇溶蛋白与谷蛋白的疏水性更强,而莲子分离蛋白由于其构成复杂,虽易溶于水,但相比清、球蛋白亲水性更弱,相比醇溶、谷蛋白疏水性更弱。
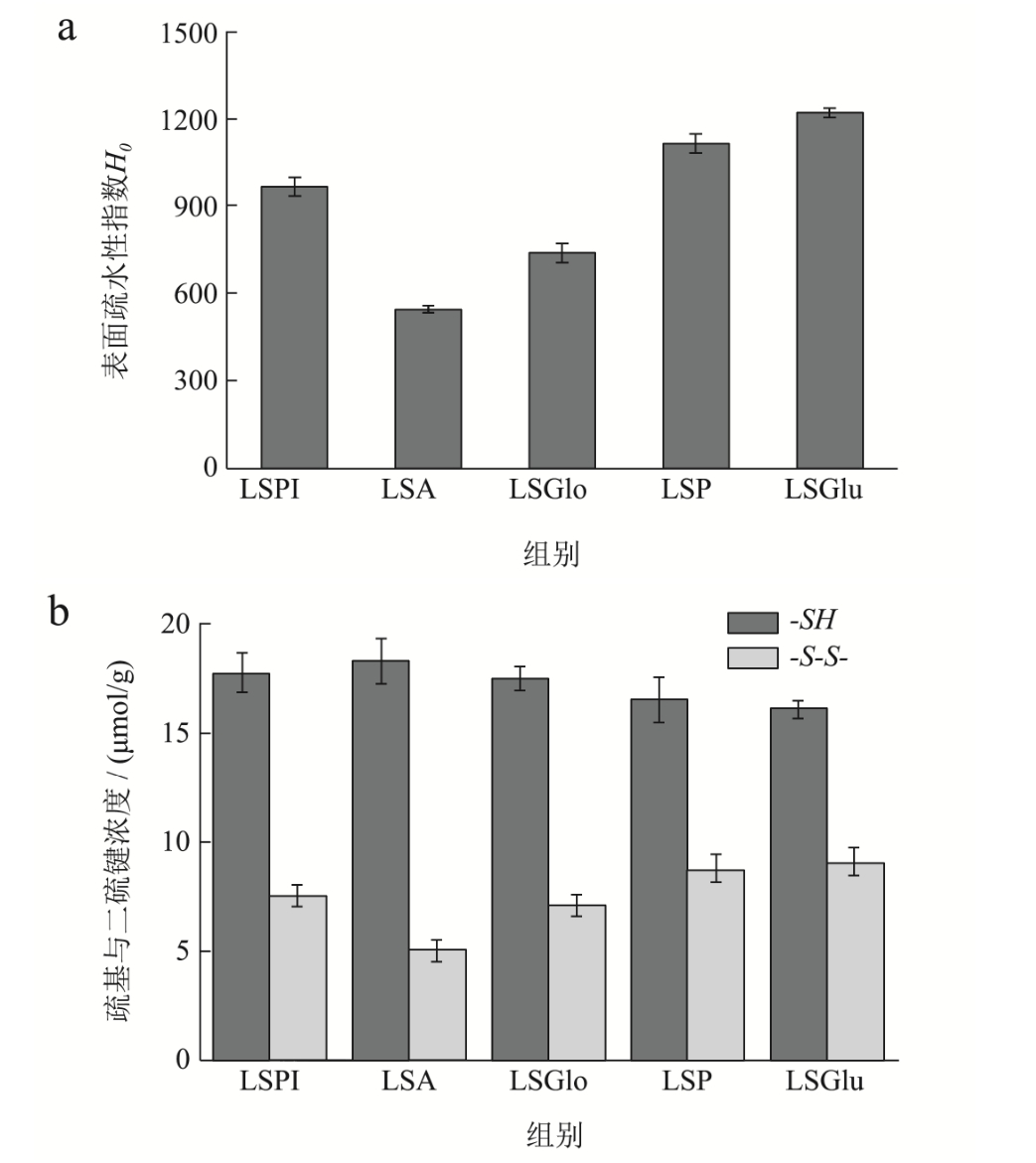
图3 (a)不同莲子蛋白表面疏水性性指数(H0),(b)巯基与二硫键摩尔质量浓度
Fig.3 (a) Surface hydrophobicity index (H0), (b) Sulfhydryl and disulfide bond molar mass concentration
2.6 蛋白分子特性
2.6.1 荧光光谱
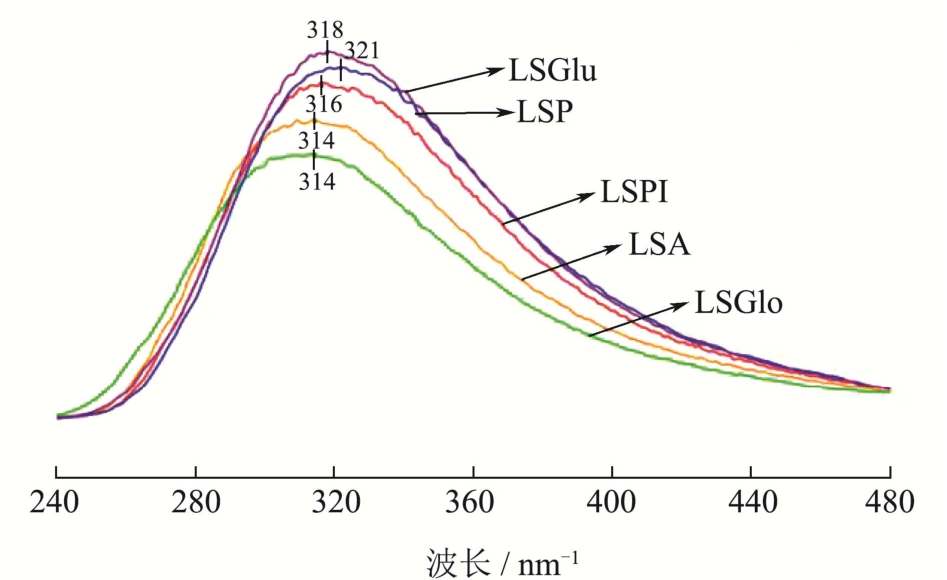
图4 不同莲子蛋白荧光光谱
Fig.4 Fluorescence spectra of different lotus seed proteins
荧光光谱用以研究蛋白质分子的构象变化。由图4可以看出,240~480 nm波长处的内荧光扫描光谱可以用来表征色氨酸(Trp)、酪氨酸(Tyr)与苯丙氨酸(Phe)残基周围的微环境变化情况。谷蛋白中的色氨酸可在310 nm处激发产生荧光[32]。图4中显示荧光峰的位置在314 nm~321 nm之间,5种蛋白质不同的荧光峰值与荧光强度说明蛋白质中氢键连接、疏水相互作用形式不同。醇溶蛋白、谷蛋白相比莲子分离蛋白波长红移,内部的色氨酸(Trp)残基暴露更多,表面疏水性增加,因而荧光强度增强。然而,莲子分离蛋白、清蛋白(球蛋白)的波长蓝移,说明部分芳香残基存始终处于更加疏水性的状态[33],键合的紧密度致使其不易展开侧链,因而屏蔽了发射光,检测不到色氨酸(Trp)的位点或降低了可检测到的自发荧光。
2.6.2 紫外分光光度
由图5可知,蛋白的最大紫外吸收波长在270~280 nm处。蛋白的紫外吸收主要是由于其蛋白内的色氨酸(Trp)、酪氨酸(Tyr)残基所引起的。其紫外光的强弱说明蛋白质中的酪氨酸更多的暴露于极性环境中,而色氨酸更多地趋向于埋藏在蛋白质分子内部[33]。蛋白结构逐步舒展开,发色基团与芳杂环疏水基团也更多向外暴露,从而引起紫外吸收的增加[34]。莲子分离蛋白的最高紫外吸收峰出现在279 nm处,环境中的极性状态发生改变而肽链上的Trp、Tyr残基所带的杂环π→π*电子跃迁是引发吸收峰出现的关键因素之一,蛋白肽链逐渐展开,π→π*和n→π*电子跃迁能量逐渐减小,因而会导致紫外吸收的相对减弱[35]。
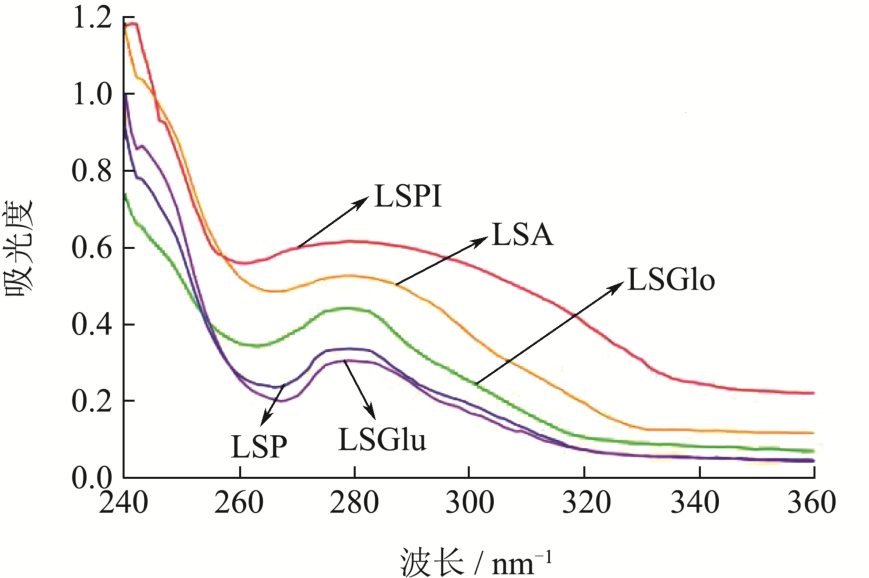
图5 不同莲子蛋白紫外光谱
Fig.5 UV spectra of different lotus seed proteins
2.6.3 圆二色光谱
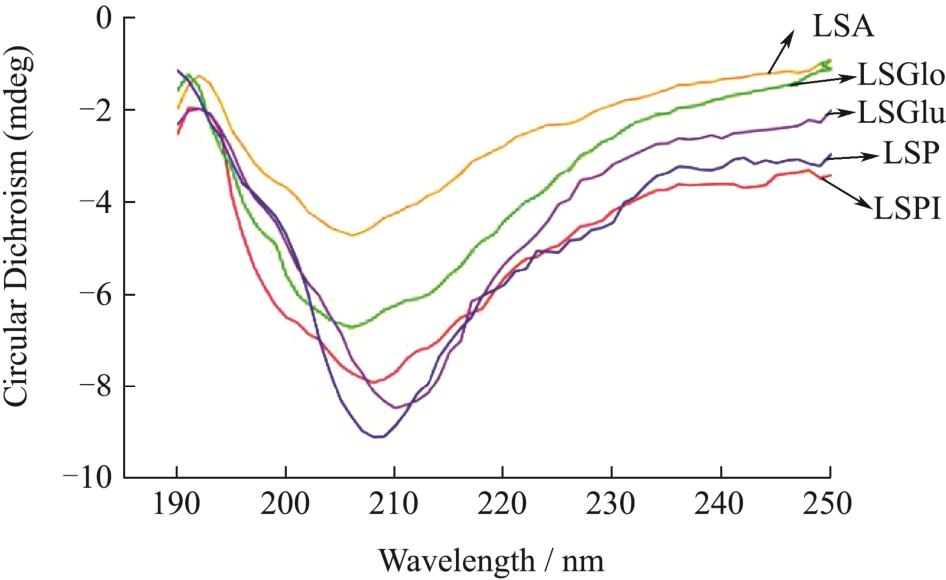
图6 不同莲子蛋白圆二色光谱
Fig.6 CD spectra of different lotus seed proteins
在CD光谱中,蛋白质二级结构的不同,所产生的圆二色谱谱带位置、吸收强度也不相同。图6中可以观察到可溶性蛋白,在200~210 nm左右波长处有一个明显的负峰,是典型的富含α-螺旋结构的蛋白质,属于α-螺旋中肽链的π→π*跃迁,此结果与Ren[36]的研究一致。在208 nm左右波长处有不同峰形的变化,且峰位置发生不同偏移,说明蛋白质二级结构单元含量不同,这与紫外扫描结果一致,蛋白质四种二级结构的不同含量,表明莲子蛋白中不同分级蛋白的空间结构组成存在较大差异。
表3 不同莲子蛋白二级结构含量对比
Table 3 Comparison of the secondary structure content of different lotus seed proteins
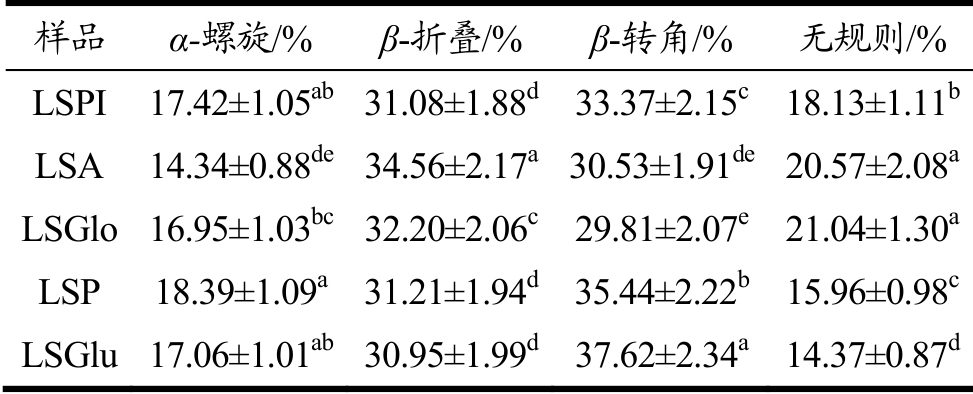
注:上标同行不同字母(a~e)表示不同样品具有差异显著性(p<0.05)。
样品 α-螺旋/% β-折叠/% β-转角/% 无规则/%LSPI 17.42±1.05ab 31.08±1.88d 33.37±2.15c 18.13±1.11b LSA 14.34±0.88de 34.56±2.17a 30.53±1.91de 20.57±2.08a LSGlo 16.95±1.03bc 32.20±2.06c 29.81±2.07e 21.04±1.30a LSP 18.39±1.09a 31.21±1.94d 35.44±2.22b 15.96±0.98c LSGlu 17.06±1.01ab 30.95±1.99d 37.62±2.34a 14.37±0.87d
二级结构实验分析结果如上表3所示。清蛋白、球蛋白的负峰强度相对较弱,说明α-螺旋结构含量少,β-折叠结构含量多,β-折叠含量高会增加蛋白质的柔韧性和扩展性,使分子结构更具柔性化[37]。醇溶蛋白中β-折叠与转角含量最大,其次为α-螺旋与无规则。Zeng等[7]对莲子分级蛋白结构研究表明,莲子清蛋白和球蛋白的螺旋体在13%~16%,37%为折叠体,无规则卷曲仅占不到15%。α-螺旋中的氢键是维持其结构的主要原因,一部分转变为无序结构,导致更多疏水片段暴露于分子表面,溶解性提高。β-折叠比例增加的同时α-螺旋结构也逐渐减小,结构之间的相互转化,便有结构性转化[38]。α-螺旋相对含量低可能与蛋白分子间部分电荷发生中和反应有关,因而产生静电作用,会影响氢键的稳定性。β-折叠相对含量降低可表明蛋白质疏水性增强。且β-折叠比α-螺旋结构更稳定,这可能是导致醇溶蛋白、谷蛋白溶解性与乳化性较低的原因之一。
3 结论
本研究制备并对比研究了5种不同莲子蛋白的结构及理化特性。其结果表明,莲子中蛋白质占总质量的16.14%,五种蛋白的等电点均处于4.9左右。理化特性研究结果表明,溶解性最好的是清蛋白51.88%(溶解度为51.88%),乳化特性最好的是莲子分离蛋白(乳化性与乳化稳定性分别为82.35%、96.02%)。这些研究发现与其他研究存在种质与品质等差异性,因而导致理化特性有所不同。分离蛋白与清蛋白的Zeta电位绝对值较高,粒径更小,单峰分布明显,表明分离蛋白与清蛋白的粒度小,更容易形成稳定体系。分子量研究结果表明,莲子分离蛋白主要以120~140 ku的较大聚合体形式存在,清蛋白含有更多的羟基基团,醇溶蛋白、谷蛋白的二硫键含量较多。巯基氧化成二硫键可增强凝胶网络结构,疏水氨基酸的暴露可影响蛋白质的空间结构。溶解性和乳化性随之增强,溶解度与乳化性变化趋势一致。这些有关莲子蛋白的研究结果与其他研究学者的研究具有一致性,但同样也存在种质资源不同的差异性。诸如有别于盐溶性蛋白较多的广昌白莲、水溶性蛋白较多的莆田莲和其他湘莲等。光谱分析表明,与醇溶蛋白和谷蛋白相比,清蛋白和球蛋白的荧光强度更弱,α-螺旋结构含量少,β-折叠结构含量多,反映其蛋白质结构具有高度的柔韧性与扩展性。通过分析不同莲子蛋白理化特性与多尺度结构,以期为莲子蛋白类的应用研究提供理论参考。
[1] 郑宝东.莲子科学与工程[M].北京:科学出版社,2010:24 ZHENG Baodong. Lotus Seed Science and Engineering [M].Beijing: Science Press, 2010: 24
[2] Zhang Y, Lu X, Zeng S, et al. Nutritional composition,physiological functions and processing of lotus (Nelumbo nucifera Gaertn.) seeds: A review [J]. Phytochemistry Reviews,2015, 14(3): 321-334
[3] 唐佩华,姜在阶,梅楚红,等.莲子蛋白的组成、溶性和品质[J].北京师范大学学报(自然科学版),1998,4:532-537
TANG Peihua, JIANG Zaijie, MEI Chuhong, et al.Composition, solubility and quality of lotus seed protein [J].Journal of Beijing Normal University (Natural Science Edition),1998, 4: 532-537
[4] Zeng H Y, Cai L H, Cai X L, et al. Amino acid profiles and quality from lotus seed proteins [J]. Journal of the Science of Food & Agriculture, 2013, 93(5): 1070-1075
[5] 李向红,刘永乐,俞健,等.莲子磨皮粉中蛋白质的提取、组成及性质[J].食品科学,2015,36(8):129-133
LI Xianghong, LIU Yongle, YU Jian, et al. Extraction,composition and properties of protein in lotus seed peeling powder [J]. Food Science, 2015, 36(8): 129-133
[6] 苏贝.湘莲蛋白质的分离提取及其功能特性研究[D].长沙:湖南农业大学,2011
SU, Bei. Xiang-Lian protein extraction and its function characteristics research [D]. Changsha: Hunan Agricultural University, 2011:51
[7] Zeng H Y, Cai L H, Cai X L, et al. Structure characterization of protein fractions from lotus (Nelumbo nucifera) seed [J].Journal of Molecular Structure, 2011, 1001(3): 139-144
[8] Shehu D M, Salihu A, Inuwa H M. Effect of boiling on protein,mineral, dietary fibre and antinutrient compositions of lotus seeds [J]. Journal of Food Composition & Analysis, 2018,67(4): 184-190
[9] Pan A D, Zeng H Y, Feng B. Heat-pretreatment and enzymolysis behavior of the lotus seed protein [J]. Food Chemistry, 2016, 201: 230-236
[10] Sun Q, Ma Z F, Kong L M, et al. Structural characteristics and functional properties of walnut glutelin as hydrolyzed: Effect of enzymatic modification [J]. International Journal of Food Properties, 2018, 22(1): 265-279
[11] GB/T 5009.3-2016,食品安全国家标准 食品中水分的测定[S]GB/T 5009.3-2016, National Standards for Food Safety -Determination of Moisture in Food [S]
[12] GB/T 5009.4-2016,食品安全国家标准 食品中灰分的测定[S]GB/T 5009.4-2016, National Standards for Food Safety -Determination of Ash in Food [S]
[13] GB/T 5009.5-2016,食品安全国家标准 食品中蛋白质的测定[S]
GB/T 5009.5-2016, National Standards for Food Safety -Determination of Protein in Food [S]
[14] GB/T 5009.6-2016,食品安全国家标准 食品中脂肪的测定[S]
GB/T 5009.6-2016, National Standards for Food Safety -Determination of Fat in Food [S]
[15] GB/T 5009.9-2016,食品安全国家标准 食品中淀粉的测定[S]GB/T 5009.9-2016, National Standards for Food Safety -Determination of Starch in Food [S]
[16] Xiong W F, Wang Y T, Zhang C L, et al. High intensity ultrasound modified ovalbumin: Structure, interface and gelation properties [J]. Ultrasonics Sonochemistry, 2016,56(31): 302-309
[17] Rutkevicius M, Allred S, Velev O D, et al. Stabilization of oil continuous emulsions with colloidal particles from water-insoluble plant proteins [J]. Food Hydrocolloids, 2018,82: 89-95
[18] Maria J S, Maria J M, Ana M R P. Influence of Maillard conjugation on structural characteristics and rheological properties of whey protein dextran systems [J]. Food Hydrocolloids, 2014, 39(11): 223-230
[19] Erickson D P, Ozturk O K, Selling G, et al. Corn zein undergoes conformational changes to higher β-sheet content during its self-assembly in an increasingly hydrophilic solvent[J]. International Journal of Biological Macromolecules, 2020,157: 232-239
[20] 蔡联辉,曾虹燕,王亚举,等.莲子蛋白质的氨基酸组成及其营养评价[J].营养学报,2010,32(5):503-506
CAI Lianhui, ZENG Hongyan, WANG Yaju, et al. Amino acid composition and nutritional evaluation of lotus seed protein [J].Journal of Nutrition, 2010, 32(5): 503-506
[21] Zheng Y M, Li Z Y, Zhang C, et al. Effects of microwave-vacuum pre-treatment with different power levels on the structural and emulsifying properties of lotus seed protein isolates [J]. Food Chemistry, 2019, 5(1): 311-332
[22] 方菲菲.莲子贮藏过程中主要化学成分变化及其陈化机理[D].南昌:南昌大学,2014
FANG Feifei. Changes of main chemical components and aging mechanism of lotus seeds during storage [D]. Nanchang:Nanchang University, 2014
[23] 孙乾,黄敏丽,曾木花,等.不同莲子蛋白氨基酸结构与热特性研究[J].中国食物与营养(已录用)
SUN Qian, HUANG Minli, ZENG Muhua, et al. Study on amino acid structure and thermal properties of different lotus seed proteins [J]. Food and Nutrition in China (Employed)
[24] 望运滔,王营娟,白艳红.预处理技术改善蛋白质乳化性研究进展[J].食品与机械,2020,36(5):211-215
WANG Yuntao, WANG Yingjuan, BAI Yanhong. Research progress of pretreatment technology to improve emulsifiability of protein [J]. Food and Machinery, 2020, 36(5): 211-215
[25] 张羽.莲子中蛋白质的分离及其食品功能特性研究[D].南京:南京师范大学,2008
ZHANG Yu. Isolation of protein from lotus seeds and study on its food functional characteristics [D]. Nanjing: Nanjing Normal University, 2008
[26] 徐虹,王馨仪,曹杨,等.莲子红皮蛋白微波辅助盐提工艺优化[J].食品科学,2011,32(4):5-12
XU Hong, WANG Xinyi, CAO Yang, et al. Optimization of microwave-assisted salt extraction process for lotus seed red skin protein [J]. Food Science, 2011, 32(4): 5-12
[27] 安然.大豆分离蛋白可溶性热聚集行为及其超声调控研究[D].哈尔滨:东北农业大学,2019 AN Ran. Study on soluble heat aggregation behavior of soybean protein isolate and its ultrasonic regulation [D]. Harbin:Northeast Agricultural University, 2019
[28] Wang K Q, Luo S Z, Cai J, et al. Effects of partial hydrolysis and subsequent cross-linking on wheat gluten physicochemical properties and structure [J]. Food Chemistry, 2016, 197(1):168-174
[29] Peng X Q, Xu Y T, Liu T X, et al. Molecular mechanism for improving emulsification efficiency of soy glycinin by glycation with soy soluble polysaccharide [J]. Journal of Agricultural & Food Chemistry, 2018, 66(46): 12316-12326
[30] Hao Z Z, Peng X Q, Tang C H, et al. Edible Pickering high internal phase emulsions stabilized by soy glycinin:Improvement of emulsification performance and Pickering stabilization by glycation with soy polysaccharide [J]. Food Hydrocolloids, 2020, 103(3): 105672
[31] 孙烨,李英浩,Wulandari,等.超声波预处理对玉米醇溶蛋白结构及其Pickering乳液稳定性的影响[J].食品与发酵工业,2021,47(1):97-106
SUN Ye, LI Yinghao, Wulandari, et al. Effect of ultrasonic pretreatment on the structure of zein and the stability of Pickering emulsion [J]. Food and Fermentation Industry, 2021,47(1): 97-106
[32] Chen Y, Tu Z, Wang H, et al. Glycation of β-lactoglobulin under dynamic high pressure microfluidization treatment:Effects on IgE-binding capacity and conformation [J]. Food Research International, 2016, 89: 882-888
[33] 朱颖,赵思明,王冬梅,等.乳液中柔性界面蛋白构效关系研究[J].农业机械学报,2021,52(3):341-349
ZHU Ying, ZHAO Siming, WANG Dongmei, et al. Study on structure-activity relationship of flexible interfacial proteins in emulsion [J]. Transactions of the Chinese Society of Agricultural Machinery, 2021, 52(3): 341-349
[34] 王琳,周国卫,于志超,等.pH值偏移处理对油莎豆蛋白结构及乳化性质的影响[J].食品科学,2020,35(22):43-50
WANG Lin, ZHOU Guowei, YU Zhichao, et al. Effect of pH offset treatment on structure and emulsifying properties of Cyperus esculentus protein [J]. Food Science, 2020, 35(22):43-50
[35] Zhong D G, Jiao Y P, Zhang Y, et al. Effects of the gene carrier polyethyleneimines on structure and function of blood components [J]. Biomaterials, 2013, 34(1): 294-305
[36] Ren X F, Wei X, Ma H, et al. Effects of a dual-frequency frequency-sweeping ultrasound treatment on the properties and structure of the zein protein [J]. Cereal Chemistry Journal, 2015,92(2): 193-197
[37] 康雪帆,李海明,陈丹洁,等.糖接枝玉米醇溶蛋白包埋虾青素[J].食品科学,2018,39(7):168-173
KANG Xuefan, LI Haiming, CHEN Danjie, et al. Embedding astaxanthin with sugar grafted zein [J]. Food Science, 2018,39(7): 168-173
[38] Qi P X, Onwulata C I. Physical properties, molecular structures,and protein quality of texturized whey protein isolate: Effect of extrusion moisture content [J]. Journal of Dairy Science, 2011,94(5): 2231-2244