酒精作为一种精神活性物质,长期以来被认为是诸多肝脏疾病的主要诱因之一,其中以酒精性肝损伤(alcoholic liver injury,ALI)最为显著,ALI根据其演变阶段可分为单纯性脂肪肝、酒精性肝炎、肝纤维化、酒精性肝硬化,严重者可诱发广泛肝细胞坏死,甚至肝功能衰竭[1]。ALI已成为威胁人类健康的世界性公共卫生问题。在我国,酒精已成为继病毒性肝炎后导致肝损伤的第二大病因[2,3]。在欧洲等发达国家中,ALI是肝硬化最主要的病因[4]。因此,ALI在全球范围内引起了学者们的重视,对它的研究也越来越深入。尽管现代医学对ALI的研究已取得较大进步,但其具体的发病机制尚未完全清楚。脂质代谢异常、氧化应激、炎症反应等是目前公认的ALI发病机制。目前临床关于ALI的治疗以戒酒为主,尚无有效药物可以对其彻底根治。随着近些年来对药食两用植物研究的深入,发现多种药食两用植物具备调节脂质代谢、氧化应激和炎症反应的作用,因此,通过膳食补充营养功效因子预防和治疗ALI也逐渐受到人们重视。
桑叶为桑科植物桑(Morus alba L.)的干燥叶,桑叶于2002年被卫生部列入《按照传统既是食品又是中药材物质目录》,即“药食同源”。现代研究表明桑叶具有多种药理作用,如:降血糖、降血脂、防癌、通便利尿和抗炎等[5-8]。桑叶中含有多种活性成分,如:生物碱、黄酮和多糖等。越来越多的研究表明桑叶中的生物碱类化合物是桑叶诸多药理作用的关键成分[9-11]。其中,桑叶生物碱(Mulberry leaf alkaloids,MLA)对肝脏的保护作用也有诸多报道,杨忠敏等[12]研究表明MLA对D-半乳糖所致的肝损伤具有保护作用;王祖文等[13]研究发现MLA对高脂饮食诱导的小鼠肝损伤具有改善作用;Zheng等[14]研究表明MLA的主要成分1-脱氧野尻霉素(1-Deoxynojirimycin,DNJ)可以改善高脂饮食诱导的非酒精性脂肪肝;本课题在前期研究中也发现DNJ对二型糖尿病动物模型db/db小鼠的非酒精性脂肪肝也有保护作用[15]。以上研究都表明MLA的肝脏保护作用与其抑制炎症和氧化应激有关,而炎症和氧化应激也是ALI发生发展的重要机制,但关于MLA对ALI的保护作用尚未见报道。基于此,本研究建立了ALI小鼠模型,探讨MLA对ALI小鼠的保护作用,为桑叶防治ALI及相关功能食品的研究与开发提供实验依据。
1 材料与方法
1.1 主要材料与试剂
56%红星二锅头酒:北京红星股份有限公司。甘油三酯(triglyceride,TG)、总胆固醇(total cholesterol,TC)、谷丙转氨酶(cereal third transaminase,ALT)、谷草转氨酶(aspartate transaminase,AST)、超氧化物歧化酶(superoxide dismutase,SOD)和丙二醛(malondialdehyde,MDA)试剂盒由南京建成生物工程研究所提供。BCA蛋白浓度测定试剂盒:北京索莱宝科技有限公司;肿瘤坏死因子α(tumor necrosis factor α,TNF-α)、白细胞介素1β(interleukin-1β,IL-1β)和白细胞介素6(interleukin-6,IL-6)ELISA试剂盒由苏州卡尔文生物科技有限公司提供。苏木精-伊红(hematoxylin-eosin,H & E)染液:北京索莱宝科技有限公司。
MLA为实验室研究自制,方法如下[16,17]:将桑叶分别加10倍量的水,煮沸提取三次,每次2 h,过滤,将滤液pH调至3~4,经过己经预处理过的D001型阳离子树脂,以4%氨水洗脱,收集氨水洗脱液,回收后过201×4阴离子树脂,再以蒸馏水续洗。合并流出液和水洗液。减压浓缩、干燥,即得MLA,采用硅钨酸沉淀法[18]测得样品中总生物碱质量分数为80.81%。
实验动物:SPF级雄性ICR小鼠50只,体重18~22 g,由北京维通利华实验动物有限公司提供,生产许可证号:SCXK(京)2016-0006。
1.2 主要仪器与设备
IKA R104高速组织匀浆机,艾卡(广州)仪器设备有限公司;iMARK酶标仪,美国伯乐公司;高速冷冻离心机,德国Eppendorf公司;JB-P5包埋机,武汉俊杰电子有限公司;RM2016病理切片机,上海徕卡仪器有限公司;KD-P组织摊片机,浙江省金华市科迪仪器设备有限公司;Nikon Eclipse E100正置光学显微镜,日本尼康公司。
1.3 试验方法
1.3.1 动物试验
小鼠适应性饲养1周后随机分为5组(n=10):正常对照组(Control)、模型组(Alcohol)、MLA低剂量组(MLA-L)、MLA中剂量组(MLA-M)和MLA高剂量组(MLA-H)。对照组:灌胃生理盐水;模型组:灌胃56%红星二锅头;MLA低剂量组(MLA-L):灌胃56%红星二锅头和MLA(40 mg/kg·day);MLA中剂量组(MLA-M):灌胃56%红星二锅头和MLA(80 mg/kg·day);MLA高剂量组(MLA-H):灌胃56%红星二锅头和MLA(160 mg/kg·day)。其中,56%红星二锅头灌胃剂量均为0.2 mL/10 g,每日上午根据体重进行灌胃。实验连续进行4周后,所有动物禁食12 h,以水合氯醛麻醉,摘眼球取血,在4 ℃条件下,3000 r/min离心15 min,取血清用于血清生化等指标的检测,然后迅速解剖取出肝脏,以生理盐水冲洗干净后,滤纸吸净后称重,用于计算肝脏指数,取部分肝脏置于4%多聚甲醛溶液中,用于病理学检测,剩余部分放置-80 ℃环境下保存,用于肝脏中的相关指标检测。
1.3.2 肝脏指数的测定
动物解剖前,对小鼠进行称重。
1.3.3 血清相关指标检测
小鼠血清中TG、TC、ALT、AST的检测均采用商业试剂盒进行检测,具体实验操作按照说明书进行。
1.3.4 肝脏相关指标检测
精密称取0.1 g肝组织置于1 mL离心管中,加入生理盐水(1:9 m/V)后匀浆,在4000 r/min,4 ℃条件下离心10 min,使用BCA蛋白浓度测定试剂盒对肝脏组织匀浆上清液蛋白浓度进行测定。使用商业试剂盒检测肝脏中的SOD、GSH-Px、CAT、MDA、TNF-α、IL-1β和IL-6,具体实验操作按照说明书进行。
1.3.5 苏木精-伊红(hematoxylin-eosin,H&E)染色
肝脏组织在4%多聚甲醛固定后,进行脱水、石蜡包埋,切厚度为5 μm的标本,切片漂浮于摊片机40 ℃温水上将组织展平,用载玻片将组织捞起,并放进60 ℃烘箱内烤片,待水烤干蜡烤化后取出依次进行如下处理:石蜡切片脱蜡至水、苏木精染色、伊红染色、脱水封片。染色结束后方可进行显微镜镜检,图像采集分析。
1.4 数据分析
使用 GraphPad Prism 5.0软件(GraphPad software®, San Diego, CA, USA)进行统计分析。结果以均数±标准差表示。采用单因素方差分析(one-way ANOVA)评估统计学意义,然后进行Dunnett’s posthoc检验。p<0.05为显著性差异。
2 结果与讨论
2.1 MLA对ALI小鼠肝脏指数的影响
肝脏肿大是ALI临床上常见的症状[19],肝脏指数可反映肝脏是否出现肿大及肿大程度,表1结果显示,Alcohol组小鼠肝脏指数与Control组相比升高21.90%(p<0.001),提示ALI小鼠肝脏出现肿大。有研究表明,MLA可以降低高脂饮食诱导的小鼠肝指数增加[13],在本实验中,与Alcohol组相比,MLA-L组小鼠的肝脏指数虽无显著性变化,但MLA-M组和MLA-H组小鼠肝脏指数分别下降11.18%、15.17%(MLA-M:p<0.001,MLA-H:p<0.001),并且MLA-M和MLA-H组小鼠的肝脏指数虽然仍高于Control组,但无统计学差异。这些结果表明MLA可以改善小鼠酒精暴露导致的肝脏肿大。
表1 MLA对ALI小鼠肝脏指数的影响
Table 1 Effects of MLA on liver index in ALI mice
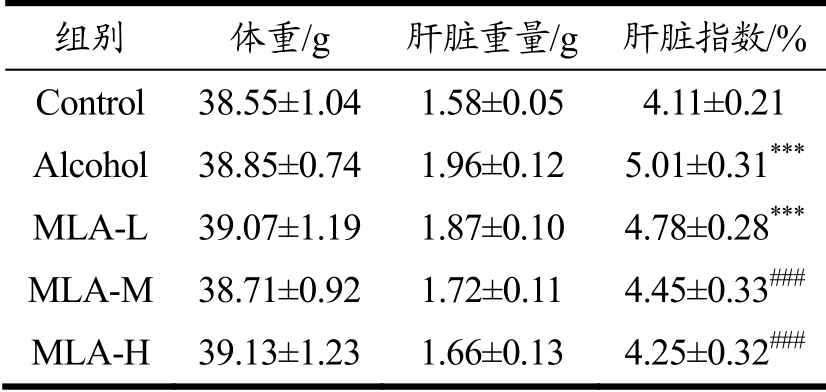
注:与Control组比较,***p<0.001;与Alcohol组比较,###p<0.001;n=10。
组别 体重/g 肝脏重量/g 肝脏指数/%Control 38.55±1.04 1.58±0.05 4.11±0.21 Alcohol 38.85±0.74 1.96±0.12 5.01±0.31***MLA-L 39.07±1.19 1.87±0.10 4.78±0.28***MLA-M 38.71±0.92 1.72±0.11 4.45±0.33###MLA-H 39.13±1.23 1.66±0.13 4.25±0.32###
2.2 MLA对ALI小鼠血脂影响
脂质代谢紊乱也是酒精性肝损伤的常见症状,过量摄入酒精可诱导肝脏脂肪变性,酒精还可影响血脂转运,造成血清TG和TC水平异常[20]。如图1所示,Alcohol组小鼠的TG和TC水平与Control组相比分别升高54.41%、43.79%(p<0.001),说明ALI小鼠出现血脂升高,脂代谢紊乱,这与Tao等[21]的研究结果一致。有研究报道桑叶水提物可以改善肥胖症大鼠的脂代谢[22],在本实验中,经过MLA干预后,MLA中、高剂量均可使ALI小鼠的血清TG降低22.78%、32.65%(MLA-M:p<0.05,MLA-H:p<0.001),使血清TC水平降低19.19%、23.16%(MLA-M:p<0.05,MLA-H:p<0.05);且MLA中、高剂量组小鼠血清TG和TC水平与Control组相比已无统计学差异;低剂量组(MLA-L)小鼠的血清TG和TC水平与Alcohol组相比虽无显著性差异,但也分别降低15.06%、10.60%。这些结果表明MLA可以改善ALI小鼠的脂质代谢紊乱。
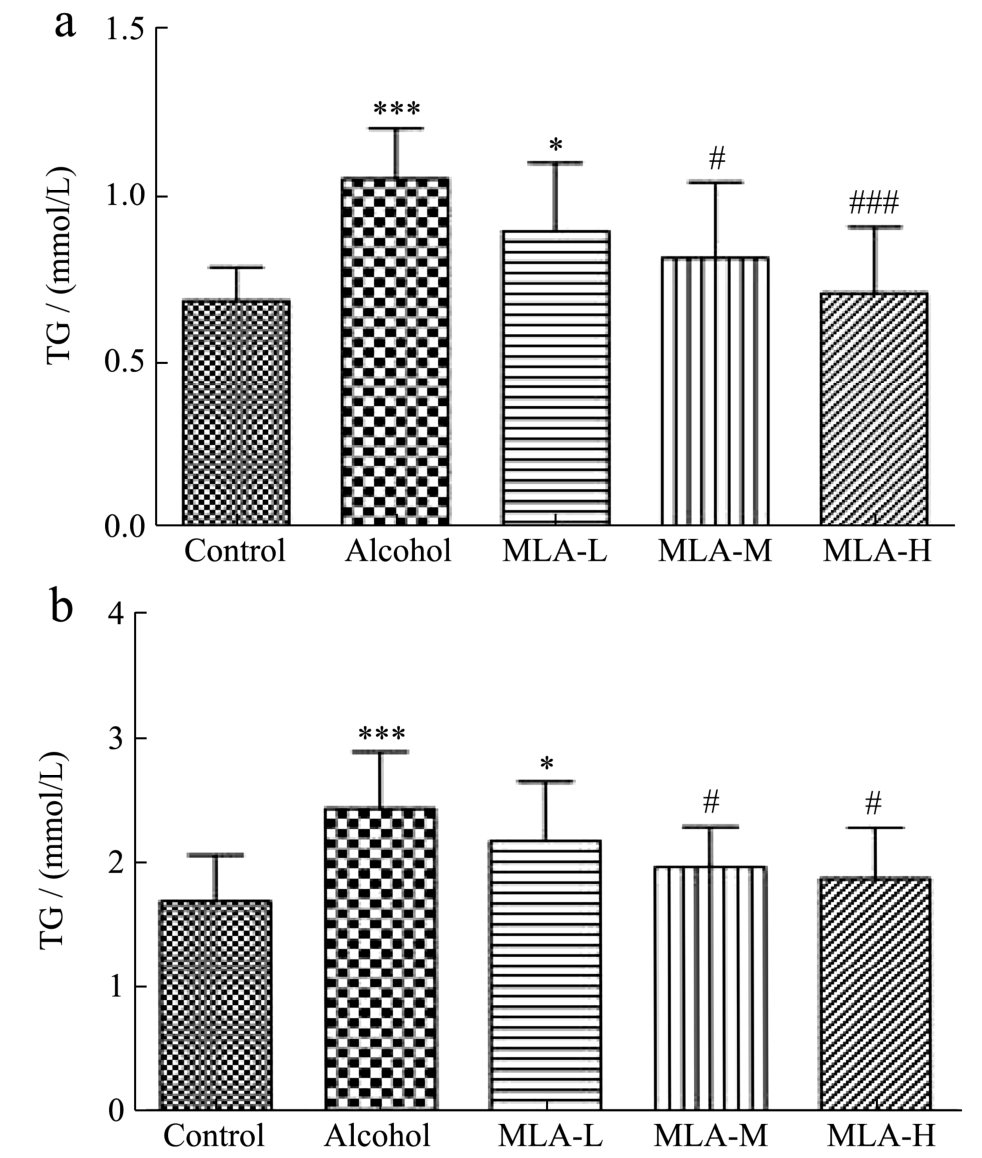
图1 MLA对ALI小鼠血脂影响
Fig.1 Effect of MLA on serum lipid of ALI mice
注:(a)为TG,(b)为TC;与Control组比较,*p<0.05,***p<0.001;与Alcohol组比较,#p<0.05,###p<0.001;n=10。
2.3 MLA对ALI小鼠肝功能的影响
ALT和AST被认为是反映肝细胞损伤和肝功能的重要指标,当机体肝细胞出现损伤或坏死时,两种转氨酶从肝脏释放进入血液,造成血液中ALT和AST浓度升高[23]。图2结果显示,与Control组小鼠相比,ALI小鼠血清中的ALT和AST分别升高52.00%、29.00%(p<0.001),表明ALI小鼠肝细胞和肝功能受损,这与Yang等[24]的研究结果一致;MLA低、中、高剂量组可使ALI小鼠血清ALT水平分别下降19.44%、28.08%、30.58%(MLA-L:p<0.05,MLA-M:p<0.001,MLA-H:p<0.001),且与Control组相比已无统计学上的差异;尽管MLA低剂量组(MLA-L)小鼠血清AST水平与Alcohol组相比无显著性差异,但MLA中、高剂量组可分别使ALI小鼠血清AST降低16.16%、16.41%(MLA-M:p<0.05,MLA-H:p<0.05)。这些结果表明MLA能够保护ALI小鼠的肝细胞,改善其肝功能。
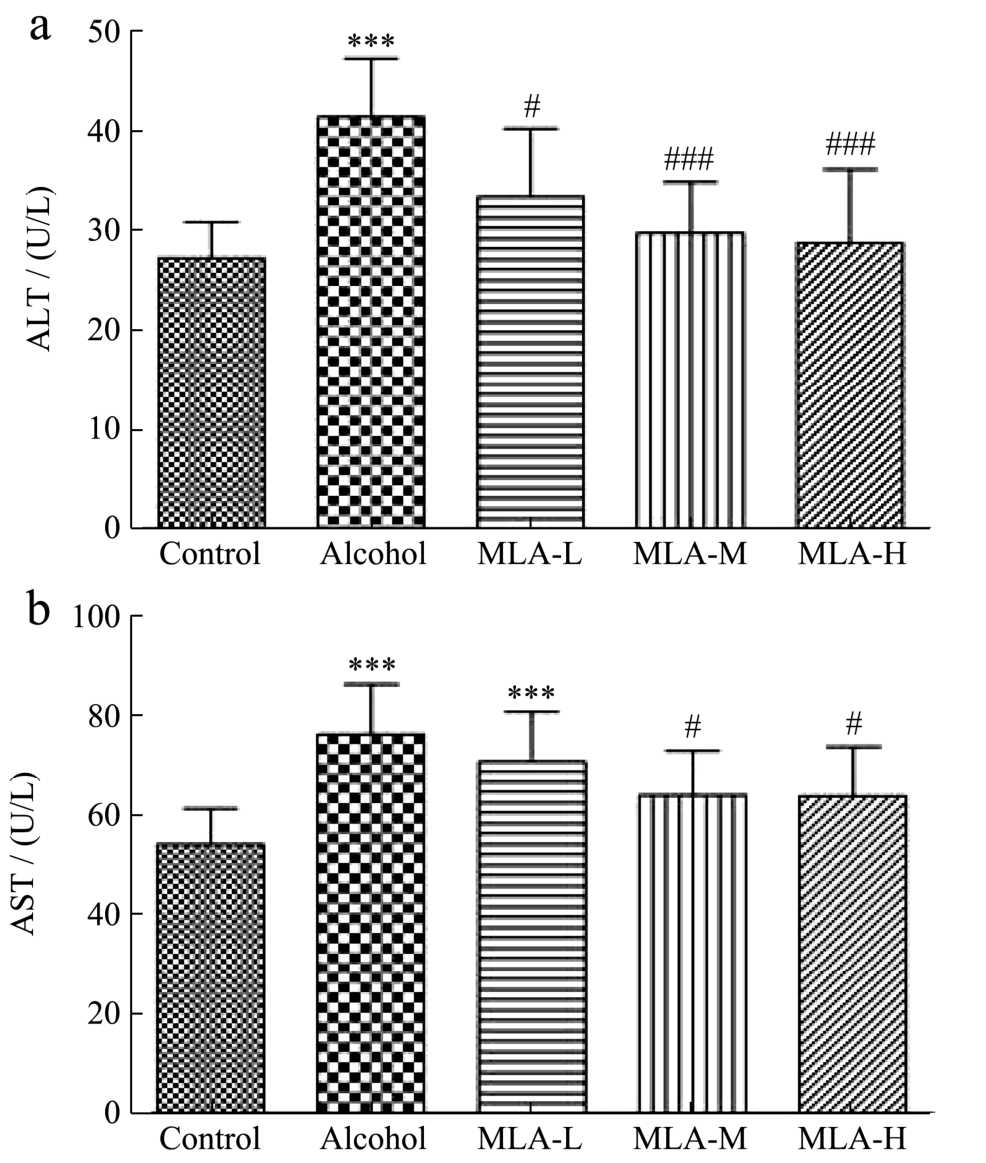
图2 MLA对ALI小鼠血清ALT和AST的影响
Fig.2 Effects of MLA on serum ALT and AST of ALI mice
注:(a)为ALT,(b)为AST;与Control组比较,***p<0.001;与Alcohol组比较,#p<0.05,###p<0.001;n=10。
2.4 MLA对ALI小鼠肝脏组织结构的影响
HE染色结果显示(图3):Control组小鼠肝细胞结构形态正常,细胞核呈圆形且排列规则整齐,整体细胞染色均匀,间隔清晰,未见炎细胞浸润、变性和坏死细胞。Alcohol组小鼠肝细胞损伤较明显,组织结构紊乱,排列不规则,细胞间隙模糊,肝细胞肿胀,可见小泡性脂变,并可见炎症细胞浸润;与Alcohol组比,MLA的低、中、高三个剂量均能不同程度改善ALI小鼠肝组织损伤,且有一定的剂量依赖效应,中、高剂量组小鼠肝细胞形态结构未见明显损伤,细胞核呈圆形且排列规则整齐,整体细胞染色均匀,间隙清晰,少见炎症细胞浸润。这些结果说明MLA可以保护ALI小鼠肝脏组织结构。
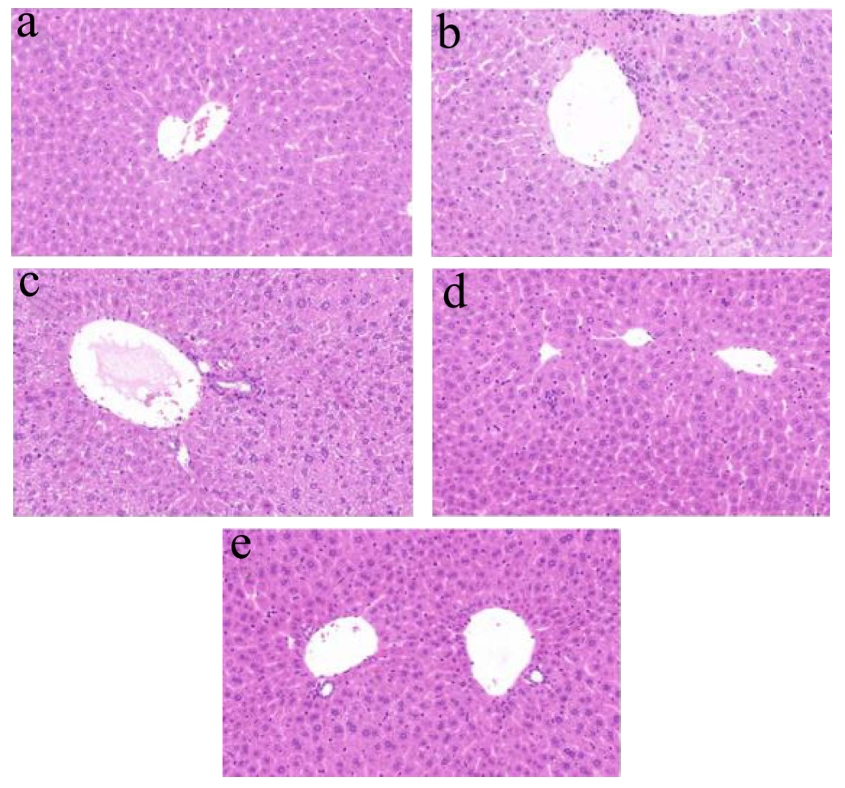
图3 MLA对ALI小鼠肝脏组织形态的影响
Fig.3 Effects of MLA on liver morphology in ALI mice
注:HE染色,拍摄倍数为10×40,a为正常对照组(Control),b为模型组(Alcohol),c为MLA低剂量组(MLA-L),d为MLA中剂量组(MLA-M),e为MLA高剂量组(MLA-H)。
2.5 MLA对ALI小鼠肝脏氧化应激的影响
肝脏是机体代谢酒精的主要器官,酒精代谢过程中会产生活性氧,当机体摄入过量酒精时,将产生大量的超氧阴离子等活性氧成分,造成机体抗氧化系统失衡,导致氧化应激,这是ALI发生与进展的重要机制之一[25]。在研究中,可以通过测定SOD、CAT、GSH-Px等指标评价机体的抗氧化能力[26,27]。同时,酒精在代谢过程中能诱发脂质过氧化,导致细胞损伤并产生脂质氧化终产物[28]。MDA是脂质过氧化的最终产物之一,具有细胞毒性,也是氧化应激的标志。因此,在研究中可以通过测定MDA反映机体脂质过氧化水平,间接反映出机体因过氧化造成的损伤情况[29]。基于此,研究检测了肝脏中SOD、CAT、GSH-Px和MDA的含量,以评价MLA对ALI小鼠肝脏氧化应激的影响。
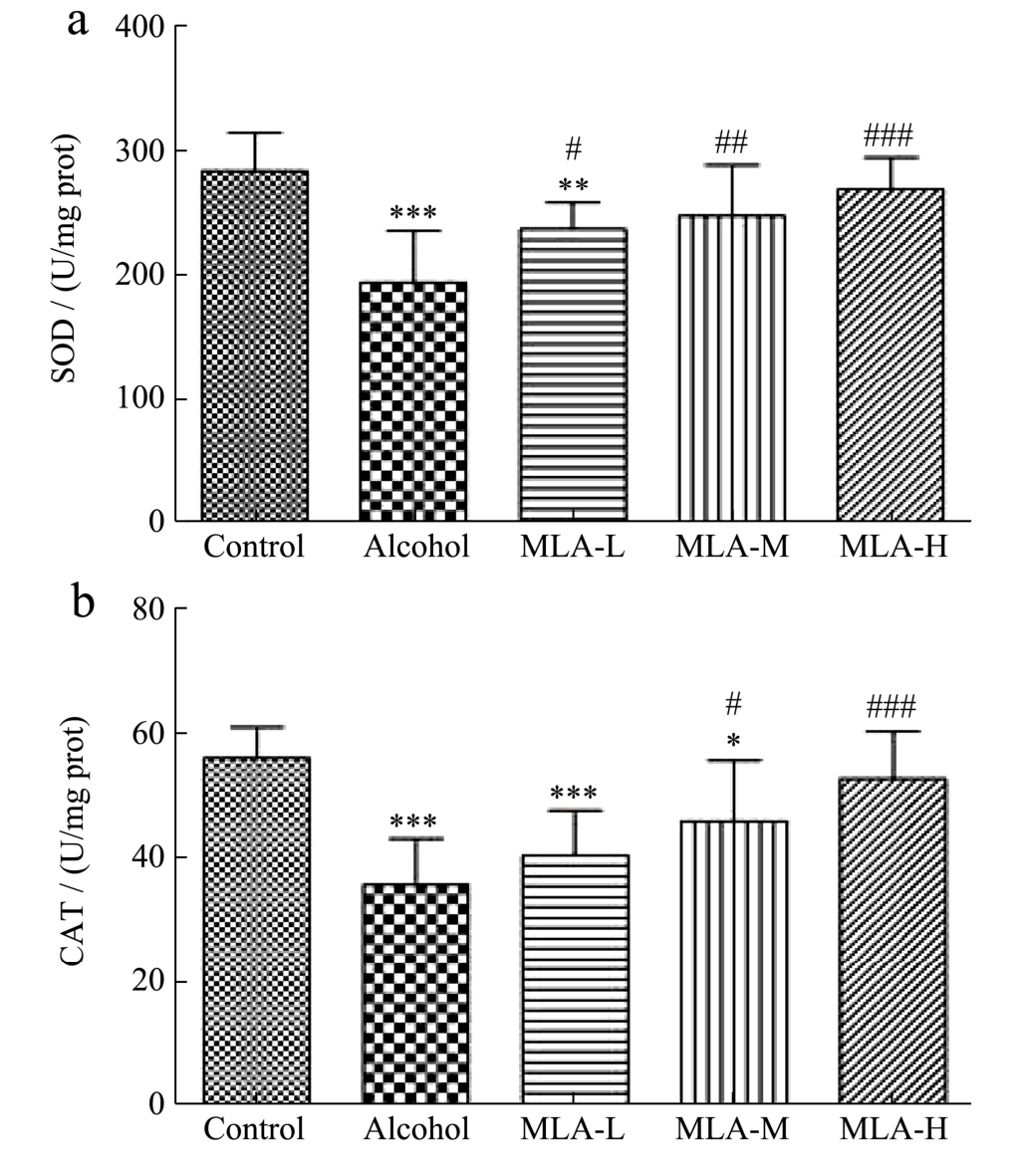
本实验结果显示(图4):Alcohol组小鼠肝脏中SOD、CAT、GSH-Px的活力明显低于Control组(p<0.001),分别下降31.71%、36.32%、24.50%,同时,Alcohol组小鼠的肝脏中MDA水平与Control组相比升高51.1%(p<0.001),表明ALI小鼠肝脏的抗氧化能力显著下降,并且已经出现脂质氧化损伤,这与栾倩等[30]的研究结果一致。有研究报道MLA能改善D-半乳糖诱导的小鼠机体氧化应激,减轻脂质氧化损伤[31]。本实验结果显示:经过MLA的干预后,低、中、高剂量组小鼠肝脏中SOD活力分别升高21.82%、27.47%、38.38%(MLA-L:p<0.05,MLA-M:p<0.01,MLA-H:p<0.001),且中、高剂量组与Control组相比已无统计学差异;中、高剂量组小鼠肝脏中CAT活力升高15.36%、19.09%(MLA-M:p<0.05,MLA-H:p<0.001),且高剂量组与Control组相比已无统计学差异,低剂量组(MLA-L)与Alcohol组相比虽无显著性差异,但也上升13.02%;中、高剂量组小鼠肝脏中GSH-Px活力分别提高27.83%、31.09%(MLA-M:p<0.01,MLA-H:p<0.001),且与Control组相比已无 统计学差异,低剂量组(MLA-L)与Alcohol组相比虽无显著性差异,但也上升10.89%。这表明MLA可以改善酒精暴露导致的机体抗氧化能力下降。经过MLA的干预后,中、高剂量组小鼠的肝脏MDA水平分别降低25.07%、31.97%(MLA-M:p<0.001,MLA-H:p<0.001),且与Control组相比已无统计学差异;低剂量组(MLA-L)与Alcohol组相比虽无显著性差异,但也下降8.02%。这些结果表明MLA可以缓解酒精暴露导致的肝脏氧化损伤。综合以上结果可以证实MLA能够改善ALI小鼠肝脏氧化应激。
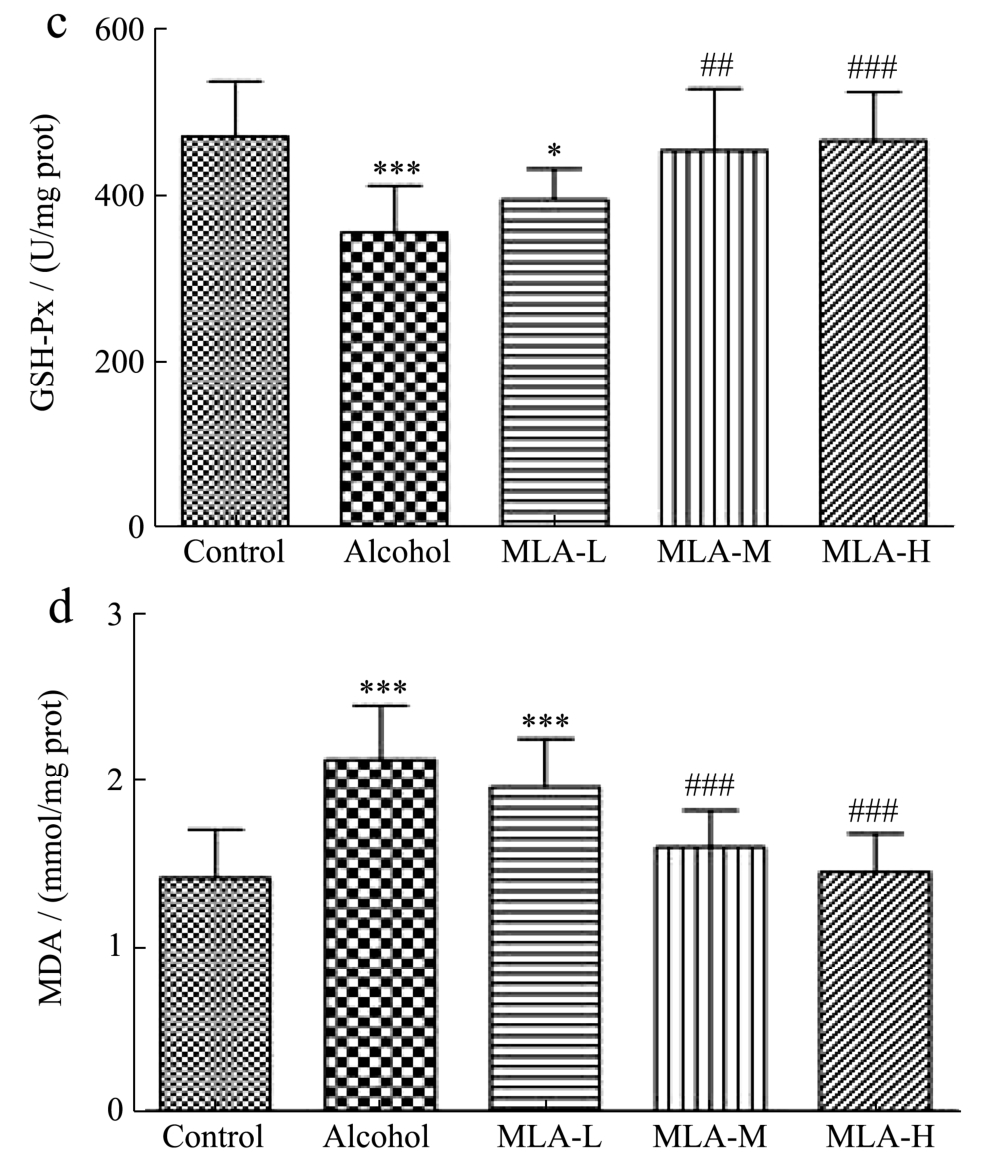
图4 MLA对ALI小鼠肝脏中SOD、CAT、GSH-Px和MDA的影响
Fig.4 Effects of MLA on SOD, CAT, GSH-Px and MDA in liver of ALI mice
注:(a)为SOD,(b)为CAT,(c)为GSH-Px,(d)为MDA;与Control组比较,*p<0.05,**p<0.01,***p<0.001;与Alcohol组比较,#p<0.05,##p<0.01,###p<0.001;n=10。
2.6 MLA对ALI小鼠炎症因子的影响
IL-1β、IL-6和TNF-α等炎症因子是肝脏炎性损伤的重要因素,酒精暴露会刺激库普弗细胞产生IL-1β、IL-6和TNF-α,造成肝细胞炎性损伤,加剧ALI的进展[32,33]。基于此,研究检测了小鼠肝脏中IL-1β、IL-6和TNF-α的含量。结果显示(图5a,b,c),与Control组相比,Alcohol组小鼠肝脏中IL-1β、IL-6和TNF-α的含量分别升高38.35%、53.88%、39.40%(p<0.001);研究报道MLA能够降低高脂饮食诱导小鼠肝脏TNF-α等肝脏炎症因子的mRNA水平[15],在本实验中,MLA低、中、高剂量组小鼠肝脏IL-1β水平与Alcohol组相比分别降低12.88%、23.51%、27.19%(MLA-L:p<0.05;MLA-M:p<0.001;MLA-H:p<0.001),且中、高剂量组与Control组相比已无统计学差异;与Alcohol组相比,MLA中、高剂量组小鼠肝脏IL-6水平均分别下降18.61%、25.41%(MLA-M:p<0.05;MLA-H:p<0.001),且中、高剂量组与Control组相比已无统计学差异,低剂量组小鼠肝脏IL-6水平虽无显著性变化,但也降低14.31%;与Alcohol组相比,MLA中、高剂量组小鼠肝脏TNF-α水平分别降低11.78%、29.59%(MLA-M:p<0.05;MLA-H:p<0.001),且高剂量组与Control组相比已无统计学差异,低剂量组小鼠肝脏TNF-α水平虽无显著性变化,但也降低了8.48%。以上结果表明MLA能抑制ALI小鼠肝脏中IL-1β、IL-6和TNF-α等炎症因子的表达,这与其发挥减轻ALI小鼠肝脏炎症反应的作用有关。
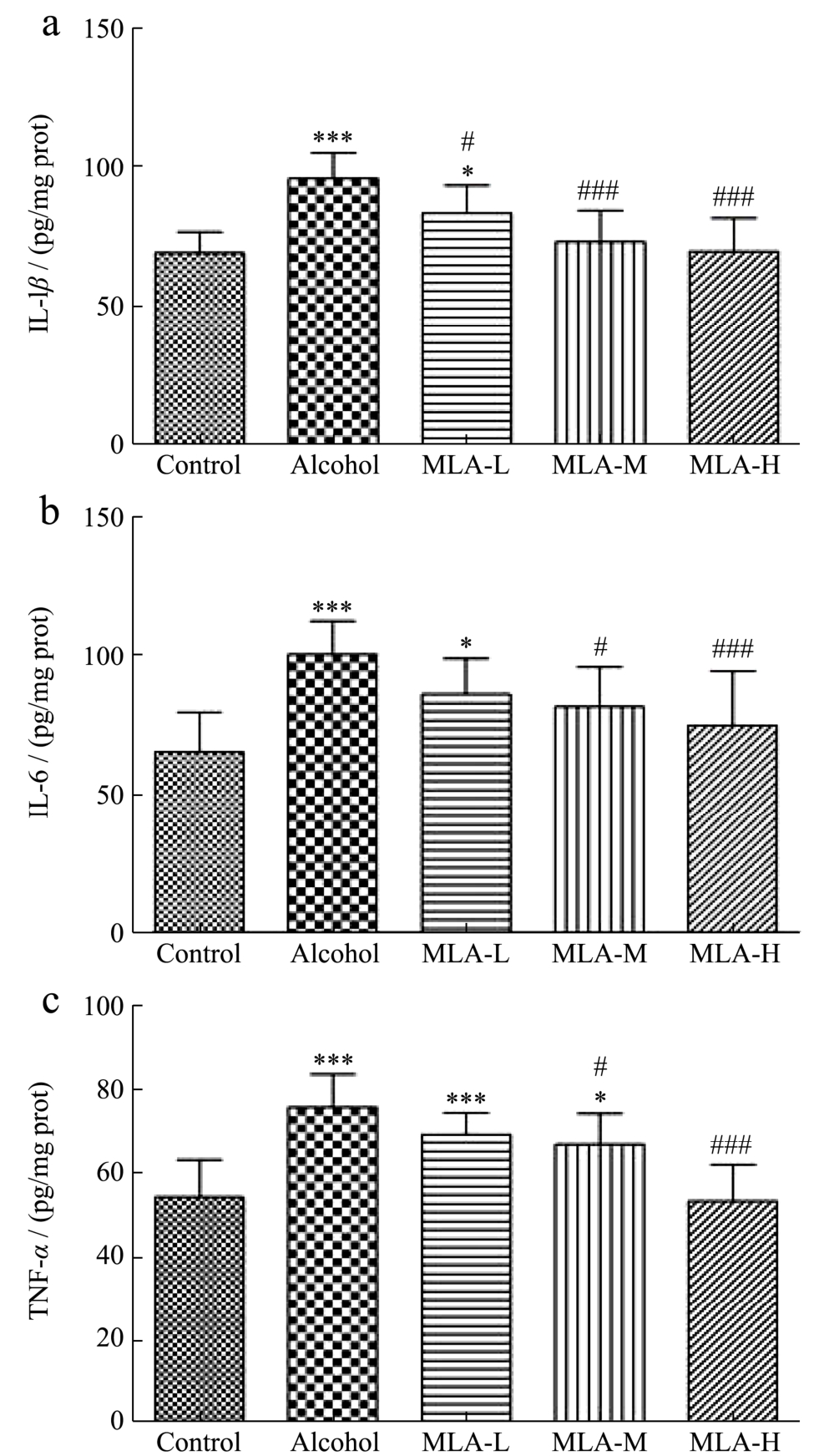
图5 MLA对ALI小鼠血清中IL-1β、IL-6 和TNF-α的影响
Fig.5 Effects of MLA on serum IL-1β, IL-6 and TNF-α in ALI mice
注:(a)为IL-1β,(b)为IL-6,(c)为TNF-α;与Control组比较,*p<0.05,***p<0.001;与Alcohol组比较,#p<0.05,###p<0.001;n=10。
3 结论
现有研究表明MLA对多种肝脏损伤具有保护作用,但MLA对酒精性肝损伤的保护作用尚未见报道。本研究发现了MLA可以降低酒精性肝损伤小鼠的肝脏肿大,改善其脂代谢,保护其肝脏形态结构及功能,并且能够改善其肝脏氧化应激和炎症反应。这些研究结果证实MLA可以改善小鼠酒精性肝损伤,其作用机制可能与改善肝脏氧化应激和抑制炎症反应有关。本研究可为桑叶防治酒精性肝损伤及相关功能食品的研究与开发提供依据。
[1] Asrani S K, Devarbhavi H, Eaton J, et al. Burden of liver diseases in the world [J]. Journal of Hepatology, 2019, 70(1): 151-171
[2] 刘岩,苏琳.酒精性肝病基层诊疗指南(2019年)[J].临床肝胆病杂志,2021,37(1):36-40
LIU Yan, SU Lin. Guideline for primary care of alcoholic liver disease (2019) [J]. Journal of Clinical Hepatology, 2021, 37(1): 36-40
[3] WHO. Global status report on alcohol and health [R]. 2018
[4] 张洁,虞朝辉.酒精性肝病的流行病学与自然史[J].现代医药卫生,2017,33(1):3-4,6
ZHANG Jie, YU Chaohui. Epidemiology and natural history of alcoholic liver disease [J]. Journal of Modern Medicine & Health, 2017, 33(1): 3-4, 6
[5] Chen C, Razali U, Saikim F H, et al. Morus alba L. plant: bioactive compounds and potential as a functional food ingredient [J]. Foods, 2021, 10(3): 689
[6] Ji S, Zhu C, Gao S, et al. Morus alba leaves ethanol extract protects pancreatic islet cells against dysfunction and death by inducing autophagy in type 2 diabetes [J]. Phytomedicine, 2021, 83: 153478
[7] Wang H, Shen Y, Zhao L, et al. 1-Deoxynojirimycin and its derivatives: a mini review of the literature [J]. Current Medicinal Chemistry, 2021, 28(3): 628-643
[8] Liao S, Long X, Zou Y, et al. Mulberry leaf phenolics and fiber exert anti-obesity through the gut microbiota-host metabolism pathway [J]. Journal of Food Science, 2021, 86(4): 1432-1447
[9] Wang Y, Yu Z, Jiang J, et al. Mulberry leaf attenuates atherosclerotic lesions in patients with coronary heart disease possibly via 1-deoxynojirimycin: a placebo-controlled, double-blind clinical trial [J]. Journal of Food Biochemistry, 2021, 45(1): e13573
[10] Han X, Song C, Feng X, et al. Isolation and hypoglycemic effects of water extracts from mulberry leaves in northeast China [J]. Food & Function, 2020, 11(4): 3112-3125
[11] Ge Q, Chen L, Tang M, et al. Analysis of mulberry leaf components in the treatment of diabetes using network pharmacology [J]. European Journal of Pharmacology, 2018, 833: 50-62
[12] 杨忠敏,沈以红,黄先智,等.桑叶生物碱对氧化应激小鼠糖脂代谢异常及肝损伤的改善作用[J].食品科学,2021,42(7): 156-161
YANG Zhongmin, SHEN Yihong, HUANG Xianzhi, et al. Improvement effect of mulberry leaf alkaloids on abnormal glucose and lipid metabolism and liver injury induced by oxidative stress in mice [J]. Food Science, 2021, 42(7): 156-161
[13] 王祖文,杨忠敏,杨敏,等.桑叶生物碱对高脂饮食诱导小鼠肝损伤的改善作用及机理[J].食品科学,2019,40(19):210- 216
WANG Zuwen, YANG Zhongmin, YANG Min, et al. Effect and mechanism of mulberry leaf alkaloids on the improvement of high-fat diet induced liver injury in mice [J]. Food Science, 2019, 40(19): 210-216
[14] Zheng J, Zhu L, Hu B, et al. 1-Deoxynojirimycin improves high fat diet-induced nonalcoholic steatohepatitis by restoring gut dysbiosis [J]. Journal of Nutritional Biochemistry, 2019, 71: 16-26
[15] Liu Q, Li X, Li C, et al. 1-Deoxynojirimycin alleviates liver injury and improves hepatic glucose metabolism in db/db mice [J]. Molecules, 2016, 21: 279
[16] Liu Q, Li X, Li C, et al. 1-Deoxynojirimycin alleviates insulin resistance via activation of insulin signaling PI3K/AKT pathway in skeletal muscle of db/db mice [J]. Molecules, 2015, 20: 21700-21714
[17] 朱成.桑叶有效部位制备与化学成分定性研究[D].南京:南京中医药大学,2015
ZHU Cheng. Research on manufacture process and chemical constitude of Morus alba L. effective fraction [D]. Nanjing: Nanjing University of Chinese Medicine, 2015
[18] 杨旭.桑叶中总生物碱提取工艺优化及降血糖活性研究[D].南京:南京理工大学,2012
YANG Xu. The optimization of separation process of total alkaloids from Morus alba leaves and their hypoglycemic activity [D]. Nanjing: Nanjing University of Science and Technology, 2012
[19] Zhou C, Lai Y, Huang P, et al. Naringin attenuates alcoholic liver injury by reducing lipid accumulation and oxidative stress [J]. Life Sciences, 2019, 216: 305-312
[20] Teschke R. Alcoholic liver disease: alcohol metabolism, cascade of molecular mechanisms, cellular targets, and clinical aspects [J]. Biomedicines, 2018, 6(4): 106
[21] Tao Z, Zhang L, Wu T, et al. Echinacoside ameliorates alcohol-induced oxidative stress and hepatic steatosis by affecting SREBP1c/FASN pathway via PPARα [J]. Food and Chemical Toxicology, 2021, 148: 111956
[22] 马珂,喻凯,何雨轩,等.桑叶水提物对肥胖症大鼠脂代谢及肠道菌群的影响[J].华西药学杂志,2019,34(3):151-154
MA Ke, YU Kai, HE Yuxuan, et al. Effects of the mulberry leaves water extract on lipid metabolism and intestinal flora in obese rats [J]. West China Journal of Pharmaceutical Sciences, 2019, 34(3): 151-154
[23] Yamada K, Ueda K, Shirakawa H, et al. The effect of liver hydrolysate on chronic ethanol-induced hepatic injury in normal rats [J]. Biological & Pharmaceutical Bulletin, 2020, 43(3): 554-557
[24] Yang Y, Chen Z, Deng L, et al. Pientzehuang ameliorates liver injury by inhibiting the PERK/eIF2α signaling pathway in alcohol and high-fat diet rats [J]. Acta Histochemica, 2018, 120: 578-585
[25] Cichoż-Lach H, Michalak A. Oxidative stress as a crucial factor in liver diseases [J]. World Journal of Gastroenterol, 2014, 25: 8082-8091
[26] Mira S M D, Castillo S J, Maria M R J. Comparative study of rosemary extracts and several synthetic and natural food antioxidants. Relevance of carnosic acid/carnosol ratio [J]. Food Chemistry, 2020, 309: 125688
[27] Lv Y, So K F, Xiao J. Liver regeneration and alcoholic liver disease [J]. Annals of Translational Medicine, 2020, 8(8): 567
[28] 张秋萍,吴霞红,郑剑恒,等.生物样本中丙二醛测定方法的研究进展[J].理化检验(化学分册),2016,52(8):979-985
ZHANG Qiuping, WU Xiahong, ZHENG Jianheng, et al. Progress of researches on methods for determination of malondialdehyde [J]. Physical Testing and Chemical Analysis (Part B: Chemical Analysis), 2016, 52(8): 979-985
[29] El-Newary S A, Shaffie N M, Omer E A, et al. The protection of thymus vulgaris leaves alcoholic extract against hepatotoxicity of alcohol in rats [J]. Asian Pacific journal of Tropical Medicine, 2017, 10(4): 361-371
[30] 栾倩,樊毅,张淼,等.枸杞芽叶有效成分对急性酒精性肝损伤保护作用研究[J].天然产物研究与开发,2020,32(11): 1803-1810,1817
LUAN Qian,FAN Yi,ZHANG Miao, et al. Protective effect of active ingredients of Lycium barbarum leaves on acute alcoholic liver injury in mice [J]. Natural Product Research and Development, 2020, 32(11): 1803-1810, 1817
[31] 王祖文,杨忠敏,黄先智,等.桑叶生物碱对四氯化碳联合高脂饮食诱导的小鼠肝纤维化的改善作用[J].食品科学,2020, 41(7):146-152
WANG Zuwen, YANG Zhongmin, HUANG Xianzhi, et al. Improvement effect of mulberry leaf alkaloids on hepatic fibrosis induced by carbon tetrachloride combined with high-fat diet in mice [J]. Food Science, 2020, 41(7): 146-152
[32] Seitz H K, Bataller R, Cortez-Pinto H, et al. Alcoholic liver disease [J]. Nature Reviews Disease Primers, 2018, 4(1): 16
[33] Gao B, Ahmad M F, Nagy L E, et al. Inflammatory pathways in alcoholic steatohepatitis [J]. Journal of Hepatology, 2019, 70(2): 249-259