马氏珠母贝(Pinctada martensii)又称合浦珠母贝,简称珍珠贝,是我国南方海水珍珠养殖的主要品种。中国药典(2015)指出珍珠具有“解毒生肌,润肤祛斑”等功效。近年来对珍珠贝的研究发现,不但珍珠,其贝肉和分泌物中同样含有与珍珠类似功效的活性成分,有待深入挖掘和开发利用。当前,在珍珠养殖产业中,取珠后的贝肉、分泌物等利用附加值很低,亟需研究如何对其进行深入的开发和利用。
任何有氧呼吸的生物都会产生自由基。体内的抗氧化防御系统在清除活性氧(ROS)、防止细胞损伤方面起着重要作用。然而,过量的ROS产生会导致氧化损伤的发生,启动DNA、RNA和膜脂等生物分子氧化,进一步可能引起机体失调,造成提前衰老或如癌症、动脉粥样硬化、糖尿病和心血管等疾病的产生[1]。因此需要摄入足够数量的抗氧化剂来预防或减缓ROS引起的氧化应激,合成抗氧化剂虽可降低食品中的自由基水平,但对人体健康有潜在的毒性作用[2],开发天然抗氧化剂具有重要研究意义。
酪氨酸酶是黑色素生成的限速酶[3],酪氨酸酶催化L-酪氨酸氧化成L-多巴,L-多巴进一步氧化成L-多巴醌,最终形成黑色素[4]。虽然黑色素有助皮肤抵御紫外线,但过量酪氨酸酶表达会造成黄褐斑、雀斑和老年斑等皮肤问题。大量研究表明,具有抗氧化作用的活性组分多具有抑制酪氨酸活性的效果[5,6],通过抗氧化剂调节酪氨酸酶活性已被确定为促进皮肤白皙的有效策略。合成酪氨酸酶抑制剂存在高细胞毒性和不稳定性[7],亟需开发无毒、稳定、有效的新型抑制剂。我国古代传统中医和现代研究表明,珍珠具有公认的美白、护肤功效,而其中的蛋白/肽组分发挥了重要作用[8]。珍珠贝肉作为取珠后的附属物,富含蛋白成分,从中提取类似于珍珠中的抗氧化活性组分并用于抑制酪氨酸酶活性将是一种可行的思路,也有利于珍珠贝肉的高值化利用。
本研究以珍珠贝肉为原料,以抗氧化能力为指标,通过单因素试验和响应面试验优化确定最佳酶解制备抗氧化肽工艺条件,并研究多肽的抗氧化活性和酪氨酸酶抑制活性,为珍珠贝肉的深加工和产业化高值化利用提供理论依据。
1 材料与方法
1.1 原料与试剂
马氏珍珠贝肉来自广西合浦县;木瓜蛋白酶、中性蛋白酶、碱性蛋白酶、胃蛋白酶和胰蛋白酶,南宁庞博生物工程有限公司;1,1-二苯基-2-苦基苯肼(DPPH)、L-酪氨酸、L-多巴、酪氨酸酶,上海源叶生物科技有限公司;2,2-联氮基-双-(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS)、6-羟基-2,5,7,8-四甲基色烷-2-羧酸(Trolox)、邻苯三酚、氯化亚铁等试剂均为分析纯。
1.2 仪器设备
AL104万分之一电子天平,梅特勒-托利多仪器(上海)有限公司;SC110A台式超高速真空离心干燥机,北京赛万特电子科技有限公司;Enspire2300多功能酶标仪,美国PerkinElmer公司;pH计,上海佑科仪器有限公司;RD-50DTZ低速离心机,上海卢湘仪离心机有限公司;WZ-100恒温水浴锅,上海申生科技有限公司。
1.3 实验方法
1.3.1 最优酶筛选
根据胰蛋白酶(pH 8.00、温度40 ℃)、碱性蛋白酶(pH 9.00、温度50 ℃)、中性蛋白酶(pH 7.00、温度45 ℃)、木瓜蛋白酶(pH 6.50、温度55 ℃)、胃蛋白酶(pH 2.00、温度40 ℃)五种酶的理论最适条件,将贝肉绞碎成肉糜,取5 g肉糜,加20 mL蒸馏水,调pH,分别加酶15 mg,恒温水浴酶解3 h,高温灭酶(90 ℃,15 min),冷却离心(4000 r/min,15 min),取上清液稀释10倍后,采用ABTS自由基清除能力测定方法评价的抗氧化能力。
1.3.2 单因素试验
结合1.3.1筛选最优酶结果,分别考察pH(6.50、6.75、7.00、7.25、7.50)、温度(35、40、45、50、55 ℃)、时间(1、2、3、4、5 h)、料液比(1:1、1:2、1:3、1:4、1:5)和酶底比(0.1%、0.2%、0.3%、0.4%、0.5%)对酶解液抗氧化能力影响。制备酶解液后将上清液稀释30倍,测ABTS自由基清除率。
1.3.3 响应面优化实验
结合1.3.2单因素试验结果,根据Box-Behnken中心组合实验设计原理,设计3因素3水平的响应面实验:温度(45、50、55 ℃)、pH(7.00、7.25、7.50)、时间(2、3、4 h),优化珍珠贝肉蛋白抗氧化肽酶解工艺。
1.3.4 氨基酸分析
参照《GB 5009.235-2016食品安全国家标准食品中氨基酸的测定》中测定方法使用全自动氨基酸分析仪(Sykam)进行测定。
1.3.5 抗氧化活性的测定
1.3.5.1 ABTS自由基清除能力测定
参考Floegel等[9]的方法略作修改。分别用超纯水配制7 mmol/L ABTS溶液和140 mmol/L过硫酸钾溶液,取88 μL过硫酸钾溶液加入5 mL ABTS溶液中,混匀室温避光12 h后,在734 nm下稀释至吸光值为0.7±0.02,得到ABTS+·工作液。取100 μL样液和100 μL ABTS+·工作液混合,室温反应10 min后于734 nm测吸光值。以超纯水作为空白对照。根据公式(1)计算清除率,并计算IC50值。
式中:
At——样品和ABTS+·工作液的吸光值;
Ar——样品和超纯水的吸光值;
Ao——超纯水和ABTS+·工作液的吸光值。
1.3.5.2 氧自由基吸收能力(ORAC)测定
参考Nimalaratne等[10]的方法略做修改,取50 μL样品和100 μL 4 μmol/L Fluorescein溶液混合均匀37 ℃保温10 min后迅速加入50 μL 153 mmol/L AAPH溶液,在激发波长490 nm和发射波长514 nm下进行测定,每隔2 min测定一次荧光值,连续测定60个循环。以磷酸缓冲溶液代替样品作为空白对照。Trolox溶液(25、50、75、100和125 μmol/L)作为标准参考物,Trolox标准曲线为:y=0.38x+0.84(R2=0.9833)。
根据公式(2)、(3),通过荧光曲线下面积(AUC)和相对面积(Net AUC)计算ORAC值,用Trolox当量(μmol TE/g冻干粉)表示。
式中:
AUC——荧光曲线面积;
Net AUC——样品组和空白组的相对面积。
1.3.5.3 Fe2+螯合能力测定
参考张美玲等[11]的方法略做修改,取50 μL样液、30 μL 0.25 mmol/L FeCl2溶液和70 μL超纯水,混匀放置2 min。迅速加入50 μL 0.5 mmol/L Ferrozine水溶液,充分震荡混匀后静置10 min后在562 nm下测吸光值,以超纯水为空白对照。根据公式(4)计算Fe2+螯合能力,并计算IC50值。
式中:
At——样品、FeCl2溶液和Ferrozine水溶液的吸光值;
Ac——超纯水、FeCl2溶液和Ferrozine水溶液的吸光值。
1.3.6 酪氨酸酶抑制效果测定
参考耿广青等[12]的方法略做修改,分别以L-酪氨酸和L-多巴作为单酚和二酚底物。取40 μL 0.1 mg/mL L-酪氨酸溶液或L-多巴溶液,加入40 μL样液和80 μL磷酸缓冲溶液,在37 ℃保温10 min后加入40 μL 250 U/mL酪氨酸酶溶液启动反应,在475 nm下分别测0 min和30 min的吸光值。根据公式(5)计算分别计算酪氨酸单酚酶和酪氨酸二酚酶的抑制率,并计算IC50值。
式中:
A1——底物、样液、酪氨酸酶和PBS体系的吸光值;
A2——样液、酪氨酸酶和PBS体系的吸光值;
A3——底物、酪氨酸酶和PBS体系的吸光值;
A4——酪氨酸酶和PBS体系的吸光值。
1.3.7 数据的统计分析
采用SPSS version 21.0软件和Excel 2019软件进行数据处理,各个实验均进行3次平行实验。
2 结果与分析
2.1 最优酶筛选
由于不同蛋白酶的酶切位点不同,蛋白酶种类会影响酶解液的抗氧化活性[13]。图1可知,中性蛋白酶、胰蛋白酶和碱性蛋白酶制备的酶解液抗氧化活性良好,其ABTS自由基清除率分别为91.87%、91.80%和91.55%。结合本实验结果以及考虑环境友好等因素,选择中性蛋白酶作为最优酶。
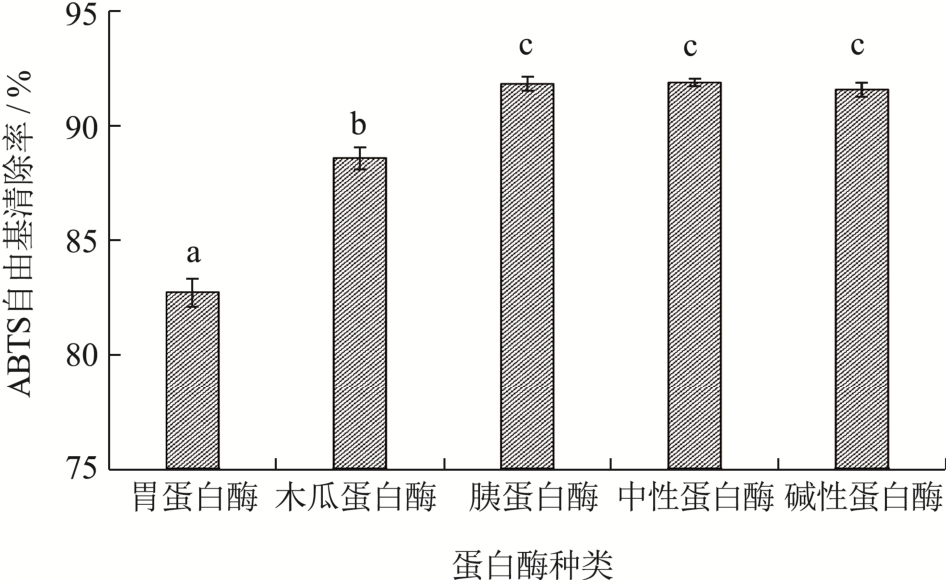
图1 五种蛋白酶抗氧化活性比较
Fig.1 Comparison of antioxidant activities of five kinds of protease (significant difference p<0.05)
注:字母不同表示显著性差异p<0.05。图2~6同,图10~14同。
2.2 单因素试验
2.2.1 pH对ABTS自由基清除率的影响
pH值不仅影响蛋白酶的状态,也影响酶与底物的结合情况[14],不同反应的最适pH也受到底物种类和浓度的影响。如图2所示,pH值为6.50~7.25时,酶解液抗氧化能力不断升高,在7.25时达到最大82.46%,之后明显开始降低。pH值过低或者过高都会影响中性蛋白酶的酶解能力,进而影响珍珠贝肉酶解液的抗氧化能力,因此根据实验结果初步选定pH值为7.25左右。
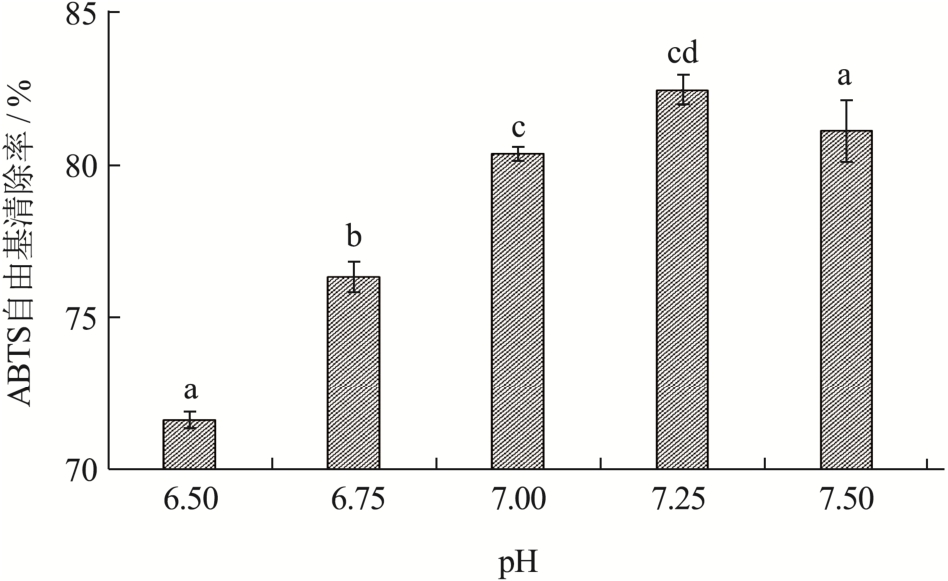
图2 pH对ABTS自由基清除率的影响
Fig.2 Effect of pH on ABTS radical scavenging rate
2.2.2 温度对ABTS自由基清除率的影响
如图3所示,当温度为35~50 ℃时,酶解液抗氧化能力不断升高,在50 ℃时达到最大79.70%,之后开始有降低趋势。温度会影响酶活力,在低温阶段,酶活力随着温度上升,酶促反应加快,但温度高于最适温度后,高温可能会改变蛋白酶的结构,使蛋白酶和底物的接触位点产生变化,导致催化活性逐渐降低,从而抑制了酶解反应[15]。根据实验结果初步选定酶解温度为50 ℃左右。
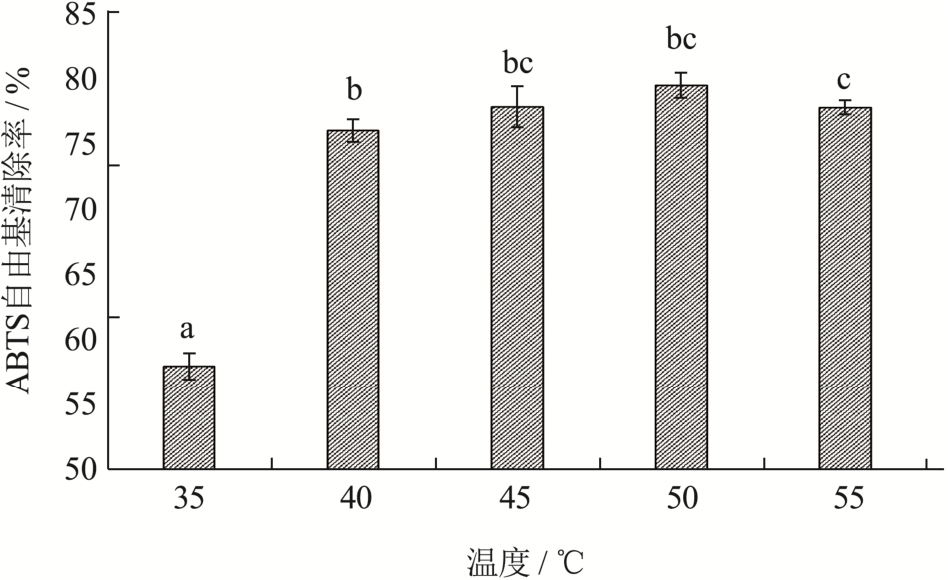
图3 温度对ABTS自由基清除率的影响
Fig.3 Effect of temperature on ABTS radical scavenging rate
2.2.3 时间对ABTS自由基清除率的影响
如图4所示,当时间为1~3 h时,酶解液抗氧化能力不断升高,在3 h时达到最大85.76%,随后明显不断降低。可能在短时间内,酶解反应尚未完全,因此随着时间的延长,酶和底物充分反应,珍珠贝肉蛋白被逐渐酶解成多肽,产生更多具有抗氧化效果的肽段。随着酶解时间的延长,部分具有抗氧化活性的多肽可能被水解成更小的片段[16]。Zou等[17]研究指出抗氧化肽的构效关系存在紧密联系,因此过度水解可能导致多肽的氨基酸的数量和空间结构发生改变,进而降低了多肽的抗氧化活性。根据实验结果初步选定酶解时间为3 h左右。
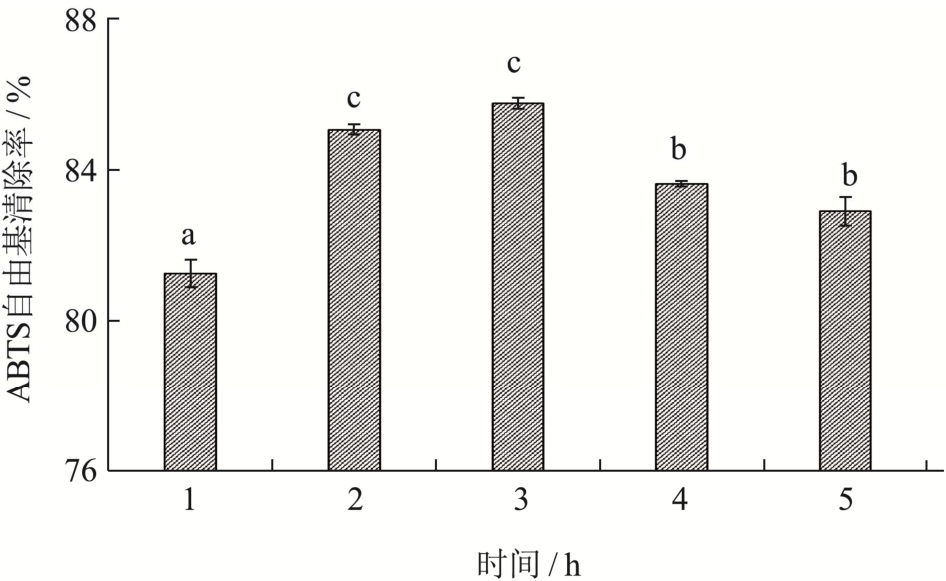
图4 时间对ABTS自由基清除率的影响
Fig.4 Effect of time on ABTS radical scavenging rate
2.2.4 酶底比对ABTS自由基清除率的影响
如图5所示,酶解液抗氧化能力在酶底比从0.1%增加到0.4%的过程中不断增强,从76.48%升高到80.31%,酶底比大于0.4%后趋于平缓。酶底比较小时,由于加酶量较少,酶和底物反应尚未饱和。随着酶底比增大,反应体系中酶浓度增大,酶和底物接触充分,反应加快,单位时间内得到更多具有抗氧化效果的多肽。但酶底比增大到一定程度,反应趋于饱和,继续增大酶底比对于酶促反应帮助不大[18]。结合实验结果和经济效益,选定酶底比为0.4%。
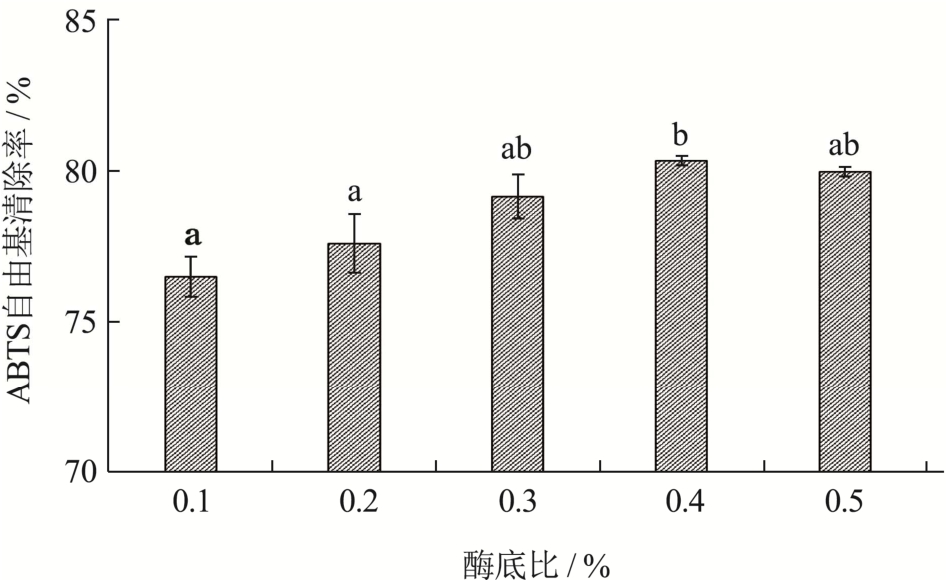
图5 酶底比对ABTS自由基清除率的影响
Fig.5 Effect of enzyme to substrate ratio on ABTS radical scavenging rate
2.2.5 料液比对ABTS自由基清除率的影响
如图6所示,当料液比从1:1增加到1:5的过程中,酶解液抗氧化能力在不断减弱,从88.70%降低到82.71%。新鲜珍珠贝肉中水分含量83%[19],贝肉本身含水分较多,在料液比1:1时,底物和蛋白酶的浓度较高,接触更充分,有利于酶促反应的进行,随着加水比例增大,底物和蛋白酶的浓度降低,接触较不充分,不利于酶促反应的进行。在实际生产中,用水量少可以节约成本和水资源,因此选定料液比为1:1。
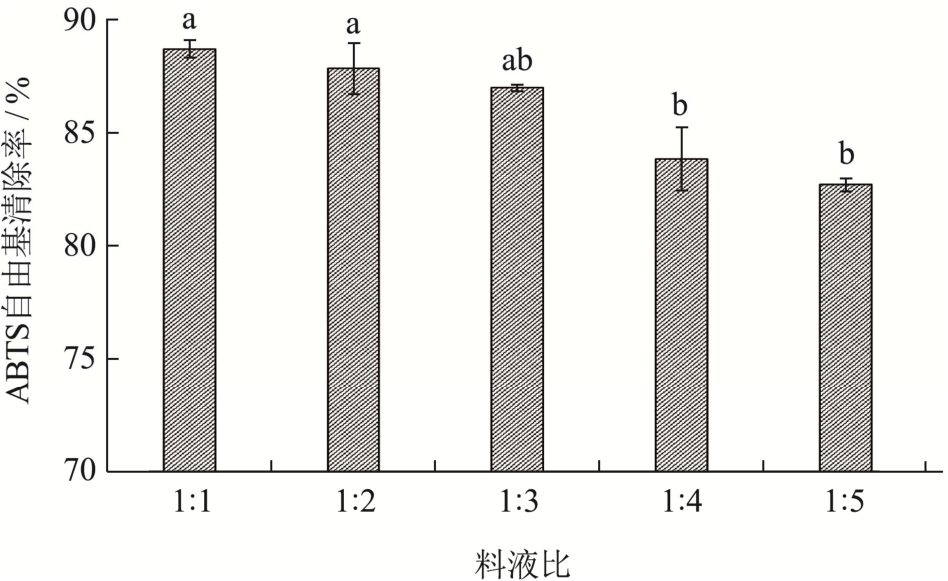
图6 料液比对ABTS自由基清除率的影响
Fig.6 Effect of material-to-liquid ratio on ABTS radical scavenging rate
2.3 响应面试验结果
2.3.1 响应面试验设计与结果
在单因素试验的基础上,选取温度(A)、pH(B)和时间(C),以珍珠贝肉酶解液对ABTS自由基清除率(Y)为响应值,设计3因素3水平的响应面实验,优化珍珠贝肉抗氧化肽酶解工艺,结果见表1。运用Design Expert 8.0.6软件,对表1进行方差分析,结果见表2。
表1 响应面试验设计与结果
Table 1 Box-behnken design and results for response surface analysis
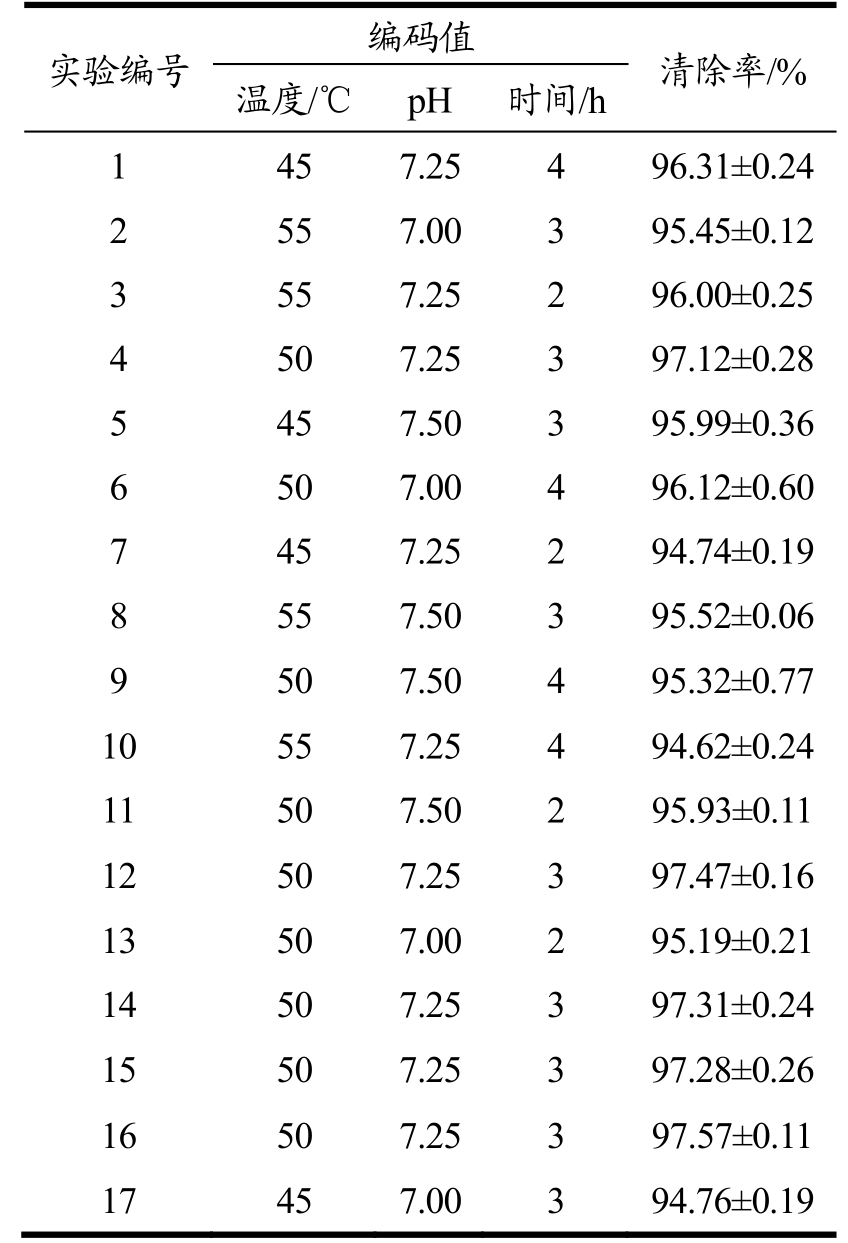
实验编号 编码值 清除率/%温度/℃ pH 时间/h 1 45 7.25 4 96.31±0.24 2 55 7.00 3 95.45±0.12 3 55 7.25 2 96.00±0.25 4 50 7.25 3 97.12±0.28 5 45 7.50 3 95.99±0.36 6 50 7.00 4 96.12±0.60 7 45 7.25 2 94.74±0.19 8 55 7.50 3 95.52±0.06 9 50 7.50 4 95.32±0.77 10 55 7.25 4 94.62±0.24 11 50 7.50 2 95.93±0.11 12 50 7.25 3 97.47±0.16 13 50 7.00 2 95.19±0.21 14 50 7.25 3 97.31±0.24 15 50 7.25 3 97.28±0.26 16 50 7.25 3 97.57±0.11 17 45 7.00 3 94.76±0.19
表2 方差分析
Table 2 Variance analysis
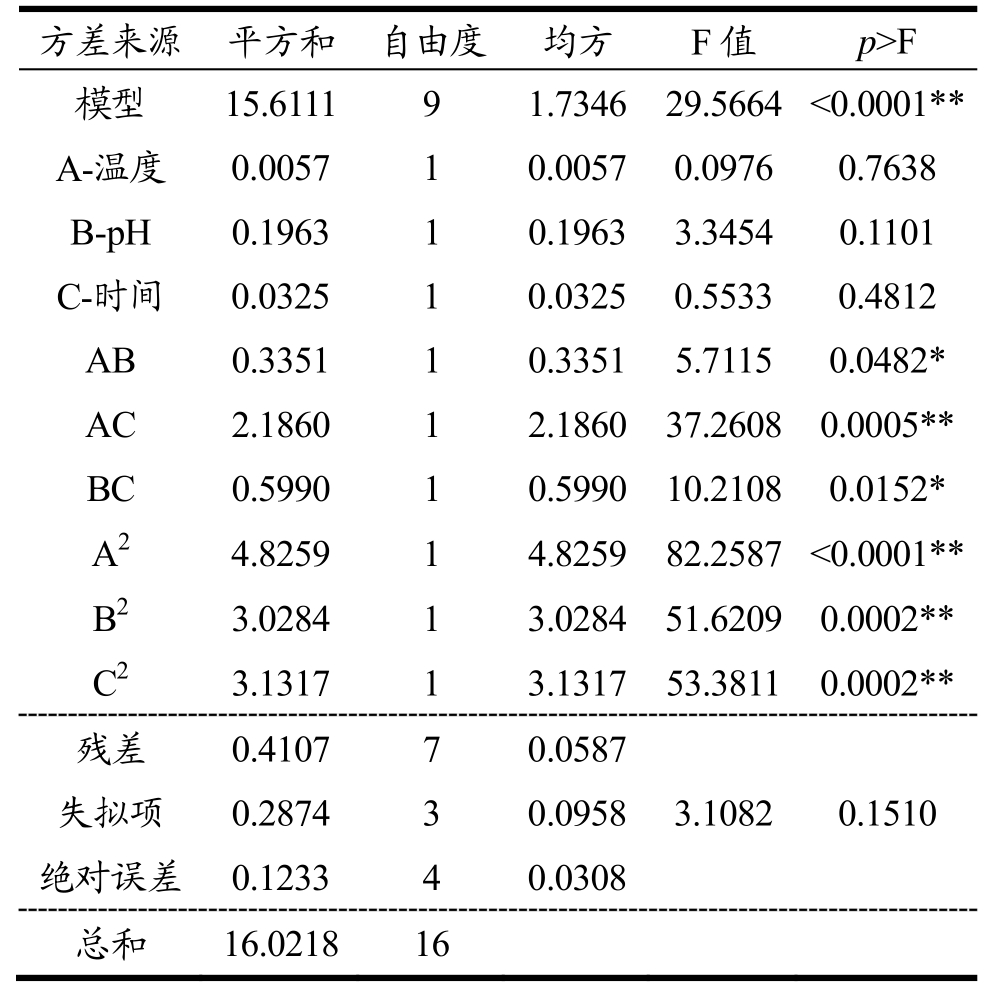
注:*差异显著,p<0.05;**差异极显著,p<0.01。模型的确定系数R2=0.9744,模型的调整系数R2Adj=0.9414。
方差来源 平方和 自由度 均方 F值 p>F模型 15.6111 9 1.7346 29.5664<0.0001**A-温度 0.0057 1 0.0057 0.0976 0.7638 B-pH 0.1963 1 0.1963 3.3454 0.1101 C-时间 0.0325 1 0.0325 0.5533 0.4812 AB 0.3351 1 0.3351 5.7115 0.0482*AC 2.1860 1 2.1860 37.2608 0.0005**BC 0.5990 1 0.5990 10.2108 0.0152*A2 4.8259 1 4.8259 82.2587 <0.0001**B2 3.0284 1 3.0284 51.6209 0.0002**C2 3.1317 1 3.1317 53.3811 0.0002**残差 0.4107 7 0.0587失拟项 0.2874 3 0.0958 3.1082 0.1510绝对误差 0.1233 4 0.0308总和 16.0218 16
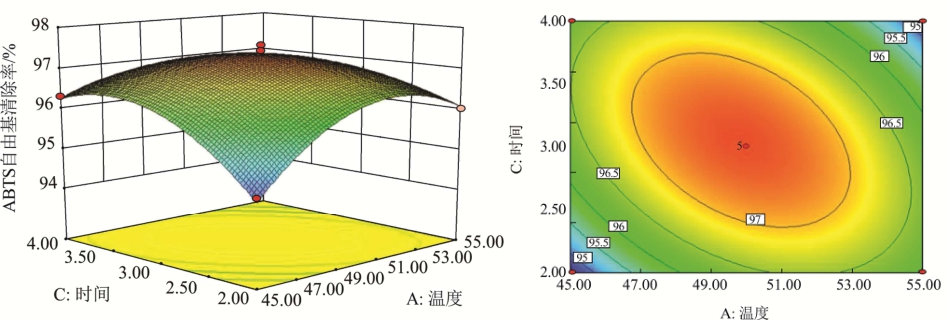
图8 时间和温度对ABTS自由基清除率影响的响应面及等高线图
Fig.8 Three-dimensional response and contour plots showing the interactive effects of time and temperature on ABTS radical scavenging rate
从方差分析结果可知,模型p值小于0.0001,表示回归模型高度显著。失拟项p值为0.1510,不显著,表示回归模型预测值与实测值的拟合水平较好,模型合适。回归系数R2为0.9744,说明该模型相关度好[20]。R2Adj值为0.9414,说明有94.14%的响应值变化可以用模型来解释,试验误差较小,模型具有良好的拟合度,可以对试验结果进行准确分析和预测[16]。在回归方程中,B2、C2和AC达到极显著水平,A2、AB和BC达到显著水平。从一次项系数的对比,响应值受到不同因素影响的顺序依次是:pH、时间、温度。通过响应面方差分析得到酶解制备珍珠贝抗氧化肽工艺的二次多项回归方程为:Y=97.35-0.027A+0.16B+0.064C-0.29AB-0.74AC-0.39BC-1.07A2-0.085B2-0.86C2。模型预测最优酶解条件为温度49.82 ℃,pH 7.27,时间3.03 h,料液比1:1,酶底比0.4%,在此条件下ABTS清除率为97.36%。
温度、时间和pH的交互对珍珠贝肉抗氧化肽抗氧化能力的影响如图7、8、9所示。每个等高线图上都有一个椭圆,说明最佳点恰好在实验范围内[21]。等高线形状越接近椭圆形,说明两因素之间的交互作用越强。从图7、8、9中可以看出温度和时间的交互作用最强,pH和时间的交互作用次之,温度和pH的交互作用最弱。
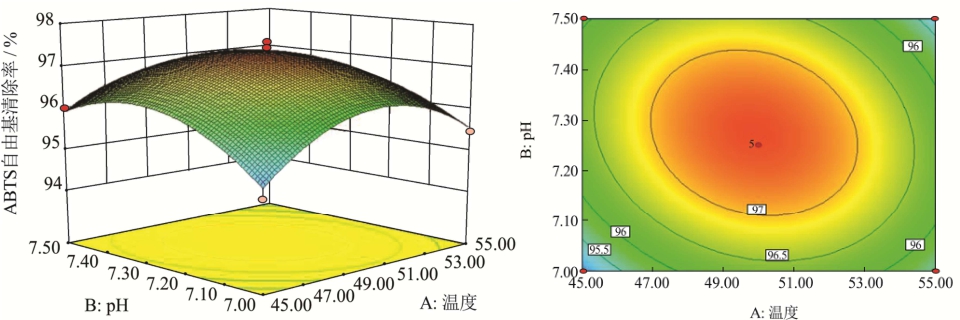
图7 pH和温度对ABTS自由基清除率影响的响应面及等高线图
Fig.7 Three-dimensional response and contour plots showing the interactive effects of pH and temperature on ABTS radical scavenging rate
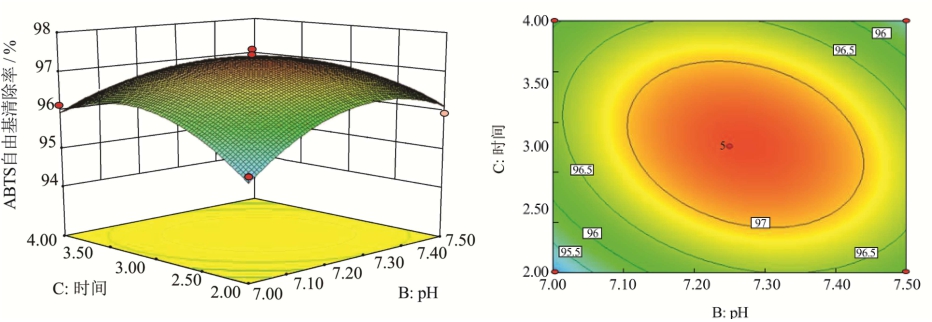
图9 时间和pH对ABTS自由基清除率影响的响应面及等高线图
Fig.9 Three-dimensional response and contour plots showing the interactive effects of time and pH on ABTS radical scavenging rate
2.3.2 模型验证
结合实际操作,实验室验证酶解条件修正为温度50.00 ℃,pH 7.25,时间3.00 h,料液比1:1,酶底比0.4%,在此条件下ABTS清除率为98.48%,与预测值接近,说明模型优化结果较准确。
2.4 氨基酸组成分析
珍珠贝肉抗氧化肽的氨基酸组成如表3所示,氨基酸种类丰富,必需氨基酸占33.36%,营养价值较高。疏水性氨基酸是肽清除自由基能力关键因素[17],如脯氨酸具有吡咯环可以作为氢供体,苯丙氨酸有助于清除自由基。酸性氨基酸带负电荷,具有自由基猝灭活性。碱性氨基酸具有螯合金属离子的能力[22],组氨酸含有咪唑环可以酶催化反应中作为质子供体,赖氨酸能帮助形成疏水微环境,芳香族氨基酸中苯环的存在可以显著提高肽的抗氧化能力[17]。在珍珠贝肉抗氧化肽中,有助提高抗氧化能力的氨基酸包括疏水性氨基酸(41.57%)、酸性氨基酸(25.32%)、碱性氨基酸(17.76%)和芳香族氨基酸(6.88%)的总占比为88.03%。同时,精氨酸、苯丙氨酸、缬氨酸、丙氨酸、亮氨酸、半胱氨酸、丝氨酸和苏氨酸等已被报道有助于抑制酪氨酸酶的氨基酸含量高[7],占比39.69%。从物质基础层面表明珍珠贝肉抗氧化肽具有较好清除自由基能力,也可能具有抑制酪氨酸酶催化氧化反应的能力。
表3 氨基酸组成分析
Table 3 Analysis of amino acids contents
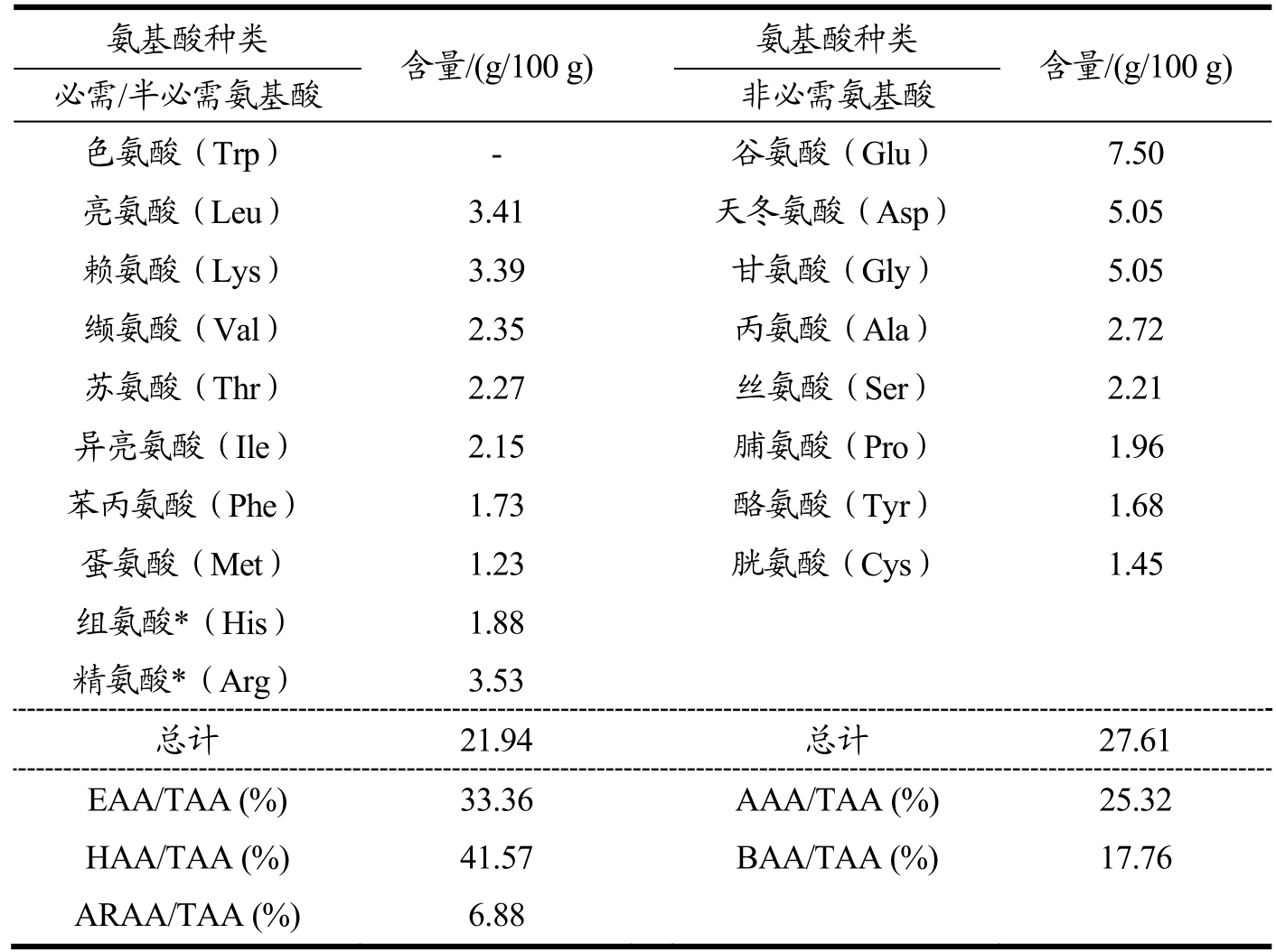
注:EAA:必需氨基酸;*:半必需氨基酸;TAA:总氨基酸;AAA:酸性氨基酸(Asp、Glu);BAA:碱性氨基酸(His、Arg、Lys);HAA:疏水性氨基酸(Ala、Phe、Ile、Leu、Met、Pro、Val、Gly);ARAA:芳香族氨基酸(Trp、Tyr、Phe)。
氨基酸种类 含量/(g/100 g) 氨基酸种类 含量/(g/100 g)必需/半必需氨基酸 非必需氨基酸色氨酸(Trp) - 谷氨酸(Glu) 7.50亮氨酸(Leu) 3.41 天冬氨酸(Asp) 5.05赖氨酸(Lys) 3.39 甘氨酸(Gly) 5.05缬氨酸(Val) 2.35 丙氨酸(Ala) 2.72苏氨酸(Thr) 2.27 丝氨酸(Ser) 2.21异亮氨酸(Ile) 2.15 脯氨酸(Pro) 1.96苯丙氨酸(Phe) 1.73 酪氨酸(Tyr) 1.68蛋氨酸(Met) 1.23 胱氨酸(Cys) 1.45组氨酸*(His) 1.88精氨酸*(Arg) 3.53总计 21.94 总计 27.61 EAA/TAA (%) 33.36 AAA/TAA (%) 25.32 HAA/TAA (%) 41.57 BAA/TAA (%) 17.76 ARAA/TAA (%) 6.88
2.5 抗氧化活性的测定
氧化体系十分复杂,相关的体外抗氧化评价方法也多种多样,因此本研究从清除ABTS自由基、氧自由基吸收能力和螯合金属离子三个方面综合评价最优酶解物冻干粉的抗氧化能力。
2.5.1 ABTS自由基清除能力测定
ABTS自由基清除实验可用于样品的总抗氧化能力的测定,其机制是通过样品提供一个氢原子或一个电子清除ABTS自由基[23]。如图10所示,随浓度增大,最优酶解物的ABTS自由基清除率提高,呈现良好量效关系,在2.5 mg/mL时,清除率达到88.77%。相关报道中发酵法制备马氏珠母贝多肽的ABTS自由基的IC50值为1.78 mg/mL[24],而本研究所得珍珠贝肉最优酶解物的IC50值为0.57 mg/mL,说明酶解法制备多肽ABTS自由基清除效果很好。据报道Cys、Tyr、Arg、His、Lys、Met、Phe和Val具有ABTS清除活性[25],而在最优酶解物中上述氨基酸占总氨基酸比例高达34.79%,因此可能有助于更好地清除ABTS自由基。
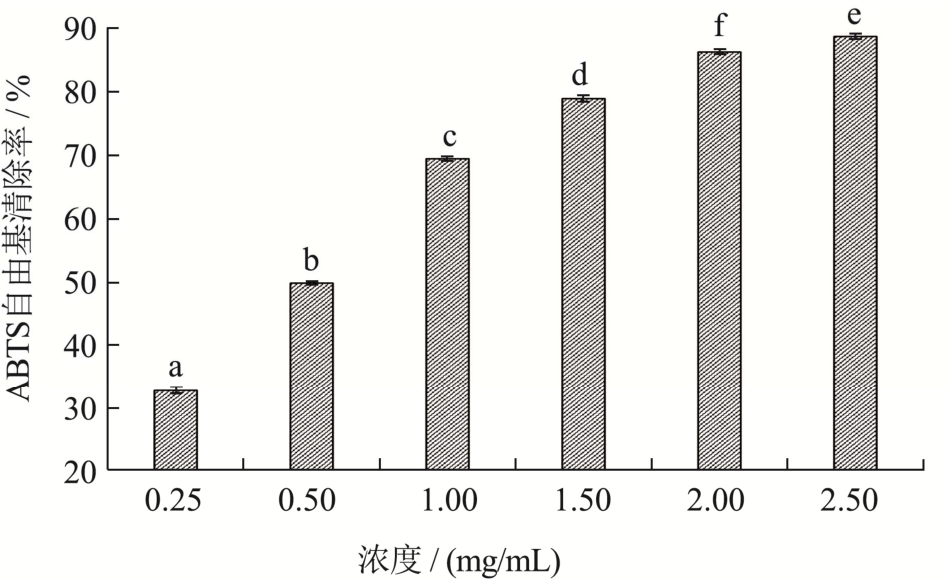
图10 最优酶解物的ABTS自由基清除率
Fig.10 ABTS radical scavenging rate of optimal enzymatic hydrolysate
2.5.2 氧自由基吸收能力(ORAC)
氧自由基吸收能力(ORAC)的测定机制是样品提供质子以清除AAPH产生的过氧自由基(ROO·)和羟基自由基(OH·)[23],ORAC值越大表明清除效果越好。在相同Net AUC下,不同浓度珍珠贝肉最优酶解物对应的Trolox浓度如图11所示。珍珠贝肉最优酶解物浓度150~400 μg/mL,相同Net AUC对应的Trolox的浓度93.16~195.61 μmol/L。相关报道中燕麦麸水解蛋白和牡蛎水解物的ORAC值分别为131~418 μmol TE/g蛋白和450~606 μmol TE/g蛋白[23,26],本研究所得珍珠贝肉最优酶解物的ORAC值为601.38 μmol TE/g冻干粉,与牡蛎水解物相近,高于燕麦麸水解物,说明珍珠贝肉最优酶解物具有良好的氧自由基吸收能力。从氨基酸角度分析,Cys、Trp、Tyr、His、Met、Arg、Leu、Lys和Phe具有氧自由基吸收能力[25],而在珍珠贝肉最优酶解物中上述氨基酸占总氨基酸比例高达33.84%,有助于吸收自由基,具有抗氧化活性的物质基础。
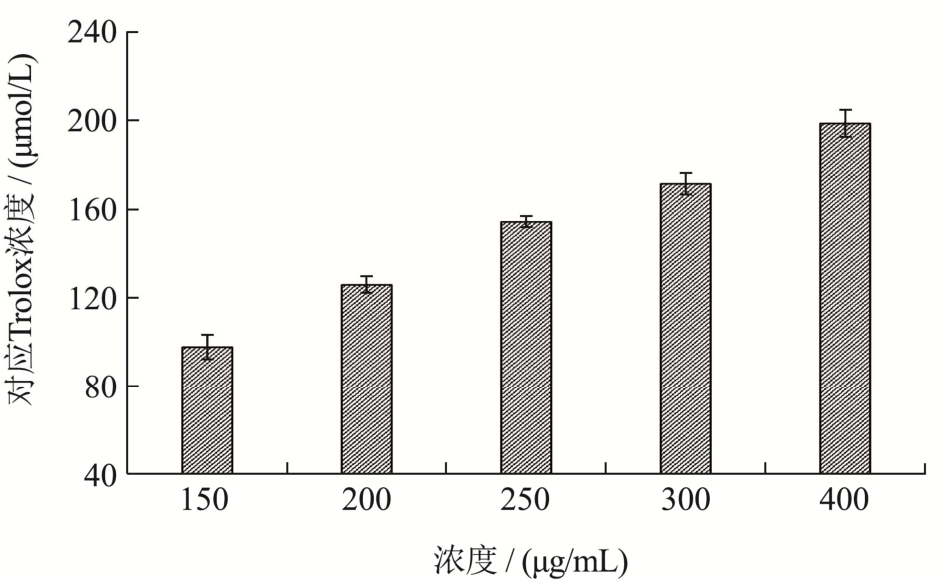
图11 最优酶解物对应的Trolox浓度
Fig.11 Trolox concentration corresponding to the optimal enzymatic hydrolysate
2.5.3 Fe2+螯合能力测定
Fe2+是促氧化剂,可以使过氧化氢和有机氢过氧化物生成羟基自由基[23],可能导致氧化诱导的代谢紊乱[22],因此样品具有螯合Fe2+能力可反应样品具有的抗氧化能力。如图12所示,在1.00~2.50 mg/mL范围内随浓度增大,珍珠贝肉最优酶解物的Fe2+螯合能力从9.81%提高到16.61%,提高效果较弱,而在2.50~10.00 mg/mL之间,Fe2+螯合能力从16.61%提高到71.42%,提高效果明显,其IC50值为6.89 mg/mL。张德举[25]研究发现只有Cys具有直接的Fe2+螯合能力,而Leu、Phe、Trp、Tyr和Val等氨基酸具有协同作用。低浓度时螯合能力较弱,高浓度时具有良好螯合Fe2+的能力可能是因为珍珠贝肉最优酶解物中Cys占比仅2.93%,可能因此低浓度时Cys含量过低,螯合作用不显著,高浓度下Cys含量提高,并在其他氨基酸协同作用下表现出显著的螯合活性。
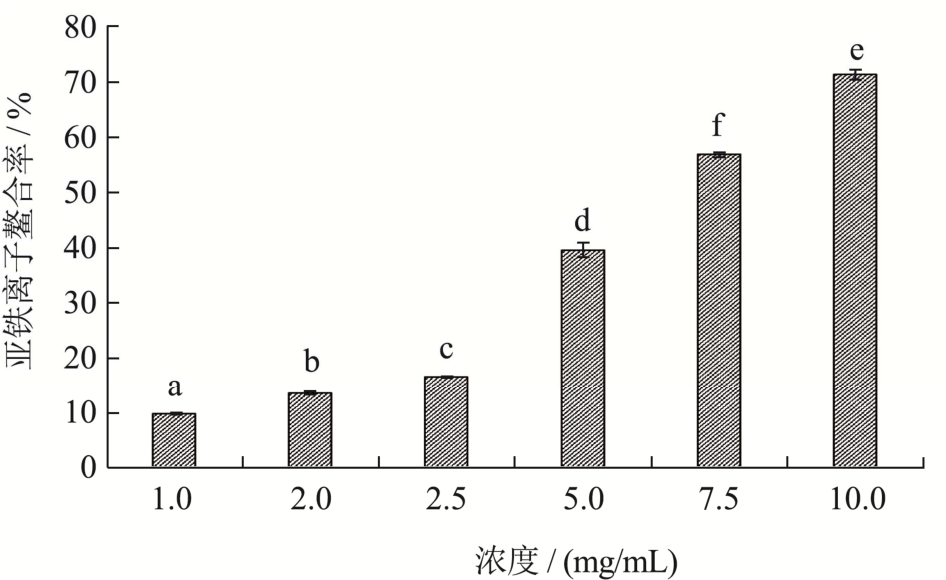
图12 最优酶解物的亚铁离子螯合能力
Fig.12 Iron-chelating activity of optimal enzymatic hydrolysate
2.6 酪氨酸酶活性抑制的测定
黑色素的生物合成是通过一系列复杂的氧化反应和酶反应进行的。酪氨酸酶是一种多酚氧化酶,酶活性包括单酚酶活性和双酚酶活性[27],参与黑色素生成的两个速率限制反应[28],分别是将单酚底物L-酪氨酸氧化成为L-多巴和将二酚底物L-多巴氧化成L-多巴醌,进而生成黑色素。通过测定珍珠贝肉最优酶解物对酪氨酸酶催化氧化L-酪氨酸和L-多巴反应的抑制效果,可以间接反映样品是否具有抑制黑色素生成的能力。
2.6.1 酪氨酸单酚酶活性抑制的测定
如图13所示,随浓度增大,珍珠贝肉最优酶解物的酪氨酸单酚酶活性抑制率提高,浓度在0.25~2.50 mg/mL之间,抑制率为49.50%~67.33%,呈现良好的量效关系。相关报道中金枪鱼粉和紫娟茶酚类提取物的单酚酶抑制IC50值分别为3.44 mg/mL和3.52 mg/mL[29,30],而珍珠贝肉最优酶解物的IC50值为0.37 mg/mL,显著低于鱼粉酶解物和部分酚类,说明其具有很强的酪氨酸单酚酶抑制能力。
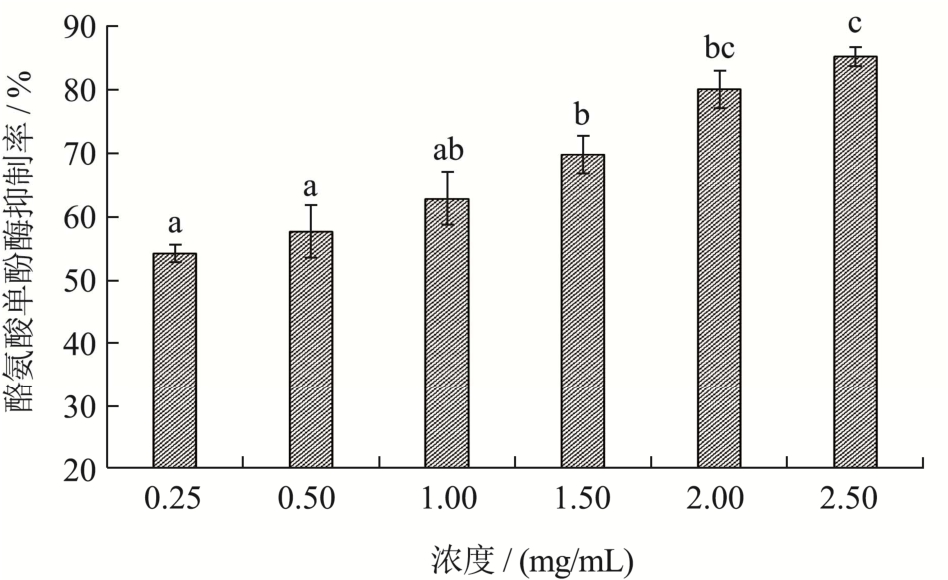
图13 最优酶解物的酪氨酸单酚酶抑制率
Fig.13 Tyrosine monophenolase inhibition rate of optimal enzymatic hydrolysate
2.6.2 酪氨酸二酚酶活性抑制的测定
如图14所示,随浓度增大,珍珠贝肉最优酶解物的酪氨酸二酚酶抑制率提高,浓度在2.50~15.0 mg/mL之间,抑制率从9.79%提高到44.93%,抑制率提高明显,浓度在15.0~25.0 mg/mL之间,抑制率从44.93%提高到54.03%,可能是随着浓度提高,对酶的抑制反应趋于饱和。相关报道中,鱼胶原肽(20 mg/mL)的酪氨酸二酚酶抑制率为32.55%[31],珍珠贝肉最优酶解物的IC50值为20.27 mg/mL,说明其具有良好的酪氨酸二酚酶抑制能力。
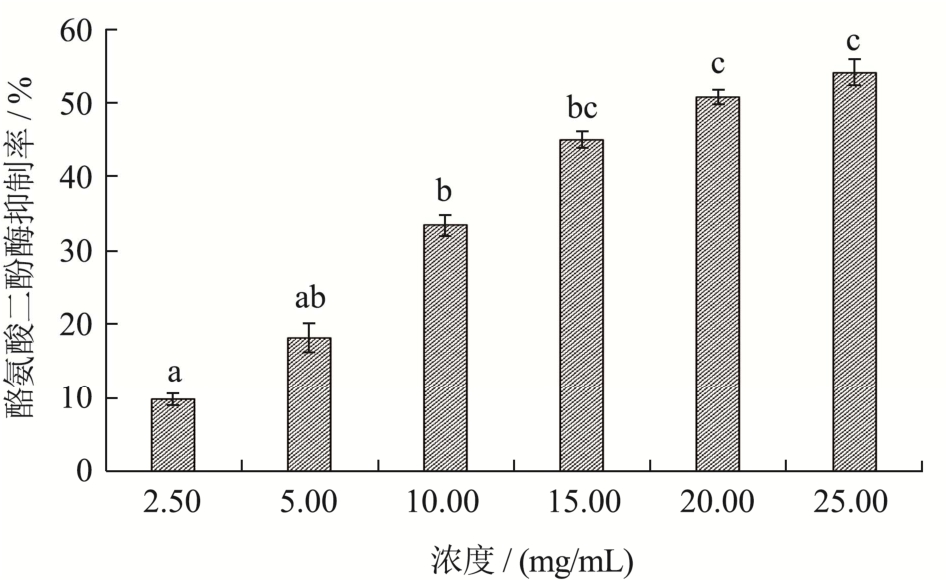
图14 最优酶解物的酪氨酸二酚酶抑制率
Fig.14 Tyrosine diphenolase inhibition rate of optimal enzymatic hydrolysate
3 结论
3.1 本研究在最优酶筛选的基础上,分析料液比、酶底比、pH、温度和时间等单因素对ABTS清除率的影响,并进行响应面优化最终确定了珍珠贝肉的最优酶解工艺为温度50 ℃,pH 7.25,时间3 h,料液比1:1,酶底比0.4%,最优酶解物的ABTS清除率为98.48%,具有良好的抗氧化活性,为大量酶解制备珍珠贝肉抗氧化肽提供工艺参考。
3.2 通过氨基酸分析,珍珠贝肉最优酶解物含有17种氨基酸,营养价值高,其中有助于提高抗氧化活性的氨基酸占比高达88.03%,有助于抑制酪氨酸酶活性的氨基酸占比39.69%,表明最优酶解物在物质层面上具备开发抗氧化剂和美白剂的潜力。
3.3 通过对珍珠贝肉最优酶解物冻干粉的体外抗氧化活性和酪氨酸酶抑制活性进行综合评价,结果表明本研究所得的抗氧化肽具有很强的ABTS自由基清除能力(IC50 0.57 mg/mL)、氧自由基吸收能力(601.38 μmol TE/g冻干粉)和较好的Fe2+螯合能力(IC50 6.89 mg/mL),并具有很好的酪氨酸单酚酶抑制能力(IC50 0.37 mg/mL)和酪氨酸二酚酶抑制能力(IC50 20.27 mg/mL),具备体外抗氧化和抑制酪氨酸酶的双重能力。本研究将对其进行分离纯化和深入研究,旨在利用珍珠贝肉开发为具有双重功效的新型抗氧化剂和美白剂,实现社会效益和经济效益。
[1] Ahn C, Kim J, Je J. Purification and antioxidant properties of octapeptide from salmon byproduct protein hydrolysate by gastrointestinal digestion [J]. Food Chemistry, 2014, 147:78-83
[2] Fai-Chu W, Jianbo X, Shaoyun W, et al. Advances on the antioxidant peptides from edible plant sources [J]. Trends in Food Science & Technology, 2020, 99: 44-57
[3] 金宇婷,支德福,郭永泰,等.酚类衍生物的美白和抗氧化活性[J].应用化学,2019,36(11):1257-1265
JIN Yuting, ZHI Defu, GUO Yongtai, et al. Whitening and antioxidant activities of phenolic derivatives [J]. Chinese Journal of Applied Chemistry, 2019, 36(11): 1257-1265
[4] 陈佳欣.核桃粕酪氨酸酶抑制肽制备、结构鉴定及其活性研究[D].北京:北京林业大学,2019
CHEN Jiaxin. Preparation, identification and activities of tyrosinase inhibitory peptide from walnut residue [D]. Beijing:Beijing Forestry University, 2019
[5] Castro-Jácome T P, L Eaq, Lugo-Cervantes E, et al.Anti-elastase, anti-tyrosinase and antioxidant properties of a peptide fraction obtained from sorghum (Sorghum bicolor L.Moench) grain [J]. International Food Research Journal, 2019,26(6): 1813-1822
[6] Shen Z, Wang Y, Guo Z, et al. Novel tyrosinase inhibitory peptide with free radical scavenging ability [J]. J Enzyme Inhib Med Chem, 2019, 34(1): 1633-1640
[7] Prakot, Chaitanawisuti, Sangtanoo, et al. Inhibitory activities of protein hydrolysates from spotted babylon snails on tyrosinase and melanogenesis [J]. Journal of Aquatic Food Product Technology, 2018, 27(7): 811-829
[8] 廖杰.珍珠粉水溶性成分的分离纯化及其活性研究[D].杭州:浙江大学,2019
LIAO Jie. Separation and purification of soluble components from pearl powder and its bioactivities [D]. Hangzhou:Zhejiang University, 2019
[9] Anna F, Dae-Ok K, Sang-Jin C, et al. Comparison of ABTS/DPPH assays to measure antioxidant capacity in popular antioxidant-rich US foods [J]. Journal of Food Composition and Analysis, 2011, 24(7): 1043-1048
[10] Nimalaratne C, Bandara N, Wu J. Purification and characterization of antioxidant peptides from enzymatically hydrolyzed chicken egg white [J]. Food Chemistry, 2015, 188:467-472
[11] 张美玲,赵新淮.大豆蛋白水解物的酶法修饰及其亚铁和钙离子的螯合能力[J].食品与发酵工业,2012,38(12):26-30
ZHANG Meiling, ZHAO Xinhuai. Enzymatic modification of soybean protein hydrolysates by plastein reaction and its influence on chelating activities for ferrous and calcium ions[J]. Food and Fermentation Industries, 2012, 38(12): 26-30
[12] 耿广青.白僵菌提取物对酪氨酸酶活性抑制作用的研究[D].安徽:安徽农业大学,2011
GENG Guangqing. Studies on inhibitive activity of Beauveria spp. extracts against tyrosinase [D]. Anhui: Anhui Agriculture University, 2011
[13] 段宙位,谢辉,窦志浩,等.石斑鱼肉肽的酶法制备工艺及其抗氧化性[J].食品科学,2015,36(5):142-147
DUAN Zhouwei, XIE Hui, DOU Zhihao, et al. Enzymatic preparation and antioxidant activities of bioactive peptides from Epinephelus meat [J]. Food Science, 2015, 36(5):142-147
[14] 范三红,胡雅喃,何亚.响应面法优化菊芋渣酶解制备抗氧化肽工艺[J].食品科学,2015,36(8):49-53
FAN Sanhong, HU Yanan, HE Ya. Optimization of enzymatic hydrolysis of Jerusalem artichoke residue for preparing antioxidant peptides by response surface methodology [J].Food Science, 2015, 36(8): 49-53
[15] 李慧凝,张明振,孟少珂,等.响应面法优化鲣鱼肽的复合酶酶解工艺及氨基酸评价[J].食品工业科技,2021,42(4):121-127
LI Huining, ZHANG Mingzhen, MENG Shaoke, et al.Optimization process condition using response surface for bi-enzymatic of Katsuwonus pelamis peptides and amino acid evaluation [J]. Science and Technology of Food Industry, 2021,42(4): 121-127
[16] 田旭静,段鹏慧,范三红,等.响应面法优化酶解藜麦糠蛋白制备抗氧化肽工艺[J].食品科学,2018,39(10):158-164
TIAN Xujing, DUAN Penghui, FAN Sanhong, et al. Response surface methodology for optimization of hydrolysis conditions for preparing antioxidant peptides from quinoa bran protein [J].Food Science, 2018, 39(10): 158-164
[17] Tang-Bin Z, Tai-Ping H, Hua-Bin L, et al. The Structure-activity relationship of the antioxidant peptides from natural proteins [J]. Molecules, 2016, 21(1): 72
[18] 范三红,毛强强,王亚云,等.响应面法优化制备南瓜籽抗氧化肽的工艺[J].食品科学,2012,33(11):241-246
FAN Sanhong, MAO Qiangqiang, WANG Yayun, et al.Optimization of preparation process for antioxidant peptides from pumpkin seed by response surface methodology [J].Food Science, 2012, 33(11): 241-246
[19] 赵谋明,肖如武,崔春,等.超滤对马氏珍珠贝肉蛋白酶解液特性的影响[J].华南理工大学学报(自然科学版),2009,37(10):124-128
ZHAO Mouming, XIAO Ruwu, CUI Chun, et al. Effects of ultrafiltration on characteristics of enzymatic hydrolysates of Pinctada martensii protein [J]. Journal of South China University of Technology (Natural Science Edition), 2009,37(10): 124-128
[20] 何定芬,郑霖波,周英杰,等.响应面法优化舟山小带鱼蛋白抗菌肽制备工艺及其抑菌效果分析[J].食品研究与开发,2020,41(10):141-147
HE Dingfen, ZHENG Linbo, ZHOU Yingjie, et al.Optimization of preparation process and antibacterial effect of Zhoushan small hairtail protein antibacterial peptide by response surface methodology [J]. Food Research and Development, 2020, 41(10): 141-147
[21] Yongliang Z, Liping S. Preparation of reactive oxygen scavenging peptides from tilapia (Oreochromis niloticus) skin gelatin: optimization using response surface methodology [J].Journal of Food Science, 2011, 76(3): 483-489
[22] Aderinola T A, Fagbemi T N, Enujiugha V N, et al. Amino acid composition and antioxidant properties of Moringa oleifera seed protein isolate and enzymatic hydrolysates [J].Heliyon, 2018, 4(10): e00877
[23] Esfandi R, Willmore W G, Tsopmo A. Peptidomic analysis of hydrolyzed oat bran proteins, and their in vitro antioxidant and metal chelating properties [J]. Food Chemistry, 2019, 279:49-57
[24] 江敏,胡小军,王标诗,等.发酵法制备马氏珠母贝抗氧化多肽工艺及清除自由基的研究[J].食品与发酵科技,2017,53(4):32-38
JIANG Min, HU Xiaojun, WANG Biaoshi, et al. Fermentation technology and free radical scavenging of Pinctada martensii antioxidant polypeptides [J]. Food and Fermentation Sciences& Technology, 2017, 53(4): 32-38
[25] 张德举.蛋清源小肽的结构与协同抗氧化活性关系研究[D].吉林:吉林大学,2017
ZHANG Deju. Study on the relationship between the structure of small peptide and its synergistic antioxidant activity [D].Jilin: Jilin University, 2017
[26] 马勇,高丽辉,冯晓文,等.模拟胃肠消化对牡蛎低聚肽抗氧化活性的影响[J].食品与机械,2020,36(11):133-137
MA Yong, GAO Lihui, FENG Xiaowen, et al. Effect of simulated gastrointestinal digestion in vitro on the antioxidant activity of oyster oligopeptides [J]. Food & Machinery, 2020,36(11): 133-137
[27] Yu Q, Fan L, Duan Z. Five individual polyphenols as tyrosinase inhibitors: Inhibitory activity, synergistic effect,action mechanism, and molecular docking [J]. Food Chemistry,2019, 297: 124910
[28] Zhuang Y, Sun L, Zhao X, et al. Antioxidant and melanogenesis-inhibitory activities of collagen peptide from jellyfish (Rhopilema esculentum) [J]. Journal of the Science of Food and Agriculture, 2009, 89(10): 1722-1727
[29] 吕乐,丁慧璞,胡伟,等.金枪鱼粉的酶解工艺及其酶解产物功能活性研究[J].食品工业科技,2020,41(3):168-174
LYU Le, DING Huipu, HU Wei, et al. Study on enzymatic hydrolysis of tuna powder and functional activity of enzymatic hydrolysis products [J]. Science and Technology of Food Industry, 2020, 41(3): 168-174
[30] 沈晓佳,赵黎明,周家春,等.紫娟茶提取物对酪氨酸酶活性的抑制作用[J].食品工业科技,2012,33(24):75-80
SHEN Xiaojia, ZHAO Liming, ZHOU Jiachun, et al.Inhibitory effect of extract from Zijuan tea on tyrosinase activity [J]. Science and Technology of Food Industry, 2012,33(24): 75-80
[31] 陈龙,陈栋梁,杨国燕,等.鱼胶原肽抑制酪氨酸酶活性能力的比较研究[J].中国美容医学,2008,10:1512-1514
CHEN Long, CHEN Dongliang, YANG Guoyan, et al.Contrastive study on activity of tyrosinase inhibition of fish collagen peptide [J]. Chinese Journal of Aesthetic Medicine,2008, 10: 1512-1514