黄曲霉毒素主要是由黄曲霉、寄生曲霉和黑曲霉及亚种等在合适的温度和湿度条件下产生的次级代谢产物,对人畜有强烈的致病性、致癌性,严重危害人体健康,在粮油、饲料以及副产品中广泛存在[1-3]。黄曲霉毒素性质稳定、毒性高、易致癌,已被视为世界范围内重要的食品污染物[4]。黄曲霉毒素有多种亚型结构[5],其中黄曲霉毒素B1(aflatoxin B1,AFB1)被认为是已知化学致癌物质中最强的致癌物质,常见于花生、玉米、小麦等粮食及其制品中[4,6,7]。因此,准确检测食品中 AFB1含量对保障食品安全,维护人类健康至关重要。传统的仪器检测方法,如高效液相色谱、薄层色谱和液相色谱-质谱联用[8-12],具有检测结果准确、灵敏度高、重复性好等优点,但这些方法耗时长且难以实现快速灵敏的检测[13,14]。近年来食品安全事件屡见不鲜,消费者对食品安全关注越来越关注,市场对快速检测技术需求也日益旺盛。基于免疫法开发出的快速检测方法具有高度的选择性和灵敏度,已成为极具竞争力的检测技术之一。然而这些快速检测方法在使用过程中往往受到高成本和稳定性差等缺点的限制[5]。其次,基于免疫法的信号标记物不稳定,检测结果易受环境因素影响而导致假阳性。为了克服这些缺陷,急需寻找能稳定信号物的新方法。因此,开发新型材料来保持信号标记物生物催化活性,使信号标记物能够在复杂多变的环境下保持着优异的稳定性是当前研究的重点和难点。
金属-有机框架(metal-organic frameworks,MOFs)材料是一类结晶无机-有机杂化材料,具有多种独特的性质[15-17]。例如,其开放式结构和多峰孔隙率允许有效的传质,在温和条件下合成,具有良好生物相容性、化学和热稳定性。这些特性引起了研究者们极大兴趣,采用MOFs作为固定基质来解决酶稳定性和降低检测成本[18-20]。研究发现,利用仿生矿化方法将酶封装到MOFs中,复合物在极端环境下能有效保持酶的生物催化活性,同时能扩展酶催化环境中pH和温度的应用范围[21,22]。目前已经开发出多种MOFs作为酶载体,如沸石咪唑酯骨架结构材料-8(zeolitic imidazolate framework-8,ZIF-8)[23]、HKUST-1[24]、MIL-101(Cr)[15]、HP-PCN-224(Fe)[25]等。最近,以ZIF-8作为固定化载体,利用仿生矿化方法在酶表面生成的保护涂层,以提高酶的稳定性和可重复性是研究热点[26,27]。在此启发下,利用仿生矿化方法在酶表面生成保护涂层作为酶联免疫法的信号标记物,以增加酶抗极端环境干扰能力,提高检测信号稳定性是可行的尝试。
本研究中,利用仿生矿化方法在ZIF-8包埋HRP(HRP@ZIF-8)作为信号标记物,在HRP表面生成的ZIF-8保护涂层,结合酶联免疫技术(enzyme-linked immunosorbent assay,ELISA)建立比色法对AFB1灵敏检测。ZIF-8的高表面积和有序的孔隙率可以增强HRP负载量以获得较强的比色信号。为了构建良好的比色信号探针,在 HRP@ZIF-8表面修饰多巴胺(dopamine,DA)形成聚多巴胺(polydopamine,PDA)层。金属-聚多巴胺框架同时具有MOFs和PDA的优点,表面富含芳环的PDA可以通过疏水-亲水相互作用或π-π堆积来修饰生物分子。以ZIF-8作为模板制备了具有丰富π电子的HRP@ZIF-8/PDA复合物与免疫球蛋白G(immunoglobulin G,IgG)偶联,合成信号标记物 HRP@ZIF-8/PDA/IgG。利用该复合物催化3,3’5,5’-四甲基联苯胺(3,3’5,5’-tetramethylbenzidine,TMB)显色来构建间接竞争免疫比色法检测 AFB1,基于MOF-ELISA检测法中HRP@ZIF-8/PDA/IgG增加了酶抗极端环境干扰的能力,提高了检测信号的稳定性。该系统建立了一种通用、快速、灵敏的比色法,实现了AFB1的肉眼快速检测。
1 材料与方法
1.1 材料和试剂
Zn(NO3)2·6H2O、2-甲基咪唑(2-methylimidazole,2-MI)、即用型TMB显色液、HRP、96孔微孔板(高结合力,白色)购自武汉飞扬生物科技有限公司;多巴胺盐酸盐、三(羟甲基)氨基甲烷(Tris)等化学试剂均为分析纯,购买于天津化学试剂公司。脱氧雪腐烯醇(deoxynivalenol,DON)、AFB1、AFB2、AFG1、AFG2、牛血清白蛋白(bovine serum albumin,BSA),小鼠单克隆抗AFB1抗体(Ab1,10.0 mg/mL,1 mL),AFB1偶联BSA(AFB1-BSA,5.0 mg/mL),兔抗鼠IgG购自山东绿都生物科技有限公司(中国山东);N-羟基-磺基琥珀酰亚胺(NHS)/N-(3-二甲基氨基丙基)-N′-乙基碳二亚胺(EDC)来自Sigma-Aldrich公司(中国上海)。Milli-pore超纯水(18.2 MΩ/cm,美国Millipore公司)用作溶剂。除非特别说明,所有实验均在室温下进行。
1.2 仪器
EnVision多功能酶标仪,新加坡Perkin Elmer公司;JEM-2010透射电子显微镜(transmission electron microscope,TEM),日本电子株式会社;RigakuD/max-2400 X 射线衍射(X-ray diffraction,XRD),日本岛津公司;TGA 4000热重分析仪(thermal gravimetric analyzer,TGA),美国林赛斯公司;DXR 2xi显微拉曼成像光谱仪,英国雷尼绍公司;3H24RI台式智能高速冷冻离心机,德国贺利氏公司。
1.3 HRP@ZIF-8/PDA/IgG生物复合材料的合成
2 mol/L锌离子、1 mg/mL HRP和0.5 mol/L 2-MI在离心管中混合,总体积为720 μL,混合液振荡后在室温下保持30 min。悬浮液在4 ℃下11000 r/min离心15 min,沉淀用去离子水洗。取500 μL HRP@ZIF-8溶液与1 mL 25 mmol/L Tris-HCl缓冲溶液混合,加入500 μL 0.1 mol/L DA溶液,剧烈搅拌5 min后,在室温下轻微振摇2 h,形成的悬浮液在4 ℃下11000 r/min离心15 min。沉淀用去离子水清洗后分散在1 mL 10 mmol/L pH 7.4 PBS中。将EDC/NHS活化后的20 μL 0.5 mg/mL IgG添加到悬浮液中,在室温下孵育 30 min,置于4 ℃冰箱中连续振摇过夜。离心收集沉淀,用10 mmol/L pH 7.4 PBS洗涤3次,去除未结合的IgG。将获得的HRP@ZIF-8/PDA/IgG复合物重新分散在1.0 mL 10 mmol/L pH 7.4 PBS中,置于冰箱中备用。
1.4 酶浓度和封装效率的测定
将300 µL 2 mol/L 锌离子、300 µL 0.5 mol/L 2-MI和120 µL不同浓度HRP在离心管中混合,混合液振荡后在室温下保持 30 min。悬浮液在 4 ℃下 11000 r/min离心15 min,取上清液检测。固定化后上清液的酶浓度根据HRP标准曲线计算来确定。包封率定义为包埋在HRP@ZIF-8复合材料中的HRP含量与HRP初始量的比值,其计算公式如下:
式中:
C1——HRP@ZIF-8复合材料中的上清液HRP浓度;
C2——最初的HRP浓度,mg/mL。
1.5 HRP@ZIF-8/PDA复合材料稳定性检测
热稳定性:分别将 HRP、HRP@ZIF-8和HRP@ZIF-8/PDA复合材料置于不同温度下(30~100 ℃)孵育 30 min,分别取出后用于评估复合材料在不同温度环境中的稳定性,通过测定不同温度处理后HRP的相对活性来表示。
pH稳定性:分别将 HRP、HRP@ZIF-8和HRP@ZIF-8/PDA复合材料置于pH 3 HCl溶液、pH 9 KOH溶液和不同pH的PBS缓冲液(pH 4~8.0)中1 h,分别取出后用于评估复合材料在不同pH环境中的稳定性,通过测定不同pH处理后HRP的相对活性来表示。
1.6 基于MOF-ELISA检测AFB1的原理
利用仿生矿化将HRP包裹在ZIF-8中,提高HRP在极端环境下的耐受能力和稳定性,随后将盐酸多巴胺修饰在HRP@ZIF-8复合物表面,为IgG提供结合位点,合成HRP@ZIF-8/PDA/IgG信号标记物。在检测AFB1时,采用间接竞争法检测,将AFB1-BSA固定在酶标板上,加入固定浓度的抗体,样品中 AFB1与酶标板上固定的 AFB1竞争结合抗体,清洗移除未结合抗体后加入 HRP@ZIF-8/PDA/IgG,加入即用型TMB显色液检测可见光谱信号,通过测定结合在酶标板上信号分子的量来确定AFB1浓度,具体如图1所示。
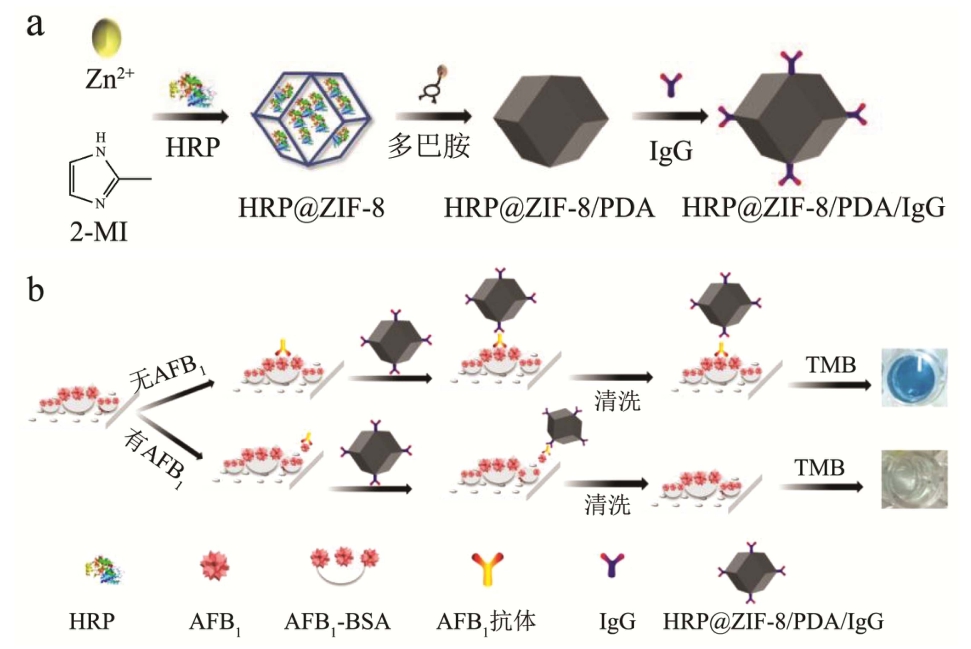
图1 基于MOFs的ELISA检测AFB1原理示意图
Fig.1 Schematic diagram of MOFs-based enzyme-linked immunoassay for AFB1 detection
1.7 AFB1比色法的建立和选择性检测
取96孔板,在每个孔内加入100 µL 0.1 mg/mL AFB1-BSA,37 ℃孵育 2 h后清洗,用含有 1.5%BSA-PBST在37 ℃封闭1 h后清洗。每孔中加入50 µL 0.1 mg/mL AFB1抗体溶液和50 µL标准AFB1/分析溶液,37 ℃孵育 1 h后清洗。每孔中加入 100 µL HRP@ZIF-8/PDA/IgG孵育1 h后清洗;加入50 µL即用型TMB溶液反应,随后加入50 µL 2 mol/L H2SO4终止反应,用酶标仪在450 nm测吸光度。为了评估所建立方法的选择性,在相同的实验条件下研究了其他常见真菌毒素(AFB2、AFG1、AFG2和DON)。每次测试至少3次平行实验。
1.8 加标回收实验
从湖北省武汉市当地超市收集大米样品和面粉样品储存在4 ℃冰箱中备用。样品提取步骤如下:取4.00 g经过研磨的大米与10 mL甲醇水溶液(80:20,V/V)混合,然后剧烈搅拌5 min。将混合物以5000 r/min离心20 min。离心后的100 μL上清液用500 μL pH 7.4 PBS稀释。将4.00 g面粉与10 mL甲醇水溶液混合,剧烈搅拌5 min。混合物离心后取5 μL上清液用PBS稀释。将不同浓度的AFB1加入稀释液中,作为AFB1的加标样品进行定性或定量检测。加标样品中 AFB1的浓度通过给出的比色法测定,然后计算回收率。每次测试至少3次平行实验。
1.9 数据处理
每个试验处理均作3个平行,试验中测定所得的数据使用Origin 2017软件进行分析及绘图。
2 结果与分析
2.1 HRP@ZIF-8/PDA复合材料的表征
采用 SEM、XRD、TGA来表征 ZIF-8和HRP@ZIF-8复合材料的晶体结构和形貌。图2a和2b为ZIF-8封装HRP前后的SEM图,可以看出其平均粒径分别为100±2.8 nm和100±3.2 nm。ZIF-8的形貌表现为典型的菱形十二面体几何结构,其形貌在HRP封装前后没有明显变化。从图 2c中可看出,HRP@ZIF-8/PDA较ZIF-8和HRP@ZIF-8的形貌并无明显变化,平均粒径为102±3.5 nm,表明HRP和PDA的修饰不会破坏 ZIF-8的结构。为了进一步验证HRP@ZIF-8/PDA合成,采用拉曼光谱表征。图2d显示了HRP@ZIF-8和HRP@ZIF-8/PDA纳米复合材料的拉曼光谱图。1500 cm-1的吸收峰主要源自于 C=C键振动,1550 cm-1~1580 cm-1主要是N=N键振动,2800 cm-1~3000 cm-1谱带主要源于C-H键振动,此外687 cm-1和1142 cm-1处呈现出强烈的吸收谱带,来自咪唑和 Zn-N[28],表明 ZIF-8 成功合成。1680 cm-1~1820 cm-1处的谱带,对应于酰胺I带,主要源自C=O拉伸模式,表明复合材料中存在酶。同时550 cm-1~800 cm-1处的谱带主要是C-Cl键的振动,1610 cm-1~1680 cm-1谱带的振动主要是C=N键的振动,表明PDA已成功修饰到 HRP@ZIF-8上。结果表明 HRP@ZIF-8和HRP@ZIF-8/PDA纳米复合材料成功合成。为了确认添加HRP和PDA后ZIF-8的结晶度有没有被破坏,采用 XRD衍射进行验证,HRP@ZIF-8和HRP@ZIF-8/PDA纳米复合材料的XRD图案(图2e)与模拟ZIF-8的图案相同,该结果表明HRP的封装和PDA的包封不影响ZIF-8的晶体结构。为了验证复合材料的热稳定性,在氦流下对合成样品进行热重分析(图2f)。ZIF-8表现出11.8%的逐渐失重,温度升高直至约200 ℃,对应于从纳米晶体表面去除空腔中的客体分子(主要为H2O)或未反应的物质(如2-MI)。在200~500 ℃范围内相对质量显示在长平台内稳定,表明 ZIF-8具有良好的热稳定性。HRP@ZIF-8和HRP@ZIF-8/PDA 的 TGA 曲线都显示出从150~400 ℃逐渐分解,这是由于复合材料中蛋白质的降解导致。HRP@ZIF-8/PDA在500~700 ℃逐渐分解主要是去除未反应的PDA。从紫外可见吸收光谱可以看出HRP@ZIF-8和HRP@ZIF-8/PDA催化TMB反应在450 nm处都出现了典型的特征峰(图2g),ZIF-8的多峰孔隙率允许有效传质,使显色底物 TMB/H2O2靠近包埋的HRP而发生反应。图2g插图也证明HRP已成功被包埋到ZIF-8中,使得TMB转变成蓝色,具有优异的催化能力,同时 HRP@ZIF-8/PDA较HRP@ZIF-8的吸收峰没有明显差异,这表明PDA不会影响 HRP@ZIF-8的催化能力。以上事实验证了HRP@ZIF-8和HRP@ZIF-8/PDA生物复合材料已成功合成,并具有良好的催化活性。

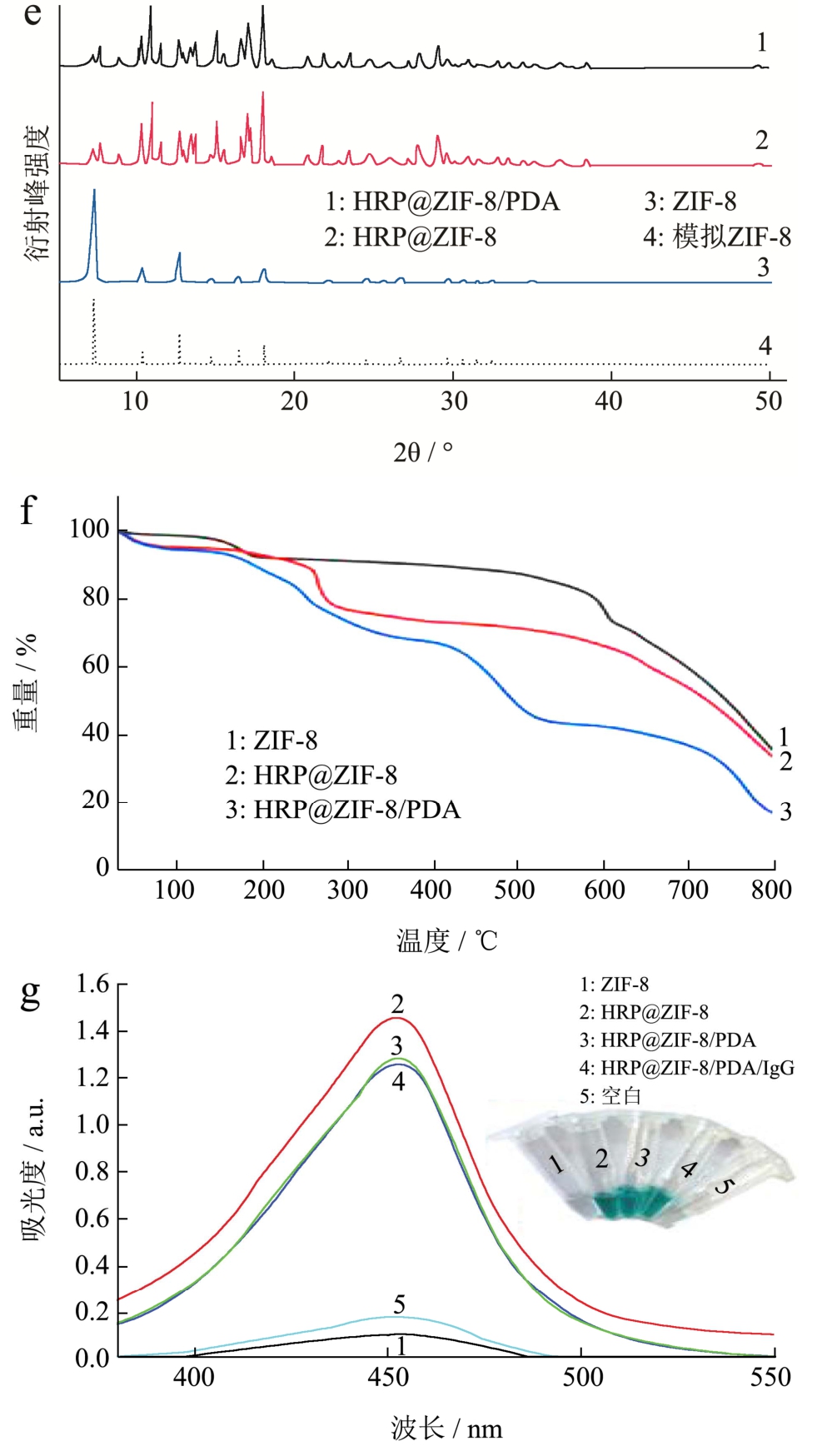
图2 ZIF-8(a)、HRP@ZIF-8(b)和HRP@ZIF-8/PDA(c)的SEM图;(d)拉曼光谱;(e)XRD衍射;(f)TGA分析图;(g)ZIF-8、HRP@ZIF-8、HRP@ZIF-8/PDA、HRP@ZIF-8/PDA/IgG和空白的紫外可见吸收光谱及其插图
Fig.2 SEM images of ZIF-8(a), HRP@ZIF-8(b) and HRP@ZIF-8/PDA(c); (d) Raman spectra of HRP, ZIF-8,HRP@ZIF-8, HRP@ZIF-8/PDA; (e) XRD diffraction; (f) TGA analysis chart; (g) UV-vis spectra and digital image (inset) of ZIF-8, HRP@ZIF-8, HRP@ZIF-8/PDA,HRP@ZIF-8/PDA/IgG and blank samples
2.2 最适HRP浓度和封装效率的确定
HRP@ZIF-8作为ELISA的信标物时,包埋HRP的浓度影响 AFB1检测的灵敏度和检测限。为了确定最佳的HRP浓度和封装效率,利用一定质量的ZIF-8包埋不同浓度的HRP,并与初始HRP浓度进行比较,以确定最佳酶浓度和封装效率。结果如图3显示,随着HRP浓度从0.2 mg/mL增加到1 mg/mL,HRP的包封效率从58.00%提高到98.60%。当HRP浓度持续增加,包封率却逐渐下降,这可能是由于高HRP浓度下成核位点数量的增加,导致HRP封装不足。因此,最终选择包埋HRP浓度为1 mg/mL。
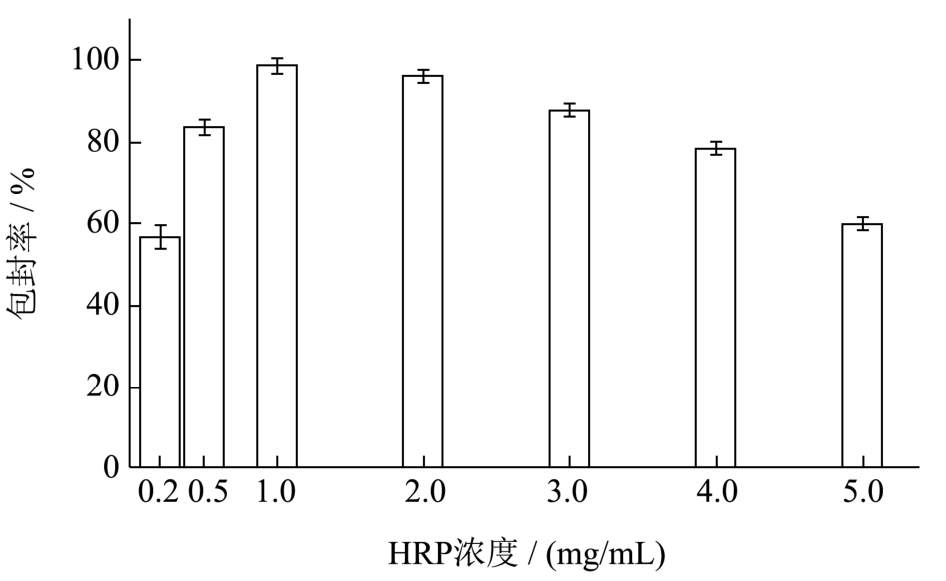
图3 HRP浓度的优化
Fig.3 Optimization of HRP concentration
2.3 HRP@ZIF-8/PDA稳定性的测定
为了验证HRP@ZIF-8和HRP@ZIF-8/PDA生物复合材料的稳定性,探究了不同温度和pH值对生物复合材料催化活性的影响。结果如图4a所示,随着温度的升高,游离HRP的相对活性在逐渐降低,当温度升高到 100 ℃时,相对活性仅为 47.78%。而HRP@ZIF-8和HRP@ZIF-8/PDA生物复合材料随着温度的升高依然还保持到 70%相对活性(图 4a)。HRP@ZIF-8的重要优势是ZIF-8作为保护层,可以在高温度(80 ℃、90 ℃和 100 ℃)下保持矿化使得HRP具有较高的活性。HRP@ZIF-8和HRP@ZIF-8/PDA生物复合材料广泛的温度范围最有可能来自于 ZIF-8的刚性结构对 HRP的紧密封装。ZIF-8刚性结构将 HRP限制在结构中,限制了 HRP结构因外界高温环境导致的展开运动[26],从而抑制了随后的聚集过程,ZIF-8刚性结构一定程度上维持HRP原有结构,使HRP保持生物催化活性。如图4b所示,对于游离HRP,最佳pH值为5.5,当pH值为3、6、7、8和9时,游离HRP分别保持其最高活性的86.57%、82.23%、70.72%和63.53%。这表明游离HRP在极酸性或碱性条件下的催化活性较低。然而,HRP@ZIF-8和HRP@ZIF-8/PDA生物复合材料在pH 3.0~9.0范围内表现出比游离HRP更高的相对催化活性,特别是在极酸性(pH 3)和碱性(pH 9)条件下分别达到93.41%、79.24%和92.92%、80.30%的相对催化活性。结果发现HRP@ZIF-8和HRP@ZIF-8/PDA生物复合材料在酸性和碱性介质环境中表现出增强耐受性,可能是由于ZIF-8作为固定基质具有合适的缓冲功能导致。结果验证了 HRP@ZIF-8和HRP@ZIF-8/PDA生物复合材料可以忍受极端条件,并保持较高的催化活性。
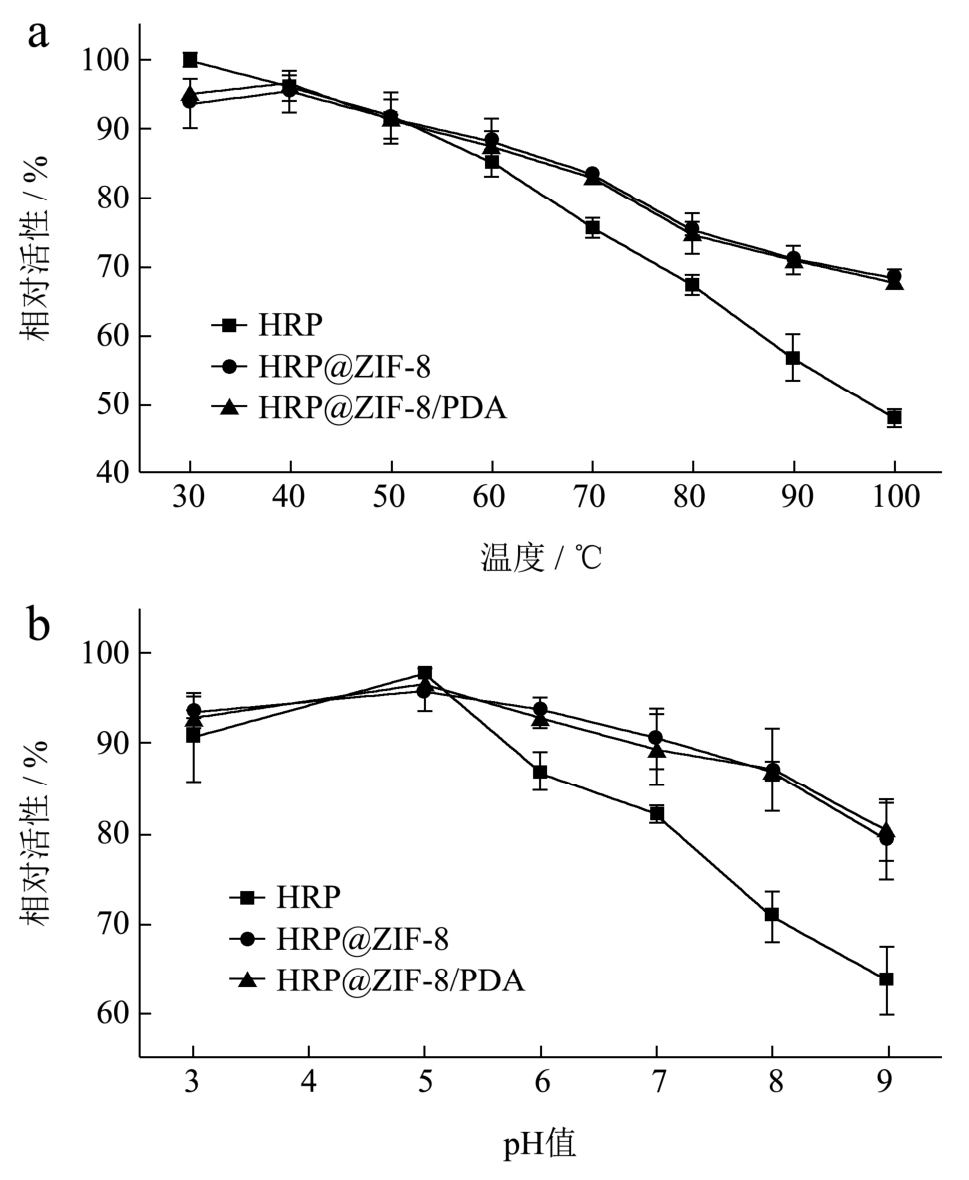
图4 HRP、HRP@ZIF-8和HRP@ZIF-8/PDA的温度-相对活性曲线(a)和pH-相对活性曲线(b)
Fig.4 pH-relativity activity profile (a) and temperature-relativity activity profile (b) of HRP, HRP@ZIF-8 and HRP@ZIF-8/PDA
2.4 MOF-ELISA检测方法的建立及灵敏度评价
通过向反应体系中分别加入0、0.01、0.02、0.05、0.10、0.20、0.50、1.00、2.00、5.00、10.00、15.00和20.00 ng/mL AFB1,观察溶液颜色变化情况并用酶标仪检测紫外可见吸收光谱。结果如图5a所示,随着AFB1浓度升高,反应后溶液颜色逐渐由蓝色变为无色,在450 nm处吸光度逐渐降低。当AFB1浓度为20 ng/mL,溶液颜色几乎为无色透明。同时AFB1浓度与450 nm处吸光度值呈现出良好的线性关系,如图5b所示。AFB1浓度在0.01~20.00 ng/mL之间时,得到的线性回归方程为 y=0.03×C[AFB1]+0.79,R2=0.99,检测限为72.00 pg/mL,低于国家标准《GB 2761-2011 食品安全国家标准 食品中真菌毒素限量》中对于谷物及其制品中 AFB1的最大限量(20 ng/mL),其检测限降低了 3~4个数量级。对比于利用HRP的商业ELISA试剂盒检测AFB1的方法,试剂盒检测AFB1的线性检测范围为0.1~10 ng/mL,检测限为620.00 pg/mL[29],而本研究利用ZIF-8仿生矿化原理包埋HRP作为信标物,使得线性检测范围更广,检测限更低,提高了HRP在极酸、极碱和极端温度下的耐受能力和HRP的稳定性,在AFB1的检测中也可发挥更好的催化作用,具有更高的灵敏度。结果表明,所构建的 MOF-ELISA比色法对于检测AFB1具有高灵敏性,满足检测要求。
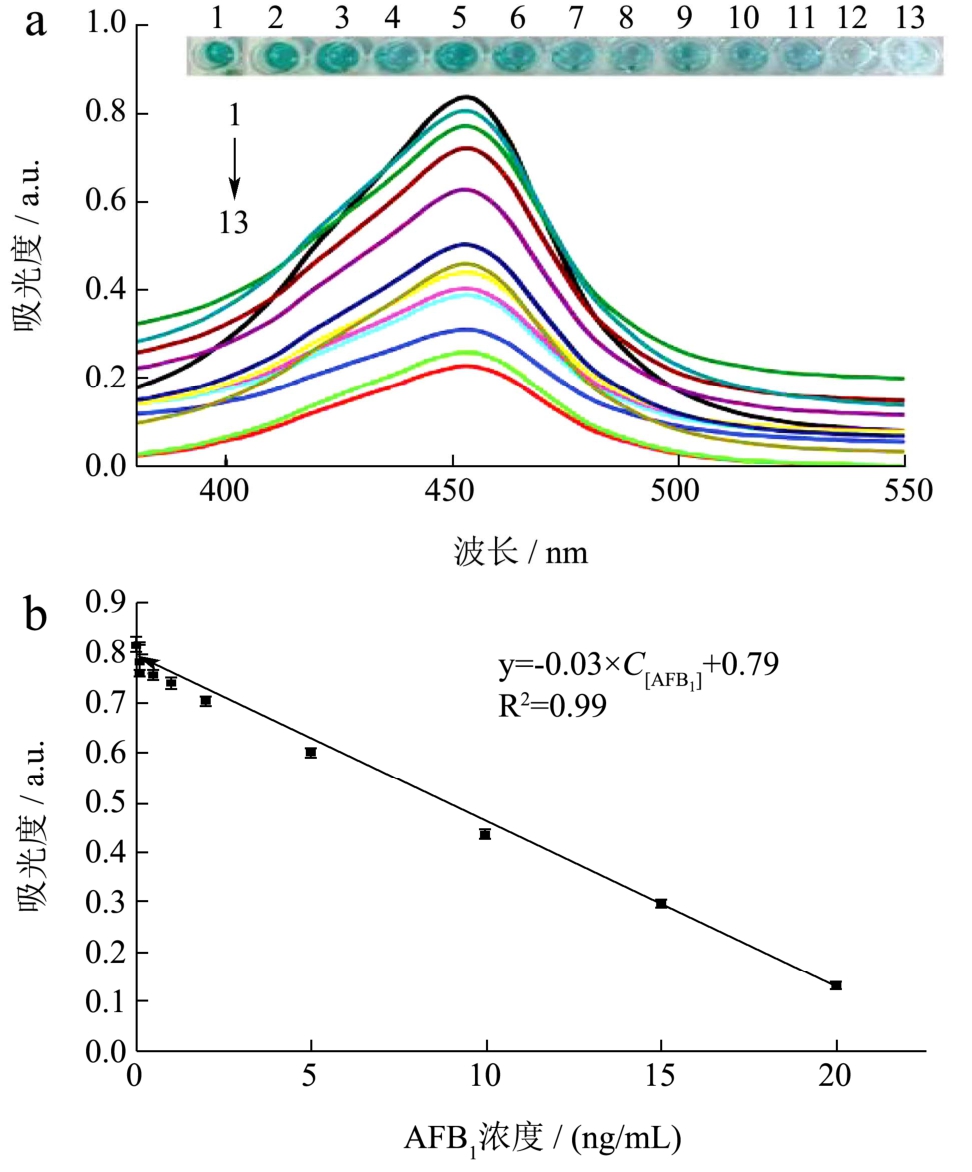
图5 (a)不同浓度AFB1的紫外-可见光谱;(b)AFB1浓度与吸光度的线性关系图
Fig.5 (a) The UV-visible spectra of AFB1 with different concentrations; (b) Linear relationship between AFB1 concentration and absorbance
注:图(a)AFB1浓度从上到下(1~13)分别为0、0.01、0.02、0.05、0.10、0.20、0.50、1.00、2.00、5.00、10.00、15.00、20.00 ng/mL。
2.5 特异性实验
为了研究所建立的 MOF-ELISA比色法对检测AFB1的特异性,本研究选用 AFB2、AFG1、AFG2和DON结构类似物作为潜在的干扰物,来测试方法的特异性。MOF-ELISA比色法对5.00 ng/mL AFB1和50.00 ng/mL其他真菌毒素在相同条件下进行检测。如图 6所示,其他真菌毒素溶液颜色与空白对照组(即没有AFB1目标物)溶液颜色均呈现出明显蓝色,而含有AFB1样品溶液颜色明显浅于其他真菌毒素和对照组溶液颜色,表明通过肉眼可直接分辨含有AFB1样品。在一定浓度AFB1抗体溶液中,加入AFB1后,AFB1被抗体特异性捕获,导致吸光度值急剧下降,吸光度为0.60,而AFB2、AFG1、AFG2和DON的吸光度变化较小,吸光度在0.81~0.82之间,与空白组的吸光度(0.83)相当。结果表明所建立的方法具有较好的选择性,基于此建立的MOF-ELISA比色法具有较好的特异性。

图6 特异性实验
Fig.6 Specific experiment
2.6 加标回收实验
为了评估开发的MOF-ELISA比色法用于AFB1检测在实际样品分析中的准确性,将不同浓度 AFB1添加到米粉和面粉样品提取液中进行回收率测试。根据上述拟合的回归方程y=0.03×C[AFB1]+0.79来计算加标样品中的AFB1浓度,测定结果列于表1。结果发现,在四种添加量中,含有0.50、1.00、2.00和5.00 ng/mL AFB1的米粉样品回收率在 96.00%~105.00%之间,RSD范围为2.26%~4.15%(n=3);在含有0.50、1.00、2.00和5.00 ng/mL AFB1的面粉样品回收率在82.00%~110.00%之间,RSD范围为1.20%~4.39%。米粉和面粉的基质干扰几乎可以忽略不计,加标回收率的RSD均小于 5%,表明该方法的重复性良好。结果表明,所建立的MOF-ELISA比色法具有良好的抗基质干扰能力,可用于米粉和面粉中AFB1含量检测。
表1 米粉和面粉样品中AFB1的回收率研究
Table 1 Detection results of the AFB1 levels in spiked rice flour and wheat flour
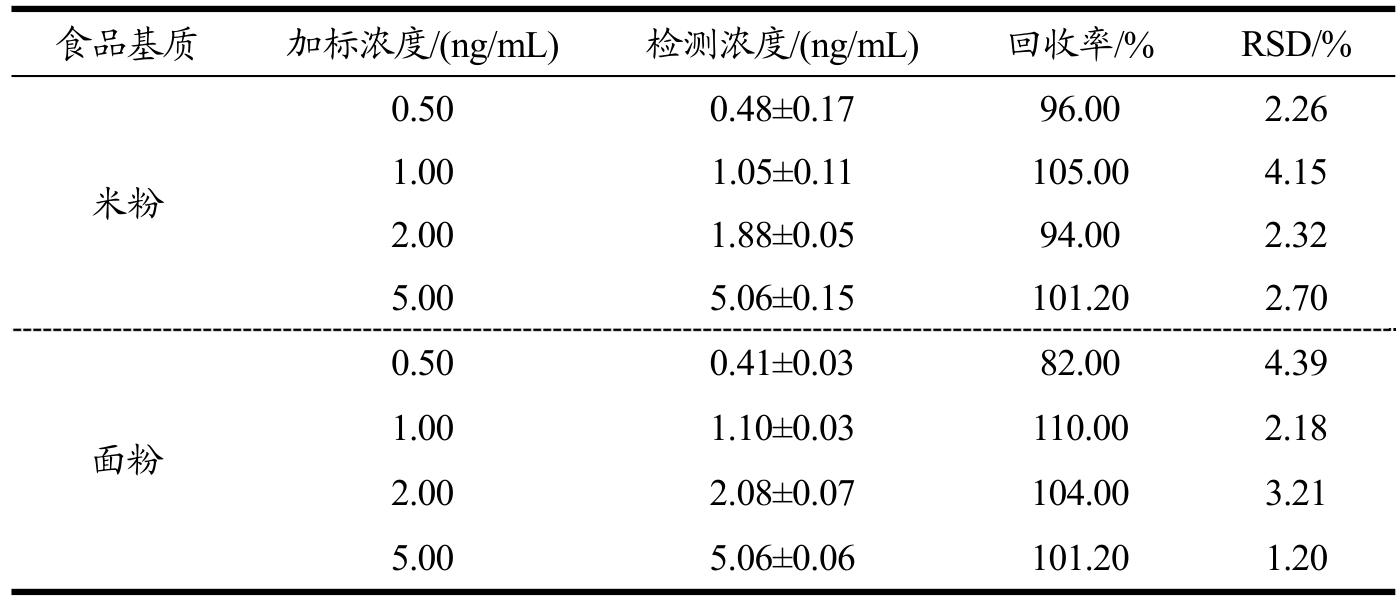
食品基质 加标浓度/(ng/mL) 检测浓度/(ng/mL) 回收率/% RSD/%0.50 0.48±0.17 96.00 2.26米粉面粉1.00 1.05±0.11 105.00 4.15 2.00 1.88±0.05 94.00 2.32 5.00 5.06±0.15 101.20 2.70 0.50 0.41±0.03 82.00 4.39 1.00 1.10±0.03 110.00 2.18 2.00 2.08±0.07 104.00 3.21 5.00 5.06±0.06 101.20 1.20
3 结论
本研究基于ZIF-8仿生矿化原理,构建了间接竞争ELISA比色法,用于米粉和面粉中AFB1的检测。ZIF-8通过仿生矿化方法完成了HRP的简单、快速封装。通过优化HRP浓度所获得的HRP@ZIF-8生物复合材料显著增强了对碱性环境和高温的耐受性,同时保持较高的酶催化活性。利用 HRP@ZIF-8/PDA/IgG作为信号标记物,可以实现 AFB1的快速肉眼检测,可见光吸光度与 AFB1浓度具有良好的线性关系,检测限为72 pg/mL,低于国家标准规定谷物中AFB1最大限量,比商业化的 AFB1检测试剂盒检测限更低,降低了3~4个数量级,本研究开发的AFB1检测方法更灵敏,而且该方法对其他常见霉菌毒素具有良好的选择性,在米粉和面粉基质中具有良好的准确性和重复性。与其他检测方法相比,基于ZIF-8的ELISA比色法具有成本低、检测速度快和易于操作等优点,为粮食中 AFB1的灵敏快速检测提供了新方法。该方法未来可扩展用于其他真菌毒素检测研究,同时对实际霉变样品进行检测,探索实际应用的可行性。
[1]Bayram E, Yılmaz E, Uzun L, et al. Multiclonal plastic antibodies for selective aflatoxin extraction from food samples [J]. Food Chemistry, 2017, 221: 829-837
[2]Jin X, Jin X, Liu X, et al. Biocatalyzed deposition amplification for detection of aflatoxin B1 based on quartz crystal microbalance [J]. Analytica Chimica Acta, 2009,645(1-2): 92-97
[3]Nirbhaya V, Chauhan D, Jain R, et al. Nanostructured graphitic carbon nitride based ultrasensing electrochemical biosensor for food toxin detection [J]. Bioelectrochemistry,2021, 139: 107738
[4]Yang Y, Li W, Shen P, et al. Aptamer fluorescence signal recovery screening for multiplex mycotoxins in cereal samples based on photonic crystal microsphere suspension array [J]. Sensors and Actuators B: Chemical, 2017, 248:351-358
[5]Chen L, Wen F, Li M, et al. A simple aptamer-based fluorescent assay for the detection of aflatoxin B1 in infant rice cereal [J]. Food Chemistry, 2017, 215: 377-382
[6]Wang L, Gan X-X. Biomolecule-functionalized magnetic nanoparticles for flow-through quartz crystal microbalance immunoassay of aflatoxin B1 [J]. Bioprocess and Biosystems Engineering, 2009, 32(1): 109-116
[7]王宇龙,王荷,赵志磊,等.基于核酸适配体的侧流层析技术同步检测赭曲霉毒素A和黄曲霉毒素B1[J].食品安全质量检测学报,2021,12(9):3441-3448
WANG Yulong, WANG He, ZHAO Zhilei, et al.Synchronous detection of ochratoxin A and aflatoxin B1 by lateral flow chromatography based on nucleic acid aptamers[J]. Journal of Food Safety and Quality, 2021, 12(9):3441-3448
[8]Jin X Y, Jin X F, Chen L G, et al. Piezoelectric immunosensor with gold nanoparticles enhanced competitive immunoreaction technique for quantification of aflatoxin B1[J]. Biosensors & Bioelectronics, 2009, 24(8): 2580-2585
[9]Li Q, Lu Z C, Tan X C, et al. Ultrasensitive detection of aflatoxin B1 by SERS aptasensor based on exonuclease-assisted recycling amplification [J]. Biosensors& Bioelectronics, 2017, 97: 59-64
[10]Zheng W L, Teng J, Cheng L, et al. Hetero-enzyme-based two-round signal amplification strategy for trace detection of aflatoxin B1 using an electrochemical aptasensor [J].Biosensors & Bioelectronics, 2016, 80: 574-581
[11]Jia B Y, Liao X F, Sun C N, et al. Development of a quantum dot nanobead-based fluorescent strip immunosensor for on-site detection of aflatoxin B1 in lotus seeds [J]. Food Chemistry, 2021, 356: 129614
[12]马江媛,桑晓霞,黄登宇.黄曲霉毒素B1的检测方法[J].食品安全质量检测学报,2019,10(24):8399-8404
MA Jiangyuan, SANG Xiaoxia, HUANG Dengyu. Detection method for aflatoxin B1 [J]. Journal of Food Safety and Quality, 2019, 10(24): 8399-8404
[13]Wang B, Chen Y F, Wu Y Y, et al. Aptamer induced assembly of fluorescent nitrogen-doped carbon dots on gold nanoparticles for sensitive detection of AFB1 [J]. Biosensors& Bioelectronics, 2016, 78: 23-30
[14]李彦伸,卢国柱,曲劲尧,等.霉菌毒素检测与脱毒技术研究进展[J].食品安全质量检测学报,2020,11(12):3919-3929
LI Yanshen, LU Guozhu, QU Jinyao, et al. Research progress of mycotoxin detection and detoxification techniques [J].Journal of Food Safety and Quality, 2020, 11(12): 3919-3929
[15]Gkaniatsou E, Sicard C, Ricoux R, et al. Enzyme encapsulation in mesoporous metal-organic frameworks for selective biodegradation of harmful dye molecules [J].Angewandte Chemie International Edition, 2018, 57(49):16141-16146
[16]Yang Q J, Liu Y, Xiao L S, et al. Self-templated transformation of MOFs into layered double hydroxide nanoarrays with selectively formed Co9S8 for high-performance asymmetric supercapacitors [J]. Chemical Engineering Journal, 2018, 354: 716-726
[17]Li L, Zhu Y, Zhou X, et al. Visible-light excited luminescent thermometer based on single lanthanide organic frameworks[J]. Advanced Functional Materials, 2016, 26(47): 8677-8684
[18]Cui J D, Ren S Z, Sun B T, et al. Optimization protocols and improved strategies for metal-organic frameworks for immobilizing enzymes: current development and future challenges [J]. Coordination Chemistry Reviews, 2018, 370:22-41
[19]Ren S Z, Li C H, Tan Z L, et al. Carbonic anhydrase@ ZIF-8 hydrogel composite membrane with improved recycling and stability for efficient CO2 capture [J]. Journal of Agricultural and Food Chemistry, 2019, 67(12): 3372-3379
[20]Du Y J, Gao J, Zhou L Y, et al. Enzyme nanocapsules armored by metal-organic frameworks: A novel approach for preparing nanobiocatalyst [J]. Chemical Engineering Journal,2017, 327: 1192-1197
[21]Chen G S, Kou X X, Huang S M, et al. Modulating the biofunctionality of metal-organic-framework-encapsulated enzymes through controllable embedding patterns [J].Angewandte Chemie International Edition, 2020, 59(7):2867-2874
[22]Ma X B, Sui H Y, Yu Q, et al. Silica capsules templated from metal-organic frameworks for enzyme immobilization and catalysis [J]. Langmuir, 2021, 37(10): 3166-3172
[23]Chen G S, Huang S M, Kou X X, et al. A convenient and versatile amino-acid-boosted biomimetic strategy for the nondestructive encapsulation of biomacromolecules within metal-organic frameworks [J]. Angewandte Chemie International Edition, 2019, 58(5): 1463-1467
[24]Wang L, Shan Y, Gu X, et al. Assembly and photocatalysis of three novel metal-organic frameworks tuned by metal polymeric motifs [J]. Journal of Coordination Chemistry,2015, 68(11): 2014-2028
[25]Liu X, Qi W, Wang Y, et al. Rational design of mimic multienzyme systems in hierarchically porous biomimetic metal-organic frameworks [J]. ACS Applied Materials &Interfaces, 2018, 10(39): 33407-33415
[26]Wang L, Zhi W J, Lian D S, et al. HRP@ZIF-8/DNA hybrids:functionality integration of ZIF-8 via biomineralization and surface absorption [J]. ACS Sustainable Chemistry &Engineering, 2019, 7(17): 14611-14620
[27]Xu W Q, Jiao L, Wu Y, et al. Metal-organic frameworks enhance biomimetic cascade catalysis for biosensing [J].Advanced Materials, 2021, 33(22): 2005172
[28]Nadar S S, Rathod V K. Immobilization of proline activated lipase within metal organic framework (MOF) [J].International Journal of Biological Macromolecules, 2020,152: 1108-1112
[29]Kolosova A Y, Shim W-B, Yang Z-Y, et al. Direct competitive ELISA based on a monoclonal antibody for detection of aflatoxin B1. Stabilization of ELISA kit components and application to grain samples [J]. Analytical and Bioanalytical Chemistry, 2006, 384(1): 286-294