灵芝,担子菌类多孔菌科,其性味甘、平,作为治疗和预防疾病药方中的一种中药,有治疗肝病、关节炎、高血压、神经衰弱、身体虚弱[1]的功效。灵芝含有的功效成分种类丰富,除灵芝总糖、灵芝三萜等天然活性物之外,还富含核苷类、生物碱类、微量元素等,是其具有抗氧化、抗肿瘤[2]等功效的原因。
从灵芝的子实体、孢子和菌丝体中均能提取到灵芝总糖,是其所含主要的化学成分之一[3],也是目前灵芝成分中研究最多的物质,截至2019年,已分离研究的多糖种类达200多种[4],灵芝总糖的提取方法是先用热水提取,然后用乙醇或甲醇沉淀,但也可以用水和碱提取,但其提取效率低,提取时间长。灵芝三萜属于高度氧化的羊毛甾烷衍生物[5],其生物合成是基于角鲨烯的环化作用,提取方式以丙酮、氯仿、甲醇、乙醇、乙醚或这些溶剂的混合物进行。提取物可以通过各种分离方法进一步纯化,包括正相和反相HPLC。最先从灵芝中分离出的三萜是灵芝酸A和灵芝酸B[6],目前已知灵芝三萜种类超135种[7]。
灵芝的活性成分总体含量不高,利用率低,为获得更大的经济效益,根据现有的资源和条件探寻提高灵芝天然活性物提取率的方法,进一步提高灵芝的利用率显得尤为重要。本实验采用的是本课题组自主研发的低温连续相变萃取装置(ZL 201310306553.5),目前低温连续相变萃取技术已被广泛应用于多种产物提取,如陈皮挥发油[8]、广佛手精油[9]、蓝圆鲹鱼油[10]等。本研究探讨了在中试条件下低温连续相变萃取技术提取灵芝活性成分的最佳工艺,旨在为灵芝活性成分的综合利用和工业化大生产提供一定的理论依据。
1 材料与方法
1.1 主要实验材料与试剂
赤灵芝,无限极(中国)有限公司;乙醇(分析纯),天津市富宇精细化工有限公司;齐墩果酸(标准品),湖南一科生物科技有限公司;乙腈(色谱纯),美国J.T.Baker公司;甲醇(分析纯),天津市富宇精细化工有限公司;高锰酸钾、氢氧化钠、酒石酸钾钠(分析纯),天津市大茂化学试剂厂;香兰素(分析纯),天津市福晨化学试剂厂;冰醋酸、高氯酸、乙酸乙酯(分析纯),天津市永大化学试剂有限公司。
1.2 实验设备
低温连续相变萃取装置,广东省天然活性物工程技术研究中心自主研发;119中药粉碎机,浙江温岭市药材机械厂;旋转蒸发仪,上海亚荣生化仪器厂;万分之一分析天平,梅特勒-托利多仪器(上海)有限公司;UV-1750紫外分光光度计,日本岛津制造所;LC-10 A高效液相色谱仪,日本岛津公司;TSK gel(G6000-G3000pwxl)色谱柱,北京绿百草科技发展有限公司。
1.3 实验方法
1.3.1 传统水提工艺提取灵芝活性成分
参照张志军等[11]的方法,将灵芝切片、粉碎、过3目筛网;加入12倍体积的三级水,100 ℃水浴提取2.5 h;经80目筛网过滤至贮液锅;加入10倍体积三级水,100 ℃水浴提取2.0 h;抽滤,合并两次水取的滤液,浓缩,温度控制在 90 ℃,取浓缩后样品计算固形物得率,检测总糖含量。
1.3.2 低温连续相变装置水提后醇提工艺提取灵芝活性成分
取已粉碎过3目筛网的灵芝粉,选用三级水,萃取温度95 ℃、萃取压力0.1 MPa、解析温度80 ℃、泵流速75 L/h提取灵芝原料,萃取时间5 h,将解析罐中提取液全部放出,浓缩,并测定其固形物含量、总糖含量。
水提结束后进行醇提,选用95%乙醇,萃取温度以及解析温度都为70 ℃、萃取压力0.1 MPa、泵流速100 L/h时提取灵芝原料,萃取时间5 h,将解析罐中提取液全部放出,浓缩,并测定其固形物含量、总糖含量。
1.3.3 低温连续相变装置醇提后水提工艺提取灵芝活性成分
取已粉碎过3目筛网的灵芝粉,选用95%乙醇,萃取温度以及解析温度均为70 ℃、萃取压力0.1 MPa、泵流速100 L/h提取灵芝原料,萃取时间总计5 h,将解析罐中提取液全部放出,浓缩,并测定其固形物含量、总糖含量
醇提结束后进行水提,选用三级水,萃取温度95 ℃、萃取压力0.1 MPa、解析温度80 ℃、泵流速35 L/h提取灵芝,萃取时间5 h,将解析罐中提取液放出,浓缩,并测定其固形物含量、总糖含量。
1.3.4 低温连续相变装置水提后醇提灵芝活性成分的工艺优化
①低温连续相变萃取灵芝活性成分工艺水提部分优化:
以水提原料所得固形物、总糖以及三萜及甾醇总含量为考察指标,对水提时间、溶剂流速、水提温度等单因素水提工艺进行优化。水提时间的优化:在萃取温度95 ℃、萃取压力0.1 MPa、解析温度80 ℃、泵流速20 L/h提取灵芝原料,萃取时间1、2、3、4、5、6、7、8、9 h,将解析罐中提取液全部放出,浓缩,并测定其固形物含量、总糖和总三萜含量;溶剂流速的优化:在萃取温度95 ℃、萃取压力0.1 MPa、解析温度80 ℃、萃取时间5 h,溶剂流速20、30、40 L/h,将解析罐中提取液全部放出,浓缩,并测定其固形物含量、总糖和总三萜含量;水提温度的优化:在萃取压力0.1 MPa、解析温度80 ℃、萃取时间5 h,溶剂流速20 L/h,萃取温度50、75、100 ℃,将解析罐中提取液全部放出,浓缩,并测定其固形物含量、总糖和总三萜含量;
②低温连续相变萃取灵芝活性成分工艺醇提部分优化:
单因素实验:醇提时间对灵芝活性成分提取效果的影响:在水提5 h的基础上,将原料自然沥干,注入95%乙醇提取,流速25 L/h,每隔1 h取样,合计取样9次,考察醇提时间对提取物三萜含量的影响;醇提浓度对灵芝活性成分提取效果的影响:在水提5 h的基础上,将原料自然沥干,注入95%乙醇提取,醇提时间5 h,乙醇浓度分别为95%、80%、70%、60%,考察醇提浓度对提取物三萜含量的影响;醇提温度对灵芝活性成分提取效果的影响:在水提5 h的基础上,将原料自然沥干,然后注入95%乙醇提取,醇提时间5 h,乙醇浓度95%,醇提温度分别为90、80、70、60 ℃,考察醇提温度对提取物三萜含量的影响。
乙醇回流提取灵芝活性成分正交实验:根据单因素实验结果,选取萃取温度、萃取溶剂浓度以及萃取时间三个因素中较优的三个水平设计正交实验,实验设计选择L9(34)正交表,各因素水平如表1所示。
表1 乙醇回流正交实验因素水平
Table 1 The level of orthogonal experimental factors in ethanol reflux
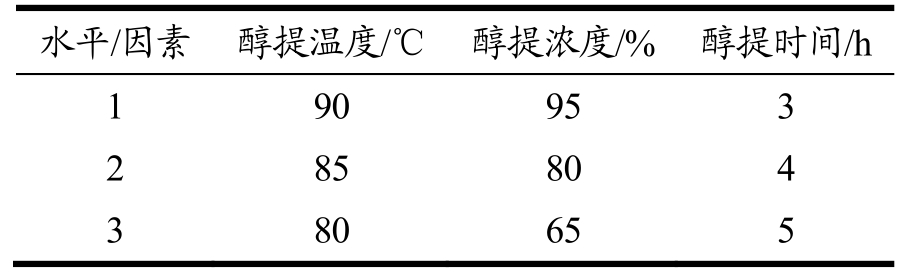
水平/因素 醇提温度/℃ 醇提浓度/% 醇提时间/h 1 90 95 3 2 85 80 4 3 80 65 5
低温连续相变醇提灵芝活性成分正交实验:根据单因素实验结果,选取萃取温度、萃取溶剂浓度以及萃取时间三个因素中较优的三个水平设计正交实验,实验设计选择L9(34)正交表,各因素水平如表2所示。
表2 低温连续相变醇提正交实验因素水平
Table 2 Factors of orthogonal experiment of ethanol extraction with low-temperature continuous phase change transition
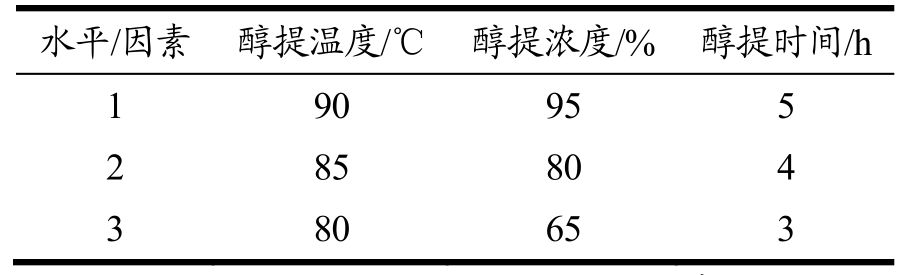
水平/因素 醇提温度/℃ 醇提浓度/% 醇提时间/h 1 90 95 5 2 85 80 4 3 80 65 3
1.3.5 总糖含量测定方法(高锰酸钾法)
总糖含量的测定:参照王富山等[12]方法,用高锰酸钾标准滴定法,计算浓缩液中总糖含量。
1.3.6 总三萜含量测定方法
参照《中国药典》[13],根据标准曲线计算样品中三萜含量。灵芝总三萜得率按以下公式计算:
1.3.7 总糖分子量分布及含量测定方法
采用高效液相色谱仪配备示差检测器,色谱柱为凝胶色谱柱:TSKgel G6000PWxl柱与 TSKgel G3000PWxl柱串联,采用的流动相为 0.02 mol/L Na2SO4,流速为0.6 mL/min,柱温箱温度为35 ℃,上样体积为 20 μL。用 0.5、1.2、2.5、5、8、15、27、41、67、180万分子量的葡聚糖标准品,以保留时间对应的洗脱体积为横坐标,相对分子量为纵坐标建立标准曲线。
1.3.8 数据处理
每个样品做 3次重复实验,所得数据用 SPSS V17.0软件统计分析,使用IBM SPSS 25.0统计软件处理正交实验的极差分析和方差分析。
2 结果与分析
2.1 不同工艺提取灵芝活性成分对比分析
参照张志军等[11]的传统水提工艺提取灵芝活性成分的固形物、总糖和总三萜的得率分别为 4.06%、0.67%、0.77%。低温连续相变先水提后醇提工艺提取灵芝活性成分固形物、总糖、总三萜的得率分别为6.34%、0.80%、1.59%。低温连续相变先醇提后水提工艺提取灵芝活性成分固形物、总糖、总三萜的得率分别为 5.19%、0.93%、1.10%(如表3所示)。对比三种提取工艺,低温连续相变萃取工艺提取灵芝所得固形物、总糖和总三萜的得率明显高于水提,热水浸提是灵芝多糖提取的传统方法,提取时间长、能源消耗大、多糖得率低、活性差[14];低温连续相变萃取工艺中先水提后醇提比先醇提后水提所得固形物多22.16%,优势明显;低温连续相变萃取工中先醇提后水提工艺较先水提后醇提所得总糖更高,但是先水提后醇提工艺中水提 5 h可将提取出 89.12%的总糖含量,而先醇提后水提工艺中醇提5 h只能提出49.67%的总糖,因此先水提后醇提工艺生产效率更高;低温连续相变萃取工艺中先水提后醇提工艺较先水提后醇提工艺提取灵芝总三萜得率高44.55%。综上,低温连续相变萃取工艺比传统水提工艺更优,低温连续相变先水提后醇提工艺比先醇提提后水提总体得率更多,效率更高。为进一步提高灵芝活性成分的提取率,我们设计实验对低温连续相变先水提后醇提工艺进行了优化。
表3 不同工艺提取灵芝活性成分分析
Table 3 Analysis of effective components from Ganoderma lucidum by different extraction techniques
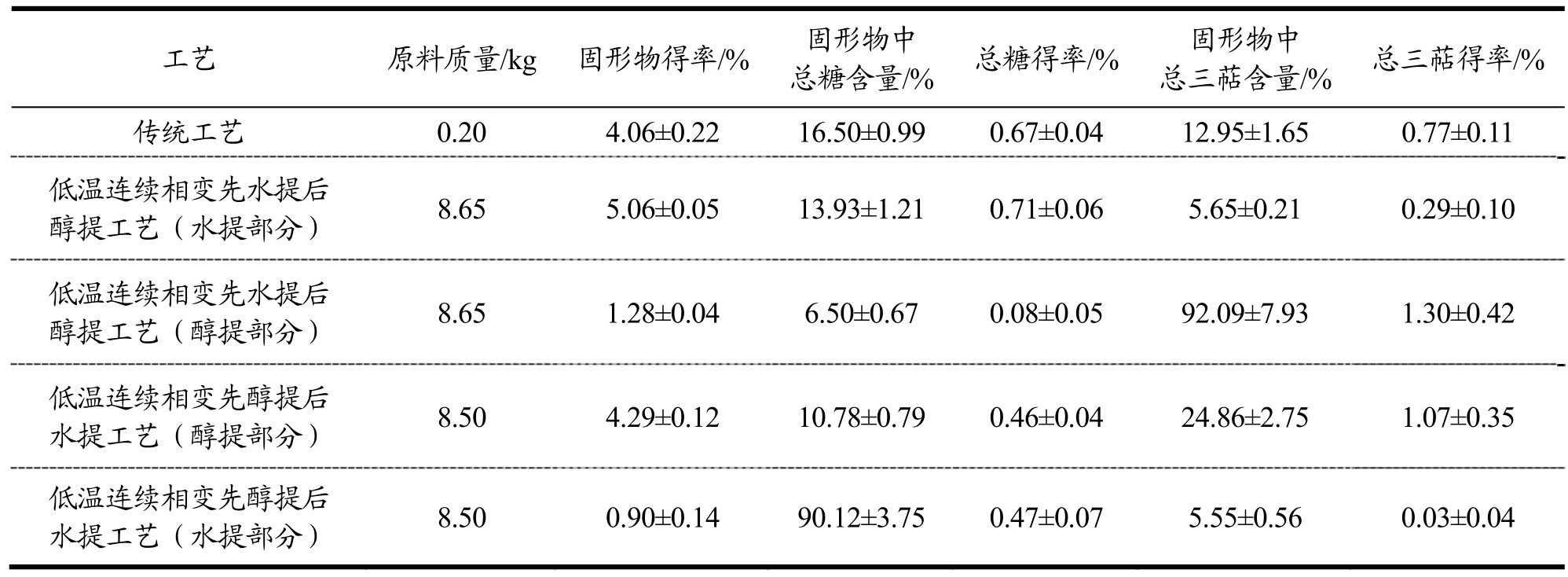
工艺 原料质量/kg 固形物得率/% 固形物中总糖含量/% 总糖得率/% 固形物中总三萜含量/% 总三萜得率/%传统工艺 0.20 4.06±0.22 16.50±0.99 0.67±0.04 12.95±1.65 0.77±0.11低温连续相变先水提后醇提工艺(水提部分) 8.65 5.06±0.05 13.93±1.21 0.71±0.06 5.65±0.21 0.29±0.10低温连续相变先水提后醇提工艺(醇提部分) 8.65 1.28±0.04 6.50±0.67 0.08±0.05 92.09±7.93 1.30±0.42低温连续相变先醇提后水提工艺(醇提部分) 8.50 4.29±0.12 10.78±0.79 0.46±0.04 24.86±2.75 1.07±0.35低温连续相变先醇提后水提工艺(水提部分) 8.50 0.90±0.14 90.12±3.75 0.47±0.07 5.55±0.56 0.03±0.04
2.2 低温连续相变萃取灵芝活性成分的水提工艺优化
水提时间的优化:水提分小时提取所灵芝活性成分如表4所示。9 h固形物得率合计为6.19%,5 h固形物得率合计为5.59%;9 h总糖得率合计为1.50%,5 h总糖得率合计为 1.27%;9 h总三萜总得率为0.37%,5 h总三萜总得率为0.32%(表4)。结果表明,随着水提时间的延长,水提灵芝所得活性成分逐渐增多,5 h后总糖得率趋于平稳,说明此时提取液中的总糖已达到平衡[11]。5 h水提灵芝所得固形物、总糖和总三萜分别占9 h水提灵芝所得的90.31%、84.67%和86.49%,所以水提5 h效率最高,利于放大生产。
表4 水提时间对低温连续相变萃取灵芝活性成分的影响
Table 4 Effect of water time on the extraction of active components from Ganoderma lucidum by low-temperature continuous phase change transition
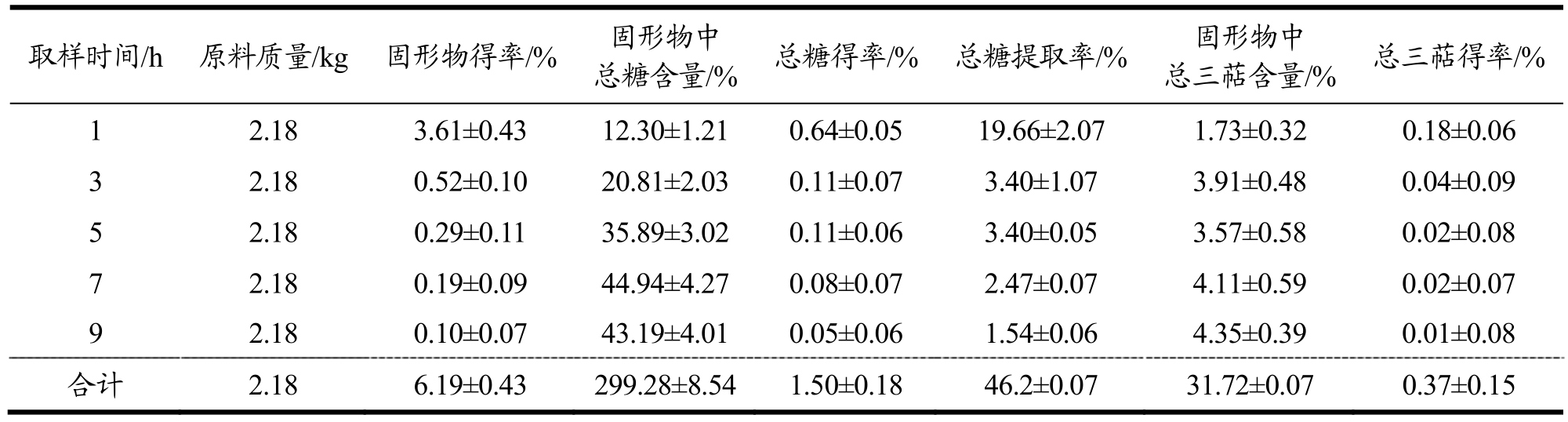
取样时间/h 原料质量/kg 固形物得率/% 固形物中总糖含量/% 总糖得率/% 总糖提取率/% 固形物中总三萜含量/% 总三萜得率/%1 2.18 3.61±0.43 12.30±1.21 0.64±0.05 19.66±2.07 1.73±0.32 0.18±0.06 3 2.18 0.52±0.10 20.81±2.03 0.11±0.07 3.40±1.07 3.91±0.48 0.04±0.09 5 2.18 0.29±0.11 35.89±3.02 0.11±0.06 3.40±0.05 3.57±0.58 0.02±0.08 7 2.18 0.19±0.09 44.94±4.27 0.08±0.07 2.47±0.07 4.11±0.59 0.02±0.07 9 2.18 0.10±0.07 43.19±4.01 0.05±0.06 1.54±0.06 4.35±0.39 0.01±0.08合计 2.18 6.19±0.43 299.28±8.54 1.50±0.18 46.2±0.07 31.72±0.07 0.37±0.15
水提溶剂流速的优化:以每小时通过物料罐中灵芝原料的溶剂量为考察因素,总糖提取率为考察指标,考察不同的溶剂流速对灵芝原料的固形物以及总糖含量的影响。溶剂流速为30 L/h时,所得固形物得率最高为5.59%,高于流速20 L/h所得固形物得率5.58%以及流速为40 L/h固形物得率5.09%;同时30 L/h流速提取所得总糖提取率为39.11%,高于20 L/h流速所得总糖提取率37.17%以及40 L/h总糖得率30.39%(表5~表7)。结果表明,流速过高并不利于总糖的提取,当流速为30 L/h时,提取总糖效果最好,可能是因为流速过高会增加其他组分(如蛋白质)的溶出,对于多糖的溶解可能存在一定影响[15]。
表5 水提溶剂流速(20 L/h)对低温连续相变萃取灵芝活性成分的影响
Table 5 Influence of water extraction solvent flow rate (20 L/h) on low-temperature continuous phase change transition of active components of Ganoderma lucidum
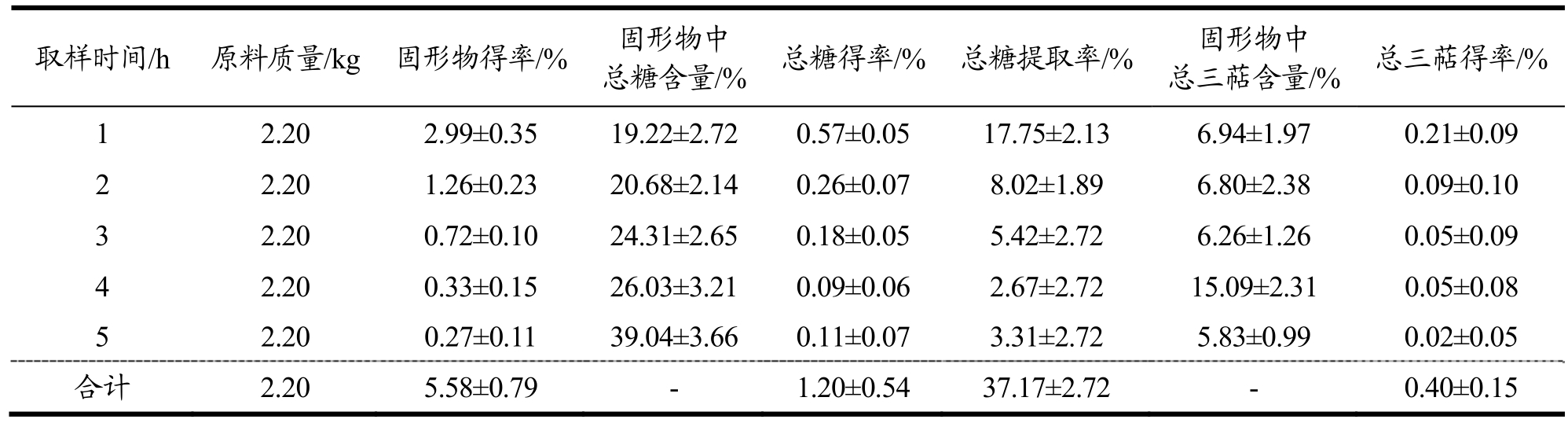
取样时间/h 原料质量/kg 固形物得率/% 固形物中总糖含量/% 总糖得率/% 总糖提取率/% 固形物中总三萜含量/% 总三萜得率/%1 2.20 2.99±0.35 19.22±2.72 0.57±0.05 17.75±2.13 6.94±1.97 0.21±0.09 2 2.20 1.26±0.23 20.68±2.14 0.26±0.07 8.02±1.89 6.80±2.38 0.09±0.10 3 2.20 0.72±0.10 24.31±2.65 0.18±0.05 5.42±2.72 6.26±1.26 0.05±0.09 4 2.20 0.33±0.15 26.03±3.21 0.09±0.06 2.67±2.72 15.09±2.31 0.05±0.08 5 2.20 0.27±0.11 39.04±3.66 0.11±0.07 3.31±2.72 5.83±0.99 0.02±0.05合计 2.20 5.58±0.79 - 1.20±0.54 37.17±2.72 - 0.40±0.15
表7 水提溶剂流速(40 L/h)对低温连续相变萃取灵芝活性成分的影响
Table 7 Influence of water extraction solvent flow rate (40 L/h) on low-temperature continuous phase change transition of active components of Ganoderma lucidum
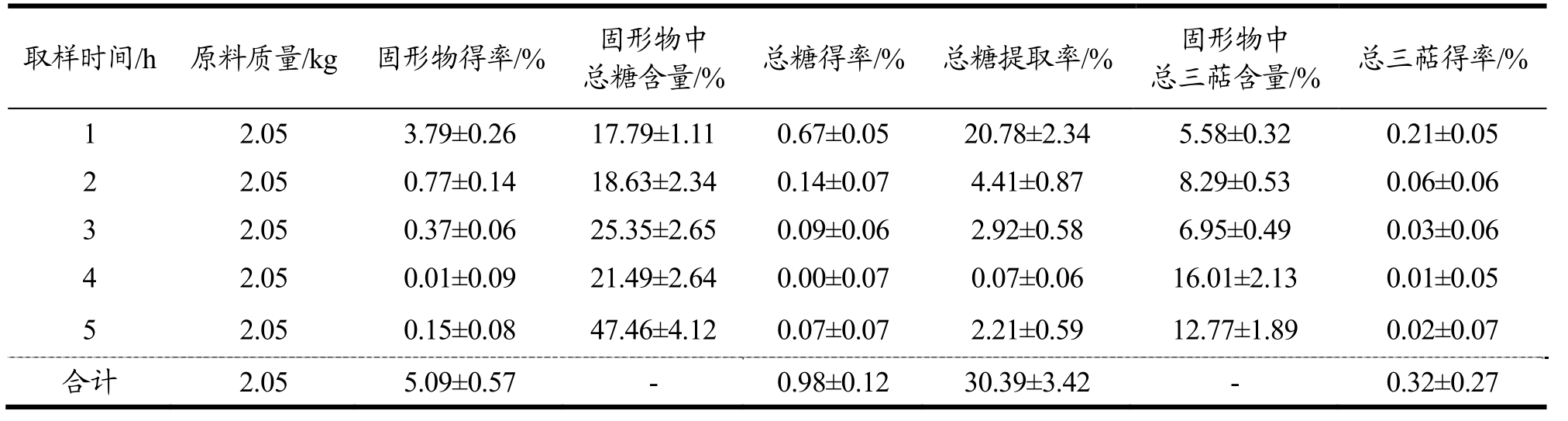
取样时间/h 原料质量/kg 固形物得率/% 固形物中总糖含量/% 总糖得率/% 总糖提取率/%固形物中总三萜含量/% 总三萜得率/%1 2.05 3.79±0.26 17.79±1.11 0.67±0.05 20.78±2.34 5.58±0.32 0.21±0.05 2 2.05 0.77±0.14 18.63±2.34 0.14±0.07 4.41±0.87 8.29±0.53 0.06±0.06 3 2.05 0.37±0.06 25.35±2.65 0.09±0.06 2.92±0.58 6.95±0.49 0.03±0.06 4 2.05 0.01±0.09 21.49±2.64 0.00±0.07 0.07±0.06 16.01±2.13 0.01±0.05 5 2.05 0.15±0.08 47.46±4.12 0.07±0.07 2.21±0.59 12.77±1.89 0.02±0.07合计 2.05 5.09±0.57 - 0.98±0.12 30.39±3.42 - 0.32±0.27
水提温度的优化:以水提温度为考察因素,总糖提取率为考察指标,考察不同水提取温度对灵芝原料的固形物、总糖和总三萜得率的影响。对比三种不同提取温度提取灵芝活性成分,发现当提取温度为100 ℃时、水提总时间为5 h、流速为30 L/h以及解析温度 78 ℃所得固形物得率为 5.59%、总糖得率为1.27%,总三萜得率为 0.32%,均为最高(表8)。水提温度越高,多糖的提取效果越好,但是温度太高,也有可能影响到灵芝活性物的生物活性[11]。
表8 水提温度对低温连续相变萃取灵芝总三萜的影响
Table 8 Effect of water temperature on the extraction of total triterpenoids from Ganoderma lucidum by low-temperature continuous phase change transition
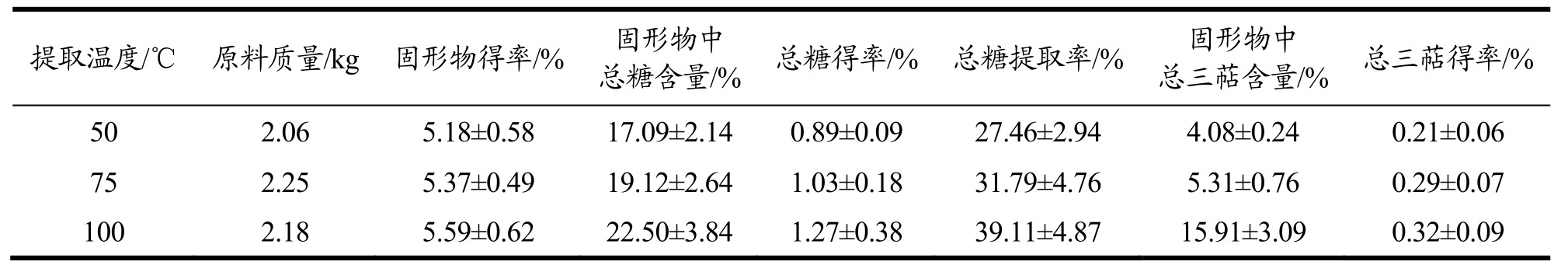
提取温度/℃ 原料质量/kg 固形物得率/% 固形物中总糖含量/% 总糖得率/% 总糖提取率/% 固形物中总三萜含量/% 总三萜得率/%50 2.06 5.18±0.58 17.09±2.14 0.89±0.09 27.46±2.94 4.08±0.24 0.21±0.06 75 2.25 5.37±0.49 19.12±2.64 1.03±0.18 31.79±4.76 5.31±0.76 0.29±0.07 100 2.18 5.59±0.62 22.50±3.84 1.27±0.38 39.11±4.87 15.91±3.09 0.32±0.09
表6 水提溶剂流速(30 L/h)对低温连续相变萃取灵芝活性成分的影响
Table 6 Influence of water extraction solvent flow rate (30 L/h) on low-temperature continuous phase change transition of active components of Ganoderma lucidum
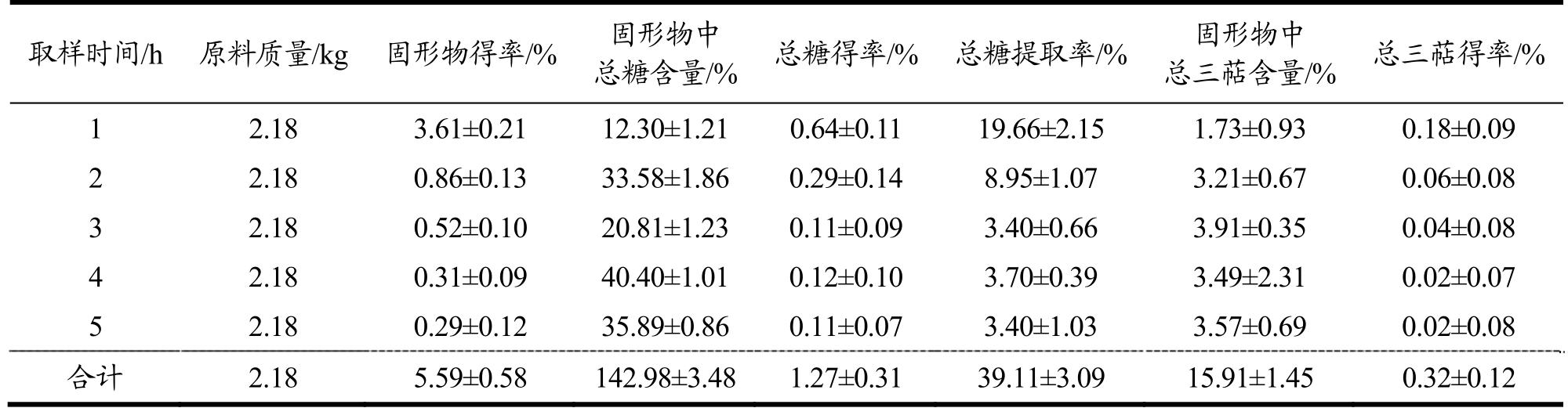
取样时间/h 原料质量/kg 固形物得率/% 固形物中总糖含量/% 总糖得率/% 总糖提取率/% 固形物中总三萜含量/% 总三萜得率/%1 2.18 3.61±0.21 12.30±1.21 0.64±0.11 19.66±2.15 1.73±0.93 0.18±0.09 2 2.18 0.86±0.13 33.58±1.86 0.29±0.14 8.95±1.07 3.21±0.67 0.06±0.08 3 2.18 0.52±0.10 20.81±1.23 0.11±0.09 3.40±0.66 3.91±0.35 0.04±0.08 4 2.18 0.31±0.09 40.40±1.01 0.12±0.10 3.70±0.39 3.49±2.31 0.02±0.07 5 2.18 0.29±0.12 35.89±0.86 0.11±0.07 3.40±1.03 3.57±0.69 0.02±0.08合计 2.18 5.59±0.58 142.98±3.48 1.27±0.31 39.11±3.09 15.91±1.45 0.32±0.12
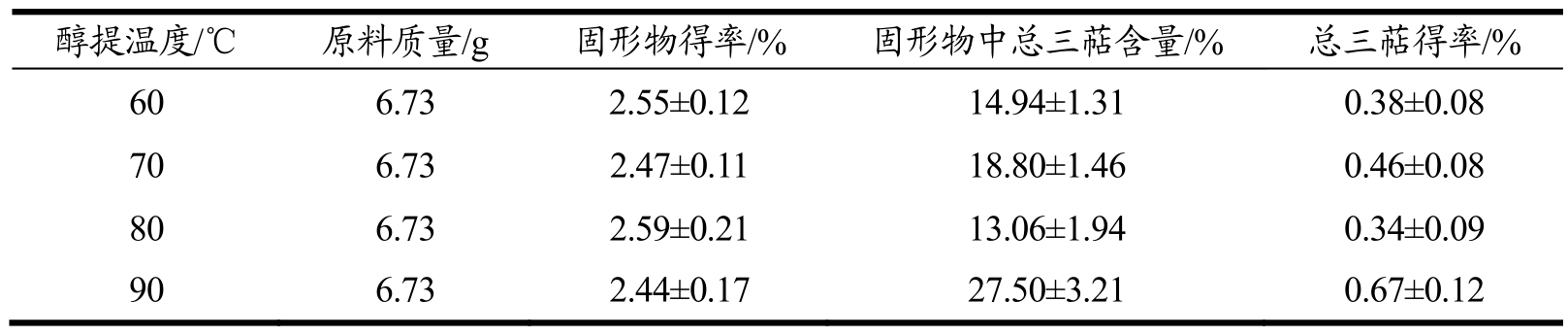
表11 醇提温度对低温连续相变萃取灵芝总三萜的影响
Table 11 Effect of ethanol temperature on the extraction of total triterpenoids from Ganoderma lucidum by low-temperature continuous phase change transition
醇提温度/℃ 原料质量/g 固形物得率/% 固形物中总三萜含量/% 总三萜得率/%60 6.73 2.55±0.12 14.94±1.31 0.38±0.08 70 6.73 2.47±0.11 18.80±1.46 0.46±0.08 80 6.73 2.59±0.21 13.06±1.94 0.34±0.09 90 6.73 2.44±0.17 27.50±3.21 0.67±0.12
2.3 低温连续相变萃取灵芝活性成分的醇提工艺优化
2.3.1 醇提单因素实验
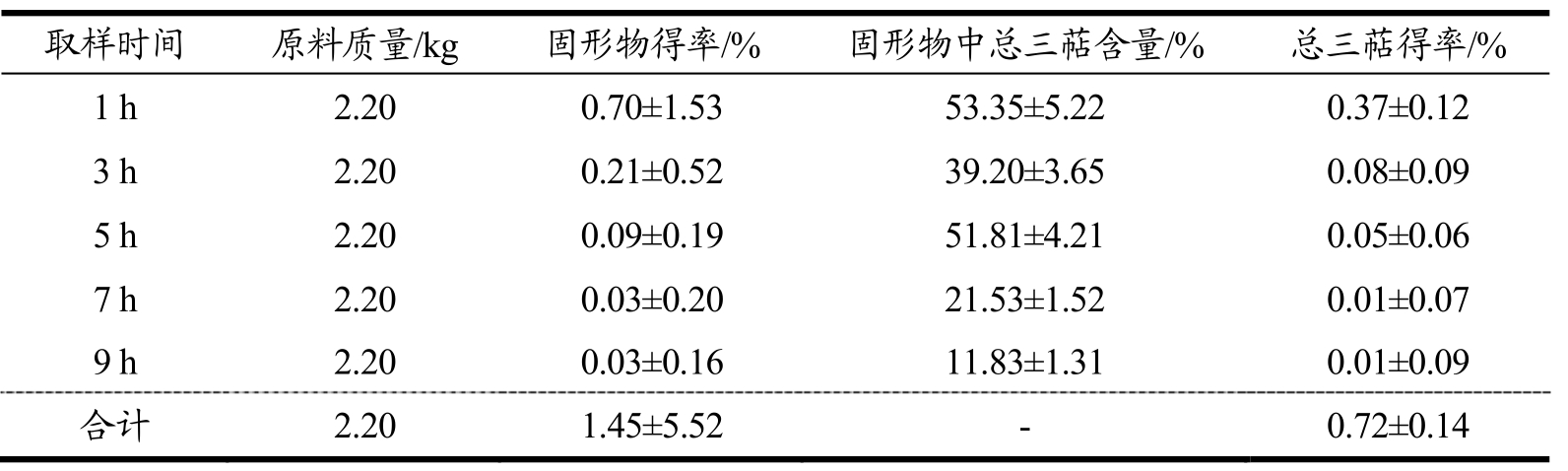
醇提时间对灵芝活性成分提取效果的影响:由表9可知,每小时灵芝总三萜得率随时间的延长逐渐减少,其中1 h总三萜得率最高,为0.37%,6 h开始总三萜得率(0.02%)明显降低,前5 h三萜得率为0.69%,占9 h灵芝总三萜总得率(95.83%),表明在前5 h三萜得率较高,5 h之后醇提三萜得率较小。在一定时间内,灵芝总三萜的得率随时间的延长而不断增加,当扩散达到平衡后,灵芝细胞内外总三萜浓度达到动态平衡,所以随着时间再延长,灵芝总三萜的提取率无明显变化[16]。
表9 醇提时间对低温连续相变萃取灵芝总三萜的影响
Table 9 Effect of ethanol time on the extraction of total triterpenoids from Ganoderma lucidum by low-temperature continuous phase change transition
取样时间 原料质量/kg 固形物得率/% 固形物中总三萜含量/% 总三萜得率/%1 h 2.20 0.70±1.53 53.35±5.22 0.37±0.12 3 h 2.20 0.21±0.52 39.20±3.65 0.08±0.09 5 h 2.20 0.09±0.19 51.81±4.21 0.05±0.06 7 h 2.20 0.03±0.20 21.53±1.52 0.01±0.07 9 h 2.20 0.03±0.16 11.83±1.31 0.01±0.09合计 2.20 1.45±5.52 - 0.72±0.14
醇提浓度对灵芝活性成分提取效果的影响:由表10所示,随着乙醇浓度的提高,其三萜得率不断提高,用 95%乙醇进行提取,其三萜得率(0.34%)要明显高于60%乙醇浓度提取三萜得率(0.15%)。杨德等[17]发现灵芝三萜类成分提取率与乙醇浓度呈正相关关系,所以高浓度的乙醇利于灵芝三萜的萃取。
表10 乙醇浓度对低温连续相变萃取灵芝总三萜的影响
Table 10 Effect of ethanol concentration on the extraction of total triterpenoids from Ganoderma lucidum by low-temperature continuous phase change transition

乙醇浓度/% 原料质量/g 固形物得率/% 固形物中总三萜含量/% 总三萜得率/%60 6.73 2.41±0.29 6.21±0.35 0.15±0.07 70 6.73 2.38±0.25 9.48±1.03 0.23±0.09 80 6.73 2.31±0.15 11.17±1.35 0.26±0.07 95 6.73 2.59±0.18 13.06±1.08 0.34±0.11
醇提温度对灵芝活性成分提取效果的影响:由表11可知,随着温度的升高,灵芝总三萜得率不断升高,当醇提温度为 90 ℃时,灵芝总三萜得率为 0.67%,要明显高于低温度提取(0.38%)。随着温度的升高,乙醇的渗透能力增加,灵芝总三萜从细胞内向外的扩散能力增加,从而提高提取率[15]。但是过高的醇提温度,需要更高的压力,会增加设备的成本,不利于工业大生产。
2.3.2 回流提取正交实验结果分析
从表12可以看出,实验室进行回流提取灵芝三萜实验,最佳提取条件为A2B1C2,即醇提温度为85 ℃、醇提浓度为95%以及醇提时间4 h,其中各因素对结果影响主次顺序为醇提浓度>醇提温度>醇提时间。
表12 回流提取正交实验及结果
Table 12 Orthogonal experiment and results of reflux extraction

因素 醇提温度/℃醇提浓度/%醇提时间/h三萜得率/%实验1 1 1 1 0.45±0.09实验2 1 2 2 0.30±0.05实验3 1 3 3 0.14±0.06实验4 2 1 2 0.59±0.12实验5 2 2 3 0.34±0.10实验6 2 3 1 0.19±0.07实验7 3 1 3 0.40±0.09实验8 3 2 1 0.29±0.08实验9 3 3 2 0.16±0.09均值1 0.30 0.48 0.31均值2 0.38 0.31 0.35均值3 0.29 0.17 0.29极差 0.09 0.32 0.06
2.3.3 低温连续相变醇提正交实验结果分析
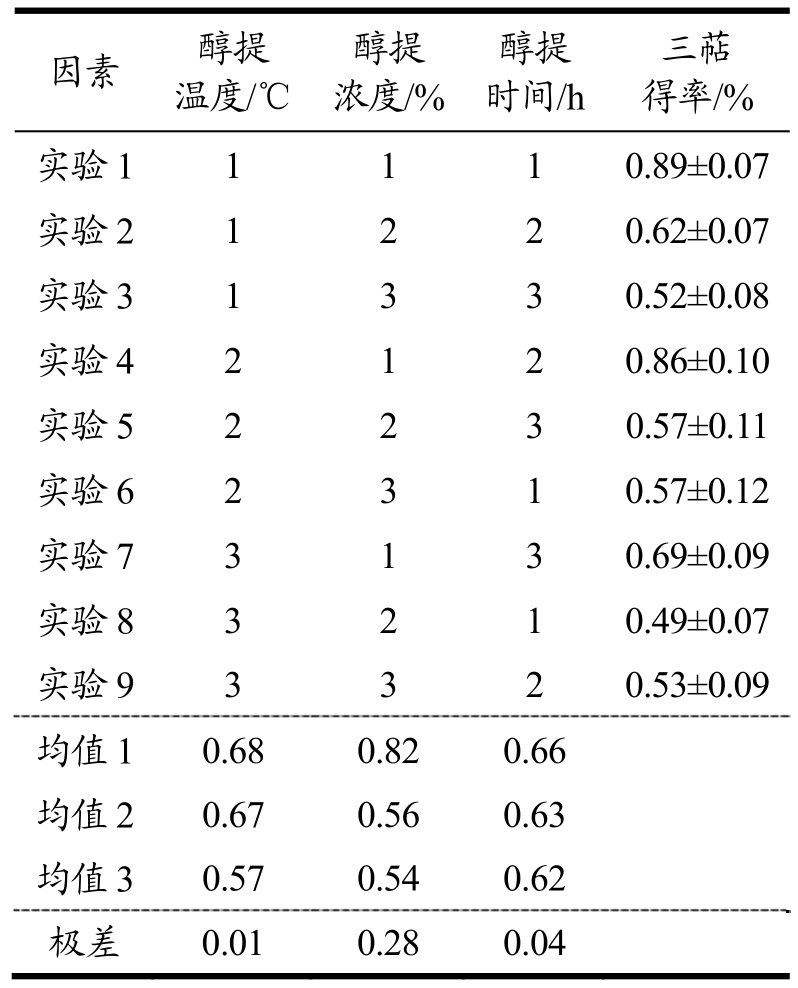
由低温连续相变醇提正交实验结果(表13)可得,最佳提取条件为A1B1C2,即提取温度为90 ℃,乙醇浓度为95%以及提取时间为4 h,其中各因素对结果影响主次顺序为醇提浓度>醇提时间>醇提温度。
表13 低温连续相变醇提正交实验及结果
Table 13 orthogonal experiment and results of ethanol extraction with low-temperature continuous phase change transition
因素 醇提温度/℃醇提浓度/%醇提时间/h三萜得率/%实验1 1 1 1 0.89±0.07实验2 1 2 2 0.62±0.07实验3 1 3 3 0.52±0.08实验4 2 1 2 0.86±0.10实验5 2 2 3 0.57±0.11实验6 2 3 1 0.57±0.12实验7 3 1 3 0.69±0.09实验8 3 2 1 0.49±0.07实验9 3 3 2 0.53±0.09均值1 0.68 0.82 0.66均值2 0.67 0.56 0.63均值3 0.57 0.54 0.62极差 0.01 0.28 0.04
对比实验室回流提取,低温连续相变萃取灵芝总三萜含量较高,其中低温连续相变萃取工艺在温度因素变化下,对灵芝总三萜得率影响较小,在考虑能耗的条件下,醇提最佳条件为低温连续相变温度85 ℃,乙醇浓度95%以及提取时间4 h。
2.3.4 低温连续相变萃取灵芝活性成分工艺验证
在正交水平设计所得的最优醇提结果条件下,在车间进行 20 L釜低温连续相变提取灵芝验证正交实验结果条件为:先进行水提,其水提总时间为5 h,水提流速为30 L/h,水提温度为100 ℃。水提结束后,原料自然沥,再注入 95%乙醇进行醇提,醇提温度85 ℃,乙醇浓度95%,醇提时间4 h,醇提流速为28 L/h,所得实验结果如表12所示,通过对比传统工艺提取灵芝所得固形物、总糖、总三萜得率(表14)发现,优化后的低温连续相变萃取灵芝工艺固形物得率为7.56%,总糖得率为1.14%,总三萜得率为1.17%,比传统水提灵芝工艺固形物、总糖和总三萜得率分别高15.60%、23.91%和333.33%。对比其他灵芝多糖提取方法,如超声辅助萃取法(灵芝多糖得率2.78%)、酶解法(灵芝多糖得率4.41%)、微波辅助萃取法(灵芝多糖得率1.78%)以及超临界萃取法(灵芝多糖得率 4.54%)等[15,18-20],虽然连续低温连续相变工艺提取灵芝总糖得率不及这些方法,但是超声辅助萃取以及微波辅助萃取可能会对多糖结构造成破坏,酶解法受pH、温度等因素影响较大,超临界萃取法受限于设备制造成本。另一方面,对比其他灵芝三萜提取方法,如乙醇回流提取,氯仿回流提取等[16,21],其三萜得率分别为0.69%和0.41%~0.93%,采用连续低温连续相变工艺提取灵芝三萜得率为1.17%,明显高于其他方法。同时这些方法均存在萃取后料液分离困难、萃取溶剂回收不便等问题,难以规模化生产。采用低温连续相变工艺提取灵芝活性成分,相比于传统溶剂浸提法具有萃取率高、萃取时间短、溶剂回收方便、损失率低且粗提物无需过滤等优点,适宜大批量工业化大生产。
表14 低温连续相变萃取灵芝活性成分工艺验证
Table 14 Low-temperature continuous phase change transition process validation of active components of Ganoderma lucidum

灵芝活性成分提取工艺 原料质量/kg 固形物得率/% 总糖得率/% 总三萜得率/%传统工艺 0.20 6.54±0.37 0.92±0.06 0.27±0.002低温连续相变萃取工艺 2.00 7.56±0.21 1.14±0.01 1.17±0.009
2.4 低温连续相变萃取工艺灵芝水提液总糖GPC分析
葡聚糖大分子量和小分子量对数log M与洗脱体积标准曲线分别为y=-0.5739x+14.208,R2=0.9906和y=-0.4075x+11.549,R2=0.9998,可用于分析计算样品的总糖分子量分布。
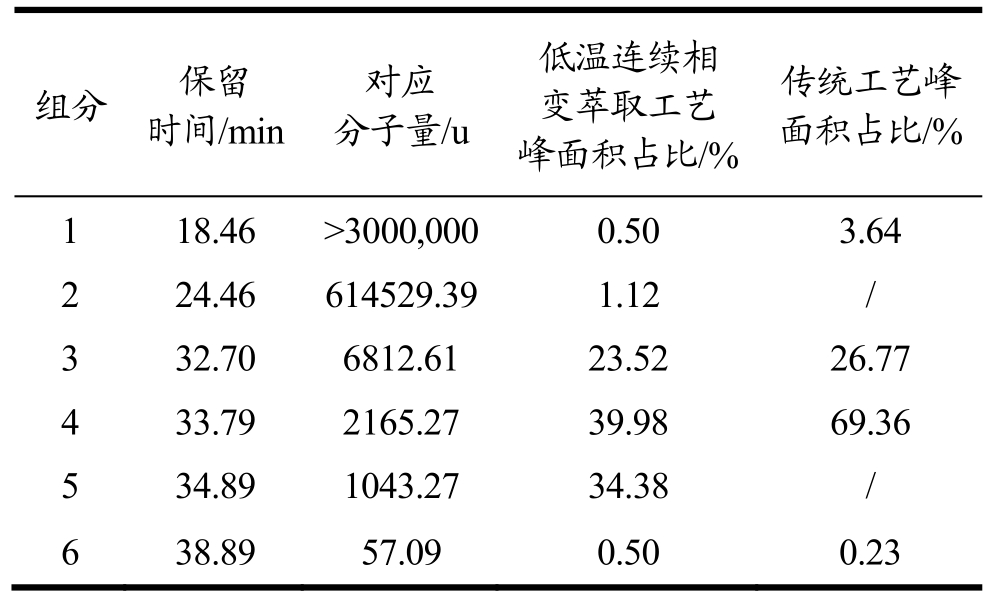
对比不同工艺的水提液上样测定GPC谱图(图1)和峰面积(表15),发现低温连续相变萃取工艺提取灵芝活性成分的各分子量的总糖含量明显高于传统水提工艺,且低温连续相变萃取工艺比传统水提工艺提取灵芝活性成分所得总糖多出组分2和组分5(分子量分别约为614529 u和1000 u)。不同灵芝多糖的组成和结构与其免疫调节、抗肿瘤、抗氧化、抗衰老等重要的生物学活性密切相关[22]。
表15 不同组分分子量段及峰面积
Table 15 Molecular weight segment and peak area of different components
组分 保留时间/min对应分子量/u低温连续相变萃取工艺峰面积占比/%传统工艺峰面积占比/%1 18.46 >3000,000 0.50 3.64 2 24.46 614529.39 1.12 /3 32.70 6812.61 23.52 26.77 4 33.79 2165.27 39.98 69.36 5 34.89 1043.27 34.38 /6 38.89 57.09 0.50 0.23
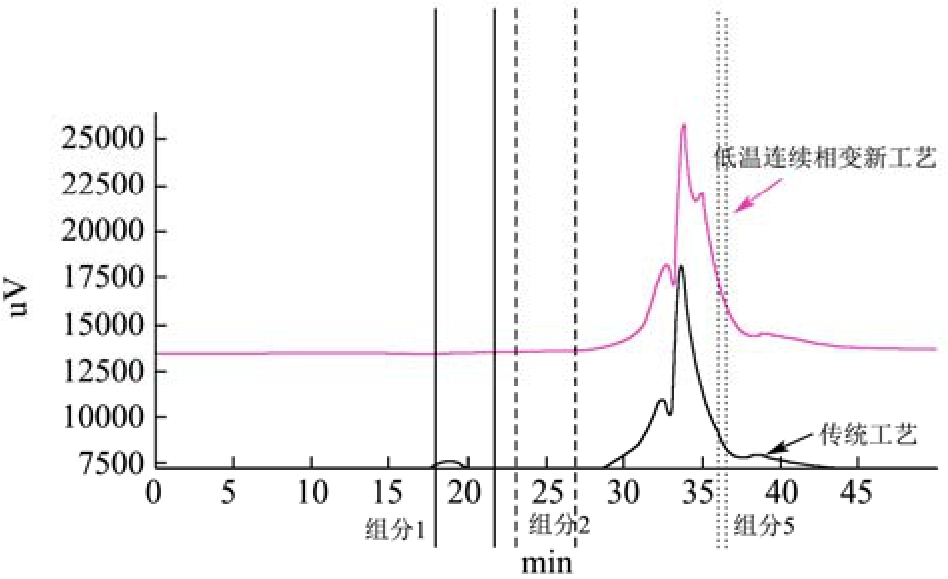
图1 低温连续相变萃取工艺灵芝水提液总糖GPC分析
Fig.1 GPC analysis of total sugar in Ganoderma lucidum water extract by low-temperature continuous phase change transition
2.5 低温连续相变萃取灵芝活性成分工艺水提液不同提取时间分子量段占比分析
分小时对低温连续相变萃取灵芝活性成分工艺水提液取样,通过 GPC测定各分子量段,发现组分 1(>3000000 u)、组分 2(614529 u)和组分 3(6812 u),随着提取时间的增加,其峰面积占比逐渐增加;组分4(2165 u),随着提取时间的增加,其峰面积占比增加后减小;组分5(1043 u)以及<500 u的组分,随着提取时间的增加,其峰面积占比逐渐减小(图2)。结果表明在低温连续相变萃取灵芝活性成分的水提液中,小分子组分的溶出时间先于比大分子组分的溶出时间。

图2 灵芝活性成分低温连续相变萃取工艺不同提取时间分子量段占比分析
Fig.2 Analysis of molecular weight fraction of Ganoderma lucidum active components in different extraction time during low-temperature continuous phase change transition process
3 结论
3.1 本研究以赤灵芝为原料,通过单因素试验和正交试验设计,确定低温连续相变萃取灵芝活性成分的最佳工艺条件。实验结果表明,低温连续相变水提灵芝活性的成分的最佳条件为:水提提取温度为100 ℃、解析温度为78 ℃、水提溶剂流速为30 L/h以及水提总时间为5 h;水提结束后进行醇提,各因素对灵芝总三萜提取影响程度的大小顺序为醇提浓度>醇提时间>醇提温度,最佳工艺条件为醇提提取温度为85 ℃,解析温度68 ℃,醇提溶剂流速为28 L/h以及醇提总时间为4 h。经验证,在该最佳工艺条件下,低温连续相变萃取灵芝固形物得率为 7.56%,总糖得率为1.14%,总三萜得率为1.17%,比传统工艺提取灵芝固形物、总糖和总三萜得率分别高 15.60%、23.91%和333.33%。采用低温连续相变工艺提取灵芝活性成分,具有萃取率高、萃取时间短、溶剂回收方便、损失率低且粗提物无需过滤等优点,且一套设备解决了对灵芝水溶性成分(灵芝总糖)和脂溶性活性成分(总三萜)的综合利用,大大提高了生产效率,该工艺在工业化大生产应用方面具有广阔的前景。
3.2 通过GPC分析不同提取工艺水提液中总糖的分子量分布及新工艺不同时间段总糖组分的分子量段占比,发现低温连续相变萃取灵芝活性成分工艺比传统工艺所提取的总糖组分要多出组分2和组分5。不同灵芝多糖的组成和结构与其生物学活性密切相关,故低温连续相变萃取灵芝所得各水提液组分的化学成分和生物学功能(如免疫调节、抗肿瘤、抗氧化、抗衰老等)有待进一步研究。
[1]Yang M, Wang X, Guan S et al.Analysis of triterpenoids in Ganoderma lucidum using liquid chromatography coupled with electrospray ionization mass spectrometry [J].J Am Soc Mass Spectr, 2007, 18(5): 927-939
[2]王彦松,顾明,赵杰东.灵芝药用研究进展[J].西南国防医药,2004,6:680-682
WANG Yansong, GU Ming, ZHAO Jiedong.Progress in medicinal research of Ganoderma lucidum [J].Strait Pharmaceutical Journal, 2004, 6: 680-682
[3]邓海林,吴佩颖,王建新.灵芝的研究进展[J].时珍国医国药,2005,2:141-143
DENG Hailin, WU Peiying, WANG Jianxin.Research progress of Ganoderma lucidum [J].Shizhen Chinese Medicine, 2005, 2: 141-143
[4]张汇,聂少平,艾连中,等.灵芝多糖的结构及其表征方法研究进展[J].中国食品学报,2020,20(1):290-301
ZHANG Hui, NIE Shaoping, AI Lianzhong, et al.Research progress on structure and characterization of Ganoderma lucidum polysaccharides [J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(1): 290-301
[5]周晓,王成忠,李双,等.灵芝中三萜类化合物的研究进展[J].齐鲁工业大学学报(自然科学版),2014,28(4):47-50
ZHOU Xiao, WANG Chengzhong, LI Shuang, et al.Research progress of Ganoderma lucidum triterpenoids [J].Journal of Qilu Universty of Technology (Natural Sciences),2014, 28(4): 47-50
[6]Guo X, Han J, Ye M, et al.Identification of major compounds in rat bile after oral administration of total triterpenoids of Ganoderma lucidum by high-performance liquid chromatography with electrospray ionization tandem mass spectrometry [J].J Pharmaceut Biomed, 2012, 63: 29-39
[7]Kubota T, Asaka Y, Miura I, et al.Structures of ganoderic acids A and B, two new lanostane type bitter triterpenes from Ganoderma lucidum (Fr.) Karst [J].Helvetica Chimica Acta,1982, 65(2): 611-619
[8]周国海,苗建银,刘飞,等.陈皮挥发油的低温连续相变萃取及特性分析[J].现代食品科技,2013,29(12):2931-2936
ZHOU Guohai, MIAO Jianyin, LIU Fei, et al.Extraction of volatile oil from tangerine peel by low-temperature continuous phase change transition and analysis of its properties [J].Modern Food Science and Technology, 2013,29(12): 2931-2936
[9]杨慧,周爱梅,夏旭,等.低温连续相变萃取广佛手精油及其组成分析[J].食品工业科技,2015,36(16):289-293
YANG Hui, ZHOU Aimei, XIA Xu, et al.Study on the extract technology and component analysis of bergamot essential oil by low-temperature continuous phase change transition [J].Science and Technology of Food Industry, 2015, 36(16):289-293
[10]杨小斌,周爱梅,王爽,等.低温连续相变萃取蓝圆鲹鱼油及其脂肪酸组成分析[J].食品工业科技,2016,37(23):291-297
YANG Xiaobin, ZHOU Aimei, WANG Shuang, et al.Study on the extraction of fish oil from Decapterus maruadsi by low-temperature continuous phase change transition and analysis on fatty acid composition [J].Science and Technology of Food Industry, 2016, 37(23): 291-297
[11]张志军,李淑芳,刘建华.灵芝多糖提取-水浸提条件的研究[J].天津农学院学报,2005,1:12-15
ZHANG Zhijun, LI Shufang, LIU jianhua.Study on extracting conditions of polysaccharides from Ganoderma lucidum [J].Journal of Tianjin Agricultural College, 2005, 1: 12-15
[12]王富山,周东辉.高锰酸钾滴定法测定食品中还原糖方法的改进[J].电大理工,2001,2:26-27
WANG Fushan, ZHOU Donghui.Improvement of potassium permanganate titration method for determination of reducing sugar in food [J].Radio and Television University Institute of Technology, 2001, 2: 26-27
[13]国家药典委员会.中华人民共和国药典[M].北京:中国医药科技出版社,2015
Chinese Pharmacopoeia Commission.Chinese Pharmacopoeia [M].Beijing: China Medical Science Press,2015
[14]任奕.灵芝中活性成分提取方法[J].农业科技与装备,2019,294(6):53-54
REN Yi.Extraction method of effective components from Ganoderma lucidums [J].Agricultural Science&Technology and Equipment, 2019, 294(6): 53-54
[15]操丽丽,周俊,郑峰,等.高压热水提取灵芝多糖及对其抗氧化活性的影响[J].食品科学技术学报,2018,36(2):58-62
CAO Lili, ZHOU Jun, ZHENG Feng, et al.Extraction of polysaccharide from Ganoderma lucidum by high pressure hot water and its effect on antioxidant activity [J].Journal of Food Science and Technology, 2018, 36(2): 58-62
[16]郑士彬,韩阳,韩静,等.响应面法优化灵芝三萜回流提取工艺[J].中南药学,2015,13(4):378-382
ZHENG Shibin, HAN Yang, HAN Jing, et al.Optimization of refluxing extraction technology of triterpenoids from Ganoderma lucidum by response surface methodology [J].Central South Pharmacy, 2015, 13(4): 378-382
[17]杨德,周明,郭鹏,等.不同浓度乙醇对灵芝功能成分浸出率的影响[J].食药用菌,2013,6:40-42
YANG De, ZHOU Ming, GUO Peng, et al.Effect of different concentration of ethanol on the extraction rate of functional components of Ganoderma lucidums [J].Edible and Medicinal Mushrooms, 2013, 6: 40-42
[18]Ma C, Feng M, Zhai X, et al.Optimization for the extraction of polysaccharides from Ganoderma lucidum and their antioxidant and antiproliferative activities [J].Journal of the Taiwan Institute of Chemical Engineers, 2013, 44(6):886-894
[19]朱玲,史吉平,王晨光,等.响应面法优化灵芝多糖的酶法提取工艺研究[J].食品工业科技,2016,37(24):238-244
ZHU Ling, SHI Jiping, WANG Chenguang, et al.Optimization of enzymatic extraction of polysaccharides from Ganoderma lucidum using response surface methodology [J].Science and Technology of Food Industry,2016, 37(24): 238-244
[20]Song C F, Wang S G, Yang J, et al.Optimization of vacuum-microwave radiation pretreatment on extraction of Ganoderma polysaccharides [J].Mathematical Problems in Engineering, 2015, 2015
[21]钱秀萍,杨庆尧,宋如景.灵芝三萜类化合物的提取[J].上海师范大学学报(自然科学版),1997,1:62-64
QIAN Xiuping, YANG Qingyao, SONG Rujing.Extraction of triterpenoids from Ganoderma lucidum [J].Journal of Shanghai Teachers Universty (Natural Sciences), 1997, 1:62-64
[22]杨慧,戴军,陈尚卫,等.灵芝子实体多糖的分离纯化、组成及其免疫活性研究[J].食品与机械,2015,1:132-136
YANG Hui, DAI Jun, CHEN Shangwei, et al.Study on isolation, purification, composition and immulogical characterics of Ganoderma lucidum body polysaccharides [J].Food & Machinery, 2015, 1: 132-136