藜麦(Chenopodium quinoa Willd.),又称南美藜、藜谷、奎奴亚藜等,为一年生藜科草本作物。藜麦原产于南美洲安第斯山脉高海拔(2800~4200 m)地区,在当地有超过5000年的种植历史,因其丰富的营养和多样的保健功能而被称为 “ 谷物之母 ” [1]。现代研究确认,藜麦中蛋白质含量高,富含淀粉、矿质元素及维生素,且氨基酸组成均衡,能够满足人体所必需的营养元素[2],长期食用藜麦,不仅对高血糖、高血脂、心脏病等疾病具有良好的辅助治疗作用,而且可以增强体力、提高免疫力、完善营养结构[3]。
藜麦的功能成分包括多酚,皂苷,黄酮及多糖等[4],藜麦总多酚中含有酚酸、香草酸、阿魏酸及其衍生物、槲皮素、山奈酚及其苷类等,藜麦总多酚具有较强的抗氧化活性[5]。藜麦中含有种类丰富的皂甙,近年来研究确认,皂苷对人体健康有益,许多传统中药材的有效成分都是皂苷,皂苷具有降低胆固醇、抑菌、抗肿瘤等多种活性[6]。
随着经济发展和生活品质的提升,亚洲女性对美白的需求日益增加。目前研发的具有美白效果的护肤品多通过添加具有美白功效的化学合成物质来实现。如氢醌,熊果苷,曲酸和BHT(2,6-二叔丁基-4-甲基苯酚)等[7],但是在使用过程中发现,伴随快速的美白效果而来的是一系列的副作用,如细胞毒性等[8]。因此,化妆品的安全性日益受到重视,来源于植物中的天然美白物质因其较低的副作用而愈受关注。黑色素形成是一个复杂的过程,其中酪氨酸酶作为黑色素合成中的关键酶异常重要[9]。已有研究确认,藜麦麸皮皂苷能够抑制酪氨酸酶活性,是一种有待开发的天然美白物质[10],但对其作用机制缺乏研究。
基于以上分析,本研究收集藜麦,通过超声辅助提取结合正交实验探索藜麦皂苷的最佳提取方法,在此基础上,培养B16细胞,验证藜麦皂苷对B16细胞黑色素合成的影响,进一步测定细胞内酪氨酸酶的活性,并探究藜麦皂苷对B16细胞黑色素合成的影响机制。获得的数据能够为藜麦皂苷作为一种美白成分在化妆品上的应用提供支撑。
1 材料与方法
1.1 实验材料
藜麦采集自四川省农业科学院阿坝州理县栽培试验基地,品种为 “ 陇藜1号 ” 。中药材粉碎机粉碎后过60目筛,置于通风阴凉处保存备用;B16小鼠黑色素瘤细胞,购买自中国科学院细胞库。
磷酸盐缓冲液(PBS)购买自上海麦克林生化科技有限公司;细胞培养相关试剂(包括DMEM培养基、胎牛血清),购自美国Gibco公司;聚乙二醇辛基苯基醚溶液(Triton X-100)、左旋多巴溶液(Levodopa,L-DOPA)、α-黑色素细胞刺激素(α-MSH)购自Sigma公司;小眼畸型相关转录因子(MITF)一抗、酪氨酸酶一抗、内参GAPDH一抗及对应的二抗,购于Abcam公司。
石油醚、甲醇、高氯酸等试剂购于成都市科龙化工试剂厂;其余试剂均为分析纯级。
1.2 仪器与设备
MCO-15AC CO2细胞培养箱,日本SANYO公司;Spectra max plus 384酶标仪,美国Molecular Devices公司;LSC plus真空冷冻干燥机美国,德国Christ公司;IX73倒置显微镜,日本Olympus公司;N1200-B旋转蒸发仪,日本东京理化公司;VOSHIN-1000W超声波清洗器,无锡沃信仪器有限公司。
1.3 方法
1.3.1 藜麦皂苷的提取
标准品选用齐墩果酸,称取齐墩果酸标准品5 mg,溶解于无水甲醇中,定容至25 mL容量瓶中,最终获得标准品溶液,溶度为0.2 mg/mL。依次准确吸取0、0.1、0.2、0.3、0.4、0.5、0.6 mL的标准品溶液于具塞试管中,水浴挥干液体并静置冷却。加入显色剂5%的香草醛-冰乙酸0.2 mL和0.8 mL的高氯酸,并通过漩涡震荡混匀。70 ℃水浴15 min,静置冷却后加入5 mL冰醋酸,反应20 min,测定波长545 nm处的吸光值,以吸光值为纵坐标,以标品浓度(mg/mL)为横坐标,绘制标准曲线。总皂苷含量计算公式如下:
式中:C:总皂苷浓度(mg/mL),基于标准曲线计算得出;V:提取液的总体积(mL);m:样品质量(g)。
称取粉碎后过60目筛的藜麦1 g,加入40倍体积的石油醚过夜脱脂。抽滤并烘干收集藜麦。选取对藜麦种子皂苷提取量影响较为显著的料液比、乙醇浓度、超声时间3个因素,设计三因素三水平正交实验,如表1所示。测定藜麦皂苷的得率。
表1 正交实验因素水平表
Table 1 Factors and levels of orthogonal test
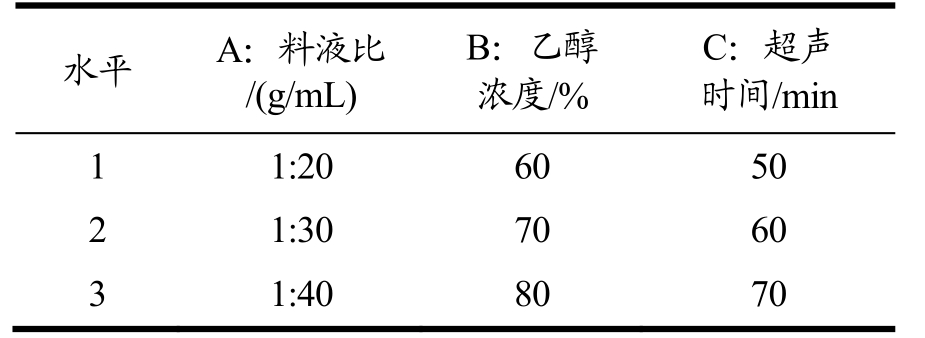
水平 A:料液比/(g/mL)B:乙醇浓度/%C:超声时间/min 1 1:20 60 50 2 1:30 70 60 3 1:40 80 70
1.3.2 B16细胞活性测定
取对数期生长的B16细胞,按照3×104个/mL的浓度接种于96孔板中,每孔100 μL培养液。37 ℃,5% CO2环境中培养24 h。弃去上清液,每孔添加含有不同浓度藜麦皂苷(12.5、25、50、100、200、400和800 μg/mL)的完全平培养液100 μL,对照组设定为不含藜麦皂苷样品的同体积培养液,空白孔不接种细胞只加100 μL培养基,每组设定3个重复。采用CCK8法测定细胞活性。上述细胞于37 ℃,5% CO2环境中继续培养24 h、48 h、72 h,每孔加入10 μL CCK-8溶液,培养4 h后,测定450 nm处的吸光值,用空白孔调零,测定并计算细胞活力[11]。细胞活力的计算公式如下:
1.3.3 藜麦皂苷对B16细胞黑色素含量的影响
采用NaOH溶解法测定B16细胞的黑色素含量[12]。取对数期生长的B16细胞,调整细胞浓度接种于6孔板(3×104个/孔)。37 ℃,5% CO2环境中培养24 h。吸弃培养液,加入不同浓度的藜麦皂苷,处理同1.3.2,每孔加入1 mL。上述细胞于37 ℃,5% CO2环境中继续培养24 h、48 h、72 h,后用PBS缓冲液冲洗3次。之后加入2 mL浓度为0.2 mol/L的NaOH溶液,80 ℃水浴1 h,彻底溶解细胞团块。测定492 nm处的吸光值,黑色素相对含量计算公式如下:
1.3.4 藜麦皂苷对B16细胞酪氨酸酶活性的影响
细胞培养及处理方法同1.3.2。藜麦皂苷处理后的细胞继续培养24 h、48 h、72 h,吸弃培养液,后用PBS缓冲液冲洗3次。加入50 μL细胞裂解液1% Triton X-100,低温冷冻1 h,取出后室温融化。37 ℃孵育并加入10 μL浓度为1%的L-DOPA溶液,反应1 h[13]。测定492 nm处的吸光值,酪氨酸酶相对活力计算公式如下:

1.3.5 黑色素形成作用通路探索
采用免疫印迹法(Western blot)测定B16细胞黑色素形成过程中关键蛋白表达情况[14]。B16细胞接种于6孔板,用含有浓度为10 nmol/L的α-MSH和藜麦皂苷共处理48 h。空白组只添加培养液,模型组为包含10 nmol/L α-MSH的培养液。处理48 h后,操作依次包括RIPA裂解B16细胞,采用Lowry法定量蛋白,进行SDS-聚丙烯酰胺凝胶电泳(SDS-PAGE),之后转膜并进行免疫反应,一抗的稀释浓度参考说明书,选择GADPH做二抗,最后通过ECL显色并于凝胶成像系统中观察。
1.3.6 统计方法
所有实验重复三次,所得数据均用SPSS 17.0软件分析,采用mean±SD表示,差异的显著性用t-test检验,以p<0.05表示差异有统计学意义。
2 结果与分析
2.1 藜麦皂苷最适提取条件
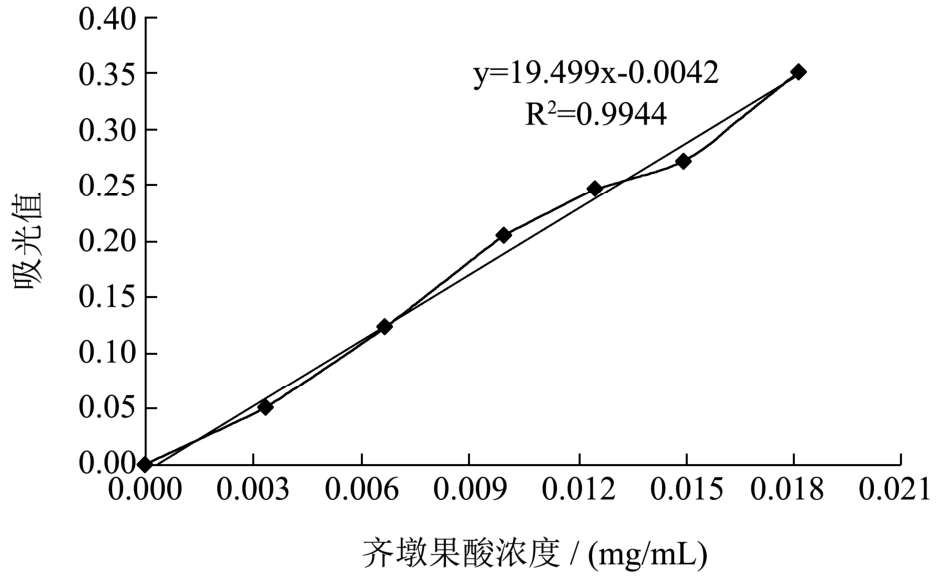
图1 齐墩果酸标准曲线
Fig.1 The standard curve of oleanolic acid
以齐墩果酸标准品浓度(mg/mL)为横坐标X,以对应的吸光值为纵坐标Y,绘制标准曲线如图1所示,得到的标准方程为y=19.449x-0.0042,R2=0.9944。
通过不同料液比,结合不同乙醇浓度和超声提取时间进行正交实验,获得藜麦皂苷的得率如表2。实验条件下藜麦皂苷的得率在0.73%~1.72%之间,影响得率的主要因素为提取时的乙醇浓度(B),最佳提取条件为A3B2C2,即料液比设定为1:40,70%浓度的乙醇下超声60 min,在此条件下,进行实验,最终获得的得率为1.78%,即17.85 mg/g。
皂苷的提取方法有多种,本实验采用超声波辅助提取法,其操作简单,易于控制;相较于传统的溶剂提取法,超声处理能够加快皂苷成分的浸出,提高工作效率[15]。
表2 L9(34)正交实验结果
Table 2 Results of L9(34) orthogonal experiment

因素实验号A料液比/(g/mL) B乙醇浓度/% C超声时间/min D 得率/(mg/g)水平1 1 1 1 0 7.31±0.22 2 1 2 2 0 17.21±0.84 3 1 3 3 0 12.88±0.86 4 2 1 2 0 9.85±0.66 5 2 2 3 0 12.16±0.43 6 2 3 1 0 10.13±0.62 7 3 1 3 0 11.95±0.58 8 3 2 1 0 15.57±0.91 9 3 3 2 0 11.09±0.81 k1 12.47 9.70 11.00 0 k2 10.71 14.98 12.72 0 k3 12.87 11.37 12.33 0 R 2.16 5.28 1.72 0主次因素 B>A>C最佳组合 A3B2C2
2.2 藜麦皂苷对B16细胞活性的影响
藜麦皂苷作用B16细胞后,细胞活性如表3所示。作用浓度和处理时间会影响藜麦皂苷对B16细胞增殖的抑制作用。低浓度的藜麦皂苷对B16细胞的活性无显著抑制作用,藜麦皂苷浓度介于12.5~200 μg/mL时,最长72 h的处理时间内,B16细胞活力未见明显下降。随着浓度的增加,藜麦皂苷对B16细胞表现出一定的抑制作用。400 μg/mL的藜麦皂苷会显著抑制B16细胞的活性,该浓度下处理24 h,B16细胞的活力降低至92.32%,而800 μg/mL的藜麦皂苷会呈现极显著的差异,72 h后细胞活力仅为87.51%。浓度为100 μg/mL的熊果苷(阳性对照)同样极显著的抑制B16细胞的活性,处理24 h后,细胞活力降至84.49%。上述结果表明,低浓度的藜麦皂苷(≤200 μg/mL)对B16细胞的细胞活性无显著影响。
表3 藜麦皂苷对B16细胞细胞活力的影响
Table 3 Effects of Quinoa saponins on cell viability of B16 cells

注:与对照组相比,*p<0.05,**p<0.01。
?
2.3 藜麦皂苷对B16细胞黑色素含量的影响
藜麦皂苷作用B16细胞后对其黑色素含量的影响如表4所示。基于藜麦皂苷对B16细胞活力的测定,选定藜麦皂苷浓度为12.5、25、50、100和200 μg/mL进行黑色素含量的测定,在此设定浓度下,B16细胞的活性不会受到明显抑制。实验设定的最低浓度的藜麦皂苷对B16细胞黑色素合成没有明显的抑制作用。25 μg/mL的藜麦皂苷只在培养72 h时表现出抑制作用。随着藜麦皂苷浓度的增加,抑制作用逐渐加强,200 μg/mL的藜麦皂苷处理B16细胞72 h,使得细胞内黑色素含量为73.85%,即藜麦皂苷对黑色素生成量的抑制率达26.15%。因此,藜麦皂苷是一种潜在的黑色素合成抑制剂。
表4 藜麦皂苷对B16细胞黑色素合成的影响
Table 4 Effect of Quinoa saponins on melanin synthesis in B16 melanoma cells

注:数值为3个重复的平均值±标准误,同列中不同小写字母表示5%差异显著性水平,下同。
样品 浓度/(μg/mL) 黑色素相对含量/%24 h 48 h 72 h对照组 - 100a 100a 100a藜麦皂苷12.5 97.85±1.81a 97.02±1.79a 97.36±1.64a 25 97.53±1.74a 97.78±1.23a 95.09±1.74b 50 94.48±1.35b 94.09±1.81b 93.78±0.82c 100 90.17±1.31c 89.92±1.05c 90.02±1.12d 200 85.25±0.88d 78.36±1.14d 73.85±1.07e
表5 藜麦皂苷对B16细胞酪氨酸酶活力的影响
Table 5 Effect of Quinoa saponins on cellular tyrosinase activity in B16 melanoma cells
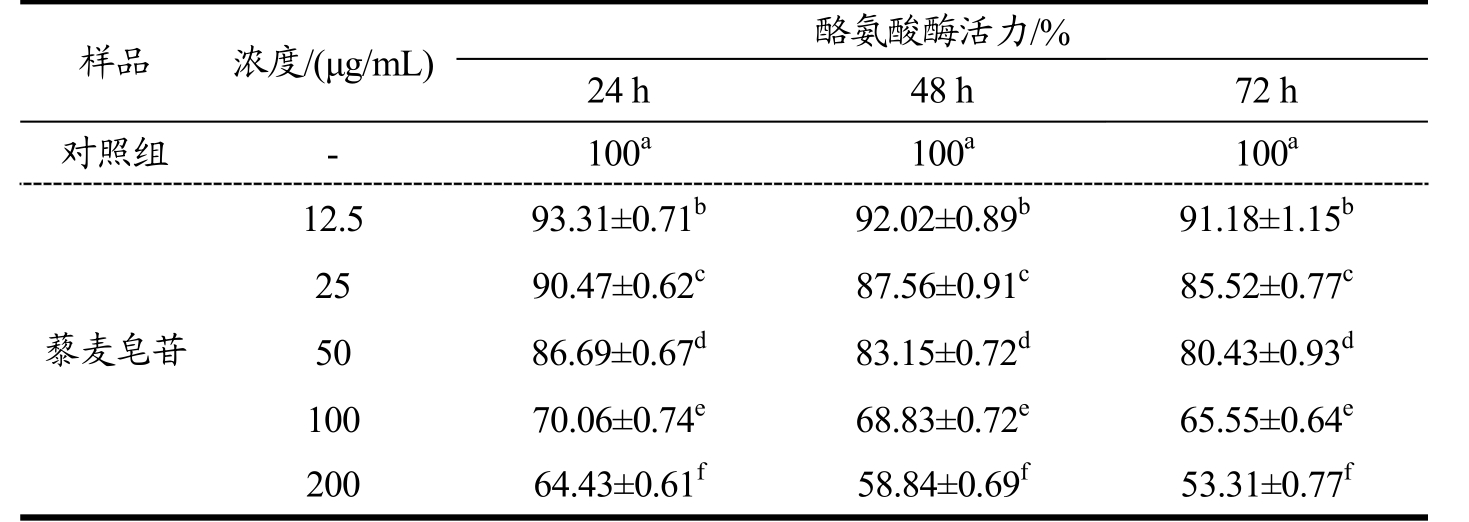
样品 浓度/(μg/mL) 酪氨酸酶活力/%24 h 48 h 72 h对照组 - 100a 100a 100a藜麦皂苷12.5 93.31±0.71b 92.02±0.89b 91.18±1.15b 25 90.47±0.62c 87.56±0.91c 85.52±0.77c 50 86.69±0.67d 83.15±0.72d 80.43±0.93d 100 70.06±0.74e 68.83±0.72e 65.55±0.64e 200 64.43±0.61f 58.84±0.69f 53.31±0.77f
2.4 藜麦皂苷对B16细胞酪氨酸酶活性的影响
如表5所示,与对照组相比,藜麦皂苷对B16细胞酪氨酸酶活性具有显著的抑制作用。在实验设定的浓度范围内,12.5 μg/mL的藜麦皂苷处理24 h,酪氨酸酶活力降低至93.31%,与对照组呈现显著差异(p<0.05)。随着藜麦皂苷浓度的增大及处理时间的增长,B16细胞酪氨酸酶活性逐步降低,呈现剂量依赖关系。实验设定范围内,藜麦皂苷对B16细胞酪氨酸酶活性抑制率为6.69%~46.69%。
人体皮肤中的黑色素是由黑色素细胞产生,可以通过细胞的树突结构转移至角质形成细胞中,并且能够重新排列分布,因此,伴随角质形成细胞的分化,黑色素可以向上迁移,最终迁移至皮肤角质层,在皮肤表面形成了色素沉积[16]。目前,已有学者探索了黑色素的合成过程,首先,黑色素细胞中的酪氨酸在酪氨酸酶(TYR)的催化作用下与多巴反应,氧化生成多巴醌,多巴醌异构化形成多巴色素,多巴色素进一步通过2条通路反应。其一,多巴色素脱羧并在TYR的作用下生成5,6-吲哚醌;其二,多巴色素在TRP-2的作用下,形成5,6-二羟基吲哚羧酸,进一步在TRP-1的催化下生成5,6-吲哚醌羧酸,5,6-吲哚醌和5,6-吲哚醌羧酸最终形成真色素。因此,酪氨酸酶在整个反应中作用重大,抑制酪氨酸酶的活性就能够有效抑制黑色素的形成[17]。在本实验中,12.5 μg/mL的藜麦皂苷对酪氨酸酶活性的抑制率为6.69%,200 μg/mL的藜麦皂苷处理72 h后,抑制率达到46.69%,具有较好的抑制作用。
2.5 藜麦皂苷对小眼畸型相关转录因子(MITF)及酪氨酸酶(TYR)蛋白表达的影响
如图2所示,α-黑色素细胞刺激素(α-MSH)作用后,细胞内(模型组)MITF和TYR的蛋白表达明显增加,分别为空白组的123%和112%。25 μg/mL藜麦皂苷处理后,MITF的相对表达量为模型组的59%,TYR则为74%。随着藜麦皂苷浓度的增加,细胞内MITF和TYR的表达量明显降低,当藜麦皂苷浓度达到200 μg/mL时,MITF和TYR的蛋白表达降至44%和49%,与模型组呈现极显著差异。
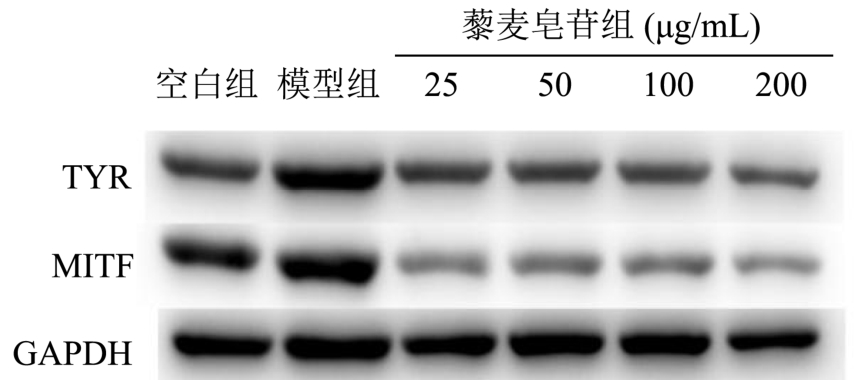
图2 藜麦皂苷对B16细胞TYR及MITF蛋白表达的影响
Fig.2 Effects of quinoa saponins on the expression of TYR and MITF proteins in B16 cells
表6 藜麦皂苷对B16细胞TYR及MITF蛋白表达的影响(mean±SD)
Table 6 Effects of quinoa saponins on the expression of TYR and MITF proteins in B16 cells (mean±SD)
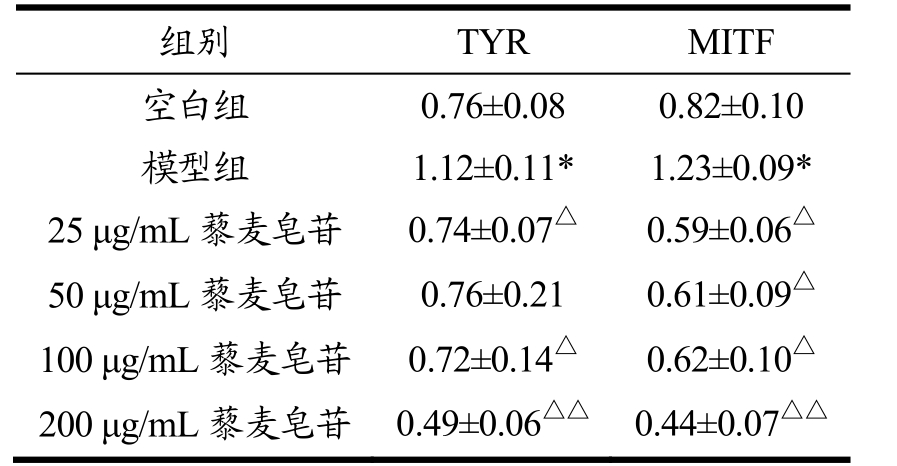
注:与对照组相比,*p<0.05;与模型组相比,△p<0.05,△△p<0.01。
组别 TYR MITF空白组 0.76±0.08 0.82±0.10模型组 1.12±0.11* 1.23±0.09*25 μg/mL藜麦皂苷 0.74±0.07△ 0.59±0.06△50 μg/mL藜麦皂苷 0.76±0.21 0.61±0.09△100 μg/mL藜麦皂苷 0.72±0.14△ 0.62±0.10△200 μg/mL藜麦皂苷 0.49±0.06△△ 0.44±0.07△△
相关研究表明,植物源的天然产物,如酚类、多糖类、黄酮类、有机酸、挥发油、三萜皂苷类等都具有酪氨酸酶(TYR)抑制活性,是天然美白剂的理想原材料[18]。Lee等的研究结果表明,人参皂苷能够显著抑制B16细胞的黑色素生成,起作用通路涉及抑制MITF和TYR的表达,作用通路与本研究一致[19]。Kim等学者获得了裂叶月见草甲醇提取物,测定发现提取物浓度为50 μg/mL时,细胞黑色素含量下降了近35.50%,酪氨酸酶活力下降22.60%[20],其剂量的作用效果与本实验藜麦皂苷相当。文冠果壳皂苷[21],蒺藜皂苷[13],海参水煮液皂苷[22]等都发现酪氨酸酶抑制活性,从天然动植物中提取皂苷用作美白成分,既符合当前以天然药物为美容成分的发展趋势,同时又能有效提高农产品的经济价值。
小眼畸形相关转录因子(MITF)是一种含有碱性螺旋-环-螺旋亮氨酸拉链结构的转录因子,作为一种色素沉积的主要调节因子而存在[23]。MITF可以调控TYR、TYRP-1和TYRP-2等与细胞黑色素的形成相关基因的转录。本实验中用到的α-黑色素细胞刺激素(α-MSH)是一种由13个氨基酸组成的神经内分泌激素,其生理功能主要是促黑色素细胞分裂。通常情况,黑色素细胞在α-MSH作用下与受体黑素皮质激素受体1(melanocortin 1 receptor,MC1R)结合,启动下游腺苷酸环化酶途径和蛋白脂酶C途径,介导黑色素合成的信号转导过程。因此,黑色素生成过程中,除了TYR的活性,一般也会监控MITF的表达。本实验确认,高浓度的藜麦皂苷(200 μg/mL)能显著抑制MITF的表达,阻断黑色素的合成。
近年来,亚洲女性对于美白的需求持续增长,此外,对于功效专注于美白的化妆品及药品的安全性要求也不断增高。相较于曲酸、氢醌等具有细胞毒性需严格控制用量的快速美白的物质,多糖类、三萜皂苷类等温和、绿色的天然美白剂也广受欢迎。目前,许多国内外研究都表明化妆品中的大部分美白成分都具有酪氨酸酶抑制活性或/和黑色素合成抑制活性,通过抑制酪氨酸酶活性,阻断或减缓真黑色的形成,从而实现美白功能。因此,寻找安全的酪氨酸酶抑制剂,将成为今后美白化妆品研发过程中的一种新潮流。
3 结论
本实验分离提取藜麦皂苷并验证其酪氨酸酶抑制活性。采用超声波辅助提取法,获得最佳提取条件为料液比1:40(g/mL),70%浓度的乙醇下超声60 min,在此条件下,获得得率为17.85 mg/g。低浓度的藜麦皂苷对于B16细胞没有明显的杀伤作用,但却能显著抑制酪氨酸酶活性,最强抑制率为46.69%,并减少细胞黑色素的形成,最强抑制率为26.15%,藜麦皂苷抑制黑色素形成的作用通路涉及TYR-MITF,能显著抑制TYR和MITF的表达。因此,藜麦皂苷能够作为一种美白成分应用于化妆品中。
[1] 王黎明,马宁,李颂,等.藜麦的营养价值及其应用前景[J].食品工业科技,2014,35(1):381-384,389
WANG Li-ming, MA Ning, LI Song, et al.Nutritional properties of quinoa and its application prospects [J].Sci Tech Food Ind, 2014, 35(1): 381-384, 389
[2] Oshodi A A, Ogungbenle H N, Oladimeji M O.Chemical composition, nutritionally valuable minerals andfunctional properties of benniseed (Sesamumradiatum), pearl millet(Peraraisetumtyphoides) and quinoa (Chenopodium quinoa)flours [J].Int J Food Sci Nutr, 1999, 50(5): 325-331
[3] Comai S, Bertazzo A, Bailoni L, et al.The content of proteic and non-proteic (free and protein-bound) typtophan in quinoa and cereal flours [J].Food Chem, 2007, 100(4): 1350-1355
[4] Ogungbenle H N.Nutritional evaluation and functional properties of quinoa (Chenopodium quinoa) flour [J].Int J Food Sci Nutr, 2003, 54(2): 153-158
[5] 阙淼琳,蒋玉蓉,曹美丽,等.响应面试验优化藜麦种子多酚提取工艺及其品种差异[J].食品科学,2016,37(4):7-12
QUE Miao-lin, JIANG Yu-rong, CAO Mei-li, et al.Optimization of polyphenols extraction from quinoa grains by response surface methodology and differences in polyphenol content among different varieties [J].Food Sci,2016, 37(4): 7-12
[6] 黄金,秦礼康,石庆楠,等.藜麦皂苷提取及萌芽对皂苷含量的影响[J].中国粮油学报,2017,32(11):34-39,46
HUANG Jin, QIN Li-kang, SHI Qing-nan, et al.Effect of quinoa saponins extraction and sprouting on saponins content[J].J Chin Cereals OilsAssoc, 2017, 32(11): 34-39, 46
[7] Nico S, Jana V, Stan P.The hunt for natural skin whitening agents [J].Int J MolSci, 2009, 10: 5326-5349
[8] 杜国英.孜然提取物对酪氨酸酶活性的抑制作用及对B16黑色素瘤细胞内黑色素生成的影响[D].兰州:兰州理工大学,2018
DU Guo-ying.Inhibitory effects of extracts from Cuminum cyminum L.on tyrosinase and melanogenesis in B16 melanoma cells [D].Lanzhou: Lanzhou University of Technology, 2018
[9] Chen M J, Hung C C, Chen Y R, et al.Novel synthetic kojic acid-methimazolederivatives inhibit mushroom tyrosinase and melanogenesis [J].J Biosci Bioeng, 2016, 122(6):666-672
[10] Medina-Meza I G, Aluwi N A, Saunders S R, et al.Profiling of triterpenoid saponins from 28 quinoa varieties(Chenopodium quinoa Willd) grown in Washington state by GC-MS [J].J Agr Food Chem, 2016, 64(45):8583-8591
[11] Satooka H, Cerda P, Kim H J, et al.Effects of matsutake mushroom scent compounds on tyrosinase and murine B16-F10 melanoma cells [J].Biochem Bioph Res Co, 2017:487(4): 840-846
[12] Lee S C, Chen C H, Yu C W, et al.Inhibitory effect of Cinnamomum osmophloeum Kanehira ethanol extracts on melanin synthesis via repression of tyrosinase expression [J].J Biosci Bioeng, 2016, 122(3): 263-269
[13] 张丽宏,安丽凤,黄敬文,等.蒺藜皂苷对人黑素瘤A375细胞酪氨酸酶和小眼相关转录因子表达的影响[J].中医药信息,2017,34(2):18-21
ZHANG Li-hong, AN Li-feng, HUANG Jing-wen, et al.Effect of Thistle saponins on TYR and MITF mRNA expressions of A375 cells [J].Inform Tridit Chin Med, 2017,34(2): 18-21
[14] 杜斌,许冬梅,张亚玲,等.miR-146a抑制酪氨酸酶基因家族在小鼠黑色素细胞中表达[J].中国生物化学与分子生物学报,2017,33(1):81-87
DU Bin, XU Dong-mei, ZHANG Ya-ling, et al.miR-146a inhibits the expression of tyrosinase gene family in mouse melanocytes cells [J].Chin J Biochem Mol Biol, 2017, 33(1):81-87
[15] 房垚.藜麦种子皂苷的提取、纯化及其体外抑菌、抗癌活性研究[D].长春:吉林农业大学,2019
FANG Yao.Extraction and purification of saponins from quinoa seeds and its antimicrobial, anticancer activities in vitro [D].Changchun: Jilin Agricultural University, 2019
[16] 叶希韵,朱萍亚.黑色素的合成与美白产品的研究进展[J].华东师范大学学报(自然科学版),2016,2016(2):1-8
YE Xi-yun, ZHU Ping-ya.A review of the studies on melanin synthesis and whitening products [J].J East Chin Norm Univ(Nat Sci), 2016, 2016(2): 1-8
[17] Wang Z J, Xu W, Liang J W, et al.Effect of fucoidan on B16 murine melanoma cell melanin formation and apoptosis [J].Afr J Tradit Complement Altern Med, 2017, 14(4): 149-155
[18] 王小燕.传统中药及植物美白成分作用机理及其在化妆品中的应用[J].轻工标准与质量,2019,4:104,110
WANG Xiao-yan.Action mechanism of traditional Chinese medicine and plant whitening ingredients and their application in cosmetics [J].Stand Qual Light Ind, 2019, 4:104, 110
[19] Lee S J, Lee W J, Chang S E, et al.Antimelanogenic effect of ginsenoside Rg3 through extracellular signal-regulated kinase-mediated inhibition of microphthalmia-associated transcription factor [J].J Ginseng Res, 2015, 39(3): 238-242
[20] Kim S E, Lee C M, Kim Y C.Anti-melanogenic effect of Oenothera laciniata methanol extract in melan-a cells [J].Toxicol Res, 2017, 33(1): 55-62
[21] 张洪梅,周泉城.文冠果壳皂苷提取物抑制酪氨酸酶活性的研究[J].中国粮油学报,2013,28(5):53-56
ZHANG Hong-mei, ZHOU Quan-cheng.Inhibitory effect of saponin consituents from Xanthoceras nutshell on tyrosinase activity [J].J Chin Cereals OilsAssoc, 2013, 28(5): 53-56
[22] 程璐,谢翔,刘中原,等.海参水煮液皂苷的美白抗衰老功效[J].精细化工,2018,35(2):267-271
CHENG Lu, XIE Xiang, LIU Zhong-yuan, et al.Research on whitening and antisenility efficacy of saponins from sea cucumber cooking water [J].Fine Chem, 2018, 35(2):267-271
[23] Ko H H, Tsai Y T, Yen M H, et al.Norartocarpetin from a folk medicine Artocarpus communis plays a melanogenesis inhibitor without cytotoxicity in B16F10 cell and skin irritation in mice [J].Bmc Complem Altern M, 2013, 13(1):348