随着日益增长的人民生活水平与人口老龄化,动脉粥样硬化、冠心病等心血管疾病发病率也呈上升趋势,成为目前导致人类死亡的重要原因之一,严重危害到国家与人民的生命财产。目前为止,美国和加拿大由于心血管疾病造成的经济损失已分别达4031亿美元和222亿美元。据世卫组织预测,到2030年,由 心血管疾病造成的死亡人数将高达2300万,是造成人类死亡的主要原因[1]。引起该类疾病的主要诱因是体内的高胆固醇含量,而且过量胆固醇也会引起非酒精性脂肪肝等疾病[2]。当血脂中的总胆固醇减少时,患心血管疾病的风险也随之减少[3]。因此,如何有效控制胆固醇摄入,降低人体中胆固醇水平是人们关注的重点,也是研究的热点之一。目前常用的降胆固醇药物为依齐麦布及他汀类药物,但此类药物价格高昂,还会产生一定的副作用[4]。大量研究发现,益生菌及其产品可降低体内的血清胆固醇水平,降低患病几率[5]。益生菌被定义为活的微生物,当摄入适量的益生菌时,对宿主的肠道菌群可产生积极影响,能够刺激或调节免疫反应,减少炎症或过敏反应,因此,将益生菌作为生物治疗药物也成为研究热点。然而目前益生菌降胆固醇的机理还未完全解析清晰,但大量研究表明,益生菌降胆固醇与其在生长过程中产生的胆盐水解酶(Bile salt hydrolase,BSH)密切相关[6]。本文通过介绍胆固醇、胆盐水解酶的特性与功能,并总结BSH降胆固醇机制,以期为益生菌的开发应用提供理论基础和依据。
1 胆固醇
胆汁是一种黄绿色溶液,其主要成分包括胆汁酸、胆固醇、磷脂和胆色素等,其中,胆汁酸含量最多,可用作脂质的生物洗涤剂,在脂肪消化中起重要作用[7]。胆汁酸主要由在肝脏中从头合成的初级胆汁酸和在肠道中由初级胆汁酸生成的次级胆汁酸构成,在正常条件下通过沿肠道的被动扩散和在回肠末端的主动转运而被吸收[8]。胆汁酸是信号传导分子,可结合其他蛋白激活宿主体内代谢及炎症相关基因的表达,调节宿主代谢。在碱性胆汁中,胆汁酸常以钾盐或钠盐的形式存在,因此又简称胆盐,负责宿主脂肪的消化和吸收。
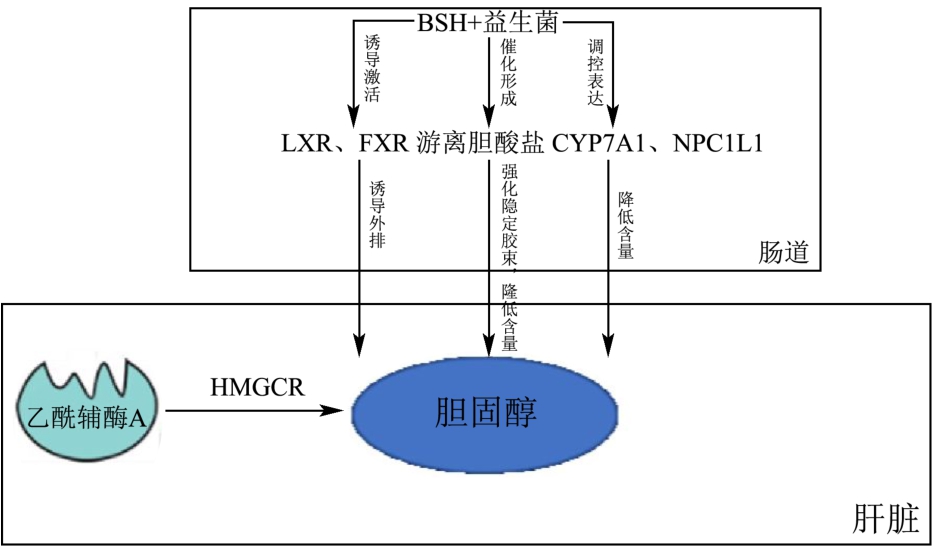
图1 体内胆固醇合成代谢过程
Fig.1 Process of cholesterol metabolismin vivo
注:LXR::Liver X receptor,肝脏X受体;FXR:Franesoid X receptor,法尼醇X受体;HMGCR:羟甲基戊二酸单酰辅酶A还原酶;CYP7A1:胆固醇7α-烃化酶;NPC1L1:Niemann-Pick C1-like 1靶点。
胆固醇广泛存在于动物体内,对于细胞膜的结构和维护是至关重要的,是组织细胞不可或缺的重要物质,也是合成胆酸和性激素等类固醇激素的重要原料,可促进脂肪的消化[9]。人体胆固醇的来源主要分为外源性和内源性。外源性来源主要指通过对外源食物例如动物器官和禽类动物的摄入;内源性来源主要指通过人体器官合成的胆固醇。因此,不同的器官所含胆固醇含量也有所不同[10]。肝脏是胆固醇代谢的主要调节部位,在肝脏中,以乙酰辅酶A为原料,以羟甲基戊二酸单酰辅酶A还原酶(HMGCR)为关键限速酶,对胆固醇进行合成与分解代谢,并向胆汁分泌大量甾醇[11,12]。正常人体血液中胆固醇含量为2.82~5.95 mmol/L[13]。胆固醇水平失衡会导致多种疾病,威胁宿主健康。胆固醇水平低于正常值时,导致血管壁变脆弱,易引起脑出血,不仅如此,也会使得机体对异物的清除能力显著下降,增加致癌率。胆固醇水平过高时,容易引起肥胖,形成动脉硬化斑块,是心血管疾病的高危因素[14]。总胆固醇水平每增加1 mmol/L,冠心病的患病风险便升高35%,相比之下,总血清胆固醇水平下降1%,心血管疾病的发病率便可下降2%~3%[15]。因此,体内胆固醇水平是心血管疾病发病率的主要决定因素,有效控制体内胆固醇水平对于维持机体健康是至关重要的。如今常采用他汀类药物控制胆固醇水平,但药物价格昂贵且易带来副作用[4],由于益生菌产品具有绿色安全,价格优惠等特点,已被广泛用于控制人体胆固醇水平。大量研究表明,使得益生菌起到降胆固醇作用的主要物质是其菌体内的胆盐水解酶[16]。
2 胆盐水解酶
胆盐是由肝脏中的胆固醇在合成限速酶CYP7A1催化下合成的,也是体内排泄胆固醇的主要途径[17]。胆盐可促进肠道对膳食脂肪和脂溶性维生素的消化和吸收[1]。胆盐水解酶(BSH)是肠道微生物在生长过程中产生的一类代谢产物,可催化水解结合胆盐,属于Ntn-CGH蛋白家族,其氨基酸序列与青霉素V酰化酶高度保守[18]。BSH可通过水解酰胺键产生游离氨基酸和游离态胆汁酸来催化水解结合胆汁酸,此反应在小肠胆汁酸代谢中至关重要,也是BSH影响机体生理的重要原因[19]。
BSH主要分布于革兰氏阳性的肠道细菌中,例如乳酸菌属、双歧杆菌属、梭状芽孢杆菌属等[20],不同来源的BSH酶活性存在着差异,在pH环境为3.5~6,37~45 ℃时活性最佳。然而BSH活性不仅与pH、温度等环境条件相关,也与活性位点相关[21]。据报道,其主要活性位点包括Cys2、Arg18、Asp21、Asn175以及Arg228。其中Cys2具有高度保守性,也是目前已被证实的经过定点诱变的残基,对BSH活性至关重要[8]。BSH可特异性识别底物的氨基酸基团并进行水解,目前已鉴定的BSH底物谱较窄,主要包括甘氨结合胆盐和牛磺结合胆盐,且大多BSH在水解甘氨结合胆盐时表现出更高的活性[22-24],这可能与牛磺结合胆盐中硫原子引起的位阻有关[25]。然而,在不同pH下,BSH对不同的底物的偏好性和水解能力也有一定差异,这可能是由于pH介导的BSH结构的变化导致的。
编码BSH的基因包括四种,分别是bsh1、bsh2、bsh3、bsh4,但并不是所有含BSH的微生物中都具有这四种基因且能够表达。Kumar等[26]鉴定发现了发酵乳杆菌NCDO394中的一个bsh基因,Fang等[27]在唾液乳杆菌中发现了bsh1和bsh2基因。也有研究鉴定发现了植物乳杆菌WCFS1中的4个bsh基因且均可表达[28],因此这些基因在微生物中是高度可变的。
3 胆盐水解酶的功能
3.1 营养成分
BSH水解胆盐的过程中会释放出甘氨酸和牛磺酸等氨基酸,甘氨酸可能被代谢为氨和二氧化碳,牛磺酸可被代谢为氨、二氧化碳和硫酸盐,这些代谢物质作为微生物生长过程中的碳源、氮源等能量来源被利用,因此,有BSH活性的菌株较BSH阴性菌株而言,在生长过程中具有营养优势。Huijghebaert等[29]发现在生长培养基中只有添加含硫氨基酸(0.1%的牛磺酸)时,才可诱导菌株活菌数显著增加,由不可生长或最高活菌数为104 cfu/mL,增加至106~107 cfu/mL,不仅如此,牛磺酸的添加也使得菌株在琼脂平板上的菌落直径增加约5倍。因此认为,BSH阳性的梭属菌株可利用牛磺酸为电子受体,从而加快菌株单位时间的生长速度。
3.2 改变细胞膜透性
细胞膜在保护细胞免受外界侵害方面起重要作用,其防御功能主要与其流动性、电荷及疏水性等密切相关[30]。据报道,BSH可促进胆固醇或胆汁进入细胞膜,并通过改变bsh介导的脂质分子间氢键而改变细胞膜流动性,增加细胞膜的电化学特性和膜强度,从而保持细胞结构的完整性,促进微生物在宿主的胃肠道上定殖生存,改善免疫系统,从而增加宿主的免疫能力[30]。
3.3 水解结合态胆盐
当细胞中胆盐浓度过高时,会影响细胞膜的磷脂双分子层结构,对人体产生不利影响,因此需有效控制体内胆盐的水平。胆盐包括结合态胆盐和游离态胆盐,结合态胆盐易溶解,可经肠道循环随粪便排出体外。BSH可通过特异性水解牛磺酸结合态胆盐和甘氨酸结合态胆盐,降低胆盐浓度,解除细胞胆盐毒性,防止细胞膜破裂,达到保护细胞的目的[31]。Kaya等[23]将鼠李糖乳杆菌中的bsh基因克隆至大肠杆菌并表达后发现,相较于牛磺酸胆盐,重组BSH显示其对甘氨酸胆盐的偏好,这可能与催化活性位点有关。但也有研究表明,即便有相同的催化位点,不同菌属的BSH对底物的水解能力也有所不同[32]。因此,BSH通过特异性水解结合胆盐,调节肠道代谢,解除胆盐毒性,改善宿主健康,而其水解胆盐的能力与催化活性位点相关,也可能受到菌株的影响。
3.4 提高肠道中益生菌存活率
对微生物而言,人体肠道环境恶劣,不利于生长及定殖。但由于BSH水解结合胆盐后增加了菌株对肠道细胞的黏附作用,因此BSH阳性菌株含有更高的胆汁耐受性,并且在肠道环境中有更高的存活率。Yang等[33]将植物乳杆菌灌胃小鼠后发现,BSH阳性的菌株较对照菌株在胃肠道中的存活时间延长3 d,且对肠细胞的黏附能力也显著增强。因此,BSH活性也成为益生菌筛选的重要标准之一。但也有研究表明,以三株不同BSH活性的乳酸菌灌胃小鼠,两周后发现菌株在小鼠肠胃环境中的生长能力并无显著性差异。这可能与不同菌株中BSH的结构差别有关,因此,BSH对微生物存活率的影响仍需要深入研究[34]。
3.5 降胆固醇
肝细胞中胆固醇的过度积累易引起冠心病,动脉粥样硬化等心血管疾病。大量研究证明,除了可以通过服用相应的药物外,口服益生菌也可降低体内胆固醇。然而分子层面的益生菌降胆固醇机制还未完全解析清晰,但对该现象已提出很多假说。例如,胆固醇转化为粪甾醇[20]、短链脂肪酸的产生[35]以及细胞壁与胆固醇间的相互作用[36],而具有活性的BSH被认为是降低体内胆固醇的关键因素[37,38]。也已有大量研究证明具有BSH活性的益生菌可显著减少肠内细胞对胆固醇的吸收,降低体内胆固醇水平[39-41],同时可降低体重,改善肥胖现象[42]。
4 胆盐水解酶降胆固醇机制
4.1 降低胆固醇稳定胶束的形成
胶束的形成需要胆盐、磷脂和胆固醇分子,中断的胶束将不能将脂肪酸运输至肠黏膜表面,导致胆固醇水平降低。具有BSH活性的益生菌进入肠道中,会增加肠腔内胆汁酸的水解,导致机体内游离态胆盐水平的增加。而与结合态胆盐相比,游离态胆盐的乳化能力较弱,胆固醇形成稳定的胶束的效率也随之降低,从而降低了机体对胆固醇和甘油三酯的吸收,因此,BSH阳性菌株可利用胆汁酸水解的游离态胆盐消弱稳定胶束的形成,降低体内胆固醇水平[43]。但目前关于胆盐水解酶对胆固醇胶束影响的报道较少,需要进一步通过动物及体外实验进行验证。
4.2 催化形成游离胆汁酸
由于胆固醇在水中的不溶性,因此对其有效吸收的必要条件是胆固醇的溶解,而不被吸收的胆固醇将会进入肠肝循环并被排出体外。由于结合胆汁酸比游离胆汁酸更易溶解且更易被肠腔吸收,因此,游离胆汁酸在肠道微生物BSH的催化下被释放,因其不易被吸收而通过肠道循环被粪便清除,便增加了胆固醇对胆汁酸从头合成的需求,降低了体内胆固醇水平[32]。Tsai等[16]利用高BSH活性的益生菌培养HepG2细胞,发现肠腔内的胆固醇被分解为不易被吸收的游离胆汁酸,随后随粪便共同排出,降低了血清胆固醇水平。除此之外,菌株对胆盐的水解能力随菌株和BSH活性的变化而变化。Öner等[44]评估了几株具有高BSH活性的乳酸菌的水解牛磺酸胆盐能力与胆酸释放量,发现双歧杆菌和乳酸菌表现出了最高的水解胆盐能力,且胆汁酸释放量更显著。
4.3 调控受体蛋白和酶的表达
4.3.1 提高CYP7A1及LXR的表达
促进胆固醇分解为胆汁酸是降低体内胆固醇水平的一个重要途径,该途径每日可清除体内一半的总胆固醇,而这一复杂的过程受到了多种蛋白的表达调控。研究表明,核受体家族的成员具有控制体内脂代谢的平衡的功能,尤其是法尼醇X受体(Franesoid X receptor,FXR)和肝脏X受体(Liver X receptor,LXR),二者可调节肝脏中的胆固醇合成胆汁酸,从而清除体内多余胆固醇,是体内胆汁酸合成和胆固醇清除的关键调控因子[45]。ATP结合转运子A1(ATP-binding cassette transporter A1,ABCA1)是促进胆固醇外排的脂蛋白受体,ATP结合转运子G1(ATP-binding cassette transporter G1,ABCG1)也具有逆向转运胆固醇的功能[46,47]。胆固醇7α-烃化酶(CYP7A1)是促进胆固醇转化为胆汁酸的合成限速酶,每天可协助人体排出400~600 mg的胆固醇[6]。
通过对大鼠灌胃具有BSH活性的植物乳杆菌,发现CYP7A1基因和蛋白表达水平显著上调,且胆固醇水平显著降低,粪便中胆汁酸排泄也显著增加[48]。Thang等[49]发现具有BSH活性的鼠李糖乳杆菌BFE5246和植物乳杆菌NR47可以显著促进ABCA1和ABCG1基因和蛋白的表达从而激活LXR,诱导胆固醇外排,降低体内胆固醇水平。由于游离胆汁酸与FXR间的高结合力,导致CYP7A1的转录受到抑制,同时由胆汁酸激活的FXR还可进一步诱导肠道胆汁酸结合蛋白(Intestinal bile acid binding protein,IBABP)基因的转录,从而促进由肠道返回至肝脏的胆汁酸的循环,降低了胆固醇重新合成胆汁酸的需求[50]。
4.3.2 抑制NPC1L1的表达
小异二聚体伴侣(Small heterodimer partner,SHP)与上述提到的调控蛋白不同的是该受体没有DNA结合域,但可作为固醇调控元件结合转录因子的辅助因子,通过固醇调节元件结合蛋白2(SREBP2)转录调控胆固醇含量[49],抑制肝脏胆固醇的生物合成或抑制其转化为胆汁酸,从而参与肝脏的脂质代谢[51]。NPC1L1是降胆固醇药物依齐麦布(EZE)的作用靶点,可以在肠上皮细胞和肝细胞的管状膜大量表达,是哺乳动物肠道吸收胆固醇的关键转运体,也是膳食胆固醇吸收的重要载体[52]。
Wang等[37]等发现过表达BSH阳性菌株植物乳杆菌AR113和干酪乳杆菌pWQH01可显著降低小鼠肝脏TC和LDL-C水平,改善了肝脏脂肪变性。进一步通过对代谢通路的分析发现,AR113和pWQH01下调表达了FXR和SHP,同时上调表达了CYP7A1、LXR和低密度脂蛋白受体(LDLR)。Kim等[51]检测了敲除SHP基因小鼠的基因表达与胆固醇吸收水平,发现SHP敲除小鼠的肠道内NPC1L1基因上调,胆固醇吸收增加。因此得出结论,SHP可抑制SREBP2,从而抑制NPC1L1的表达和胆固醇的吸收,因此,BSH可参与调控NPC1L1的表达,达到控制体内胆固醇的目的。所以,激活SHP可被开发用于高胆固醇的治疗。
5 BSH的争议性
BSH虽可以增加菌株的营养优势并最大化益生菌在肠道中的存活率,也可降低结合胆盐的毒性与机体胆固醇水平,但同时也可能会扰乱正常的肠道环境,造成肠道疾病,带来不利影响。游离胆汁酸的乳化脂肪和形成稳态胶束的效率与结合胆汁酸相比较低,因此,BSH可能扰乱油脂消化,导致对脂肪酸和甘油单酯的吸收率降低。另外,游离胆盐可产生对DNA有损害的次级胆汁酸而引发结肠黏膜功能受损,导致腹泻或炎症,甚至结肠癌[53]。由BSH引起的胆汁酸浓度的改变使得胆固醇与卵磷脂相对浓度发生改变,当呈现过饱和状态时,多余的胆固醇与钙盐可形成沉淀,导致结石的产生[54]。因此,如何最大化BSH有利影响的同时,尽量避免其带来的负面影响也将是日后需要进一步研究的方向。
6 结论
6.1 目前心血管疾病的高病发率,促使研究人员尽快寻找绿色安全有效的防治方法。常用的他丁类药物具有副作用,且价格昂贵。而大量研究已证明许多益生菌可有效降低人体胆固醇,并据大量研究报道,BSH可协助益生菌在肠胃环境中最大化地发挥益生作用,调控宿主代谢,改善宿主健康。然而目前对BSH的研究主要集中在其结构,底物特异性,催化活性位点及生理功能方面,对其降胆固醇作用机理研究较少。本文通过对BSH特性及生理功能的总结,强调其降胆固醇作用,并分析总结其降胆固醇机理,发现BSH降胆固醇主要与胆固醇的形成方式以及相关蛋白的表达有关,为BSH的研究提供理论基础。
6.2 然而,BSH对宿主也会产生一些负面影响,如何控制其安全性,防止疾病发生也值得关注。但目前关于胆盐水解酶降胆固醇的研究结论主要集中于鼠、猪等动物体的实验,因此,仍需要深入的临床研究进一步揭示BSH特性及降胆固醇机理,这将对降胆固醇的益生菌保健品及药物开发有重要意义。
[1]Jones M L, Tomaro-Duchesneau C, Martoni C J, et al. Cholesterol lowering with bile salt hydrolase-active probiotic bacteria, mechanism of action, clinical evidence, and future direction for heart health applications [J]. Expert Opinion on Biological Therapy, 2013, 13(5): 631-642
[2]Browning J D, Horton J D. Molecular mediators of hepatic steatosis and liver injury [J]. Journal of Clinical Investigation, 2004, 114(2): 147-152
[3]Chien Y L, Wu L Y, Lee T C, et al. Cholesterol-lowering effect of phytosterol-containing lactic-fermented milk powder in hamsters [J]. Food Chemistry, 2010, 119(3): 1121-1126
[4]Bellosta S. Safety of statins: focus on clinical pharmacokinetics and drug interactions [J]. Circulation, 2004, 23(suppl 1): III50-57
[5]Jeun J, Kim S, Cho S, et al. Hypocholesterolemic effects ofLactobacillus plantarum KCTC3928 by increased bile acid excretion in C57BL/6 mice [J]. Nutrition, 2010, 26(3): 321-330
[6]李权威,张开屏,赵艳红,等.乳酸菌调控胆固醇代谢关键因子的研究进展[J].中国食品学报,2021,21(1):341-350
LI Quanwei, ZHANG Kaiping, ZHAO Yanhong, et al. Research progress of regulatory key factors involved in cholesterol metabolism by lactic acid bacteria [J]. Journal of Chinese Institute of Food Science and Technology, 2021, 21(1): 341-350
[7]Begley M, Gahan C G M, Hill C. The interaction between bacteria and bile [J]. FEMS Microbiology Reviews, 2005, 29(4): 625-651
[8]Begley M, Hill C, Gahan C G M. Bile salt hydrolase activity in probiotics [J]. Applied and Environmental Microbiology, 2006, 72(3): 1729-1738
[9]Narwala V, Deswalb R, Batrac B, et al. Cholesterol biosensors: a review [J]. Steroids, 2019, 143: 6-17
[10]李雅迪.益生菌降胆固醇机制初探[D].昆明:昆明理工大学, 2017
LI Yadi. The preliminary study on cholestetol-reducing mechanism by probiotics [D]. Kunming: Kunming University of Science and Technology, 2017
[11]Booth L, Roberts J L, Poklepovic A, et al. The levels of mutant K-RAS and mutant N-RAS are rapidly reduced in a Beclin1/ATG5 -dependent fashion by the irreversible ERBB1/2/4 inhibitor neratinib [J]. Cancer Biology & Therapy, 2018, 19(2): 132-137
[12]de Boer J F, Schonewille M, Boesjes M, et al. Intestinal farnesoid X receptor controls transintestinal cholesterol excretion in mice [J]. Gastroenterology, 2016, 152(5): 1126-1138
[13]路四海.嗜酸乳杆菌降低胆固醇作用及其机理研究[D].新乡:河南科技学院,2012
LU Sihai. Study on cholesterol removal byLactobacillus acidophilus and its mechanism [D]. Xinxiang: Henan Institute of Science and Technology, 2012
[14]Duan Y, Zhang F, Yuan W, et al. Hepatic cholesterol accumulation ascribed to the activation of ileum Fxr-Fgf15 pathway inhibiting hepatic Cyp7a1 in high-fat diet-induced obesity rats [J]. Life Sciences, 2019, 232: 116638
[15]Manson J E, Tosteson H, Ridker P M, et al. Review article: the primary prevention of myocardial infarction [J]. The New England Journal of Medicine, 1992, 326(21): 1406-1416
[16]Tsai C, Lin P, Hsieh Y, et al. Cholesterol-lowering potentials of lactic acid bacteria based on bile-salt hydrolase activity and effect of potent strains on cholesterol metabolismin vitro andin vivo[J]. The Scientific World Journal, 2014, 2014: 690752
[17]Geng W, Lin J. Bacterial bile salt hydrolase: an intestinal microbiome target for enhanced animal health [J]. Animal Health Research Reviews, 2016, 17(2): 148-158
[18]Kumar R S, Brannigan J A, Prabhune A A, et al. Structural and functional analysis of a conjugated bile salt hydrolase fromBifidobacterium longumreveals an evolutionary relationship with penicillin V acylase [J]. Journal of Biological Chemistry, 2006, 281(43): 32516-32525
[19]Dong Z, Lee B H. Bile salt hydrolases: structure and function, substrate preference, and inhibitor development [J]. Protein Science, 2018, 27(10): 1742-1754
[20]Horáčková, Plocková M, Demnerová K. Importance of microbial defence systems to bile salts and mechanisms of serum cholesterol reduction [J]. Biotechnology Advances, 2018, 36(3): 682-690
[21]黄艳娜,任婧.胆盐水解酶基因结构与功能研究现状[J].乳业科学与技术,2015,38(2):33-36
HUANG Yanna, REN Jing. Current status of research on the structure and function of bile salt hydrolase gene [J]. Journal of Dairy Science and Technology, 2015, 38(2): 33-36
[22]Ba N M, Öztürk M. Molecular cloning and characterization of bile salt hydrolase fromLactobacillus gasseriATCC 33323 strain [J]. Food Biotechnology, 2018, 32(2): 95-111
[23]Kaya Y, Kök M, Öztürk M. Molecular cloning, expression and characterization of bile salt hydrolase fromLactobacillus rhamnosus E9 strain [J]. Food Biotechnology, 2017, 31(2): 128-140
[24]Gu X, Luo X, Wang C, et al. Cloning and analysis of bile salt hydrolase genes fromLactobacillus plantarumCGMCC No. 8198 [J]. Biotechnology Letters, 2014, 36(5): 975-983
[25]Chae J P, Valeriano V D, Kim G B, et al. Molecular cloning, characterization and comparison of bile salt hydrolases fromLactobacillus johnsoniiPF01 [J]. Journal Applied Microbiology, 2013, 114(1): 121-133
[26]Kumar R, Rajkumar H, Kumar M, et al. Molecular cloning, characterization and heterologous expression of bile salt hydrolase (Bsh) fromLactobacillus fermentum NCDO394 [J]. Molecular Biology Reports, 2013, 40(8): 5057-5066
[27]Fang F, Li Y, Bumann M, et al. Allelic variation of bile salt hydrolase genes inLactobacillus salivariusdoes not determine bile resistance levels [J]. Journal of Bacteriology, 2009, 191(18): 5743-5757
[28]Lambert J M, Bongers R S, de Vos W M, et al. Functional analysis of four bile salt hydrolase and penicillin acylase family members inLactobacillus plantarumWCFS1 [J]. Applied and Environmental Microbiology, 2008, 74(15): 4719-4726
[29]Huijghebaert S M, Mertens J A, Eyssen H J. Isolation of a bile salt sulfatase-producingClostridium strain from rat intestinal microflora [J]. Applied and Environmental Microbiology, 1982, 43(1): 185-192
[30]Axmann M, Strobl W M, Plochberger B, et al. Cholesterol transfer at the plasma membrane [J]. Atherosclerosis, 2019, 290: 111-117
[31]Bustos A Y, Font De Valdez G, Fadda S, et al. New insights into bacterial bile resistance mechanisms: the role of bile salt hydrolase and its impact on human health [J]. Food Research International, 2018, 112: 250-262
[32]Jiang J, Hang X, Zhang M, et al. Diversity of bile salt hydrolase activities in different lactobacilli toward human bile salts [J]. Annals of Microbiology, 2010, 60(1): 81-88
[33]Yang Y, Liu Y, Zhou S, et al. Bile salt hydrolase can improveLactobacillus plantarum survival in gastrointestinal tract by enhancing their adhesion ability [J]. FEMS Microbiology Letters, 2019, 366(8)
[34]Bateup J M, McConnell M A, Jenkinson H F, et al. Comparison ofLactobacillus strains with respect to bile salt hydrolase activity, colonization of the gastrointestinal tract, and growth rate of the murine host [J]. Applied and Environmental Microbiology, 1995, 61(3): 1147-1149
[35]Ishimwe N, Daliri E B, Lee B H, et al. The perspective on cholesterol-lowering mechanisms of probiotics [J]. Molecular Nutrition & Food Research, 2015, 59(1): 94-105
[36]Lye H, Rahmat-Ali G R, Liong M. Mechanisms of cholesterol removal by lactobacilli under conditions that mimic the human gastrointestinal tract [J]. International Dairy Journal, 2010, 20(3): 169-175
[37]Wang G, Huang W, Xia Y, et al. Cholesterol-lowering potentials ofLactobacillus strain overexpression of bile salt hydrolase on high cholesterol diet-induced hyper- cholesterolemic mice [J]. Food & Function, 2019, 10(3): 1684-1695
[38]Kimoto H, Ohmomo S, Okamoto T. Cholesterol removal from media by lactococci [J]. Journal of Dairy Science, 2002, 85(12): 3182-3188
[39]Singhal N, Maurya A K, Mohanty S, et al. Evaluation of bile salt hydrolases, cholesterol-lowering capabilities, and probiotic potential ofEnterococcus faeciumisolated from rhizosphere [J]. Frontiers in Microbiology, 2019, 10: 1567
[40]Guo L, Wang L, Liu F, et al. Effect of bile salt hydrolase-activeLactobacillus plantarum KLDS 1.0344 on cholesterol metabolism in rats fed a high-cholesterol diet [J]. Journal of Functional Foods, 2019, 61: 1-9
[41]王俊国,孟和毕力格,包秋华,等.具有胆盐水解酶活性的乳酸菌对高血脂症大鼠血脂的调节作用[J].食品科学,2013,34(1):257-262
WANG Junguo, MENGHE Bilige, BAO Qiuhua, et al. Hypolipidemic effect ofLactobacillus with bile salt hydrolase activity in hyperlipidemic rats [J]. Food Science, 2013, 34(1): 257-262
[42]Miyoshi M, Ogawa A, Higurashi S, et al. Anti-obesity effect ofLactobacillus gasseriSBT2055 accompanied by inhibition of pro-inflammatory gene expression in the visceral adipose tissue in diet-induced obese mice [J]. European Journal of Nutrition, 2014, 53(2): 599-606
[43]Kumar R, Grover S, Batish V K. Hypocholesterolaemic effect of dietary inclusion of two putative probiotic bile salt hydrolase-producingLactobacillus plantarumstrains in sprague-dawley rats [J]. British Journal of Nutrition, 2011, 105(4): 561-573
[44]Öner Ö, Aslim B, Aydas S B. Mechanisms of cholesterol-lowering effects ofLactobacilli andBifidobacteria strains as potential probiotics with theirbshgene analysis [J]. Journal of Molecular Microbiology and Biotechnology, 2014, 24(1): 12-18
[45]Lambert G, Amar M J A, Guo G, et al. The farnesoid X-receptor is an essential regulator of cholesterol homeostasis [J]. Journal of Biological Chemistry, 2003, 278(4): 2563-2570
[46]Liong M T, Shah N P. Bile salt deconjugation ability, bile salt hydrolase activity and cholesterol co-precipitation ability of Lactobacillistrains [J]. International Dairy Journal, 2005, 15(4): 391-398
[47]Yoon H, Ju J, Lee J, et al. The probioticLactobacillus rhamnosus BFE5264 andLactobacillus plantarumNR74 promote cholesterol efflux and suppress inflammation in THP-1 cells [J]. Journal of the Science of Food and Agriculture, 2013, 93: 781-787
[48]Ramakrishna R, Kumar D, Bhateria M, et al. 16-Dehydropregnenolone lowers serum cholesterol by up-regulation of CYP7A1 in hyperlipidemic male hamsters [J]. Journal of Steroid Biochemistry and Molecular Biology, 2017, 168: 110-117
[49]Thang S K, Chen P, Gao W, et al. Xanthohumol suppresses NPC1L1 gene expression through down regulation of HNF-4α and inhibits cholesterol uptake in Caco-2 cells [J]. Journal of Agricultural and Food Chemistry, 2019, 67(40): 11119-11128
[50]Choi S, Lew L, Yeo S, et al. Probiotics and the BSH-related cholesterol lowering mechanism: a Jekyll and Hyde scenario [J]. Critical Reviews in Biotechnology, 2013, 35(3): 392-401
[51]Kim Y, Byun S, Seok S, et al. Small heterodimer partner and fibroblast growth factor 19 inhibit expression of NPC1L1 in mouse intestine and cholesterol absorption [J]. Gastroenterology, 2019, 156(4): 1052-1065
[52]Huang Y, Zheng Y. The probioticLactobacillus acidophilusreduces cholesterol absorption through the down-regulation of Niemann-Pick C1-like 1 in Caco-2 cells [J]. British Journal of Nutrition, 2010, 103(4): 473-478
[53]Bernstein H, Bernstein C, Payne C M, et al. Bile acids as carcinogens in human gastrointestinal cancers [J]. Mutation Research/Reviews in Mutation Research, 2005, 589(1): 47-65
[54]岳婷婷,侯红漫.胆盐水解酶的研究现状[J].中国乳品工业, 2010,38(2):33-37
YUE Tingting, HOU Hongman. Study of the bile salt hydrolase [J]. China Dairy Industry, 2010, 38(2): 33-37