在日常生活中,由乳液这种多相食品分散体系构成的天然及加工食品种类繁多,常见的乳液型食品有牛奶、乳饮料、奶油、涂抹酱等[1],多相食品胶体体系也被称为界面主导食品体系,如何构建良好的界面以维持食品体系的稳定性是一个值得思考的食品科学问题[2]。现有研究表明,通过构建分子间(蛋白-蛋白,蛋白-多糖)复合界面体系可以有效提高乳液系统的稳定性及功能性质,使之能更好地在食品体系中应用[3]。
小麦蛋白也被称为谷朊粉,是从小麦粉中提取出来的天然蛋白质[4]。与其他植物蛋白相比,小麦蛋白富含二硫键,根据它们能否在乙醇水溶液中溶解,可以分为两个部分:可溶性的单体小麦醇溶蛋白和不溶性的聚聚集体小麦谷蛋白,麦醇溶蛋白分子呈球状,分子量较小,具有延伸性,弹性小;麦谷蛋白分子为纤维状,分子量较大,具有弹性,延伸性小,这两者的共同作用,使得小麦面筋具有其它植物蛋白所没有的独特粘弹性,能够在面包中形成强大的网络结构[5]。我们前期的研究已经证明,麦醇溶蛋白和麦谷蛋白在小麦蛋白稳定的乳液凝胶中起到显著的协同作用[6]。因此,通过调控这两种组分的组成比例,研究其对于小麦蛋白基乳液体系形成及稳定的影响,能够为小麦蛋白在食品体系中的应用提供新的思路。
脂肪是维持人体生命活动必需的三大营养物质之一,但脂肪摄入过量容易造成肥胖,延缓脂肪释放是应对肥胖的一种潜在策略,前期研究证明延缓脂肪的消化分解可以在维持饱腹感的同时降低食品中热量的摄入[7]。在乳液体系中,脂肪的氧化和水解通常是发生在乳液的油-水界面层[8]。因此基于这样的原理,通过不同配比的麦醇溶蛋白和麦谷蛋白形成较为致密的界面层,制备稳定性和消化特性均良好的乳液,并应用在食品体系中,使食品具有一定的功能特性,例如延缓脂肪的释放,抑制肥胖或其他脂肪相关的疾病。
1 材料与方法
1.1 原料
小麦蛋白购于美国Bob’s Red Mill 公司,杜马斯定氮法(Dumas)测定蛋白质含量为74.70%,其中麦醇溶蛋白占小麦蛋白总量的47.60%,麦谷蛋白占52.40%;荧光染色剂(尼罗红和尼罗蓝A)购于Sigma-Aldrich 公司;葵花籽油购于广州当地超市;其他化学试剂均属于分析纯。
1.2 仪器与设备
BSA2245 分析天平,德国Sartorius 公司;Big-squid磁力搅拌器、Ultra-Turrax T10 均质机,德国IKA 公司;CR22冷冻离心机,日本Hitachi公司;DELTA 1-24 LSC冷冻干燥机,德国Christ 公司;Rapid N Cube 杜马斯定氮仪,德国Elementar公司;Millipore纯水机Essential 5,美国Millipore 公司;激光共聚焦显微镜,德国Leica公司;表面界面张力仪,德国Dataphysics 公司;场发射扫描电镜,德国Zeiss 公司;Mastersizer 3000 微米粒度仪,英国Malvern 公司;光学显微镜,OLYMPUS公司;Version2.3 Light 自动滴定仪,瑞士万通中国有限公司。
1.3 试验方法
1.3.1 麦醇溶蛋白和麦谷蛋白的提取
准确称量100 g 小麦蛋白分散在1000 mL 70%(V/V)乙醇溶液中,在室温环境(25 ℃)下搅拌2 h。随后将蛋白悬浮液进行离心(8000 r/min,20 min)处理,离心沉淀为小麦谷蛋白,上清液为小麦醇溶蛋白。将沉淀部分小心取出,先使用70%(V/V)乙醇溶液重复清洗三次,再使用去离子水重复清洗三次,清洗过后经冷冻干燥后得到的蛋白即为小麦谷蛋白;对离心后上清液部进行透析处理,第一个24 h 用去离子水透析,第二个24 h 换成使用0.05 M 乙酸透析,第三个24 h 再使用去离子水透析,透析后的蛋白溶液经冷冻干燥得到的蛋白即为小麦醇溶蛋白;分级后得到的两种蛋白组分经粉碎均放置于常温干燥处进行保存。
1.3.2 小麦蛋白基乳液的制备
将小麦蛋白、不同比例的麦醇溶蛋白、麦谷蛋白(1:0、0:1、1:1、2:1、1:2)溶于pH 为11.0 的NaOH水溶液中,搅拌1 h 后,用HCl 将pH 回调至7.4,再搅拌1 h,制备得到分散均一的小麦蛋白基悬浮液,然后将葵花籽油加入到小麦蛋白悬浮液中,在15000 r/min 下均质2 min。在所有制备的乳液中,最终的蛋白总浓度均为1 wt%,油相浓度为20 wt%。
1.3.3 蛋白界面性质及乳液微观结构表征
1.3.3.1 界面微观结构观察
通过凝胶捕获技术(GTT)结合扫描电子显微镜(SEM)观察油-水界面处吸附蛋白的微观结构[9]。首先按照1.3.2 的方法将小麦蛋白、不同比例的麦谷蛋白和麦醇溶蛋白配制成蛋白浓度为0.5 wt.%的悬浮液,取10 g 蛋白悬浮液于20 mL 烧杯中,然后加入预热(90 ℃)的葵花籽油,在90 ℃下以50 r/min 温和搅拌30 min,以确保蛋白在油-水界面处得到充分吸附。随后在顶部覆盖1 mL 具有疏水特性的聚二甲基硅氧烷(PDMS),在4 ℃环境下放置48 h 使得PDMS 固化成胶,此时在界面吸附的蛋白颗粒被PDMS 固定下来,用镊子轻轻取出PDMS,并用少量去离子水冲洗几次,采用SEM 观察界面吸附颗粒形貌。
1.3.3.2 界面张力的测定
首先将小麦蛋白及不同配比的麦醇溶蛋白、麦谷蛋白组合溶解于去离子水中,蛋白浓度均为0.1 wt%,随后将配置好的蛋白溶液吸入注射器,在含有纯化葵花籽油的光学玻璃比色杯中形成一滴蛋白样品溶液(10 μL),使用摄像机监测10800 s,检测并绘制界面张力随吸附时间的变化曲线。
1.3.3.3 乳液的微观结构
将10 mg 尼罗红和10 mg 尼罗蓝A 共同分散在10 mL 无水乙醇中以制备混合荧光染色剂,将染色剂与乳液按照质量比1:25 进行染色,然后将染色的乳液置于凹形载玻片上,用盖玻片覆盖保证样品完全固定,使用激光共聚焦显微镜(CLSM)40×观察样品并采集图片。尼罗红和尼罗蓝A 的激发波长分别为488 nm和633 nm。
1.3.3.4 乳液的粒径
使用Marlvern MasterSizer 3000 微米粒度仪测定新鲜乳液的粒径分布和体积平均直径(d4,3)。用去离子水稀释样品,水相和葵花籽油相的折射率分别为1.33 和1.52。
1.3.4 乳液的稳定性探究
1.3.4.1 储藏稳定性
按照1.3.1.1 的方法制备小麦蛋白基乳液,滴加0.02%的叠氮钠以排除微生物对实验结果的影响,将其保存在4 ℃冰箱中30 d,并在5 d、10 d、30 d 时按照1.3.2.3 的方法测定乳液的粒径。
1.3.4.2 热稳定性
按照1.3.1.1 的方式制备小麦蛋白基乳液,随后将其放入90 ℃水浴锅中加热30 min,取出后冷却至室温,按照1.3.2.3 的方法测定乳液的粒径。
1.3.5 体外模拟胃肠消化实验[10]
为了探究乳液中游离脂肪酸的释放情况,本部分进行模拟体外胃肠消化实验。利用光学显微镜记录了经过胃、肠消化后乳液的形貌,通过NaOH 的消耗量计算得出游离脂肪酸的释放量。
模拟胃消化:首先配制模拟胃液,取2 g NaCl 和7 mL 浓HCl,用去离子水定容至1 L,并用1.0 mol/L盐酸调节pH 至2.0。取20 mL 新制乳液于50 mL 烧杯中,加入20 mL 模拟胃液,加入64 mg 胃蛋白酶,并用1.0 mol/L 调节pH 至1.2,于37 ℃水浴锅中恒温,以100 r/min 的速度搅拌2 h。
模拟肠消化:采用自动滴定仪进行模拟肠消化实验。经过胃液消化的混合液体,用4 mol/L NaOH 调节体系的pH 至7.0 后,依次按顺序加入4 mL 46.87 mg/mL 胆盐,1 mL 110 mg/mL CaCl2溶液,2.5 mL 24 mg/mL 胰脂肪酶。充分混合均匀后,调节混合液pH至7.0。在测试的过程中,通过自动滴入的0.5 M NaOH维持体系的pH 在7.0,通过恒温水浴将温度控制在37 ℃,以100 r/min 的速度搅拌消化2 h。
经过模拟胃肠消化实验后,游离脂肪酸的释放量可以通过模拟肠消化所消耗的NaOH 来计算,相关的公式为:
式中:m 为样品中结构脂的总质量(g);M 为结构脂分子的平均分子量(g/mol);C 为NaOH 溶液的浓度(mol/L);V为NaOH 溶液的体积(L)。结构脂的平均分子量通常为880 g/mol,以消耗前滴定脂肪酸消耗的NaOH 量作为空白。
1.4 数据处理分析
特别说明除外,所有样品测定均独立进行三次重复实验,实验均使用新鲜制备的样品,每个测试重复测三次,通过SPSS 21.0软件进行数据的方差分析(AVOVA),采用Duncan检验对多样本间进行显著性分析(p<0.05)。
2 结果与讨论
2.1 蛋白界面性质的表征
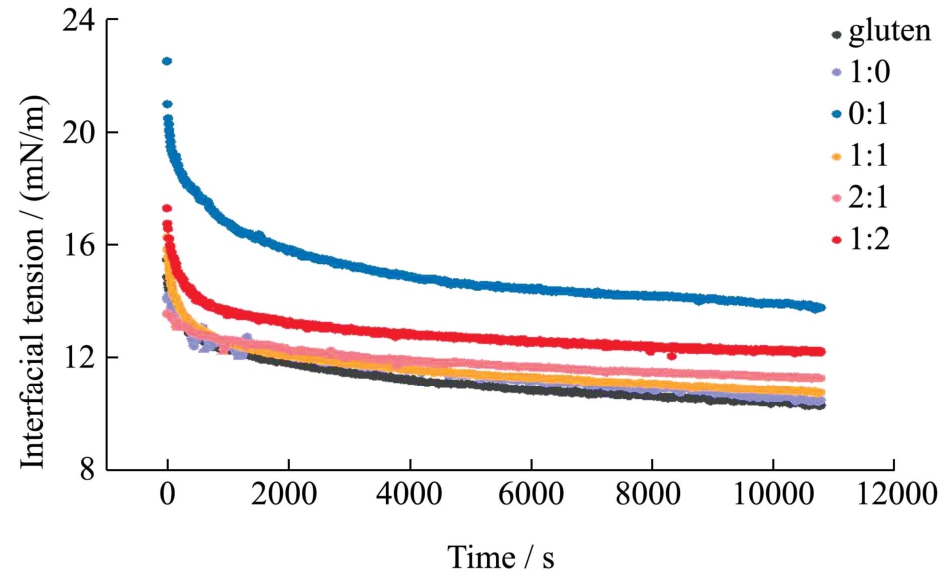
图1 界面张力随时间的演变曲线
Fig.1 The time evolution of interfacial tension at the interface
图1 为浓度为0.1 wt%的小麦蛋白以及不同麦醇溶蛋白、麦谷蛋白比例的蛋白悬浮液在油-水界面的表面张力曲线。由图1 可知,小麦蛋白的界面张力伴随吸附时间的增加均呈现下降的趋势。其中,麦谷蛋白的界面张力随着吸附时间的增加其下降趋势逐渐变小,其终点界面张力值明显高于其他组分,这说明麦谷蛋白的界面吸附能力较弱,而麦醇溶蛋白的界面张力变化趋势与小麦蛋白相似,这说明,小麦蛋白的界面吸附能力由麦醇溶蛋白主导。随着麦谷蛋白的比例上升,最终的界面张力值有所回升。
通过界面张力的测定,能初步判断麦醇溶蛋白具有较强的界面张力,在界面吸附中起到主导作用。通过图2 可以更加直观地看到小麦蛋白和不同配比的麦醇溶蛋白、麦谷蛋白在油-水界面上的吸附量。如图所示,麦醇溶蛋白能够在界面上形成一定量的吸附,且颗粒尺度较小,约为3~4 μm,而麦谷蛋白在界面上形成的是大于10 μm 的颗粒,由于麦谷蛋白本身就是一种聚集体,分子量较大,因此它在界面的吸附能力不强,颗粒尺度大。小麦蛋白在界面的吸附量较大,形成的是由单体麦醇溶蛋白和聚集体麦谷蛋白构成的复合体系。而麦醇溶蛋白和麦谷蛋白比例为1:1 的样品界面层与单一麦醇溶蛋白的界面层相似,但配比为1:1的界面层所富集的颗粒较多。而配比为2:1 和1:2 的蛋白界面层则表现出了明显不同,这两个组分的蛋白富集效果十分明显,能够在界面形成致密的吸附层,且尺度均一,呈现出明显的长杆状形貌。之前也有文献报道麦醇溶蛋白和麦谷蛋白的水解混合物可通过自组装形成微米级的纤维聚集体[11]。

图2 凝胶捕获技术结合扫描电镜观察吸附在油-水界面处的微观颗粒结构
Fig.2 The microstructure of the absorbed monolayer at oil-water interface, observed by gel trapping technology (GTT)combined with SEM
注:(a)小麦蛋白;(b)1:0;(c)0:1;(d)1:1;(e)2:1;(f)1:2;比例尺:10 μm。
2.2 乳液的微观结构表征
将小麦蛋白和不同比例的麦醇溶蛋白、麦谷蛋白和葵花籽油混合后制成油相为20 wt%的乳液,通过对蛋白和油脂进行特异性染色,以及激光共聚焦显微镜观察细致的乳液微观结构,图3 是乳液的CLSM 图片,葵花籽油和小蛋白分别用尼罗红(标记绿色)和尼罗蓝A(标记红色)染色[12]。可以发现,蛋白在油-水界面有所富集,且富集量的多少与SEM 显示的结果相符合。通过表1 可以得出,相比于单独的小麦蛋白乳液,通过麦醇溶蛋白和麦谷蛋白的组分调节之后,能够形成比小麦蛋白乳液粒度更小的乳液。
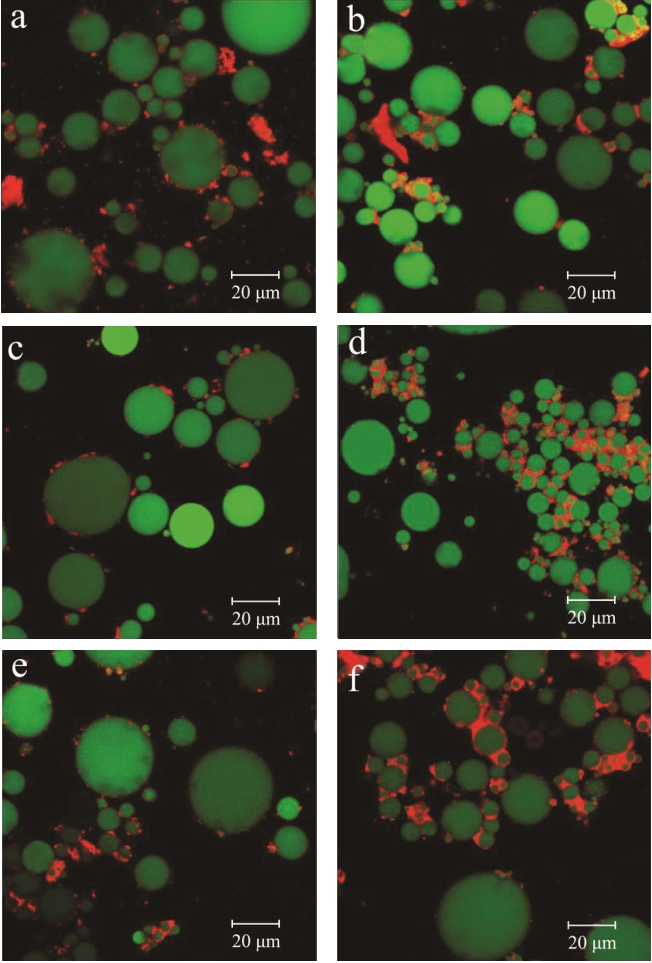
图3 新制乳液的CLSM 图像
Fig.3 CLSM images of initial emulsions
注:(a)小麦蛋白;(b)1:0;(c)0:1;(d)1:1;(e)2:1;(f)1:2;比例尺:20 μm。
表1 新制乳液的体积平均直径
Table 1 The volume mean diameter of emulsions
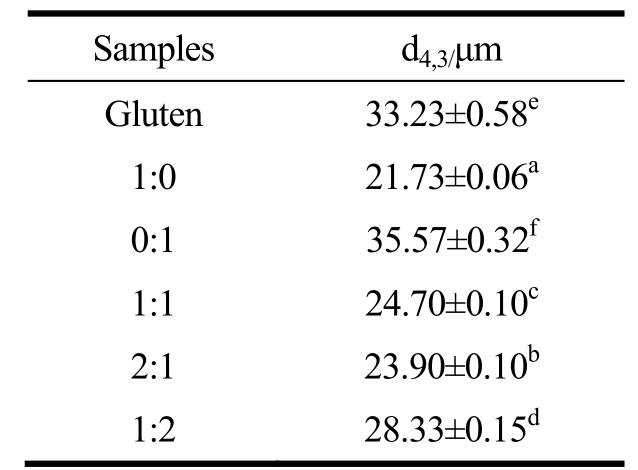
注:不同字母表示各组间存在显著性差异(p<0.05)。
Samples d4,3/μm Gluten 33.23±0.58e 1:0 21.73±0.06a 0:1 35.57±0.32f 1:1 24.70±0.10c 2:1 23.90±0.10b 1:2 28.33±0.15d
2.3 乳液的稳定性探究
如图4 所示,通过测定在4 ℃下保存的小麦蛋白基乳液在5 d、10 d、30 d 的粒度,了解不同组分乳液的贮藏稳定性。小麦蛋白乳液在5 d 后粒度就发生了显著的改变,油相析出,很不稳定,这可能是由于小麦蛋白作为整体无法充分发挥蛋白组分的协同作用。而由单一麦醇溶蛋白和麦谷蛋白稳定的乳液在0~30 d的粒度基本维持在21.33 μm 和33.19 μm 左右,然而在30 d 也出现了破乳现象,经过组分调节后的乳液在经过30 d 后还能有较好的稳定性,麦醇溶蛋白和麦谷蛋白比例为1:1、2:1、1:2 的样品粒度分别维持在24.03 μm、23.14 μm、27.83 μm 左右。
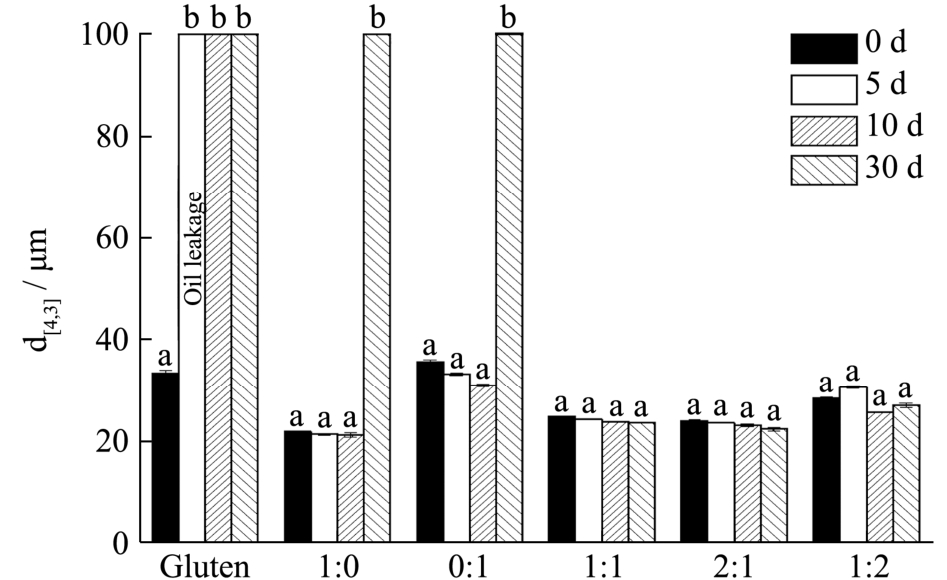
图4 乳液储藏0 d、5 d、10 d 和30 d 的粒度
Fig.4 Volume mean diameter of emulsions stored for 0 d, 5 d,10 d and 30 d
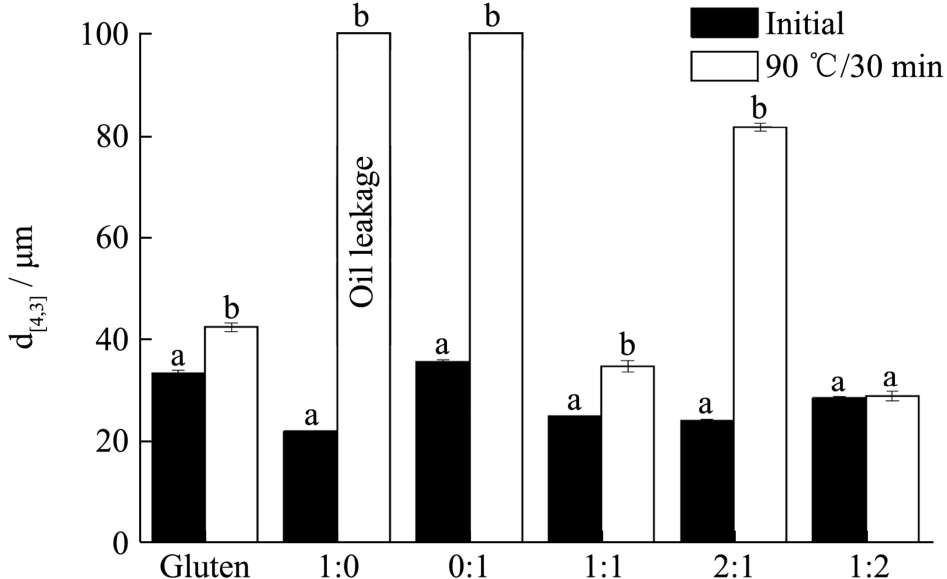
图5 新制乳液和乳液在90 ℃加热30 min 后的粒度图
Fig.5 Volume mean diameter of initial emulsions and heated at 90 ℃ for 30 min
如图5 所示,将新制备的乳液放置在90 ℃水浴加热30 min 后测定其粒度变化,发现麦醇溶蛋白和麦谷蛋白的比例为1:2 时,乳液的稳定性最好,粒度维持在28.33 μm 左右,这可能是因为在这样的复合体系中,少量的麦醇溶蛋白起到稳定界面的主导作用,足够的麦谷蛋白作为大分子聚集体在界面上富集,起到支撑保护的作用,相当于为界面提供了一个骨架,防止乳液结构在高温下被破坏,这进一步体现了两种蛋白在界面的协同作用。
2.4 模拟胃肠消化实验
为了探究小麦蛋白基乳液能够对于游离脂肪酸是否具有一定的缓释作用,进行模拟体外胃肠消化试验,并通过光学显微镜观察记录各阶段后的乳液形态。通过图6 可以看到所有的乳液在经过模拟胃消化后,乳滴尺度稍微有些增大,但还是能够保持乳滴的基本形貌,这说明小麦蛋白基乳液在pH 2.0 的酸性条件下,能够经受住胃蛋白酶的酶解消化;在经历了2 h 的模拟肠消化后,大部分结构脂被胰脂肪酶分解成小颗粒,但由小麦蛋白、单一麦醇溶蛋白和麦谷蛋白制备的乳液变得不稳定,出现破乳现象,原本有序的球状油滴开始聚集成不规则的油滴,而经过组分调节的三种乳液在经历模拟小肠消化后,乳滴依然保持原有形态,且粒度变化趋势基本相同。
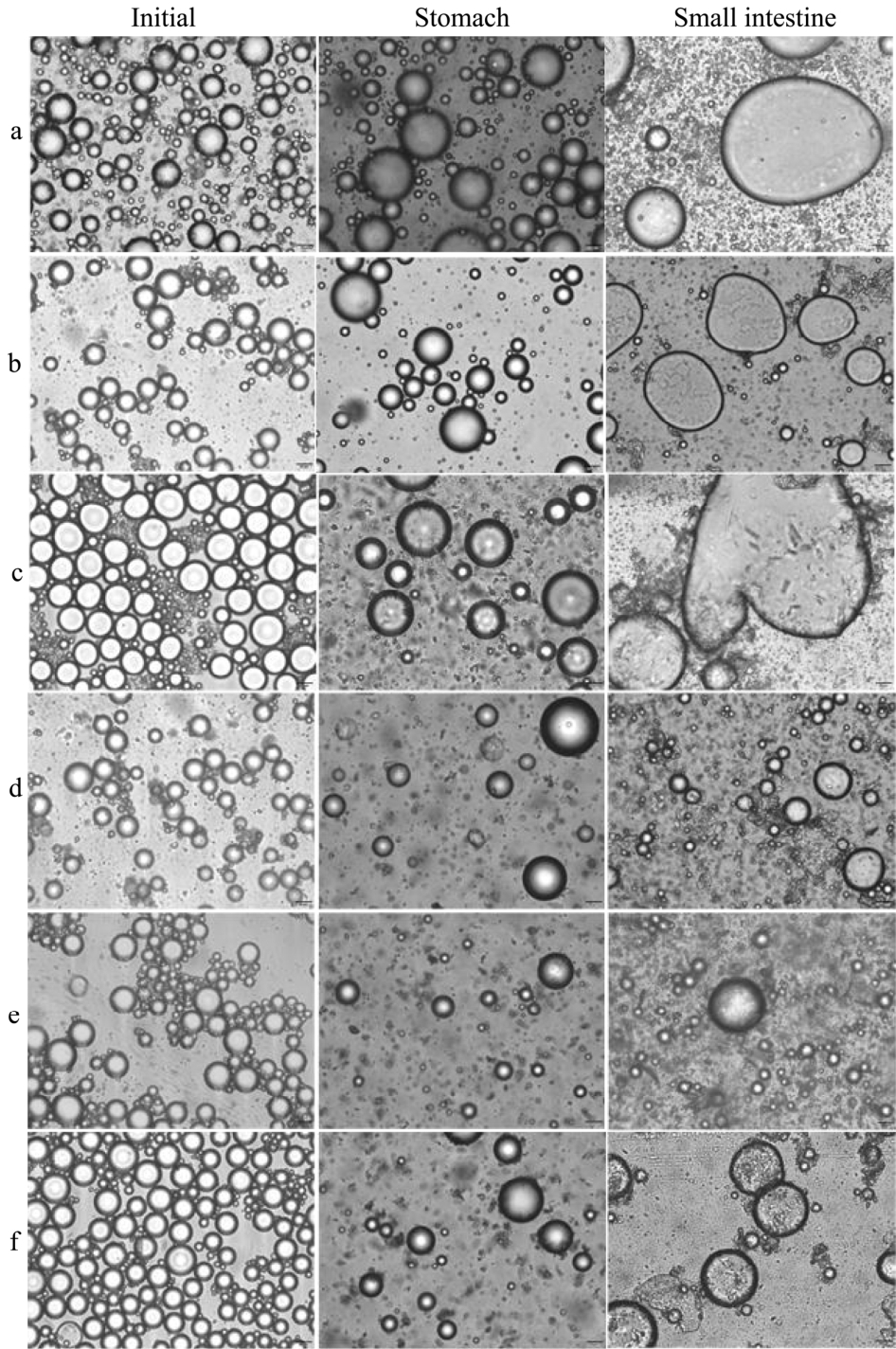
图6 乳液模拟胃肠消化后光学显微镜图像
Fig.6 Influence of simulated gastrointestinal conditions on microstructure (determined by optical microscope) of emulsions
注:(a)小麦蛋白;(b)1:0;(c)0:1;(d)1:1;(e)2:1;(f)1:2;比例尺:20 μm。
从图7 的脂肪酸释放曲线可以看出,在模拟小肠消化实验中,相比于依靠小麦蛋白、单一的麦醇溶蛋白和麦谷蛋白稳定的乳液,经过组分调节后的乳液,游离脂肪酸(FFA)释放速率变化较为缓慢,尤其在前2000 s,比例为1:2 的样品存在明显的FFA 缓释区域,最终FFA 释放量也最低。体内的消化实质上是肠液各组分(如胆盐、脂肪酶、矿物离子)在乳滴界面共同作用的结果,同样是一种界面主导的体系[13]。因此,通过操控麦醇溶蛋白和麦谷蛋白这两种组分的比例所制备而成的乳液,拥有稳定而致密的界面层-麦醇溶蛋白在界面上形成稳定的界面层,同时大分子麦谷蛋白在界面上起到支撑保护的作用,两者在界面的协同使得乳液可以经受胃蛋白酶及胰脂肪酶的酶解,界面层难以被胆盐和胰脂肪酶所取代,从而达到延缓脂肪消化的效果[14]。

图7 游离脂肪酸释放曲线
Fig.7 The calculated percentage of free fatty acids (FFA%)released
3 结论
本实验通过调控小麦醇溶蛋白和小麦谷蛋白的比例成功制备出了稳定性良好、并能延缓脂肪释放的乳液。由小麦蛋白稳定的乳液在储藏第5 d 就出现破乳现象,油相漏出,通过单一的麦醇溶蛋白、麦谷蛋白稳定的乳液在储藏的第30 d 开始破乳失稳,而通过比例调控制备的乳液在4 ℃下储藏30 d 后粒度变化不大,乳液始终稳定;经过90 ℃加热30 min 后,麦醇溶蛋白和麦谷蛋白的比例控制在1:2 时的稳定性最好,粒度基本保持不变,为28.33 μm 左右。在模拟胃肠消化实验中,乳液都能抵御胃蛋白酶的酶解消化,维持乳滴的形貌;然而在模拟小肠消化过程中,未经比例调控的组分出现破乳现象,而经过比例调控的组分仍能够保持其乳滴形貌;从游离脂肪酸释放曲线可以看到,在7200 s 的模拟小肠消化试验中,经过比例调控的组分游离脂肪酸释放变得缓慢,最终释放量减少,尤其是当麦醇溶蛋白和麦谷蛋白的比例控制在1:2时,延缓的趋势最为明显。这主要取决于麦醇溶蛋白和麦谷蛋白在界面上的协同作用,小分子麦醇溶蛋白良好的界面特性配合大分子麦谷蛋白提供的支撑保护作用使乳液界面层稳定而致密,抵挡外部环境对乳液的破坏,使乳液保持稳定。这有助于构建界面主导的食品乳液体系,同时设计出具有控制油脂释放功能的食品。
[1] Dickinson E. Emulsion gels: The structuring of soft solids with protein-stabilized oil droplets [J]. Food Hydrocolloids,2012, 28(1): 224-241
[2] Mao L, Lu Y, Cui M, et al. Design of gel structures in water and oil phases for improved delivery of bioactive food ingredients [J]. Critical Reviews in Food Science and Nutrition, 2019: 1-16
[3] Wijaya W, Van der Meeren P, Wijaya C H, et al. High internal phase emulsions stabilized solely by whey protein isolate-low methoxyl pectin complexes: effect of pH and polymer concentration [J]. Food & Function, 2017, 8(2): 584-594
[4] Payne P I, Holt L M, Jackson E A, et al. Wheat storage proteins: their genetics and their potential for manipulation by plant breeding [J]. Philosophical Transactions of the Royal Society of London. B, Biological Sciences, 1984, 304(1120):359-371
[5] Lagrain B, Brijs K, Delcour J A. Reaction kinetics of gliadin-glutenin cross-linking in model systems and in bread making [J]. Journal of Agricultural and Food Chemistry, 2008,56(22): 10660-10666
[6] Liu X, Chen X W, Guo J, et al. Wheat gluten based percolating emulsion gels as simple strategy for structuring liquid oil [J]. Food Hydrocolloids, 2016, 61: 747-755
[7] Scheuble, N., Lussi, M., Geue, T., Carrière, F., & Fischer, P.Blocking gastric lipase adsorption and displacement processes with viscoelastic biopolymer adsorption layers [J].Biomacromolecules, 2016, 17(10), 3328-3337
[8] Zhou F Z, Yan L, Yin S W, et al. Development of Pickering emulsions stabilized by gliadin/ proanthocyanidins hybrid particles (GPHPs) and the fate of lipid oxidation and digestion [J]. Journal of Agricultural and Food Chemistry,2018, 66(6): 1461-1471
[9] Gao Z M, Yang X Q, Wu N N, et al. Protein-based pickering emulsion and oil gel prepared by complexes of zein colloidal particles and stearate [J]. Journal of Agricultural and Food Chemistry, 2014, 62(12): 2672-2678
[10] 徐丽青.岩藻黄素纳米乳液的制备、性质及体外释放研究[D].南昌:南昌大学,2015 XU Li-qing. Preparation, characterization and in vitro digestion of fucoxanthin emulsion [D]. Nanchang:Nanchang University, 2015
[11] Ridgley D M, Ebanks K C, Barone J R. Peptide mixtures can self-assemble into large amyloid fibers of varying size and morphology [J]. Biomacromolecules, 2011, 12(10):3770-3779
[12] Liu X, Guo J, Wan Z L, et al. Wheat gluten-stabilized high internal phase emulsions as mayonnaise replacers [J]. Food hydrocolloids, 2018, 77: 168-175
[13] Wu N N, Huang X, Yang X Q, et al. In vitro assessment of the bioaccessibility of fatty acids and tocopherol from soybean oil body emulsions stabilized with ι-carrageenan [J].Journal of Agricultural and Food Chemistry, 2012, 60(6):1567-1575
[14] Bellesi F A, Martinez M J, Ruiz-Henestrosa V M P, et al.Comparative behavior of protein or polysaccharide stabilized emulsion under in vitro gastrointestinal conditions [J]. Food Hydrocolloids, 2016, 52: 47-56