细叶小檗(Berberis poiretii)是一种主要分布在东北、内蒙古、河北等地的落叶灌木,为小檗科(Berberidaceae)小檗属[1]。除了根和茎,小檗果实中也含有具生物活性成分的小檗碱、小檗胺、巴马汀、哥伦胺和苦参碱等,合称为总生物碱[2],特别是小檗碱,对痢疾[3]、传染性原虫[4]、肿瘤[5]具有抵抗作用,也常用于调节血糖[6]、血脂[7]、血压[8]和心率失常[9]等多种疾病,人们愈加重视小檗碱抑制肠道菌对人体内分泌[10]、脑功能[11]的研究;其抑菌杀虫功效在农牧领域中的应用也备受关注[12,13]。
小檗碱等生物碱是一种含氮碱基的有机化合物,在黄连等植物中含量并不高[14-16],所以大多提取工作聚焦于开发新的中药资源与优化工艺提高小檗碱得率,目前提取方法主要有酸水法[17]、碱水法[18]、乙醇提取法[19]和超临界流体提取法[20]等。对于其性质和效用的研究国内外学者也已经做了大量的研究[21,22],但不同的工艺参数对抑菌活性的影响鲜有报道;人体肠胃具有特殊的化学环境,亟需探讨小檗碱的降解动力学行为;为了使生物碱在有限资源条件下发挥最大效用,探究小檗碱及其抑菌活性在不同的提取加工条件下的稳定性和降解行为具有重要意义。
该实验以细叶小檗果中提取的总生物碱为对象,建立总生物碱残留量和抑菌圈内外差值(D-d)双指标,研究不同的工艺条件对总生物碱含量和抑菌活性的影响,同时以动力学角度分析总生物碱含量与抑菌活性的稳定性变化,并计算总生物碱在变化过程的动力学参数,为细叶小檗果这一植物资源的有效利用提供参考,为把控和优化小檗碱的深加工提供理论依据。
1 材料与方法
1.1 试剂与仪器
细叶小檗果实,黑龙江省鹤岗市;供试菌种:大肠杆菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)和枯草芽孢杆菌(Bacillus subtilis),东北林业大学微生物实验室;盐酸小檗碱标准品(纯度≥95%),上海源叶生物科技有限公司;试剂均为分析纯。
PHS-3E pH 计,上海精密科学仪器有限公司;KQ-300DE数控超声波清洗器,昆山市超声仪器有限公司;UV-1810型紫外分光光度计,上海普析公司;IS-RSD3 台式恒温振荡器,美国精骐有限公司;超净工作台,美国西盟有限公司;RE-2000A 旋转蒸发器,巩义市予华仪器有限责任公司;SHZ-D(Ⅲ)循环水式真空泵,巩义市予华仪器有限责任公司;DK-8D 三孔电热恒温水槽,上海一恒科学仪器有限公司;DH6000A 型电热恒温培养箱,天津市泰斯特仪器有限公司;手提式压力蒸汽灭菌锅,上海博讯实业有限公司医疗设备厂;高速万能粉碎机,天津市泰斯特仪器有限公司;10×7.8×6 mm 牛津杯,新华乡新华检测仪器厂。
1.2 实验方法
1.2.1 细叶小檗总生物碱的提取与测定
将预先整理干净且充分干燥的细叶小檗果实粉碎,采用超声波辅助半仿生法[23]提取果实中的总生物碱,乙醇含量27%(V/V)、液料比32 mL/g、温度52 ℃、超声功率800 W,逐步调节提取液的pH 值为为2.2、7.6 和8.5,对应提取时间依次为50 min、25 min 和25 min,抽滤除去残渣,旋转蒸发得到总生物碱,备用。
采用紫外分光光度法测定盐酸小檗碱的标准曲线,精确称取盐酸小檗碱标准品0.0043g,用乙醇溶解并移至100 mL容量瓶中作为储备液。精密吸取总储备液1、2、3、4、5、6 mL 于25 mL 具塞试管中定容,在紫外分光光度计的波长345nm 处分别测定其吸光度值y,以吸光度值y、盐酸小檗碱浓度x,制作标准曲线,并计算总生物碱得率与浓度。
1.2.2 细叶小檗总生物碱抑菌活性的测定
经过前期大量的试验探索,确定了以琼脂-孔洞扩散法反映抑菌活性。采用抑菌圈直径(D)与空白抑菌圈直径即牛津杯外径(d)的差值,(D-d)值作为抑菌活性的评价指标[24]。将大肠杆菌、金黄色葡萄球菌和枯草芽孢杆菌分别接于LB 液体培养基中,在37℃下活化培养至对数生长期,调整菌悬液浓度为105~106 cfu/mL,菌液涂布量为0.2 mL,琼脂培养基加液量为20 mL,采用平板涂布法制备含菌平板,使用牛津杯,每个平板4个孔(样品2个,对照1个,pH 或乙醇对照以排除干扰因素),每孔加样量为0.18mL,于无菌操作间中预扩散2 h,再放入37℃恒温培养箱中培养12 h,测量记录抑菌圈直径。
1.2.3 环境因素对细叶小檗总生物碱抑菌活性影响的研究1.2.3.1单一影响因素的研究
将1.2.1 所得的总生物碱分别在梯度的pH 值、温度和紫外光照与自然光照下处理一定时间,定时取样测量记录,并计算总生物碱的残留量和抑菌圈的变化。
pH 对总生物碱活性的影响:使用5 mol/L HCl 或NaOH溶液分别调节pH 为2、4、6.8、9、11,定容后于棕色容量瓶中避光常温放置,在0 d、5d、10 d、15d、20 d、25d、30 d 取样,测定浓度并进行抑菌试验,原pH 的总生物碱为对照,每个平板设置相同pH的空白对照。
温度对总生物碱活性的影响:取一定量总生物碱于棕色容量中,于60、70、80、90、100 ℃的恒温水浴中热处理,在0、4、8、12、16、20 h 后取样,测定浓度并进行抑菌试验,室温下放置的总生物碱为对照。
光照对总生物碱活性的影响:取一定量总生物碱于透明容量瓶中置于自然光照下室温下放置一定时间,在0、5、10、15、20、25、30 d 取样,测定浓度并进行抑菌试验,以避光处理的总生物碱为对照。
紫外对总生物碱活性的影响:将一定量总生物碱在紫外灯(功率为20W,垂直距离40cm)下处理,并在0、0.5、1、1.5、2、2.5、3h 时取样,测定浓度并进行抑菌试验,以避光处理的总生物碱为对照。
1.2.3.2酸碱与热交互作用对抑菌活性的研究
将总生物碱分别在pH 2、11 的环境80 ℃下处理48 h,每隔8 h 取样,进行残留量测定和抑菌实验,原pH 的总生物碱在80 ℃下处理48 h 为对照,以三种细菌的抑菌圈平均值作图。
1.2.4 细叶小檗总生物碱的热降解模型
对本实验中总生物碱的热降解进行零级或一级反应的动力学反应模型判别,根据动力学模型[25,26]计算热处理过程中生物碱在相应反应级数下的降解速率常数k、线性回归分析相关系数R2。
式中:f(c),反应物在时间为t 时刻的质量浓度,mg/mL;f(c0),反应物在t=0时的浓度,mg/mL;t,反应时间,h;k,在相应贮藏条件下反应物降解反应相关速率常数。
计算零级反应和一级反应的半衰期:
式中:t1/2,反应物被消耗掉1/2 即f(c)=f(c0)/2 时,所需要的反应时间,h。
计算出反应的活化能:
式中:A,是对于指定反应与反应物质量浓度和反应温度均无关系的常数;Ea“活化能”,也称为“阿累尼乌斯活化能”;R,气体常数;T,绝对温度,K。
1.2.5 数据处理方法
抑菌平板试验与含量测量试验均设置3 个平行,试验结果采用SPSS软件进行显著性差异分析,数据表示方式为(平均数±方差),作图工具为Origin 2018。
2 结果与分析
2.1 总生物碱的提取
建立盐酸小檗碱标准曲线方程为y=69.477x-0.0128,R2=0.9993。根据标准曲线计算,细叶小檗果实中的总生物碱得率为15.66 mg/g,与符群等[23]提取效率基本一致。经旋转蒸发得无乙醇味的总生物碱,总生物碱浓度为5.6mg/mL,呈深红色的粘稠液态,含较多固形物,经测量pH 为7。
2.2 单一因素的影响
2.2.1 pH 对总生物碱的影响
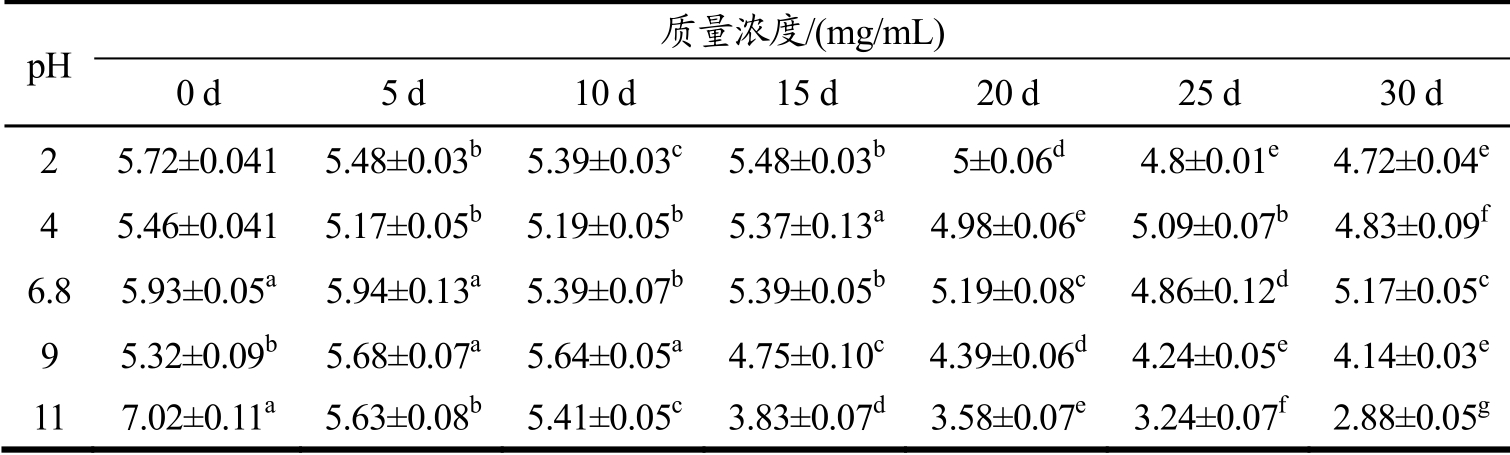
表1不同pH 条件下处理一定时间对总生物碱残留量的影响
Table 1 The effect of treatment at different pH conditionsfor a certain time on total alkaloid residues
注:结果以均值±标准差表示,同一行数据不同字母表示显著性差异(p<0.05)。
pH 质量浓度/(mg/mL)0 d 5d 10 d 15d 20 d 25d 30d 2 5.72±0.0415.48±0.03b 5.39±0.03c 5.48±0.03b 5±0.06d 4.8±0.01e 4.72±0.04e 4 5.46±0.0415.17±0.05b 5.19±0.05b 5.37±0.13a 4.98±0.06e 5.09±0.07b 4.83±0.09f 6.8 5.93±0.05a 5.94±0.13a 5.39±0.07b 5.39±0.05b 5.19±0.08c 4.86±0.12d 5.17±0.05c 9 5.32±0.09b 5.68±0.07a 5.64±0.05a 4.75±0.10c 4.39±0.06d 4.24±0.05e 4.14±0.03e 117.02±0.11a 5.63±0.08b 5.41±0.05c 3.83±0.07d 3.58±0.07e 3.24±0.07f 2.88±0.05g
将提取的总生物碱调节为pH 2、4、6.8、9 和11后,30 d 内定时取样测量总生物碱残留量,原pH 组为对照,结果如表1 所示。
由表1可知,在相同pH 下,随着处理时间的增加,总生物碱的终残留量明显下降,变化显著;pH 2和pH 4 组的终残留量分别为4.72 和4.83 mg/mL,pH 6.8条件下总生物碱最终残留量最大为5.17mg/mL,pH 9 和pH 11 的终残留量分别为4.14 和2.88 mg/mL,可以看出中性和酸性环境有利于总生物碱的保存;pH 9、11条件下总生物碱残留量较少,说明碱性环境对小檗碱的破坏力更强。记录总生物碱在经pH 处理30 d后抑菌活性的变化,原pH组为对照,结果如图1所示。
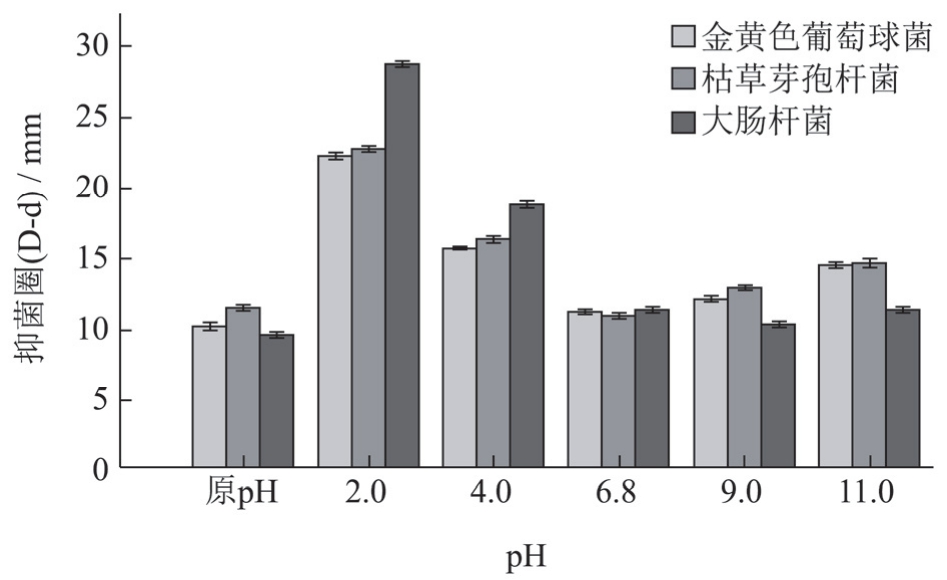
图1不同pH 条件下处理一定时间对抑菌活性的影响
Fig.1 The effect of treatment at different pH conditions for a certain time on antibacterial activity
如图1 所示,与对照组相比,总生物碱在经酸性条件处理后对三种细菌的抑制效果得到增强,pH 2 组显著增强,提高了1倍,尤其是对大肠杆菌的(D-d)值在pH 2 时提高了18 mm;pH 6.8 条件下的抑菌圈大小与原pH生物碱没有显著差别;在经碱性条件处理后,抑菌效果提高了3mm;pH 2 条件下抑菌活性是最强的。
部分研究[27,28]认为小檗碱对于G+细菌的抑制效果要强于G-细菌,但本研究显示小檗碱酸化后对大肠杆菌抑制效果显著,小檗碱碱化后对金黄色葡萄球菌和枯草芽孢杆菌的抑制效果更为显著。
抑菌活性的效果如图2 所示,2、4 为pH 实验组样,1 为相应pH 的对照,3 为原pH 总生物碱的对照。
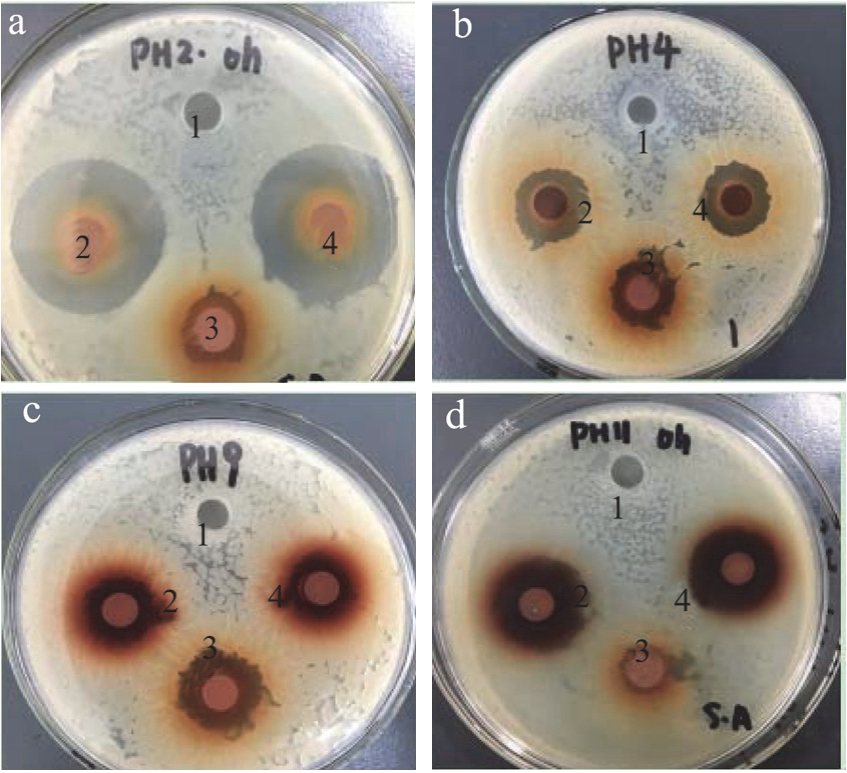
图2抑菌试验结果
Fig.2 Antibacterial test results
如图2 所示,1 相应的pH 对照没有抑菌圈,所以排除pH 对抑菌效果的干扰;pH 2 和4 平板图中2、4抑菌效果明显增强,pH 9 和11 平板图中2、4 抑菌效果增强,说明酸化与碱化对总生物碱的抑菌活性均有强化效果。
资料表明[29],总生物碱中的主要活性成分小檗碱,是一种异喹啉类生物碱,表现为季铵型、醇型、醛型3 种互变异构体,其中以季铵碱型最稳定。本文利用超声辅助半仿生法提取的总生物碱中既有小檗碱,又有盐酸小檗碱,经酸处理后,带正电的小檗碱易和带负电荷的离子或分子结合[30],大部分转化盐酸小檗碱等氯酸盐,是稳定的季铵碱型,因此抑菌活性显著增强,郑红艳等[29]研究发现季铵结构是原小檗碱抑菌活性所必须的结构,且C2、C3位上2 个亚甲二氧基可以增强抑菌活性;经碱处理,在热的NaOH 溶液中,盐酸小檗碱又可以转化回小檗碱[27],变为醛型或醇型结构,活性降低,抑菌效果相对季铵碱型较差。
2.2.2 温度对总生物碱的影响
表2不同温度条件下处理一定时间对总生物碱残留量的影响
Table 2 The effect of treatment at different temperature conditions for a certain time on total alkaloid residues
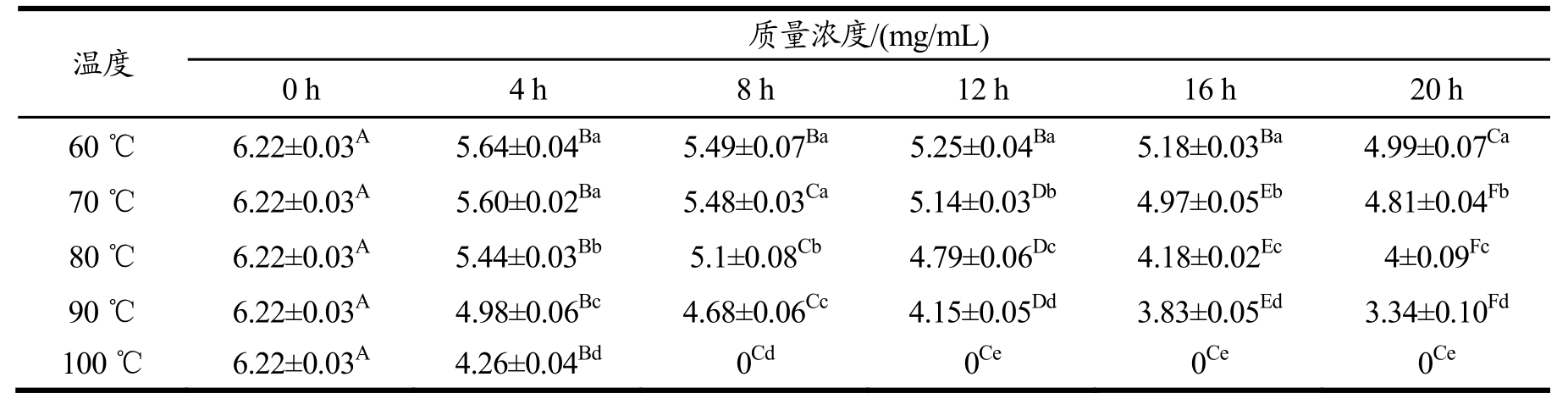
注:同一行上标大写字母者与同一列上标小写字母者为差异显著(p<0.05)。表4 同。
温度 质量浓度/(mg/mL) 0 h 4 h 8 h 12 h 16 h 20 h 60℃6.22±0.03A 5.64±0.04Ba 5.49±0.07Ba 5.25±0.04Ba 5.18±0.03Ba 4.99±0.07Ca 70℃6.22±0.03A 5.60±0.02Ba 5.48±0.03Ca 5.14±0.03Db 4.97±0.05Eb 4.81±0.04Fb 80 ℃6.22±0.03A 5.44±0.03Bb 5.1±0.08Cb 4.79±0.06Dc 4.18±0.02Ec 4±0.09Fc 90℃6.22±0.03A 4.98±0.06Bc 4.68±0.06Cc 4.15±0.05Dd 3.83±0.05Ed 3.34±0.10Fd 100 ℃6.22±0.03A 4.26±0.04Bd 0Cd 0Ce 0Ce 0Ce
记录在不同温度下处理20 h总生物碱残留量的变化,结果如表2 所示。
由表2 可知,总生物碱在100 ℃下超过4 h 会全部降解,90℃下超过20 h 会降解过半,60、70 和80 ℃下总生物碱的降解幅度相对较小;在同一温度下随着加热时间的增加总生物碱持续降解,变化显著;在同一时间随着处理温度的升高总生物碱的降解速率加快,变化显著,由此表明总生物碱的热稳定性很差,但呈现出稳定的降解状态。
记录总生物碱在不同温度下处理20 h后抑菌活性的变化,室温下的总生物碱做对照,结果如图3 所示。
由图3 可知,与空白对照相比,随着处理温度增加(60 ~80 ℃ ℃),抑菌活性不断减弱;在90 ℃下20 h、100 ℃下4 h 处理后抑菌活性会完全消失,说明热力作用对抑菌活性的破坏力十分强,总生物碱抑菌活性的热稳定性很差,这是由于小檗碱结构中9 号位是活性较大的部位,断裂9 号位-CH3在热力中是择优的[31]。
为了最大限度的保留总生物碱的有效成分和抑菌活性,建议对该类总生物碱的加工温度控制在80 ℃以下,允许80 ~100 ℃ ℃的短瞬时处理。
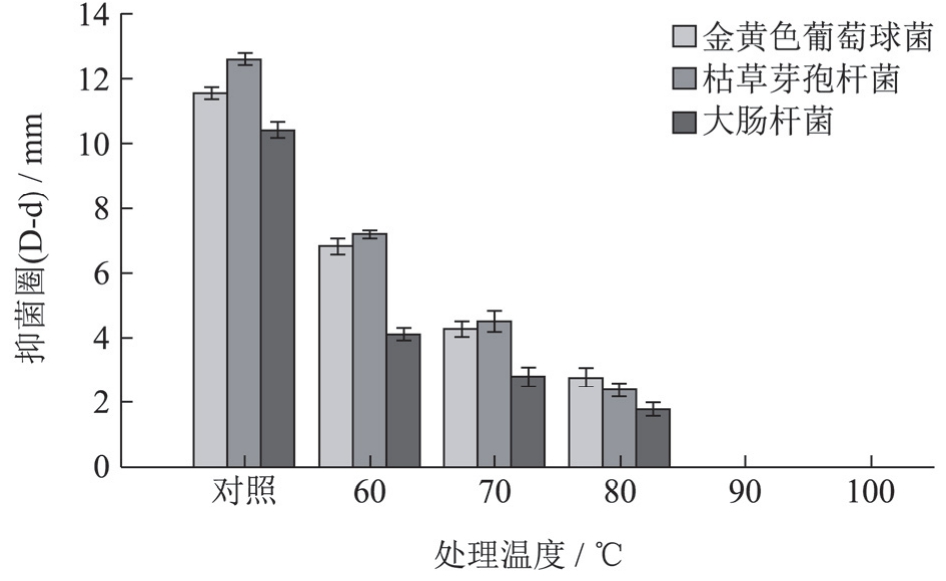
图3不同温度条件下处理一定时间对抑菌活性的影响
Fig.3 The effect of treatment at different temperature conditions for a certain time on antibacterial activity
2.2.3 光照对总生物碱的影响
记录总生物碱在室温下自然光照30 d和紫外照射3 h 内的变化,结果如表3 所示。
表3自然光照与紫外光照条件下处理一定时间对总生物碱残留量的影响
Table 3The effect of treatment at natural light and ultraviolet light condition for a certain time on total alkaloid residues
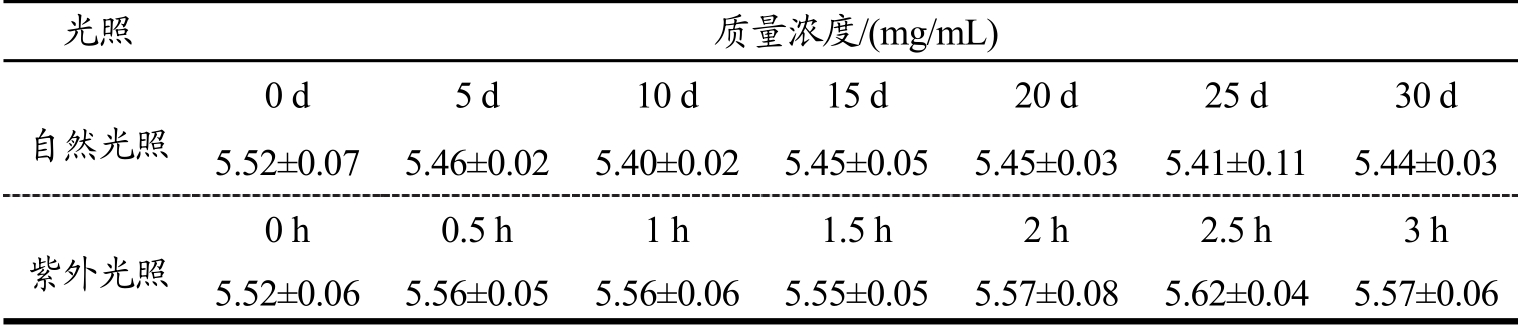
光照 质量浓度/(mg/mL) 自然光照0d 5d 10 d 15d 20d 25d 30 d 5.52±0.07 5.46±0.02 5.40±0.02 5.45±0.055.45±0.035.41±0.115.44±0.03紫外光照0 h 0.5 h 1 h 1.5 h 2 h 2.5 h 3 h 5.52±0.06 5.56±0.055.56±0.06 5.55±0.055.57±0.085.62±0.04 5.57±0.06
由表3可知,经过室温下自然光照30d 和紫外照射3 h 后,经SPSS显著性分析总生物碱残留量,并未发生显著性变化(p>0.05),说明自然光照与紫外照射对总生物碱的稳定性均没有影响。
记录总生物碱在室温下自然光照30d和紫外照射3 h 后抑菌活性的变化,对照组为避光处理,结果如图4所示。
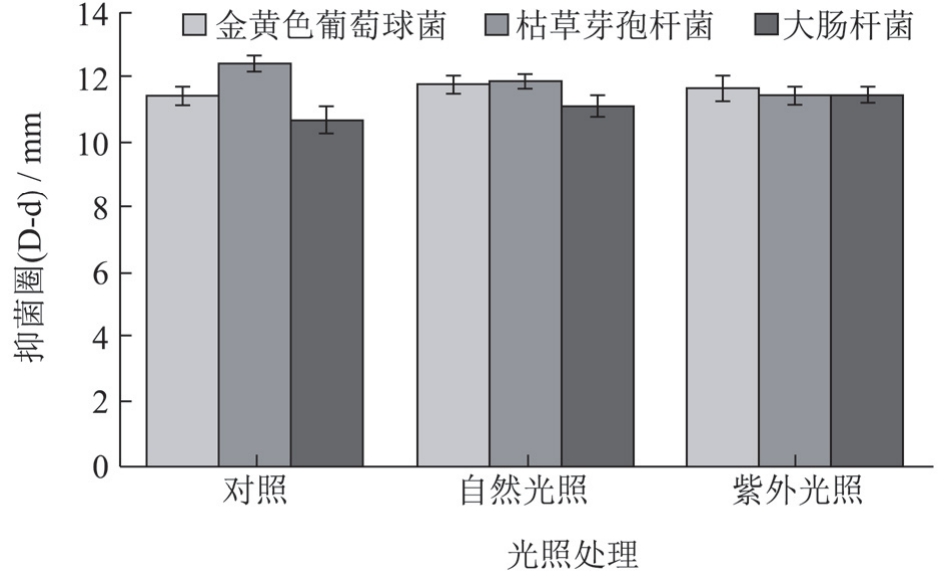
图4 自然光照与紫外光照条件下处理一定时间对抑菌活性的影响
Fig.4 The effect of treatment at natural light and ultraviolet light condition for a certain time on antibacterial activity
由图4可知,抑菌活性在光照处理前后几乎不发生改变,因此断定自然光照和紫外光照对总生物碱稳定性和抑菌活性没有影响。
2.3 抑菌活性在酸碱与热共同处理下的降解研究
基于实验1.2.3.1中pH组与温度组的结果,发现pH 组中总生物碱的含量降低,但抑菌活性却提高,并不成正比,因此设计了1.2.3.2中pH 与热处理的组合实验,考察经酸碱处理后增强的的抑菌活性的热稳定性,目的是探究小檗碱酸式盐、碱式盐与抑菌活性的内在联系。
记录总生物碱在pH 2、pH 11条件80 ℃下处理48 h 内的残留量变化,结果如表4所示。
由表4可知,总生物碱在pH 2、pH 11条件80 ℃下处理48 h 内,总生物碱残留量随着处理时间的增加持续降解,差异显著,说明热力作用持续降解小檗碱酸式盐与碱式盐。
记录总生物碱在pH 2、pH 11条件80 ℃下处理48 h 内抑菌活性的变化,原pH 的总生物碱在80 ℃下处理48 h 作对照,以三种细菌的抑菌圈平均值作图,结果如图5 所示。
由图5可知,原pH的总生物碱平均(D-d)为10 mm,总生物碱经酸化后(D-d)>20 mm,抑菌活性总体上显著提高了1倍,尤其对大肠杆菌(D-d)提高了18 mm,碱化后对菌金黄色葡萄球菌和枯草芽孢杆菌的抑菌活性(D-d)提高了3 mm;80℃下持续处理48 h后,对照组抑菌活性完全消失,虽然两pH处理组(D-d)随着热力的持续而减弱,但抑菌活性都得以保留,酸处理组(D-d)为20~22 mm,碱处理组(D-d)为5~9mm,说明酸化碱化均提高了小檗碱热稳定性,而小檗碱盐酸盐的热稳定性更强。
表4 80℃条件下处理一定时间对pH2、pH11 组中总生物碱残留量的影响
Table 4 The effect of treatment at 80 ℃conditions for a certain time on total alkaloid residue of pH 2 and pH 11group
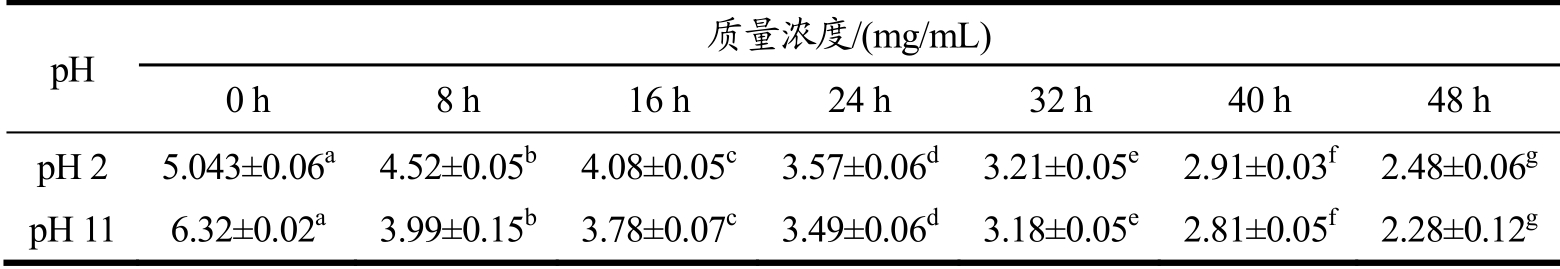
pH 质量浓度/(mg/mL) 0 h 8 h 16 h 24 h 32 h 40 h 48 h pH 2 5.043±0.06a 4.52±0.05b 4.08±0.05c 3.57±0.06d 3.21±0.05e 2.91±0.03f 2.48±0.06g pH 116.32±0.02a 3.99±0.15b 3.78±0.07c 3.49±0.06d 3.18±0.05e 2.81±0.05f 2.28±0.12g
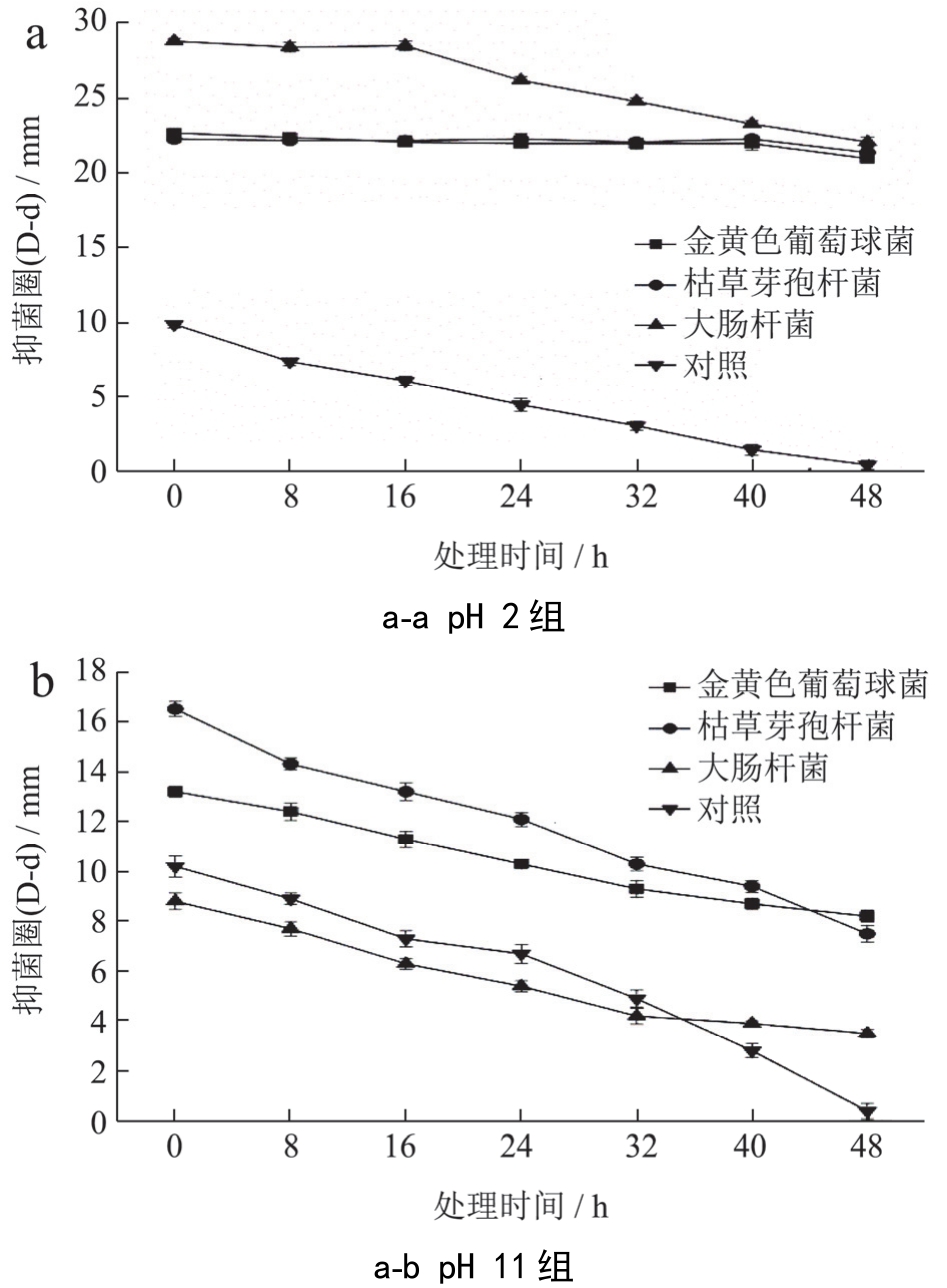
图580℃条件下处理一定时间对pH2、pH 11 组中总生物碱抑菌活性的影响
Fig.5 The effect of treatment at 80 ℃conditions for a certain time on antibacterial activity of pH 2and pH 11group
2.4 总生物碱的热降解动力学
在1.2.3.1 和1.2.3.2 研究的基础上,得到总生物碱经热力处理后降解的数据,通过1.2.4 中热降解模型计算热降解参数。
通过比较相应反应级数下的反应速率常数k 来推断降解反应快慢,比较零级和一级反应的线性回归系数R2来推断反应级数,较高的则可判定符合此级数。
表5 总生物碱在不同温度下热降解的零级和一级反应速率常数及回归系数
Table 5 Zero-order and first-order reaction rate constants and regression coefficients for thermal degradation of total alkaloids at different temperatures
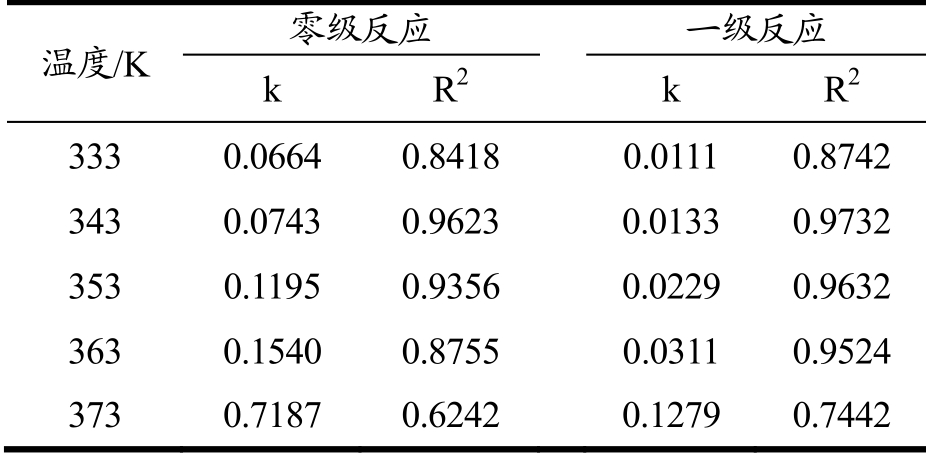
温度/K 零级反应 一级反应k R2k R2 3330.0664 0.84180.01110.8742 3430.07430.96230.01330.9732 3530.11950.9356 0.0229 0.9632 3630.1540 0.87550.03110.9524 3730.7187 0.6242 0.1279 0.7442
由表5可知,随着温度的升高速率常数也增大,总生物碱在不同温度下的一级反应的回归系数R2 要高于相应的零级反应,说明细叶小檗中总生物碱的热降解符合一级动力学反应。
表6 总生物碱的热降解参数
Table 6 Thermal degradation parameters of total alkaloids
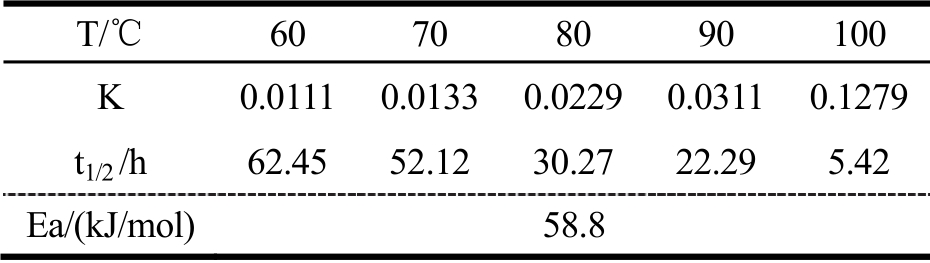
T/℃60 70 80 90 100 K 0.01110.01330.0229 0.03110.1279 t1/2 /h 62.4552.12 30.27 22.29 5.42 Ea/(kJ/mol)58.8
由表6 可知,根据Arrhenius 经验公式计算,活化能Ea 是细叶小檗中总生物碱热降解到达能峰所需要吸收能量,为58.8kJ/mol,相对稳定;总生物碱在梯度温度下的半衰期t1/2逐渐降低,说明受热温度越高,总生物碱降解的越快;100℃是最易分解的温度,建议在此温度下加工时控制处理时长。
由表7可知,细叶小檗中总生物碱在改变pH 后的热降解也符合一级动力学反应,K 与表6 中80 ℃下反应速率相近,说明改变pH 环境后的热降解速率并未受影响。
表780℃条件下处理一定时间后pH2、pH 11 组中总生物碱热降解的零级和一级反应速率常数及回归系数
Table 7 Zero-order and first-order reaction rate constants and regression coefficients of thermal degradation at 80 ℃for a certain time condition of total alkaloids of pH 2and pH 11 group
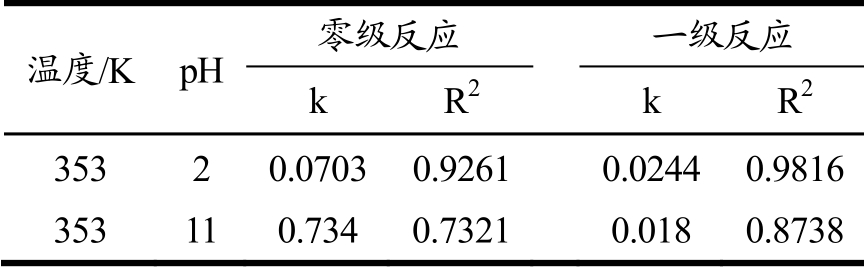
温度/K pH 零级反应 一级反应k R2 k R2 3532 0.07030.92610.0244 0.9816 353110.734 0.73210.018 0.8738
3 结论
3.1在细叶小檗果总生物碱对革兰氏阳性和阴性细菌广谱抑制的基础上,通过考察光照、温度以及pH值等单一因素对总生物碱的稳定性和抑菌活性的影响,以及其在pH 2酸溶液和pH 11碱溶液下的热降解。结果表明,温度和pH 值对细叶小檗果中总生物碱的稳定性和抑菌活性影响最为显著,自然光照与紫外照射对总生物碱的稳定性与抑菌活性均无影响。总生物碱的热降解速率随着温度的升高而加快,抑菌活性随着处理温度的升高而减弱,在90 ℃处理20 h、100 ℃处理4h 后完全失活。总生物碱经酸与碱处理后抑菌活性均有增强,经酸化后抑菌活性提高了13~18 mm,尤其对大肠杆菌(D-d)为28 mm,碱化后对金黄色葡萄球菌和枯草芽孢杆菌的抑菌活性提高了3~5mm;80 ℃下持续处理48 h 后,对照组抑菌活性完全消失,虽然两pH组抑菌活性随着热力的持续而减弱,但抑菌活性仍得以保留,酸处理组(D-d)为20~22 mm,碱处理组(D-d)为5~9mm,可见酸化碱化均提高了总生物碱的热稳定性,小檗碱盐酸盐的热稳定性更强。总生物碱的热降解反应符合一级动力学模型,活化能Ea为58.80 kJ/mol,半衰期t1/2随着温度的升高而缩短。3.2 通过测定从人尿中分离的小檗碱代谢产物的含量,发现小檗碱不易被吸收,且在肠胃中较为稳定地存在,小檗碱被酸化后(胃液pH 0.9~1.5)抑菌活性得以增强和保留,所以具有较好的杀菌效果[32];有研究[33]表明,含小檗碱中药的抑菌活性与其所含的小檗碱量呈线性相关,而本研究通过酸化总生物碱,将抑菌活性增强了一倍,大大提高了中药材中小檗碱的有效利用率;大量研究通过复杂的取代反应来改造小檗碱的分子结构以改变药物特性,进而改变其体内外抑菌活性[22,27],小檗碱13 号位烷基取代衍生物的抑菌活性提高了近百倍[34],作者认为本研成果具有成本低易操作等优点,在提高小檗碱的抑菌活性和应用上具有一定的发展潜力。
3.3结合总生物碱的含量和抑菌活性在不同加工条件下的表现来看,小檗碱等总生物碱的适宜保存温度应控制在60 ℃以下,加工温度控制在80 ℃以下,处理时长控制在20 h 以内;适宜pH 为中性及酸性环境,在pH 2 下有最大抑菌活性;酸化碱化处理可在热加工中最大程度保留总生物碱的抑菌活性。
3.4 通过本研究结果证明,热力使总生物碱降解、抑菌活性减弱,并计算了总生物碱热降解动力学的参数;小檗碱在酸化碱化后可以提高抑菌活性与热稳定性,尤其是酸式盐形式,可以利用小檗碱的酸碱成盐特性提高和保护其抑菌活性,为小檗碱等生物碱的高效提取与深加工条件的把控提供科学的参考。
[1]BhardwajD, Kaushik N.Phytochemical and pharmacological studies in genus berberis [J].Phytochemistry Reviews,2012,11(4):523-542
[2]陈巍,武洲,田原,等.细叶小檗果实的化学成分研究[J].亚太传统医药,2012,8(3):23-24 CHEN Wei,WU Zhou,TIAN Yuan, et al.Study on chemical constituents of the fruit of Berberis poiretii Schneid [J].Asia-Pacific Traditional Medicine,2012,8(3):23-24
[3]韩俞,袁雨,李国峰,等.探讨头孢曲松联合小檗碱保留灌肠治疗急性细菌性痢疾的疗效[J].中国继续医学教育,2016,8(10):148-149 HAN Yu, YUAN Yu,LI Guo-feng,et al.To investigate the efficacy of ceftriaxone combined with berberine enema in the treatment of acute bacterial dysentery [J].2016,8(10):148-149
[4]陈亚楠.黄连根茎浸提物对绿藻和水溞的毒害作用[D].重庆:西南大学,2016 CHEN Ya-nan.The toxicity of coptis chinensis root extracts to daphnia carinata and green algae [D].Chongqing:Southwest University, 2016
[5]WU Yan-yan,LU Tong-ming,ZANG Lin-quan,et al.Effects of berberine on tumor growth and intestinal permeability in HCT116 tumor-bearing mice using polyamines as targets [J].Biomedicine & Pharmacotherapy, 2018,107:1447-1453
[6]HAO Zhang,JING Wei, RONG Xue,et al.Berberine lowers blood glucose in type 2 diabetes mellitus patients through increasing insulin receptor expression [J].Metabolism-clinical & Experimental,2010,59(2):285-292
[7]Zhang Yu-pei,Deng Yuan-jun,Tang Kai-rui,et al.Berberine ameliorates high-fat diet-induced non-alcoholic fatty liver disease in rats via activation of SIRT3/AMPK/ACC pathway [J].Current Medical Science,2019,39(1):37-43
[8]Ma Yu-guang,Liang Liang, Zhang Yin-bin,et al.Berberine reduced blood pressure and improved vasodilation in diabetic rats [J].Journal of Molecular Endocrinology,2017,59(3):191
[9]汪永孝,谭月华,盛宝恒,等.小檗碱抗缺血性心律失常的作用及其机理[J].中国药理学与毒理学杂志,1993,2:108-111 WANG Yong-xiao,TAN Yue-hua,SHENG Bao-heng,et al.Effect of berberine on cardiac arrhythmia following coronary artery occlusion and its mechanism [J].Chinese Journal of Pharmacology and Toxicology,1993, 2:108-111
[10]罗飞,李永民,田嘉铭,等.人参总皂苷合黄连小檗碱对慢性心衰大鼠神经内分泌的影响[J].时珍国医国药,2011,22(1):113-114 LUO Fei,LI Yong-min,TIAN Jia-ming,et al.Effects of ginseng total saponins combined with berberine on neuroendocrine in rats with chronic heart failure [J].Lishizhen Medicine and Materia Medica Research,2011, 22(1):113-114
[11]吴俊芳,刘天培.小檗碱对培养大鼠神经细胞内游离Ca~(2+)的影响[J].药学学报,1997,1:15-18 WU Jun-fang,LIU Tian-pei.Effect of berbrine on intracellular free Ca2+ concentration in cultured brain cells [J].Acta Pharmaceutica Sinica, 1997, 1:15-18
[12]董增贺,刘可杰,杨光,等.盐酸小檗碱复混配方防治果树腐烂病初报[J].北方果树,2006,3:14-15 DONG Zeng-he,LIU Ke-jie, YANG Guang,et al.Preliminary report on the prevention and treatment of fruit tree rot by berberine hydrochloride compounding formula [J].Northern Fruits, 2006,3:14-15
[13]汪水平,王文娟,陈祖鸿,等.小檗碱对肉兔生长发育与血液指标的影响[J].动物营养学报,2013.25(4):785-794 WANG Shui-ping,WANG Wen-juan,CHEN Zu-hong,et al.Effects of berberine on growth development and blood parameters of meat rabbits [J].Journal of Animal Nutrition, 2013,25(4):785-794
[14]刘萍,向灿辉,邓镇涛,等.黄连盐酸小檗碱的提取鉴定及抑菌活性研究[J].轻工科技,2011,27(1):3-4 LIU Ping,XIANG Can-hui,DENG Zhen-tao,et al.Extraction and identification of berberine hydrochloride and itsantibacterial activity [J].Guangxi Light Industry,2011,27(1):3-4
[15]王柳卜,贾宪生,胡成刚,等.三颗针中盐酸小檗碱、盐酸药根碱及盐酸巴马汀的含量测定[J].时珍国医国药,2011,22(1):175-177 WANG Liu-bo,JIA Xian-sheng,HU Cheng-gang,et al.Determination of berberine hydrochloride,jatrorrhizine hydrochloride and palmatine hydrochloride in three needles [J].Shi Zhen National Medicine,2011,22(1):175-177
[16]席国萍.黄连中小檗碱的提取、分离和纯化的研究[D].贵阳:贵州大学,2005 XI Guo-ping.Study on extraction,isolation and purification of berberine from rhizoma coptidis [D].Guiyang:Guizhou University,2005
[17]郭慧琳,贺奋义,杨明.正交试验优选酸水法提取黄连中小檗碱的工艺及其抑菌活性的研究[J].畜牧兽医杂志,2013,32(4):12-14 GUO Hui-lin, HE Fen-lin,YANG Ming.Optimization of acid-water method for extracting berberine from rhizoma coptis by orthogonal design and study on its antibacterial activity in vitro [J].Journal of Animal Husbandry and Veterinary Medicine, 2013,32(4):12-14
[18]刘婷.黄连叶片与须根中小檗碱的提取纯化研究[D].杨凌:西北农林科技大学,2010 LIU Ting.Study on extraction and purification of berberine from the leaves and fibrous roots of coptis chinensin [D].Yangling: Northwest A & F University,2010
[19]罗音久,曾中良,古淑英.黄连须中盐酸小檗碱的提取工艺研究[J].四川畜牧兽医学院学报,2002,3:17-20 LUO Yin-jiu,ZENG Zhong-liang,GU Shu-ying.Study on the extraction procedure of berberine-hydrochloric from fibrous radix coptis [J].Journal of Sichuan College of Animal Science and Veterinary,2002,3:17-20
[20]佟若菲,张秋爽,朱雪瑜.黄连中生物碱的超临界CO2萃取工艺研究[J].天津药学,2010,22(5):71-73 TONG Ruo-fei,ZHANG Qiu-shuang,ZHU Xue-yu.Optimization of process of alkaloids from rhizoma coptidis by supercritical CO2 extraction [J].Tianjin Pharmacy,2010,22(5):71-73
[21]Sona J,Lubos C,Marta C,et al.Effects of berberine on proliferation,cell cycle and apoptosisin Hela and L1210 cells [J].Journal of Pharmacy & Pharmacology,2003.55(8):1143-1149
[22]李慧玉,袁梽漪,王玉刚,等.小檗碱抑菌作用的研究:调控肠道菌代谢的可能性及其意义[J].世界科学技术-中医药现代化,2017,19(4):596-601 LI Hui-yu,YUAN Zhi-yi,WANG Yu- gang,et al.Berberine effect of anti-microbiota:possibility and clinical significance on gut microbiota and metabolism:a review [J].World Science and Technology-Modernization of Traditional Chinese Medicine,2017,19(4):596-601
[23]符群,张海婷.半仿生法提取细叶小檗总生物碱及抑菌性研究[J].北京林业大学学报,2018,40(5):121-127 FU Qun,ZHANG Hai-ting.Using the method of semi-bionic to extract total alkaloids from berberis poiretii and to study the antibacterial property [J].Journal of Beijing Forestry University,2018,40(5):121-127
[24]李萍,张兰,舒展,等.琼脂-孔洞扩散法测定物质抑菌活性中相关影响因素的探讨[J].中国调味品,2017,42(8):52-57 LI Ping,ZHANG Lan,SHU Zhan,et al.Study on the related factors of the determination of antimicrobial activity by of agar-hole diffusion method [J].China Spices,2017,42(8):52-57
[25]郭庆启,张娜.树莓果汁中花色苷降解动力学的研究[J].中国林副特产,2011,5:35-37 GUO Qing-qi, ZHANG Na.Degradation kinetics of anthocyanins in raspberry juice [J].China Forestry Deputy Specialty,2011,5:35-37
[26]刘长姣,申丹妮,王磊,等.黑米花色苷热降解动力学研究[J].中国食品添加剂,2018,173(7):109-113 LIU Chang-jiao,SHEN Dan-ni, WANG Lei,et al.Thermal degradation kinetics study on black rice anthocyanins [J].Chinese Food Additive, 2018,173(7):109-113
[27]钟慈平,骞宇,舒畅,等.小檗碱及其衍生物抑菌作用研究进展[J].食品科学,2013,34(7):321-325 ZHONG Ci-ping,QIAN Yu,SHU Chang,et al.Research progress in antimicrobial effects of berberine and its derivativess [J].Food Science,2013,34(7):321-325
[28]杨庆珍,郑司浩,黄林芳.小檗碱提取方法和药理活性研究进展[J].中国新药杂志,2015,5:519-525 YANG Qing-zhen, ZHENG Si-hao,HUANG Lin-fang.Advance in extraction methods and pharmacological activities of berberine [J].Chinese Journal of New Drugs,2015,5:519-525
[29]郑洪艳.原小檗碱类生物碱作用差异的机理研究[D].天津:天津医科大学,2004 ZHENG Hong-yan.Experimental and theoretical studies of protoberberine alkaloids on the mechanism of multiple activities [D]. Tianjin: Tianjin Medical University, 2004
[30]张茜,朴香淑.小檗碱抑菌作用研究进展[J].中国畜牧杂志,2010,46(3):58-61 ZHANG Qian,PU Xiang-shu.Advance in antimicr obial activities of berberine [J].Chinese Animal Husbandry Magazine, 2010, 46(3):58-61
[31]胡冬华,袁绪富.黄连素的提取及分子活性部位研究[J].长春中医药大学学报,2006,22(1):67 HU Dong-hua,YUAN Xu-fu.Extraction and molecular active site of berberine [J].Journal of Changchun College of Traditional Chinese Medicine, 2006, 22(1):67
[32]朱志勇.小檗碱在人及大鼠体内代谢产物的研究[D].沈阳:沈阳药科大学,2002 ZHU Zhi-yong.Study on the metabolites of berberine in human and rat [D].Shenyang:Shenyang Pharmaceutical University,2002
[33]金建玲,栾永娜,华国强,等.含小檗碱中药的抑菌活性与小檗碱含量的关系[J].中医药学报,2005,33(5):19-21 JIN Jian-ling,LUAN Yong-na,HUA Guo-qiang,et al.Relationship between antibacterial activity of berberine containing Chinese medicine and berberine content [J].Journal of Traditional Chinese Medicine, 2005,33(5):19-21
[34]陆阳.13位烷基取代原小檗碱季铵盐类的抗菌活性[J].中草药,1998,5:356LU Yang.Antibacterial activity of 13-position alkyl substituted pro-berberine quaternary ammonium salt [J].Chinese Herbal Medicine,1998,5:356