蛋白质是一类重要的食物营养成分,能为人体提供自身无法合成而细胞代谢所必需的氨基酸。但是其结构通常受pH、离子强度,温度(高温/冻融)、有机溶剂等影响而发生改变,进而影响蛋白质的功能性质,这极大限制了蛋白质在食品领域的应用。因此,大量研究通过物理、化学或酶法等处理方式改变蛋白质的性质而来获得不同用途的食品配料[1,2],其中美拉德反应是一种温和绿色的蛋白质改性方式,在可控的时间、温度、pH和水分等条件下通过加热蛋白质与糖类接枝实现改性[1]。多糖是高度稳定、安全无毒、亲水、可生物降解的天然生物聚合物,自然资源丰富,种类繁多,加工成本低并含有多种活性基团,其广泛的分子量分布和不同的化学组成有助于蛋白结构的变异性[3],正是这些优点促使了多糖在蛋白质偶联物中的应用[4]。已有研究发现美拉德反应可改善蛋白质的乳化性能[5,6]、热稳定性[7]、抗氧化能力[8]等。
乳清分离蛋白(WPI)是奶酪工业的副产品,主要由β-乳球蛋白(β-Lg)、α-乳清蛋白(α-La)、牛血清白蛋白(BSA)和其他微量蛋白组成[9],具有很高的营养价值。然而,在WPI常见的加工方式中,如蒸煮、烘焙、冲调、喷雾干燥等,WPI的结构受到破坏,乳化性能等功能性质降低,且其热稳定性较差,消化速度过快,无法满足人体对其营养成分的持续吸收,这些缺点制约了它的应用。低聚木糖是一种具有益生元潜力的寡糖,已被证明可以改善肠道微生态的平衡,并对代谢异常的个体有益,不仅具有较高的医疗价值[10],而且在食品工业生产中可替代蔗糖等高热量糖类[11],这归咎于低聚木糖几乎不能被人体消化,能减少糖分的摄入。此外,研究发现木糖在单糖美拉德反应来改性蛋白质提高MRPs抗菌活性和抗氧化活性方面表现优异[12,13],而低聚木糖作为美拉德反应底物却很少被研究。
故本研究以低聚木糖和WPI为对象,采用湿热法进行美拉德反应,探究不同比例的低聚木糖-WPI体系的美拉德反应程度及其产物的主要功能性质,以期为WPI糖基化和其美拉德反应产物的应用提供参考。
1 材料与试剂
1.1 原料
乳清分离蛋白,美国Hilmar公司(Hilmar 9410,蛋白质>93.0%)。
低聚木糖(≥95%),生化级,上海金穗生物科技有限公司。
1.2 仪器与设备
TU-1900紫外可见分光光度计,北京普析通用仪器有限公司;Zetasizer Nano ZSE纳米粒度电位仪,英国马尔文公司;Ultra Turrax T18高速分散机,德国IKA公司;PHS-3C精密pH计,上海雷磁新径仪器有限公司;DHR-2流变仪,美国TA公司。
1.3 实验方法
1.3.1 WPI-低聚木糖美拉德反应产物的制备
分别称取适量低聚木糖与 WPI分散在去离子水中制备固形物浓度为10%(W/V)的溶液,改变低聚木糖与WPI质量比分别为1:1、1:2、1:3、1:4,在4 ℃冰箱中充分水合12 h得到溶液。反应前用0.1 mol/L NaOH调节溶液的pH为8.0,90 ℃水浴加热,不同时间分别取样后迅速冰浴终止反应,所得溶液经冷冻干燥留待后用。
1.3.2 pH的测量
取反应过程中0 min、30 min、60 min、90 min、120 min、150 min样品通过冰浴终止反应后测定体系的pH值变化。
1.3.3 UV-Vis吸光度的测量
参考 Kim & Lee[14]的方法,在 294 nm 处测定MRPs的吸光度,作为非酶促褐变中间产物形成的指标;在420 nm处测定MRPs的吸光度,作为在更高级阶段形成棕色聚合物的指标。
1.3.4 MRPs粒径测量
取1.3.1中制备的MRPs溶液,用去离子水稀释1000倍,分析MRPs溶液粒径大小,得到平均粒径。
1.3.5 MRPs的乳化活性及稳定性测定
参考Zhao[15]的方法略有改进,采用比浊法测定样品的乳化性质。为制备乳液,将4.0 mL精制花生油和16.0 mL蛋白含量为1 mg/mL样品溶液在0.1 mol/L磷酸盐缓冲液(pH 7.0)中一起在100 mL玻璃烧杯中摇动并通过高速分散机在12000 r/min下保持1 min。将等份的新鲜制备的乳液(50 µL)从烧杯底部0.5 cm处取出并分散到5 mL 0.1% (W/V)十二烷基硫酸钠(SDS)溶液中。以0.1% (W/V) SDS溶液作为空白对照,在500 nm下测量溶液的吸光度A0。将乳液静置10 min后,迅速从烧杯底部0.5 cm处取50 µL等份试样并分散到5 mL 0.1% (W/V) SDS溶液中,再次在500 nm下测量溶液的吸光度A10。按照下式计算乳化活性指数(EAI)和乳液稳定性指数(ESI):
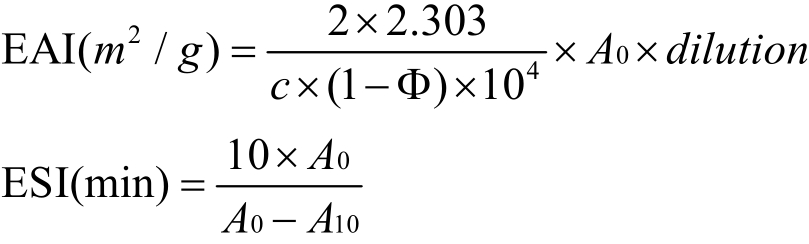
其中:稀释度(dilution)=100,c表示乳化前的蛋白质浓度(g/mL)和Φ为乳液的油体积分数(V/V,Φ= 0.20)。
1.3.6 MRPs流变学性质测定
用100 mM磷酸钠缓冲液(pH 7.0)来制备10%(W/V)的恒定蛋白质浓度 WPI-低聚木糖美拉德反应产物的水溶液。将溶液在环境温度(~25 ℃)下适度搅拌下搅拌3小时,然后在4 ℃下储存过夜以确保完全水合。在流变特性测量之前,将储备液脱气以防止凝胶中形成气泡。将10%(W/V)WPI溶液作为空白对照。
采用DHR-2流变仪对MRPs的动态和静态流变学性质进行测定。平板直径为40 mm,板间距离为1000 μm。参考Sun[16]等人的方法稍加改进,实验采用温度扫描测试来测定MRPs动态流变学特性。为了防止水分蒸发,将一薄圈硅油滴加到样品暴露的边缘上。将溶液以 5 ℃/min的速率从 25 ℃加热至 90 ℃,在90 ℃下保持30 min,然后以5 ℃/min的速率冷却至25 ℃并恒温持续10 min。在整个处理过程中,在6.28 rad/s的频率和 1%的应变幅度下连续记录储能模量(G')和损耗模量(G'')作为时间的函数。为了确保在所有频率扫描期间记录的数据在线性粘弹性区域内,应变幅度水平设定为1%。参考Jiang[17]的方法,将悬浮液加载到流变仪上并使其平衡至测量温度(25 ℃)1 min。通过监测表观粘度作为施加的剪切速率(0.1~100 s-1)的函数来获得流动曲线。
1.3.7 实验数据处理
所有实验至少重复 3次,实验数据以平均值±标准差表示。数据采用 Origin 9.6进行绘制,并进行ANOVA单因素方差分析中的Turkey检验,p<0.05表明数据间存在显著性差异。
2 结果与分析
2.1 反应中溶液pH变化
在美拉德反应期间不同比例的低聚木糖与 WPI体系 pH变化如图 1所示。随着反应时间的延长,4个体系的pH均呈现下降趋势。在反应最初的0.5 h内体系pH迅速下降,此后pH缓慢下降直至反应结束,并且pH从8.01降至7.77~7.51,其中低聚木糖与WPI比例为1:4时,pH变化最小,比例为1:1时变化最大。pH降低可能存在两个原因:(1)糖降解成酸性物质,例如甲酸、乙酸和羟甲基糠醛[18]等,同时在反应初期时,迅速产生的酸性物质也促进了糖的降解[19];(2)美拉德反应其实是羰氨缩合反应,氨基酸的碱性基团-氨基不断与还原糖的羧基结合从而使反应体系的 pH值下降。在羰氨缩合反应后,糖通过反醇醛、烯醇化和脱水反应进行降解,这些反应都是碱催化反应[20],因此随着反应进行,pH降低,这些碱催化反应速率受到抑制,体系pH下降逐渐减慢,同时由于反应过程中的甲酸、乙酸、丙酮醛、乙二醛等物质进一步反应形成低碱性物质,从而抑制了体系的pH进一步下降。比例为1:1的体系在2~2.5 h时pH突然降低可能是由于该比例下氨基含量较少、羰基含量较大,反应后期美拉德反应速率降低,而糖的持续降解产生较多的酸性物质。
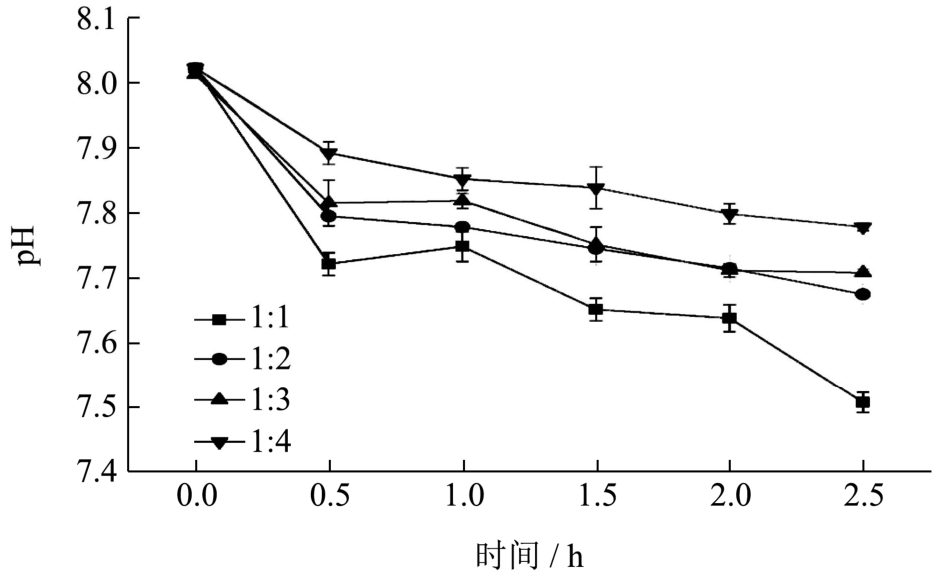
图1 不同比例低聚木糖与WPI美拉德反应过程中pH的变化
Fig.1 Changes of pH in Maillard reaction at different ratios of xylooligosaccharides and whey protein isolate
2.2 UV-Vis吸光度的变化
美拉德反应中期会生成高活性的无色小分子中间产物,如Amadori重排产物形成的还原酮,以及它们在Strecker反应后生成的小分子醛类等,这些中间产物在294 nm处有紫外吸收;其后中间产物经过环化、脱氢、retro-Aldol反应、重排、异构化,最后缩合形成棕色含氮聚合物或者共聚物—类黑素,其在420 nm处有可见光吸收[21-23]。因此可根据紫外-可见光吸收值来推断美拉德反应的进程。
图 2a、2b分别为不同比例的反应体系(低聚木糖:WPI)初始时刻和反应2.5 h时在294 nm和420 nm处的吸光度。由图可知,四种体系反应后在两种吸光波长处的吸光度都有所增加,结合图 1,在整个反应过程中,所有体系的pH不断降低但pH始终大于7,此时Amadori重排产物主要发生中度脱水或2,3-烯醇化,被促进形成Strecker氨基酮和醛,同时酮胺和醛糖胺裂解形成小的二羰基化分子,例如 2,3-丁二酮、甲基乙二醛或乙二醛[18],这些小分子化合物的产生导致在294 nm处吸光度的增加。从294 nm处吸光度的增加来看,比例为 1:2的反应体系增量最大(0.075±0.025);而比例为 1:1的反应体系增量最小(0.030±0.0073),这说明比例为1:2的体系在反应中产生的酮类和醛类等高活性中间产物最多,而比例为1:1的体系产生的中间产物最少。从420 nm处吸光度的增加来看,比例为 1:2的反应体系增量最大(0.076±0.0082),说明该比例下反应产生的类黑素最多,而另外三个比例吸光度的增量无显著性差异,这与294 nm处结果相对应。类黑素是由上述产物经过环化、异构化、缩合等反应形成的棕色含氮聚合体,因此类黑素的含量与中间产物的积累量有关,这与本文研究结果一致。
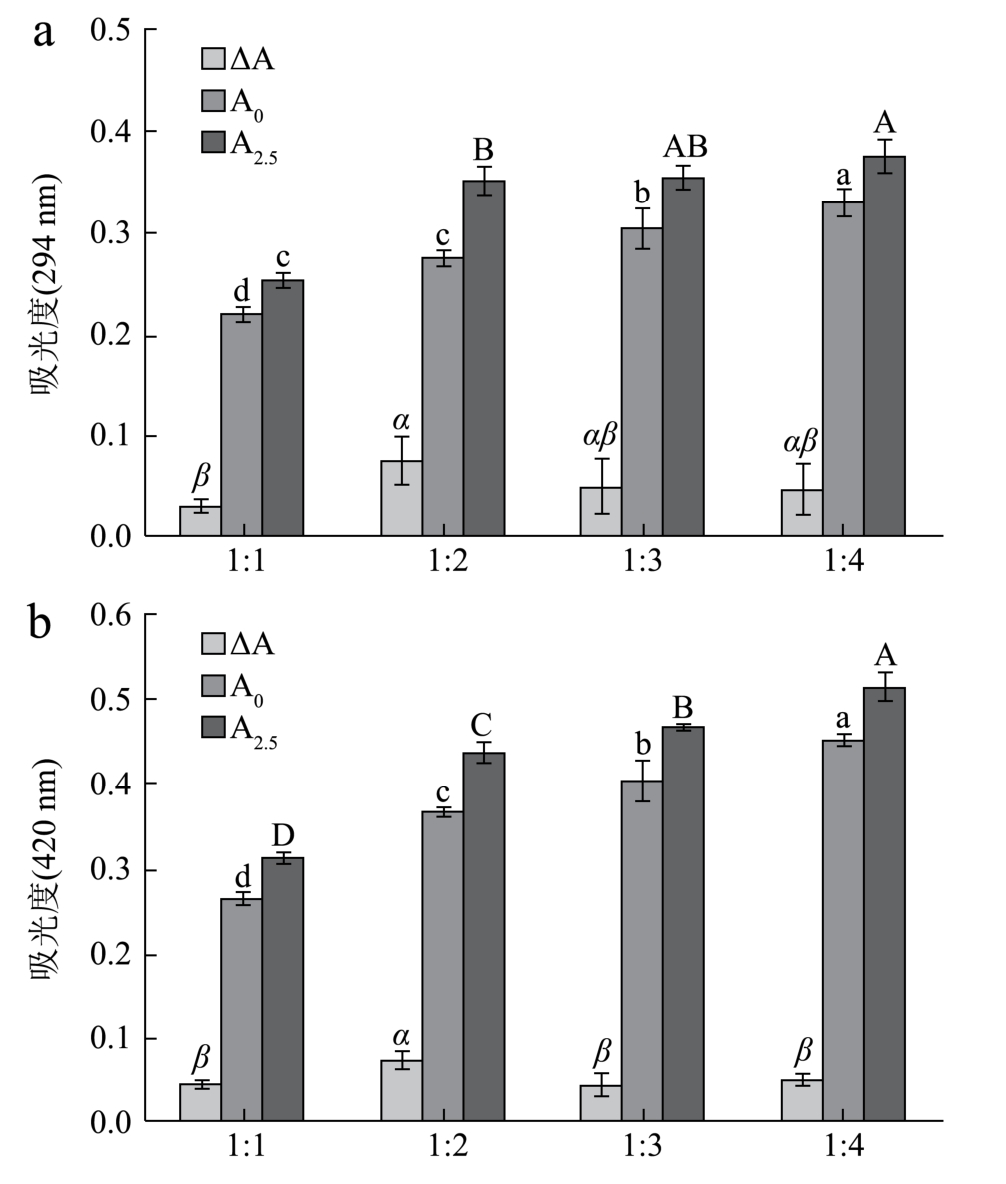
图2 不同比例的低聚木糖-WPI美拉德反应产物在反应前后中间产物(a)、褐变程度(b)的变化
Fig.2 Changes of intermediate products (a) and browning degree (b) of Maillard reaction products before and after the reaction at different ratios of xylooligosaccharides-whey protein isolate
注:不同字母表示差异显著,p<0.05,下同。
2.3 低聚木糖-WPI美拉德产物粒径分析
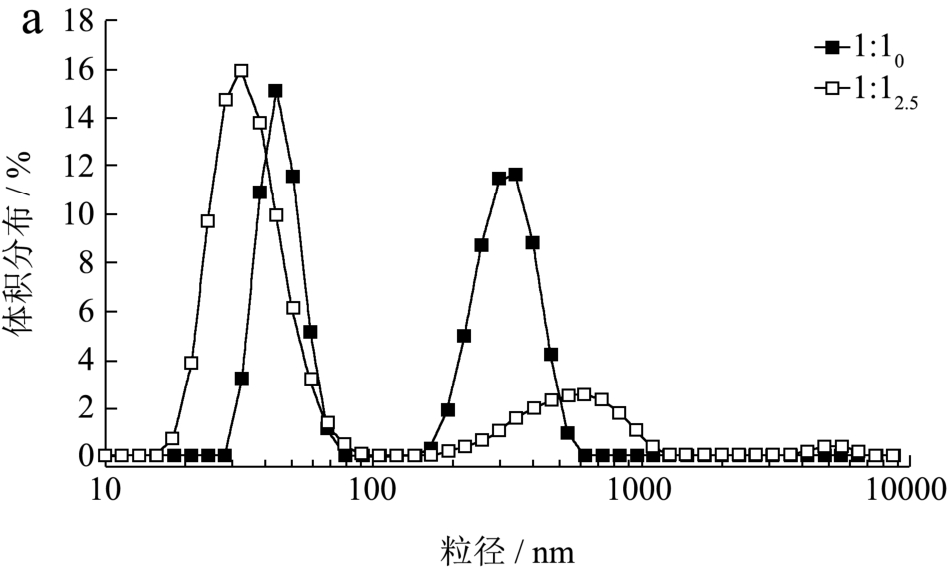
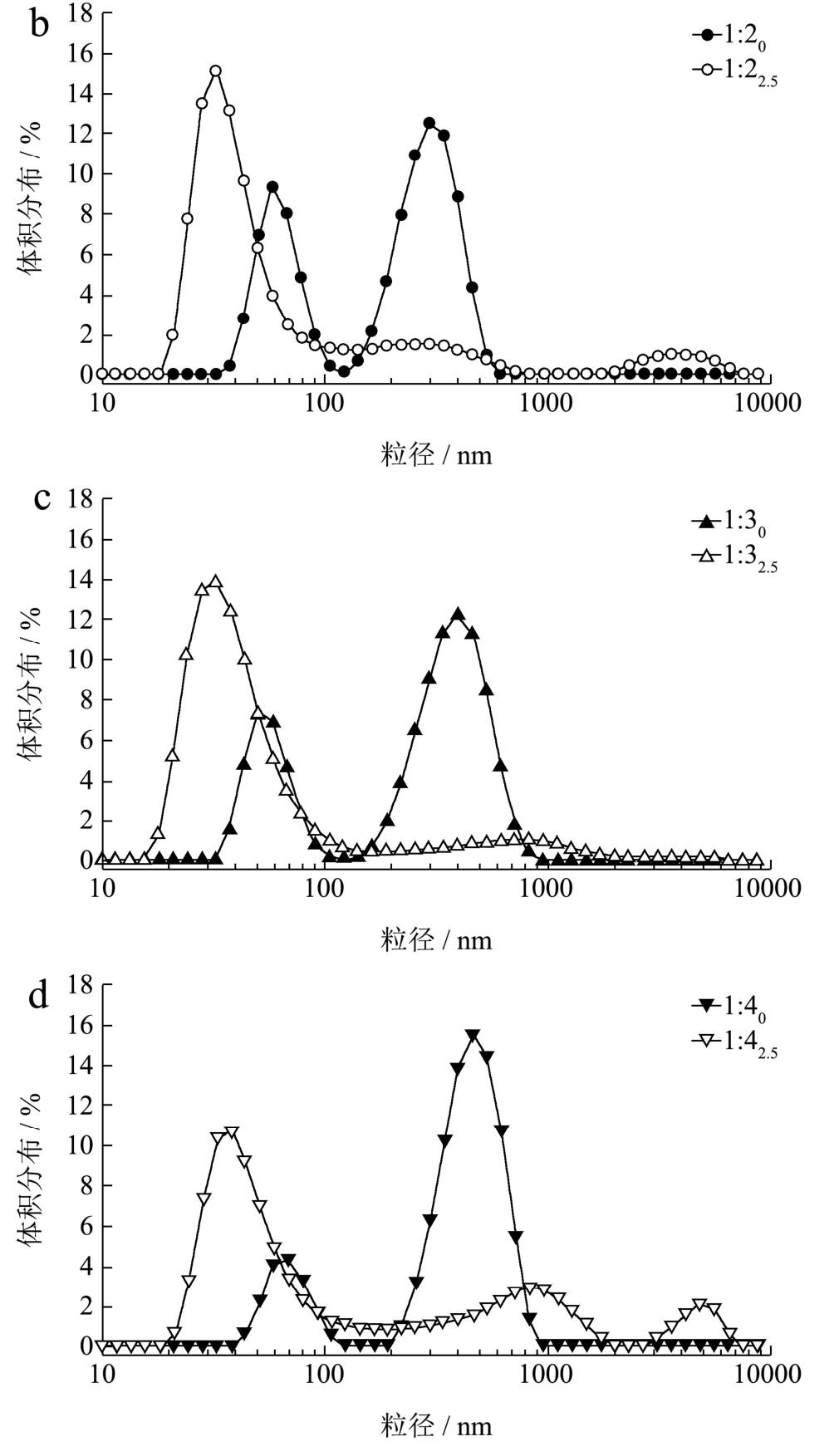
图3 不同比例的低聚木糖-WPI美拉德反应产物在反应前后粒径的变化
Fig.3 Changes in particle size of Maillard reaction product at different ratios of xylooligosaccharides-whey protein isolate before and after the reaction
不同比例的低聚木糖-WPI体系在美拉德反应前后粒径变化如图3所示。WPI经过湿热法美拉德反应前,各体系的平均粒径范围均在 200~450 nm;反应2.5 h后,分子量增大,而平均粒径减小,各体系的平均粒径范围均在80~250 nm,其中比例为1:3的平均粒径最小为94.88±1.88 nm,比例为1:2的平均粒径最大为214.83±4.80 nm。其可能的原因有:(1)蛋白质通过热处理后,分子去折叠,内部基团暴露使氨基与低聚木糖中的羰基进行共价结合时,打破了蛋白质自身的亲水/疏水平衡,亲水性的多糖接枝到蛋白质上使肽链中的亲水基团数量增加[24],进而增加蛋白质表面的亲水性,并在表面形成一层“毛发”层[25],“毛发”层的空间位阻和颗粒间的静电斥力使得分子聚集度低,粒子更易于分散,从而粒径减小;(2)糖基化减少 WPI的热聚集,可能是由于部分未折叠的蛋白质分子的可逆聚集以及多糖-蛋白质的空间位阻而抑制未折叠的蛋白质-蛋白质发生相互作用[7]。
Beliciu[26]与Risso等[27]研究认为蛋白质胶束经不同温度处理后,高温使蛋白质变性,结构发生破坏,布朗运动增加,分子间疏水作用增强,使得蛋白胶束粒径增大,这与本文研究结论不一致,可能的原因在于进行反应的蛋白质和多糖不一致,并且美拉德体系成分多且复杂,不同反应温度、pH、时间、蛋白质与多糖比例以及体系不同成分间的相互作用等,这些都将影响美拉德反应途径并造成研究结果的不同,具体反应机理有待进一步研究。
2.4 低聚木糖-WPI美拉德反应产物的乳化性能
图4a、4b为不同比例的低聚木糖-WPI体系美拉德反应前后乳化特性的变化,其中湿热处理前后的WPI作为对照组。由图4a可知,反应前各体系乳化活性(平均为 35.65±1.45 m2/g)差异性不显著,而相较初始体系,经美拉德反应2.5 h的体系乳化活性稍有提高,其中比例为1:3的体系乳化活性最好(乳化活性指数为40.18±1.12 m2/g),比例为1:1的体系乳化活性最差(乳化活性指数为 35.80±0.15 m2/g),但与之相反的是,WPI经热处理后乳化性反而降低(34.10±0.75 m2/g)。
根据图 4b,反应前各体系的乳化稳定性范围为60.06±0.88~42.30±5.88 m2/g,其中低聚木糖-WPI比例为1:1时乳化稳定性最大,比例为1:3时最小,这可能是多糖含量不同造成的差异;而美拉德反应后各体系乳化稳定性均增加,比例为1:2的乳化稳定性最好(65.23%),比例为1:3时最差(56.85%),同时热处理后的WPI乳化稳定性也降低(41.64%± 0.77%)。WPI分子同时含有亲水基团和疏水基团,具有两亲性,因此能形成一层亲水基团朝外,疏水基团朝内的膜吸附在油滴表面使得油水界面保持平衡,从而具有良好的乳化特性,但这层油水界面膜较薄,容易受到温度、离子强度、pH等因素的影响[28]。而在美拉德反应中多糖接枝到蛋白质分子上,一方面打破蛋白质本身的亲水/疏水平衡,增加蛋白质亲水性的同时也将蛋白质内部疏水基团暴露,增强了与油水
界面的相互作用进而提高其乳化活性[29],另一方面多糖分子的接入很大程度的增加了蛋白质分子的空间位阻和液滴间静电斥力[25],使得界面膜的厚度[8]和机械强度增加从而增加了乳化稳定性。正是由于这些原因,比例为1:2的体系美拉德反应程度最大,同时也具有最佳的乳化活性和乳化稳定性,大量研究也证明美拉德反应有增强蛋白质乳化活性和稳定性的作用[5,6,17]。而温度过高也会使部分蛋白质高度变性,内部基团被破坏,亲水/疏水性失衡或者蛋白质聚集、絮凝,从而导致乳化性能降低,这可能是热处理后WPI乳化特性降低及其MRPs乳化活性增加较小的原因之一。
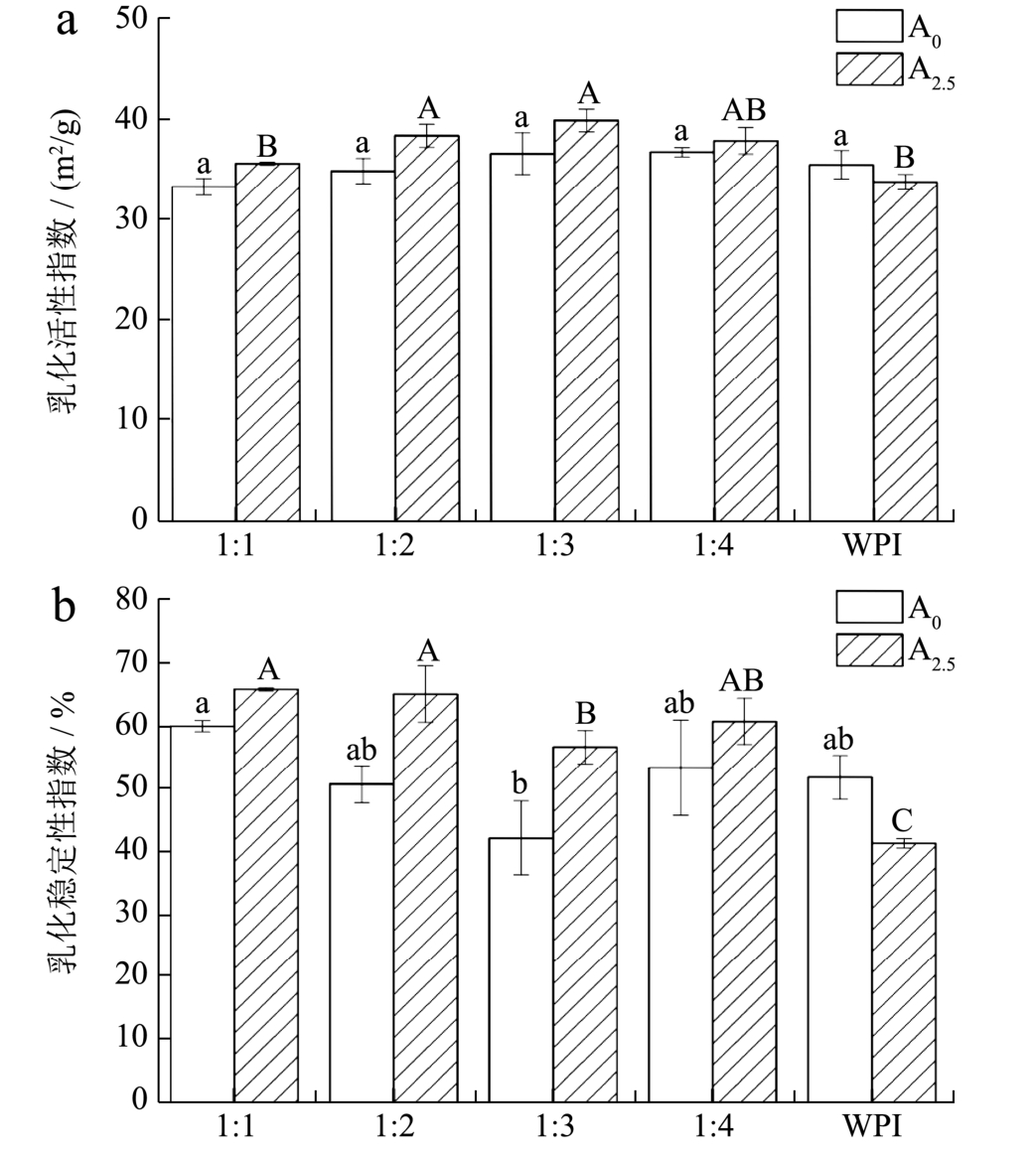
图4 不同比例的低聚木糖-WPI体系反应前后乳化活性(a)及乳化稳定性(b)的变化
Fig.4 Changes of emulsification activity (a) and emulsion stability (b) before and after the reaction of different ratios of xylooligosaccharides-whey protein isolate system
2.5 低聚木糖-WPI美拉德反应产物的流变学性质
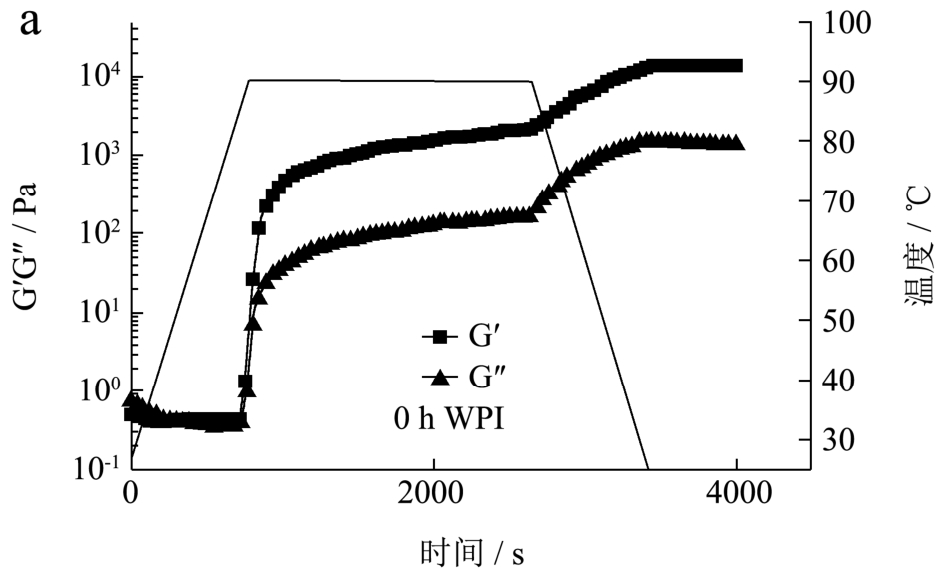
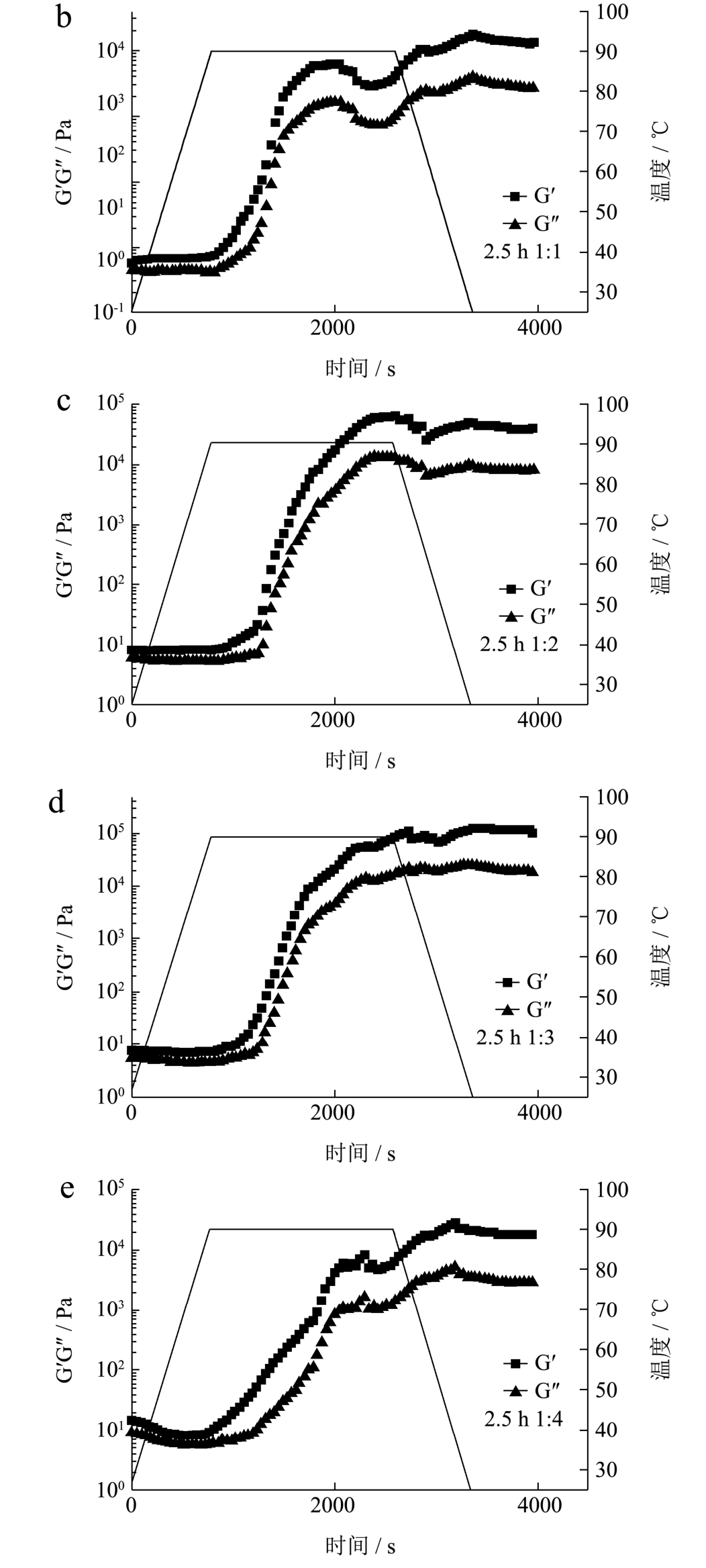
图5 加热—冷却处理期间储能模量G'和损耗模量G''的变化,直线表示温度曲线
Fig.5 Changes of storage modulus G′ and loss modulus G″during the heating-cooling treatment, the straight line indicates the temperature profile
食品中蛋白质的流变学行为与其功能特性有关,特别是凝胶化能力,直接影响食品的品质,例如味道、口感和货架期稳定性等[30]。图5显示WPI及4种比例低聚木糖-WPI美拉德反应产物的储能模量 G'和损耗模量G''随温度和时间的变化曲线。
对于10% (W/V)的WPI,模量的变化曲线显示在图5a中,类似于一般球状蛋白质的热诱导凝胶化现象[31]。当升温温度在 25.80~55.29 ℃时,WPI溶液的G''>G',表现为流体特征,即溶胶状态;当温度在55.78 ℃时,WPI溶液开始出现 G'>G'',在 88.64 ℃时G'的急剧增大,说明在这个阶段发生了溶液-凝胶的转变,同时在初始的温度上升阶段(温度范围约为25~88.64 ℃),G'和 G''的值都非常小(<1 Pa),根据Dewit等[32]的 WPI差示扫描量热法(DSC)结果(WPI吸热变性曲线的峰值约在74 ℃(β-lg),肩峰约在66 ℃(α-la)),发现WPI需要超过变性温度才能变性从而影响 G'和 G'',该发现与 Sun[16]、María[33]等人研究一致;随后G'始终大于G'',在90 ℃下保持30 min期间,可能是热诱导更多的蛋白质分子聚集,WPI凝胶网络增强,从而提高了升温初始形成的弱凝胶弹性。随着温度从 90 ℃降至 25 ℃,G'进一步增大,最终达到13000 Pa以上,这种现象表明胶体网络强度在冷却过程中逐渐增强,这可能是由于变性蛋白质之间形成了额外的非共价相互作用(如凝胶结构中的分子间氢键、范德华力)[33];在接下来的 25 ℃平衡期间,G'和 G''几乎没有进一步的改变,保持相对平行,说明此时已经形成稳定的蛋白质凝胶网络结构。
不同比例的低聚木糖-WPI美拉德反应产物溶液体系的模量随温度和时间的变化与 WPI的凝胶形成过程有所不同。在升温阶段中(25~90 ℃),G'和G''的变化较小,并且该值均小于10 Pa。在90 ℃下加热后才观察到MRPs溶液G'和G''显着增加,相比WPI曲线(125 s、88.64 ℃时开始急剧增大)MRPs溶液 G'和G''显著增加的时间和温度均出现延迟(比例为 1:1、1:2、1:3、1:4的体系分别在147 s、154 s、167 s、129 s),这种现象可能与低聚木糖的附着导致蛋白质变性温度升高有关[7]。另一方面,G'和G''在冷却过程中继续增加,在接下来的25 ℃平衡期间G'和G''值逐渐变得稳定,其中比例为 1:3的体系 G'值高达约 97000 Pa(约WPI的7倍),其次是1:2的G'值约为38000 Pa,1:4和1:1的G'值分别为18000 Pa和13000 Pa。同时整个升温和降温过程,G'始终大于G'',表明低聚木糖-WPI美拉德反应产物体系可能在25 ℃之前就表现出类固体性质。蛋白质和还原糖的美拉德反应期间,蛋白质二级结构会发生改变[34,35],因此低聚木糖与WPI接枝后,蛋白质二级结构的改变可能使得糖基化蛋白质分子相对容易在凝胶化的初步阶段以更快的速率经历变性和聚集;同时WPI接入低聚木糖可能从本质上改变了WPI的凝胶化机制(热聚集反应动力学发生变化),从而导致了储能模量和损耗模量值的变化。此外,有研究发现不同分子量的右旋糖苷和 WPI美拉德体系也显示出其凝胶弹性行为的增加,说明多糖的亲水部分不会减弱疏水性氨基酸之间相互作用并削弱凝胶网络[33,36]。

图6 WPI和其美拉德反应产物的流动行为(表观粘度和剪切速率)
Fig.6 Flow behaviors (apparent viscosity versus shear rate) of the evaluated suspensions of original WPI and its Maillard reaction products
在实际生产加工(例如液体产品的均质细化)中剪切稀化作用有助于产品均质更完全,同时降低能耗、减少生产成本。WPI和4种比例低聚木糖-WPI美拉德反应产物溶液的流动行为如图6所示,数据显示了溶液的表观粘度随剪切速率的变化情况。在0.1~100 s-1的剪切速率范围内,剪切速率不断升高,5种体系表观粘度不断降低,表现出剪切稀化行为,呈现出一种典型的假塑性流体流变特性。此外,在相同剪切速率下,WPI的表观粘度最小;虽然美拉德反应使得体系表观粘度增加,但体系中WPI所占比例越大,其假塑性特征越明显;随着WPI占比的降低,剪切速率不断增大,表观粘度下降逐渐减小。
3 结论
研究发现,低聚木糖-WPI质量比为1:2时,体系美拉德反应程度最高,平均粒径最大,乳化活性和乳化稳定性也得到最大程度的提高。此外本实验研究了糖基化修饰对WPI凝胶行为的影响,发现美拉德反应导致了各体系模量不同程度的增加,其中比例为 1:3的低聚木糖-WPI美拉德反应产物的粘弹性最强,G'值约为原始WPI的7倍。上述实验结果证明,美拉德反应可改善WPI的乳化特性和凝胶特性。
[1] Kato A. Maillard-type protein-polysaccharide conjugates [J].Developments in Food Science, 2000, 41: 385-395
[2] Yanxue D, Suhua S, Yan J, et al. Physicochemical properties and emulsion stabilization of rice dreg glutelin conjugated with κ-carrageenan through Maillard reaction [J]. Journal of the Science of Food & Agriculture, 2012, 93(1): 125-133
[3] Liu Z, Jiao Y, Wang Y, et al. Polysaccharides-based nanoparticles as drug delivery systems [J]. Advanced Drug Delivery Reviews, 2008, 60(15): 1650-1662
[4] Oliver C M. Insight into the glycation of milk proteins: An ESI- and MALDI-MS perspective (review) [J]. Critical Reviews in Food Science & Nutrition, 2011, 51(5): 410-431
[5] Zha F, Dong S, Rao J, et al. Pea protein isolate-gum Arabic Maillard conjugates improves physical and oxidative stability of oil-in-water emulsions [J]. Food Chem, 2019, 285:130-138
[6] Hou C, Wu S, Xia Y, et al. A novel emulsifier prepared from Acacia seyal polysaccharide through Maillard reaction with casein peptides [J]. Food Hydrocolloids, 2017, 69: 236-241
[7] Pirestani S, Nasirpour A, Keramat J, et al. Structural properties of canola protein isolate-gum Arabic Maillard conjugate in an aqueous model system [J]. Food Hydrocolloids, 2018, 79: 228-234
[8] Shi Y, Liang R, Chen L, et al. The antioxidant mechanism of Maillard reaction products in oil-in-water emulsion system[J]. Food Hydrocolloids, 2019, 87: 582-592
[9] Dan Z, Srinivasan D, Lucey J A. Formation of whey protein isolate (WPI)-dextran conjugates in aqueous solutions [J]. J Agric Food Chem, 2008, 56(16): 7113-7118
[10] Li Z, Summanen P H, Komoriya T, et al. In vitro study of the prebiotic xylooligosaccharides (XOS) on the growth of Bifidobacterium spp and Lactobacillus spp [J]. International Journal of Food Sciences & Nutrition, 2015, 66(8): 919-922
[11] 张守文,胡源媛,谢应根.低聚木糖的功能特性及生产状况[J].中国粮油学报,2006,21(6):185-188 ZHANG Shou-wen, HU Yuan-yuan, XIE Ying-gen.Xylo-oligosaccharide: functional properties and production status [J]. Journal of the Chinese Cereals and Oils Association,2006, 21(6): 185-188
[12] Wang L-H, Sun X, Huang G-Q, et al. Conjugation of soybean protein isolate with xylose/fructose through wet-heating Maillard reaction [J]. Journal of Food Measurement and Characterization, 2018, 12(4): 2718-2724
[13] Zhu K-X, Li J, Li M, et al. Functional properties of chitosan-xylose Maillard reaction products and their application to semi-dried noodle [J]. Carbohydrate Polymers,2013, 92(2): 1972-1977
[14] Kim J-S, Lee Y-S. Study of Maillard reaction products derived from aqueous model systems with different peptide chain lengths [J]. Food Chemistry, 2009, 116(4): 846-853
[15] Zhao Q, Xiong H, Selomulya C, et al. Enzymatic hydrolysis of rice dreg protein: effects of enzyme type on the functional properties and antioxidant activities of recovered proteins [J].Food Chemistry, 2012, 134(3): 1360-1367
[16] Sun W-W, Yu S-J, Yang X-Q, et al. Study on the rheological properties of heat-induced whey protein isolate-dextran conjugate gel [J]. Food Research International, 2011, 44(10):3259-3263
[17] Jiang S-J, Zhao X-H. Transglutaminase-induced cross-linking and glucosamine conjugation of casein and some functional properties of the modified product [J]. International Dairy Journal, 2011, 21(4): 198-205
[18] Bertrand E, El Boustany P, Faulds C B, et al., The Maillard Reaction in Food: An Introduction. [M]. In Reference Module in Food Science: Elsevier, 2018
[19] Liu S-C, Yang D-J, Jin S-Y, et al. Kinetics of color development, pH decreasing, and anti-oxidative activity reduction of Maillard reaction in galactose/glycine model systems [J]. Food Chemistry, 2008, 108(2): 533-541
[20] Shibamoto T, Bernhard R. A. Investigation of pyrazine formation pathways in glucose-ammonia model systems [J].Journal of the Agricultural Chemical Society of Japan, 1968,41(1): 143-153
[21] Yu X, Zhao M, Hu J, et al. Correspondence analysis of antioxidant activity and UV-Vis absorbance of Maillard reaction products as related to reactants [J]. LWT-Food Science and Technology, 2012, 46(1): 1-9
[22] 张亦鸣,谢晶,薛斌,等.低聚木糖-脯氨酸美拉德反应衍生物的制备及其抗氧化性能[J].食品与发酵工业,2015,41(1):18-22 ZHANG Yi-ming, XIE Jing, XUE Bin, et al. Maillard reaction of xylo-oligosaccharide with proline and the antioxidant activity of the xylo-oligosaccharide derivatives [J].Food and Fermentation Industries, 2015, 41(1):18-22
[23] 郑文华,许旭.美拉德反应的研究进展[J].化学进展,2005,17(1):122-129 ZHENG Wen-hua, XU Xu. Research progress on Maillard reaction [J]. Progress In Chemistry, 2005, 17(1): 122-129
[24] 孙炜炜,于淑娟,杨晓泉,等.乳清分离蛋白-葡聚糖接枝物性质的荧光光谱法分析[J].光谱学与光谱分析,2011,31(12):3307-3310 SUN Wei-wei, YU Shu-juan, YANG Xiao-quan, et al.Fluorescence spectra analysis of whey protein isolate-dextran conjugate [J]. Spectroscopy and Spectral Analysis, 2011,31(12): 3307-3310
[25] Livney Y D, Garti N. Complexes and Conjugates of Biopolymers for Delivery of Bioactive Ingredients via food.[M]. Delivery and Controlled Release of Bioactives in Foods and Nutraceuticals: Elsevier, 2008, 234-250
[26] Beliciu C M, Moraru C I. Effect of solvent and temperature on the size distribution of casein micelles measured by dynamic light scattering [J]. Journal of Dairy Science, 2009,92(5): 1829-1839
[27] Risso P H, Relling V M, Armesto M S, et al. Effect of size,proteic composition, and heat treatment on the colloidal stability of proteolyzed bovine casein micelles [J]. Colloid &Polymer Science, 2007, 285(7): 809-817
[28] 许朵霞,包亚妮,闫冰,等.乳清分离蛋白与壳聚糖美拉德反应初级阶段产物乳化性研究[J].食品科学,2012,33(7):16-19 XU Duo-xia, BAO Ya-ni, YAN Bing, et al. Emulsifying properties of whey protein isolate-chitosan conjugates prepared from the primary stage of Maillard reaction. [J].Food Science 2012, 33(7):16-19
[29] 耿浩,刘悦,梁新婷,等.热诱导对乳清浓缩蛋白和分离蛋白乳化性及稳定性的影响[J].中国食品学报,2016,16(8):71-77 GENG Hao, LIU Yue, LIANG Xin-ting, et al. Effect of heat treatment on emulsification and stability of WPC and WPI [J].Journal of Chinese Institute of Food Science and Technology,2016, 16(8): 71-77
[30] Liu J, Ru Q, Ding Y. Glycation a promising method for food protein modification: Physicochemical properties and structure: A review [J]. Food Research International, 2012,49(1): 170-183
[31] Hua Y, Cui S W Qi. Gelling property of soy protein-gum mixtures [J]. Food Hydrocolloids, 2003, 17(6): 889-894
[32] Dewit J N, Klarenbeek G. Effects of various heat treatments on structure and solubility of whey proteins [J]. J Dairy Sci,1984, 67(11): 2701-2710
[33] Spotti M J, Martinez M J, Pilosof A M R, et al. Rheological properties of whey protein and dextran conjugates at different reaction times [J]. Food Hydrocolloids, 2014, 38: 76-84
[34] Niu L Y, Jiang S T, Pan L J, et al. Characteristics and functional properties of wheat germ protein glycated with saccharides through Maillard reaction [J]. International Journal of Food Science & Technology, 2011, 46(10): 2197-2203
[35] Sun W W, Yu S J, Zeng X A, et al. Properties of whey protein isolate-dextran conjugate prepared using pulsed electric field[J]. Food Research International, 2011, 44(4): 1052-1058
[36] Spotti M J, Martinez M J, Pilosof A M R, et al. Influence of Maillard conjugation on structural characteristics and rheological properties of whey protein/dextran systems [J].Food Hydrocolloids, 2014, 39: 223-230