藜麦(Chenopodium quinoa Willd)是一种原产于安第斯山脉的一年生苋科植物,是古代印加民族的主要食物来源[1],目前在亚洲、非洲、欧洲以及南美洲等地区均有种植。我国西藏于 1987年开始试种藜麦,后得到普及,2008年开始大规模种植藜麦。我国山西、甘肃、青海、河北等省份藜麦产量较高[2]。藜麦由于营养价值较高而被世界广泛关注,富含蛋白质、氨基酸、淀粉、纤维素、矿物质,尤其是氨基酸种类丰富且含量均衡,被联合国粮食农业组织(Food and Agriculture Organization,FAO)称为唯一一种单体植物便可以满足人体基本营养需求的营养作物[3]。除此之外,藜麦当中还含有许多生物活性物质包括皂苷、黄酮类及多酚类物质等,从而具有抗炎、抗菌、抗肿瘤、抗衰老等效果[4-6],使其成为了包括医学、食品卫生学在内的一些领域的重点研究对象。
藜麦种皮上富含藜麦皂苷和黄酮类成分,导致藜麦籽粒味道苦涩,不利于食用。因此在食用之前,通常会对藜麦籽粒进行脱皮处理,使得皂苷含量低于0.11%,以消除食用时藜麦的不良口味[7]。从而在实际生产过程中会产生大量的藜麦麸皮,少数麸皮饲用,大多数麸皮会被丢弃,不但造成了资源浪费,也对环境造成了潜在威胁。有研究表明,谷物麸皮中富含营养物质与矿物质,特别是蛋白质与油脂类成分要高于精加工产品[8]。因此在实际生产过程中,越来越多的加工副产物可作为一种新型的食用资源加以高值化利用[9-10]。
本研究以藜麦麸皮为原料,测定藜麦麸皮中各营养成分及活性成分皂苷的含量,提取藜麦麸皮油脂,并对油脂成分与抗氧化活性进行探究。从而为提升藜麦麸皮的利用价值提供数据支持。
1 材料与方法
1.1 材料与仪器
藜麦麸皮,2018年购自山西省静乐县山西亿隆藜麦有限公司,粉碎机粉碎后过60目筛子筛选备用;1,1-二苯基-2-三硝基苯肼,梯希爱(上海)化成工业发展有限公司;石油醚、乙醚、氢氧化钾、冰醋酸、甲醇、无水乙醇、2,6-二叔丁基-4-甲基苯、丙酮、邻苯三酚、三羟甲基氨基甲烷(Tris)、盐酸、乙二胺四乙酸(EDTA)、二硫苏糖醇(DTT)、高氯酸、香草醛,国药集团化学试剂有限公司,均为分析纯;商陆皂苷甲标准品(纯度>99%),上海源叶生物科技有限公司;96孔板。
SZF-06A脂肪测定仪,上海昕瑞仪器仪表有限公司;Thermo酶标仪,美国;GC 1100气相色谱仪,北京普析通用仪器责任有限公司;高效液相色谱仪,日本岛津;ICP_MS 7900电感耦合等离子体质谱仪,美国安捷伦;PALL-cascade超纯水制备机,济南东岱科学器材有限公司。
1.2 实验方法
1.2.1 藜麦麸皮各成分含量测定
1.2.1.1 藜麦麸皮水分含量的测定
根据GB 5009.3-2016《食品安全国家标准食品中水分的测定》中的直接干燥法测定。
1.2.1.2 藜麦麸皮中蛋白质含量的测定
根据GB 5009.5-2016《食品安全国家标准食品中蛋白质的测定》中的凯氏定氮法测定。
1.2.1.3 藜麦麸皮中膳食纤维含量的测定
根据GB 5009.88-2014《食品安全国家标准食品中膳食纤维的测定》中的方法进行测定。
1.2.1.4 藜麦麸皮中还原性多糖含量的测定
根据GB 5009.7-2016《食品安全国家标准食品中还原糖的测定》中的苯酚-硫酸法进行测定。
1.2.1.5 藜麦麸皮中淀粉含量的测定
根据GB 5009.9-2016《食品安全国家标准食品中淀粉的测定》中的酶水解法进行测定。
1.2.1.6 藜麦麸皮中油脂含量的测定
根据GB 5009.6-2016《食品安全国家标准食品中脂肪的测定》中的索氏抽提法进行测定。
1.2.1.7 藜麦麸皮中矿物质含量的测定
根据GB 2760-2017《食品安全国家标准食品添加剂使用标准》中的方法进行测定。
1.2.1.8 HPLC法测定藜麦麸皮中皂苷含量
根据文献[22]色谱条件进行测定。具体方法为称取0.5 g藜麦麸皮粉末,加入10 mL甲醇称重,超声震荡30 min,静置后再次称重,补足差重,取1 mL进样。
1.2.2 藜麦麸皮油脂的制备
称取六份、藜麦麸皮粉样品,每份样品7 ± 0.001 g,按照国标GB 5009.6-2016的方法进行油脂的制备。藜麦麸皮含油量的计算式见式(1),样品重复分析三次,取三次结果的平均值。
式中:ω为含油量(以质量分数计),单位为%;m1为干燥后提取物质量,单位为克(g);m为藜麦麸皮样品粉质量,单位为克(g)。
1.2.3 藜麦麸皮油脂脂肪酸组成的气质联用仪分析
参考NY/T 3110-2017(《植物油料中全谱脂肪酸的测定气相色谱-质谱法》称取均匀试样300 mg(精确至0.1 mg),移入10 mL具塞试管中,加入2 mL石油醚-乙醚混合液与 1 mL氢氧化钾-甲醇溶液;涡旋振荡,静置反应1 h;再次涡旋振荡,加入2 mL去离子水;静置30 min分层,以4500 r/min离心2 min,取上清液,用石油醚稀释20倍,供气相色谱-质谱联用仪测定。
1.2.3.1 气相色谱条件
参考李丹华[11]的方法稍作改进。毛细管色谱柱:聚二氰丙基硅氧烷强极性固定相(内径0.5 mm,膜厚0.2 μm);进样口温度:220 ℃;升温程序:100 ℃保持0.2 min,100~215 ℃按10 ℃/min速度升温后保持0.1 min,215~244 ℃按2 ℃/min速度升温后保持0.2min;载气:氦气;流速:1.2 mL/min;分流比:20:1;进样量:1 μL;接口温度:280 ℃。
1.2.3.2 质谱条件
离子源温度:250 ℃;四级杆温度:150 ℃;电离模式:EI;溶剂延迟时间:3 min;数据采集模式:选择离子检测方式(SIM),监测离子:m/z=55、67、74、79。
1.2.3.3 脂肪酸含量测定
在上述条件下将脂肪酸标准测定液及样品测定液分别注入气相色谱仪。利用37种脂肪酸甲酯混合标准品判断各峰对应的脂肪酸,结合峰面积归一法计算其相对含量。脂肪酸含量的计算见式(2):
式中:X:某脂肪酸占总脂肪酸的百分比(单位为%);A:脂肪酸的峰面积;ΣA:脂肪酸甲酯的峰面积之和。
1.2.4 DPPH自由基清除活性测定
参照Shimada等的方法[12],略作改动。配制0.1 mmol/L DPPH溶液(以无水乙醇作溶剂)。称取0.1 g藜麦麸皮油脂样品,用无水乙醇配制成不同浓度,将试剂或样品依次加入各试管,混合均匀,室温下准确反应30 min,在517 nm下测定吸光值(A)。使用BHT作为阳性对照,计算样品对DPPH的清除能力。
1.2.5 藜麦麸皮油对超氧阴离子清除率的测定
参照静天玉等的方法[13],略作改动。采用邻苯三酚氧化法,称取0.01 g藜麦麸皮油脂,加入2 mL丙酮溶解,用蒸馏水配制成不同浓度,将试剂或样品依次加入各试管,混合均匀。准确反应10 min后,加入30 μL DTT溶液终止反应,1 h内测定325 nm处的吸光值(A)。使用BHT作为阳性对照,计算藜麦麸皮油脂对超氧阴离子的清除率。
1.2.6 数据统计分析
每组试验指标做三组平行实验,最后测定的结果数据用SPSS 17.0统计软件进行分析,数据表示用“均值±标准差”表示。
2 结果与分析
2.1 藜麦麸皮中营养成分含量测定
藜麦麸皮中常见的营养成分含量如表1所示:
表1 藜麦麸皮中常见的营养成分含量(%)
Table 1 Contents of common nutrients in quinoa barn

营养成分 含量/% 营养成分 含量/%水分 8.60±0.21 还原性多糖 4.85±0.12蛋白质 26.86±0.11 淀粉 28.78±0.26膳食纤维 12.90±0.09 油脂 14.15±0.33
藜麦麸皮中含有丰富的蛋白质以及淀粉,其含量分别占26.86%、28.78%,其蛋白含量远高于白藜麦种子(11.81%),是红色、黑色藜麦种子蛋白含量(13.74%、13.39%)的两倍[14],与其他作物例如大麦、水稻、玉米等相比较,蛋白含量也表现出明显的优势[15,16],表明更易从藜麦麸皮中提取蛋白。但淀粉含量远低于藜麦种子淀粉含量(61.23%),说明淀粉主要集中在藜麦的种子里;陈树俊[17]的研究表明,藜麦种子中的膳食纤维总含量为 8%左右,而藜麦麸皮中的膳食纤维含量为12.90%,所以益将藜麦麸皮制成粗谷物食品,用于降低胆固醇、调节血糖水平,预防心血管疾病和糖尿病。此外,藜麦麸皮中的油脂含量占14.15%,结果说明藜麦麸皮有提取油脂的潜力。
2.2 藜麦麸皮中各种矿物质含量测定
藜麦麸皮中各种矿物质含量测定如表2所示:
表2 藜麦麸皮中各种矿物质含量
Table 2 Various mineral contents in quinoa barn (mg/kg)
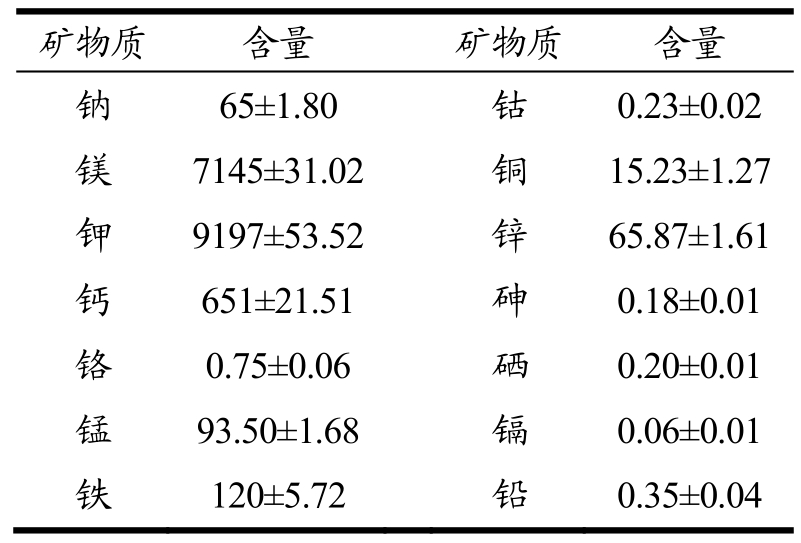
矿物质 含量 矿物质 含量钠 65±1.80 钴 0.23±0.02镁 7145±31.02 铜 15.23±1.27钾 9197±53.52 锌 65.87±1.61钙 651±21.51 砷 0.18±0.01铬 0.75±0.06 硒 0.20±0.01锰 93.50±1.68 镉 0.06±0.01铁 120±5.72 铅 0.35±0.04
藜麦麸皮中含有多种矿物质,尤其是钾、镁、钙、铁、钠以及锌含量丰富,这与焦红艳[18]的研究一致,尤其是钾、铁、锌的营养质量指数(Index of Nutrition Quality,INQ)大于 1,这使藜麦麸皮制成的食物更适宜于超重或者肥胖的人。藜麦籽粒中的钾、镁、铁、锰、铜、钠含量分别为6939 mg/kg、4152 mg/kg、92 mg/kg、34 mg/kg、6 mg/kg、12 mg/kg,其含量均低于藜麦麸皮中矿物质的含量[19];但藜麦籽粒中的钙含量为918 mg/kg,其含量远远高于藜麦麸皮中钙的含量。藜麦麸皮的钙、镁、铁、铜、锌高于小麦、水稻、大麦中各元素含量[20,21]。
2.3 HPLC法测定藜麦皂苷含量
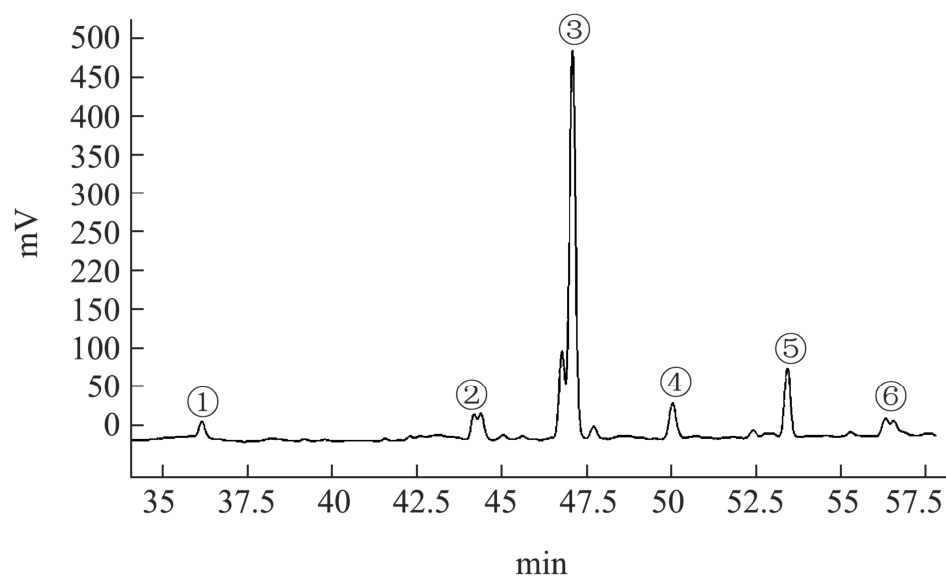
图1 藜麦麸皮中皂苷液相图谱
Fig.1 Liquid Phase map of saponins in Chenopodium gluten
实验室前期对于藜麦麸皮的乙醇提取物进行了分离纯化,得到6种主要物质,根据NMR结合高分辨质谱数据对6种物质进行鉴定[22],鉴定后与皂苷液相图谱进行比对,发现所分离纯化的6种物质即为峰①-峰⑥,分别为峰①(RT=36 min)3-O-β-D-glucopyranosyl-(1→3)-α-L-arabinopyranosyl hederagenin 28-O-β-D-glucopyranosyl,属于常春藤(Hed)型皂苷、峰②(RT=44 min)3-O-β-D-glucopyranosyl-(1→3)-α-L-ara-binopyrano syl-phytolaccagenic acid-27-oxo-28-O-β-D-glucopyrano syl,属于商陆酸型(PA)皂苷、峰③(RT=46 min)3-O-β-D-glucopyranosyl-(1→3)-α-L-arabinopyranosyl-phytolac cagenic acid 28-O-β-D-glucopyranosyl 属于商陆酸型(PA) 型 皂 苷 、 峰 ④ (RT=50 min)3-O-α-L-arabinopyranosyl phytolac-cagenic acid 28-O-β-D-glucopyranosyl ester,属于商陆酸型(PA)皂苷、峰⑤(RT=53 min)3-O-β-D-glucopyranosyl-(1→4)- β-D-glucopyranosyl-28-O-hederagenin,属于常春藤(Hed)型型皂苷、峰⑥(RT=56 min)3-O-phytola-ccagenic acid 28-O-β-D-glucopyranosyl ester,属于商陆酸型(PA)皂苷。采用外标法对6种皂苷进行定量分析,结果如表3所示。
藜麦麸皮中的皂苷类化合物含量为 4%左右,远高于藜麦籽粒中皂苷含量0.4%~1.1%[23]。目前,基于藜麦皂苷较高的安全性,国外正开发藜麦皂苷作为生物农药抑制福寿螺、金蜗牛等软体有害动物[24,25]。因此,从藜麦麸皮中制备的藜麦皂苷具有进一步开发利用的价值。
表3 6种皂苷的标准曲线以及含量测定
Table 3 Standard curve and content determination of 6 saponins
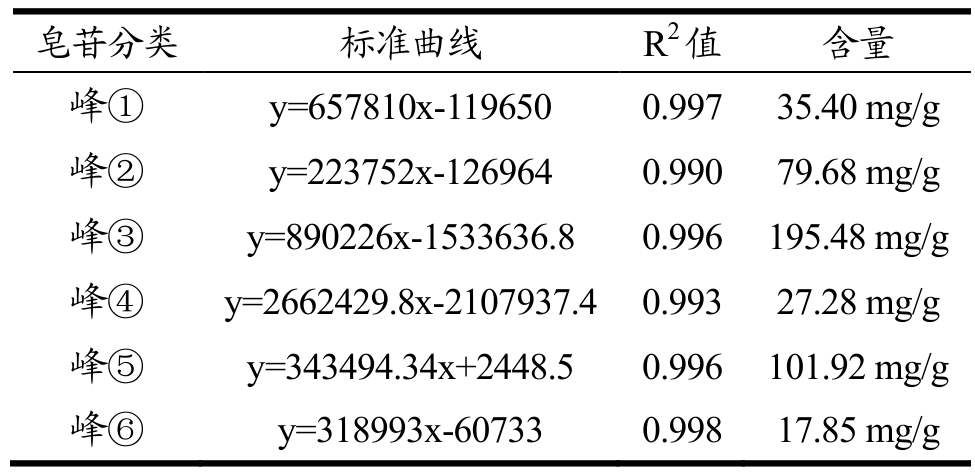
皂苷分类 标准曲线 R2值 含量峰① y=657810x-119650 0.997 35.40 mg/g峰② y=223752x-126964 0.990 79.68 mg/g峰③ y=890226x-1533636.8 0.996 195.48 mg/g峰④ y=2662429.8x-2107937.4 0.993 27.28 mg/g峰⑤ y=343494.34x+2448.5 0.996 101.92 mg/g峰⑥ y=318993x-60733 0.998 17.85 mg/g
2.4 藜麦麸皮油脂的脂肪酸组成
表4 藜麦麸皮油脂的部分脂肪酸组成及其相对含量(%)
Table 4 The composition and relative content of the fatty acid in the bran and fat of wheat bran
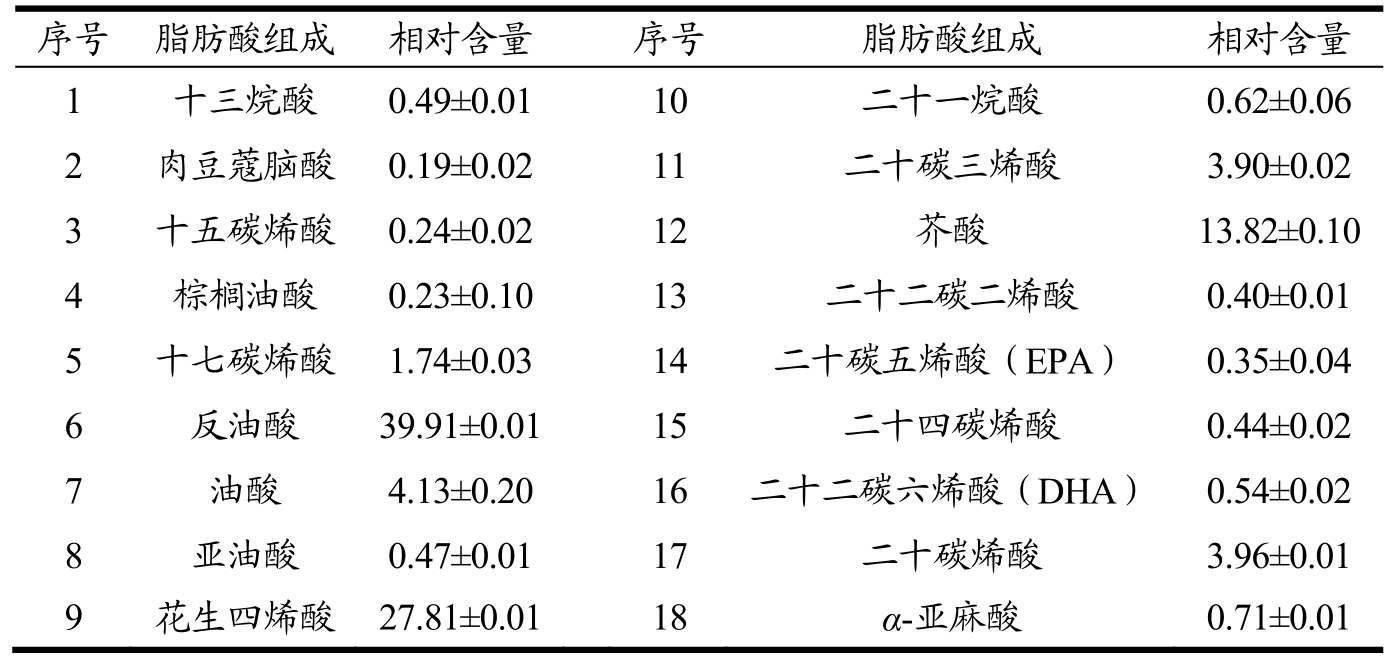
序号 脂肪酸组成 相对含量 序号 脂肪酸组成 相对含量1 十三烷酸 0.49±0.01 10 二十一烷酸 0.62±0.06 2 肉豆蔻脑酸 0.19±0.02 11 二十碳三烯酸 3.90±0.02 3 十五碳烯酸 0.24±0.02 12 芥酸 13.82±0.10 4 棕榈油酸 0.23±0.10 13 二十二碳二烯酸 0.40±0.01 5 十七碳烯酸 1.74±0.03 14 二十碳五烯酸(EPA) 0.35±0.04 6 反油酸 39.91±0.01 15 二十四碳烯酸 0.44±0.02 7 油酸 4.13±0.20 16 二十二碳六烯酸(DHA) 0.54±0.02 8 亚油酸 0.47±0.01 17 二十碳烯酸 3.96±0.01 9 花生四烯酸 27.81±0.01 18 α-亚麻酸 0.71±0.01
藜麦麸皮中提取的油脂含量为14.15%±0.33%;采用气相色谱-质谱联用仪分析藜麦麸皮油脂的脂肪酸组成,共检测到22种脂肪酸(其中4种含量很低,忽略计算),通过与37种脂肪酸甲酯混合标准品的脂肪酸比较,鉴定出藜麦麸皮油脂的脂肪酸种类,并计算出其相对含量,藜麦麸皮油脂的部分脂肪酸组成及其相对含量结果如表4所示。
藜麦麸皮油脂中的不饱和脂肪酸(单不饱和脂肪酸与多不饱和脂肪酸)含量为70.48%,其中单不饱和脂肪酸含量占总脂肪酸的64.17%,多不饱和脂肪酸含量占总脂肪酸的6.31%;饱和脂肪酸含量为29.52%。相对含量较高的四种脂肪酸为反油酸、花生四烯酸、芥酸以及油酸。值得注意的是,反油酸含量结果略高,这与前期报道中采用超临界萃取法获取的藜麦油脂中反油酸含量较高相符合,可能是由藜麦油脂本身的特殊性决定的[26]。反油酸作为含量最高的脂肪酸,是一种天然反式脂肪酸,Dorfman S. E.等人经流行病学研究表明,天然反式脂肪酸对人体健康无害也无益[27]。反油酸是油酸的同分异构体,被认为是IP-TFAs的典型代表物。天然植物油中的反油酸含量通常较低,但在该植物油中的反油酸含量较高,罗凡等人研究结果初步得出高温是油脂中反式脂肪酸产生的充分条件[28]。本实验中油脂是采用索氏抽提法获取,由于采用正己烷作为提取剂,提取温度较高,从而影响藜麦油脂中反式脂肪酸的含量。
花生四烯酸是一种对人体有益的脂肪酸,在藜麦麸皮油脂中含量较高(27.81%±0.01%),经研究发现,花生四烯酸及产物参与了体内多种疾病过程,如哮喘、心血管疾病、肿瘤等[29];花生四烯酸在炎症反应过程中,可以增强巨噬细胞、中性粒细胞对病原菌的杀伤作用,并可合成抗炎因子[30]。花生四烯酸进入人体后,在生物体内主要是以磷脂的形式存在于细胞膜上,需要时经酶水解而释放出来,在磷脂酶A2和磷脂酶C的作用下分解成游离的花生四烯酸[31]。花生四烯酸的释放受磷脂酶A2和磷脂酶C的调节,当细胞膜受到各种刺激时,花生四烯酸便从细胞膜的磷脂池中释放出来,并转变为具有生物活性的代谢产物[31]。由此藜麦麸皮油可以作为人体花生四烯酸的潜在来源之一。芥酸是一种22碳长链脂肪酸,在现代工业中发挥越来越重要的作用[32,33],生产加工过程中可以根据其性质进行加工处理从而降低含量。油酸也是一种不可或缺的营养物质,在人和动物的新陈代谢过程中发挥着举足轻重的作用,但人体自身合成的油酸并不能满足自身的需要,必须从日常食品中摄取一定的量来满足人们对油酸的需求。在植物生长过程中,油酸含量与芥酸含量存在一定的关系,因此,我们可以通过改良其在生长过程中某些因素来提高藜麦麸皮中的油酸含量而降低其芥酸含量[34],从而为油料的开发利用提供新的途径。
2.5 藜麦麸皮油脂对 DPPH自由基的清除率测定
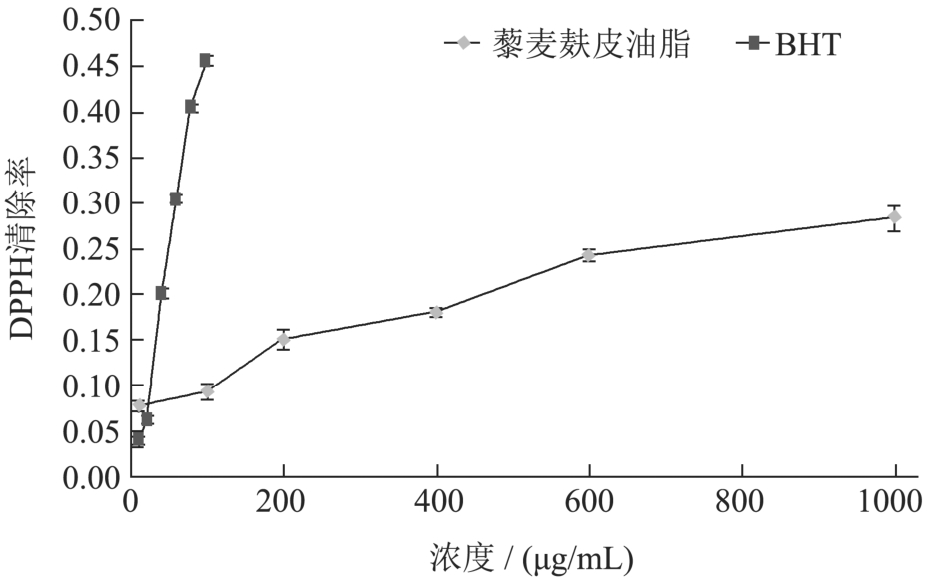
图2 不同浓度的藜麦麸皮油脂和BHT对于DPPH自由基的清除率
Fig.2 The scavenging rate of DPPH free radical by different concentrations of quinoa bran oil and BHT
不同浓度的藜麦麸皮油脂和 BHT(2,6-二叔丁基-4-甲基苯酚)对DPPH自由基的清除率趋势图如图2。通过比较,藜麦麸皮油脂存在一定的清除DPPH自由基的能力,且清除率随浓度增加而逐渐升高。在低浓度时,藜麦麸皮油脂清除DPPH自由基的能力稍高于BHT,但是,当两者浓度同为100 μg/mL时,藜麦麸皮油脂对DPPH自由基的清除率为9.26%,而BHT的清除率为45.69%,藜麦麸皮油脂的清除率为BHT清除率的 1/5。在同等的浓度下,藜麦麸皮油脂清除DPPH自由基的能力要远远高于牡丹籽油和甜橙油[35,36]。通过藜麦麸皮油脂DPPH清除率线性拟合曲线可知,该油脂清除羟基自由基的IC50值是2.08 mg/mL。DPPH自由基是一种稳定的自由基,其广泛用于评估油脂的自由基清除活性[37]。藜麦麸皮油脂能有效清除DPPH自由基,表明其具有一定的抗氧化能力,可用于功能性油脂产品的开发。
2.6 藜麦麸皮油脂对超氧阴离子的清除率测定
超氧阴离子是生物体内自由基产生的根源,清除超氧阴离子的意义很大,藜麦麸皮油脂和 BHT在不同浓度下对于超氧阴离子的清除率趋势见图3。
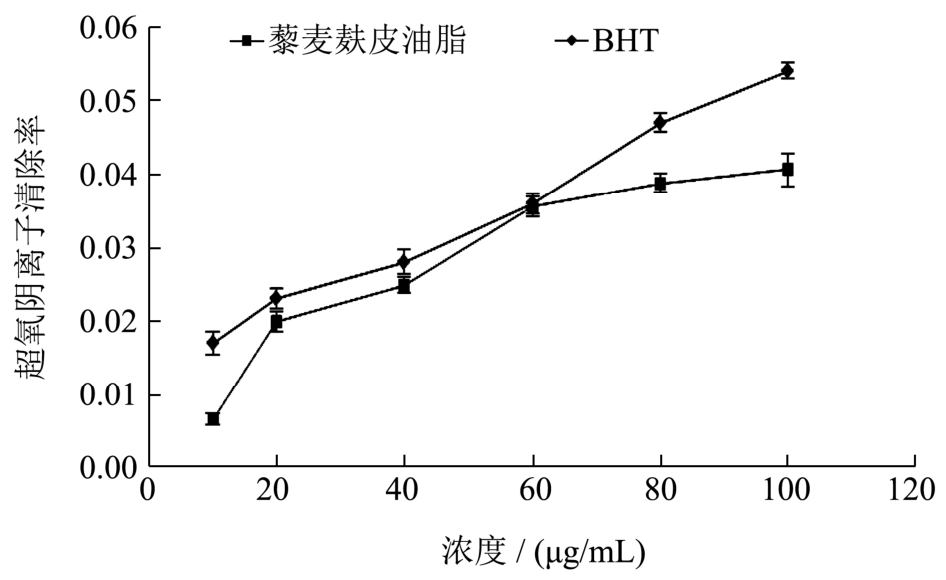
图3 不同浓度的藜麦麸皮油脂和BHT对超氧阴离子清除率
Fig.3 The scavenging rate of superoxide anion by different concentrations of quinoa bran oil and BHT
比较发现,BHT对于清除超氧阴离子的能力略高于藜麦麸皮油脂,当浓度为60 μg/mL的时候,BHT和藜麦麸皮油脂对超氧离子的清除率分别为3.60%和3.56%,表明藜麦麸皮油脂存在一定的清除超氧阴离子的活性但其活性较低,其主要原因是超氧阴离子的反应体系为水溶液。
藜麦油脂中具有大量甾醇类物质如类胡萝卜素类及维生素E,且量高于小麦,水稻,燕麦等粮食作物[38]。此外,藜麦油脂中富含不饱和脂肪酸,不饱和脂肪酸含量越高,其抗氧化活性越强[39]。这也可能是藜麦油脂具有较高抗氧化性的原因之一。然而,藜麦麸皮油脂中不饱和脂肪酸含量高达70.48%,容易被氧化从而不利于油脂的长期储存。植物油脂中常见的硬脂酸、油酸、亚油酸、亚麻酸相对氧化速率比为1:10:100:200,高油酸和高硬脂酸的植物油会表现出较高的氧化稳定性[40],藜麦麸皮油脂中的油酸以及硬脂酸(十八烷酸)含量很低,这说明单纯藜麦油脂在加工存储中存在被氧化的风险。
3 结论
藜麦麸皮中含有多种营养成分、活性成分以及矿物质等微量元素,其蛋白质、淀粉以及油脂的含量较高,其中蛋白含量超过25%,具有一定的开发利用价值;藜麦麸皮中的皂苷含量也超过 3%,可以进一步开发利用制备成生物活性制剂。在藜麦麸皮油脂中有大量的不饱和脂肪酸的存在,且甾醇类物质含量较高,具有一定的抗氧化性,后期可根据油脂特性进行工艺化加工处理,有望制备成可食用油脂;另外,藜麦麸皮油脂的活性成分以及不同组分的拮抗作用和协同作用有待进一步分析研究,藜麦麸皮油脂的加工处理及在其他方面的应用还有待进一步的探索和改良。总之,基于丰富的营养成分类型和较高的活性成分含量,藜麦麸皮具有进一步深加工的利用价值。
[1] Jacobsen S E. The worldwide potential for quinoa(Chenopodium quinoa Willd.) [J]. Food Reviews International, 2003, 19(1-2): 167-177
[2] 任贵兴,杨修仕,么杨.中国藜麦产业现状[J].作物杂志,2015,12(5):1-5 REN Gui-xing, YANG Xiu-shi, YAO Yang. Current Situation of quinoa industry in China [J]. Crops, 2015(5): 1-5
[3] James L E A, Chapter 1 quinoa (Chenopodium quinoa Willd.):Composition, chemistry, nutritional, and functional properties[J]. Advances in Food and Nutrition Research, 2009, 58(9):1-31
[4] Stuardo M, Maritin R S. Antifungal properties of quinoa(Chenopodium quinoa Willd) alkali treated saponins against Botrytis cinerea [J]. Industrial Crops and Products, 2008,27(3): 296-302
[5] Hirose Y, Fujita T, Ishii T, et al. Antioxidative properties and flavonoid composition of Chenopodium quinoa seeds cultivated in Japan [J]. Food Chemistry, 2010, 119(4):1300-1306
[6] Woldemichael G M, Wink M. Identification and biological activities of triterpenoid saponins from Chenopodium quinoa[J]. Agricultural and Food Chemistry, 2001, 49(5): 2327-2332[7] Laura M L, Aylen C, Axel E N. Traditional post-harvest processing to make quinoa grains (Chenopodium quinoavar.quinoa) apt for consumption in Northern Lipez(Potosí, Bolivia): ethnoarchaeological and archaeobotanical analyses [J]. Archaeological and Anthropological Sciences,2011, 3(1): 49-70
[8] 薛鹏,张威毅,张丰香.元阳红米麸皮、精米、糙米、留胚米中营养成分及花色苷含量分析[J].现代食品科技,2018,34(3):212-217,158 XUE Peng, ZHANG Wei-yi, ZHANG Feng-xiang, et al.Analysis of nutrient composition and anthocyanin content in wheat bran, milled rice, brown rice and embryo rice in Yuanyang [J]. Modern Food Technology, 2018, 34(3): 212-217, 158
[9] 任贵兴,叶全宝.藜麦生产与应用[M].北京:科学出版社,2016 REN Gui-xing, YE Quan-bao. Production and Application of Quinoa [M]. Beijing: Science press, 2016
[10] 杜静婷,陈超,范三红.响应面法优化藜麦糠皂苷的提取及抗氧化活性[J].山西农业科学,2016,44(7):932-937 DU Jing-ting, CHEN Chao, FAN San-hong. Optimization of extraction conditions for saponins from Chenopodium quinoa bran by response surface method and its antioxidant activities[J]. Journal of Shanxi Agricultural Sciences, 2016, 44(7):932-937
[11] 李丹华,朱圣陶.气相色谱法测定常见植物油中脂肪酸[J].粮食与油脂,2006,11(8):29-32 LI Dan-hua, ZHU Sheng-tao. Determination of fatty acids in vegetable oils by gas chromatography [J]. Cereals and Oils,2006, 11(8): 29-32
[12] Shimada K, Fujikawa K, Yahara K, et al. Antioxidative properties of xanthan on the antioxidation of soybean oil in cyclodextrin emulsion [J]. Agricultural and Food Chemistry,1992, 40(11): 945-948
[13] 静天玉,赵晓瑜.用终止剂改进超氧化物歧化酶邻苯三酚测活法[J].生物化学与生物物理,1995,22(1):84-86 JING Tian-yu, ZHAO Xiao-yu. The improved pyrogallol method by using terminating agent for superoxide dismutate measurement [J]. Progress in Biochemistry and Biophysics,1995, 22(1): 84-86
[14] 李玉英,王玉玲,王转花.藜麦营养成分分析及黄酮提取物的抗氧化和抗菌活性研究[J].山西农业科学,2018,387(5):61-65,73 LI Yu-ying, WANG Yu-ling, WANG Zhuan-hua. Study on nutritional components of quinoa and the antioxidant and antibacterial activity of flavonoids extracts [J]. Journal of Shanxi Agricultural Sciences, 2018, 387(5): 61-65, 73
[15] Verena N, Juan D, Ruth C. Assessment of the nutritional composition of quinoa (Chenopodium quinoa Willd.) [J].Food Chemistry, 2016, 193(11): 47-54
[16] PeirettI P G, Gai F, Tassone S. Fatty acid profile and nutritive value of quinoa (Chenopodium quinoa Willd.) seeds and plants at different growth stages [J]. Animal Feed Science and Technology, 2013, 183(1-2): 56-61
[17] 陈树俊,胡洁,庞振鹏,等.藜麦营养成分及多酚抗氧化活性的研究进展[J].山西农业科学,2016,44(1):110-114 CHEN Shu-jun, HU Jie, PANG Zhen-peng, et al. Research progress on nutritional components and antioxidant activity of polyphenol of quinoa [J]. Journal of Shanxi Agricultural Sciences, 2016, 44(1): 110-114
[18] 焦红艳,高文庚,陈丽文.藜麦营养成分测定及对孕期妇女健康的促进作用[J].基层医学论坛,2018,530(14):36-37 JIAO Hong-yan, GAO Wen-geng, CHEN Li-wen.Determination of the nutritional composition of quinoa and its effect on health of pregnant women [J]. The Medical Forum, 2018, 530(14): 36-37
[19] Ando H, Chen Y C, Tang H J, et al. Food components in fractions of quinoa seed [J]. Food Science and Technology Research, 2002, 8(1): 80-84
[20] Koziol M J. Chemical composition and nutritional evaluation of quinoa (Chenopodium quinoa Willd.) [J]. Journal of Food Composition and Analysis, 1992, 5(1): 35-68
[21] Ahuja J K C, Haytowitz D, Pehrsson P, et al. USDA national nutrient database for standard reference [R]. 2015, Release 28.DOI: 10.13140/RG.2.1.2550.5523
[22] 赵雷,丁葵英,薛鹏,等.藜麦麸皮不同极性部位的抑菌及酪氨酸酶抑制活性研究[J].食品工业科技,2019,40(6):82-88,94 ZHAO Lei, DING Kui-ying, XUE Peng, et al. Bacteriostatic and tyrosinase inhibitory activities of different polar sites from quinoa bran [J]. Science and Technology of Food Industry, 2019, 40(6): 82-88, 94
[23] Mastebroek H D, Limburg H, Gilles T, et al. Occurrence of sapogenins in leaves and seeds of quinoa (Chenopodium quinoa Willd.) [J]. Journal of the Sciences of Food and Agriculture, 2000, 80(11): 152-156
[24] Brito F C D, Gosmann G, Oliveira G T. Extracts of the unripe fruit of Ilex paraguariensis as a potential chemical control against the golden apple snail Pomacea canaliculata(Gastropoda, Ampullariidae) [J]. Natural Product Research,2018, 11(21): 1-4
[25] Jiang X, Hansen H C B, Strobel B W, et al. What is the aquatic toxicity of saponin-rich plant extracts used as biopesticides [J]. Environmental Pollution, 2018, 236(21):416-424
[26] 柳慧芳,郭金英,江利华,等.超临界 CO2萃取藜麦油脂的工艺优化及其脂肪酸成分分析[J].食品工业科技,2018,39(22):200-202 LIU Hui-fang, GUO Jin-ying, JIANG Li-hua, et al.Optimization of supercritical CO2 extraction of quinoa oil and fatty acid composition analysis [J]. Food Industry Science and Technology, 2018, 39(22): 200-202
[27] Dorfman S E, Laurent D, Gounarides J S, et al. Metabolic implications of dietary trans-fatty acids [J]. Obesity, 2009,17(6): 1200-1207
[28] 罗凡,费学谦,李康雄,等.高温油茶籽油中苯并芘和反油酸产生规律研究[J].中国粮油学报, 2016,31(8):44-47,54LUO Fan, FEI Xue-qian, LI Kang-xiong, et al. Study on the production of benzo pyrene and reverse oleic acid in high temperature Camellia oleifera seed oil [J]. Chinese Journal of Grain and Oil, 2016, 31(8): 44-47, 54
[29] Peters G M. Leukotrienes [J]. New England Journal Medicine, 2007, 357(11): 1841-1854
[30] Peters G M, Canetti C, Mancuso P. Leukotrienes:Underappreciated mediators of innate immune responses [J].The Journal of Immunology, 2005, 174(21): 589-594
[31] 周之伟,王文娟,白文佩,等.花生四烯酸及其代谢产物与围绝经期的关系[J].国际妇产科学杂志,2015,42(2):177-179,186ZHOU Zhi-wei, WANG Wen-juan, BAI Wen-pei, et al.Relationship between arachidonic acid and its metabolites and perimenopause [J]. International Journal of Obstetrics and Gynecology, 2015, 42(2): 177-179, 186
[32] 王贵春,杨光圣.油菜高含油量育种研究进展[J].安徽农业科学,2007,35(18):5373-5375WANG Gui-chun, YANG Guang-sheng. Research progress in the high oil content oilseed rape breeding [J]. Journal of Anhui Agricultural Science. 2007,35(18):5373-5375
[33] 张瑛.花生衣多酚的提取、纯化及其活性研究[D].太原:山西大学,2016ZHANG Ying. Peanut skin polyphenols extraction,purification and activity research [D]. TaiYuan: ShanXi University, 2016
[34] 杨柳,李东欣,谭太龙.不同油酸含量油菜脂肪酸含量分析[J].作物研究,2018,32(5):390-394,402YANG Liu, LI Dong-xin, TAN Tai-long. Analysis of fatty acid content in rapeseed with different oleic acid contents [J].Crop Research, 2018, 32(5): 390-394, 402
[35] 翟文婷,朱献标,李艳丽,等.牡丹籽油成分分析及其抗氧化活性研究[J].烟台大学学报(自然科学与工程版),2013,26(2):147-150 ZHAI Wen-ting, ZHU Xian-biao, LI Yan-li, et al.Composition analysis and antioxidant activity of peony seed oil [J]. Journal of Yantai University (Natural Science and Engineering Edition), 2013, 26(2): 147-150
[36] 龚文静,王磊,邱玥,等.甜橙油抗氧化活性研究[J].安徽农业科学,2011,39(35):21783-21784,22131 GONG Wen-jing, WANG Lei, QIU Yue, et al. Study on the antioxidant activity of sweet orange oil [J]. Anhui Agricultural Science, 2011, 39(35): 21783-21784, 22131
[37] Dong H M, Zhang Q, Li L,et al. Antioxidant activity and chemical compositions of essential oil and ethanol extract of Chuanminshen violaceum [J]. Industrial Crops and Products,2015, 76(6): 290-297
[38] Filho A M, Pirozi MR, Borges J T, et al. Chaves J B, Coimbra J S. Quinoa: Nutritional, functional, and antinutritional aspects [J]. Critical Reviews in Food Science and Nutrition,2017 57(8): 1618-1630
[39] 吴雪辉,周薇,李昌宝,等.茶油的氧化稳定性研究[J].中国粮油学报,2008,23(3):96-99 WU Xue-hui, ZHOU Wei, LI Chang-bao, et al. Study on oxidation stability of camellia oil [J]. Journal of the Chinese Cereals and Oils Association, 2008, 23(3): 96-99
[40] Bradley D G, Min D B. Singlet oxygen oxidation of foods [J].Critical Reviews in Food Science and Nutrition, 1992, 31(3):211-236