川陈皮素(nobiletin)是一类天然黄酮类化合物,通常存在于芸香科及大戟科植物的茎叶及果皮中,广泛应用在医学和食品科学中。川陈皮素的制备方法主要包括植物萃取法和化学合成法。现代药理研究表明,川陈皮素具有抗炎、抗氧化及调节免疫等多种生物活性[1]。脂多糖(Lipopolysaccharides,LPS)是革兰氏阴性菌细胞壁的主要成分,由多糖,O-特异性链和类脂A组成,其中类脂A是LPS的主要活性成分[2]。Toll样受体(Toll like receptor,TLR)最早是从果蝇体内分离得到的,它主要决定果蝇的非特异性免疫反应。1997年首次在人体分离出果蝇TLR的同系物,从而发现它可以识别病原菌,启动特异性和非特异性免疫反应。TLR产生不同的效应分子对抗不同的微生物感染,调节着组织和细胞的炎症反应[3]。其中,Toll样受体4(Toll-like receptor 4,TLR4)在识别LPS及介导的炎症反应信号转导中起着重要作用。LPS能够结合TLR4激活巨噬细胞介导下游胞内信号如核转录因子κB(Nuclearfactor-kappa B,NF-κB)和丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)等信号通路,从而介导炎症反应,是复制整体动物和细胞炎症模型的常用外源激活剂[4]。大量研究发现,许多黄酮类的化合物显示了良好的抗炎效应,如Qi G等的研究表明,川陈皮素可减轻LPS刺激的全身炎症反应,如减少白细胞介素-1β(Interleukin-1β,IL-1β)和肿瘤坏死因子 α(Tumor Necrosis Factor-α,TNF-α)的产生;同时可减轻腹腔注射LPS引起的中枢神经炎症反应及LPS诱导的空间学习记忆能力的损伤,其分子机制与其调节 MAPK和核转录因子 κB(Nuclearfactor-kappa B,NF-κB)信号通路有关[5]。Liu F等的研究表明,川陈皮素可通过氧化应激途径减轻缺氧再灌注诱导的H9c2心肌细胞的凋亡[6]。但川陈皮素能否通过调节 TLR4信号途径减轻 LPS诱导的RAW 264.7细胞的炎症反应还尚未见相关报道。因此,本研究以LPS刺激的RAW 264.7细胞为离体细胞炎症模型,探讨川陈皮素抑制炎症反应的作用,并围绕TLR4信号相关途径进行深入的研究,为后期开发川陈皮素抗炎药物的提供实验室基础。
1 材料与方法
1.1 材料
川陈皮素分子式C27H32O14,分子量为580.53,相对纯度大于或等于98%,购于四川成都植标化纯生物技术有限公司;RAW 264.7细胞,购于北京协和细胞资源中心;DMEM高糖培养基,美国Sigma;胎牛血清,Sciencell公司;LPS,Sigma公司,(来源于大肠杆菌);MTT,武汉博士德生物公司;NO试剂盒,碧云天生物公司;反转录试剂盒,Thermo公司;PCR引物,生工生物工程公司;NF-κB和Lamin B抗体,美国Cell signaling公司。
1.2 仪器
NU-4750E型二氧化碳培养箱,NuAire美国;CKX41倒置显微镜,Olympus日本;全波长酶标仪,Thermo美国;PCR仪,Whatman Biometra德国;凝胶成像分析系统,Gel logic 200美国柯达;CT15RT高速冷冻离心机,上海天美生化仪器设备工程有限公司。
1.3 方法
1.3.1 RAW 264.7细胞复苏及培养
用75%酒精擦拭超净工作台,紫外线照射超净工作台30 min,从液氮罐中取出冻存管,迅速将冻存管放到已经预热的水浴锅(37 ℃)中迅速解冻,不断摇动,待冻存管内液体完全溶解(控制在1 min内),取出用酒精棉球擦拭冻存管外壁,再拿入超净台内,将冻存管内的液体转入15 mL离心管,加入2倍体积含10%胎牛血清的DMEM培养基,800 r/min离心5 min,弃去上清液,重悬细胞,接种到培养瓶中,37 ℃、5% CO2条件下培养。传代:待细胞长至90%后,从培养箱内取出细胞,小心吸出旧培养液,用PBS清洗,加入3 mL 10%胎牛血清的DMEM培养基,用细胞刮棒沿一个方向轻轻将细胞刮下来,将细胞悬液转移到15 mL离心管中,800 r/min离心5 min,弃去上清液,加入培养液,用滴管轻轻吹打细胞制成细胞悬液,分装入培养瓶,放入37 ℃培养箱、5% CO2条件下培养。
1.3.2 川陈皮素对LPS诱导的RAW 264.7细胞活力的影响
将RAW 264.7细胞悬液以1×105/mL的密度接种于96孔板,细胞贴壁后,设置正常对照组、LPS刺激组(1 mg/L)及川陈皮素给药组(0.1 mg/L、1 mg/L、5 mg/L和25 mg/L),每组6个复孔,24 h后加入MTT,避光培养4 h后吸弃上清,每孔加入150 μL DMSO,于摇床低速震荡溶解结晶,酶标仪490 nm处测量吸光度,细胞活力计算公式为:(实验组OD值-空白组OD)值)/(对照组OD-空白组OD)×100%。
1.3.3 川陈皮素对LPS诱导的RAW 264.7细胞释放NO水平的影响
将RAW 264.7细胞悬液以1×105/mL的密度接种于96孔板,细胞贴壁后,吸弃上清,加入不同浓度的川陈皮素(0.1 mg/L、1 mg/L、5 mg/L和25 mg/L)预保护12 h,每组6个复孔,再加入终浓度为1 mg/L的LPS刺激12 h,Griess法测定上清液中NO含量。
1.3.4 川陈皮素对LPS诱导的RAW 264.7细胞 TLR4、CD14、iNOS、IL-1β、TNF-α 的 mRNA表达水平的影响
将RAW 264.7细胞悬液以1×105/mL密度接种6孔板,每孔2 mL,待细胞贴壁后,设置正常对照组、LPS刺激组(1 mg/L)及川陈皮素给药组(0.1 mg/L、1 mg/L、5 mg/L和25 mg/L),药物预保护12 h,再加入1 mg/L LPS刺激12 h,按Trizol试剂盒提取总RNA,逆转录为 cDNA后 Real-time PCR仪扩增。β-actin、iNOS、TNF-α、IL-1β、CD14和 TLR4引物 由上海生工合成,引物序列如下表:
表1 Real-time PCR引物序列
Table 1 The primers for Real-time PCR

引物 上游 下游β-actin 5’-CGTGCGTGACATCAAAGAGAA-3’ 5’-TGGATGCCACAGGATTCCAT-3’iNOS 5’-GCCCTGCTTTGTGCGAAG-3’ 5’-GCCCTTTGTGCTGGGAGTC-3’TNF-α 5’-AGGCAACCTGACCACTCTCC-3’ 5’-CACCACCATCAAGGACTCAA-3’IL-1β 5’-TGTCCTGTGTAATGAAAGACGGC-3’ 5’-GCTTGTGCTGCTTGTGAGG-3’CD14 5’-CAACAGGCTGGATAGGAACCC-3’ 5’-GCCACTGCTTGGGATGATG-3’TLR4 5’-CTCTGGCATCATCTTCATTGTCC-3’ 5’-CTGCTGTTTGCTCAGGATTCG-3’
扩增条件为94 ℃ 5 min、94 ℃ 30 s、55 ℃ 30 s、72 ℃ 30 s、30个循环、72 ℃ 5 min,琼脂糖凝胶电泳检测各指标的mRNA表达情况。
1.3.5 川陈皮素对LPS诱导的RAW 264.7细胞NF-κB表达的影响
将RAW 264.7细胞悬液以1×105/mL密度接种6孔板,每孔2 mL,待细胞贴壁后,设置正常对照组、LPS刺激组(1 mg/L)及川陈皮素给药组(0.1 mg/L、1 mg/L、5 mg/L和25 mg/L),药物预保护12 h,再加入1 mg/L LPS刺激12 h后把六孔板取出,弃上清,用预冷的PBS洗两遍,然后加入1 mL PBS,用细胞刮棒将细胞刮取,1000 r/min,离心5 min,弃上清收集细胞估计离心后体积(PCV),加入5倍PCV的CEB-A,5 μL蛋白酶抑制剂,涡旋混合仪剧烈震荡30 s,置于冰上15 min,每隔5 min震荡15 s。加入1/20体积的CEB-B,涡旋混合仪震荡10 s,静置于冰上1 min。1000 r/min 4 ℃离心5 min,沉淀为核粗提物,上清为胞浆蛋白。用100 μL CEB-A洗涤沉淀,1000 r/min离心 5 min,弃上清。在离心沉淀物(细胞核)中加入100 μL预冷的NEB,最大转速涡旋剧烈震荡15 s,冰上静置30 min,每间隔10 min涡旋剧烈震荡15 s。4 ℃,12000 r/min,离心5 min,迅速将上清转入另一离心管,即得胞核蛋白。胞核蛋白进行蛋白定量,取一定体积的蛋白加入5X的上样缓冲液,煮沸10 min,电泳并转PVDF膜。5%脱脂奶粉封闭1 h后,分别使用NF-κB和内参Lamin B的抗体,4 ℃孵育过夜,TBST洗3次,二抗室温下孵育1 h,TBST洗3次,ECL化学发光法显影。
1.3.6 统计学分析
采用GraphPad Prism 5软件,PCR结果采用Image J软件分析,计量资料采用X±S表示,全部数据采用SPSS 18.0统计软件进行分析,各组均数用单因素方差分析,p<0.05表示差异有统计学意义。
2 结果与讨论
2.1 结果
2.1.1 川陈皮素对LPS诱导的RAW 264.7细胞释放乳酸脱氢酶的影响
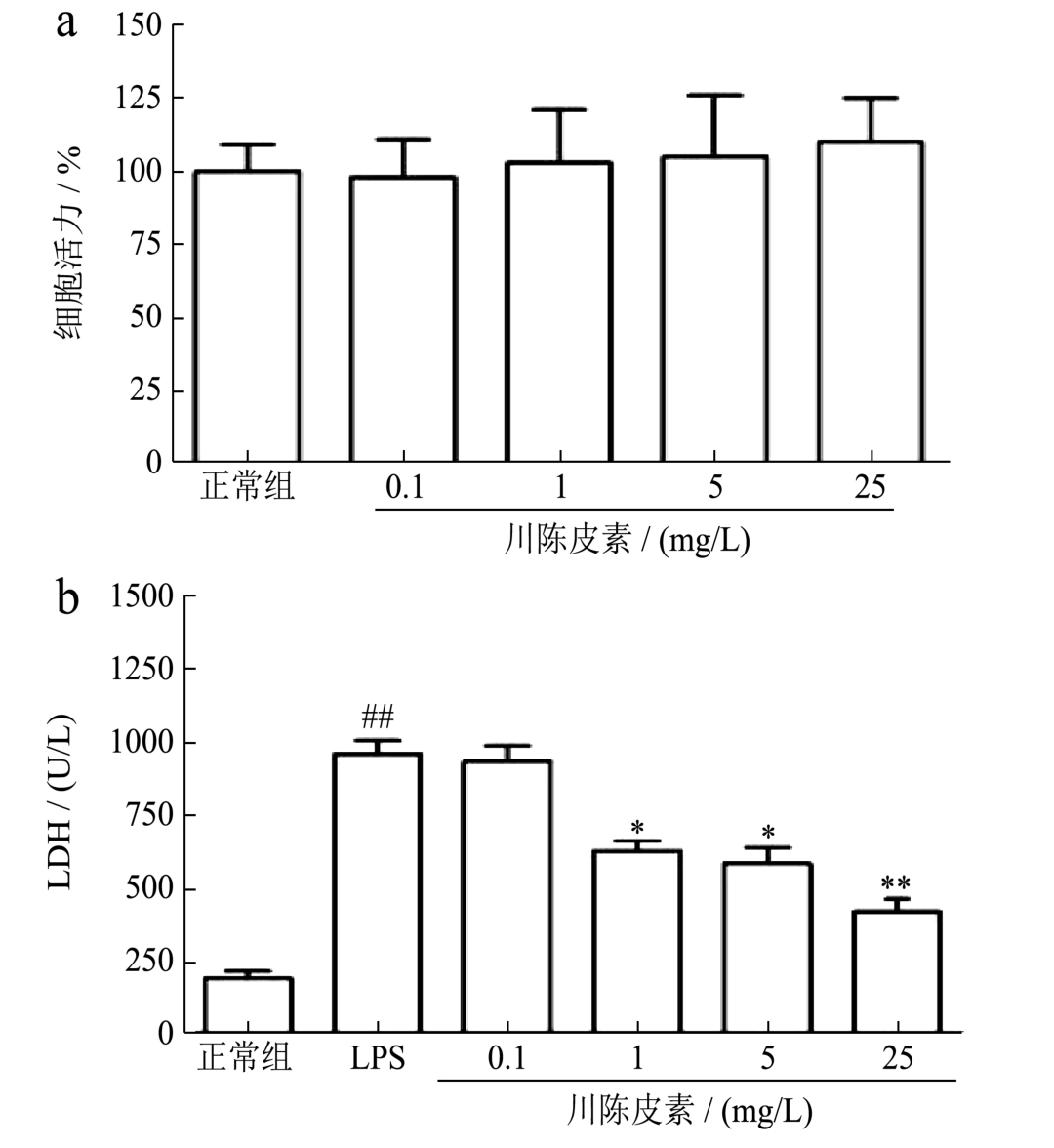
图1 川陈皮素对LPS诱导的RAW 264.7细胞释放乳酸脱氢酶的影响
Fig.1 Effect of Nobiletin on LDH releasing in RAW 264.7 Cell induced by LPS
注:与正常组比较, ##p<0.01;与LPS刺激组比较,*p<0.05,**p<0.01;图a:细胞活力;图b:乳酸脱氢酶活力。
采用MTT法检测了川陈皮素对细胞活力的影响,与正常组相比,川陈皮素各剂量组(0.1 mg/L、1 mg/L、5 mg/L和25 mg/L)对细胞活力均没有影响;我们又采用乳酸脱氢酶试剂盒检测了川陈皮素对乳酸脱氢酶的影响,正常组乳酸脱氢酶的水平是(188±25)U/L,与正常组相比,LPS刺激的RAW 264.7细胞的乳酸脱氢酶活力显著升高到(958±46)U/L,是正常组细胞乳酸脱氢酶水平的5.12倍(p<0.01),给予川陈皮素干预后,1 mg/L、5 mg/L和25 mg/L的川陈皮素均能降低LPS诱导的RAW 264.7细胞释放乳酸脱氢酶的水平,分别降低到(625±34)U/L、(528±55)U/L和(417±55)U/L(p<0.05 或p<0.01),结果见图1。
2.1.2 川陈皮素对LPS诱导的RAW 264.7细胞释放NO水平和iNOS表达的影响
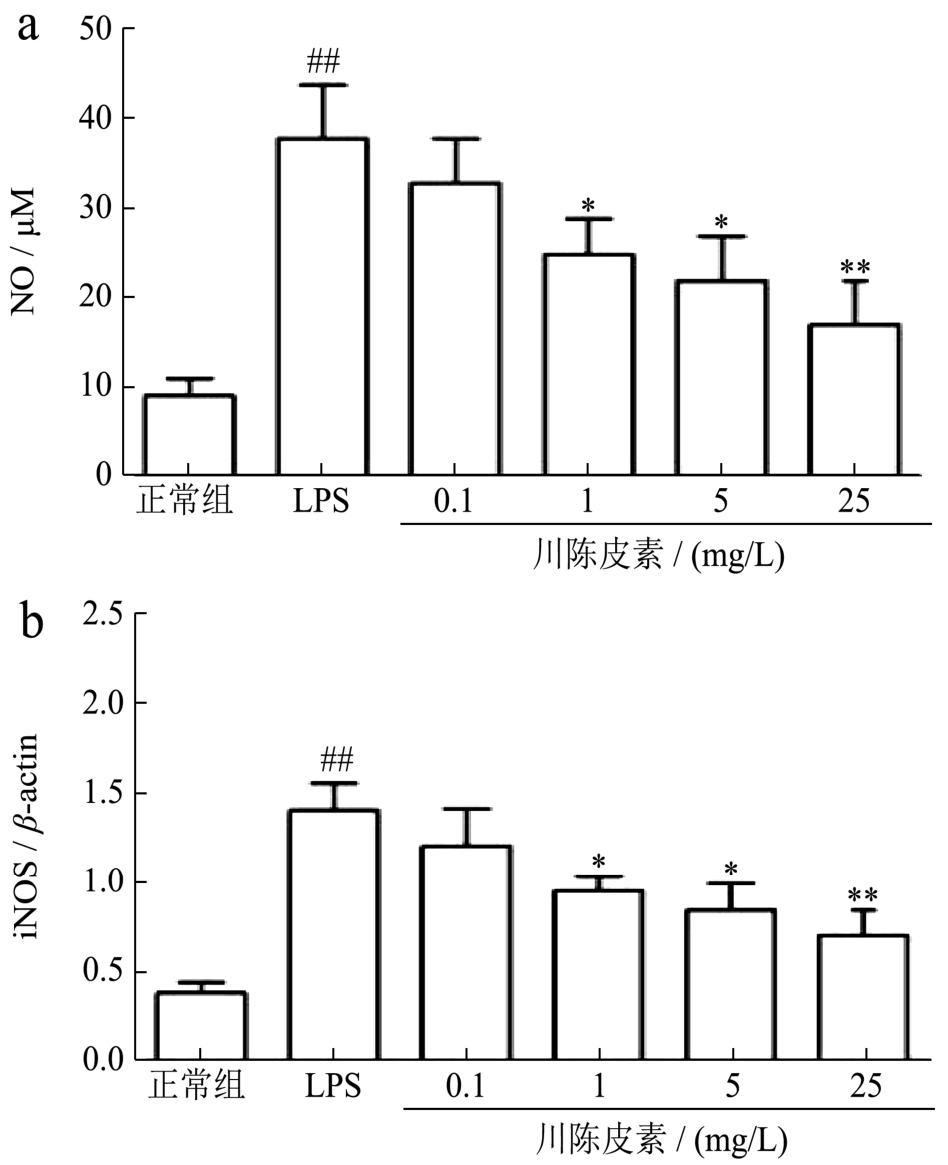
图2 川陈皮素对LPS诱导的RAW 264.7细胞释放NO水平和iNOS表达的影响
Fig.2 Effect of Nobiletin on NO level and iNOS expression in RAW 264.7 Cell induced by LPS
注:与正常对照组比较,##p<0.01;与LPS刺激组比较,*p<0.05,**p<0.01;图a:NO释放水平;图b:iNOS表达水平。
诱导型一氧化氮合酶(Inducible nitric oxide synthase,iNOS)主要在炎症和免疫反应中被激活,催化NO产生,但NO产生过量则可诱导炎症性疾病的发生和发展[7]。因此,我们采用NO检测试剂盒和Real-time PCR的方法分别检测了NO水平和iNOS的mRNA表达水平。实验结果表明,正常组的NO释放水平是(9±2) μM,iNOS mRNA 相对表达水平是0.38±0.06,LPS诱导RAW 264.7细胞的NO释放水平和iNOS表达均显著升高,分别升高到(38±6) μM和1.40±0.15(p<0.01);给予川陈皮素干预后,1 mg/L、5 mg/L和25 mg/L各剂量组均能减少LPS诱导的RAW 264.7细胞的NO释放水平和iNOS表达,其中NO水平分别降低到(25±4) μM、(22±5) μM 和(17±5) μM,iNOS表达分别降低到0.95±0.08、0.84±0.15和0.7±0.14(p<0.05或p<0.01),结果见图2。
2.1.3 川陈皮素对LPS诱导的RAW 264.7细胞IL-1β和TNF-α的mRNA表达水平的影响
LPS诱导的巨噬细胞等释放的炎症因子造成的级联反应对组织细胞的损伤程度远远大于其本身对机体的影响,其中以经典的促炎症因子IL-1β和TNF-α最为重要。因此,采用Real-time PCR的方法分别检测IL-1β和TNF-α的mRNA表达水平。与正常组相比,LPS刺激的 RAW 264.7细胞的 IL-1β和 TNF-α的mRNA表达水平显著升高,分别升高了4.91倍和10倍(p<0.01);给予川陈皮素干预后,1 mg/L、5 mg/L和25 mg/L川陈皮素各剂量组均能降低LPS诱导的RAW 264.7细胞的IL-1β和TNF-α的表达水平,其中,各剂量组的IL-1β表达水平分别降低了31%、47%和59%;TNF-α表达水平分别降低了50%、54%和64%(p<0.05或p<0.01),结果见图3。
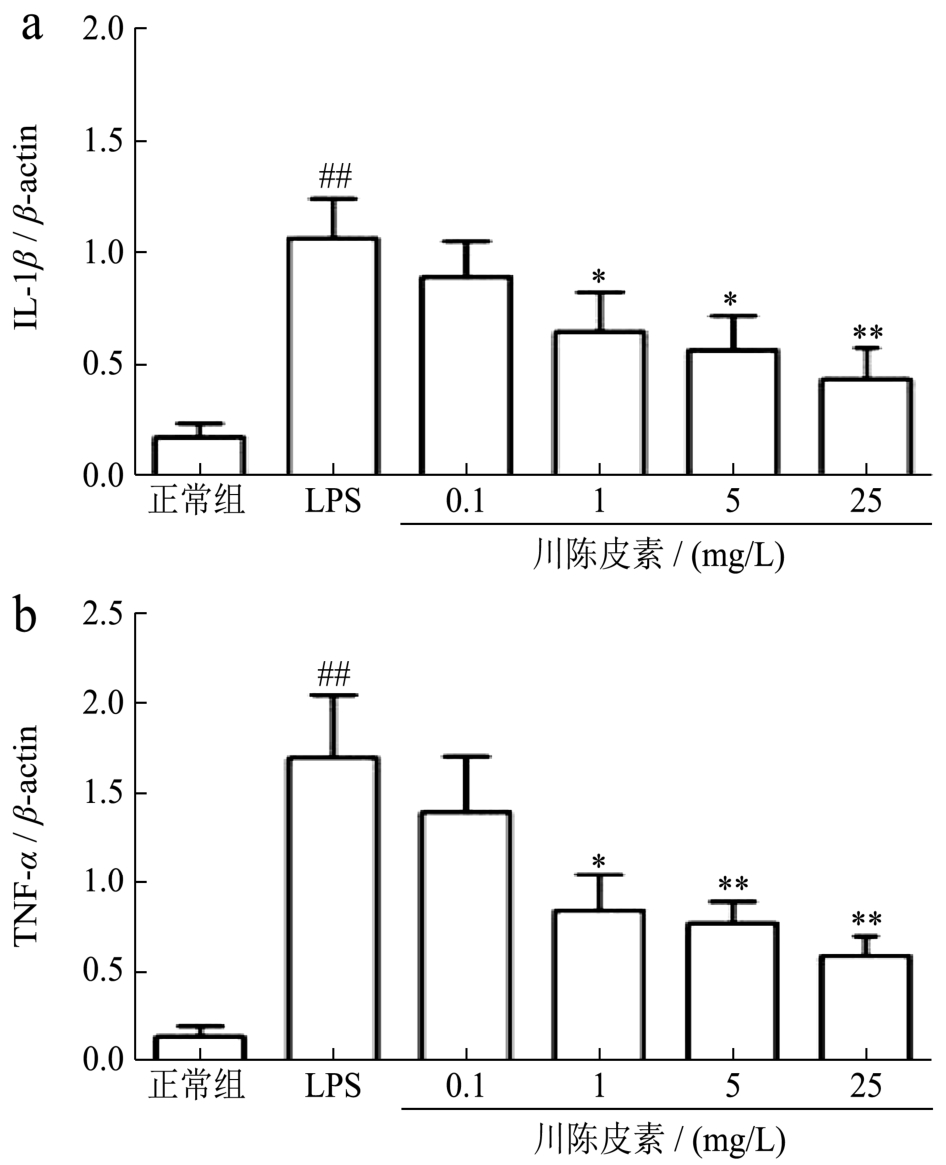
图3 川陈皮素对LPS诱导的RAW 264.7细胞IL-1β和TNF-α的mRNA表达水平的影响
Fig.3 Effect of Nobiletin on mRNA expression of IL-1β and TNF-α in RAW 264.7 Cell induced by LPS
注:与正常组比较,##p<0.01;与LPS刺激组比较,*p<0.05,**p<0.01;图a:IL-1β表达水平;图b:TNF-α表达水平。
2.1.4 川陈皮素对LPS诱导的RAW 264.7细胞NF-κB表达的影响
NF-κB是介导炎症反应中发生的重要信号分子[8]。我们采用Western Blot法检测了NF-κB的核蛋白表达水平,与正常组相比,LPS刺激的RAW 264.7细胞NF-κB核蛋白表达水平显著升高,升高了2.50倍(p<0.01),给予川陈皮素干预后,1 mg/L、5 mg/L和25 mg/L川陈皮素各剂量组均能降低LPS诱导的RAW 264.7细胞NF-κB的核蛋白表达水平,分别降低了20%、32%和52%(p<0.05或p<0.01),结果见图4。
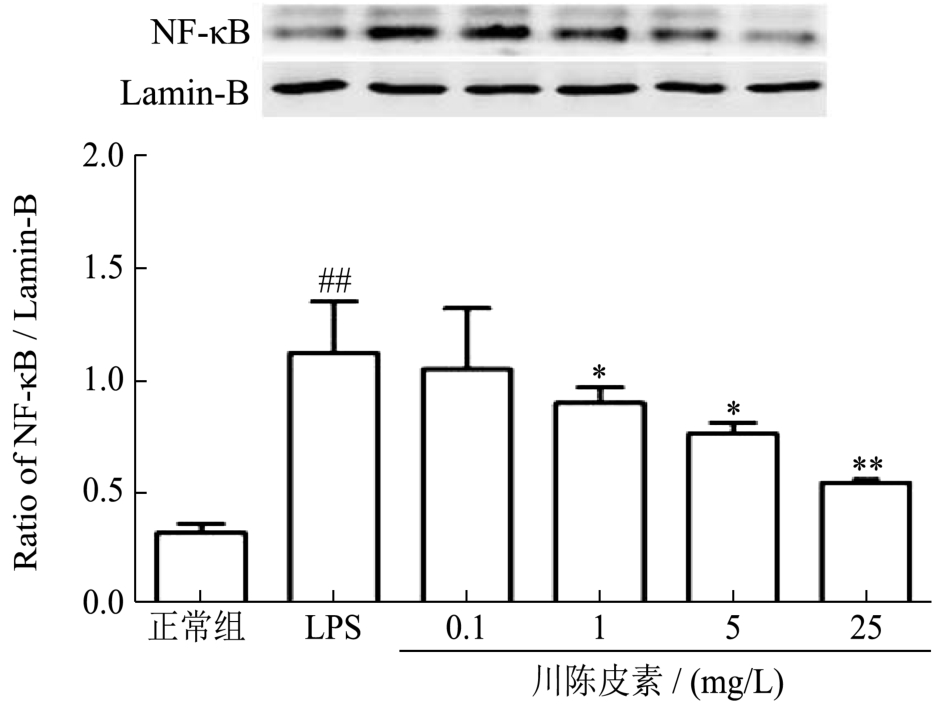
图4 川陈皮素对LPS诱导的RAW 264.7细胞NF-κB表达水平的影响
Fig.4 Effect of Nobiletin on nuclear expression of NF-κB in RAW 264.7 Cell induced by LPS
注:与正常组比较,##p<0.01;与LPS刺激组比较,*p<0.05,**p<0.01。
2.1.5 川陈皮素对LPS诱导的RAW 264.7细胞TLR4和CD14的mRNA表达水平的影响
TLR4和CD14形成的多受体复合物在LPS介导的炎症反应中起重要作用[9]。因此,采用Real-time PCR方法检测了TLR4和CD14 mRNA的表达水平。与正常组相比,LPS刺激的RAW 264.7细胞的TLR4和CD14 mRNA表达水平显著升高,分别升高4.53倍和2.84倍(p<0.01);给予川陈皮素干预后,1 mg/L、5 mg/L和25 mg/L川陈皮素各剂量组均能降低LPS诱导的RAW 264.7细胞的TLR4 和CD14 mRNA的表达水平,其中,TLR4分别降低了41%、50%和57%;CD14的表达水平降低了 51%、59%和 62%(p<0.05或p<0.01),结果见图5。
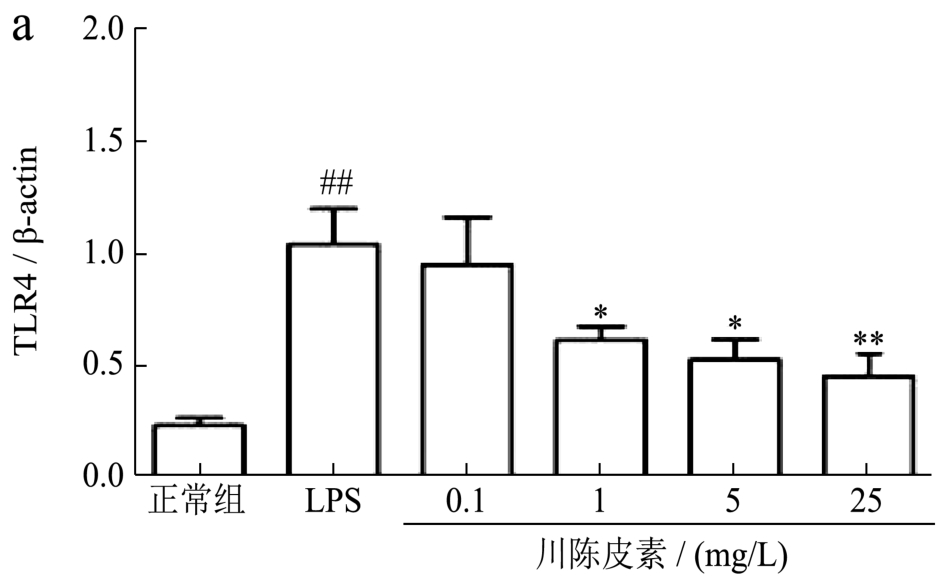
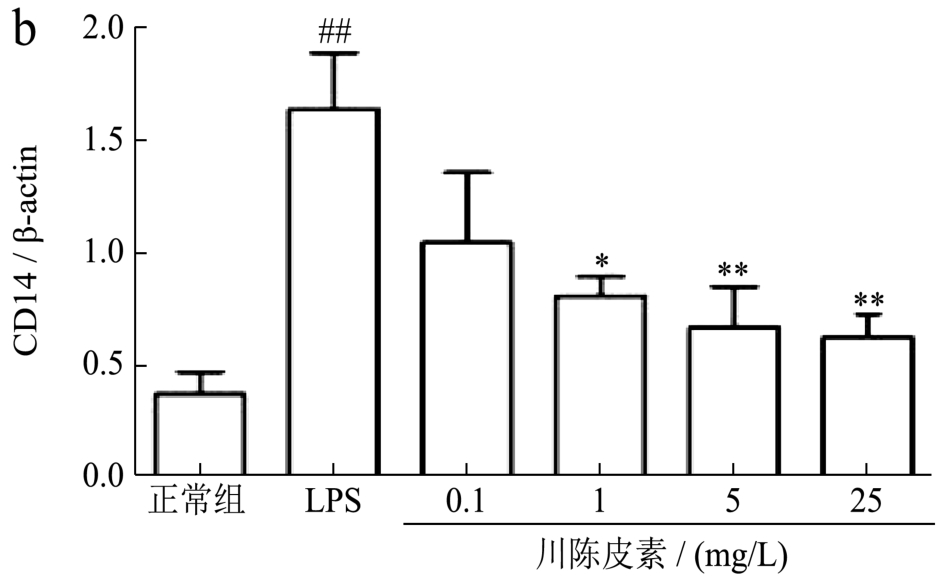
图5 川陈皮素对LPS诱导的RAW 264.7细胞TLR4和CD14的mRNA表达水平的影响
Fig.5 Effect of Nobiletin on mRNA expression of TLR4 and CD14 in RAW 264.7 cell induced by LPS
注:与正常组比较,#p<0.05,##p<0.01;与LPS刺激组比较,*p<0.05,**p<0.01;图 a:TLR4 表达水平;图 b:CD14表达水平。
2.2 讨论
LPS是革兰氏阴性菌细胞壁的主要组成成分,其毒性成分主要为类脂质A,能够引起哺乳动物细胞发生免疫反应,从而导致促炎因子的释放。通过细胞表面的先天免疫分子受体识别LPS是感染性休克的重要过程[4]。TNF-α是由巨噬细胞/单核细胞在急性炎症过程中产生的炎性细胞因子,并且调控细胞内多种信号通路,导致细胞坏死或凋亡。机体受到细菌入侵后,TNF-α在30 min之内就可以检测到,IL-1、IL-6分别在3 h、6 h可以检测到。NO参与机体的许多生理过程,同时也是一种重要的炎症介质,其过量产生可促进炎症性疾病的发生发展。研究显示,许多药物都可以通过抑制炎症相关因子的产生显示出良好的抗炎活性。如Dai等人的研究发现,竹节参的不用提取部位和竹节参皂苷均对LPS诱导的RAW 264.7细胞具有良好的抗炎效应,可明显减轻细胞上清液中IL-1β和TNF-α的产生水平,且能减少细胞中IL-1β和TNF-α的mRNA表达水平[10]。因此,如果要评价某种药物的抗炎效果,研究者们首先考虑用IL-1β和TNF-α的释放水平或表达水平来进行初步的评价。本研究中,我们采用1 mg/L的LPS刺激RAW 264.7细胞,给予不同剂量的川陈皮素预保护后,实验结果表明,川陈皮素能抑制LPS刺激导致的RAW 264.7细胞中IL-1β和TNF-α的mRNA表达水平的增强。此外,过量NO产生能够导致多种炎症状态,抑制NO的产生与抗炎作用密切相关[7]。在本研究中发现,与正常组相比,LPS能够引起RAW 264.7细胞上清液中的NO的分泌升高以及RAW 264.7细胞中iNOS表达水平的增加,给予不同剂量的川陈皮素预保护后,川陈皮素能抑制LPS刺激导致的RAW 264.7细胞上清液中NO的分泌和iNOS表达水平的升高。
TLR4作为Toll样家族的一个成员,被发现是由哺乳动物的先天免疫细胞表达的第一个模式识别受体[4]。CD14是表达于单核细胞表面上糖基磷脂酰肌醇链接的一种糖蛋白,同时作为一种可溶性蛋白质存在于血清中。CD14在LPS信号调节中的关键作用已经通过CD14-/-敲除小鼠证实,该缺陷鼠对于直接注射LPS或者注射活菌引发的感染性休克感染具有高度的抵抗性[11]。CD14首先与LPS结合,然后LPS结合蛋白将CD14与LPS的结合物转运到TLR4-MD-2复合物。LPS与TLR4结合形成复合物之后具有高亲和力,从而将信号转导到细胞内进而诱导一系列的炎症级联信号[9]。我们的研究也表明,川陈皮素能显著抑制 LPS诱导的RAW 264.7细胞中CD14和TLR4的mRNA表达水平。NF-κB属于Rel家族的二聚体蛋白,大多数二聚体包括p65和p50两种亚基。NF-κB p65,又称RelA,其C端含有转录激活域,其中富集丝氨酸、酸性氨基酸和疏水性氨基酸,能直接与各种IκB成员藕联而激活转录过程,而p50和p52无此结构。在正常生理条件下,NF-κB与IκB结合形成复合体,以无活性形式存在于胞浆中。当细胞受细胞外信号刺激后,IκB 激酶复合体(IκB kinase,IKK)活化将IκB 磷酸化,使NF-κB暴露核定位位点。游离的NF-κB迅速移位到细胞核与特异性 κB序列结合,诱导相关基因转录 [12]。研究报道,甘草酸和异脂酸可以通过抑制TLR4/MD-2复合物,进而抑制NF-κB信号途径抑制LPS诱导的炎症反应[13]。本实验中,我们的研究表明,川陈皮素能显著抑制LPS诱导的RAW 264.7细胞中NF-κB核蛋白的表达水平。以上研究结果提示,川陈皮素的抗炎效应与其调控TLR4-NF-κB信号通路,进而抑制炎性因子分泌有关。
3 结论
川陈皮素对LPS诱导的RAW 264.7细胞损伤具有良好的保护作用,其保护作用与其抗炎效应相关,深入的分子机制研究表明其抗炎作用与其调控TLR4-NF-κB信号通路,进而抑制炎性因子分泌有关。
[1]王景翔,于宏伟,胡瑞省.川陈皮素研究进展[J].安徽农业科学,2011,39(13):7731-7733 WANG Jin-xiang, YU Hong-wei, HU Rui-sheng. Research advances of nobiletin [J]. Journal of Anhui Agriculture Science, 2011, 39(13): 7731-7733
[2] Kong Y, Le Y. Toll-like receptors in inflammation of the central nervous system [J]. Int Immunopharmacol, 2011,11(10): 1407-1414
[3] Medzhitov R, Janeway, C A. Innate immunity: the virtues of a nonclonal system of recognition [J]. Cell, 1997, 91(3): 295-298
[4]Nijland R, Hofland T, Van Strijp J A. Recognition of LPS by TLR4: Potential for anti-inflammatory therapies [J]. Mar Drugs, 2014, 12(7): 4260-4673
[5]Qi G, Mi Y, Fan R, et al. Nobiletin protects against systemic inflammation-stimulated memory impairment via MAPK and NF-κB signaling pathways [J]. J Agric Food Chem, 2019,67(18)
[6]Liu F, Zhang H, Li Y, et al. Nobiletin suppresses oxidative stress and apoptosis in H9c2 cardiomyocytes following hypoxia/reoxygenation injury [J]. Eur J Pharmacol, 2019, 854:48-53
[7]Davis K, Martin E, Turko I, et al. Novel effects of nitric oxide [J]. Annu Rev Pharmacol Toxicol, 2001, 41: 203-236
[8]Hanada T, Yoshimura A. Regulation of cytokine signaling and inflammation [J]. Cytokine Growth Factor Rev, 2002,13(4-5): 413-421
[9]Jinfeng Wu, Junmin Zhou, Xianghong Chen, et al.Attenuation of LPS-induced in ammation by ICT, a derivate of icariin, via inhibition of the CD14/TLR4 signaling pathway in human monocytes [J]. International Immunopharmacology, 2012, 12(1): 74-79
[10]Dai Y W, Yuan D, Wan J Z, et al. Study on protective effect of total saponins of Panax japonicus on LPS-induced RAW 264.7 cell inflammation through NF-kappa B pathway [J].China Journal of Chinaese Materla Medica, 2014, 39(11):2076-2080
[11]Ulevitch R J, Tobias P S. Receptor-dependent mechanisms of cell stimulation by bacterial endotoxin [J]. Annu Rev Immunol, 1995, 13: 437-435
[12]Hoesel B, Schmid A. The complexity of NF-κB signaling in inflammation and cancer [J]. Molecular Cancer, 2013,12: 1-86
[13]Honda H, Nagai Y, Matsunaga T, et al. Glycyrrhizin and isoliquiritigenin suppress the LPS sensor toll-like receptor 4/MD-2 complex signaling in a different manner [J]. J Leukoc Biol, 2012, 91(6): 967-976