保宁醋是我国四大传统名醋之一,其先后荣获1915年“巴拿马太平洋万国博览会”金奖,2002年成为国家免检产品,并在2005年获“中国驰名商标”等多种荣誉,享誉国内外[1]。
保宁醋生产的主要原料是大米、麸皮,添加自然通风制成的醋曲,以生料固态发酵的方式在低温条件下酿造而成,其中自然通风制曲是整个酿造工艺的关键环节,决定酿造微生物的种类及数量,直接影响保宁醋的风味特征及感官评定。此外,由于在制曲酿造过程中,添加了白叩、砂仁、杜仲、当归、五味和薄荷等六十多种中草药,使保宁醋具有独特的中草药香味,色泽鲜亮、酸味柔和适中、醇香回甜、经久不腐,成为我国传统药醋的典型代表[2]。
食醋酿造中的产酸微生物种类繁多,除功能性醋酸菌外,大量乳酸菌不仅能发酵产生乳酸和乙酸等有机酸,还可以提供众多的挥发性物质、氨基酸等风味物质,从而有效改善食醋的风味[3]。此外,乳酸菌还可产生胞外多糖等功能性物质,具有降血脂、抗辐射和增强免疫能力等益生功能,这对于提升食醋的功能性,满足当前的消费趋势具有重要研究方向[4]。目前,在保宁醋酿造研究中,多涉及醋醅中醋酸菌产酸能力方面,关于保宁醋固态酿造醋曲中产酸产多糖乳酸菌的分离、鉴定及应用少有报道。
本研究采用可培养的方法从保宁醋醋曲中,以产酸量、产多糖含量及耐酸能力为指标筛选乳酸菌,以生理生化试验和16S rDNA分子生物学鉴定方法相结合进行菌株鉴定,并对其代谢产物进一步分析,探究其在保宁醋发酵过程中的发挥作用,对保宁醋生产和发酵工艺的改良具有指导意义。
1 材料与方法
1.1 实验材料
1.1.1 材料来源
保宁醋醋曲,四川省保宁醋有限公司提供。
1.1.2 仪器设备
SHP0201147047电子分析天平,上海恒平科学仪器有限公司;SW-CJ-IF超净工作台,苏净集团苏州安泰空气技术有限公司;LDZX-50FBS立式压力蒸汽灭菌器,上海深谙医疗器械厂;BH200微生物显微镜,宁波舜宇仪器有限公司;S-3C型pH计,成都世纪方舟科技有限公司;DY-6C电泳仪,北京市六一仪器厂;S1000PCR扩增仪,美国Bio-Rad公司;GelDoc 2000紫外凝胶成像仪,美国 Bio-Rad公司;7890A-5975B气相色谱质谱,美国Agilent公司;Agilent 1200高效液相色谱,美国Agilent公司。
1.1.3 主要试剂
葡萄糖、酵母浸粉、蛋白胨、硫酸铵、硫酸镁、琼脂粉、氯化钙、磷酸氢二钠、磷酸二氢钠、磷酸二氢钾,均为分析纯,成都市科龙化工试剂厂;DL2000 DNA Marker、rTaq酶、dNTP等PCR相关试剂,大连宝生物有限公司。
1.1.4 培养基
MRS固体培养基:葡萄糖20%,蛋白胨10%,牛肉膏8%,酵母粉4%,柠檬酸三铵2%,K2HPO4·3H2O 1.5%,乙酸钠5%,MgSO4·7H2O 0.2%,MnSO4·H2O 0.38%,吐温80 1%,琼脂15%,蒸馏水1000 mL,pH 6.2,121 ℃高压灭菌30 min。
乳酸菌分离培养基(溴甲酚紫 MRS培养基):在MRS培养基中加入160 mg/L溴甲酚紫,蒸馏水1 L、pH 6.2,121 ℃高压灭菌20 min。
1.2 实验方法
1.2.1 乳酸菌的分离
样品预处理:称取10 g醋曲样品于装有30 mL dH2O的离心管中,涡旋均匀,四层纱布过滤后备用。
富集培养及稀释涂布:取 2 mL加入已灭菌的MRS液体培养基中,28 ℃,150 r/min摇床培养24 h后,取1.0 mL菌液于盛有9 mL 0.85%生理盐水的试管中,依次用已灭菌0.85%生理盐水稀释,获得最终浓度为 10-3~10-5的稀释液,每个稀释度吸取 100 µL稀释液涂布于溴甲酚紫MRS培养基平板上,28 ℃倒置培养 2~3 d。
纯化及保藏:挑取变色圈较大的菌株,划线纯化2~3次,镜检后接种于斜面试管进行短期保藏,采用甘油保藏法进行长期保藏。
1.2.2 乳酸菌的筛选
乳酸菌的定性试验:分别挑取两环纯化后的乳酸菌接种于50 mL液体MRS培养基中,37 ℃,静置培养12 h后,以5%的接种量接入新的液体MRS培养基中,37 ℃静置培养4 d,分别取10 mL发酵液,5000 r/min离心10 min取上清液,采用纸层析法[5]进行乳酸定性试验,以未接种MRS培养基为空白对照。
乳酸菌的产酸率测定:分别挑取两环定性后乳酸菌接种于50 mL液体MRS培养基中,37 ℃静置培养12 h,以3%接种量接种于100 mL液体MRS培养基,继续静置培养4 d,取10 mL发酵液加入装有40 mL蒸馏水的三角瓶中,滴加1~2滴酚酞,摇匀后用滴定法测定产酸率,每株菌平行3次,产酸率计算见公式(1)。
式中:V为发酵液样品滴定耗用的NaOH体积,mL;V0为样品的体积,mL;CNaOH为NaOH标准溶液浓度,mol/L;0.09为总酸转换乳酸系数。
1.2.3 多糖乳酸菌的筛选
胞外多糖的提取及测定:将活化后的乳酸菌接种于MRS液体培养基中,37 ℃静置培养24 h后,取5 mL发酵液,5000 r/min离心10 min,取上清液加入2.5 mL 20%TCA(三氯乙酸)溶液,4 ℃过夜,1000 r/min离心20 min,取上清液,加入3×95%乙醇,置于4 ℃冰箱中过夜,4 ℃、1000 r/min离心20 min,取沉淀加入10 mL蒸馏水溶解后,装于透析袋中,以蒸馏水透析24 h后,换用超纯水透析24 h,其中每8 h更换蒸馏水或超纯水。透析结束后,透析液定容至25 mL,为EPS(extracellular polysaccharide)溶液[5]。采用苯酚-硫酸法[6]测定EPS溶液吸光度,操作步骤同乳酸菌的定性实验,根据葡萄糖标准曲线计算乳酸菌胞外多糖含量。
产多糖乳酸菌的耐酸性试验:将活化后较高产多糖乳酸菌以3%接种量接种于不同pH(2.5、3.0、3.5、4.0、4.5、5.0)的液体MRS培养基中,37 ℃静置培养24 h后,在波长为600 nm处测定培养液吸光度。以pH为横坐标,吸光度为纵坐标,绘制产多糖乳酸菌的耐酸性能曲线。
1.2.4 产酸菌的鉴定
产酸菌的生理生化鉴定:参考《伯杰明细菌手册》进行生理生化试验。
DNA提取:参考吉志伟等[7]文献中方法,提取DNA。
PCR扩增:采用引物27F/1492r对醋酸菌和乳酸菌的16S rDNA区进行特异性扩增,其PCR扩增体系参考文献[8]。测序结果经 BLAST同源性比对后,在Mega 6.0软件中采用Neighbor-join-in法构建系统发育树,进行同源性分析。
1.2.5 发酵液的挥发性物质分析
将初筛菌株接种于 50 mL液体 MRS培养基,30 ℃,120 r/min培养5 d,以未接种发酵培养为空白对照,准确量取7 mL发酵液于15 mL顶空瓶中恒温(65 ℃)水浴,将 50/30 μm DVB/CAR/PDMS 萃取头插入顶空瓶中平衡10 min后吸附30 min(在固相微萃取装置上实现)后,将萃取头移入气相色谱的高温汽化室中解吸5 min,进行GC-MS分析。色谱、质谱条件参照刘阳等[9]文献中条件。
1.2.6 发酵液的有机酸分析
发酵液前处理:取10 mL发酵液,5000 r/min离心20 min,准确量取5 mL上清液于100 mL容量瓶中,分别加入2 mL 10.6%亚铁氰化钾(需要避光保存)和2 mL 30%硫酸锌,摇匀后用ddH2O定容。室温下静止沉淀30 min,取澄清液5000 r/min离心20 min后,取上清液,上清液用0.22 μm微孔滤膜过滤,滤液采用HPLC进行有机酸分析[10]。
液相系统:Agilent 1200;Gemini色谱柱:C18 4.6×250 mm,5 μm;流动相:(NH4)2HPO4/甲醇=95/5,pH 2.7;进样体积:20 μL;流动速度:0.4 mL/min;柱温:20 ℃;检测器:UV 210 nm。
有机酸的定性、定量分析:以保留时间和样品加标定性,将不同浓度的有机酸标准溶液在同样的色谱条件下进样,以有机酸浓度为横坐标(mg/mL),有机酸峰面积(mV)为纵坐标,绘制标准曲线,采用峰面积外标法定量,得到不同有机酸的线性范围、回归方程及相关系数。有机酸计算公式见公式2:
式中:C为醋醅中有机酸含量,g/100 g干醅;C样为由有机酸标准曲线所得有机酸浓度,mg/mL;N为样品稀释倍数;W为醋醅质量,g;M为醋醅水分含量,%。
1.2.7 数据统计分析
实验数据处理由GC-MS数据分析软件系统完成,未知化合物经计算机检索同时与NSIT、RTLPEST两个谱库相匹配,仅当匹配度大于800(最大值为 1000)的鉴定结果才予以报道。利用IBM SPSS Statistics 19.0软件数据分析,Origin 8.5软件用于作图分析。
2 结果与分析
2.1 产多糖乳酸菌的筛选
2.1.1 乳酸菌定性试验
从保宁醋醋曲中得到疑似乳酸菌菌株共12株,分别编号为L1~L12,采用层析法检测12株菌株是否产生乳酸,结果如表1所示,乳酸标准样品的Rf值为0.82,其他菌株的Rf值均在0.82左右,可确定12株菌株均能产生乳酸。
表1 乳酸菌的纸层析试验
Table 1 Paper chromatography of lactic acid bacteria
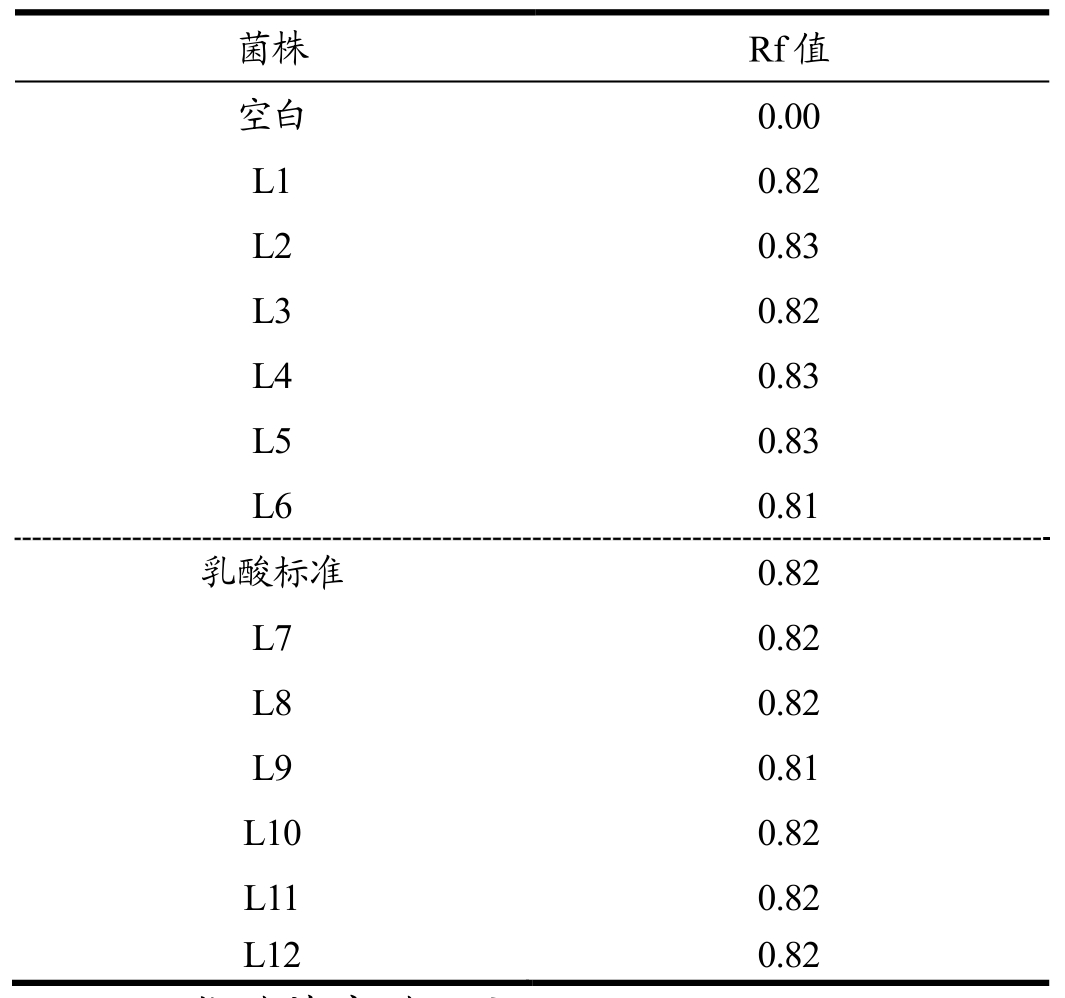
菌株空白L 1 L 2 L 3 L 4 L 5 L 6乳酸标准L 7 L 8 L 9 L 1 0 L 1 1 L 1 2 R f值0.0 0 0.8 2 0.8 3 0.8 2 0.8 3 0.8 3 0.8 1 0.8 2 0.8 2 0.8 2 0.8 1 0.8 2 0.8 2 0.8 2
2.1.2 乳酸菌产酸测定
乳酸菌的产酸率是衡量乳酸菌性能的一个重要的指标,通过酸碱滴定法测定乳酸的含量,其结果如图1所示。
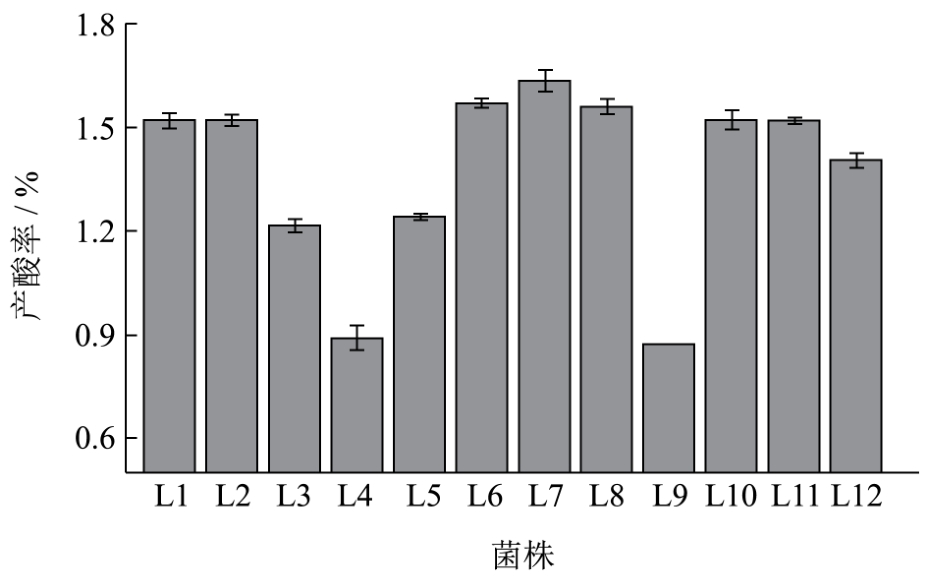
图1 乳酸菌的产酸率
Fig.1 Acid-producing rate of lactic acid bacteria strains
图1中,菌株L3、L4、L5、L9的产酸率较低,均低于 1.30%,菌株 L12产酸率稍低于 1.50%,为1.417%,其余菌株产酸率均稍高于 1.50%,菌株 L7的产酸率最高,达到1.62%。目前,研究中的乳酸菌的产酸率均较低,大多低于 1.50%,故而选择产酸率在1.50%左右的菌株L1、L2、L6、L7、L8、L10、L11和L12进行后期试验。
2.1.3 产多糖乳酸菌的筛选
乳酸菌胞外多糖的测定:经过对乳酸菌胞外多糖的提取,并采用苯酚-硫酸法测定吸光度,依据葡萄糖标准曲线,计算8株乳酸菌发酵液的多糖含量,其结果如图2所示。
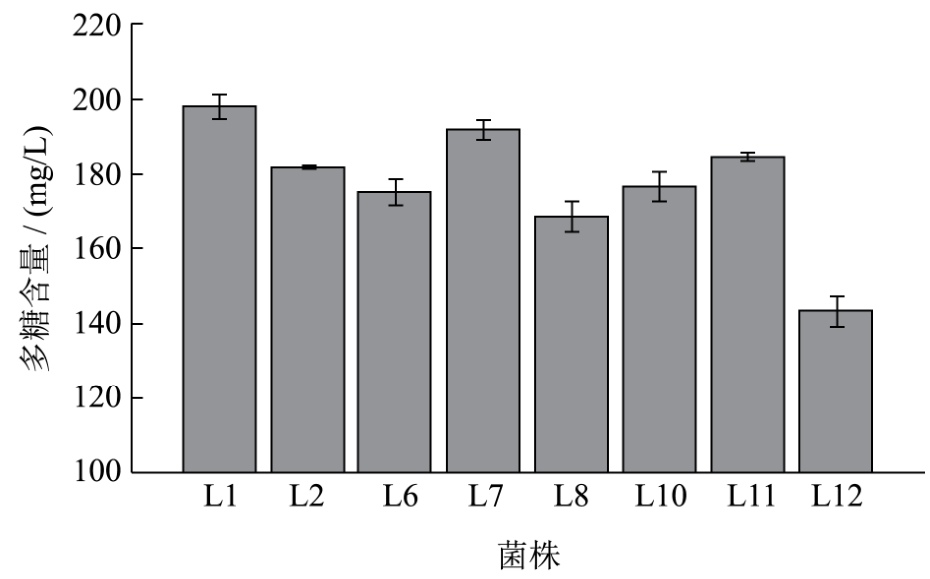
图2 乳酸菌发酵液多糖含量
Fig.2 Polysaccharide contents of fermentation broth of lactic acid bacteria
图2中,除菌株L12外,不同菌株的产多糖含量有所差异,菌株 L12产多糖含量最低,仅为 143.27 mg/L,菌株L1产多糖含量最高,其次为L7、L11、L2,分别达到198.05 mg/L、191.98 mg/L、184.80 mg/L和182.07 mg/L,均高于本实验室在泡菜中筛选得到一株产量为108.00 mg/L的乳酸菌。此外,唐血梅等[10]人从新疆酸马奶中得到一株多糖含量为 121.60 mg/L的乳酸菌,而菌株L1、L7、L11和L2的多糖含量均高于121.60 mg/L,表明四株乳酸菌的胞外多糖含量较高,并且四株乳酸菌发酵液中多糖含量并无明显差异,故而选用该四株乳酸菌进行后期耐酸性能试验。
2.1.4 产多糖乳酸菌的耐酸性试验
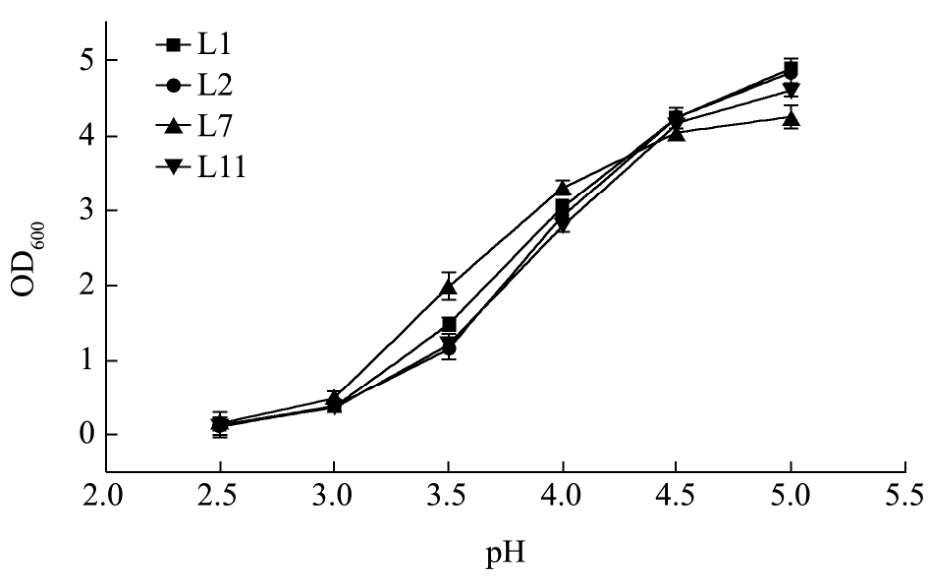
图3 产多糖乳酸菌的耐酸能力
Fig.3 Acid-resistant ability of polysaccharide-producing lactic acid bacteria
将活化后的菌株接种于不同pH的液体MRS培养基中培养,培养结束后,在波长600 nm下测定发酵液的吸光度。其变化情况如图3所示。
图3中,四株乳酸菌随pH增加,其发酵液的吸光度逐渐增加,在pH为2.5时,四株乳酸菌均能生长,但其发酵液吸光度均在 0.1~0.2范围内,表明其生长受到明显的抑制。
在pH在3.0~5.0的范围时,菌株L1、L2发酵液的吸光度随pH变化而明显变化,并未出现较为平缓的趋势,菌株L11在pH为3.0~4.5范围内,发酵液吸光度变化强烈,在pH 4.5后,变化开始有所平缓。菌株L7在pH为3.0~4.0范围内,发酵液吸光度变化最为明显,但在pH 4.0后,发酵液吸光度开始趋于平缓,变化程度均小于其他三株乳酸菌。综合考虑乳酸菌的产酸量、产多糖量以及耐酸能力,选用乳酸菌 L7进行后期的生物强化试验。
2.2 生理生化鉴定及16S rDNA分子鉴定
2.2.1 L7的生理生化鉴定

图4 乳酸菌的菌落形态和个体形态
Fig.4 Colony morphology and individual morphology of the isolated lactic acid bacteria
将菌株L7接种于醋酸菌分离培养基和MRS培养基上,观察其菌落形态,通过革兰氏染色观察其个体形态,对其进行部分生理生化试验。其菌落形态及个体形态结果如图4所示,生理生化试验结果如表2所示。L7菌落较小为圆形,乳白色或乳黄色,边缘整齐,湿润光滑,有光泽,革兰氏染色为阳性菌,为短杆状,多为单生,参考《伯杰细菌手册》可初步判定乳酸菌L7为发酵乳杆菌属。
表2 乳酸菌的生理生化鉴定
Table 2 Physiological and biochemical identification of lactic acid bacteria
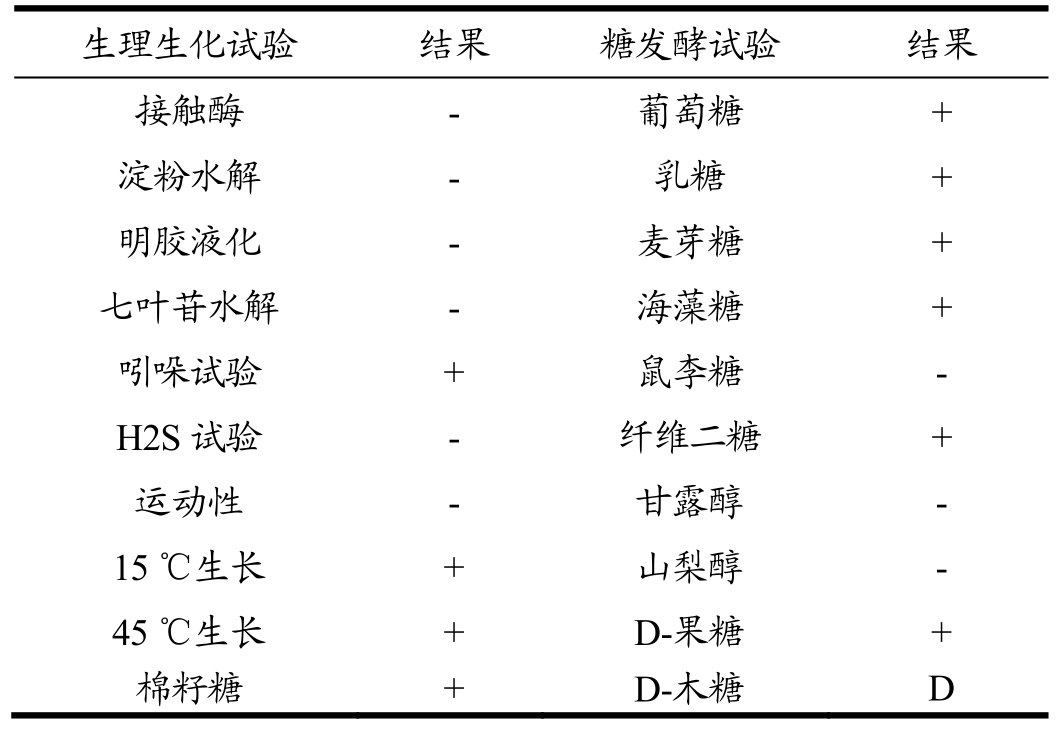
注:“+”代表阳性;“-”代表阴性;“D”代表可变。
生理生化试验 结果 糖发酵试验 结果接触酶 - 葡萄糖 +淀粉水解 - 乳糖 +明胶液化 - 麦芽糖 +七叶苷水解 - 海藻糖 +吲哚试验 + 鼠李糖 -H2S试验 - 纤维二糖 +运动性 - 甘露醇 -15 ℃生长 + 山梨醇 -45 ℃生长 + D-果糖 +棉籽糖 + D-木糖 D
2.2.2 L7的16S rDNA分子鉴定
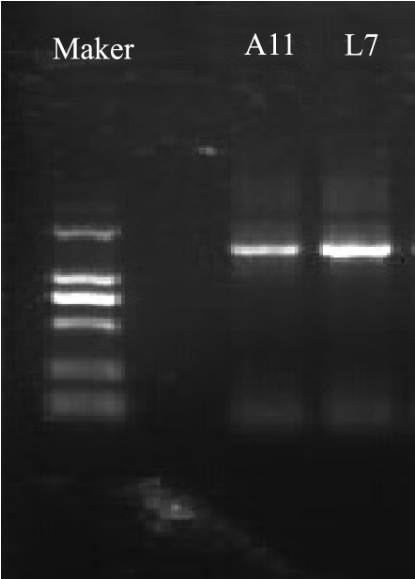
图5 PCR扩增电泳图
Fig.5 PCR amplification electrophoresis of the strian L7 DNA
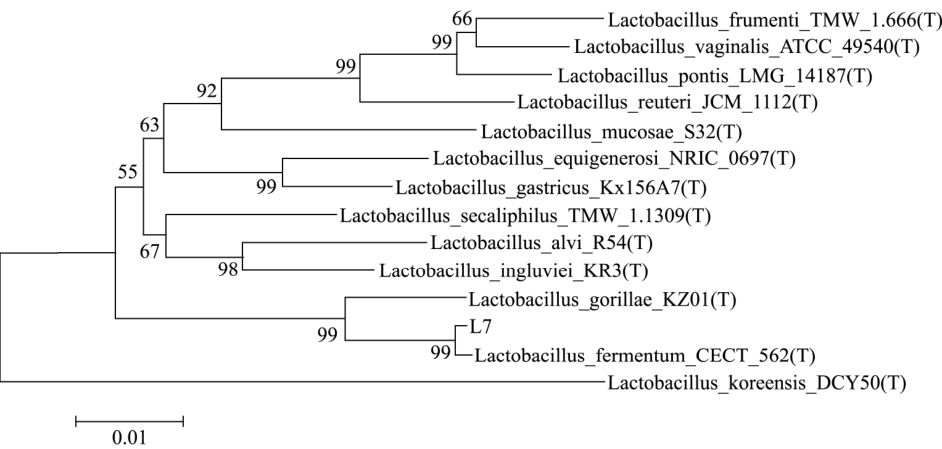
图6 L7系统发育树示意图
Fig.6 Phylogenetic tree of the strain L7
以乳酸菌L7的DNA为模板,27F/1492r为引物,进行PCR扩增,其扩增产物以1%的琼脂糖电泳检测,其扩增结果如图5所示。送往上海杰李生物有限公司测序,BLAST基因比对后,MEGA 6.0软件构建系统进化发育树,结果如图 6所示,发酵乳酸杆菌(Lactobacillus_femertum_CECT_562)与菌株L7在同一分支上,同源性为99%,故可认为菌株L7发酵乳酸杆菌(Lactobacillusfemertum)。
2.3 代谢产物分析
2.3.1 乳酸菌L7发酵液中挥发性物质分析
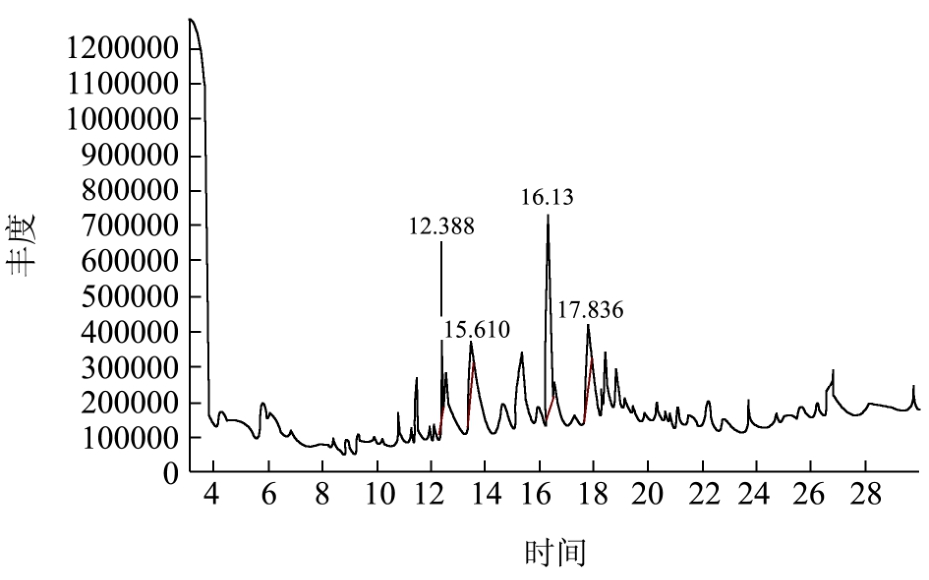
图7 空白发酵液总离子流图
Fig.7 Ion-flow graph of THE blank fermentation broth
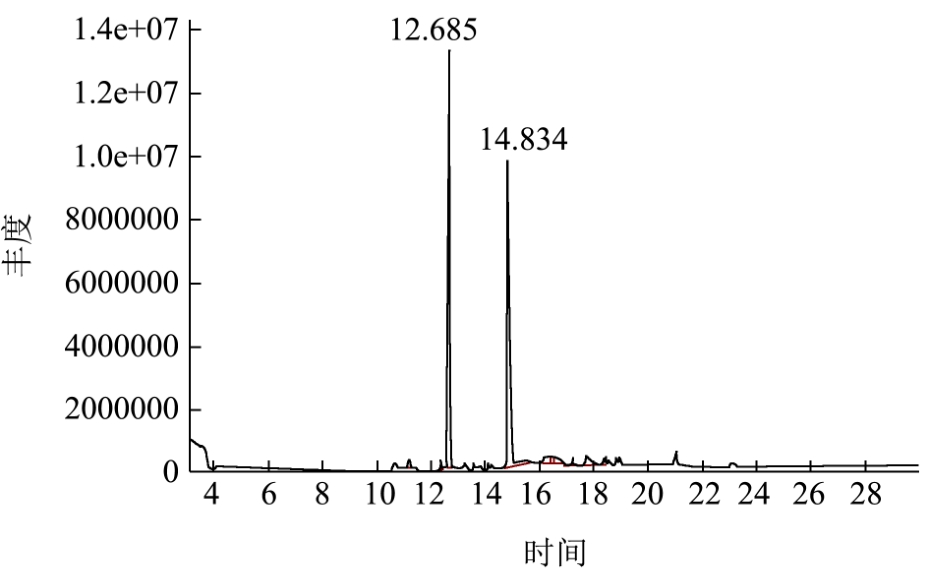
图8 乳酸菌L7发酵液的总离子流图
Fig.8 Ion-flow graph of fermentation broth ofthe strain L7
采用 HS-SPME-GC-MS法检测乳酸菌发酵液中的挥发性成分种类及相对含量,其结果如图7、图8、表3所示。
表3中,空白发酵液和L7发酵液中分别检出挥发性物质4种和11种,其中空白发酵液中主要是吡嗪和醛类物质,在L7发酵液中并未检出2,5-二甲基吡嗪和苯甲醛,并且其他两种物质均显著减少,表明该四种挥发性物质可能被L7所利用。菌株L7可产生9种新的代谢产物,其中醇类物质4种、酯类1种、酸类1种、酮类1种及其他物质2种,主要的挥发性物质为乙酸和 3-羟基-2-丁酮,相对含量分别达到 45.76%和36.22%,L7也可生成较多的乙酸,不仅可增加成品醋的酸度,提高出酸率,而且乙酸与乙醇等醇类物质酯化生成各种酯类物质从来增加其风味成分。目前,有研究发现芽孢杆菌可产生3-羟基-2-丁酮[11]、川芎嗪[12]等物质,关于乳酸菌生成 3-羟基-2-丁酮的研究较少,而乳酸菌L7可产生大量3-羟基-2-丁酮,这将为川芎嗪的生成提供前提物质,而川芎嗪是食醋中重要的功能性物质,具有扩张血管、改善组织微循环,提高组织血流灌注、调节脂质代谢、抗脂质过氧化、调节免疫等作用[13,14],该物质有利于提升食醋中的功能性,改善食醋的功能。
表3 产多糖乳酸菌L7发酵液中挥发性成分
Table 3 Volatile components of the fermentation broth of lactic acid bacteria L7
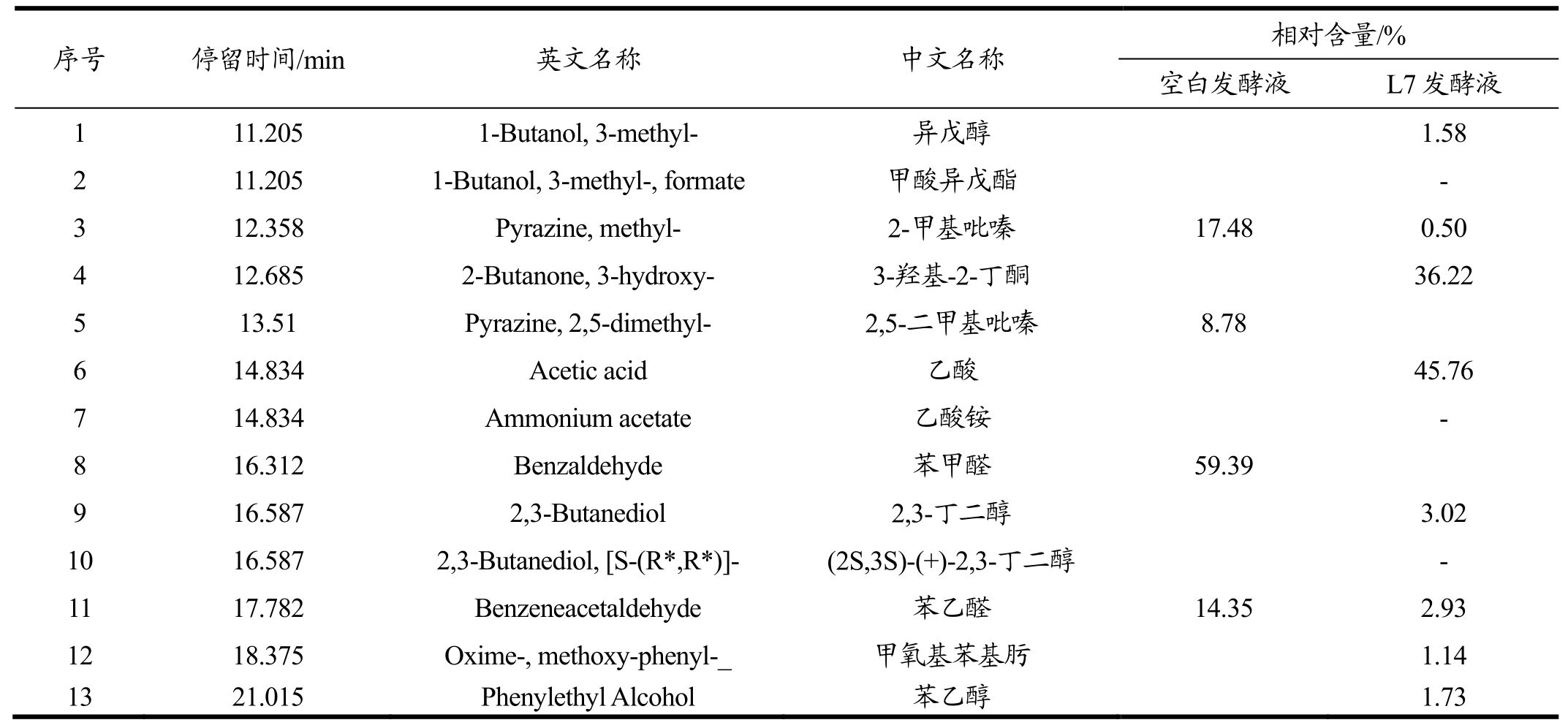
注:“-”表示可检测,但无具体相对含量。
序号 停留时间/m i n 英文名称 中文名称1 1 1.2 0 5 1-B u t a n o l, 3-m e t h y l- 异戊醇2 1 1.2 0 5 1-B u t a n o l, 3-m e t h y l-, f o r m a t e 甲酸异戊酯3 1 2.3 5 8 P y r a z i n e, m e t h y l- 2-甲基吡嗪4 1 2.6 8 5 2-B u t a n o n e, 3-h y d r o x y- 3-羟基-2-丁酮5 1 3.5 1 P y r a z i n e, 2,5-d i m e t h y l- 2,5-二甲基吡嗪6 1 4.8 3 4 A c e t i c a c i d 乙酸7 1 4.8 3 4 A m m o n i u m a c e t a t e 乙酸铵8 1 6.3 1 2 B e n z a l d e h y d e 苯甲醛9 1 6.5 8 7 2,3-B u t a n e d i o l 2,3-丁二醇1 0 1 6.5 8 7 2,3-B u t a n e d i o l, [S-(R*,R*)]- (2 S,3 S)-(+)-2,3-丁二醇1 1 1 7.7 8 2 B e n z e n e a c e t a l d e h y d e 苯乙醛1 2 1 8.3 7 5 O x i m e-, m e t h o x y-p h e n y l-_ 甲氧基苯基肟1 3 2 1.0 1 5 P h e n y l e t h y l A l c o h o l 苯乙醇 相对含量/%空白发酵液 L 7发酵液 1.5 8 -1 7.4 8 0.5 0 3 6.2 2 8.7 8 4 5.7 6 -5 9.3 9 3.0 2 -1 4.3 5 2.9 3 1.1 4 1.7 3
2.3.2 发酵液中有机酸分析
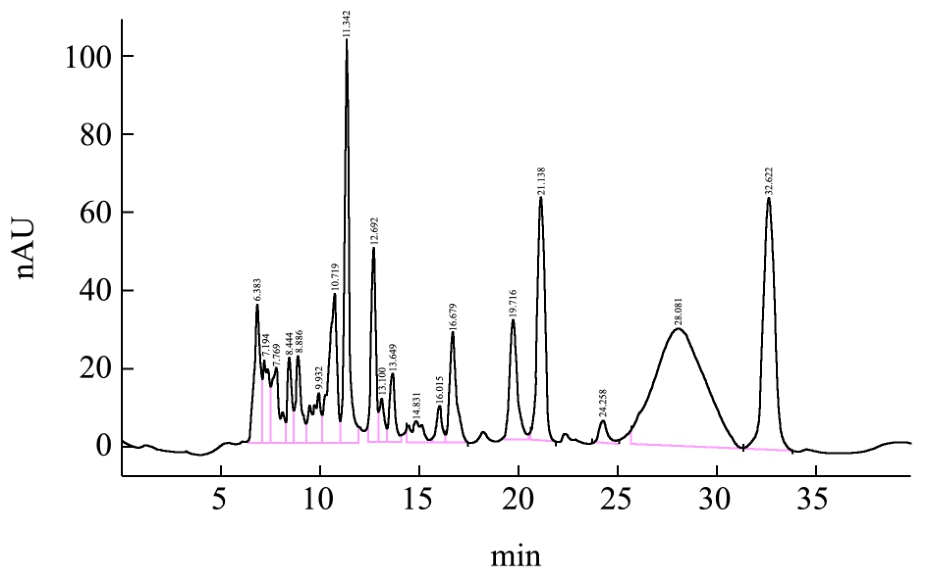
图9 乳酸菌L7发酵液中有机酸色谱图
Fig.9 Organic acid chromatogram of fermentation broth of Lactic acid bacteria L7
表4 发酵液中有机酸检测
Table 4 Detection of organic acid in the fermentation broth
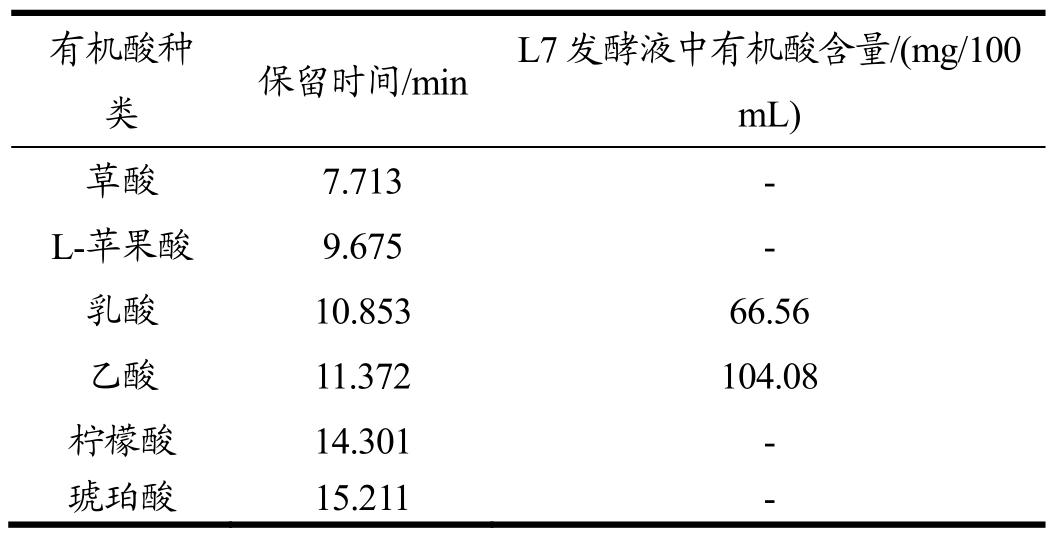
注:“-”表示未检测到。
有机酸种类 保留时间/m i n L 7发酵液中有机酸含量/(m g/1 0 0 m L)草酸 7.7 1 3 -L-苹果酸 9.6 7 5 -乳酸 1 0.8 5 3 6 6.5 6乙酸 1 1.3 7 2 1 0 4.0 8柠檬酸 1 4.3 0 1 -琥珀酸 1 5.2 1 1 -
乳酸菌L7发酵液中有机酸的分析:采用高效液相色谱法检测乳酸菌发酵液中的有机酸的种类及相对含量,其结果如图9、表4所示。
表4中,乳酸菌L7发酵液中均只检测到两种有机酸,分别为乳酸、乙酸,其保留时间:分别为10.853 min、11.372 min。乳酸含量达到66.56 mg/100 mL,乙酸高达104.08 mg/100 mL。
3 结论
从保宁醋醋曲中筛选得到 12株乳酸菌,通过定性、产酸率、耐酸能力试验,多糖含量测定,得到一株产多糖量为191.98 mg/L,产酸率为1.62%的乳酸菌,分别通过生理生化试验及16S rDNA鉴定为发酵乳酸杆菌(Lactobacillus_femertum)。采用固相微萃取-气质联用法和高效液相色谱法分析醋酸菌 L7发酵液中的风味物质和有机酸含量,共检测到11种挥发性物质,主要为3-羟基-2-丁酮和乙酸,相对含量分别为36.22%和45.76%,有机酸共检测到乳酸和乙酸,产量分别为66.56 mg/100 mL和104.08 mg/100 mL,这将有利于提高食醋酸度以及川芎嗪含量。乳酸菌在食醋发酵过程中发挥重要作用,而此次所得乳酸杆菌产酸能力突出,且可高产多糖,其对保宁醋工业生产和发酵工艺的改良具有指导意义。
参考文献
[1]刘军.保宁醋酿造的工艺特性[J].江苏调味副食品,2003,20(6):11-18 LIU Jun. The craft characteristic of the Baoning vinegar make by fermentation [J]. Jiangsu Condiment and Subsidiary Food, 2003, 20(6):11-18
[2]晨焰.四川保宁醋[J].上海调味品,1999,4:8-9 CHEN Yan. Sichuan Baoning vinegar [J]. Shanghai Seasoning, 1999, 4:8-9
[3]张锦盛,刘军,朱文优,等.固态发酵酿醋中复合麸曲的应用研究[J].中国酿造,2013,32(1):124-126 ZHANG Jin-sheng, LIU Jun, ZHU Wen-you, et al.Application of compound bran-kojis in vinegar production with solid-state fermentation [J]. China Brewing, 2013, 32(1):124-126
[4]刘军,朱文优,杨勇.保宁醋固态发酵理化指标的动态分析[J].中国酿造,2006,5:45-47 LIU Jun, ZHU Wen-you, YANG Yong. Dynamic analysis of physio chemical index of Baoning vinegar with solid-state fermentation [J]. China Brewing, 2006, 5:45-47
[5]刘先,康小红,孙军德.高产胞外多糖乳酸菌的筛选与初步鉴定[J].农产品加工(学刊),2010,3:38-40 LIU Xian, KANG Xiao-hong, SUN Jun-de. Screening and identification of lactic acid bacteria with high EPS-producing capacity [J]. Nongchanpin Jiagong(Xuekan), 2010, 3:38-40
[6]刘晓涵,陈永刚,林励,等.蒽酮硫酸法与苯酚硫酸法测定枸杞子中多糖含量的比较[J].食品科技,2009,34(9):270-272 LIU Xiao-han, CHEN Yong-gang, LIN Li, et al. Comparison of methods in determination of polysaccharide in Lycium Barbarum L. [J]. Food Science and Technology, 2009, 34(9):270-272
[7]吉志伟,刘阳,邓静,等.自然发酵甜面酱中一株芽孢杆菌的分离鉴定及益生特性初探[J].中国调味品,2015,40(12):26-30 JI Zhi-wei, LIU Yang, DENG Jing, et al. Isolation and identification of a bacillus strain from the spontaneous fermented sweet sauce and preliminary study on probiotic properties [J]. China Condiment, 2015, 40(12):26-30
[8]Sekiguchi H, Watanabe M, Nakahara T, et al. Succession of bacterial community structure along the Changjiang river determined by denaturing gradient gel electrophoresis and clone library analysis [J]. Appl. Environ. Microbiol., 2002, 68(10):5142-5150
[9]刘阳,邓静,吴华昌,等.柑橘果皮中生香酵母的筛选及挥发性香气成分分析[J].食品安全质量检测学报,2014,5(12):4050-4055 LIU Yang, DENG Jing, WU Hua-chang, et al. Screening of yeast in citrus peels and their volatile aromatic components analysis [J]. Food Safety and Quality Detection Technology,2014, 5(12):4050-4055
[10]唐血梅,李海英,赵芳,等.新疆酸马奶中高产胞外多糖乳酸菌筛选鉴定及培养条件优化研究[J].新疆农业科学,2012,49(8):1540-1545 TANG Xue-mei, LI Hai-ying, ZHAO Fang, et al. Study on screening and identification of a lactic acid bacterium with high EPS producing capacity and optimization of culture conditions in koumiss in Xinjiang [J]. Xinjiang Agricultural Sciences, 2012, 49(8):1540-1545
[11]Xiao Z, Ma C, Xu P, et al. Acetoin catabolism and acetylbutanediol formation by Bacillus pumilus in a chemically defined medium [J]. PloS one, 2009, 4(5):e5627[12]Nicholson W L. The Bacillus subtilis ydjL (bdhA) gene encodes acetoin reductase/2,3-butanediol dehydrogenase [J].Appl. Environ. Microbiol., 2008, 74(22):6832-6838
[13]杨雪梅.川芎嗪药理作用研究进展[J].中国生化药物杂志,2010,31(3):215-217 YANG Xue-mei. Research progress of pharmacological action of ligustrazine [J]. Chinese Journal of Biochemical Pharmaceutics, 2010, 31(3):215-217
[14]黄文东,杨永飞,陈建文,等.丹参素与川芎嗪对心血管系统的协同作用[J].中国药理学通报,2013,29(3):432-436 HUANG Wen-dong, YANG Yong-fei, CHEN Jian-wen, et al.Synergistic effects of danshensu and ligustrazine on cardiovascular system [J]. Chinese Pharmacological Bulletin,2013, 29(3):432-436