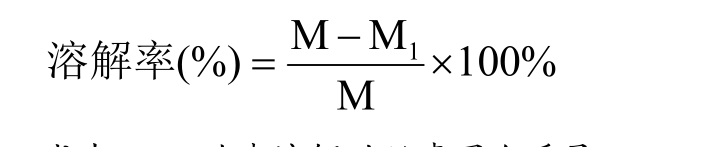丝素蛋白在氯化钙-乙醇-水体系中的溶解行为及其结构的变化
陈佳弘,江虹锐,余炼,王成华,赵谋明,刘小玲
(广西大学轻工与食品工程学院,广西南宁 530004)
摘要:为制备可溶性丝素蛋白应用于食品,本文探讨了不溶性丝素蛋白向可溶性再生丝素蛋白转化的条件并分析丝素蛋白结构变化对其溶解性的影响。以丝素蛋白的溶解时间和再生丝素蛋白的氮溶解指数为指标分析了溶解体系、温度、盐浓度和乙醇浓度对丝素蛋白溶解的影响。研究表明,利用氯化钙-乙醇-水体系可将不溶性丝素蛋白溶解,当氯化钙在30%的乙醇溶液中浓度达到4mol/L时,95℃保温9min,丝素蛋白完全溶解,所得再生丝素蛋白氮溶解指数达到91%。利用低场核磁共振仪、圆二色谱仪、X-射线衍射仪和扫描电镜观测丝素在混合溶液中的结构变化,结果显示,在三元体系中,丝素与水结合逐渐增强,丝素纤维膨大,随后逐渐断裂为片层状,结晶结构破坏,再生丝素从β-折叠转变为无规则卷曲,导致溶解性改善。
关键词:丝素蛋白;溶解;氮溶解指数;结构
Abstract:Conditions for the transformation of insoluble silk fibroin into soluble regenerated silk fibroin and the effect of structural changes in silk fibroin on its solubility were examined to enable preparation of soluble silk fibroin for use in food products. The effects of solvent system, temperature, salt concentration, and ethanol concentration on the dissolution of silk fibroin, as assessed by dissolution time and the nitrogen solubility index of the regenerated silk fibroin, were analyzed. The results showed that insoluble silk fibroin could be dissolved in calcium chloride-ethanol-water systems; soaking of silk fibroin in a solution of 4mol/L calcium chloride and 30% (V/V) ethanol and heating at 95℃for 9min led to complete dissolution, and the nitrogen solubility index of the regenerated silk fibroin reached 91%. Structural changes in silk fibroin upon dissolution were also examined using low-field nuclearmagnetic resonance (NMR) spectroscopy, circular dichroism spectroscopy, X-ray diffractometry, and scanning electronmicroscopy. In the calcium chloride-ethanol-water system, interactions between silk fibroin and water gradually increased in strength, the silk fibroin fibers swelled and gradually broke into a lamellar shape, and the crystal structure of the silk fibroin was destroyed. In solution, the structure of the regenerated silk fibroin changed from a β-sheet structure to a random coil structure, resulting in an improvement in solubility.
Key words:silk fibroin; dissolution; nitrogen solubility index; structure
蚕丝由丝素蛋白(silk fibroin,SF)和丝胶蛋白构成,其中丝素蛋白约占蚕丝的75~83%[1]。丝素蛋白与人体组织生物相容性高,药物渗透强,以及良好的机械性能和降解性[2],因此被广泛应用于生物医学、医疗材料、日化产品、组织工程[3]和药物输送系统[4]。此 外,丝素蛋白还可以应用于食品领域,研究表明它对降低血液胆固醇含量、降血脂、降血糖和促进酒精代谢具有积极作用[5~7];同时,可溶性再生丝素蛋白还具有乳化、起泡和凝胶等功能特性,可以改善食品加工特性,日本早已研发出一系列添加再生丝素蛋白的饮料、果酒和糕点,国内也有研究者利用再生丝素蛋白良好的乳化性和凝胶性改善酸奶的保水性和黏度[8,9]。
天然丝素蛋白具有反向平行的β-折叠结构,在分子间和分子内氢键以及范德华力的作用下结构稳定,不溶于水[10]。如何使纤维状不溶性的丝素蛋白转变为可溶性的再生丝素蛋白(regenerated silk fibroin,RSF),是扩展丝素用途的关键点。研究者多采用无机盐体系溶解丝素蛋白,如李玲玲[11]等人为制备再生丝素蛋白药物缓释载体,利用氯化钙-甲醇-水、氯化钙-乙醇-水、硝酸钙-甲醇-水以及硝酸钙-乙醇-水在60~70℃溶解丝素蛋白,溶解时间需要 1~2h。吴惠英等人[12]将丝素蛋白置于氯化钙-甲酸体系中溶解2 h,然后利用再生丝素蛋白溶解进行静电纺丝。以上研究者制备的再生丝素蛋白多应用于材料学领域,所制备的再生丝素蛋白结构较为完整,但溶解性能较差,且对丝素的溶解条件没有进行深入研究。
本文的目的在于制备一种溶解性更好的再生丝素蛋白应用于食品领域。基于这一目的,在溶解过程中以丝素蛋白的完全溶解时间和再生丝素蛋白的溶解性(NSI)为指标,研究溶解体系组成,溶解剂各组分浓度和溶解温度对丝素溶解的影响,同时探讨不溶性丝素在氯化钙、乙醇及水的混合体系中的溶解行为,并用低场核磁共振仪、圆二色谱仪和X-射线衍射仪等分析此过程中丝素蛋白的结构变化,以此阐明丝素溶解行为的本质。
1 材料与方法
1.1 材料与设备
1.1.1 材料与试剂
蚕茧,浙江桐乡道朴丝绸有限公司;碳酸钠、无水乙醇均为分析纯,天津市北辰方正试剂厂;8000 u透析袋,美国联合碳化公司。
1.1.2 仪器与设备
101-1型电热鼓风干燥箱,北京科伟永兴仪器有限公司;SHJ-A数显恒温磁力搅拌水箱,杭州聚同电子有限公司;DC-1500喷雾干燥机,上海达程实验设备有限公司;JDG0.2真空冷冻干燥机,兰州科近真空冻干技术有限公司;5418R离心机,德国EPPENDORF公司;SKD800自动凯氏定氮仪,上海沛欧分析仪器有限公司;Micro MR20-025V-1低场核磁共振成像分析仪,上海纽迈电子科技有限公司;MOS-450圆二色谱仪,法国CBIO-LOGIC公司;F16502扫描电镜,荷兰PHENOM公司;SMARTLAB3KW X-射线分析仪,株式会社理学公司。
1.2 实验方法
1.2.1 可溶性再生丝素蛋白粉的制备
参考周凤娟等[13]的方法并稍作修改,称取50 g蚕丝加入5000mL,5g/L的碳酸钠溶液中,在100℃加热40min去除溶于热碱溶液的丝胶蛋白,将获取的丝素蛋白用去离子洗净、烘干至恒重备用。将8 g丝素蛋白置于 120mL混合溶解剂中加热溶解,溶液于6000 r/min 离心 30min 后,使用8000 u 透析袋透析 3 d脱盐,每4 h更换一次去离子水。脱盐后的将丝素蛋白溶液在进风温度 150~160℃,出风温度 70~80℃下喷雾干燥即可获得可溶性再生丝素蛋白粉末。
1.2.2 丝素蛋白溶解条件研究
为获得具有良好溶解性的再生丝素蛋白,探究了溶解体系的选择、溶解体系的构成及溶解温度等条件因素,并以完全溶解时间T(min)和氮溶解指数NSI(%)加以评价。其中,溶解剂从表1中的盐的水溶液或盐的乙醇溶液中筛选。
表1 溶解体系的构成
Table 1 Composition of solvent systems used for silk fibroin dissolution
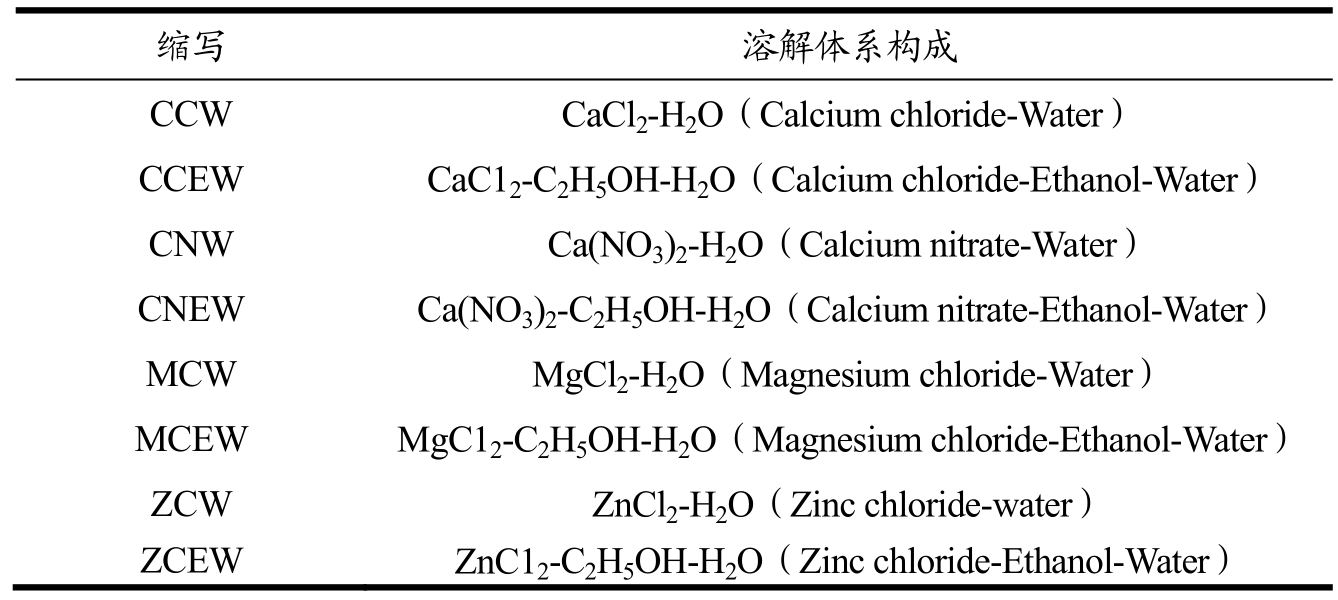
缩写 溶解体系构成 CCW CaCl2-H2O(Calcium chloride-Water) CCEW CaC12-C2H5OH-H2O(Calcium chloride-Ethanol-Water) CNW Ca(NO3)2-H2O(Calcium nitrate-Water) CNEW Ca(NO3)2-C2H5OH-H2O(Calcium nitrate-Ethanol-Water) MCW MgCl2-H2O(Magnesium chloride-Water) MCEW MgC12-C2H5OH-H2O(Magnesium chloride-Ethanol-Water) ZCW ZnCl2-H2O(Zinc chloride-water) ZCEW ZnC12-C2H5OH-H2O(Zinc chloride-Ethanol-Water)
1.2.3 丝素蛋白溶解过程结构变化的研究
在给定的混合溶液及温度条件下,每隔一定时间,测定置于溶液的丝素蛋白溶解率,并取出未溶解的丝素蛋白,吸取表面水分后用低场核磁共振测定样品的横向弛豫时间;溶于溶液的丝素蛋白用圆二色谱测定其椭圆吸光度。将上述未溶丝素蛋白进行冻干,将已溶解的再生丝素蛋白进行喷雾干燥,用X-射线衍射仪测定其衍射峰及用电子显微镜观察其表面形貌。
1.2.4 丝素蛋白溶解时间的测定
如何使纤维状不溶性的丝素蛋白转变为可溶性的再生丝素蛋白将丝素蛋白置于盐溶液中,直至其丝状物完全消失,所耗时间为溶解时间T(min)。
1.2.5 再生丝素蛋白氮溶解指数的分析方法
参考杨峰[14]的方法并稍作修改,准确称取1 g(精确至0.0001 g)可溶性丝素蛋白粉末样品于50mL烧杯中,量取40mL去离子水,于室温下搅拌120min,然后定容至50mL,静置几分钟,取上层液1500 r/min离心10min,然后取离心后的上清液10mL。用凯氏定氮法分别测定上清液和可溶性丝素蛋白粉末中的氮含量,通过下式计算样品的氮溶解指数(NSI):
式中:N1为上清液的氮质量(mg);N为称样蛋白粉中的氮质量(mg)。
1.2.6 丝素蛋白溶解率表示
将丝素置于溶解体系中加热溶解一段时间,取出未溶解的丝素用去离子水洗净,于100℃烘干。
式中:M1为未溶解的丝素蛋白质量(mg);M为溶解前丝素蛋白质量(mg)。
1.2.7 丝素蛋白的低场核磁共振横向弛豫时间(T2)测定
参考赵婷婷等[15]的方法并稍作修改,溶液中未溶解的丝素蛋白利用Micro MR20-025V-1低场核磁共振成像分析仪测定溶解过程中丝素的横向弛豫时间,测定选用Q-CPMG序列,其参数值为:SW=200,NS=4,SF=18.38 MHZ ,TW=2000ms,NECH=4500,RFD=0.02ms,TE=0.385ms。参数设置完后,开始采样,每个测试重复3次。
1.2.8 再生丝素蛋白溶液的圆二色谱测定
取不同溶解时间下(不同溶解率时)的丝素蛋白溶液,蛋白质浓度标定为 5.3×10-2g/mL,利用MOS-450圆二色谱仪测定样品的圆二色谱。参考[16]。远紫外圆二色谱扫描范围为190~250nm,将蛋白质溶液稀释 10倍后测定;近紫外圆二色谱扫描范围为250~350nm,将蛋白质溶液稀释2倍后测定。石英样品池光程为1.0mm,测量参数:带宽1.0nm;扫描速率100nm/min;响应时间0.5 s;分辨率0.2nm;扫描次数6次。
1.2.9 丝素蛋白和再生丝素蛋白微观形貌观察
利用 F16502扫描电镜观察丝素蛋白和再生丝素蛋白在盐溶过程中的微观形态变化,测试条件10 kV,未溶解的丝素蛋白放大倍数1100倍,再生丝素蛋白放大倍数为2000倍,对样品进行喷金后观察。
1.2.10 丝素蛋白和再生丝素蛋白的 X-射线衍射图
参考Lu[17]的方法。用SMARTLAB3KW X-射线衍射仪对溶解率对脱胶蚕丝和再生丝素蛋白粉末进行X 射线扫描,记录 2θ=10°~50°间的衍射强度曲线。测试条件:铜靶 Cu Kα(λ=0.15406nm)、管电压 40 kV、管电流40mA、扫描速度为4°/min。利用 JADE6.0对图谱进行分析,确定衍射峰和晶面间距。
1.2.11 数据处理
应用SPSS 17.0统计软件对实验数据进行单因素方差分析(One-way-ANOVA)作总体差异显著性分析,组间采用S-N-K法比较,以p<0.05为差异显著,所有测定至少重复3次。
2 结果与讨论
2.1 溶解体系的构成对丝素溶解时间的影响
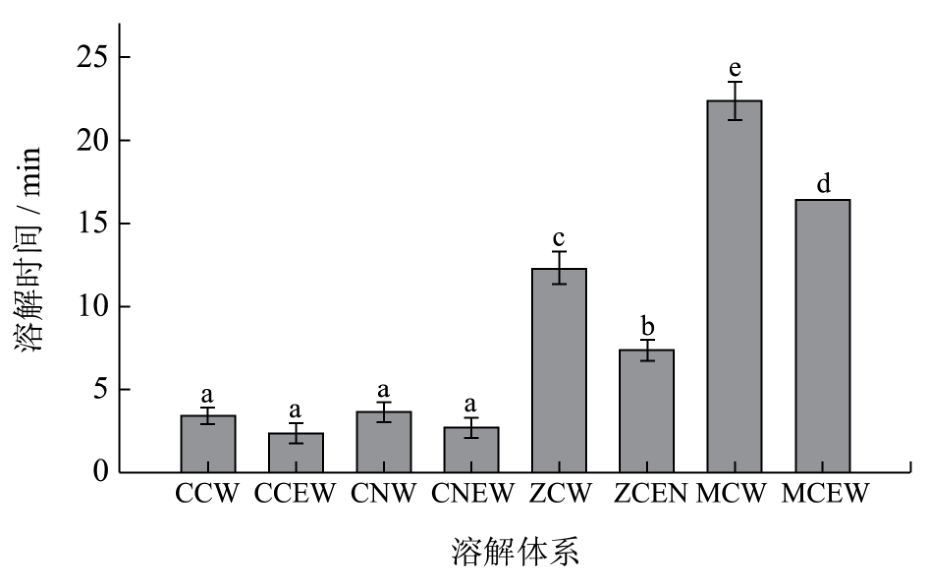
图1显示不溶丝素在不同混合溶液体系中溶解的快慢。由图 1可知,在盐的水溶液体系中,氯化钙(CCW)和硝酸钙(CNW)的溶解时间显著低于氯化镁(ZCW)和硝酸镁(MCW),耗时不足5min,溶液中的不溶性丝纤维全部溶解。比较阳离子的差异可见,在相同的阴离子条件(Cl-)下,溶解速率快慢的顺序为钙(CCW)、锌(ZCW)、镁(MCW),三者溶解时间呈明显递增趋势。在相同阳离子(Ca2+)的条件下,氯离子(CCW)要略优于硝酸根离子(CNW)。可见,盐的离子构成对丝素的促溶作用效果不同,由于比较的盐的数量有限,无法寻找其变化规律。
在盐的乙醇溶液体系中,溶解时间与盐的组成之间的变化规律一致。水溶液中加入乙醇,使之占溶液体积比的40%后发现,各种盐溶液,乙醇加入后都促进了不溶丝纤维的溶解,降低其全部溶解所需时间,但对氯化钙和硝酸钙的影响不显著,对氯化锌和对氯化镁的影响极显著,从原来的12min和22min分别减小到 7min和 16min。刘明[18]利用 CaC12-H2O、CaC12-C2H5OH-H2O、LiBr-H2O和LiBr-C2H5OH-H2O等体系溶解丝素发现,LiBr溶液溶解丝素的能力强于CaC12溶液,同时两种盐溶液加入乙醇后其溶解丝素的能力都增大,但未对溶解时间及再生丝素的溶解性能进行考察。实验的结果与其基本一致,但考虑到生产成本等因素,未对溴化锂进行考察。
2.2 溶解体系的构成对再生丝素蛋白溶解性的影响
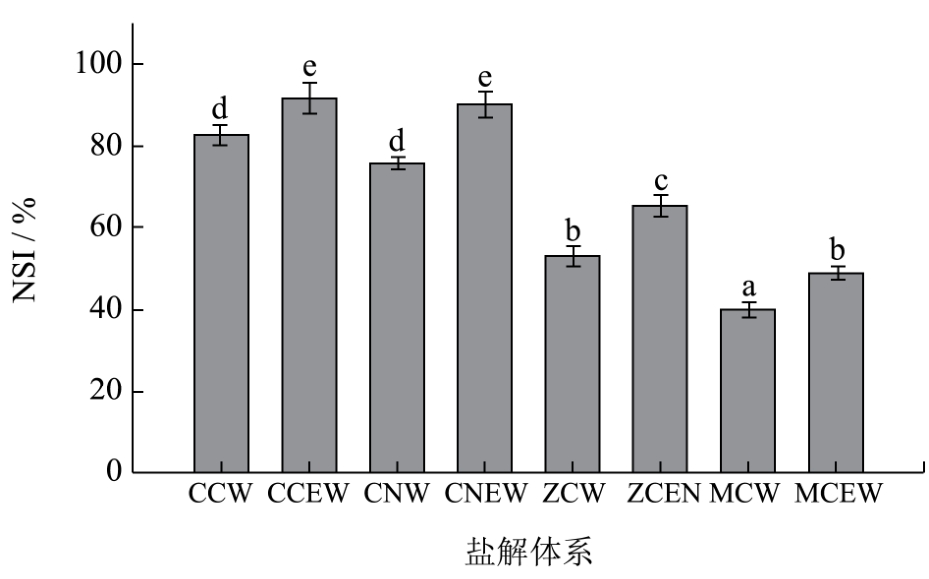
图2反映了不同混合溶液处理所得的再生丝素蛋白,在重新复水溶解的过程中的溶解性,以氮溶指数表征。由图2可见,几种盐溶体系所得的可溶性再生丝素蛋白粉,它们的溶解性有较大差异,氯化钙(CCW)和硝酸钙(CNW)所得的样品氮溶解指数较高,在80%左右,且两者无显著差异,氯化镁(ZCW)和硝酸镁(MCW)显著低于前两者,氯化镁最低,仅达到40%。
加入乙醇后,不仅使得不溶丝纤维溶解速度提高,且其溶解产物的溶解度都比水溶液组显著提高照(**EW 与**W 有显著差异,p>0.05)。其中氯化钙-乙醇-水三元体系(CCEW)制备的可溶性丝素蛋白NSI值最高,为92%,比其对照组氯化钙-水(CCW)的83%显著增大。苏峰[19]利用氯化钙水溶液在100℃溶解丝素蛋白后,185℃喷雾干燥获得的可溶性丝素蛋白粉末的NSI值为80%,明显低于本研究中化钙-乙醇-水体系(CCEW)的NSI值。
综上所述,从溶解时间短,NSI值较大的四个体系CCW、CCEW、CNW和CNEW中进一步考察乙醇体积比、盐浓度及溶解温度等的影响。
2.3 加热温度对丝素蛋白溶解时间的影响
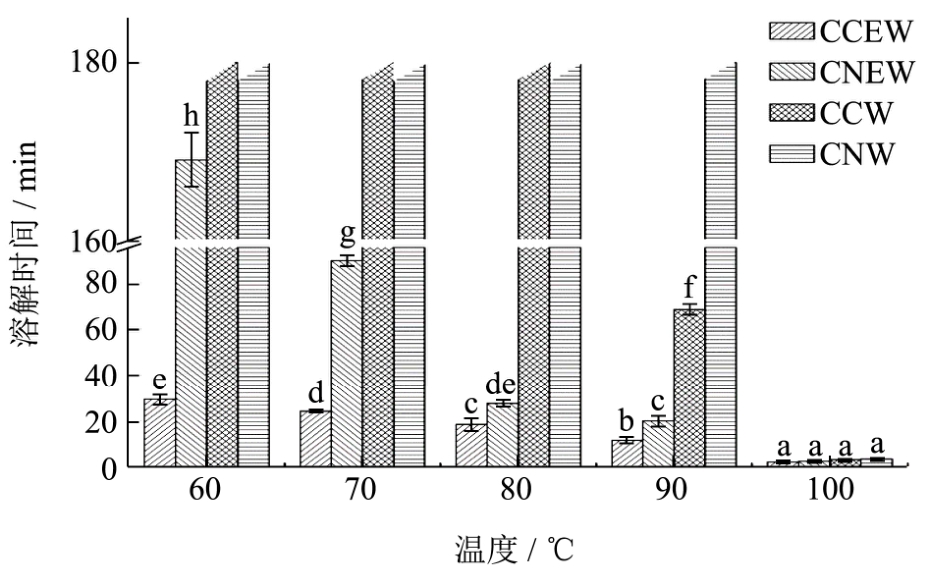
由图3可知,在同一温度下(除100℃),脱胶蚕丝在氯化钙-乙醇-水混合体系(CCEW)中的溶解时间显著低于其他体系中的溶解时间,60℃时 CCEW中的溶解时间29min,显著低于在CNEW中的溶解时间 169min,因此氯化钙盐溶液对脱胶蚕丝的溶解能力强于硝酸钙等其它盐类。相同温度和相同金属盐离子体系下,加入乙醇后溶解时间显著减小,如在60℃时,CCW和CCEW相比,脱胶蚕丝在CCW中180min仍无法完全溶解,而在CCEW中的溶解时间仅为29min。因此加入一定量乙醇有利于脱胶蚕丝溶解。
此外,同一体系中,随着温度升高,溶解时间都显著性减小,如CCEW三元体系中,当温度由60℃升高到100℃,溶解时间从30min降低至2min。严国良[20]等人使用离子液体 1-烯丙基-3-甲基咪唑氯化物([AMIM]Cl)和 1-丁基-3-甲基咪唑氯化物([BMIM]Cl)溶解丝素蛋白(0.5%),发现在80℃时丝素蛋白无法完全溶解,90℃时在[BMIM]Cl和[AMIM]Cl溶解时间分别为100min和95min。这两种离子液体的溶解时间远远大于氯化钙的乙醇水溶液(CCEW)。
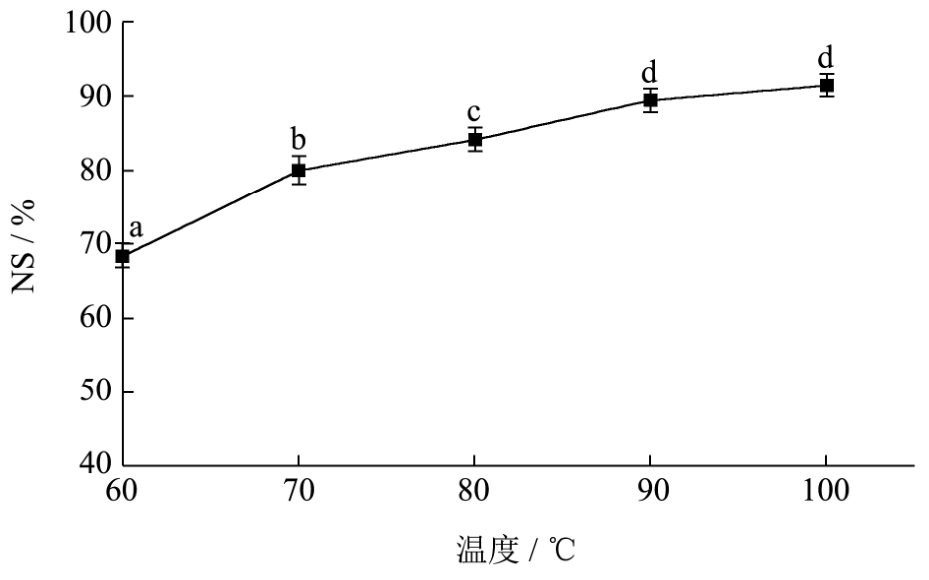
2.4 加热温度对再生丝素蛋白溶解性的影响
图4显示不同加热温度下所得的再生丝素蛋白的氮溶解指数。由图4可知,在氯化钙乙醇水体系中,随着盐溶温度升高,可溶性丝素蛋白的NSI值不断增大,温度分别为90℃和100℃时,NSI值分别为88.3%和 92.3%,两者之间无显著性差异。综上所述,丝素在氯化钙-乙醇-水三元体系中溶解时间最短,同时该体系温度在 90~100℃下获取的可溶性丝素蛋白的NSI值最高,溶解性较好。综上可见,不溶性丝素以CCEW(氯化钙-乙醇-水)体系为溶解剂,并在90~100℃下保温,其溶解的速率和溶解能力均较好。
2.5 氯化钙浓度对丝素蛋白溶解时间及再生丝素蛋白溶解性的影响
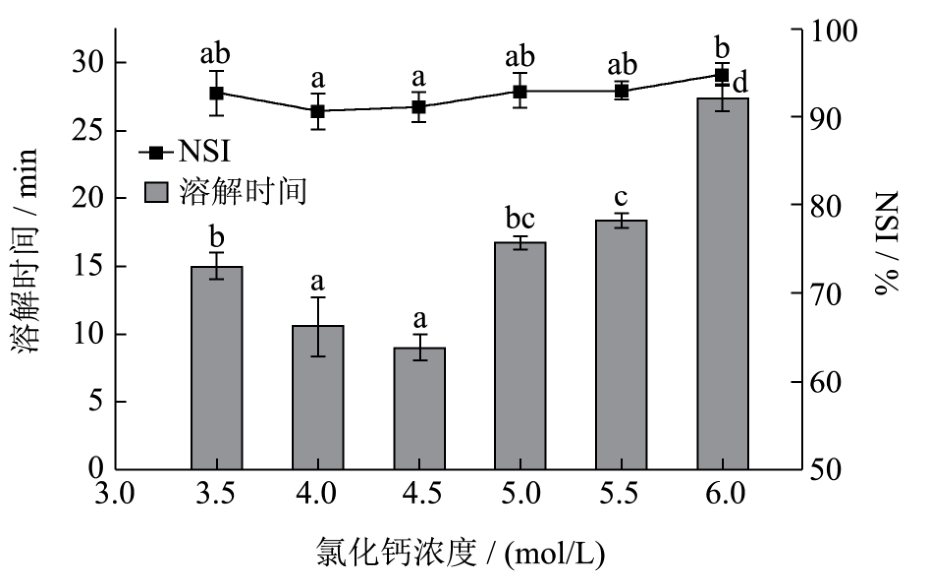
由图5可知,盐浓度在4.5mol/L时,丝素的溶解时间最短仅为 9min;而偏离此浓度,均使得其溶解时间延长。氯化钙浓度为4.0mol/L时,溶解时间为11min,与4.5mol/L时无显著性差异。氯化钙浓度为6mol/L时,氮溶解指数最高为94%,并与浓度为4.0mol/L的最低值(91%)有显著差异,除此之外,各组丝素蛋白的NSI值之间无显著性差异。综合而言,氯化钙浓度为4.0~4.5mol/L时兼顾溶解时间和氮溶解指数达到较佳水平,若考虑到再生丝素蛋白后续脱盐,还可考虑降低氯化钙浓度到3.5mol/L,此时溶解时间也仅为 15min。
2.6 乙醇浓度对丝素蛋白溶解时间及再生丝素蛋白溶解性的影响
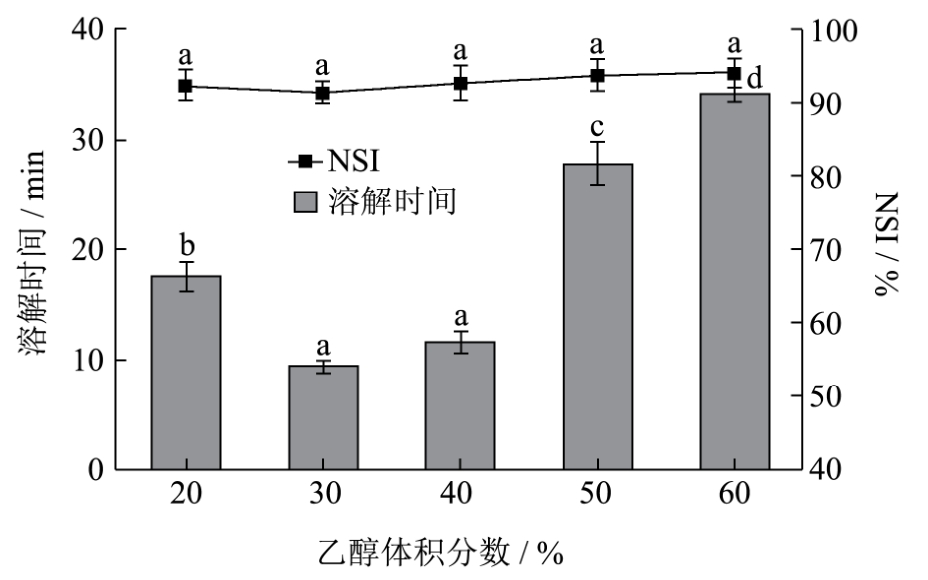
由图6可见,体系中乙醇浓度对丝素溶解性的影响与氯化钙浓度的相似。乙醇体积分数为30%时,溶解时间为9min,乙醇体积分数为40%时,溶解时间为11min,二者无显著差异。乙醇在溶液中的体积比由 20%提高到 60%时,所得可溶性丝素蛋白的 NSI值之间无显著性差异。综合考虑,选择溶解剂中乙醇体积占比为30~40%。
综合相关影响因素的作用,选择丝素的溶解条件为,以氯化钙-乙醇-水体系为溶解剂,其中乙醇水溶液的乙醇体积比为30%,氯化钙浓度为4.0mol/L,并在95℃下加热溶解。在此条件下,需要完全溶解丝素蛋白,仅需9min,所得再生丝素蛋白粉的NSI为91%。李玲玲[11]利用摩尔比为 1:2:8的四种无机盐体系(氯化钙-甲醇-水、氯化钙-乙醇-水、硝酸钙-甲醇-水和硝酸钙-乙醇-水)溶解丝素,溶解体系氯化钙的浓度约为4.5mol/L,乙醇的浓度约为45%,需要60~70℃加热1~2h才能完全溶解。本实验和已有的研究相比,降低了氯化钙和乙醇的浓度,后续脱盐效率更高;关于盐溶温度,研究发现在60~70℃加热1~2h溶解获取的再生丝素蛋白的NSI值低于80%,本实验在90℃制备的再生丝素蛋白的溶解性明显优于已有研究。
2.7 丝素蛋白在溶解过程中与水结合状态的变化
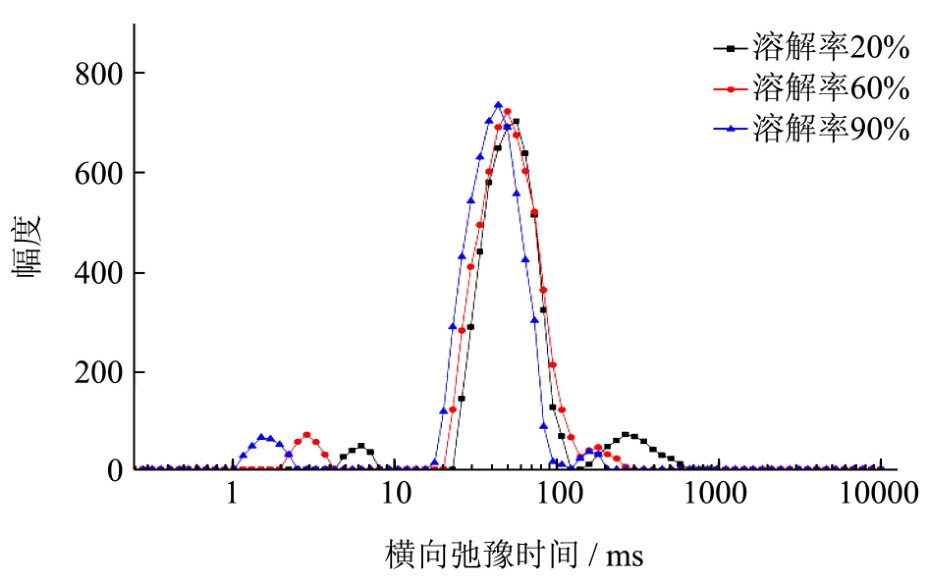
在丝素未完全溶解的不同时间点取出未溶解的丝素,其在低场核磁中的弛豫时间变化如图7所示。低场核磁共振得到的T2分布图谱主要显示有三个峰,T21(1~10ms)代表结合水、T22(10~100ms)代表不易流动水、T23(100~1000ms)代表自由水;横向弛豫时间T2可以间接表明水分的自由度,T2越大表明水分越自由,各组分弛豫时间和积分面积所占的比例的不同,可以反映出食品中存在着不同状态的水[21~23]。
由图7可见,T22积分面积比最大。随着加热时间推进、溶解的持续进行,丝素蛋白溶解率增大,表征未溶解的丝素中不易流动水的T22(10~100ms)峰,随着脱胶蚕丝的溶解率增大而峰位左移,同时峰幅度增大,说明溶剂中的水分与丝素结合,导致不可流动水的比例提高。
由表 2可知,丝素蛋白的溶解率由 20%增加到90%,峰面积比P21和P22分别由5.7%和75.2%显著增加到8.7%和88.1%,说明随着时间延长及溶解的持续进行,一部分纤维表面的自由水进入到丝纤维的内部,并与丝纤维蛋白发生水合,导致该部分水的流动性下降。李伟妮等[24]利用低场核磁共振研究山羊肉在冷藏过程中的变化,发现峰面积P22减小,P23随贮藏时间逐渐增大,说明不易流动水在冷藏过程发生了水分迁移导致其含量降低,即不易流动水向自由水转化,从而使自由水含量增加。综上所述,丝素蛋白的溶解与肉的冷藏失水相反,丝素蛋白在盐溶液中膨胀,水分进入丝素蛋白纤维内部,水与蛋白质的结合,促使丝纤维吸水膨胀的发生。
表2 丝素蛋白在溶解过程中的横向弛豫时间及峰面积比
Table 2 Transverse relaxation time and peak area ratio of silk fibroin in the process of dissolution
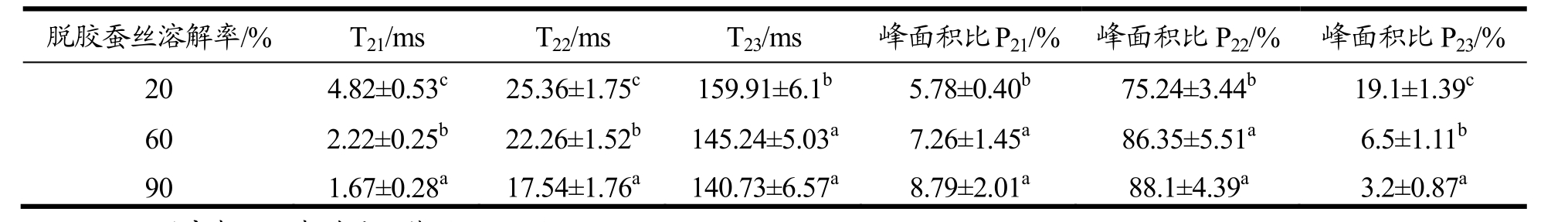
注:同一列肩表不同者差异显著(p<0.05)。
脱胶蚕丝溶解率/% T21/ms T22/ms T23/ms 峰面积比P21/% 峰面积比P22/% 峰面积比P23/%20 4.82±0.53c 25.36±1.75c 159.91±6.1b 5.78±0.40b 75.24±3.44b 19.1±1.39c60 2.22±0.25b 22.26±1.52b 145.24±5.03a 7.26±1.45a 86.35±5.51a 6.5±1.11b90 1.67±0.28a 17.54±1.76a 140.73±6.57a 8.79±2.01a 88.1±4.39a 3.2±0.87a
2.8 再生丝素蛋白溶液的圆二色谱图
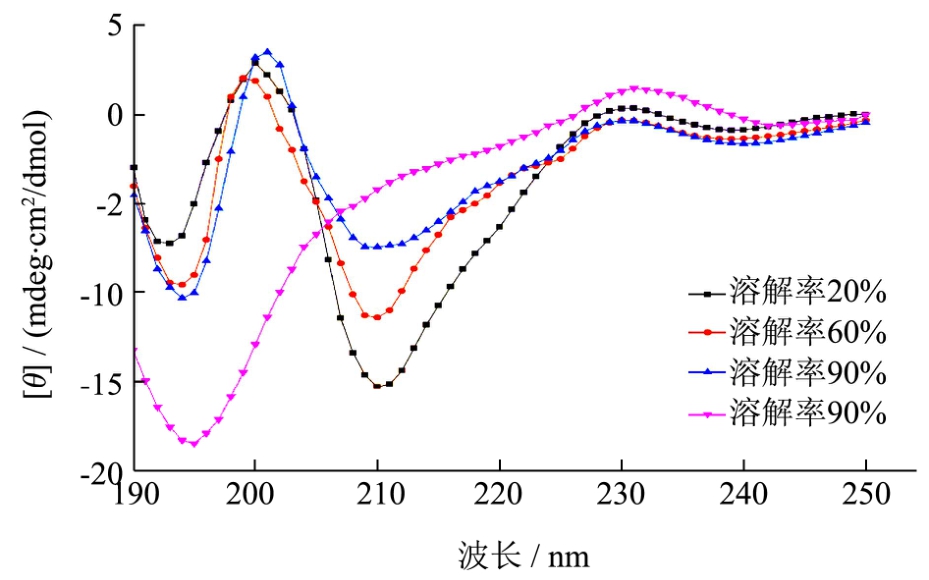
蛋白质的CD光谱分为远紫外区和近紫外区,远紫外区为185~245nm,远紫外区是肽键的吸收峰,因此该区域反映了蛋白质主链的构象,可以反映二级结构的含量和变化;近紫外为区240~320nm,该区域主要由侧链生色团所贡献,如色氨酸残基和酪氨酸残基等的吸收,可以提供一些三级结构,包括芳香性残基侧链环境及二硫键的信息[16,25]。一般认为在蚕丝蛋白的圆二色性光谱图中,无规卷曲结构在波长 192~196nm附近有强的负吸收峰,β-折叠结构在210~215nm附近出现负峰[13]。
由图8可知,当脱胶蚕丝溶解率为20%时,再生丝素蛋白溶液在波长209nm处出现特征负峰,在波长194nm处出现微小负峰,则此时溶液的丝素蛋白的二级结构以β折叠为主,含少量无规则卷曲结构;脱胶蚕丝溶解率从20%增加到90%这一过程中,表征β折叠结构的负峰不断减小,表征无规则卷曲结构的负峰不断增大,说明在盐溶过程中,丝素蛋白二级结构由β折叠变为无规则卷曲。溶解率100%时,溶液中的丝素蛋白的二级结构基本变为无规则卷曲,β折叠结构特征负峰消失。周凤娟[13]和倪莉[25]等人对可溶性丝素蛋白的研究发现,其圆二色谱图都在 195nm处出现特征负峰,可溶性丝素蛋白的二级结构主要为无规则卷曲。
近紫外CD谱中275nm处很强的科顿效应主要是源于Tyr残基的振动变化,280nm处是由Trp引起的[26]。由图9可知随着脱胶蚕丝溶解率的增大,可溶性丝素蛋白溶液的圆二色谱图显示280nm处负峰峰高增加,随着溶解的进行,说明丝素蛋白的色氨酸不断暴露于溶液中,使丝素蛋白分子失去有序度,转向无规则的分子量链。杨宇红[16]等人研究再生丝素蛋白溶液在不同pH值的近紫外圆二色谱发现,pH 4~5时,280nm处的Tyr特征负峰达到极值,此时Tyr残基的圆二色性最强。
2.9 丝素蛋白和再生丝素蛋白的 X-射线衍射图
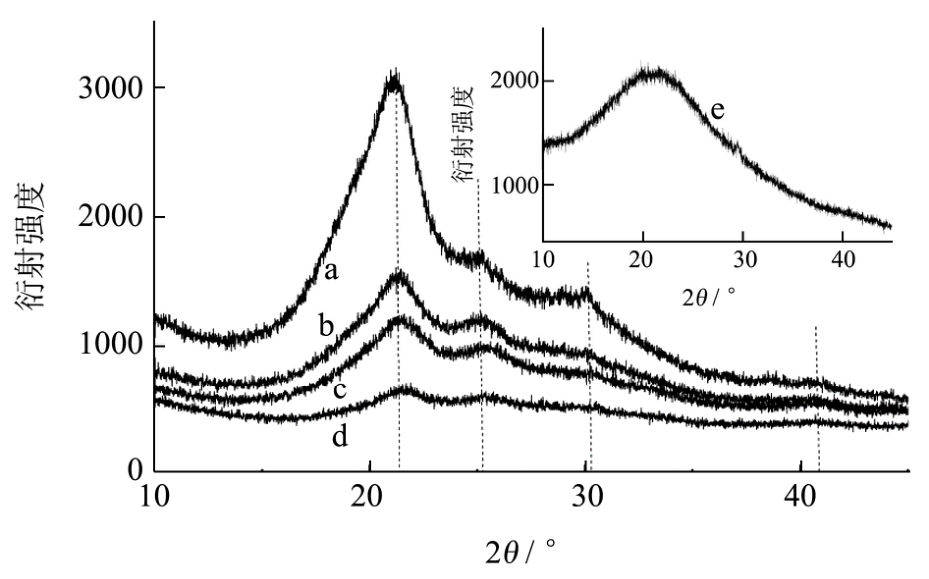
在有文献报道,丝素蛋白晶型结构主要包括Silk Ⅰ(α-螺旋和 β-转角)结构和 Silk Ⅱ(β-折叠)结构,silk Ⅰ和 silk Ⅱ的晶面间距 d(nm)分别为:0.98(Ⅱ)、0.74(Ⅰ)、0.56(Ⅰ)、0.48(Ⅱ)、0.44(Ⅰ)、0.43(Ⅱ)、0.41(Ⅰ)和 0.36(Ⅰ)[17,27]。Silk Ⅱ结构的特征衍射峰出现在18.9°、20.7°、24.9°和 40.97°处[28]。
由图10可知,丝素蛋白的特征衍射峰角度2θ分别为 20.8°、25.0°、30.9°和 41.0°,其晶面间距 d(nm)分别为:0.43(Ⅱ)、0.36(Ⅰ)、0.28(Ⅰ)和 0.22(Ⅱ)。可知丝素蛋白以Silk Ⅱ(β-折叠)结构为主,还包含Silk Ⅰ(α-螺旋和β-转角)结构。图11表明,在丝素蛋白溶解过程中,位于20.8°和41.0°的衍射峰随着溶解率增加,其衍射强度明显减弱,当溶解率升高到90%时,41.0°的衍射峰基本消失;同样的,25.0°和 30.9°处的衍射峰强度随着溶解率增加而减弱,当溶解率为90%时,位于30.9°的衍射峰基本消失。
由图10中的插图可知,丝素蛋白完全溶解后获取的再生丝素蛋白粉末,其X-射线衍射图谱无明显的特征峰,说明其呈现无定型的状态。这和其他可溶性丝素蛋白的研究类似,表现为从10.5°到25°的广泛角度范围(波长为0.1371nm)存在一个高峰,显示了非晶体状态[17]。
综上所述,在丝素溶解过程中,其晶体结构被破坏,二级结构分解,形成可溶于水的再生丝素蛋白,此时其呈现无规则无定型的状态。
2.10 丝素溶解过程中微观形貌变化
由图11可以观察到,丝素蛋白最初为光滑连续的带状结构,宽度约为10 μm;当溶解率为20%,少部分蚕丝发生断裂;溶解率为60%时,大部分蚕丝断裂,且蚕丝发生膨胀;当溶解率为90%时,可以明显观察到原来带状的丝素分解为片状,宽度增加为20 μm。溶液中的再生丝素蛋白干燥后最终呈现不规则的颗粒状(见图11),直径约为5 μm。董文秀[29]等人利用氯化钙溶液溶解丝素蛋白,发现在溶解过程中丝素纤维逐步变成松散的带状结构,最终转化为片层状结构,这和本实验的研究结果类似。
3 结论
本文探究不溶性丝素蛋白向可溶性再生丝素蛋白转变的条件及其溶解过程中的结构变化,结果表明,将不溶性丝素蛋白加入一定浓度的盐的水溶液或盐的乙醇水溶液加热,当达到一定温度时,不溶性丝素可溶解到溶液中。经比较和优选,当不溶性丝素置于氯化钙-乙醇-水体系(其中乙醇体积分数 30%,氯化钙浓度为4mol/L)中,在95℃加热,仅需9min丝素可全部溶解。经透析脱盐干燥,得到的再生丝素蛋白粉末的氮溶解指数NSI达到91%。与其他的溶解剂相比,该体系的溶解效率高,所得的再生丝素蛋白粉溶解性好。
以氯化钙-乙醇-水体系加热溶解丝素的过程中,丝素蛋白首先从溶剂中吸收水,水分被丝素蛋白所束缚,导致丝素体积膨胀。其次丝素发生断裂成为片层状,导致具有高度结晶结构的丝素纤维的结晶结构破坏,其以β-折叠为基础的有序结构逐步转变为无规则卷曲结构,分子内氢键转向与水的高度水合,实现可溶性。
参考文献
[1] Wongkrongsak S, Tangthong T, Pasanphan W. Electron beam induced water-soluble silk fibroin nanoparticles as a natural antioxidant and reducing agent for a green synthesis of gold nanocolloid [J]. Radiation Physics and Chemistry, 2016, 118: 27-34
[2] Vepari C, Kaplan D L. Silk as a biomaterial [J]. Progress in Polymer Science, 2007, 32(9): 991-1007
[3] Ude A U, Eshkoor R A, Zulkifili R, et al. Bombyxmori silk fibre and its composite: a review of contemporary developments [J]. Materials & Design, 2014, 57(5): 298-305
[4] Xing T, Hu W, Li S, et al. Preparation, structure and properties ofmulti-functional silk via ATRPmethod [J]. Applied Surface Science, 2012, 258(7): 3208-3213
[5] 周凤娟,许时婴,杨瑞金,等.丝素活性肽对高胆固醇血症小鼠的影响[J].丝绸,2007,8:30-40 ZHOU Feng-juan, XU Shi-ying, YANG Rui-jin, et al. Effect of silk fibroin active peptides on hypercholesterolemicmice [J]. Silk, 2007, 8: 30-40
[6] Zhang X, Geng X, Jiang H, et al. Synthesis and characteristics of chitin and chitosan with the (2-hydroxy-3- trimethylammonium)propyl functionality, and evaluation of their antioxidant activity in vitro [J]. Carbohydrate Polymers, 2012, 89(2): 486-491
[7] 陆旋,周兵,周晓红.N-乙酰半胱氨酸联合家蚕丝素蛋白解酒效果的动物试验[J].蚕业科学,2009,35(3):675-679 LU Xuan, ZHOU Bing, ZHOU Xiao-hong. Animal trials for the anti-alcoholic effect of N-acetyIcysteine combined silk fibroin [J]. Science of Sericulture, 2009, 35(3): 675-679
[8] 赵海俊,勇合超,周海鑫,等.丝素功能性质的研究[J].粮油加工,2010,11:119-121 ZHAO Hai-jun, YONG He-chao, ZHOU Hai-xin, et al. Silk fibroin functional properties [J]. Grain and Oil Processing, 2010, 11: 119-121
[9] 屠洁,刘冠卉,燕薇.4种常用稳定剂和丝素蛋白对搅拌型酸奶黏度和保水性的影响[J].食品科学,2012,33(21):136-140 TU Jie, LIU Guan-hui, YAN Wei. Effects of four common stabilizers combined with silk fibroin on viscosity and water-holding capacity of stirred yogurt [J]. Food Science, 2012, 33(21): 136-140
[10] Murphy A R, Kaplan D L. Biomedical applications of chemically-modified silk fibroin [J]. Journal of Materials Chemistry, 2009, 19(36): 6443
[11] 李玲玲,周伟,代方银,等.不同钙-醇溶解体系丝素蛋白的制备及表征研究[J].中国生物工程杂志,2012,32(4):28-32 LI Ling-ling, ZHOU Wei, DAI Fang-yin, et al. Study on the preparation and characterization of silk fibroin from different calcium alcohol soluble system [J]. Chinese Journal of Biotechnology, 2012, 32(4): 28-32
[12] 吴惠英,左保齐.氯化钙-甲酸溶解体系再生丝素长丝的制备及其性能[J].纺织学报,2016,37(2):1-6 WU Hui-ying, ZUO Bao-qi. Preparation and properties of regenerated silk fibroin by calcium chloride formic acid dissolving system [J]. Textile Journals, 2016, 37(2): 1-6
[13] 周凤娟,许时婴,王璋,等.可溶性丝素蛋白的结构研究[J].丝绸,2003,8:23-25 ZHOU Feng-juan, XU Shi-ying, WANG Zhang, et al. The study of the structure of soluble silk fibroin [J]. Silk, 2003, 8:23-25
[14] 杨锋,刘雪,任仙娥,等.不同商用大豆分离蛋白结构特征和功能性质的比较[J].现代食品科技,2016,9(32):107-115 YANG Feng, LIU Xue, REN Xian-e, et al. Comparsion of structural characteristics and functional properties of different commercial soy protein isolates [J]. Modern Food Science and Technology, 2016, 9(32): 107-115
[15] 赵婷婷,王欣,卢海燕,等.低场核磁共振结合主成分分析法在食用油脂品质分析中的应用[J].现代食品科技,2014, 9(30):179-185 ZHAO Ting-ting, WANG Xin, LU Hai-yan, et al. The quality assessment of edible oils and fats by LF-NMR coupled with PCA [J]. Modern Food Science and Technology, 2014, 9(30): 179-185
[16] 杨宇红,邵正中,陈新.光谱法研究pH值对再生桑蚕丝素蛋白在水溶液中结构的影响[J].化学学报,2006,16(64): 1730-1736 YANG Yu-hong, SHAO Zheng-zhong, CHEN Xin. Influence of pH value on the structure of regenerated bombyxmori silk fibroin in aqueous solution by optical spectroscopy [J]. Chinese Journal of Chemistry, 2006, 16(64): 1730-1736
[17] Lu Q, Hu X, Wang X, et al. Water-insoluble silk films with silk I structure [J]. Acta Biomaterialia, 2010, 6(4): 1380-1387
[18] 刘明.FTIR对丝素蛋白构象的研究[D].杭州:浙江大学,2006 LIU Ming. Fourier infrared spectroscopy to the study of silk fibroin conformation [D]. Hangzhou: Zhejiang University, 2006
[19] 苏锋.可溶性丝素蛋白的制备及其应用研究[D].无锡:江南大学,2004 SU Feng. Soluble preparation of silk fibroin and its application research [D]. Wuxi: Jiangnan University, 2004
[20] 严国良,谢桂军,陈小军,等.丝素蛋白在离子液体中的溶解特性研究[J].合成技术及应用,2009,24(4):1-5 YAN Guo-liang, XIE Gui-jun, CHEN Xiao-jun, et al. Silk fibroin dissolve characteristics research in ionic liquids [J]. Synthetic Technology and Application, 2009, 24(4): 1-5
[21] Bornberg E, Brùndum J W M, Sb E. Pre-rigor conditions in beef under varying temperature and pH-falls studied with rigometer, NMR and NIR [J]. Food Chemistry, 2000, 4(69): 407-418
[22] Hullberg A, Bertram H C. Relationships between sensory perception and water distribution determined by low-field NMR T2 relaxation in processed pork-impact of tumbling and RN-allele [J]. Meat Science, 2005, 69(4): 709-720
[23] 李银,李侠,张春晖,等.利用低场核磁共振技术测定肌原纤维蛋白凝胶的保水性及其水分含量[J].现代食品科技,2013, 11(29):2777-2781 LI Yin, LI Xia, ZHANG Chun-hui, et al. Water-holding capacity and water content ofmyofibrillar protein gel by low-field nuclearmagnetic resonance [J]. Modern Food Science and Technology, 2013, 11(29): 2777-2781
[24] 李伟妮,韩剑众.冷藏山羊肉品质变化的核磁共振研究[J].食品工业科技,2010,10(30):125-127 LI Wei-ni, HAN Jian-zhong. Nuclearmagnetic resonance (NMR) research of frozen goatmeat quality change [J]. Science and Technology of Food Industry, 2010, 10(30): 125-127
[25] 倪莉,王璋,姚文华,等.丝素蛋白结构的研究 1.探讨氯化钙溶液溶解丝素的机理[J].中国食品学报,2001,1:12-18 NI Li, WANG Zhang, YAO Wen-hua, et al. Silk fibroin structure research (1) to explore themechanism of calcium chloride solution of fibroin [J]. Journal of Chinese Food, 2001, 1: 12-18
[26] 鲁子贤,崔涛,施庆洛.圆二色性和旋光色散在分子生物学中的应用[M].北京:科学出版社,1987 LU Zi-xian, CUI Tao, SHI Qing-luo. Circular dichroism and optical dispersion in the application ofmolecular biology [M]. Beijing: Science Press, 1987
[27] Zhang Q, Cheng Y, Liu Y, et al. Study on silk fibroin gelation: effect of polyalcohol [J]. Advanced Materials Research, 2010, 3(175): 137-142
[28] 王学超,李延报,陆春华,等.水溶性丝素蛋白的制备及其构象转变[J].南京工业大学学报,2013,35(2):55-58 WANG Xue-chao, LI Yan-bao, LU Chun-hua, et al. The preparation of water-soluble silk fibroin and the conformational change [J]. Journal of Nanjing University of Technology, 2013, 35(2): 55-58
[29] 董文秀,李军生,阎柳娟,等.乙醇对丝素蛋白结构及功能特性的影响[J].现代食品科技,2015,2:106-112 DONG Wen-xiu, LI Jun-sheng, YAN Liu-juan, et al. Effect of ethanol on the structural and functional properties of silk fibroin [J]. Modern Food Science and Technology, 2015, 2: 106-112
Dissolution Behavior and Structural Changes of Silk Fibroin in Calcium Chloride-Ethanol-Water Solvent Systems
CHEN Jia-hong, JIANG Hong-rui, YU Lian, WANG Cheng-hua, ZHAO Mou-ming, LIU Xiao-ling
(Institute of Light Industry and Food Engineering, Guangxi University, Nanning 530004, China)
文章篇号:1673-9078(2017)9-37-45
DOI:10.13982/j.mfst.1673-9078.2017.9.006
收稿日期:2017-01-20
基金项目:广西自然科学基金项目(2016JJE120003)
作者简介:陈佳弘(1992-),女,硕士研究生,研究方向:食品科学
通讯作者:刘小玲(1972-),女,博士,教授,研究方向:生物大分子结构与性质