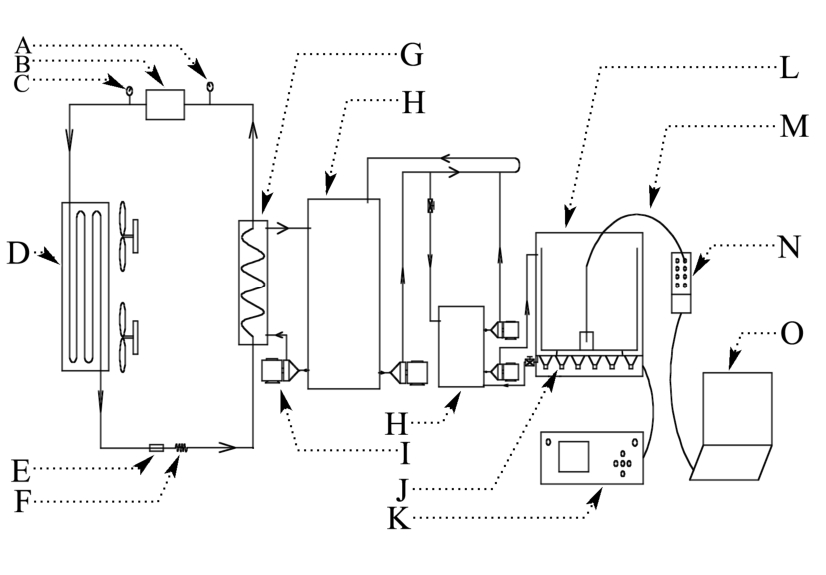
图1 超声波辅助浸渍冷冻装置示意图
Fig.1 Schematic diagram of the ultrasound-assisted immersion freezing device
注:A,氟压低压表;B,压缩机;C,氟压低压表;D,冷凝器;E,过滤器;F,膨胀阀;G,蒸发器;H,水箱;I,水泵;J,超声波换能器;K,超声波发生器;L,超声波处理腔;M,热电偶;N,数据采集器;O,电脑。
摘要:为了研究组织内部孔隙中气体含量对超声辅助浸渍冷冻冻结效果的影响,加深对空气对超声衰减所造成的影响的了解。本研究以萝卜组织为食品材料模型,采用真空脱气方式对萝卜组织中气体含量进行调节,得到气体含量分别为9.91%、6.46%、4.01%及0的4种萝卜组织,分别在28 kHz、0.33 W/cm2的超声条件下进行超声辅助浸渍冷冻处理,并与常规浸渍冷冻比较。结果表明:与常规浸渍冷冻相比,4种不同气体含量的萝卜组织经过超声辅助浸渍冷冻处理后冻结速率分别提高了20.00%、27.00%、29.00%和33.00%,相变时间分别缩短了16.00%、24.00%、27.00%和31.00%。随着组织中气体含量的降低,超声辅助浸渍冷冻冻结速率得到显著提高(p<0.05),样品冷冻解冻后的硬度、微观结构及钙离子含量均得到显著的改善(p<0.05)。研究发现组织内部孔隙中气体含量是降低超声辅助浸渍冷冻冻结效果的一大影响因素,脱气处理可以有效改善含气物料超声辅助浸渍冷冻效果。
关键词:超声辅助浸渍冷冻;气体含量;衰减;冻结速率;品质
传统冷冻过程中由于热传递速率相对较慢,形成的冰晶大而少且分布不均匀,过大的冰晶会刺破细胞膜,破坏组织结构,导致生物组织损伤严重、细胞破裂、解冻后汁液流失等后果[1,2]。超声波辅助浸渍冷冻作为一种新型的冷冻技术,近年来得到了快速发展。将超声波应用到冷冻工业中,通过其独特的超声空化及微射流效应,可诱发晶核生成及控制冰晶生长[3,4];超声空化和声流还可以通过减小固-液界面处边界层的厚度来降低传热阻力并加强对流传热[5,6],从而提高冻结速率并使得在冷冻过程中所形成的冰晶细小且分布均匀[7]。我们研究团队及其他研究者已经对土豆[8,9]、萝卜[10]、苹果[1]和草莓[11]等进行了超声辅助浸渍冷冻研究。然而,通过对比发现,在超声辅助浸渍冷冻条件下,各物料冻结速率发生了不同程度的提高(其中草莓、萝卜、土豆和苹果的冻结总时间最大分别缩短了21.48%[11]、16.84%[10]、14.29%[8]和8%[1])。在对以前的研究工作进行分析总结后认为:各食品物料内部气体含量的差异可能是导致超声辅助浸渍冷冻冻结效果出现差异的主要原因。超声波作为一种机械波,在传递过程中会发生不断的衰减,并且其衰减程度会随着媒介的不同而存在较大差距[12],其中超声波在空气中的衰减尤为明显[13]。植物组织中由于孔隙的存在(例如:苹果组织中孔隙含量在 20~25%[14],土豆组织中孔隙含量仅2%[15]),超声波在其中传递时会发生散射及吸收衰减[7]。有研究报道,超声衰减系数随孔隙率的升高呈现出上升的趋势[16,17],并且当组织中气体含量过高时,超声传递将受到阻碍[18]。
本研究以经过真空脱气处理所得到的不同气体含量的萝卜组织为研究对象,通过对4种不同气体含量的萝卜组织在特定超声强度及频率下进行超声辅助浸渍冷冻(ultrasound-assisted immersion freezing,UF)处理,并与常规浸渍冷冻(normal immersion freezing,F)进行对比,主要以冷冻过程中的冻结效率以及冻品解冻后的硬度、微观结构、总钙离子及醇不溶性固形物(AIS)中钙离子含量为考察指标(AIS中钙离子即为结合态钙离子,当细胞的完整性受到破坏时细胞中的钙离子将会失去结合位点,由结合态转变成游离态,导致结合钙离子含量的降低,所以组织中总钙离子及AIS中钙离子含量的变化可以有效的反应出冰晶对细胞的破坏程度[19]),进行萝卜组织中气体含量对超声辅助浸渍冷冻效果影响的分析,加深对超声波在传递过程中的衰减的进一步了解。
1.1 仪器与设备

图1 超声波辅助浸渍冷冻装置示意图
Fig.1 Schematic diagram of the ultrasound-assisted immersion freezing device
注:A,氟压低压表;B,压缩机;C,氟压低压表;D,冷凝器;E,过滤器;F,膨胀阀;G,蒸发器;H,水箱;I,水泵;J,超声波换能器;K,超声波发生器;L,超声波处理腔;M,热电偶;N,数据采集器;O,电脑。
自行搭建超声辅助浸渍冷冻实验平台,如图1所示。整套装置主要由:①超声处理装置(SB-600 DTY超声波多频清洗机,宁波新芝生物科技股份有限公司);②冷却系统(LS-20 kW风冷式冷水机泵,北京贝科溥制冷设备有限公司);③测温系统(T-型热电偶、TC-08数据采集器,美国OMEGA工程公司)三部分组成。H 2050高速冷冻离心机(湖南湘仪仪器有限公司);SX-8-10型箱式电阻炉(天津市泰斯特仪器有限公司);TA-XT2i型质构仪(英国Stable Micro System公司);Z-2000型原子吸收光谱仪(日本日立公司);TCS-SPE激光共聚焦显微镜(德国Leica公司)。
1.2 原料处理
新鲜萝卜(购于广州市穂石菜市场)洗净切好(1.7 cm直径、2.0 cm高度)。对切好的萝卜组织进行真空脱气处理,以达到组织内部孔隙中气体含量的差异。其中脱气处理方式及样品对应的气体含量如表 1所示。脱气处理后的样品用封口袋包好置于4 ℃冰箱中备用。
不同气体含量的萝卜组织UF处理流程如图1所示。通过前期预实验筛选出最佳超声处理条件(频率28 kHz、输出功率420 W,选定位置超声强度为0.33 W/cm2)及所对应超声腔体中的位置,后续实验过程中样品均置于此选定位置。冷媒(体积比为2:1的乙二醇及水的混合液)温度控制在-20±0.5 ℃。各样品采用F和UF两种方式处理,如表2所示。其中,UF处理条件为:物料中心到-0.5 ℃开始超声,工作30 s间歇30 s,超声时间120 s。当样品中心温度达到-18 ℃时,将样品从冷媒中取出并快速放入-18 ℃冰箱中备用。
表1 萝卜组织孔隙中气体含量的调节方式及对应参数
Table 1 Methods to adjust the air content in radish tissue pores and corresponding parameters

注:表中压力为以大气压为基准的相对压力。
编号 标示 处理方式 气体含量/% 水分含量/% 1 C 新鲜萝卜组织 9.91 95.51 2 D5min-0.02MPa新鲜萝卜组织在-0.02 MPa下脱气5 min 6.46 95.65 3 D5min-0.05MPa新鲜萝卜组织在-0.05 MPa下脱气5 min 4.01 95.74 4 D5min-0.09MPa新鲜萝卜组织在-0.09 MPa下脱气5 min 0 95.89
表2 不同气体含量萝卜组织的冷冻处理方式
Table 2 Freezing treatments for radish tissues with different air contents
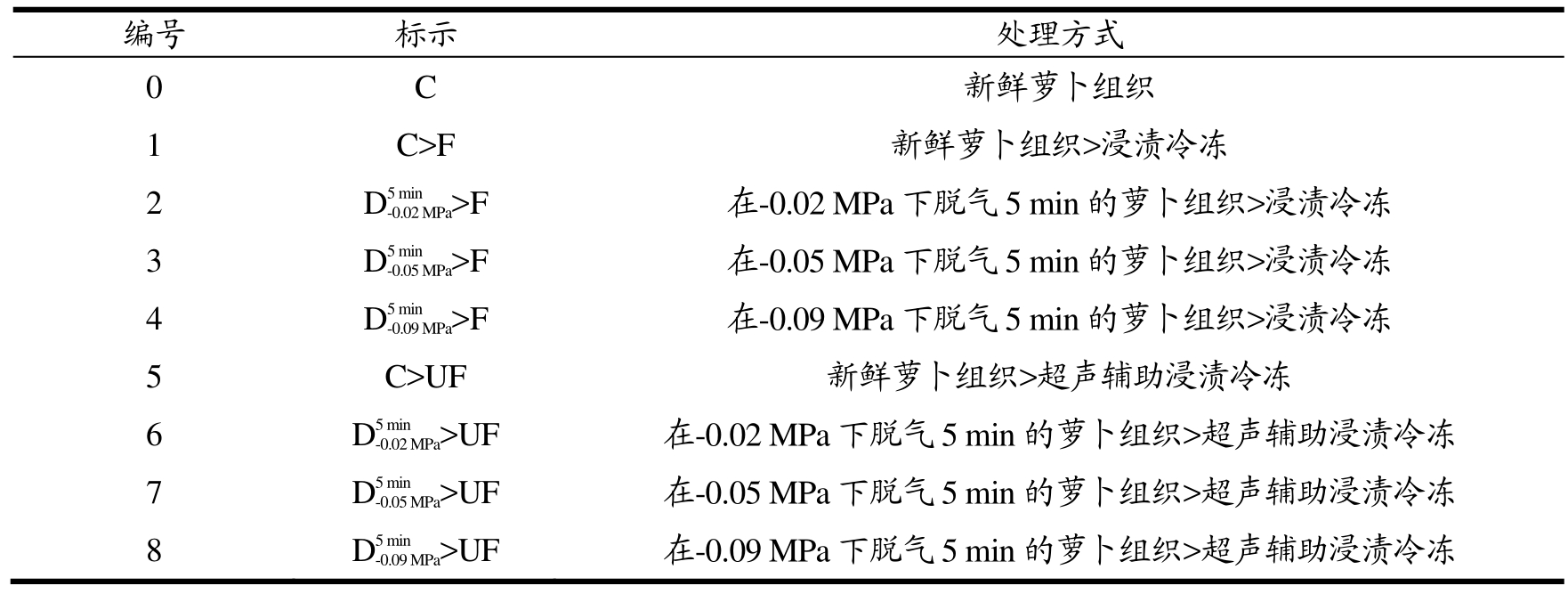
编号 标示 处理方式0 C 新鲜萝卜组织1 C>F 新鲜萝卜组织>浸渍冷冻2 D5min-0.02MPa>F 在-0.02 MPa下脱气5 min的萝卜组织>浸渍冷冻3 D5min-0.05MPa>F 在-0.05 MPa下脱气5 min的萝卜组织>浸渍冷冻4 D5min-0.09MPa>F 在-0.09 MPa下脱气5 min的萝卜组织>浸渍冷冻5 C>UF 新鲜萝卜组织>超声辅助浸渍冷冻6 D5min-0.02MPa>UF 在-0.02 MPa下脱气5 min的萝卜组织>超声辅助浸渍冷冻7 D5min-0.05MPa>UF 在-0.05 MPa下脱气5 min的萝卜组织>超声辅助浸渍冷冻8 D5min-0.09MPa>UF 在-0.09 MPa下脱气5 min的萝卜组织>超声辅助浸渍冷冻
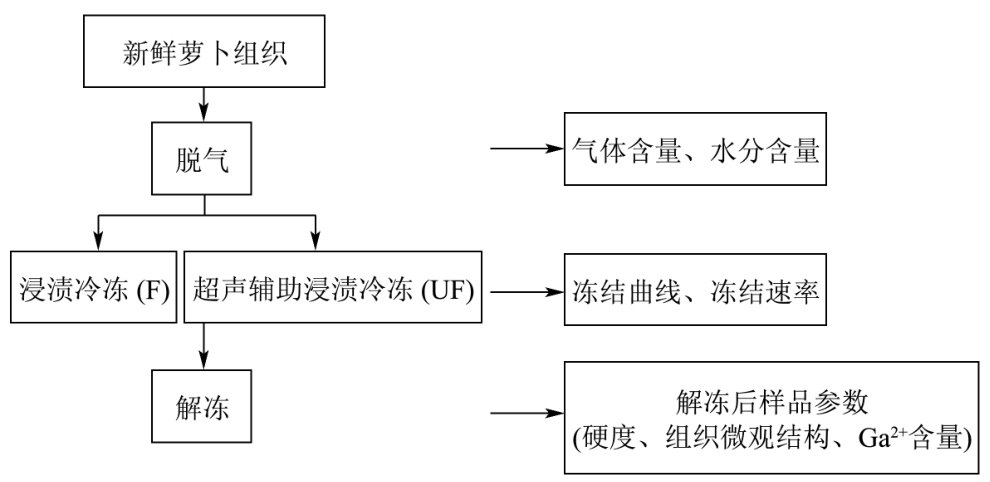
图2 萝卜组织中气体含量对超声辅助浸渍冷冻冻结效果影响实验流程图
Fig.2 Scheme of ultrasound-assisted immersion freezing of radish tissues with different air contents
1.3 物料基本参数测定
1.3.1 组织内部孔隙中气体含量的测定
参考Lazar DrazÏeta等的方法[20]。根据阿基米德原理对萝卜组织中的气体含量进行测定。每种样品进行3次平行。
1.3.2 组织中水分含量的测定
直接干燥法(GB 5009.3-2010)。
1.3.3 硬度的测定
参考Fernández-León等的方法[21]。采用TA-XT2i型质构仪对样品硬度进行测定。测试过程中选用压缩模式,并采用直径为2 mm的圆柱形平底探头对待测样品进行测试。测试参数设定为:测试前速度 2.00 mm/s,测试速度1.00 mm/s,测试后速度5.00 mm/s,触发力5.00 g,压缩变形程度60%,以最大峰值作为样品的硬度指标。每种样品进行6次平行。
1.3.4 激光共聚焦显微镜(CLSM)法观察组织微观结构
参考Dürrenberger及Haiyan Cen的方法[22,23]。取组织薄片(长×宽×厚:1×1×0.1 cm3),用0.1%的刚果红染液染色10 min,染色结束后用清水漂洗三次,然后在488 nm激发波长下对组织进行CLSM显微成像。采用Leica Application Suite X分析软件对图像进行分析处理。
1.4 样品中Ca2+含量测定
1.4.1 总Ca2+含量
样品中钙离子含量的测定采用Kawashima等的方法[24]。取样品5 g,加入65%硝酸10 mL,经充分消化及灰化后将残留物转移到100 mL容量瓶中,用蒸馏水定容,同时加入硝酸镧及硝酸,使得最终硝酸镧及硝酸的浓度分别为0.5%和1%。以碳酸钙作为标准样,标准样中最终的镧溶液和硝酸溶液的浓度同样分别为0.5%和1%。最终采用原子吸收分光光度法对溶液中钙离子含量进行测定,每组3次平行。
1.4.2 醇不溶固形物(AIS)中Ca2+含量
样品中AIS的提取采用Galetto等的方法[19]。称取5 g样品放入烧杯,添加25 mL体积分数为96%的乙醇,均质2 min。混合液进行60 ℃水浴5 min。悬浮液冷却至常温后于25 ℃、10013 g条件下离心20 min。离心结束后弃上清液并对沉淀物进行醇洗(80%乙醇两次、96%乙醇一次)。最后在40 ℃烘箱中对沉淀物进行干燥处理,即为醇不溶固形物。AIS中Ca2+含量的测定与总Ca2+含量测定方法一致。
1.5 数据分析
采用SPSS软件对实验数据进行统计分析,使用Tukey法对各样品平均值进行方差分析,置信度水平为 95%;实验数据均以平均值±标准偏差表示;采用Origin 8.5软件进行作图。
2.1 组织中气体含量对萝卜组织超声辅助浸渍冷冻冻结速率的影响所代表的处理方式与表2相一致。
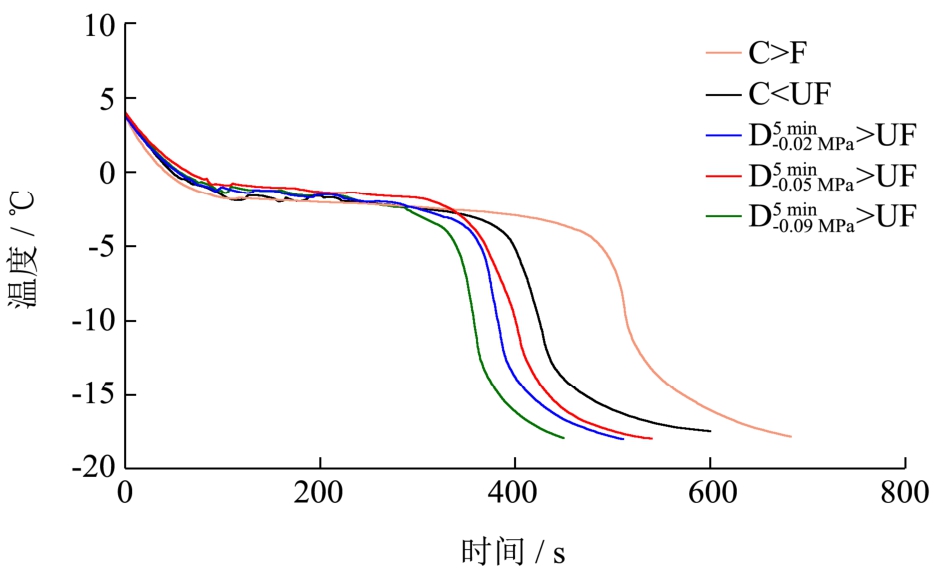
图3 不同气体含量的萝卜组织的冻结曲线
Fig.3 Freezing curves of radish tissues with different air contents
注:C>F、C>UF、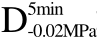 >UF、
>UF、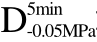 >UF 和
>UF 和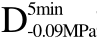 >UF
>UF
不同气体含量的萝卜组织在F及UF条件下的冻结曲线(图2)以及单位质量(1 g)水分冻结总时间(图3)及相变时间(图4)。由图2可知,与F相比,UF处理可显著缩短(p<0.05)4种不同气体含量萝卜组织的冻结总时间(物料中心温度从从 4 ℃下降到-18 ℃)以及冻结过程中的相变时间,大大提高了冻结速率。这主要是因为超声波的机械效应可以对组织内部造成扰动,加快传热速率。另外,超声空化效应能够促进结晶过程中的一次成核以及二次成核,缩短了冻结过程中的相变阶段时间及冻结总时间[3]。通过对比发现,不同气体含量的萝卜组织经F处理后单位质量(1 g)水分冻结过程中相变时间未出现显著差异(p>0.05),C、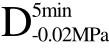 和
和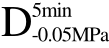 三种不同气体含量的萝卜组织单位质量(1 g)水分冻结总时间也未出现显著性差异。然而,在UF处理下C、
三种不同气体含量的萝卜组织单位质量(1 g)水分冻结总时间也未出现显著性差异。然而,在UF处理下C、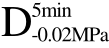 、
、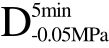 和
和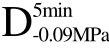 四种不同气体含量的萝卜组织单位质量(1 g)水分冻结总时间及相变时间均发生了显著性降低(p<0.05)。与F相比,未经任何脱气方式处理的新鲜萝卜组织C经UF处理后冻结速率提高了20.00%,而Baoguo Xu等[10]也报道了经超声处理后萝卜的冻结速率提高了16.84%,两者的研究结果相接近。但是,本研究中经真空脱气处理的样品
四种不同气体含量的萝卜组织单位质量(1 g)水分冻结总时间及相变时间均发生了显著性降低(p<0.05)。与F相比,未经任何脱气方式处理的新鲜萝卜组织C经UF处理后冻结速率提高了20.00%,而Baoguo Xu等[10]也报道了经超声处理后萝卜的冻结速率提高了16.84%,两者的研究结果相接近。但是,本研究中经真空脱气处理的样品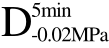 、
、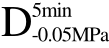 和
和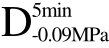 经UF处理后,冻结速率分别提高了 27.00%、29.00%和33.00%,均超过了16.84%和20.00%。这可能是因为虽然不同介质的导热系数不同(例如,空气的导热系数为0.024 W/(m·K),水的导热系数为0.54 W/(m·K)),但在气体含量较低的情况下,当物料温度与环温相差较大时,气体对物料内部传热速率的影响基本可以忽略。而超声波在不同介质中的衰减系数相差很大(例如,生理盐水(0.9%)及空气的衰减系数(1 MHz)分别为0.002及12.0 dB/cm[12])。所以气体含量的差异对超声辅助浸渍冷冻冻结效果的影响较常规浸渍冷冻要明显,且萝卜组织中气体含量越低超声辅助浸渍冷冻作用效果越好。
经UF处理后,冻结速率分别提高了 27.00%、29.00%和33.00%,均超过了16.84%和20.00%。这可能是因为虽然不同介质的导热系数不同(例如,空气的导热系数为0.024 W/(m·K),水的导热系数为0.54 W/(m·K)),但在气体含量较低的情况下,当物料温度与环温相差较大时,气体对物料内部传热速率的影响基本可以忽略。而超声波在不同介质中的衰减系数相差很大(例如,生理盐水(0.9%)及空气的衰减系数(1 MHz)分别为0.002及12.0 dB/cm[12])。所以气体含量的差异对超声辅助浸渍冷冻冻结效果的影响较常规浸渍冷冻要明显,且萝卜组织中气体含量越低超声辅助浸渍冷冻作用效果越好。
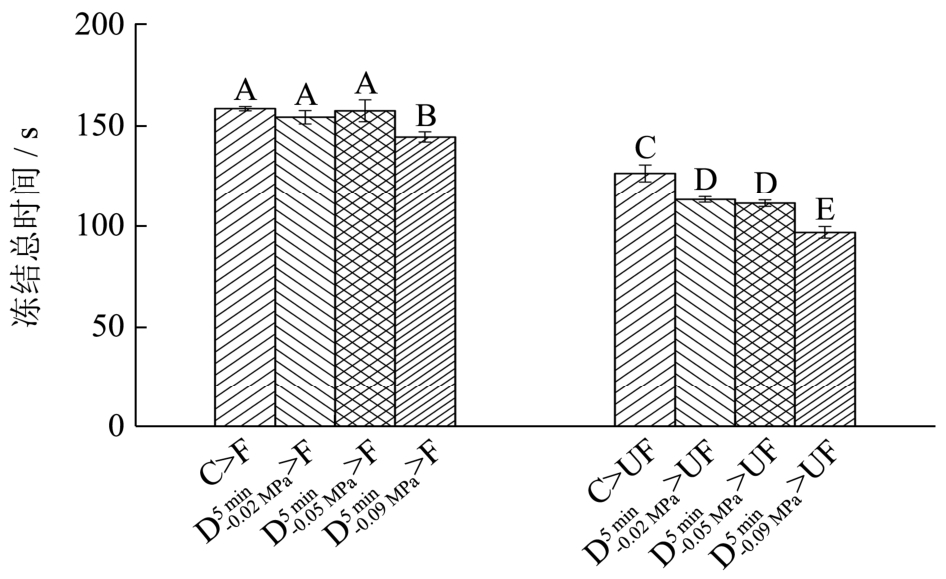
图4 不同气体含量萝卜组织中单位质量(1 g)水分冻结总时间
Fig.4 Total freezing time of a unit mass (1 g) of juice in radish tissues with different air contents
注:C>F、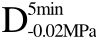 >F
>F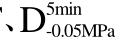 >F、
>F、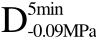 >F、C>UF、
>F、C>UF、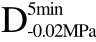 >UF、
>UF、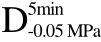 >UF和
>UF和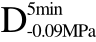 >UF所代表的处理方式与表2相一致。
>UF所代表的处理方式与表2相一致。
2.2 组织中气体含量对萝卜组织超声辅助浸渍冷冻后硬度的影响
四种不同气体含量的样品经F及UF处理,解冻后的硬度值如图5所示。与新鲜样品相比,冷冻处理后样品硬度都发生了显著性的降低(p<0.05),相同的结果在Xin等[25]的研究中也有报道。这主要是因为组织中水分含量较高,并且细胞外液浓度较细胞内液要低,冰晶首先会在细胞外液中形成,在相同温度下水的蒸汽压大于冰的蒸汽压,在蒸汽压差的作用下,细胞内的水会向细胞外迁移,使得细胞外的冰晶不断生长,形成较大冰晶并对细胞结构造成一定的机械损伤。由图可知,在F条件下,经过C、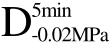 、
、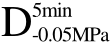 和
和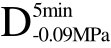 四种方式脱气处理后的样品解冻后样品硬度值并未出现较大差异。与F相比,C、
四种方式脱气处理后的样品解冻后样品硬度值并未出现较大差异。与F相比,C、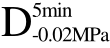 、
、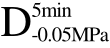 和
和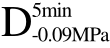 四种方式脱气处理后的样品经过 UF处理后硬度值分别提高了0.5%、-1.92%、1.26%和14.16%。这可能是由于在气体含量较低的情况下,气体含量的差异对物料的传热效率影响不大,而会对超声波的衰减造成较大程度的影响。未经脱气处理的样品C中气体含量相对较高,超声波衰减较严重,所以超声辅助效果并不明显,组织内部形成的冰晶还是与F处理过程形成的冰晶相似,组织受到冰晶的破坏程度较大。而经
四种方式脱气处理后的样品经过 UF处理后硬度值分别提高了0.5%、-1.92%、1.26%和14.16%。这可能是由于在气体含量较低的情况下,气体含量的差异对物料的传热效率影响不大,而会对超声波的衰减造成较大程度的影响。未经脱气处理的样品C中气体含量相对较高,超声波衰减较严重,所以超声辅助效果并不明显,组织内部形成的冰晶还是与F处理过程形成的冰晶相似,组织受到冰晶的破坏程度较大。而经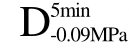 方式脱气处理的样品,超声波在组织内部能够很好的传递,超声空化效应明显,组织内部生成的冰晶细小且均匀分布于细胞内外,这使得细胞所受到的机械损伤大大降低,组织结构完整,所以解冻后硬度也得到显著提高(p<0.05)。
方式脱气处理的样品,超声波在组织内部能够很好的传递,超声空化效应明显,组织内部生成的冰晶细小且均匀分布于细胞内外,这使得细胞所受到的机械损伤大大降低,组织结构完整,所以解冻后硬度也得到显著提高(p<0.05)。
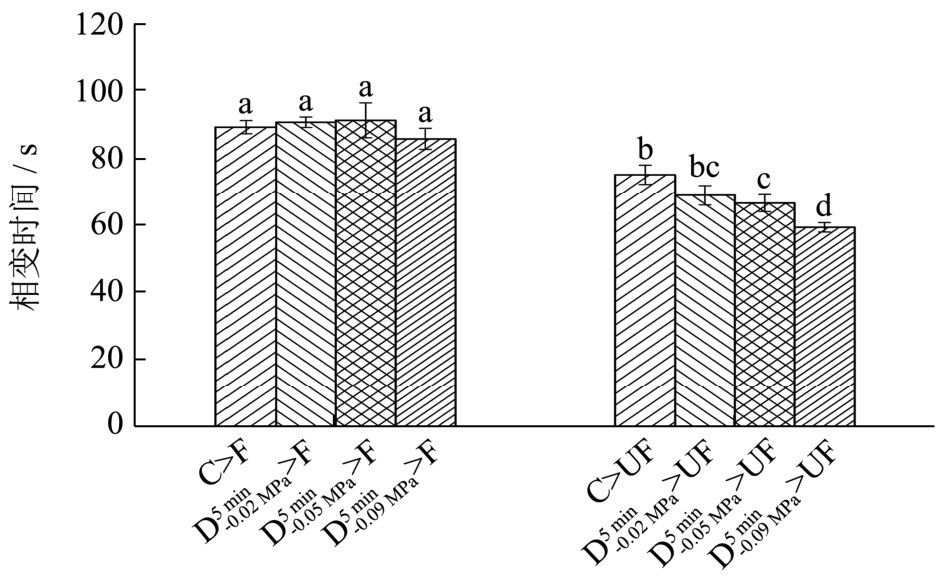
图5 不同气体含量萝卜组织中单位质量(1 g)水分冻结过程相变时间
Fig.5 Phase transition time of a unit mass (1 g) of juice in radish tissues with different air contents
注:C>F、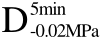 >F、
>F、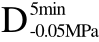 >F、
>F、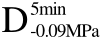 >F、C>UF、
>F、C>UF、
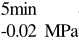 >UF、
>UF、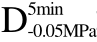 >UF和
>UF和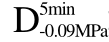 >UF所代表的处理方式与表2相一致。
>UF所代表的处理方式与表2相一致。
2.3 组织中气体含量对萝卜组织超声辅助浸渍冷冻后微观结构的影响
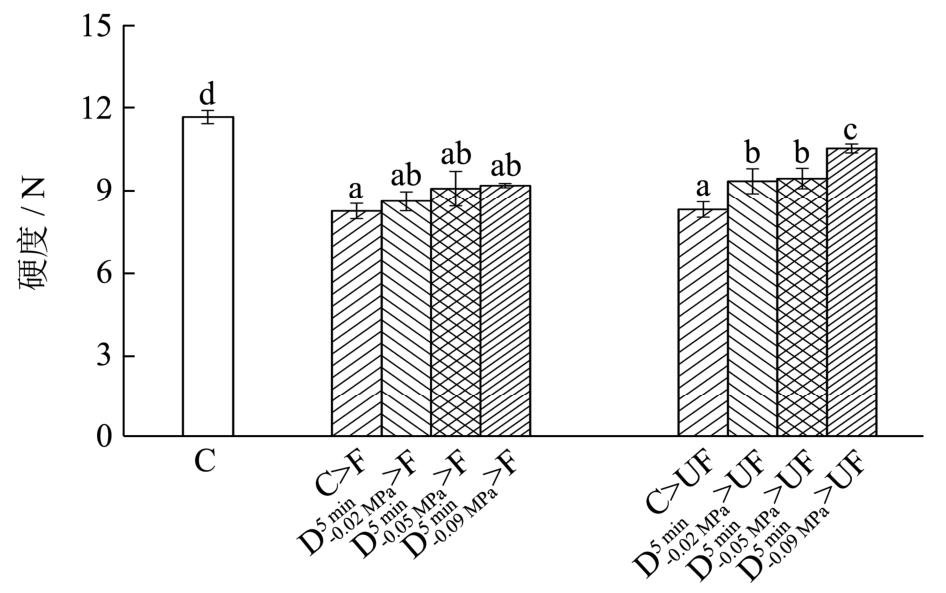
图6 不同气体含量的萝卜组织新鲜样品及经冷冻解冻后的硬度值
Fig.6 Hardness of radish tissues with different air contents after freezing treatment
注:C、C>F、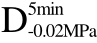 >F、
>F、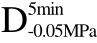 >F、
>F、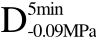 >F、C>UF、
>F、C>UF、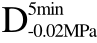 >UF、
>UF、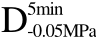 >UF、
>UF、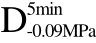 >UF所代表的处理方式与表 2相一致。
>UF所代表的处理方式与表 2相一致。
各样品经F与UF处理后组织的微观结构如图6所示,图中标记 D(disruption)表示细胞破裂,S(separation)表示细胞分离。由图可知,新鲜萝卜组织细胞结构排列整齐致密,细胞结构完整。与新鲜组织结构相比,经F与UF处理后的样品微观结构都会发生一定程度的破裂与变形。从图中可以看出,经C>F及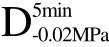 >F处理的两种样品内部结构破损较严重,经
>F处理的两种样品内部结构破损较严重,经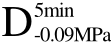 >F 处理后的样品中细胞之间出现了明显的分离,在Xu等[26]的研究中也观察到了类似现象,这些现象都说明了在常规浸渍冷冻过程中,冰晶首先在细胞间隙中形成并且不断长大,并对周围的细胞造成不定向的挤压以及刺破,从而造成了细胞的破损、坍塌以及分离。与 F相比,经过 C>UF、
>F 处理后的样品中细胞之间出现了明显的分离,在Xu等[26]的研究中也观察到了类似现象,这些现象都说明了在常规浸渍冷冻过程中,冰晶首先在细胞间隙中形成并且不断长大,并对周围的细胞造成不定向的挤压以及刺破,从而造成了细胞的破损、坍塌以及分离。与 F相比,经过 C>UF、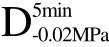 >UF、
>UF、
 >UF及
>UF及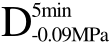 >UF四种处理的样品解冻后的组织中细胞破损程度有了明显的降低。这可能是因为在UF过程中,超声空化效应促进了组织内部晶核的形成,使得冰晶同时在胞内及胞外形成并生长,而非仅在细胞间隙中形成。超声空化效应还会形成微射流对已经形成的冰晶造成一定的破碎效果[4],所以组织内部所形成的冰晶整体比较细小且均匀分布于细胞内外。在C>UF、
>UF四种处理的样品解冻后的组织中细胞破损程度有了明显的降低。这可能是因为在UF过程中,超声空化效应促进了组织内部晶核的形成,使得冰晶同时在胞内及胞外形成并生长,而非仅在细胞间隙中形成。超声空化效应还会形成微射流对已经形成的冰晶造成一定的破碎效果[4],所以组织内部所形成的冰晶整体比较细小且均匀分布于细胞内外。在C>UF、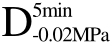 >UF、
>UF、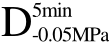 >UF及
>UF及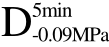 >UF四种处理的样品中,C>UF处理后的样品细胞结构有明显的破损以及变形,而其它3种处理后的样品细胞破损程度很低,组织结构基本保持完整,这可能是因为新鲜萝卜组织未经过脱气处理,组织中的气体含量相对较高,超声波在未经脱气处理的组织中传递时衰减程度较大,超声辅助浸渍冷冻作用效果不是很明显。
>UF四种处理的样品中,C>UF处理后的样品细胞结构有明显的破损以及变形,而其它3种处理后的样品细胞破损程度很低,组织结构基本保持完整,这可能是因为新鲜萝卜组织未经过脱气处理,组织中的气体含量相对较高,超声波在未经脱气处理的组织中传递时衰减程度较大,超声辅助浸渍冷冻作用效果不是很明显。
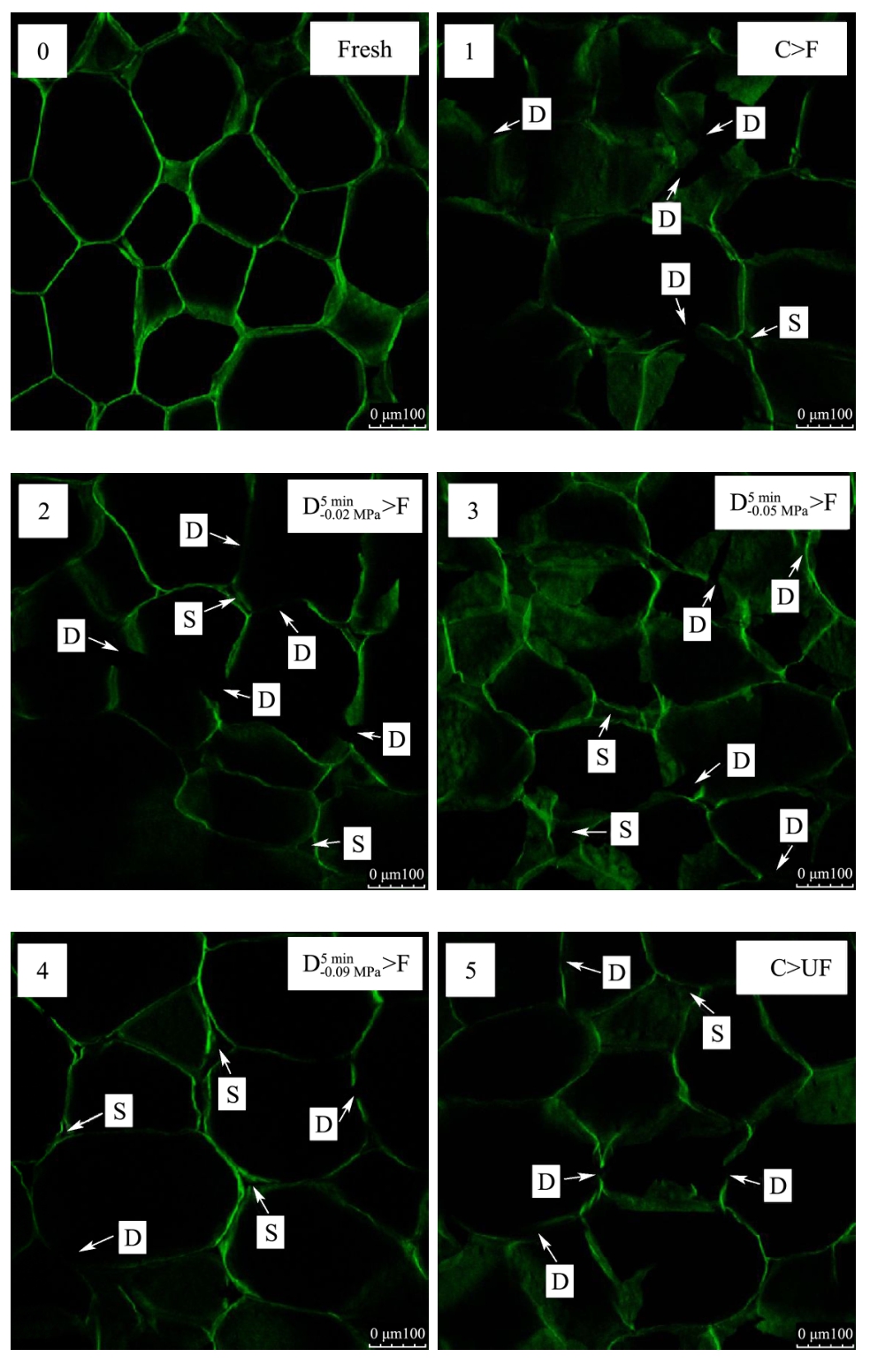
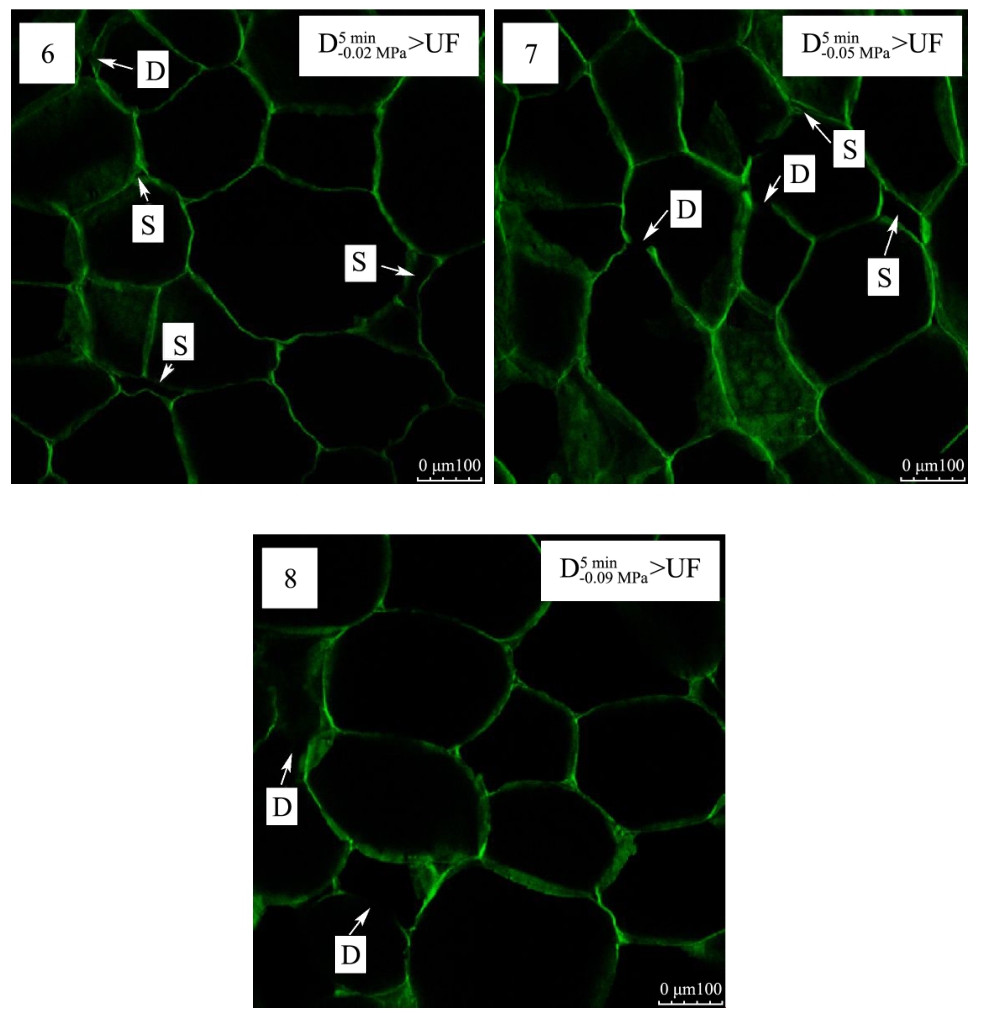
图7 萝卜组织的微观组织图片
Fig.7 Images of the microstructure of radish tissues
注:Fresh代表新鲜组织,C>F、 >F、
>F、 >F、
>F、 >F、C>UF、
>F、C>UF、 >UF、
>UF、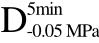 >UF、
>UF、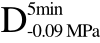 >UF所代表的处理方式与表2相一致。
>UF所代表的处理方式与表2相一致。
2.4 组织中气体含量对萝卜组织超声辅助浸渍冷冻后总Ca2+及AIS中Ca2+含量的影响
表3 超声辅助浸渍冷冻对不同气体含量的萝卜组织中的钙离子含量的影响
Table 3 Effects of ultrasound-assisted immersion freezing on the calcium content of radish tissues with different air contents
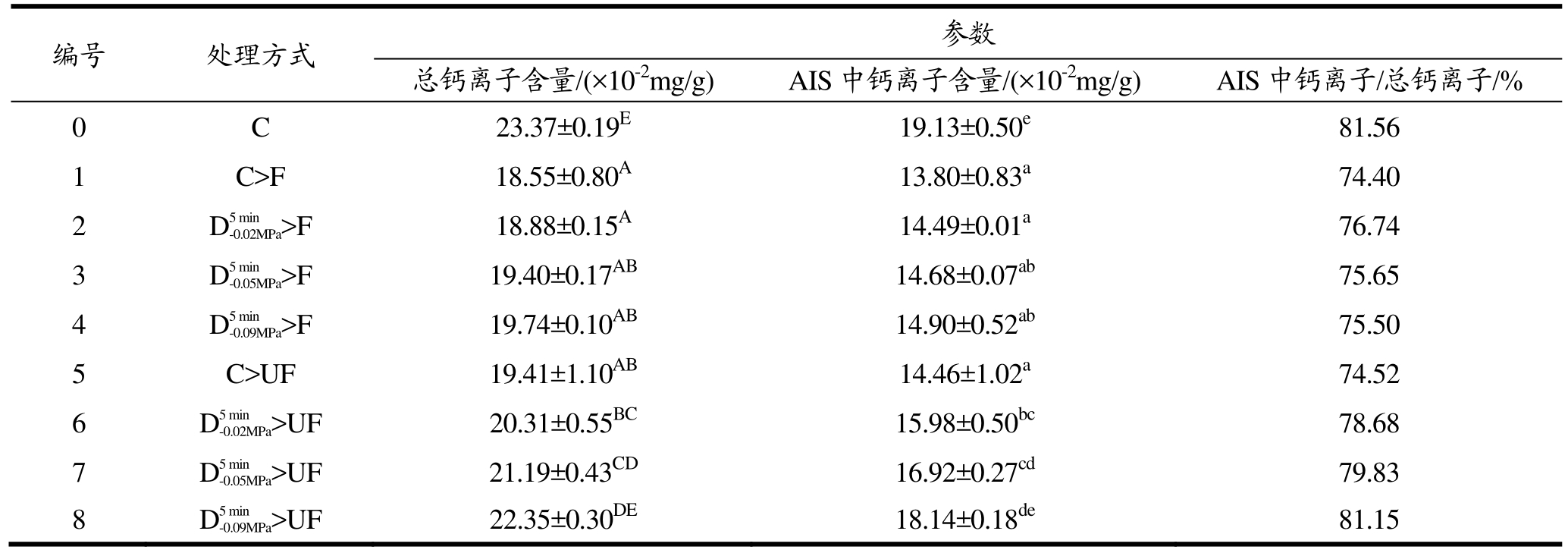
注:同一列中不同字母代表具有显著性差异(p<0.05)。
编号 处理方式参数总钙离子含量/(×10-2mg/g) AIS中钙离子含量/(×10-2mg/g) AIS中钙离子/总钙离子/% 0 C 23.37±0.19E19.13±0.50e81.56 1 C>F 18.55±0.80A13.80±0.83a74.40 2 D5min-0.02MPa>F 18.88±0.15A14.49±0.01a76.74 3 D5min-0.05MPa>F 19.40±0.17AB14.68±0.07ab75.65 4 D5min-0.09MPa>F 19.74±0.10AB14.90±0.52ab75.50 5 C>UF 19.41±1.10AB14.46±1.02a74.52 6 D5min-0.02MPa>UF 20.31±0.55BC15.98±0.50bc78.68 7 D5min-0.05MPa>UF 21.19±0.43CD16.92±0.27cd79.83 8 D5min-0.09MPa>UF 22.35±0.30DE18.14±0.18de81.15
不同气体含量的萝卜组织经F及UF冷冻处理后,组织内部总钙离子含量及AIS中钙离子含量如表3所示。从表中数据可以看出,4种不同气体含量的萝卜组织经F处理再进行解冻以后,各样品中总钙离子含量及 AIS中钙离子含量均未出现显著性差异(p>0.05)。这主要是因为在F过程中,物料内部的热传递主要以温度差为驱动,虽然不同介质间的导热系数存在差距,但是组织中的孔隙很小,孔隙中气体含量也比较低,在物料与冷媒之间的温度相差很大时,由于气体所导致的传热速率降低基本可以忽略。然而,经过UF处理后,解冻后样品中的总钙离子含量及AIS中钙离子含量均随组织内部气体含量的降低而出现了显著性的上升(p<0.05)。并且,与F相比,经UF处理后的各样品中AIS中钙离子含量与总钙离子含量的比值均出现了提高,这与Xin等[27]的报道相一致。这可能是因为超声处理促进了样品冷冻过程中的传热传质,降低了冰晶对冷冻组织的损伤程度[19],减少了汁液流失,从而使得组织内部的Ca2+得到更好的保留。
经C、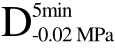 、
、 和
和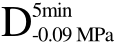 四种不同方式脱气处理后的样品,组织内部孔隙中气体含量的不同导致了超声衰减系数的差异,并对UF冻结效果造成了显著影响。与F相比,经UF处理后4种不同气体含量的样品冻结速率分别提高了20.00%、27.00%、29.00%和33.00%,相变时间分别缩短了16.00%、24.00%、27.00%和31.00%,两组数据非常接近,可见UF处理主要是缩短了冷冻过程中相变阶段的时间,从而达到提高冻结速率的效果。所以,在进行UF处理时应该在冷冻过程中的相变阶段施加超声处理。随着组织中气体含量的降低,UF冻结效果得到显著改善(p<0.05),可见气体含量是阻碍超声作用效果的一大影响因素,脱气处理可以有效提高含气物料超声辅助浸渍冷冻冻结速率。
四种不同方式脱气处理后的样品,组织内部孔隙中气体含量的不同导致了超声衰减系数的差异,并对UF冻结效果造成了显著影响。与F相比,经UF处理后4种不同气体含量的样品冻结速率分别提高了20.00%、27.00%、29.00%和33.00%,相变时间分别缩短了16.00%、24.00%、27.00%和31.00%,两组数据非常接近,可见UF处理主要是缩短了冷冻过程中相变阶段的时间,从而达到提高冻结速率的效果。所以,在进行UF处理时应该在冷冻过程中的相变阶段施加超声处理。随着组织中气体含量的降低,UF冻结效果得到显著改善(p<0.05),可见气体含量是阻碍超声作用效果的一大影响因素,脱气处理可以有效提高含气物料超声辅助浸渍冷冻冻结速率。
参考文献:
[1] Delgado A E, Zheng L, Sun D W. Influence of ultrasound on freezing rate of immersion-frozen apples [J]. Food and Bioprocess Technology, 2008, 2(3): 263-270
[2] Xin-feng C, Min Z, Xu B, et al. The principles of ultrasound and its application in freezing related processes of food materials: a review [J]. Ultrasonics Sonochemistry, 2015, 27: 576-585
[3] Chow R, Blindt R, Chivers R, et al. The sonocrystallisation of ice in sucrose solutions: primary and secondary nucleation [J]. Ultrasonics, 2003, 41(8): 595-604
[4] Chow R, Blindt R, Chivers R, et al. A study on the primary and secondary nucleation of ice by power ultrasound [J]. Ultrasonics, 2005, 43(4): 227-30
[5] Legay M, Gondrexon N, Le Person S, et al. Enhancement of heat transfer by ultrasound: review and recent advances [J]. International Journal of Chemical Engineering, 2011, 2011: 1-17
[6] Kiani H, Sun D W, Zhang Z. The effect of ultrasound irradiation on the convective heat transfer rate during immersion cooling of a stationary sphere [J]. Ultrasonics Sonochemistry, 2012, 19(6): 1238-1245
[7] Awad T S, Moharram H A, Shaltout O E, et al. Applications of ultrasound in analysis, processing and quality control of food: a review [J]. Food Research International, 2012, 48(2): 410-427
[8] Li B, Sun D W. Effect of power ultrasound on freezing rate during immersion freezing of potatoes [J]. Journal of Food Engineering, 2002, 55(3): 277-282
[9] Comandini P, Blanda G, Soto-Caballero M C, et al. Effects of power ultrasound on immersion freezing parameters of potatoes [J]. Innovative Food Science and Emerging Technologies, 2013, 18(18): 120-125
[10] Xu B, Min Z, Bhandari B, et al. Influence of power ultrasound on ice nucleation of radish cylinders during ultrasound-assisted immersionfreezing [J]. International Journal of Refrigeration-Revue Internationale Du Froid, 2014, 46: 1-8
[11] Xin-feng C, Min Z, Adhikari B, et al. Effect of ultrasound irradiation on some freezing parameters of ultrasoundassisted immersion freezing of strawberries [J]. International Journal of Refrigeration, 2014, 44(7): 49-55
[12] 冯诺.超声手册[M].南京:南京大学出版社,1999
FENG Nuo. Ultrasonics handbook [M]. Nanjing: Nanjing University Press, 1999
[13] Feng H, Barbosa-Cánovas G V, JochenWeiss. Ultrasound technologies for food and bioprocessing [M]. New York: Springer Science+Business Media, 2011
[14] Khan A A, Vincent J F V. Compressive stiffness and fracture properties of apple and potato parenchyma [J]. Journal of Texture Studies, 1993, 24(4): 423-435
[15] Mizrach A, Galili N, Rosenhouse G. Determination of fruit and vegetable properties by ultrasonic excitation [J]. Transactions of the American Society of Agricultural Engineers, 1989, 32(6): 2053-2058
[16] Ling L, Ming-kun L, Bo-ming Z, et al. Effects of porosity on the ultrasonic absorption coefficient and mechanical strength of carbon/epoxy composites [J]. Acta Mater. Compos. Sin., 2004, 21(5): 116-121
[17] Wen M, Fu-shun L. Effect of porosity on the attenuation coefficient and mechanical properties of glass fiber reinforced composites [J]. Acta Mater. Compos. Sin., 2012, 29(5): 69-75
[18] Tamura Y, Tsurumi N, Matsumoto Y. Visualizations of bubble motions and temperature rises by focused ultrasound [J]. Procedia Engineering, 2014, 90: 5-10
[19] Galetto C D, Verdini R A, Zorrilla S E, et al. Freezing of strawberries by immersion in CaCl2solutions [J]. FoodChemistry, 2010, 123(2): 243-248
[20] Dražeta L, Lang A, Hall A J, et al. Air volume measurement of ‘braeburn’ apple fruit [J]. Journal of Experimental Botany, 2004, 55(399): 1061-1069
[21] Fernández-León M F, Fernández-León A M, Lozano M, et al. Altered commercial controlled atmosphere storage conditions for ‘parhenon’ broccoli plants (Brassica oleracea L. var. italica). Influence on the outer quality parameters and on the health-promoting compounds [J]. LWT-Food Science and Technology, 2013, 50(2): 665-672
[22] Cen H, Lu R, Mendoza F, et al. Relationship of the optical absorption and scattering properties with mechanical and structural properties of apple tissue [J]. Postharvest Biology and Technology, 2013, 85(11): 30-38
[23] Dürrenberger M B, Handschin S, Conde-Petit B, et al. Visualization of food structure by confocal laser scanning microscopy (CLSM) [J]. LWT-Food Science and Technology, 2001, 34(1): 11-17
[24] Kawashima L M, Valente Soares L M. Mineral profile of raw and cooked leafy vegetables consumed in southern Brazil [J]. Journal of Food Composition and Analysis, 2003, 16(5): 605-611
[25] Ying X, Min Z, Adhikari B. The effects of ultrasound-assisted freezing on the freezing time and quality of broccoli (Brassica oleracea L. var. botrytis L.) during immersion freezing [J]. International Journal of Refrigeration, 2014, 41: 82-91
[26] Xu B G, Zhang M, Bhandari B, et al. Effect of ultrasound-assisted freezing on the physico-chemical properties and volatile compounds of red radish [J]. Ultrasonics Sonochemistry, 2015, 27: 316-324
[27] Ying X, Min Z, Adhikari B. Ultrasound assisted immersion freezing of broccoli (Brassica oleracea L. var. botrytis L.) [J]. Ultrasonics Sonochemistry, 2014, 21(5): 1728-1735
Effects of Air Content in Radish Tissue Pores on Freezing Efficiency during Ultrasound-assisted Immersion Freezing
Abstract:To gain a deeper understanding about the effect of air on ultrasonic attenuation, the freezing efficiency of the ultrasound-assisted immersion freezing method was determined on tissue samples with pores comprising different air contents. Radish tissue was used as a food model. The air content in the vegetable tissues was adjusted by vacuum degassing treatments to obtain tissue pores with 9.91%, 6.46%, 4.01%, or 0% of air. These samples were then treated by ultrasound-assisted immersion freezing at a frequency of 28 kHz and power of 0.33 W/cm2, and the results were compared with those from samples subjected to normal immersion freezing at the same temperature. Consequently, relative to the samples that were frozen normally, the freezing rates of the samples with 9.91%, 6.46%, 4.01%, and 0% of air were improved by 20.00%, 27.00%, 29.00%, and 33.00%, respectively, after ultrasound-assisted immersion freezing, and the phase transition times of these samples were reduced by 16.00%, 24.00%, 27.00%, and 31.00%, respectively. With decreasing air content in the radishes, the freezing rate of the ultrasound-assisted immersion freezing method was increased significantly (p<0.05), and the hardness, microstructure, and calcium content of the thawed samples were significantly enhanced (p<0.05) as well. The results suggested that the higher air content in the radish tissue pores was a major factor causing the decrease in the efficiency of ultrasound-assisted immersion freezing, and degassing treatment could effectively improve the efficiency of this freezing technique on air-containing substances.
Key words:ultrasound-assisted immersion freezing; air content; attenuation; freezing rate; quality
文章篇号:1673-9078(2017)7-172-179
DOI:10.13982/j.mfst.1673-9078.2017.7.025
收稿日期:2017-03-05
基金项目:东普通高校国际暨港澳台合作创新平台(2015KGJHZ001);农产品保鲜物流共性技术创新团队(2016LM2154);广州市科技计划(201508020097)