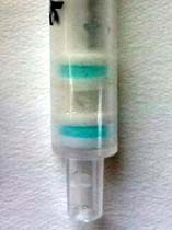
图1 检测柱检测条件优化
Fig.1 Optimization of the gel detection column
摘要:本研究建立了兽药呋喃它酮代谢物(Furaltadone metabolites,AMOZ)的免疫亲和凝胶柱检测新方法,并用于动物源性食品中呋喃它酮代谢物残留的可视化快速检测。整个检测在一个标准的1 mL固相萃取(SPE)柱中进行,柱中包含两层:一个结合了呋喃它酮代谢物特异性抗体的凝胶检测层和一个结合了辣根过氧化物酶(HRP)抗体的凝胶质控层。将样品提取液与酶标抗原预混合后加入到检测柱中,基于抗原抗体的竞争结合反应和辣根过氧化物酶的酶促反应,根据检测柱的检测层颜色的深浅和有无来定性,半定量检测呋喃它酮代谢物的含量。整个检测过程可以在10 min内完成,该凝胶检测柱的检测限为20 μg/L;牛肉、鲷鱼、鸡肉、虾肉、猪肉、鱿鱼、鸡肝和黄花鱼等动物源性食品中呋喃它酮代谢物的检测限为3 μg/kg。该方法准确度高、特异性好、检测步骤简单,适用于大量样品中呋喃它酮代谢物残留的快速检测。
关键词:呋喃它酮代谢物;凝胶柱;可视化检测;动物源性食品
呋喃它酮(Furaltadone)属于硝基呋喃类(Nitrofurans)兽药的一种,具有广谱抗菌性,能抑制和杀死多类细菌和原虫、对真菌也有抑制杀伤作用,细菌对此药物不易产生耐药性并与其他类药物之间无交叉耐药性,因而被广泛地用于水产、畜禽和蜜蜂等食源性动物的疾病预防与治疗,也用作动物饲料添加剂促生长剂。鉴于呋喃它酮的危害,欧盟规定呋喃它酮禁止在食用性动物中使用。我国农业部也发布公告规定在动物源性食品中不得检出呋喃它酮。然而,在动物源性食品中,特别是水产品中检出呋喃它酮代谢物(Furaltadone metabolites,AMOZ)的残留案例还时有发生,因此建立准确可靠、简单有效的检测方法来加强对呋喃它酮的监管很有必要。呋喃它酮对光敏感,禽畜用药后在动物机体内仅仅有几小时的半衰期,所以检测样品时不能检测到原药,但其代谢产物在动物组织中残留时间长,以共价结合蛋白的形态可在体内残留数周,甚至可传给后代[1]。目前动物源性食品中呋喃它酮的残留检测主要通过衍生化处理后再进行检测,常用的检测方法主要有高效液相色谱法[2,3]、液相色谱-串联质谱法[4~8]和免疫分析法[9~12]等。仪器分析法虽然准确性高,但是检测步骤繁琐,仪器设备昂贵,同时需要专业的操作人员,可作为确证性方法,不适合现场快速检测。免疫分析法特异性好、检测成本低、操作简单快速、结果判断容易,适合现场快速检测。本研究以动物组织残留标示物呋喃它酮代谢物AMOZ为目标物,建立一种新型可视化免疫层析凝胶检测柱用于动物源性食品中呋喃它酮代谢物残留的快速检测。
1.1 材料与试剂
呋喃它酮等硝基呋喃类兽药原药及其代谢物标准品、辣根过氧化物酶、过氧化氢脲、3,3,5,5-四甲基联苯胺(TMB)、N-羟基琥珀酰亚胺(NHS)、N,N’-二环已基碳化二亚胺(DCC)、二甲基甲酰胺(DMF)、甘氨酸、Proclin 300抑菌素:美国Sigma公司;β-环糊精、二甲基亚砜(DMSO):德国Merck公司;CNBr-Sepharose 4B溴化氰活化琼脂糖凝胶:美国GE公司;辣根过氧化物酶(HRP)抗体:北京庄盟生物技术公司;碳酸氢钠、氯化钠、氢氧化钠、冰醋酸、盐酸、柠檬酸、醋酸钠、磷酸氢二钠、磷酸二氢钠、乙酸乙酯、正己烷、邻硝基苯甲醛:国药集团化学试剂有限公司。
1.2 仪器与设备
超纯水系统:美国Millipore公司;分析天平-BL610:德国赛多利斯公司;周转式振摇器-MS2:美国IKA公司;旋涡混合器-HQ-60:北方同正生物技术发展公司;烧结玻璃过滤器:天津盛博玻璃仪器有限公司;SPE柱(1 mL)、聚乙烯垫片、转接头:美国Agilent Technologies公司。
1.3 主要溶液
偶联缓冲液(caupling buffer,pH 8.3):称取2.92 g NaCl,0.84 g NaHCO3,加入100 mL双蒸水,用NaOH调pH至8.3。清洗缓冲液(acetate buffer,pH 4.0):称取2.92 g NaCl,0.58 mL CH3COOH,加入100 mL双蒸水溶解,用无水乙酸钠调pH至4.0。封闭缓冲液(blocking buffer,pH 8.0):取0.3 g甘氨酸,加入10 mL偶联缓冲液中。底物液(TMB-过氧化氢脲溶液):底物液A:无水醋酸钠8.2 g,β-糊精2.5 g,过氧化氢脲428.6 mg,加双蒸水至1000 mL,调节pH至5.0,4 ℃保存,使用时恢复至室温。底物液B:100 mg TMB溶于10 mL DMSO中,棕色瓶保存。使用前15 min混合,14.6 mL A溶液和0.45 mL B溶液。
1.4 方法
1.4.1 呋喃它酮代谢物酶标抗原(CPAMOZHRP)的制备
(1)称取4.7 mg CPAMOZ,2.3 mg N-羟基琥珀酰亚胺(NHS)溶解于100 μL DMF中,然后再向混合液中加入3.9 mg DCC,室温下搅拌18 h,离心(4500 r/min)15 min,得到的上清液为活性酯。
(2)称取5 mg HRP蛋白溶解于2 mL的PBS(0.01 mol/L,pH 7.4)中。4 ℃下再逐渐加入50 µL上面的活性酯。继续搅拌过夜,将反应液转移到透析袋中,用PBS缓冲溶液透析72 h。收集透析后液体,置4 ℃冰箱保存备用。
1.4.2 封闭胶的制备
(1)溶胀:称取0.5 g溴化氰活化的琼脂糖凝胶,用40 mL、1 mmol/L HCl溶液在具砂板层析柱中溶胀清洗15 min,待凝胶完全溶胀后用偶联缓冲液调至中性。
(2)封闭:加入9 mL封闭缓冲液室温反应2 h,目的是封闭凝胶上残余的基团。再用10 mL清洗缓冲液和10 mL偶联缓冲液交替清洗三次。制备好的封闭胶用10 mL PBS(含有0.03%的Proclin 300)稀释重悬,4 ℃贮存。
1.4.3 抗体胶的制备
(1)溶胀:称取0.25 g的溴化氢活化的琼脂糖凝胶,用20 mL、1 mmol/L HCl溶液在具砂板层析柱中溶胀清洗15 min,待凝胶完全溶胀后用偶联缓冲液调至中性。
(2)偶连抗体:取0.5 mg的呋喃它酮代谢物多克隆抗体,并用1 mL偶联缓冲液对抗体稀释,加入到凝胶中悬起,在室温下用定向摇床振摇2 h。使用10 mL偶联缓冲液清洗凝胶,去除未偶联上的呋喃它酮代谢物多克隆抗体。
(3)封闭:用封闭缓冲液将凝胶上残余的活性基团进行封闭,室温下在定向摇床上反应2 h。反应完后用10 mL清洗缓冲液和10 mL偶联缓冲液交替清洗三次。制备好的凝胶用5 mL PBS(含有0.03%的Proclin 300)稀释重悬,4 ℃贮存。
1.4.4 检测柱的制备
检测柱主要由质控层和检测层组成,底层是质控层,中间是大约3 mm的空气间隔(防止加入底物显色后试剂从质控层迁移到检测层中),上层为检测层。质控层的制备:最底部是垫片,加入150 μL抗HRP抗体胶和封闭胶的混合物,用注射器加压打出多余的液体,再盖上第二个垫片。检测层的制备:在质控层上方约3 mm处固定第三个垫片,然后加入150 μL抗体胶和封闭胶混合液,注射器加压打出多余的液体,再盖上第四个垫片。
1.4.5 检测柱检测步骤和检测限
(1)加样:用1 mL PBS将按一定比例稀释酶标抗原与NPAMOZ标准品或样品溶液预混合,从进样口加入到柱子中,控制流速为1 mL/min。
(2)洗柱:用3 mL PBST冲洗柱子,再用2 mL PBS冲洗柱子,以冲洗去除未与抗体结合的抗原和残留的Tween-20。
(3)显色:加入300 μL底物液,反应30 s后,用注射器将底物液完全排出,继续显色4 min后,观察反应结果。
以目测检测层蓝色消失时NPAMOZ的最小浓度定义为凝胶检测柱的检测限。
1.4.6 实际样品的检测
牛肉、鲷鱼、虾肉、鸡肉、猪肉、鱿鱼、鸡肝、黄花鱼8种组织样品处理方法如下:
(1)衍生处理:称取5.0 g的样品于50 mL的离心管中,加入10 mL的去离子水和2 mL的1 mol/L的HCl溶液,混匀后加入300 µL的邻硝基苯甲醛溶液(50 mmol/L),混匀后,置于60 ℃水浴中分别反应120 min。
(2)萃取处理:将衍生后的样品取出恢复至室温后加入5 mL的PBS和1.6 mL的1 mol/L的NaOH溶液调制pH至中性,然后再加入7 mL的乙酸乙酯,漩涡混匀30 s后5000 r/min离心10 min,取上层即乙酸乙酯层于10 mL的离心管中,50 ℃氮气吹干。加2 mL的正己烷复溶,再加入1 mL的PBS缓冲溶液,震荡混匀后5000 r/min离心10 min,将上层的正己烷层弃掉,下层溶液用于检测。
2.1 检测柱检测条件的确定
为了缩短检测时间,使检测结果易于判断,需要对检测层抗体胶的稀释倍数、酶标抗原稀释倍数、HRP抗体胶稀释倍数、样品稀释液pH值、加样时间和显色时间进行优化,从而达到快速可视化检测的目的。
经优化检测层抗体胶用封闭胶稀释80倍,HRP抗体胶用封闭胶稀释20倍,酶标抗原稀释倍数为150000,样品稀释液pH值为7.4,加样时间为1 min,显色时间为3~4 min,此条件下的检测层与质控层显色后显现出清晰的蓝色,且质控层和检测层颜色一致,如图1所示,图中上层为检测层,下层为质控层。

图1 检测柱检测条件优化
Fig.1 Optimization of the gel detection column
2.2 检测柱检测限的确定
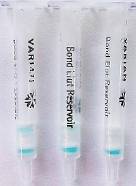
图2 可视化凝胶检测柱检测呋喃它酮代谢物衍生物(NPAMOZ)
Fig.2 Detection of NPAMOZ with the visual gel detection column
注:NPAMOZ的浓度从左至右分别为:0、10、20 μg/L。
呋喃它酮代谢物(AMOZ)经过衍生化以后可以用凝胶检测柱进行检测,以呋喃它酮代谢物衍生物(NPAMOZ)为检测目标物,通过测定其浓度可间接获得呋喃它酮代谢物(AMOZ)的浓度。可视化凝胶检测柱检测呋喃它酮代谢物衍生物(NPAMOZ)结果如图2所示,随着NPAMOZ浓度升高,检测柱检测层的颜色从深到浅再到消色。当NPAMOZ浓度为20 μg/L时,检测柱的检测层几乎无色。多次重复试验后,确定了免疫凝胶检测柱的目测检测NPAMOZ的方法检测限为20 μg/L。
为验证方法的特异性,实验选取结构类似物硝基呋喃类兽药原药、代谢物、代谢物衍生物和衍生化试剂以及其他种类兽药进行交叉反应实验。
2.3 方法特异性
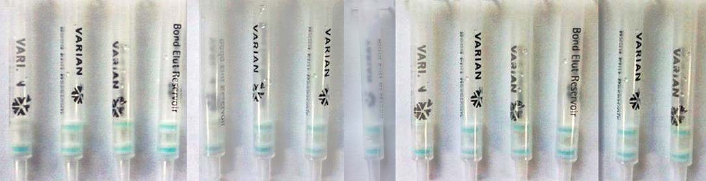
图3 与结构类似物的交叉反应
Fig.3 Cross-reactivity with analogues
注:从左到右依次是:NPAMOZ、NPAOZ、NPAHD、NPSEM、呋喃它酮、呋喃唑酮、呋喃妥因、呋喃西林、AMOZ、AOZ、AHD、SEM、邻硝基苯甲醛、对硝基苯甲酸。NPAMOZ浓度为20 μg/L;呋喃它酮浓度为100 μg/L;AMOZ浓度为300 μg/L;其他浓度均是1000 μg/L。
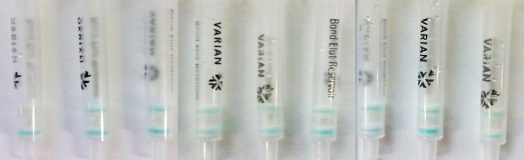
图4 与其它种类兽药的交叉反应
Fig.4 Cross-reactivity with other veterinary drugs
注:从左到右依次是:NPAMOZ;恩诺沙星;氯霉素;链霉素;青霉素;甲硝唑;磺胺二甲嘧啶;磺胺多辛;四环素。NPAMOZ浓度为20 μg/L,其他兽药浓度均是1000 μg/L。
如图3所示,方法与呋喃它酮原药有交叉反应,与呋喃它酮代谢物AMOZ有较低的交叉反应,而剩下其他药物,当其浓度达到1000 μg/L时,检测层仍会出现明显的蓝色,表明方法与其他硝基呋喃类原药、代谢物和代谢物衍生物没有交叉反应。而图4中,NPAMOZ浓度为20 μg/L时检测柱检测层颜色消失,其余兽药浓度为1000 μg/L时,检测层仍会出现明显的蓝色,表明方法与其他兽药也没有交叉反应。由图3和4可以看出方法有很好的特异性。
2.4 实际样品的检测
向8种动物源性食品中分别添加浓度为0 μg/kg、3 μg/kg的AMOZ标准品。添加后的样品经过1.4.6所提到的方法处理后直接用于凝胶检测柱检测,实验结果如图5所示。
由图5可以看出,当AMOZ添加浓度为0 μg/kg时,目测检测柱检测层呈现蓝色,为阴性结果。当AMOZ添加浓度为3 μg/kg时,检测柱检测层蓝色消失,为阳性结果。本研究建立的凝胶检测柱方法检测动物源性食品时的样品检测限为3 μg/kg。
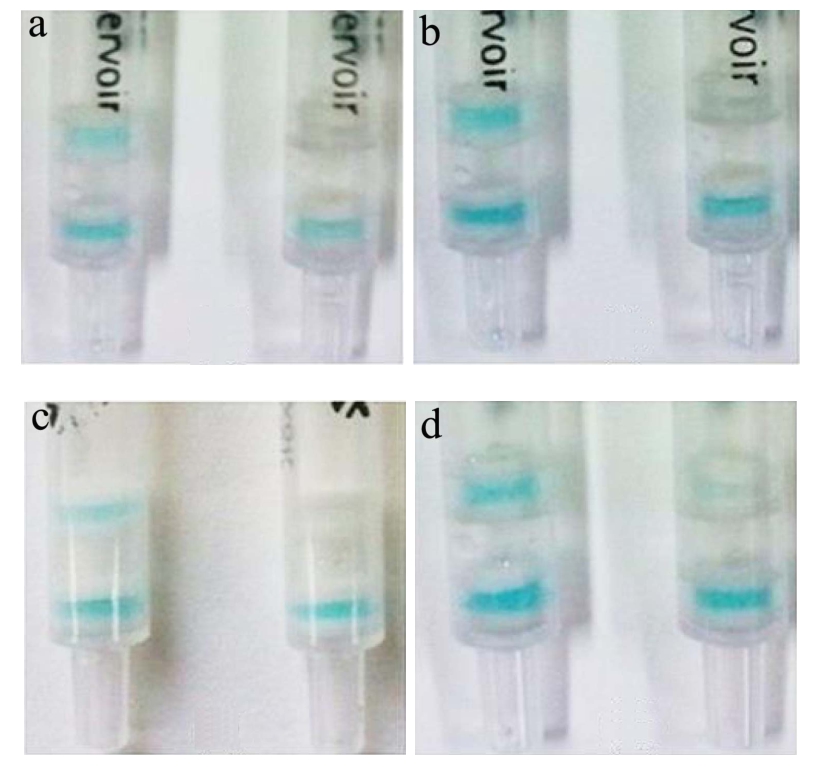
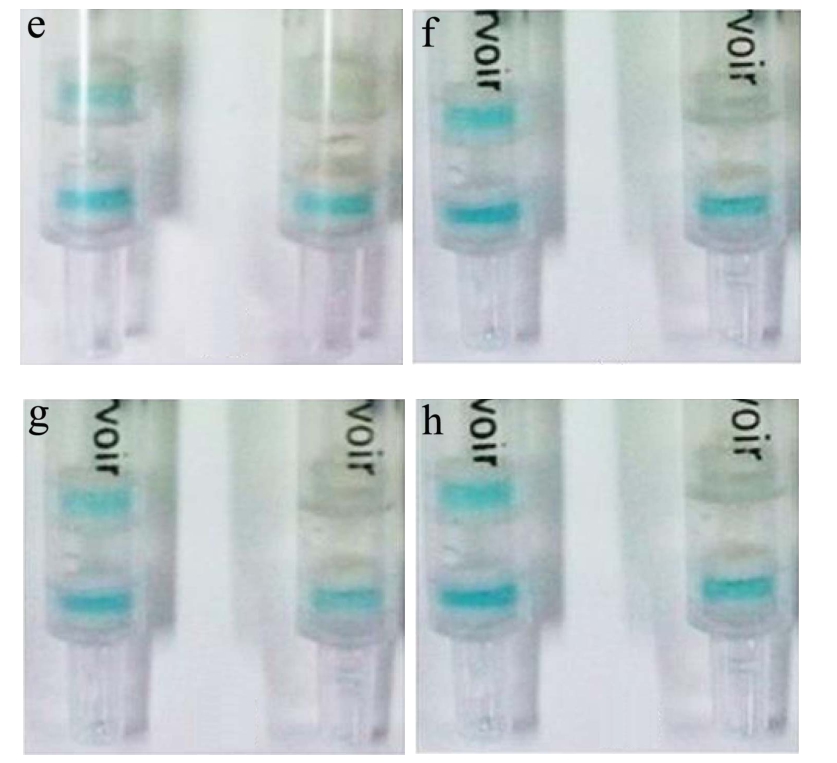
图5 可视化凝胶检测柱检测动物源性食品中AMOZ
Fig.5 Detection of AMOZ in animal-derived foods using the visual gel detection column
注:a,牛肉;b,鲷鱼;c,虾肉;d,鸡肉;e,猪肉;f,鱿鱼;g,鸡肝;h,黄花鱼;AMOZ添加浓度分别为:0和3 μg/kg。
本文建立了一种可视化快速检测动物源性食品中呋喃它酮代谢物残留的新型免疫凝胶柱方法。针对动物源性食品,呋喃它酮代谢物AMOZ的检测限为3 μg/kg。方法特异性好,操作简单,无需借助仪器,目测即可得出结果,整个检测过程可以在10 min内完成,适用于大量样品中呋喃它酮代谢物残留的快速筛查。
参考文献:
[1] Mc Cracken R J, Van Rhijn J A, Kennedy D G. Transfer of nitrofuran residues from parent broiler breeder chickens to broiler progeny [J]. British Poultry Science, 2005, 46(3): 287-292
[2] 黄宣运,李冰,蔡友琼,等.高效液相色谱法同时测定水产品中4种硝基呋喃原药残留[J].分析试验室,2013,32(2):44-49
HUANG Xuan-yun, LI Bing, CAI You-qiong, et al. Determination of four nitrofuran residues in aquatic products using high performance liquid chromatography [J]. Chinese Journal of Analysis Laboratory, 2013, 32(2): 44-49
[3] Galeano Díaz T, Guiberteau Cabanillas A, Acedo Valenzuela M I, et al. Determination of nitrofurantoin, furazolidone and furaltadone in milk by high performance liquid chromatography by electrochemical detection [J]. Journal of Chromatography A, 1997, 764(2): 243-248
[4] 徐英江,任传博,田秀慧,等.海产品中硝基呋喃类原药的超高效液相色谱串联质谱测定[J].分析测试学报,2010,29(4): 327-330
XU Ying-jiang, REN Chuan-bo, TIAN Xiu-hui, et al. Determination of nitrofurans in sea foods by ultra-high performance liquid chromatography tandem mass spectrometry [J]. Journal of Instrumental Analysis, 2010, 29(4): 327-330
[5] 华正罡,冯静,伊萍.超高效液相色谱-串联质谱法测定鸡肉中硝基呋喃类药物残留[J].中国卫生检验杂志,2014,24(11): 1556-1559
HUA Zheng-gang, FENG Jing, YI Ping. Determination of nitrofurans residues in chicken by UPLC-MS /MS [J]. Chin. J. Health Lab. Tec., 2014, 24(11): 1556-1559
[6] Verdon E, Couedor P, Sanders P. Multi-residue monitoring for the simultaneous determination of five nitrofurans (furazolidone, furaltadone, nitrofurazone, nitrofurantoine, nifursol) in poultry muscle tissue through the detection of their five major metabolites (AOZ, AMOZ, SEM, AHD, DNSAH) by liquid chromatography coupled to electrospray tandem mass spectrometry-in-house validation in line with commission decision 657/2002/EC [J]. Analytica Chimica Acta, 2007, 586(1-2): 336-347
[7] Yu Wen-hui, Chin Tzong-shean, Lai Hong-thih. Detection of Nitrofurans and their metabolites in pond water and sediments by liquid chromatography (LC)-photodiode array detection and LC-ion spray tandem mass spectrometry [J]. International Biodeterioration Biodegradation, 2013, 85(11): 517-526
[8] Kim D, Kim By, Hyung S W, et al. An optimized method for the accurate determination of nitrofurans in chicken meat using isotope dilution-liquid chromatography/mass spectrometry [J]. Journal of Food Composition and Analysis, 2015, 40(31): 24-31
[9] 吕月霞,王瑞,黄登宇,等.呋喃它酮代谢物直接竞争化学发光酶免疫分析法的建立[J].食品工业科技,2015,36(22):71-75,86
LV Yue-xia, WANG Rui, HUANG Deng-yu, et al. Development of a direct competitive chemiluminescent enzyme immunoassay for detection of furaltadone metabolite [J]. Science and Technology of Food Industry, 2015, 36(22): 71-75, 86[10] XU Zhen-lin, SHEN Yu-dong, SUN Yuan-Ming, et al. Novel hapten synthesis for antibody production and development of an enzyme-linked immunosorbent assay for determination of furaltadone metabolite 3-amino-5-morpholinomethyl-2-oxazolidinone (AMOZ) [J]. Talanta, 2013, 103(2): 306-313
[11] DAI Jin-bo, XU Zhen-lin, LIU Feng-yin, et al. Determination of furaltadone metabolite in fish by chemiluminescence enzyme immunoassay [J]. Chinese Journal of Analytical Chemistry, 2015, 43(6): 871-875
[12] 杨典原,吕月霞,李亚楠,等.化学发光酶免疫法检测呋喃它酮代谢物残留[J].畜牧与兽医2016,48(4):112-115
YANG Dian-yuan, LV Yue-xia, LI Ya-nan, et al. Competitive chemiluminescent enzyme immunoassay for detection of furaltadone metabolite [J]. Animal Husbandry & Veterinary Medicine, 2016, 48(4): 112-115
Study of a Gel-based Immunoassay Method for the Rapid Visual Detection of Furaltadone Metabolites
Abstract:A new method using an immuno-affinity column for the detection of metabolites of the veterinary drug furaltadone (AMOZ) was established in this study, and was applied for the rapid visual detection of AMOZ residues in animal-derived foods. Measurement was conducted in a standard solid phase extraction cartridge (1 mL) that consisted of a detection layer, containing anti-furaltadone metabolite antibody-coupled gel, and a quality control layer with anti-HRP antibody-coupled gel. The sample extract was pre-mixed with the enzyme-labeled antigen and the mixture was added to the detection column. Based on the direct competitive immuno-reaction and the HRP enzymatic reaction, qualitative analysis was performed according to the presence and strength of color, and the content of AMOZ was determined semi-quantitatively. The whole procedure was completed within 10 min, and the limit of detection of the gel-based detection column for the detection of furaltadone metabolite derivatives (NPAMOZ) was 20 μg/L. The visual detection limits of this method for the detection of AMOZ in animal-derived foods (beef, snapper, chicken, shrimp, pork, squid, chicken liver, and yellow croaker) were 3 μg/kg. This gel-based visual immunoassay method has high accuracy and good specificity and is easy to use; it is suitable for the rapid detection of AMOZ residues in a large number of animal-derived food samples.
Key words:furaltadone metabolites; gel column; visual detection; animal-derived food
文章篇号:1673-9078(2017)5-277-281
DOI:10.13982/j.mfst.1673-9078.2017.5.044
收稿日期:2016-06-29
基金项目:国家国际科技合作专项项目(2014DFR30350);“十二五”科技支撑计划(2013BAD18B11)