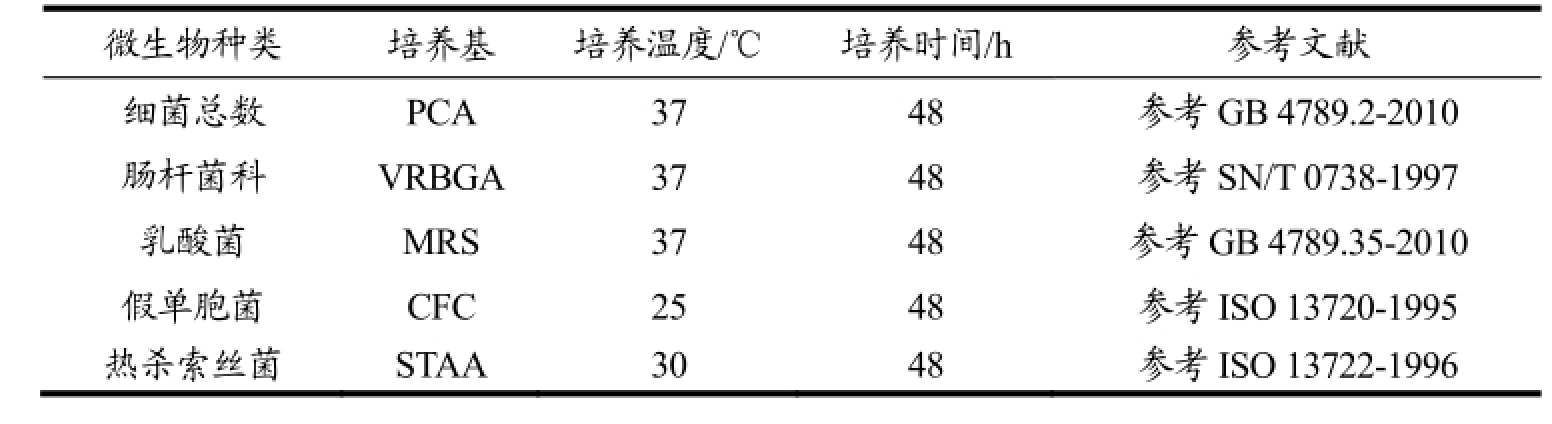
表1 微生物选择性培养基及培养条件
Table 1 Selective media and incubation conditions for different bacteria
摘要:本研究的目的是通过测定挥发性代谢化合物的变化来预测冷鲜黄羽肉鸡中微生物的动态变化。样品用托盘包装,置于-1 ℃和4 ℃贮藏,进行感官评价、微生物计数(细菌总数、肠杆菌科、乳酸菌、假单胞菌和热杀索丝菌)和挥发性代谢化合物分析。通过顶空固相微萃取气相色谱-质谱联用技术共得到61种化合物,为了同时反映两种温度下冷鲜黄羽肉鸡的腐败情况,将含量很低或未在两种条件下同时检出的物质剔除,最后共得到24种化合物。通过主成分分析得出:描述新鲜肉的指标有:2-丁酮、2-辛基-1-十二烷醇、十一烷、十二烷、己酸乙酯、辛酸乙酯、丁酸茴香酯、壬醛和三氯甲烷;描述腐败肉的指标有:乙偶姻、异戊醇、异戊醛、2-乙基己醇、2-氨基-6-苯甲酸、2-戊酮、二甲基二硫和乙酸乙酯。通过最小偏二乘法回归分析,发现这17种化合物可有效预测不同微生物数量。
关键词:冷鲜黄羽肉鸡;肉质腐败;代谢产物;顶空固相微萃取气相色谱-质谱联用;最小偏二乘法回归分析
肉腐败程度通常是通过感官分析或微生物分析进行评判。感官分析是指肉给消费者感官所提供的信息,主要包括外观和气味等最重要的质量属性,消费者以此来判断肉类质量和它的可接受性,因此气味在评判肉的品质中有着重要地位[1]。一般来说,新鲜肉带有血腥味和轻微的甜味,而腐败肉则是浓郁的甜味、黄油味、酸味和令人不愉快的腐臭味。而这些腐败肉所产生的气味主要是微生物的活动所产生的挥发性代谢产物,其来源主要是脂肪(尤其是磷脂)的氧化所产生的酸类、醛类、酮类和醇类物质[2]。基于气味与微生物之间的必然联系,有研究者提出通过对微生物的代谢产物进行定量和定性分析,可以综合全面地评估肉的品质[3]。而现有的分析代谢化合物技术主要有高效液相色谱技术、电子鼻嗅觉系统和HS/SPME-GC/ MS(顶空固相微萃取气相色谱-质谱联用)技术,其中HS/SPME-GC/MS因廉价、无需溶剂、操作简单、灵敏和良好的选择性等优点被广泛应用分析[4]。由于HS/SPME-GC/MS分析所得的组分过多,多元统计数据分析方法被广泛应用于食品等相关领域。多元统计数据分析方法主要包括主成分分析法(principal component analysis,PCA)、主成分回归分析法(principal component regression,PCR)和偏最小二乘法(partial least squares regression,PLS-R)。这些方法可以用于估计化学成分参数和感官特征之间关系,特别是当变量之间存在多重共线性时,其优势更明显[1]。
近年来有研究表明,肉在-1 ℃条件下组织中水分呈微结晶状态,既不严重影响肉的质构特性,又能更好地抑制微生物生长繁殖[5]。因此,本研究以黄羽肉鸡为研究对象,分别考察-1 ℃和4 ℃托盘包装条件下,黄羽肉鸡感官评价、微生物计数(细菌总数、肠杆菌科、乳酸菌、假单胞菌和热杀索丝菌)和挥发性代谢化合物的变化情况,以确定冷鲜黄羽肉鸡储存过程中需重点监控的的挥发性代谢化合物,并以这些挥发性代谢化合物为基础,通过PLS-R分析预测整个储存过程中不同微生物的数量,并对预测结果进行评价。
1.1 材料、试剂与仪器
材料:光鲜黄羽肉鸡购于广州市江丰实业股份有限公司。
试剂:氯化钠为分析纯,天津光复精细化工研究所;C5-C20正构烷烃混合标准品为色谱纯,德国CNW Technologies GmbH公司;2,4,6-三甲基吡啶标准品为色谱纯,Adamas Reagent公司;平板计数琼脂(PCA)和MRS培养基,广州环凯微生物有限公司;VRBGA培养基、STAA培养基和假单胞菌CFC选择性培养基,青岛海博生物技术有限公司。
仪器:气象色谱-质谱联用仪(6890N-5975B),美国Aglient公司;萃取头(75 μm CAR/PDMS),美国Supelco公司;超净工作台(SW-CJ-2D),苏州净化设备有限公司;分析天平(ALC-210.4),德国赛多利斯爱科勒公司;生化培养箱(LRH-250),上海一恒科学仪器有限公司;立式压力蒸汽灭菌器(LS-50LD),江阴滨江医疗设备有限公司;冰箱(BCD-648WDBE),海尔集团;磁力加热搅拌器(DF-Ⅱ),常州润华电器有限公司。
1.2 方法
1.2.1 样品分装
将光鲜黄羽肉鸡,于无菌条件下取鸡胸肉部分,切割成50 g左右的小块,然后置于经紫外灯灭菌的吸塑托盘中,并用PE保鲜膜(氧气透过率:18800 cm3/(m2·24 h·atm);透湿量:23 g/(m2·24 h))封口,分别置于-1 ℃和4 ℃条件下贮藏12 d,每隔2 d取样进行微生物分析、感官评价和挥发性代谢化合物测定。
1.2.2 微生物分析
无菌条件下准确称取-1 ℃和4 ℃下储存的光鲜黄羽肉鸡鸡肉25 g(n=3),用无菌剪刀剪碎,加入225 mL灭菌生理盐水中,扎紧口置于摇床上(200 r/min)振荡30 min。然后按10倍递增稀释到所需稀释度,然后进行平板计数,主要检测细菌总数、肠杆菌科、乳酸菌、假单胞菌和热杀索丝菌,具体的选择性培养基和培养条件如表1所示。
表1 微生物选择性培养基及培养条件
Table 1 Selective media and incubation conditions for different bacteria

1.2.3 感官评价
储藏期间,对每次取样的肉进行感官测定。评定小组由10位实验室工作人员组成(5男5女),每人都进行相同的感官评价培训,在评定时对人员进行隔离后打分。在煮熟前进行颜色和气味的评判,煮熟后进行口感滋味的评判。评分共分为5个等级,分别为1分、1.5分、2分、2.5分和3分。1分表示新鲜;1.5分表示二级鲜肉,一般体现在红度下降黄度上升,但气味和味道无明显变化,还是可以接受的;2分表示肉的色泽气味已处于变质,但煮熟后还可以接受;>2说明肉无论煮前还是煮后均已经完全变质[6]。
1.2.4 挥发性代谢化合物测定
1.2.4.1 HS-SPME提取挥发性代谢化合物
样品绞碎后称取2 g置于15 mL顶空样品瓶中,再依次加入5 mL、25%氯化钠、100 μL 2,4,6-三甲基吡啶标准品,拧紧盖子。然后40 ℃水浴15 min,将老化后的75 μm CAR/PDMS萃取头插入样品瓶顶空部分,于40 ℃吸附30 min,吸附结束后上机测定。
1.2.4.2 GC-MS操作条件
色谱条件:采用DB-5MS毛细管色谱柱(30 m×0.32 mm i.d.1 μm)对挥发性代谢化合物进行分离。起始柱温40 ℃,保持3 min;以6 /min℃升至80 ℃,无保留,以10 /min℃升至240 ℃,保留7 min。进样口温度250 ℃;载气He,不分流,流量0.8 mL/min;压力35 kPa;检测温度240 ℃。
质谱条件:离子源温度200 ℃,电离温度EI,电子能量70 eV,灯丝电流15 μA,扫描质量范围为33~450 u。
定性分析:通过计算机检索并根据NIST11.L谱库和Wiley谱库匹配,记录相似度大于85的物质[7]。
定量分析:以2,4,6-三甲基吡啶为内标,根据内标物的量、样品各组分的峰面积与内标峰面积的比值,计算样品中各挥发性组分的含量[8]:
式中,Ω为添加入检测样品的2,4,6-三甲基吡啶内标的质量(μg);Ai为各挥发性组分的峰面积;A为内标物质的峰面积;m为被测样品的质量(g)。
1.3 数据处理
测得的挥发性代谢化合物先进行主成分分析,选取重要的挥发性代谢化合物,然后通过最小偏二乘法回归分析预测微生物的数量。预测结果的通过偏差度(bias factor,Bf)、准确度(accuracy factor,Af)、均方根误差(root mean square error,RMSE)、预测值与真实值间的回归系数(R2)和百分比相对误差(relative error, RE)来评价。所有数据经Excel 2007和SPSS 17.0整理和处理后,通过Statistica 6.0和Unscrambler 9.7进行主成分分析和偏最小二乘法回归分析。
2.1 冷鲜黄羽肉鸡冷藏过程中微生物与感官品质变化
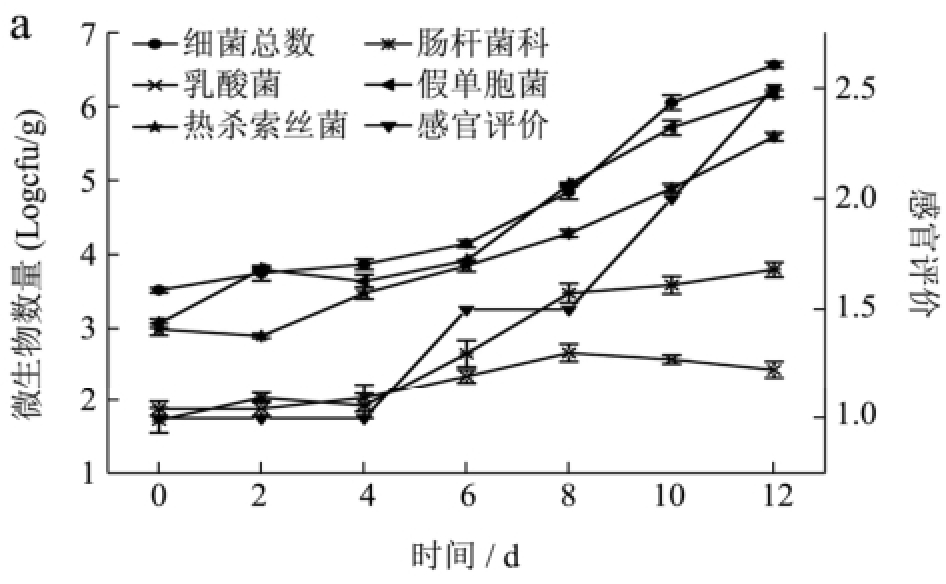
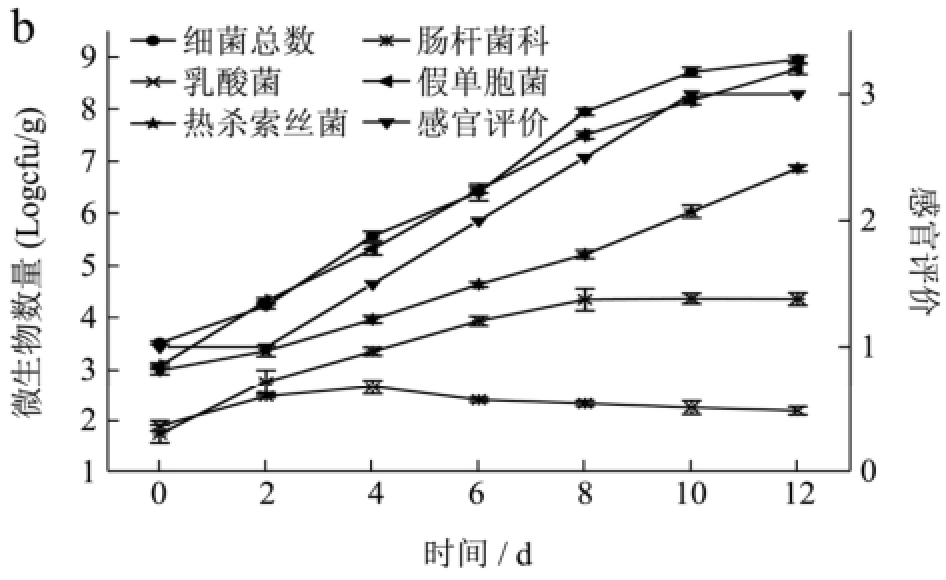
图1 -1 ℃和4 ℃储存条件下冷鲜黄羽肉鸡中微生物的生长曲线与感官评价
Fig.1 Growth curves and sensory evaluation of the chilled yellow broiler chicken meat stored at -1 and 4 ℃
注:a为-1 ℃条件;b为4 ℃条件。
黄羽肉鸡储存期间微生物与感官评价的变化如图1。从图中可看出,冷鲜黄羽肉鸡在储藏过程中的优势腐败菌主要是假单胞菌和热杀索丝菌,肠杆菌科的生长速率较慢,而乳酸菌前期生长速率较慢后期呈下降趋势。这是由于低温条件下,假单胞菌、热杀索丝菌、不动杆菌、嗜冷杆菌属和莫拉克斯氏菌属等是肉及肉制品中主要的优势菌[9]。在好氧条件下,假单胞菌的生长率较其它菌有明显的优势,而且这种优势随着贮存温度降低而增加[10]。其它菌种由于不能与假单胞菌竞争有效的氧分子而使生长受到抑制,与此同时低氧分压有助于兼性厌氧的热杀索丝菌的生长[11],因此在有氧条件下,冷却肉在贮存后期的腐败菌主要是假单胞菌和热杀索丝菌。乳酸菌和大肠杆菌由于假单胞菌和热杀索丝菌的大量繁殖而在竞争中处于劣势,生长缓慢。此外,微生物的初始菌量相对较少对其成为优势菌也有着重要影响[12]。在图1中可以看出假单胞菌属及热杀索丝菌属的初始菌量均较高分别达到3.06 (Log cfu/g)和2.98 (Log cfu/g),而肠杆菌科与乳酸菌则较低,分别为1.72 (Log cfu/g)和1.88 (Log cfu/g)。
通过感官评价分析,发现随着温度的升高,冷鲜黄羽肉鸡的货架期逐渐变短。与4 ℃条件相比,-1 ℃条件有利于延长冷鲜黄羽肉鸡的货架期。
2.2 冷鲜黄羽肉鸡冷藏过程中挥发性代谢化合物变化
表2 冷鲜黄羽肉鸡储存过程中挥发性代谢化合物含量的变化
Table 2 Changes in the volatile metabolite contents in chilled yellow broiler chicken meat during storage (ng/g)

注:a代表感官评分1,新鲜;b代表感官评分1.5,二级鲜肉;c代表感官评分2,煮前外观已变质,煮后尚可接受,货架期结束;d代表感官评分2.5,完全变质。
通过HS/SPME-GC/MS技术,对-1 ℃和4 ℃条件下冷鲜黄羽肉鸡的整个储存过程中挥发性成分进行检测,共得到61种挥发性代谢化合物。为了建立全局模型,将含量很低或未在两种条件下检出的物质剔除,最后共得到24种物质(表2)。这些物质包括醇类物质6个、烷烃类4个、酮类3个、醛类4个、酯类5个、硫化物和含氮化合物各1个。
从表2中得到,在冷鲜黄羽肉鸡肉储存期间,异戊醇、2-乙基己醇和癸醛在储存期间呈上升趋势;1-辛烯-3醇、2-辛醇、壬醛和己醛在初期呈上升趋势,进入完全腐败阶段后呈下降趋势;乙醇在储存期间基本保持稳定。醇类和醛类物质主要是由于微生物代谢葡萄糖、氨基酸和脂肪产生,其中醇类物质可能来源于蛋白质的水解和氨基酸的代谢[13],而饱和醛类主要来自于脂肪的氧化[14]。具体参与产生这两类化合物的微生物有:乙醇(Shewanella baltica,Pseudomonas spp.,Moraxella,Leuconostoc gasicomitatum)[15,16],异戊醇(Pseudomonas fragi,Pseudomonas spp.,Brochothrix thermosphacta)[13,17,18],1-辛烯-3醇(P. fragi,Carnobacterium maltaromaticum,B. thermosphacta,Pseudomonas spp.,Carnobacterium spp.,Rahnella aquatilis)[13,17,19],2-乙基己醇(B. thermosphacta,P. fragi,Pseudomonas spp.,Enterobacteriaceae,C. maltaromaticum)[13,17,20,21],异戊醛(Pseudomonas spp.,Streptococcus liquefaciencs,Enterobacter agglomerans,P. fragi,B. thermosphacta, Aeomonas hydrophila)[22,23],己醛(B. thermosphacta,L. gasicomitatum,C. maltaromaticum)[13,16,19],癸醛(C. maltaromaticum,P. fragi)[17,19],壬醛(L. gasicomitatum,B. thermosphacta,P. fragi,C. maltaromaticum)[13,16,17,19]。
酮类化合物中,乙偶姻和2-戊酮呈上升趋势;2-丁酮在初期呈上升趋势,进入完全腐败阶段后呈下降趋势。酮类物质的产生可能是脂肪的氧化、酶的α、β氧化或通过革兰氏阴性细菌的其它代谢途径(如:烷烃的降解和醇脱氢)[20,21,24]。具体参与产生酮类化合物的微生物有:乙偶姻乙偶姻(L. gasicomitatum,Pseudomonas spp.,S. putrefaciens,Moraxella,B. thermosphacta,Enterobacteriaceae,Lactic acid bacteria,C. maltaromaticum,P. fragi,Carnobacterium spp.)[15~18,21],2-丁酮(L. gasicomitatum,Pseudomonas spp.,S. putrefaciens,Moraxella,Clostridium algidicarnis,Hafnia alvei,Lactobacillus fuchuensis,Lactobacillus sp.)[15,16,25],2-戊酮(C. maltaromaticum, L. gasicomitatum)[16]。
酯类化合物中,除乙酸乙酯在储存过程中呈上升趋势,其它酯类化合物均呈下降趋势。酯类化合物可能是在微生物酯酶的作用下,各种醇和羧酸发生酯化反应而产生[26]。具体参与产生酯类化合物的微生物有:乙酸乙酯(P. fragi,Pseudomonas spp.,Moraxella,S. putrefaciens)[15,17],丁酸乙酯(P. fragi,B. thermosphacta,Pseudomonas spp.,R. aquatilis,Carnobacterium spp.)[17,18,27],己酸乙酯(B. thermosphacta,P. fragi,Serratia proteamaculans,Pseudomonas spp.,Carnobacterium spp.)[17,18,20,21,27],辛酸乙酯(Carnobacterium spp.,P. fragi,Pseudomonas spp.,R. aquatilis,Carnobacterium spp.)[17,18,20,21,27]。
二甲基二硫和2-氨基-6-甲基苯甲酸呈上升趋势。当肉及肉制品在有氧条件下储存,且假单胞菌成为优势菌时,假单胞菌会利用葡萄糖、氨基酸代谢产生大量含氮化合物和硫化物[12]。参与产生二甲基二硫的微生物有:Pseudomonas spp.,S. putrefaciens,Moraxella,P. fragi,Pseudomonas fluorescens,Enterobacteriaceae,S. Liquefaciencs,H. alvei,Lactobacillus curvatus,Lactobacillus sakei[17,21,27]。
综上所述,菌落总数、肠杆菌科(Enterobacteriaceae)、乳酸菌(Lactic acid bacteria)、假单胞菌(Pseudomonas spp.)和热杀索丝菌(B. thermosphacta)会参与相应的醇类、酮类、醛类和酯类等物的产生或分解。初步判定这些挥发性代谢化合物可以预测各微生物。
2.3 挥发性代谢化合物的主成分分析结果
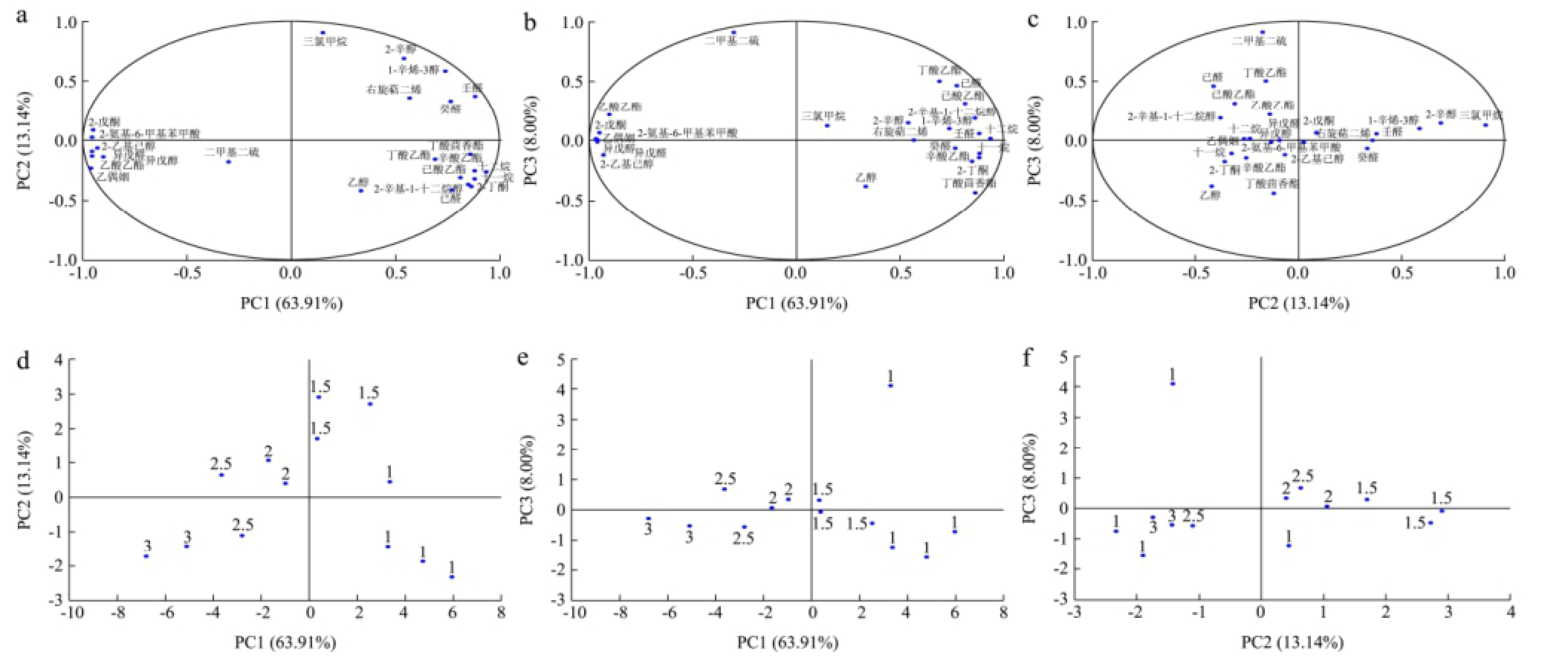
图2 提取的3个主成分的载荷图与得分图
Fig.2 Loadings and scores plots of the 3 extracted principal components
注:a、b和c为载荷图;d、e和f为得分图(标记有感官评分)。
以24种挥发性代谢化合物为变量进行主成分分析,分析过程中抽取特征值为0.6,共得到5个主成分(累计方差为94.33%),其中前3个主成分的累计方差为85.05%,能够较为全面的反应所有信息,各主成分之间的载荷图及得分图如图2所示。
从图2a中可知,PC1(横坐标)左侧物质与PC1呈负相关,右侧物质与PC1呈正相关;PC2(纵坐标)上方物质与PC2呈正相关,下方物质与PC2呈负相关。从图2b中可知,PC3(纵坐标)上方物质与PC3呈正相关,下方物质与PC3呈负相关。
通过分析选取负荷>0.8的挥发性代谢化合物,并结合图中a~f可得,在所有物质中,2-丁酮、2-辛基-1-十二烷醇、十一烷、十二烷、己酸乙酯、辛酸乙酯、丁酸茴香酯、壬醛和三氯甲烷可能与可接受的肉质呈正相关,而乙偶姻、异戊醇、异戊醛、2-乙基己醇、2-氨基-6-苯甲酸、2-戊酮、二甲基二硫和乙酸乙酯可能与腐败的肉质呈正相关,这些主要物质可以作为冷鲜黄羽肉鸡储藏过程中的重点监控指标。此外,这些物质将被用于PLSR分析,来估测微生物数量。
2.4 微生物数量的估测
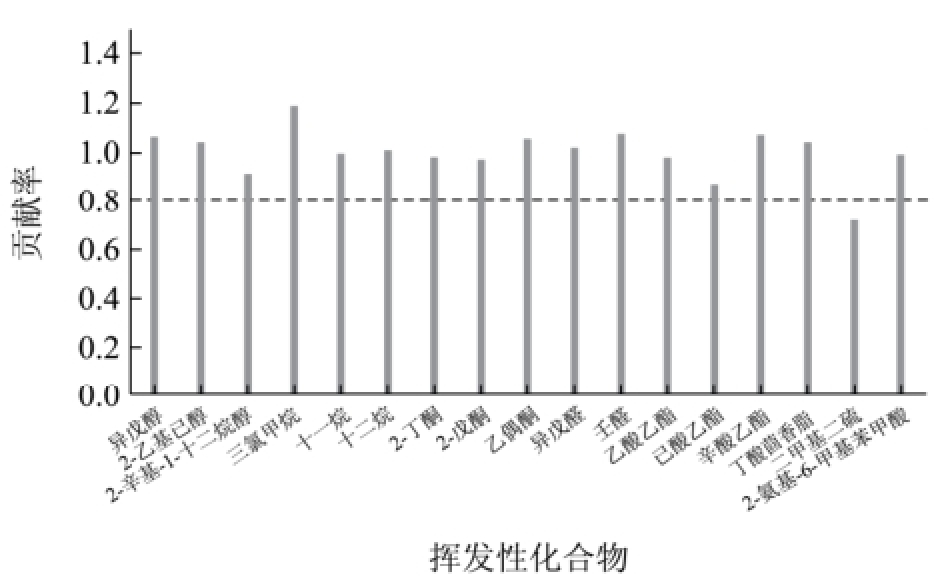
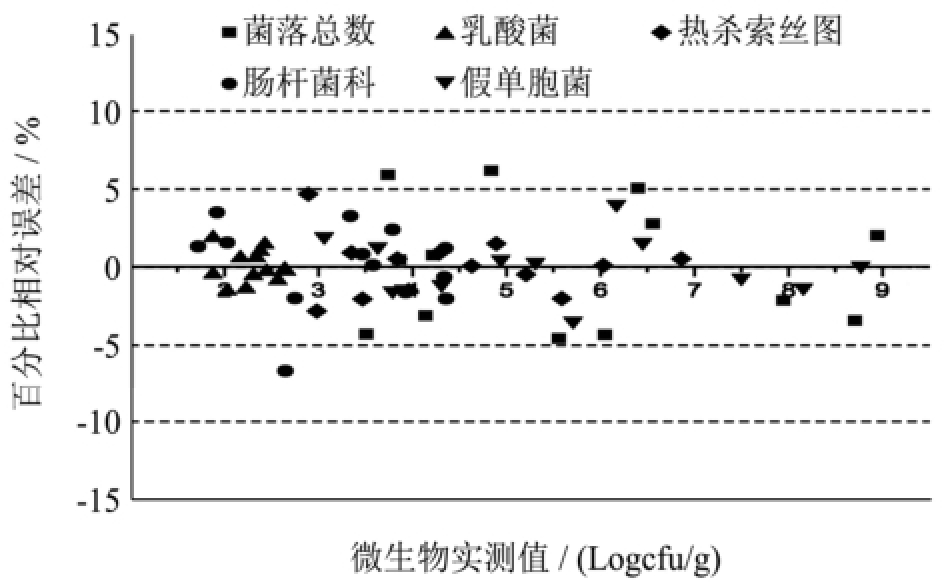
图3 变量重要性图和各微生物预测值与实测值之间的百分比相对误差图
Fig.3 Variable importance plot and percent relative errors between observed and estimated counts for various microbes
对主成分分析所得的主要挥发性代谢化合物数据标准化处理,以17种挥发性代谢化合物为自变量和各微生物数量为因变量,进行最小偏二乘法回归分析(PLS-R)。为获得较优的模型,分析中选取交叉验证。从变量重要性图(图3)发现二甲基二硫贡献率较低,故删除该化合物,以其它化合物来预测不同微生物数量。
利用PLS-R分析来估计细菌总数、肠杆菌科、乳酸菌、假单胞菌和热杀索丝菌的数量,结果较为理想。从图4可以看出,各微生物的预测值与实测值之间的线性关系很好,二者之间很接近,且回归系数均在0.98以上,其中优势菌假单胞菌和热杀索丝菌的回归系数为0.9962和0.9965(表3)。
表3 通过PLS-R预测微生物数量的性能参数比较
Table 3 Comparison of performance indices for the estimation of microbial counts using PLS-R
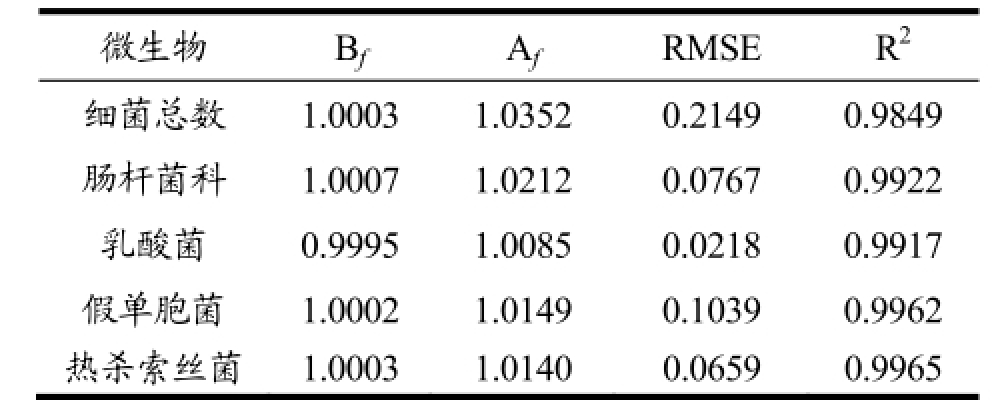
预测的结果理想与否,主要通过均方根误差(RMSE)、偏差度(Bf)、准确度(Af)以及相对误差(RE)来评价。其中Bf和Af越接近于1,预测效果越理想;对于Bf值一般认为在0.90~1.05的范围之内,预测效果较为理想;Bf值在0.70~0.90或者1.06~1.15范围之内,则预测结果是可以被接受的;如果Bf值大于1.15或者小于0.70,则说明预测失败[28]。从表3中可看出,Bf和Af均很接近于1,其中Af值的波动范围小于4%;Bf值0.90~1.05。所以从Bf值和Af值上看,各微生物的预测效果较为理想。就RMSE值来说,各微生物的RMSE值均较小,但细菌总数和假单胞菌的较大,表明预测值与实测值之间的差异相对较大,所以它们二者的预测效果没有其它微生物的效果好。从图3中的相对误差图可以看出,所有微生物的相对误差范围均小于10%,除细菌总数和肠杆菌科有个别相对误差大于5%,绝大部分处于5%的范围内。
综合各评价指标可知,通过PLS-R分析,挥发性代谢化合物可以较好地预测冷鲜黄羽肉鸡腐败过程中各微生物的数量,其中对热杀索丝菌和乳酸菌的预测效果最好,肠杆菌科、假单胞菌和细菌总数次之。
由上面的分析可知最小偏二乘法回归分析的预测效果比较理想。以往的微生物预测主要通过测定微生物数量,然后利用数学模型(如:修正的Gompertz模型、Baranyi模型及修正的Logistic模型等)或人工神经网络进行预测,其所能反映的信息相对较少。而本实验将挥发性代谢化合物与微生物预测进行了有效的结合,微生物数量的变化可以反映相应的代谢化合物的积累与消耗,反过来代谢化合物的变化可以反映微生物的生长趋势等现象。所以本实验可以对于微生物的预测提供一个新的思路和方向。
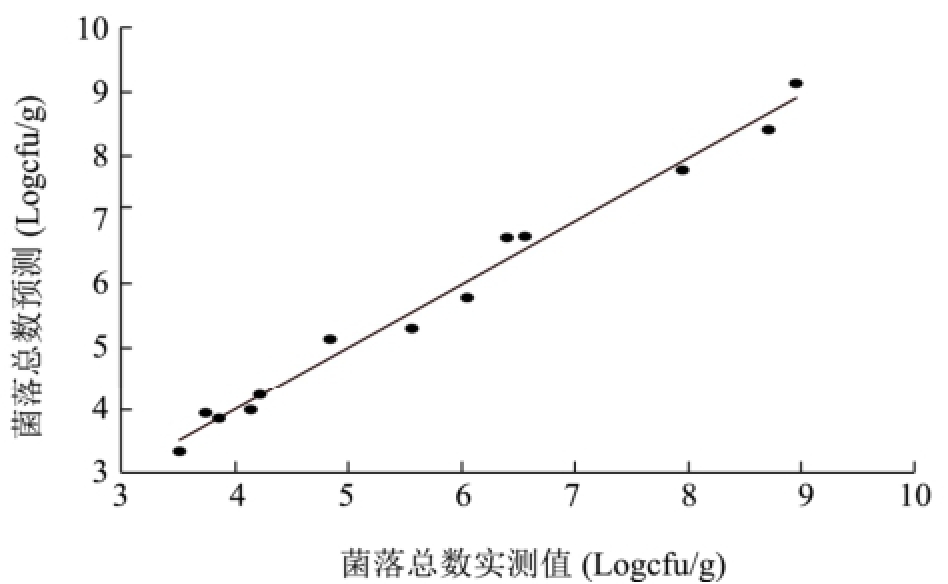
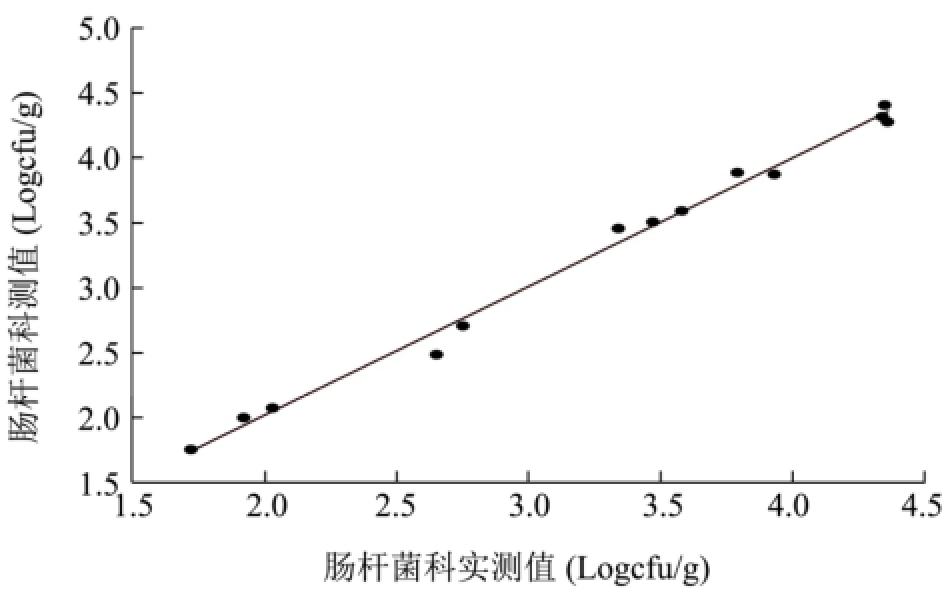
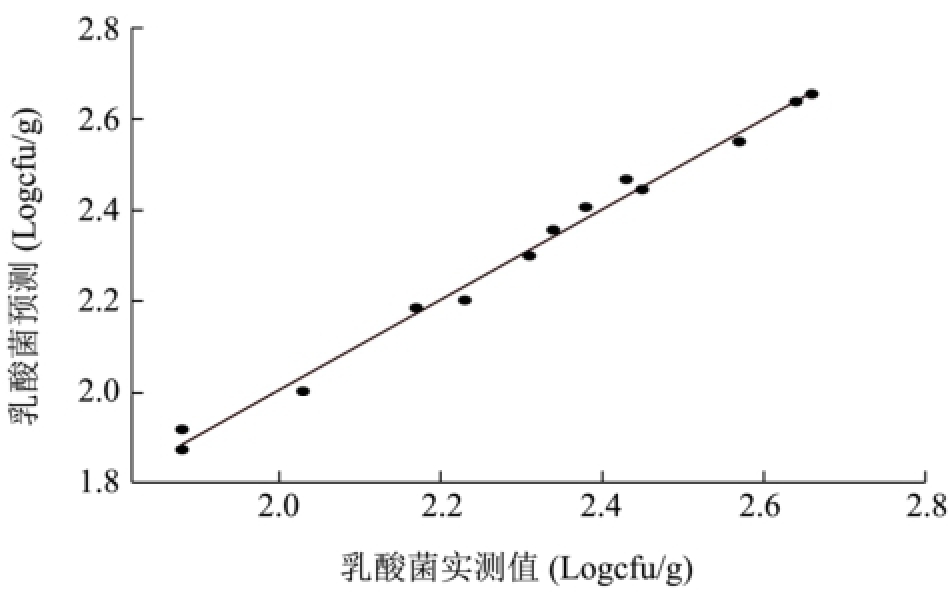
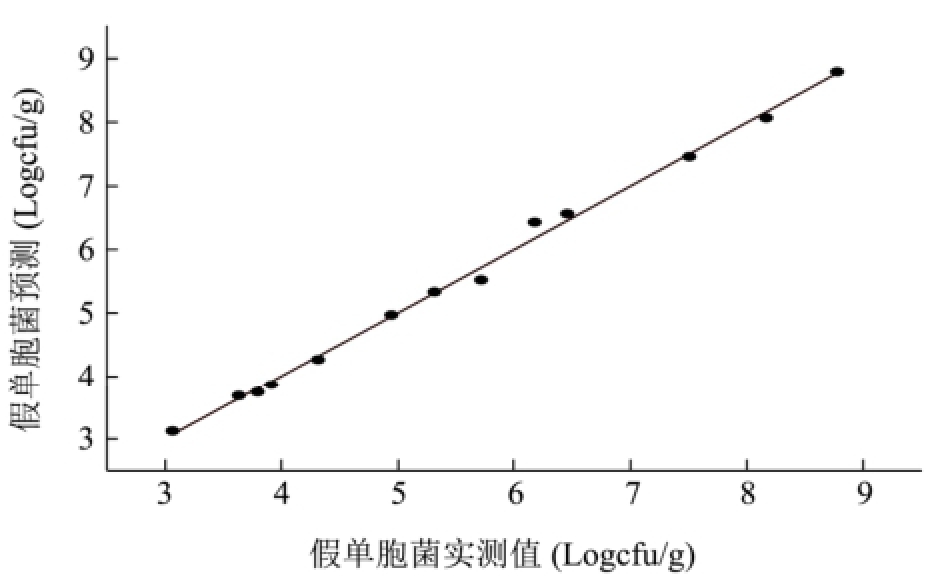

图4 各微生物预测值与实测值之间关系
Fig.4 The relationship between observed and estimated values of microorganisms
本研究通过HS/SPME-GC/MS技术,在冷鲜黄羽肉鸡-1 ℃和4 ℃的整个储存过程中,共检测出持续变化的挥发性代谢化合物24种(包括醛类、醇类、酯类、酮类、烷烃类和含氮含硫化合物)。对这些物质进行主成分分析,得到17种主要物质可以作为冷鲜黄羽肉鸡储藏过程中的重点监控指标。将这17种物质和微生物之间通过PLSR分析,发现在删除二甲基二硫后,其它16中挥发性代谢化合物能很好地预测冷鲜黄羽肉鸡储存过程中不同微生物的变化,其中对热杀索丝菌和乳酸菌的预测效果最佳。
参考文献:
[1] Saraiva C, Oliveira I, Silva J, et al. Implementation of multivariate techniques for the selection of volatile compounds as indicators of sensory quality of raw beef [J]. Journal of Food Science and Technology, 2014, 52(6): 3887-3898
[2] Estévez M, Morcuende D, Ventanas S, et al. Analysis of volatiles in meat from Iberian pigs and lean pigs after refrigeration and cooking by using SPME-GC-MS [J]. Journal of Agricultural and Food Chemistry, 2003, 51(11): 3429-3435
[3] Mikš-Krajnik M, Yoon Y-J, Yuk H-G. Detection of volatile organic compounds as markers of chicken breast spoilage using HS-SPME-GC/MS-FASST [J]. Food Science and Biotechnology, 2015, 24(1): 361-372
[4] Bhattacharjee P, Panigrahi S, Lin D, et al. A comparative qualitative study of the profile of volatile organic compounds associated with Salmonella contamination of packaged aged and fresh beef by HS-SPME/GC-MS [J]. Journal of Food Science and Technology, 2011, 48(1):1-13
[5] Farouk M M, Kemp R M, Cartwright S, et al. The initial freezing point temperature of beef rises with the rise in pH: A short communication [J]. Meat Science, 2013, 94(1): 121-124
[6] Argyri A A, Doulgeraki A I, Blana V A, et al. Potential of a simple HPLC-based approach for the identification of the spoilage status of minced beef stored at various temperatures and packaging systems [J]. International Journal of Food Microbiology, 2011, 150(1): 25-33
[7] Domínguez R, Gómez M, Fonseca S, et al. Effect of different cooking methods on lipid oxidation and formation of volatile compounds in foal meat [J]. Meat Science, 2014, 97(2): 223-230
[8] 龙斌,王锡昌,张凤枰,等.同时蒸馏萃取-气相色谱-质谱联用分析养殖南方大口鲶肌肉挥发性风味成分[J].食品科学,2013,34(24):188-192
LONG Bin, WANG Xi-chang, ZHANG Feng-ping, et al. Analysis of volatile flavor compounds of farmed silurus meridionalis chen meat by simultaneous distillation extraction and gas chromatography-mass spectrometry [J]. Food Science, 2013, 34(24): 188-192
[9] Casaburi A, Piombino P, Nychas G J, et al. Bacterial populations and the volatilome associated to meat spoilage [J]. Food Microbiology, 2015, 45(2): 83-102
[10] 彭勇.冷却猪肉常见腐败微生物致腐能力的研究[D].北京:中国农业大学,2005
PENG Yong. Study on putrefaction potential of putrescence microorganism in chilled pork [D]. Beijing: China Agricultural University, 2005
[11] Dainty R H, Hibbard C M. Aerobic metabolism of brochothrix thermosphacta growing on meat surfaces and in laboratory media [J]. Journal of Applied Bacteriology, 1980, 48(3): 387-396
[12] Sun X D, Holley R A. Antimicrobial and antioxidative strategies to reduce pathogens and extend the shelf life of fresh red meats [J]. Comprehensive Reviews in Food Science and Food Safety, 2012, 11(4): 340-354
[13] Casaburi A, De Filippis F, Villani F, et al. Activities of strains of Brochothrix thermosphacta in vitro and in meat [J]. Food Research International, 2014, 62(8): 366-374
[14] Xie J, Sun B, Zheng F, et al. Volatile flavor constituents in roasted pork of mini-pig [J]. Food Chemistry, 2008, 109(3): 506-514
[15] Tsigarida E, Boziaris I S, Nychas G J E. Bacterial synergism or antagonism in a gel cassette system [J]. Applied and Environmental Microbiology, 2003, 69(12): 7204-7209
[16] Jääskeläinen E, Johansson P, Kostiainen O, et al. Significance of heme-based respiration in meat spoilage caused by Leuconostoc gasicomitatum [J]. Applied and Environmental Microbiology, 2012, 79(4): 1078-1085
[17] Ercolini D, Casaburi A, Nasi A, et al. Different molecular types of Pseudomonas fragi have the same overall behaviour as meat spoilers [J]. International Journal of Food Microbiology, 2010, 142(1): 120-131
[18] La Storia A, Ferrocino I, Torrieri E, et al. A combination of modified atmosphere and antimicrobial packaging to extend the shelf-life of beefsteaks stored at chill temperature [J]. International Journal of Food Microbiology, 2012, 158(3): 186-194
[19] Casaburi A, Nasi A, Ferrocino I, et al. Spoilage-related activity of Carnobacterium maltaromaticum strains in air-stored and vacuum-packed meat [J]. Applied and Environmental Microbiology, 2011, 77(22): 7382-7393
[20] Ercolini D, Russo F, Nasi A, et al. Mesophilic and psychrotrophic bacteria from meat and their spoilage potential in vitro and in beef [J]. Applied and Environmental Microbiology, 2009, 75(7): 1990-2001
[21] Ercolini D, Ferrocino I, Nasi A, et al. Monitoring of microbial metabolites and bacterial diversity in beef stored under different packaging conditions [J]. Applied and Environmental Microbiology, 2011, 77(20): 7372-7381
[22] Adams M R. The microbiology of meat and poultry [J]. International Journal of Food Science & Technology, 1998, 33(2): 193-194
[23] Dainty R H, Edwards R A, Hibbard C M. Spoilage of vacuum-packed beef by a Clostridium sp [J]. Journal of the Science of Food and Agriculture, 1989, 49(4): 473-486
[24] Leroy F, Vasilopoulos C, Van Hemelryck S, et al. Volatile analysis of spoiled, artisan-type, modified-atmospherepackaged cooked ham stored under different temperatures [J]. Food Microbiology, 2009, 26(1): 94-102
[25] Hernández-Macedo M, Contreras-Castillo C, Tsai S, et al. Gases and volatile compounds associated with microorganisms in blown pack spoilage of Brazilian vacuum-packed beef [J]. Letters in Applied Microbiology, 2012, 55(6): 467-475
[26] Insausti K, Beriain M, Gorraiz C, et al. Volatile compounds of raw beef from 5 local Spanish cattle breeds stored under modified atmosphere [J]. Journal of Food Science, 2002, 67(4): 1580-1589
[27] Casaburi A, Di Martino V, Ercolini D, et al. Antimicrobialactivity of Myrtus communis L. water-ethanol extract against meat spoilage strains of Brochothrix thermosphacta and Pseudomonas fragi in vitro and in meat [J]. Ann Microbiol., 2015, 65(2): 841-850
[28] 周康,杨兆锞,刘书亮,等.鲤鱼中腐败希瓦氏菌生长模型的建立和验证[J].食品科学,2015,36(15):147-150
ZHOU Kang, YANG Zhao-ke, LIU Shu-liang, et al. Modeling and validation of the growth of Shewanella putrefaciens from Cyprinus carpio [J]. Food Science, 2015, 36(15): 147-150
Prediction of Changes in Microbial Composition of Chilled Yellow Broiler Chicken Meat Using HS/SPME-GC/MS Technology
Abstract:The dynamic changes in microbial composition of chilled yellow broiler chicken meat were predicted by assessing changes in volatile metabolic compounds. Samples were packed in trays and stored at -1 and 4 ℃, and sensory evaluation, microbial counts (total viable counts of Enterobacteriaceae spp., lactic acid bacteria, Pseudomonas spp., and Brochothrix thermosphacta), and volatile metabolic compounds were analyzed. Sixty-one compounds were identified in headspace/solid phase microextraction-gas chromatography/mass spectroscopy analysis. To reflect spoilage of chilled yellow broiler chicken under two temperature conditions simultaneously, substances at very low or non-detectable amounts were removed, after which 24 compounds were obtained. The results of principal component analysis showed that 2-butanone, 2-octyl-1-dodecanol, undecane, dodecane, ethyl caproate, ethyl caprylate, anisyl butyrate, 1-nonanal, and trichloromethane were descriptive indicators of freshness, whereas acetoin, 3-methyl-1-butanol, 3-methyl-l-butyraldehyde, 2-ethylhexanol, 2-amino-6-methylbenzoic acid, 2-pentanone, dimethyl disulfide, and ethyl acetate were descriptive indicators of spoilage. Partial least squares regression analysis revealed that these 17 compounds could effectively predict the counts of different microorganisms.
Key words:chilled yellow broiler chicken meat; meat spoilage; metabolites; headspace/solid phase microextraction-gas chromatography/mass spectroscopy; partial least squares regression
文章篇号:1673-9078(2017)3-295-303
DOI:10.13982/j.mfst.1673-9078.2017.3.044
收稿日期:2016-01-07
基金项目:广州市产学研协同创新重大专项(201508020019),广东省促进科技服务业发展计划项目(2013B040400009,2014B040404059),广东省农业厅科技项目(2016LM3167);广东省现代农业产业共性技术创新团队项目(2016LM2151)