
图1 T1脂肪酶的表达与纯化电泳图
Fig.1 SDS-polyacrylamide gel electrophoresis patterns of the expression and purification of T1 lipase
注:M表示Marker;1表示发酵液;2表示可溶蛋白;3表示纤维素吸附的CBD-T1;4表示酶切后的T1与CBD标签;5表示酶切后的3C蛋白酶与CBD标签;6表示T1纯化蛋白。
摘要:本文研究了非离子型、阳离子型、阴离子型以及两性离子型表面活性剂对T1脂肪酶活力的影响。采用不同浓度的表面活性剂对T1脂肪酶进行处理,再以对硝基苯酚月桂酸酯作为底物,测定处理后的酶活变化。研究发现,低浓度的非离子型表面活性剂对T1都有激活作用,使其相对酶活提高50%到150%。当非离子型表面活性剂的浓度超过其临界胶束浓度,T1的活力受到不同程度的抑制,其中吐温80的抑制作用最为明显。阳离子型(CTAB)、阴离子型(N-L与SDS)和两性离子型(SB3-14)表面活性剂都对脂肪酶的酶活有强烈的抑制作用,可能是因为离子型表面活性剂的带电基团与蛋白质表面的带电氨基酸产生强烈的电荷相斥作用,导致蛋白变性而失去活力。T1脂肪酶是一类具有工业应用价值的耐热脂肪酶,研究不同类型的表面活性剂对其活力的影响,对于在不同目的下选择使用适合的表面活性剂具有重要意义。
关键词:T1脂肪酶;表面活性剂;临界胶束浓度;激活
脂肪酶是一类具有多功能的生物催化剂,它能在油-水界面上催化脂肪的水解、醇解、酸解、酯化和酯交换等反应[1],并且具有较高的底物专一性、区域选择性和对映选择性,已被广泛应用于食品、制药、造纸以及洗涤剂等行业[2~4]。在食品工业中,脂肪酶常用于改良油脂的性质、油脂脱胶、增加乳品和肉类的风味,以及合成婴儿配方奶粉中的人乳脂类似物[2,5,6]。
在许多脂肪酶的反应体系中都会添加表面活性剂,不同的表面活性剂对脂肪酶的活力有提高或抑制的作用。比如解脂耶氏酵母脂肪酶YLLIP2(Yarrowia lipolytica lipase)的水解活力在低浓度的非离子型、阴离子型和两性表面活性剂的条件下都有不同程度的提高,而高浓度的表面活性剂则对嗜热真菌脂肪酶TlL(Thermomyces lanuginosus lipase)的水解活力有抑制作用[7]。在反应体系中添加能提高脂肪酶活力的表面活性剂,可以提高反应效率,缩短反应时间。对脂肪酶具有抑制作用的表面活性剂则具有潜在的药用价值,比如抑制消化系统中的脂肪酶以达到减肥效果,甚至用于治疗2型糖尿病和粥样动脉硬化等疾病[8]。此外,脂肪酶可作为洗涤剂的添加剂以增强去污能力,对去除食品加工设备的残留油脂和衣物中的油性污渍更为有效[9]。因此,研究不同类型的表面活性剂对脂肪酶活力的影响,对于在不同目的下选择使用适合的表面活性剂具有重要意义。
T1脂肪酶是一种来源于Geobacillus zalihae的嗜碱性耐热脂肪酶,由于它具有较强的耐热性和较高的催化活力,因此在许多工业中有较好的应用前景[10]。目前还未见有文献报道不同类型的表面活性剂对T1脂肪酶活力的影响。本文研究了非离子型、阳离子型、阴离子型以及两性表面活性剂对T1脂肪酶水解活力的影响,为将来该酶在食品、制药和洗涤剂等不同行业中的应用提供指导。
1.1 原料与试剂
含有pET-23a-CBD-T1质粒的大肠杆菌Bl21表达菌株由本课题组提供,3C蛋白酶由本实验室表达并制备[11]。蛋白胨和酵母提取物购自英国Oxoid公司;对硝基苯酚(pNP)、对硝基苯酚月桂酸酯(pNPD)购于Sigma-Aldrich公司;氨苄抗生素、诱导剂IPTG、二硫苏糖醇(DTT)、曲拉通X-100、吐温20和吐温80购于生工生物工程(上海)股份有限公司;十六烷基三甲基溴化铵(CTAB)、N-月桂酰基氨酸钠(N-L)、十二烷基硫酸钠(SDS)和3-磺丙基十四烷基二甲甜菜碱(SB3-14)购于上海阿拉丁生化科技股份有限公司;其他试剂均为市售国产分析纯。主要仪器有瑞士Tecan公司Infinite F50酶标仪和超声破碎仪等。
1.2 实验方法
1.2.1 T1脂肪酶的表达与纯化
1.2.1.1 菌株培养及菌体破碎
取含有pET-23a-CBD-T1质粒的大肠杆菌Bl21表达菌株,按2%接种量接种到5 mL的LB培养基中(含100 µg/mL氨苄青霉素),于37 ℃、200 r/min条件下过夜培养得到种子液。按10%接种量于500 mL LB培养基(含氨苄)中于37 ℃、200 r/min扩大培养,待OD600达到0.6~0.8时,加入诱导剂IPTG(终浓度0.2 mM),温度降到20 ℃继续培养18~22 h。将诱导培养后的细胞在4 ℃、10000 r/min下离心收集,并加入预冷的PBS缓冲液(pH 7.4)重悬,然后置于冰浴中超声破碎菌体,条件为功率250 W,脉冲4 s,暂停4 s,共15 min。将破碎后的菌液于4 ℃、10000 r/min离心得到上清液即为可溶蛋白。
1.2.1.2 酶的纯化
微晶纤维素经过磷酸酸化处理以及蒸馏水洗涤除去多余的磷酸,用于上一步所得CBD-T1可溶蛋白的纯化。将上一步所得上清液与经过处理的纤维素于4 ℃混匀1 h,经过低温高速离心得到吸附了CBD-T1的纤维素,并用预冷的PBS缓冲液洗去纤维素上非特异性结合的杂蛋白。
1.2.1.3 酶切CBD标签与电泳检测
向吸附了CBD-T1的纤维素中加入适量50 mM甘氨酸缓冲液(pH 9.0)、吸附在纤维素上的CBD-3C蛋白酶以及还原剂DTT(终浓度1 mM),混匀后室温酶切4 h。酶切后低温高速离心,所得上清液即为纯化后的T1蛋白。SDS-PAGE检测其纯度。
1.2.2 T1脂肪酶的酶活测定
用无水乙醇配制10 mM pNP标准液,分别取0~10 μL于96孔酶标板,用甘氨酸缓冲液(pH 9.0)补足至100 μL,然后于每个样品中加入100 μL、1% SDS溶液,振荡混匀后测定405 nm处的吸光值,得到吸光值与pNP浓度的标准曲线。测定活力时,每个样品依次加入80 μL甘氨酸缓冲液(pH 9.0)、10 μL、10 mM底物pNPD和10 μL酶液,于65 ℃反应5 min后,加入100 μL、1% SDS溶液终止反应。空白组采用经过煮沸灭活的酶液。将在一定条件下,单位时间内脂肪酶生成1 μmol对硝基苯酚所需的酶量为一个脂肪酶活力单位(U)。
1.2.3 表面活性剂对酶活的影响
在纯化后的T1脂肪酶中分别加入各种表面活性剂,使其最终浓度分别为0.0~10.0 mM,室温孵化10 min后,在65 ℃、50 mM甘氨酸缓冲液(pH 9.0)条件下测定酶活。以0.0 mM表面活性剂处理后的酶活为100%,计算经过其他浓度表面活性剂处理后的相对酶活。
1.2.4 数据统计分析
每组实验均设三个平行并重复三次,利用GraphPad 6.0软件对实验数据进行方差分析以及作图。当p<0.05时,差异性显著。
2.1 T1脂肪酶的表达与纯化

图1 T1脂肪酶的表达与纯化电泳图
Fig.1 SDS-polyacrylamide gel electrophoresis patterns of the expression and purification of T1 lipase
注:M表示Marker;1表示发酵液;2表示可溶蛋白;3表示纤维素吸附的CBD-T1;4表示酶切后的T1与CBD标签;5表示酶切后的3C蛋白酶与CBD标签;6表示T1纯化蛋白。
由本课题组所构建的pET-23a-CBD-T1质粒在目的蛋白T1的基因序列上游带有CBD (cellulose binding domain)标签,可以与纤维素进行特异性吸附,从而达到纯化目的蛋白的效果。3C蛋白酶可以特异性地切除CBD标签。T1脂肪酶的纯化效果如图1所示,所得目的蛋白纯度较高,可用于下一步的研究。
2.2 表面活性剂的选择
表1 表面活性剂的类型与性质
Table 1 Types and properties of the studied surfactants

表面活性剂的分子结构具有两亲性,一端为亲水基团,另一端为疏水基团。根据亲水基团的性质,可以把表面活性剂分为非离子型、阳离子型、阴离子型和两性离子型[12]。本研究所采用的表面活性剂,涵盖了表面活性剂各个类型(如表1所示)。在水溶液中,低浓度的表面活性剂可溶于水;当浓度逐渐增大,表面活性剂倾向于聚集并形成胶束,使得疏水性基团聚集于胶束内部,避免与极性的溶剂分子接触。表面活性剂开始形成胶束的浓度称为临界胶束浓度(critical micelles concentration,CMC),是表面活性剂的一个重要性质[13]。
2.3 非离子型表面活性剂对T1脂肪酶酶活的影响
从图2可以看出,T1的酶活在较低浓度的非离子型表面活性剂条件下,活力都迅速提高;随着表面活性剂浓度的增加,活力则有不同程度的下降。在2.5 mM的曲拉通X-100条件下,T1的酶活达到最高,相对活力接近200%;随着曲拉通X-100的浓度提高,T1的活力稍有下降,在10 mM的浓度下仍保留150%的相对活力。曲拉通X-100对T1以及与T1同家族的脂肪酶BTL2的酶活影响十分类似[14]。脂肪酶BTL2的酶活在0.15~1.5 mM曲拉通X-100的条件下达到最高,相对活力接近200%。T1的酶活在1 mM吐温20的条件下达到最高,相对酶活接近250%。在0.005 mM吐温80的条件下,T1的相对酶活提高到150%;再随着吐温80浓度的增加,酶活迅速下降,达到平衡后相对酶活约为75%。
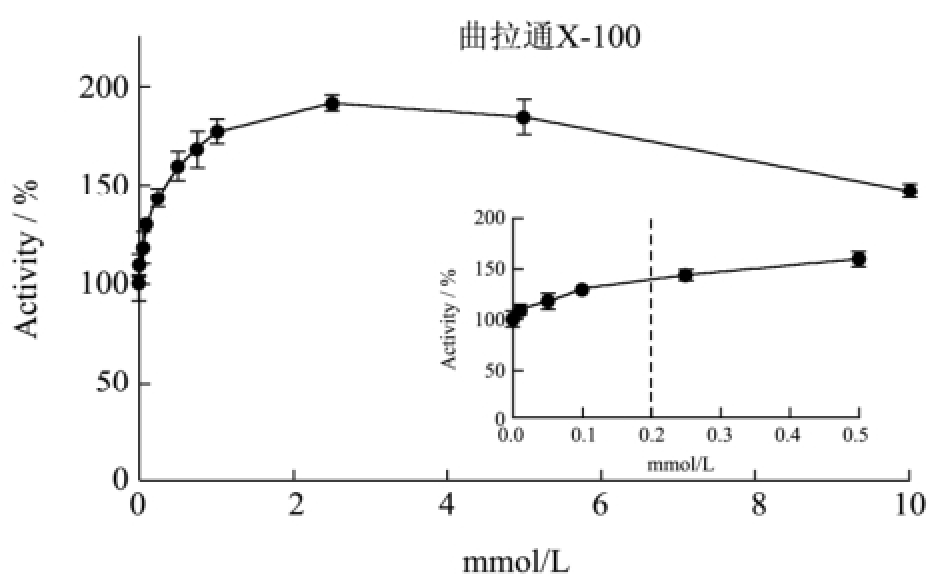
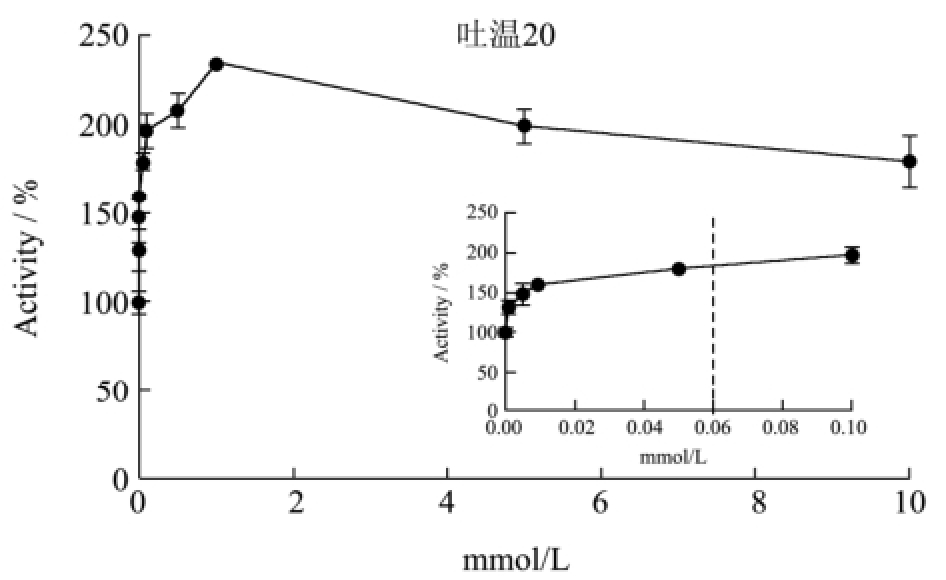
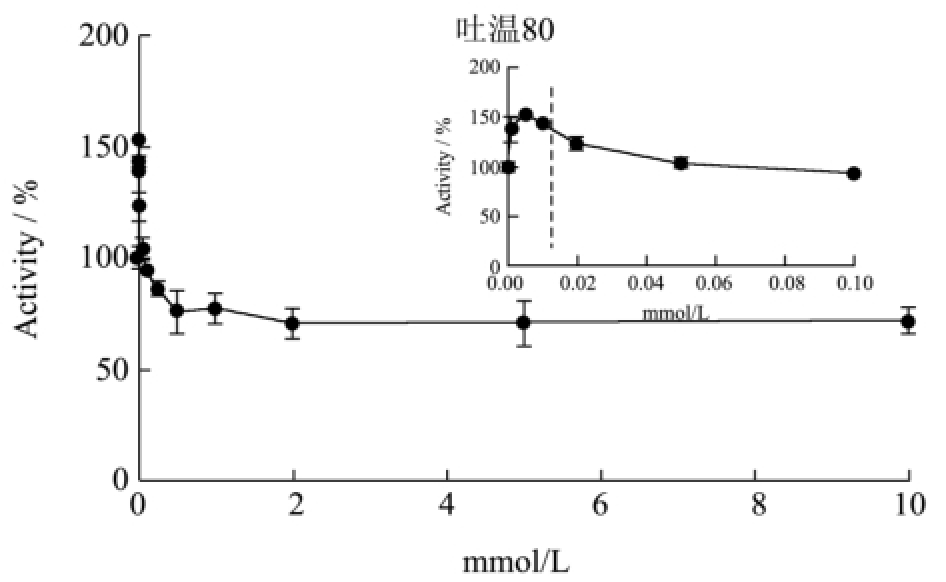
图2 非离子型表面活性剂对T1脂肪酶酶活的影响
Fig.2 Effects of nonionic surfactants on T1 lipase activity
注:虚线表示临界胶束浓度。
我们发现,非离子型表面活性剂在低于其临界胶束浓度的条件下,可以激活脂肪酶;在形成胶束后,非离子型表面活性剂对T1的酶活有不同程度的抑制作用,其中吐温80的抑制作用最为明显。Carrasco-López提出,非离子型表面活性剂在低浓度时可以与脂肪酶的疏水活性中心产生相互作用,帮助脂肪酶稳定在开放的构象,有利于底物进入活性中心以及产物的释放,因此脂肪酶的活力得到提高[14]。Hermoso解析了猪脂肪酶与非离子型表面活性剂四聚乙二醇单辛醚(TGME)的复合晶体结构,提出在高浓度的非离子型表面活性剂条件下,表面活性剂会进入脂肪酶的活性中心并与其紧密结合,使脂肪酶的活性中心被占据,而无法催化其他底物的水解反应,因此脂肪酶的活力受到抑制[15]。
2.4 阳离子型表面活性剂对T1脂肪酶酶活的影响

图3 阳离子型表面活性剂对T1脂肪酶酶活的影响
Fig.3 Effect of cationic surfactants on T1 lipase activity
注:虚线表示临界胶束浓度。
如图3所示,T1脂肪酶的酶活在低浓度的CTAB条件下迅速失活,当CTAB浓度达到临界胶束浓度即1.0 mM时,T1的相对活力仅为13%。由于阳离子型表面活性剂的亲水基团带有正电,因此可能会与酶分子表面带正电的氨基酸产生电荷排斥作用,导致酶的构象发生变化并且失去活力[16]。王靖等通过FTIR红外光谱发现牛血清白蛋白(BSA)经过高浓度的CTAB作用后,蛋白质的二级机构被破坏[17]。
2.5 阴离子型表面活性剂对T1脂肪酶酶活的影响如图4所示,阴离子型表面活性剂对T1脂肪酶的酶活都有抑制作用。N-L在较低浓度时已对T1的酶活产生抑制作用,随着N-L浓度的升高,酶活迅速降低;待抑制作用达到平衡时,残留的相对酶活约为35%。SDS抑制了约50%的酶活,但在0.01 mM的SDS条件下,T1的酶活有微量的提高。SDS是常见的蛋白质变性剂,其分子上的硫酸基团与蛋白质表面的带正电氨基酸可以紧密结合,而分子上的烷基则可以与蛋白质的疏水部分紧密结合,从而导致蛋白质发生变性[16]。比如牛血清蛋白在4 mM的SDS条件下会失活[18]。

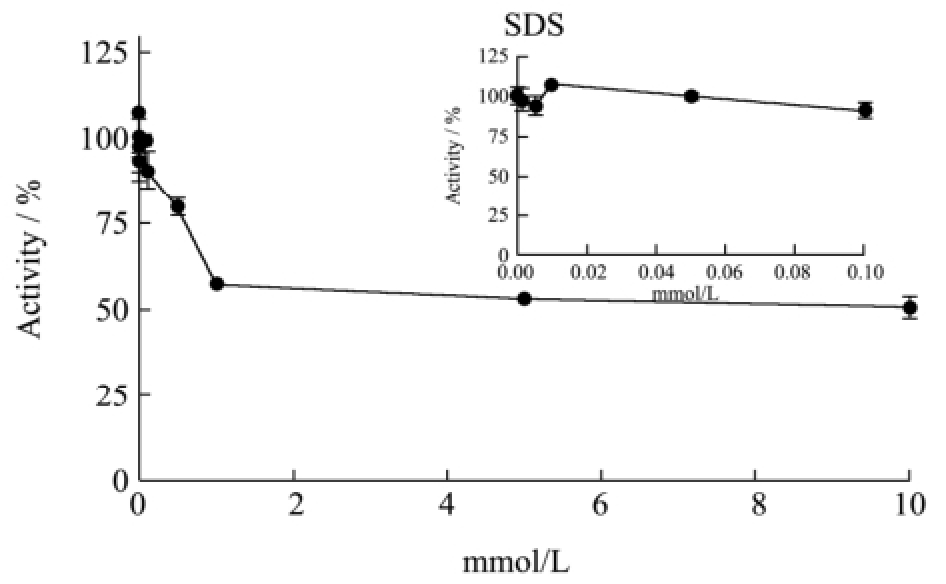
图4 阴离子型表面活性剂对T1脂肪酶酶活的影响
Fig.4 Effect of anionic surfactants on T1 lipase activity
注:虚线表示临界胶束浓度。
2.6 两性离子型表面活性剂对T1脂肪酶酶活的影响
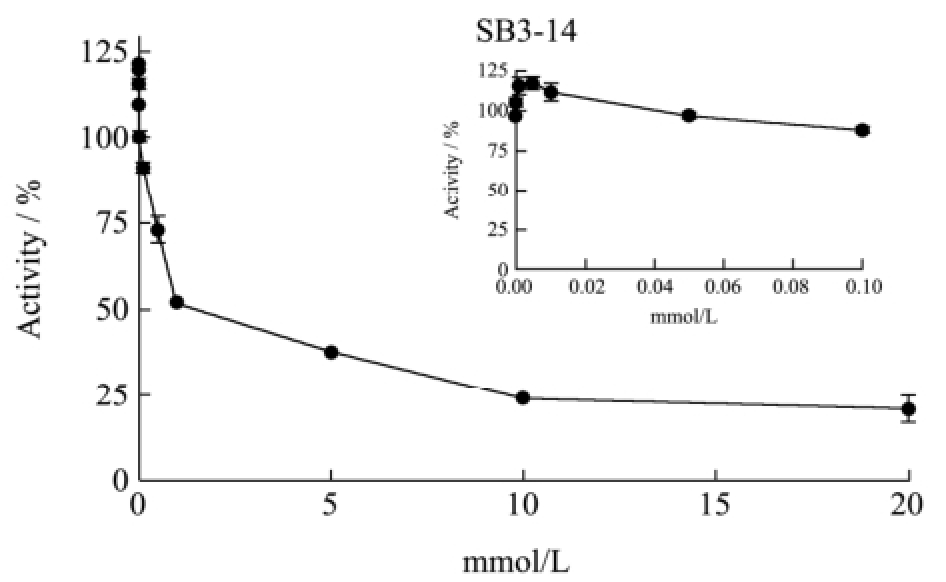
图5 两性离子型表面活性剂对T1脂肪酶酶活的影响
Fig.5 Effect of zwitterionic surfactants on T1 lipase activity
在较低浓度的两性离子型表面活性剂SB3-14条件下,T1脂肪酶的酶活稍有提高;随着SB3-14浓度的提高(大于临界胶束浓度0.1 mM),表面活性剂对T1的酶活产生较强的抑制作用(图5)。两性离子型表面活性剂Zwittergent3-12对嗜热真菌脂肪酶TlL也有类似的抑制作用[7]。通常离子型表面活性剂首先通过其带电基团与蛋白表面的带电氨基酸产生静电性结合,随后表面活性剂的疏水基团与蛋白的疏水部分产生协同性结合[19]。在低浓度的离子型表面活性剂条件下,两种结合作用可以帮助稳定酶分子的构象,还可以增加酶与底物的相互作用。随着表面活性剂浓度的提高,两种结合作用逐渐增强,则会导致酶的变性与失活[20,21]。
本文通过测定T1脂肪酶经过不同浓度的表面活性剂处理后的水解活力的变化,考察了各种表面活性剂对T1脂肪酶活力的影响。低浓度的非离子型表面活性剂对T1都有激活作用,能使相对酶活提高至150%到250%;当浓度超过表面活性剂的临界胶束浓度,T1的酶活有不同程度的抑制,其中吐温80的抑制作用最为明显。低浓度的阴离子型表面活性剂SDS和两性离子型表面活性剂SB3-14对T1的酶活有微弱的提高作用;总体来看,带有电荷的阳离子型(CTAB)、阴离子型(N-L、SDS)和两性离子型(SB3-14)表面活性剂都对脂肪酶的酶活有强烈的抑制作用,可能是因为表面活性剂的带电基团与蛋白质表面的带点氨基酸产生强烈的电荷相斥作用,导致蛋白质容易变性而失去活力。
参考文献:
[1] Houde A, Kademi A, Leblanc D. Lipases and their industrial applications [J]. Applied Biochemistry and Biotechnology, 2004, 118(1-3): 155-70
[2] Aravindan R, Anbumathi P, Viruthagiri T. Lipase applications in food industry [J]. Indian Journal of Biotechnology, 2007, 6(2): 141
[3] Pollard D J, Woodley J M. Biocatalysis for pharmaceutical intermediates: the future is now [J]. Trends Biotechnol., 2007, 25(2): 66-73
[4] Bajpai P. Application of enzymes in the pulp and paper industry [J]. Biotechnology Progress, 1999, 15(2): 147-57
[5] 杨继国,杨博,林炜铁.植物油物理精炼中的脱胶工艺[J].中国油脂,2004,29(2):7-10
YANG Ji-guo, YANG Bo, LIN Wei-tie. Degumming process of vegetable oils physical refining [J]. China Oils and Fats, 2004, 29(2): 7-10
[6] Qin X L, Huang H H, Lan D M, et al. Typoselectivity of crude Geobacillus sp. T1 lipase fused with a cellulose-binding domain and its use in the synthesis of structured lipids [J]. Journal of the American Oil Chemists' Society, 2014, 91(1): 55-62
[7] Aloulou A, Puccinelli D, De Caro A, et al. A comparative study on two fungal lipases from Thermomyces lanuginosus and Yarrowia lipolytica shows the combined effects of detergents and pH on lipase adsorption and activity [J]. Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids, 2007, 1771(12): 1446-56
[8] Delorme V, Dhouib R, Canaan S, et al. Effects of surfactants on lipase structure, activity, and inhibition [J]. Pharmaceutical Research, 2011, 28(8): 1831-42
[9] Hasan F, Shah A A, Hameed A. Industrial applications of microbial lipases [J]. Enzyme and Microbial Technology, 2006, 39(2): 235-51
[10] Leow T C, Rahman RNZRA, Basri M, et al. A thermoalkaliphilic lipase of Geobacillus sp. T1 [J]. Extremophiles, 2007, 11(3): 527-35
[11] Xu Y, Guo S, Wang W, et al. Enzymatic hydrolysis of palm stearin to produce diacylglycerol with a highly thermostable lipase [J]. European Journal of Lipid Science and Technology, 2013, 115(5): 564-70
[12] Helenius A, McCaslin D R, Fries E, et al. Properties of detergents [J]. Methods in Enzymology, 1979, 56(7): 34-49
[13] Bhairi S. A guide to the properties and uses of detergents in biology and biochemsitry [J]. Doc No CB0068-0892, 1997
[14] Carrasco-López C, Godoy C, de las Rivas B, et al. Activation of bacterial thermoalkalophilic lipases is spurred by dramatic structural rearrangements [J]. Journal of Biological Chemistry, 2009, 284(7): 4365-72
[15] Hermoso J, Pignol D, Kerfelec B, et al. Lipase activation by nonionic detergents the crystal structure of the porcine lipase-colipase-tetraethylene glycol monooctyl ether complex [J]. Journal of Biological Chemistry, 1996, 271(30): 18007-16
[16] Otzen D E. Protein unfolding in detergents: effect of micelle structure, ionic strength, pH, and temperature [J]. Biophysical Journal, 2002, 83(4): 2219-30
[17] 王靖,郭晨,梁向峰,等.阳离子表面活性剂CTAB对蛋白质二级结构的影响[J].光谱学与光谱分析,2006,26(7):65-66
WANG Jing, GUO Chen, LIANG Xiang-feng, et al. Effect of cationic surfactant cetyltrimethyl ammonium bromide on the secondary structure of protein [J]. Spectroscopy and Spectral Analysis, 2006, 26(7): 65-66[18] Kelley D, McClements D. Interactions of bovine serum albumin with ionic surfactants in aqueous solutions [J]. Food Hydrocolloids, 2003, 17(1): 73-85
[19] Yonath J, Blauer G. Protein-detergent interactions [J]. European Journal of Biochemistry, 1974, 41(1): 163-70
[20] Nozaki Y, Reynolds J A, Tanford C. The interaction of a cationic detergent with bovine serum albumin and other proteins [J]. Journal of Biological Chemistry, 1974, 249(14): 4452-9
[21] Reynolds J A, Herbert S, Polet H, et al. The binding of divers detergent anions to bovine serum albumin [J]. Biochemistry, 1967, 6(3): 937-47
Effect of Surfactants on T1 Lipase Activity
Abstract:T1 lipase was incubated with nonionic, cationic (CTAB), anionic (N-L and sodium dodecyl sulphate [SDS]), and zwitterionic (SB3-14) surfactants at different concentrations, and subsequent changes in enzymatic activity was measured using p-nitrophenyl dodecanoate as substrate. The results showed that nonionic surfactants at low concentrations activated T1 lipase, whose relative activity increased by 50% to 150%. Conversely, T1 lipase activity was inhibited to various degrees when the concentration of nonionic surfactants exceeded their critical micelle concentration, and the most significant inhibitory effect was observed with Tween 80. The cationic, anionic, and zwitterionic surfactants strongly inhibited T1 lipase activity, probably due to strong charge repulsions produced between the charged groups of the surfactant and the charged amino acids on the protein surface, which may have led to protein denaturation and inactivation. On the other hand, SDS and SB3-14 at low concentrations slightly activated T1 lipase. Since T1 lipase is a thermostable lipase with high industrial application value, it would be useful to further investigate the effects of different surfactants on T1 lipase activity to help select suitable surfactants for different purposes.
Key words:T1 lipase; surfactants; critical micelle concentration; activation
文章篇号:1673-9078(2017)3-179-183
DOI:10.13982/j.mfst.1673-9078.2017.3.027
收稿日期:2016-03-17
基金项目:国家自然科学基金资助项目(21406076);国家高技术研究发展计划(863项目)(2014AA091701)