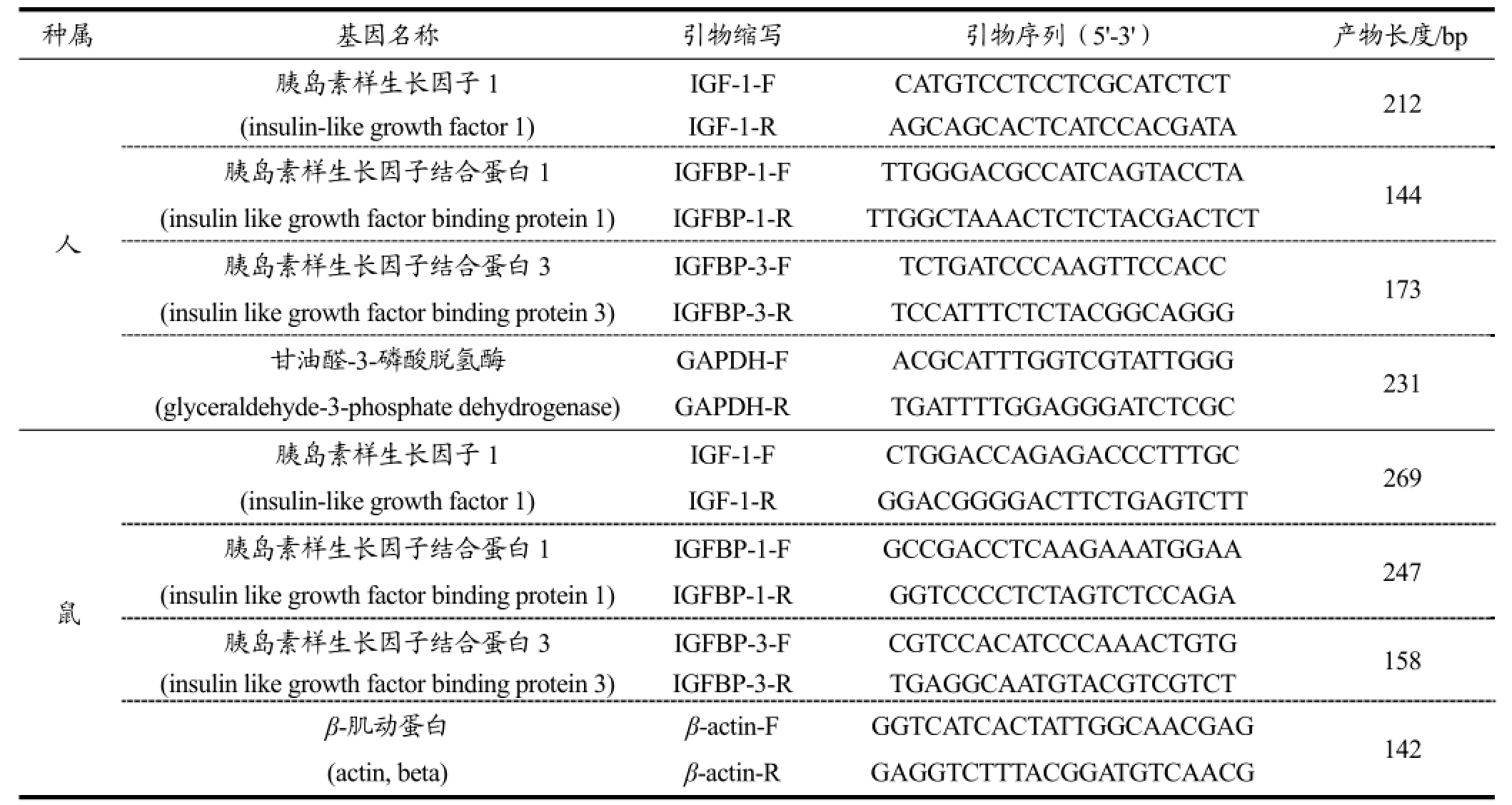
表1 PCR引物序列
Table 1 PCR primer sequences
摘要:为研究甘氨酸(Glycine,Gly)对肝脏IGF-1表达和分泌的影响,本文一方面采用不同浓度Gly离体处理HepG2肝细胞,另一方面采用小鼠尾静脉注射1.0 g/kg Gly和等摩尔Ala,0.5 h和1 h后采集血液、肝脏和肌肉样品。研究采用定量PCR检测了IGF-1以及IGFBPs基因表达水平的影响,同时运用Western blot法分析了肝细胞和肝脏生长激素受体通路(JAK2/STAT5)与肌肉IGF-I受体通路(ERK/Akt/mTOR)的变化。研究结果发现,不同浓度的Gly能剂量依赖性提高HepG2细胞IGF-1的蛋白和mRNA表达水平;1.0 g/kg Gly能显著提高小鼠血清中的IGF-1和白蛋白含量,且极显著提高肝脏IGF-1和IGFBP-3 mRNA水平,下调IGFBP-1 mRNA水平。细胞和活体试验均表明,Gly能够有效激活肝细胞和肝脏JAK2/STAT5信号通路,同时提高腓肠肌IGF-I受体信号通路磷酸化水平。这些研究说明甘氨酸可能直接提高肝脏生长激素受体信号通路敏感性,从而促进IGF-1的表达和分泌。研究结果为深入揭示甘氨酸的分子营养学功能和作用机制提供了实验依据。
关键词:甘氨酸;胰岛素样生长因子1;肝脏;HepG2细胞;信号通路
胰岛素样生长因子1(Insulin-like growth factor 1,IGF-1)是机体内重要的生长因子之一,在动物出生后的生长发育过程中具有重要的生理作用。大量研究表明,IGF-1作用于IGF-1受体后,一方面通过MAPK /ERK和Akt/mTOR信号通路促进蛋白质的合成[1,2],另一方面通过FoxOs抑制骨骼肌蛋白质的分解[3],从而促进骨骼肌的肥大和体重的增加[4]。
循环血液中的IGF-1主要由肝脏合成并分泌。生长激素(Growth Hormone,GH)是调控肝脏IGF-1表达与分泌的主要内分泌激素[5]。GH与生长激素受体(GH receptor,GHR)结合后形成二聚体并将信号由胞外传入到胞内,首先激活并募集胞质中的酪氨酸激酶2(Janus tyrosine kinase,JAK2),进而引起一系列转录因子如信号转导与转录激活子5(Signal transducers and activators of transcription,STAT5)磷酸化,磷酸化的STAT5形成二聚体并转位进入细胞核与IGF-1 mRNA转录调控元件结合,从而促进IGF-1的转录和翻译[6]。
除GH外,机体充足的营养也是维持IGF水平的另一重要因素。研究表明,在低营养状态下,肝细胞GHR和IGF-1基因的表达均受到抑制,循环血液中的IGF-1水平也相应降低。其中,已发现某些氨基酸,如精氨酸、脯氨酸、苏氨酸和色氨酸等,是调控肝细胞GHR和IGF-1 mRNA表达的重要营养性因素[7]。
甘氨酸是自然界中结构最简单的氨基酸。哺乳动物体内可以合成甘氨酸,但其合成水平远远不能满足机体的需要,需要外源添加一定量的甘氨酸才能达到动物的最优生长状况。因此,甘氨酸也被归类为营养性必需氨基酸[8]。有大量研究表明,甘氨酸在抑制氧化应激、抗炎和免疫调节及对抗肌肉萎缩和酒精性肝炎等方面发挥着重要作用[9,10]。但目前尚不清楚甘氨酸是否在肝脏IGF-1的表达和分泌调控中发挥作用。
因此,本文分别以HepG2细胞系和昆明小鼠为研究模型,探讨甘氨酸对肝脏IGF-1表达和分泌的细胞和活体效应,并分析肝脏JAK2/STAT5信号通路和肌肉蛋白质周转相关信号通路的变化。研究结果为进一步拓展甘氨酸的应用范围,解析其发挥作用的分子营养学机制提供实验基础。
1.1 试验材料
1.1.1 试验动物和细胞系
普通无特定病原体(Specific Pathogen Free,SPF)级昆明小鼠和基础饲料均购自广东省医学实验中心;HepG2肝细胞系为华南农业大学动物科学学院生理生化实验室保存(购于美国ATCC公司)。
1.1.2 主要试剂
甘氨酸和丙氨酸(美国Sigma公司);IGF-1放射免疫检测试剂盒(天津九鼎生物有限公司);Trizol(北京赛百胜基因技术有限公司);DNase I、Recombinant Ribonuclease Inhibitor(日本Takara公司);M-MLV Reverse Transcriptase(美国Promega公司);Realtime PCR Master Mix(日本Toyobo公司);磷酸化和非磷酸化JAK2、STAT5、mTOR、Akt、ERK、FoxO3a一抗(美国Cell Signaling公司);IGF-1一抗(北京Bioss公司);β-actin一抗和辣根过氧化物酶标记的山羊抗兔二抗(北京康为世纪生物科技有限公司);超敏发光液(江苏碧云天生物技术研究所);HG-DMEM培养基、双抗、胰酶和胎牛血清等(美国Gibco公司)。
1.2 试验方法
1.2.1 小鼠分组与处理
选取24只8周龄雄性昆明小鼠(体重46±2 g),单笼饲喂一周,自由饮水与采食。动物饲养环境温度控制在24 ℃,12 h/12 h光暗周期节律。小鼠据体重相等原则随机分为甘氨酸组(Gly)和丙氨酸组(Ala)两组,每组12只。小鼠试验前一周预注射2~3次生理盐水以适应注射应激。Gly组按照1.2 g/kg剂量腹腔注射甘氨酸,Ala组注射等摩尔丙氨酸。注射后0.5 h和1.0 h时每组各随机取6只,采集全血制血清,同时迅速分离腓肠肌和肝脏组织,液氮速冻后-80 ℃保存备用。
1.2.2 细胞培养
将HepG2细胞以4×104个/cm2的密度均匀接种于6孔板,含10% FBS、双抗(100 U/mL青霉素、100 U/mL链霉素)溶液的HG-DMEM培养基中,置于37 ℃、5% CO2、95%饱和湿度条件下的细胞培养箱中培养24 h左右。待细胞密度达到80%左右后将0、100、200、300和500 μM的甘氨酸溶液添加到新鲜培养基中处理细胞24 h并收板,用PBS溶液漂洗细胞板2次后-80 ℃保存备用。
1.2.3 Western Blotting检测蛋白表达
加入含1% PMSF的RIPA溶液裂解细胞或组织样(匀浆)30 min。收集裂解液,12000 r/min离心10 min,取上清液用BCA法测定总蛋白浓度。采用SDS-PAGE凝胶电泳分离蛋白,转膜后用含0.05% Tween-20的TBST溶液漂洗3次后,5%的脱脂牛奶室温封闭2 h;TBST洗膜,将膜置于TBST稀释后的一抗杂交液中(JAK2,1:2000;STAT5,1:2000;IGF-1,1:1000;p-mTOR,1:2000;mTOR,1:2000;p-ERK,1:3000;ERK,1:2000;p-FoxO3a,1:2000;FoxO3a,1:2000;p-4EBP1,1:2000;4EBP1,1:2000),4 ℃孵育过夜,次日室温孵育二抗(山羊抗兔IgG-HRP,1:5000)1 h;洗膜后用多色成相仪(美国ProteinSimple公司产品)曝光,图片用Image J软件进行条带灰度值分析,以β-actin作为内参蛋白校正并做相对表达量分析,数值以两者的灰度值比值表示。平行试验重复3次。
1.2.4 实时定量PCR
各目的基因的引物采用Premier 5.0软件设计(表1),由上海生工有限公司合成。总RNA的提取按试剂盒说明书进行。RNA用NanoDrop 2000核酸浓度测定仪测浓度,于-80 ℃保存备用。反转录步骤:以2 μg提取的总RNA为模板,用3 μL OligodT-18作为引物并用DEPC水将总体积补至8 μL,将上述反应液混合后在PCR仪中以70 ℃运行5 min,取出后迅速置于冰上冷却5 min;随后加入1 μL MMLV逆转录酶、4 μL MMLV 5× Buffer、1.5 μL dNTP Mixture、0.5 μL RNA酶抑制剂和5 μL DEPC水,混合后按照37 ℃、5 min,72 ℃、7 min,12 ℃的程序催化合成cDNA,合成的cDNA置于-20℃备用。采用Mx3005P实时荧光定量PCR(美国Stratagene产品)检测基因的表达量,以β-actin作为内参基因,荧光的采集与溶解曲线的制作按照荧光定量PCR仪操作说明进行。每个样品做2个平行,试验重复3次,目的基因的相对表达量用2-ΔΔCt法计算。
表1 PCR引物序列
Table 1 PCR primer sequences

1.3 数据分析
使用Graphpad Prism 6.0软件制作数据图,采用SPSS 17.0软件进行统计分析,组间差异采用单因素方差分析(one-way ANOVA)处理并进行多重比较。试验结果以平均值±标准误(means±SEM)表示。p<0.05为差异显著,p<0.01为差异极显著。
2.1 甘氨酸对肝细胞IGF-1及其结合蛋白表达的影响
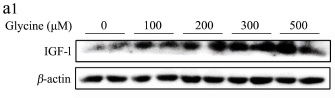
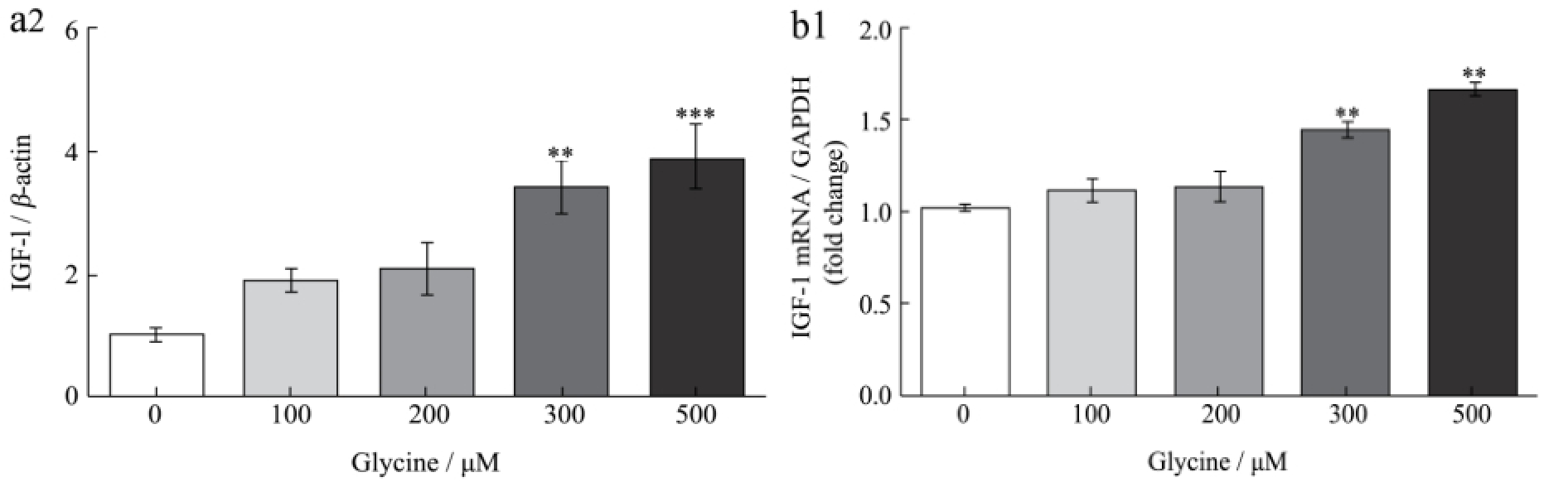
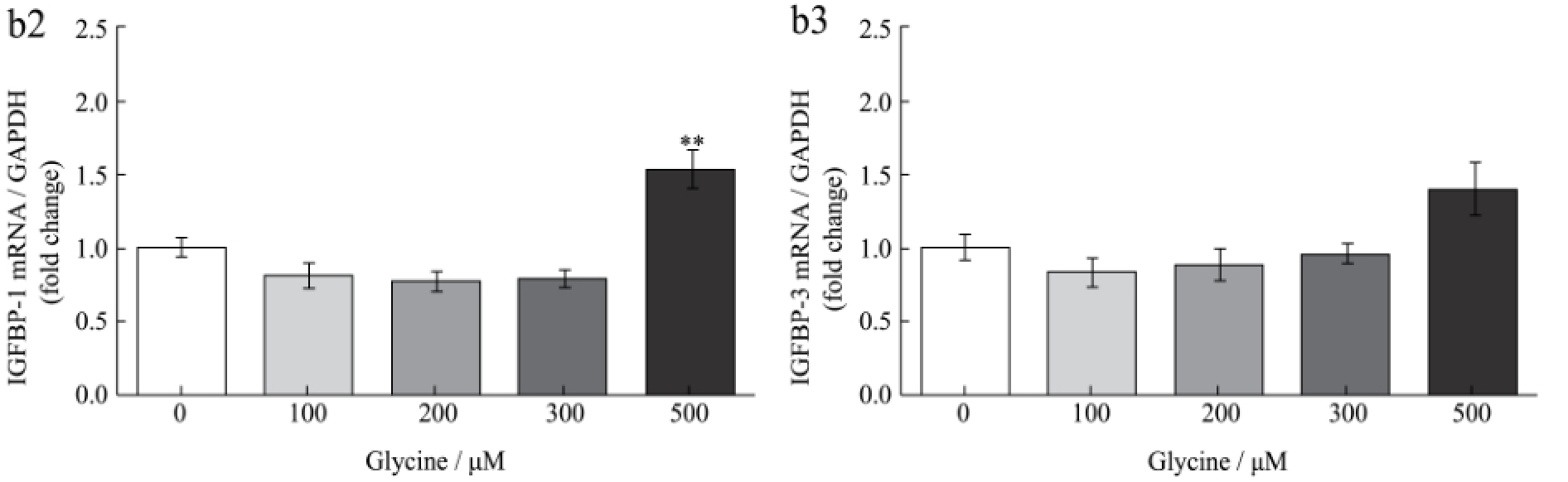
图1 甘氨酸对HepG2细胞IGF-1及其结合蛋白表达的影响
Fig.1 Effect of glycine on the expression of IGF-1 and its binding proteins in HepG2 cells
为研究甘氨酸对肝脏IGF-1表达的影响,本试验首先采用不同浓度的甘氨酸处理人肝癌细胞系HepG2细胞24 h并检测相关蛋白和基因的表达水平。
离体研究结果如图1所示,不同浓度甘氨酸能剂量依赖性促进HepG2细胞IGF-1的蛋白和mRNA表达水平。甘氨酸浓度为300 μM和500 μM时IGF-1蛋白和mRNA水平均达到极显著水平(p<0.01)。此外,500 μM甘氨酸能极显著促进肝细胞IGFBP-1 mRNA表达(p<0.01),但各浓度甘氨酸对IGFBP-3 mRNA表达无显著影响(p>0.05)。说明甘氨酸促进IGF-1表达。
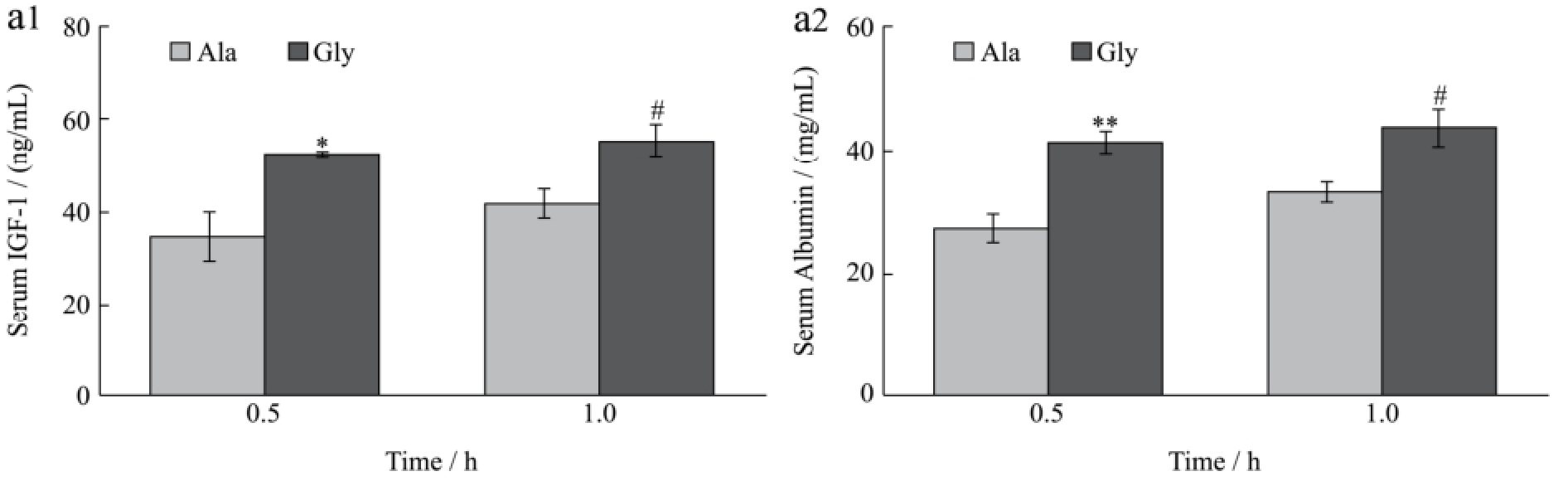

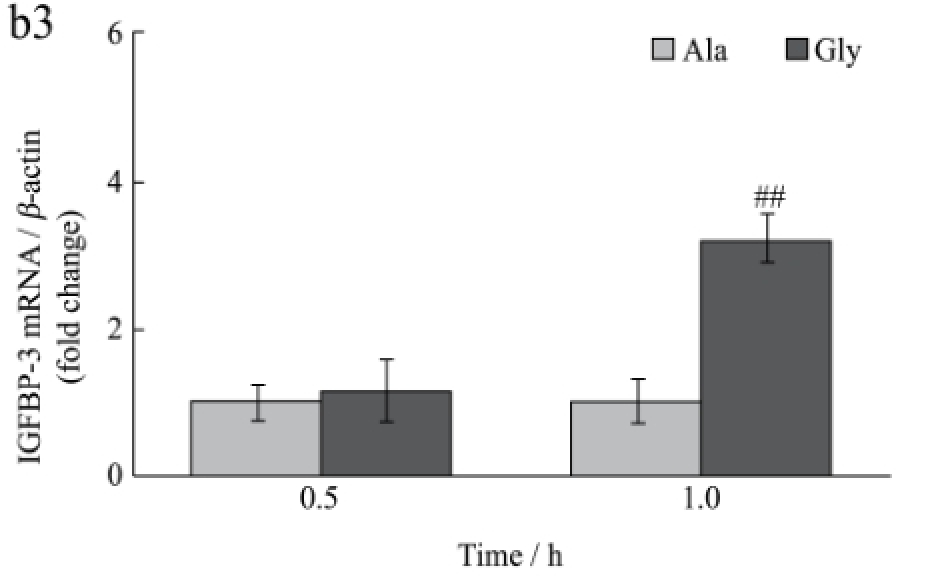
图2 甘氨酸对小鼠肝脏IGF-1分泌及IGFs基因表达的影响
Fig.2 Effect of glycine on the secretion of IGF-1 and expression of IGFs gene in mice liver
2.2 甘氨酸对肝脏IGF-1分泌及IGFs基因表达的影响
IGF-1和白蛋白都是主要由肝脏合成并分泌到血液的功能性蛋白质。为了进一步研究甘氨酸是否能在活体水平上促进肝脏IGF-1的表达和分泌,本试验采用1.0 g/kg甘氨酸尾静脉注射小鼠并分析血液和肝脏中IGF-1的含量和mRNA水平。
在体研究结果如图2所示,小鼠尾静脉注射甘氨酸后0.5 h和1 h时血清中的IGF-1和白蛋白含量均显著高于丙氨酸对照组(p<0.05)。同时,注射甘氨酸后1 h时能够极显著提高肝脏IGF-1和IGFBP-3 mRNA水平(p<0.01),极显著下调IGFBP-1 mRNA的表达(p<0.01);但在0.5 h时均无显著影响(p>0.05)。该结果提示甘氨酸能够促进肝脏IGF-1的分泌和基因表达。
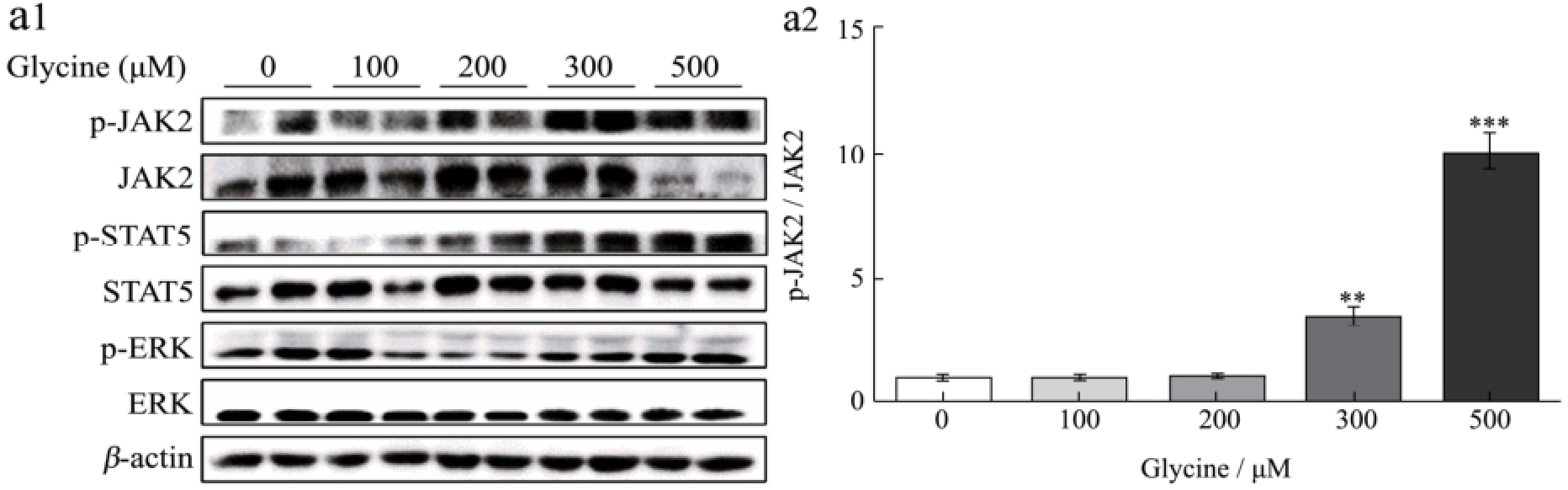
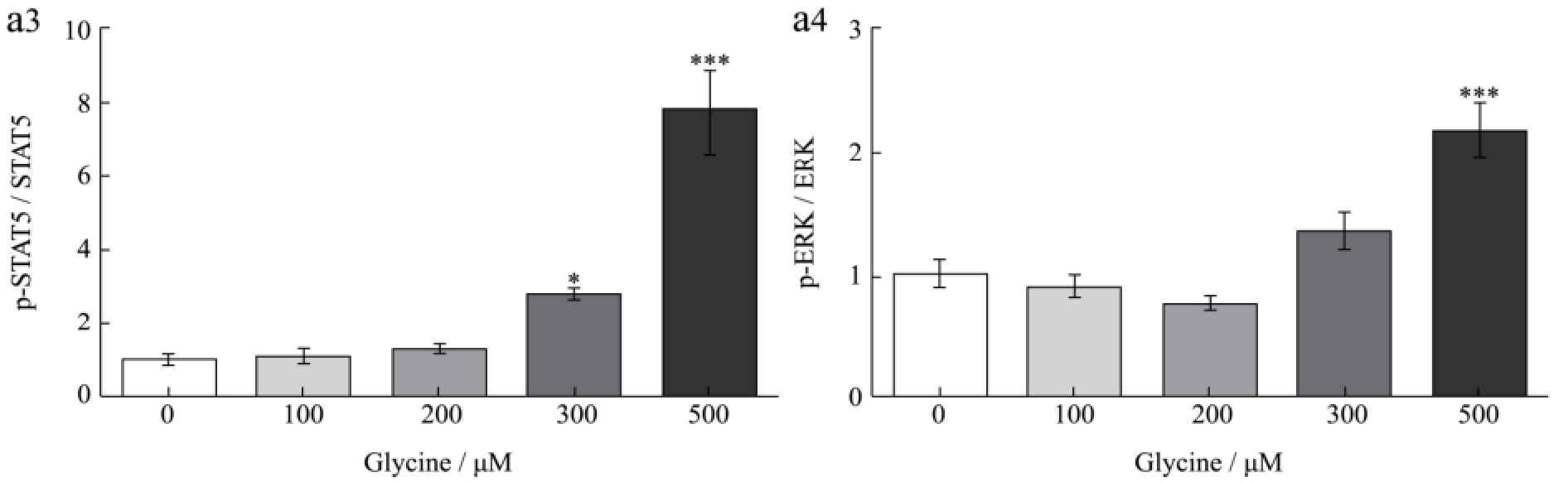
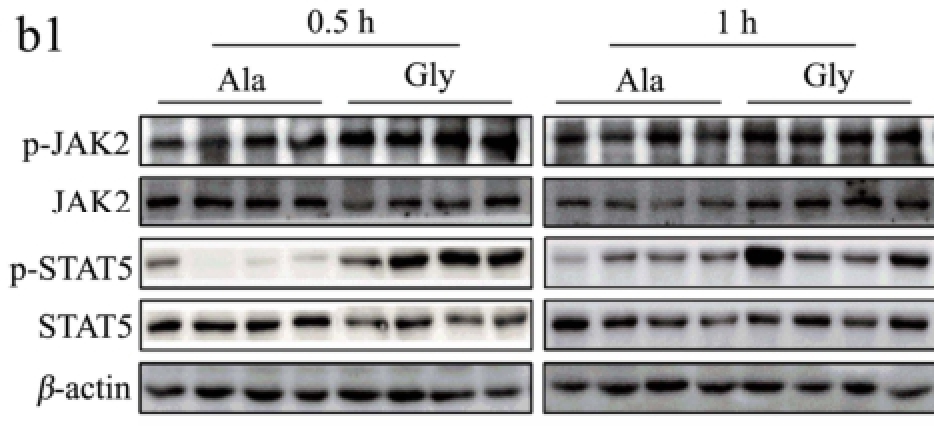
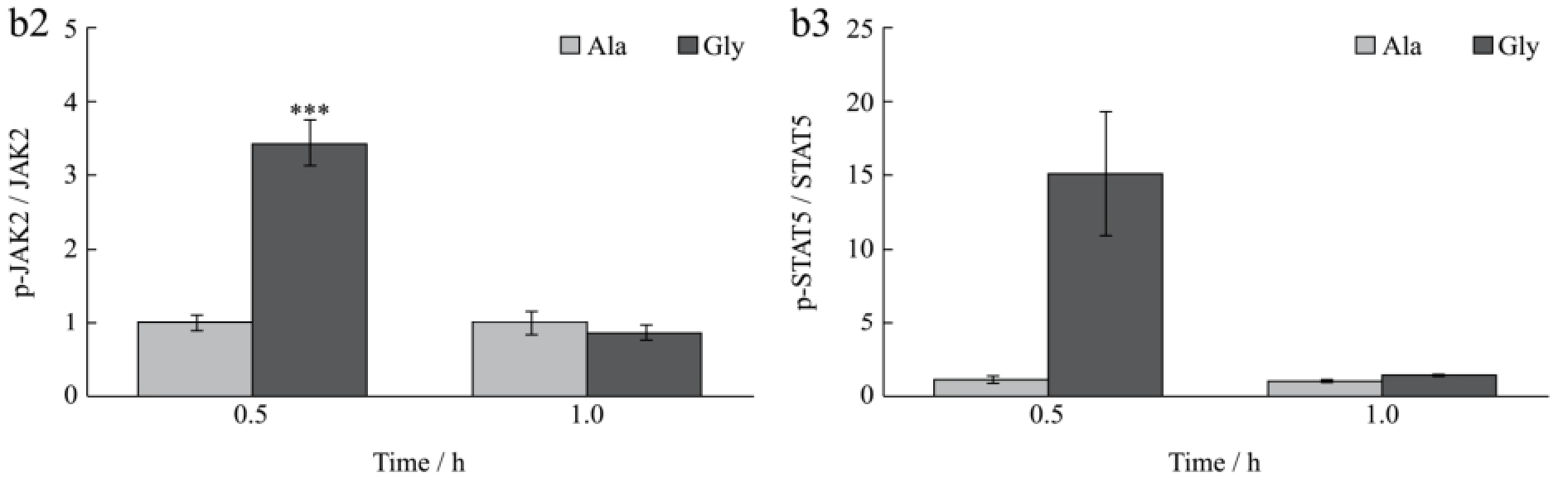
图3 甘氨酸对肝脏JAK2/STAT5和ERK信号通路的影响
Fig.3 Effect of glycine on the hepatic JAK2/STAT5 and ERK signalling pathways
2.3 甘氨酸对肝脏JAK2/STAT5和ERK信号通路的影响
由图1和图2可知,甘氨酸可以促进肝细胞和小鼠肝脏IGF-1的表达和分泌,但其具体调控机制仍未见报道,因此本试验分别利用离体和在体试验探讨JAK2/STAT5信号通路是否参与介导甘氨酸促进IGF-1表达的作用。
如图3所示,甘氨酸能够剂量依赖性促进HepG2细胞JAK2/STAT5和ERK的磷酸化,其中500 μM甘氨酸处理组与对照组相比差异极显著(p<0.001)。随后的活体试验结果同样显示,与丙氨酸相比,小鼠尾静脉注射1.0 g/kg甘氨酸后0.5 h时能够极显著促进小鼠肝脏组织JAK2和STAT5的磷酸化(p<0.01),但随着时间延长至1 h,JAK2/STAT5通路的磷酸化水平恢复至正常水平。该结果提示甘氨酸可能通过促进肝脏JAK2/STAT信号通路的磷酸化,从而促进IGF-1的表达和分泌。
2.4 甘氨酸对肌肉蛋白质周转相关信号通路的影响
肝脏分泌的IGF-1经血液循环后可以作用于器官和组织发挥其生理功能,当IGF-1作用于肌肉组织时可以促进肌肉的蛋白质合成并抑制肌肉蛋白质的降解,因此本试验将进一步探讨甘氨酸在肌肉组织蛋白质周转中发挥的作用。
如图4所示,小鼠尾静脉注射甘氨酸0.5 h后,随着血液IGF-1水平的升高,肌肉组织蛋白质合成相关信号蛋白ERK、Akt和mTOR的磷酸化水平也显著上升(p<0.05),但甘氨酸对肌肉蛋白质降解相关信号蛋白FoxO3a的磷酸化水平没有显著的影响(p>0.05)。上述结果说明甘氨酸能促进肝脏IGF-1的分泌,进而上调骨骼肌蛋白质合成相关信号通路的磷酸化水平。
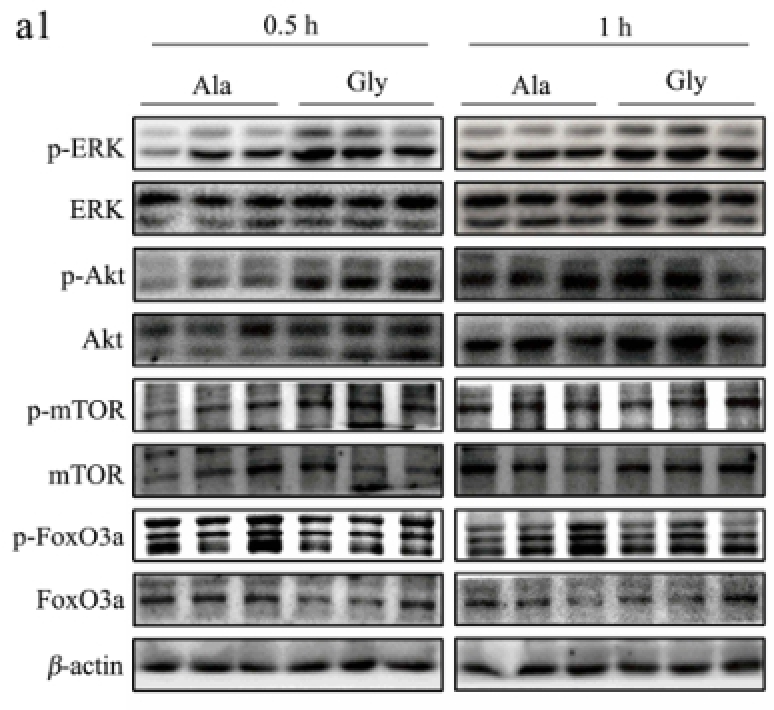

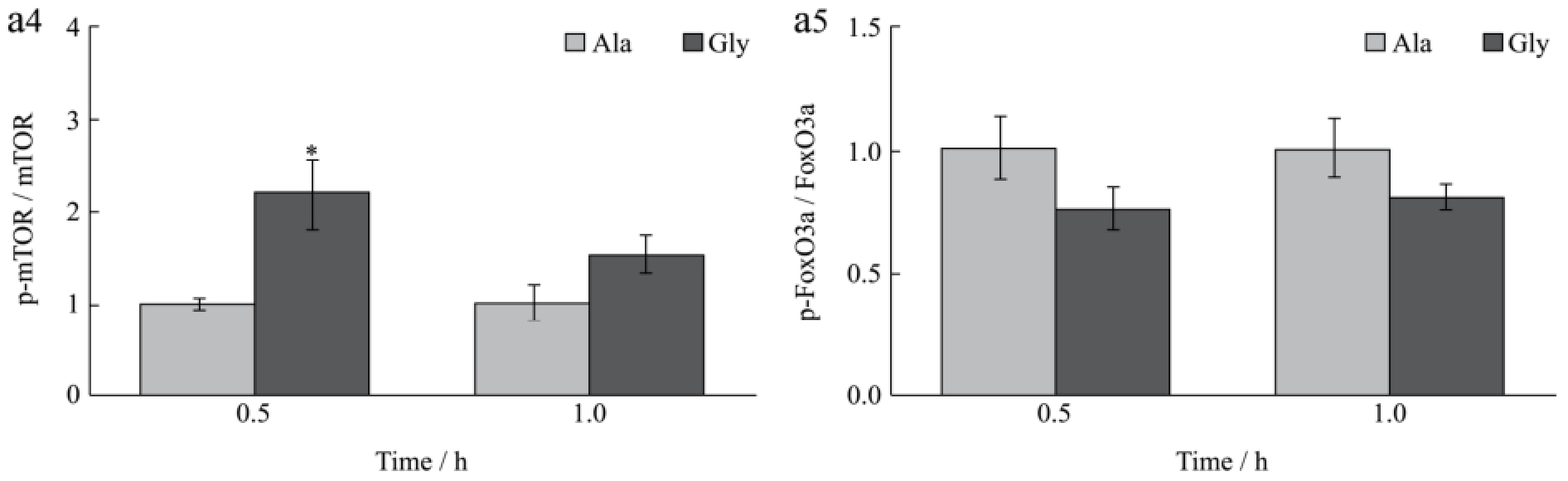
图4 甘氨酸对小鼠腓肠肌蛋白质周转相关信号通路的影响
Fig.4 Effect of glycine on protein turnover related signalling pathways in mice gastrocnemius
3.1 甘氨酸促进肝脏IGF-1的表达和分泌
本研究分别利用体外细胞试验和小鼠活体试验,证明了甘氨酸能够激活肝脏JAK2/STAT5信号通路,促进HepG2细胞和小鼠肝脏IGF-1的表达与分泌。IGF-1结合蛋白家族(Insulin-like growth factor binding protein,IGFBPs)作为胰岛素样生长因子(包括IGF-1和IGF-2)的载体蛋白,可通过结合的方式调节IGFs的活性和循环水平并延长其半衰期[11]。IGFBP-1和IGFBP-3是主要由肝脏合成与分泌的结合蛋白,其表达受多种营养条件调控,与动物所处生理状态也密切相关,在循环血液中,IGFBP-1主要功能是抑制IGF-1的活性,而IGFBP-3则是主要对IGF-1起运输作用[12]。本研究检测了小鼠尾静脉注射甘氨酸后肝脏IGFBP的表达,其中IGFBP-1 mRNA水平显著降低,而IGFBP-3 mRNA水平显著升高,说明甘氨酸不仅可以直接促进IGF-1的表达,而且可以间接通过调节其结合蛋白的表达,进一步提高IGF-1的生物学活性。但本研究细胞离体试验中未能发现甘氨酸具有类似作用,推测甘氨酸对IGFBP表达的调控可能并非是对肝脏的直接作用。
3.2 甘氨酸激活肝脏JAK2/STAT5信号通路
众所周知,肝脏IGF-1的表达受GH诱导的JAK2/STAT5信号通路调控,其中STAT5b为调节IGF-1启动子转录活性的主要转录因子,STAT5a也有类似作用[13,14]。而且有临床研究表明,正常人静脉注射甘氨酸后能剂量依赖性刺激垂体GH的释放[15]。本研究首先给予小鼠尾静脉注射甘氨酸,探索了甘氨酸对JAK2/STAT5磷酸化水平的影响。结果发现甘氨酸与丙氨酸相比能显著提高肝脏JAK2和STAT5的磷酸化水平。随后在细胞试验中也发现,在无GH处理下,甘氨酸同样能剂量依赖性激活细胞JAK2/STAT5通路。由此可以推测,甘氨酸促进HepG2细胞JAK2/ STAT5信号通路的磷酸化可能以GH非依赖性机制来实现,但其具体调控机制仍有待进一步探索。
3.3 甘氨酸对肌肉IGF-1受体信号通路的影响
IGF-1与其受体IGF-1R结合后可以通过PI3K/ AKT/mTOR信号通路促进骨骼肌蛋白质的合成,并可以通过Ras/Raf/MEK/ERK信号通路促进肌细胞的增殖。本研究中在对小鼠尾静脉注射甘氨酸后发现,甘氨酸组显著促进了IGF-1下游蛋白Akt、mTOR和ERK的磷酸化水平。该结果说明甘氨酸不仅能促进肝脏IGF-1的表达和分泌,而且还可以进一步调节肌肉靶组织的IGF-1受体信号通路。骨骼肌蛋白质的沉积是合成与降解的动态平衡。降解主要由泛素/蛋白酶体途径和自噬/溶酶体两种途径介导,其中FoxO转录因子家族作为蛋白质降解和细胞自噬的关键联络分子在这两种途径中发挥了至关重要的作用[16]。有文献报道长期注射甘氨酸能有效抵抗肌肉萎缩和骨骼肌蛋白质降解[17,18],但本研究发现急性甘氨酸处理对肌肉FoxO3a的磷酸化水平无明显影响,推测可能是由于急性实验中甘氨酸作用时间与FoxO3a信号的表达不同步所致。
甘氨酸能激活肝脏和肝细胞JAK2-STAT5信号通路,促进IGF-1的表达和分泌,同时诱导骨骼肌蛋白质合成相关信号通路。研究结果为深入揭示甘氨酸的分子营养学功能和作用机制提供重要的试验依据。
参考文献:
[1] E N Fuentes, B T Björnsson, J A Valdés, et al. IGF-I/ PI3K/Akt and IGF-I/MAPK/ERK pathways in vivo in skeletal muscle are regulated by nutrition and contribute to somatic growth in the fine flounder [J]. Am. J. Physiol. Regul. Integr. Comp. Physiol., 2011, 300(6): 532-42
[2] C Rommel, S C Bodine, B A Clarke, et al. Mediation of IGF-1-induced skeletal myotube hypertrophy by PI(3)K/Akt/ mTOR and PI(3)K/Akt/GSK3 pathways [J]. Nat. Cell Biol., 2001, 3(11): 1009-1013
[3] T N Stitt, D Drujan, B A Clarke, et al. The IGF-1/PI3K/Akt pathway prevents expression of muscle atrophy-induced ubiquitin ligases by inhibiting FOXO transcription factors [J]. Mol. Cell, 2004, 14(3): 395-403
[4] T Shavlakadze, J Chai, K Maley, et al. A growth stimulus is needed for IGF-1 to induce skeletal muscle hypertrophy in vivo [J]. J. Cell. Sci., 2010, 123(6): 960-71
[5] K M Reindl, J D Kittilson, H E Bergan, et al. Growth hormone-stimulated insulin-like growth factor-1 expression in rainbow trout (Oncorhynchus mykiss) hepatocytes is mediated by ERK, PI3K-AKT, and JAK-STAT [J]. Am. J. Physiol. Regul. Integr. Comp. Physiol., 2011, 301(1): 236-43
[6] M Yamamoto, G Iguchi, H Fukuoka, et al. SIRT1 regulates adaptive response of the growth hormone-insulin-like growth factor-I axis under fasting conditions in liver [J]. Proc. Natl. Acad. Sci. U S A, 2013, 110(37): 14948-14953
[7] Brameld J M, R S Gilmour, J Buttery. Glucose and amino acids interact with hormones to control expression of insulin-like growth factor-I and growth hormone receptor mRNA in cultured pig hepatocytes [J]. J. Nutr., 1999, 129(7): 1298-1306[8] W Wang, Z Dai, Z Wu, et al. Glycine is a nutritionally essential amino acid for maximal growth of milk-fed young pigs [J]. Amino Acids, 2014, 46(8): 2037-2045
[9] W Wang, Z Wu, G Lin, et al. Glycine stimulates protein synthesis and inhibits oxidative stress in pig small intestinal epithelial cells [J]. J. Nutr., 2014, 144(10): 1540-1548
[10] 杜瑞平,张兴夫,高明,等.甘氨酸的免疫调节作用及其分子机制[J].动物营养学报,2015,27(3):663-670
[11] DU Rui-ping, ZHANG Xing-fu, GAO Ming, et al. Immunomodulatory effects of glycine and its molecular mechanism [J]. Chinese Journal of Animal Nutrition, 2015, 27(3): 663-670
[12] D R Clemmons, W H Busby, T Arai, et al. Role of insulin-like growth factor binding proteins in the control of IGF actions [J]. Prog. Growth Factor Res., 1995, 6(2-4): 357-366
[12] Underwood L E. Nutritional regulation of IGF-I and IGFBPs [J]. J. Pediatr. Endocrinol. Metab., 1996, 1(9): 303-312
[13] Y Chen, D Sun, V M Krishnamurthy, et al. Endotoxin attenuates growth hormone-induced hepatic insulin-like growth factor I expression by inhibiting JAK2/STAT5 signal transduction and STAT5b DNA binding [J]. Am. J. Physiol. Endocrinol. Metab., 2007, 292(6): 1856-1862
[14] Varco-Merth B, P Rotwein. Differential effects of STAT proteins on growth hormone-mediated IGF-I gene expression [J]. Am. J. Physiol. Endocrinol. Metab., 2014, 307(9): 847-855
[15] K Kasai, H Suzuki, T Nakamura, et al. Glycine stimulated growth hormone release in man [J]. Acta Endocrinol (Copenh), 1980, 93(3): 283-286
[16] Bonaldo P, M Sandri. Cellular and molecular mechanisms of muscle atrophy [J]. Dis. Model. Mech., 2013, 6(1): 25-39
[17] D J Ham, K T Murphy, A Chee, et al. Glycine administration attenuates skeletal muscle wasting in a mouse model of cancer cachexia [J]. Clinical Nutrition, 2014, 33(3): 448-458
[18] M K Caldow, D J Ham, D P Godeassi, et al. Glycine supplementation during calorie restriction accelerates fat loss and protects against further muscle loss in obese mice [J]. Clinical Nutrition, 2015, 34(S1): 1-9
Effects of Glycine on Hepatic IGF-I Expression Regulation and the Underlying Signaling Pathways
Abstract:To investigate the effects of Glycine (Gly) on the expression and secretion of hepatic insulin-like growth factor 1 (IGF-1), HepG2 cells were treated with different concentrations of Gly in vitro. Meanwhile, mice were injected (i.v.) with 1.0 g/kg Gly or equimolar alanine (Ala) via tail veins, and blood, liver, and gastrocnemius samples were collected at 0.5 h and 1 h post-injection. The expression of IGF-1 and insulin-like growth factor binding proteins (IGFBPs) mRNAs in hepatocytes and mouse liver was analyzed by quantitative polymerase chain reaction (qPCR). Meanwhile, changes in the hepatic growth hormone receptor pathway (JAK2/STAT5) and muscular IGF-I receptor pathway (ERK/Akt/mTOR) were also detected by western blot. The results showed that the expression levels of IGF-1 protein and mRNA in HepG2 cells were elevated by Gly in a dose-dependent manner. The in vivo data demonstrated that 1.0 g/kg Gly could remarkably increase the serum IGF-1 and albumin levels, significantly upregulate the expression levels of hepatic IGF-1 and IGFBP-3 mRNA, and downregulate that of IGFBP-1 mRNA. In vitro and in vivo experiments both indicated that Gly could effectively activate the JAK2/STAT5 signaling pathway in HepG2 cells and mouse liver, and enhance the phosphorylation level of the IGF-I receptor signaling pathway in gastrocnemius. These results suggest that glycine may directly improve the sensitivity of hepatic growth hormone receptor signaling pathways, thus promoting the expression and secretion of IGF-1. These results provide the experimental basis for revealing the molecular nutrition function and action mechanism of Gly.
Key words:glycine; IGF-1; liver; HepG2 cells; signaling pathway
文章篇号:1673-9078(2017)3-1-7
DOI:10.13982/j.mfst.1673-9078.2017.3.001
收稿日期:2016-04-11
基金项目:国家“973”课题(2013CB127304)