摘要:本文研究了不同次数(0、1、2、3、4、5和6次)的冻融处理对糊化后的普通玉米和糯玉米淀粉凝胶理化性的影响。采用扫描电子显微镜对淀粉凝胶的微观结构进行分析,测定了凝胶化淀粉的碘蓝值、碘结合力、最大吸收波长、透明度、持水性、溶解度与膨胀力、水解特性和体外消化性。普通玉米淀粉凝胶呈孔状结构,糯玉米淀粉凝胶冻融2次后出现层状结构,二者孔径和层距都随冻融次数增加而减小。冻融循环处理对两种凝胶化玉米淀粉的碘蓝值、碘结合力、最大吸收波长和直链淀粉含量均无显著性影响。随冻融次数增加,普通玉米淀粉的透明度、持水性、RDS与SDS含量逐渐减小,而溶解度、膨胀力、水解率和RS含量逐渐升高;而糯玉米淀粉的透明度、持水性、溶解度和膨胀力逐渐减小,RDS、SDS和RS含量及水解率均无显著性变化。
关键词:冻融循环;凝胶化淀粉;理化特性
随着冷冻、冷藏技术的发展和人们生活节奏的不断加快,面制食品和淀粉质食品在运输、贮藏和销售直至最终消费前通常需经过多次的冻融过程。淀粉作为面制品的重要组分,在冻融交替作用下的稳定性直接关系到冷冻面制品品质的优劣[1,2]。低温冻结时,淀粉质食品中的液态水转化成固态水,导致了淀粉富集区的形成,在淀粉富集区内未冻结的水分会进一步使淀粉分子链间缔合;在融化时,冰晶融化并伴随着水分从凝胶孔隙中溢出。使淀粉质食品发生脱水收缩现象。
经过冻融(Freeze-thawing,FT)处理后的淀粉凝胶呈现网状结构或层状结构,随着冻融次数的增加孔径或层距逐渐减小,淀粉凝胶的质地硬度和胶粘性增大,而弹性和内聚性较小 。凝胶化淀粉的相对结晶度、糊化焓和抗性淀粉含量也会随着冻融次数的增加而升高[4~6]。由于脱水收缩作用,冻融次数越多的淀粉凝胶析水率越大,冻融稳定性越差。研究还发现,含有Ca2+复合物的淀粉、乙酰化淀粉比原淀粉具有较好的冻融稳定性,经过多次冻融后,析水率较小,凝胶化淀粉比冷水可溶淀粉具有较差的冻融稳定性,而酸处理后的淀粉由于发生水解导致冻融稳定性变差,同时研究还发现不同电性的淀粉也具有不同的冻融稳定性,带有负电荷的淀粉冻融稳定性优于原淀粉,而带有正电荷的淀粉冻融稳定性最差[7~11]。影响淀粉凝胶冻融特性的因素包括淀粉种类、水分含量、冻融速率、冻融温度及冻融次数等[12~14]。
虽然关于冻融循环处理对凝胶化淀粉理化性质的影响报道较多,但是在凝胶化淀粉的水解特性和体外消化性等与食品质量相关的特性方面报道甚少。为了扩展人们对淀粉凝胶微观领域以及淀粉凝胶在人体内的消化特性的认识,本文以普通玉米淀粉和糯玉米淀粉为研究对象,研究冻融处理次数对玉米淀粉凝胶微观结构和对凝胶化玉米淀粉的碘蓝值、直链淀粉含量、透明度、持水性、溶解度与膨胀力、体外消化性和水解特性的影响,以期为低温贮藏淀粉质食品提供一定的理论依据和参考价值。
1.1 材料与试剂
普通玉米淀粉:购于南京华飞口碱厂;糯玉米淀粉:山东华农特种玉米开发有限公司。
糖化酶和猪胰 α-淀粉酶,阿拉丁试剂公司;3,5-二硝基水杨酸,国药集团化学试剂有限公司;无水葡萄糖,上海伯奥生物科技有限公司;石油醚、无水乙醇、氢氧化钠、盐酸、溴化钾、硫酸和硫酸铜等均为化学纯。
1.2 仪器与设备
SHA-C恒温振荡器,常州澳华仪器有限公司;UV-1240紫外分光光度计,SHIMADZU公司;UV-2550双光束紫外分光光度计,SHIMADZU公司;101-1型电热鼓风干燥箱,北京科委永鑫实验仪器设备厂;QL-901 Vortex澳门市其林贝尔仪器制造有限公司。
1.3 试验方法
1.3.1 样品处理
10%的玉米淀粉乳在沸水浴中不断搅拌糊化 30 min,自然冷却后置于-18 ℃的冰箱中,冻结22 h后取出,30 ℃水浴解冻2 h,由此获得冻融一次的淀粉凝胶样品;依据此步骤分别制备冻融次数为0、1、2、3、4、5和6次的淀粉凝胶样品。将获得的淀粉凝胶样品在45 ℃的鼓风干燥机中干燥48 h,再粉碎,过100目筛,获得淀粉样品。
1.3.2 样品组分分析
水分、总淀粉、粗蛋白、粗脂肪和灰分含量分别参照GB 5497-1985、GB/T 5009.9-2003、GB 5009.5-2010、GB/T 5512-2008和GB 5009.4-2010方法测定。
1.3.3 淀粉凝胶微观结构观察
将样品适当处理后置于粘有导电胶布的铝制载物台上,将载物台放入镀金仪器中,用离子溅射镀膜仪对样品进行喷炭镀金,20 min后将载物台取出利用Hitachi S-3400型扫描电子显微镜观察拍摄。
1.3.4 碘蓝值
参考Morrison[15]方法并略作改进。称40 mg样品分散于10 mL尿素二甲基亚砜溶液(V/V=1:9),室温下放置10 min,沸水浴加热20 min,每5 min振荡一次,使之完全溶解,冷却至室温。取1 mL于100 mL棕色容量瓶,加95 mL蒸馏水,2 mL、0.2% I2-KI试剂(0.002 g/mL I2+0.02 g/mL KI),定容后立即混匀,室温下放置20 min,在500~700 nm处扫描最大吸收波长λmax,635 nm和520 nm处测其吸光度,A635为碘蓝值,A635/A520为碘结合力。
1.3.5 直链淀粉
利用直/支链淀粉试剂盒(Megazyme,Ireland)进行测定,重复3次。
1.3.6 透明度
参考缪铭等[16]方法。
1.3.7 持水性
参考王晓艳等[17]的方法并略作改进。称取约1 g样品(干基),记为m,置于50 mL离心管中,加入20 mL去离子水,称重m1;常温下搅拌1 h后,4000 r/min离心15 min,弃掉上清液,将离心管口倾斜45 °,静置10 min后,再次弃掉上清液,并吸干附着在管壁上的水分,再称其质量m2。持水率为每克样品吸收水分的质量。
式中,m表示称取样品的质量,g;m1表示离心前管和样品的质量,g;m2表示离心后管和样品的质量,g。
1.3.8 溶解度与膨胀力
参考Leach等[18]方法并略作改进。准确称取一定量的样品,配制成质量分数为2%的淀粉乳,取30 mL分别在50 ℃、60 ℃、70 ℃、80 ℃和90 ℃水浴中加热30 min,以120 r/min振荡,并不停用玻璃棒搅拌;冷却后3500 r/min离心15 min,将上层清液倒入铝盒中,在105 ℃下烘干至恒重,得被溶解淀粉量A/g;离心管中沉淀物质量表示为 P/g。按下列公式计算淀粉的溶解度和膨胀力:
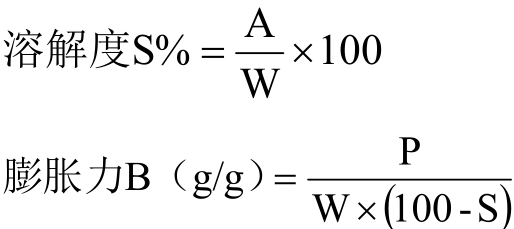
式中,W为淀粉样品质量(g,干基重)。
1.3.9 体外消化性
参考Englyst[19]方法并略作改进。精确称取100 mg(分别记为M1和M2)样品于100 mL锥形瓶中,加入0.5 M醋酸钠-醋酸缓冲液(pH 5.2)10 mL,在37 ℃水浴锅中平衡10 min,加入4 mL猪胰α-淀粉酶和1 mL糖化酶(2500 U/mL),以200 r/min的转速摇动,计时。分别在20 min和120 min取出,煮沸5 min灭酶。转移至离心管中以3500 r/min离心10 min。再重复离心一次,将上清液转移到100 mL容量瓶中,定容。最后取1 mL用DNS法测还原糖含量。
酶:糖化酶2500 U/mL,吸取2.5 mL糖化酶原液用醋酸钠缓冲溶液(pH 5.2)定容到100 mL容量瓶中。猪胰α-淀粉酶:3000 U/mL,称7 g酶,加入100 mL醋酸钠缓冲溶液(pH 5.2),搅拌至溶解,3000 r/min离心10 min,取上清液。公式:
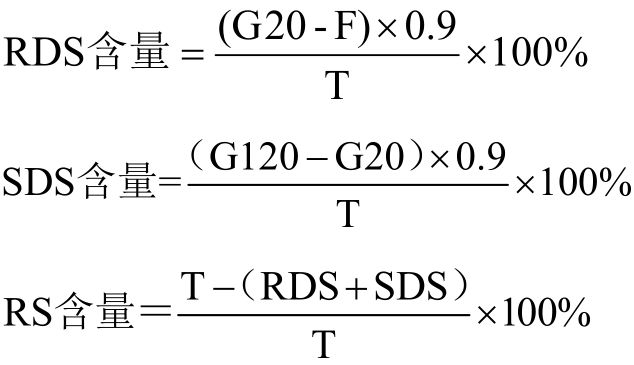
式中,G20为淀粉酶水解20 min后产生的葡萄糖含量,mg;F为酶水解处理前淀粉中游离葡萄糖含量,mg;G120为淀粉酶水解120 min后产生的葡萄糖含量,mg;T为样品中总淀粉含量,mg;RDS为快速消化淀粉(Rapidly Digest Starch);SDS为慢速消化淀粉(Slowly Digest Starch);RS为抗性淀粉(Resistant Starch)。
1.3.10 酶解特性
参考Englyst[19]方法并略作改进。称取100 mg样品放在玻璃试管中,并加入15个玻璃珠(4 mm直径);加入4 mL、0.5 M醋酸钠-醋酸缓冲液(pH 5.2)到试管中,盖紧盖子并涡旋;把试管水平放在 37 ℃振荡水浴锅中以200 r/min振动5 min;加入1 mL α-淀粉酶(3000 U/mL),盖紧盖子涡旋,整个过程保持水浴锅振荡;水解0.5 h、1.0 h、1.5 h、2.0 h、2.5 h和3.0 h后,分别吸取100 μL溶液立即与1 mL、50%乙醇混合,并涡旋,然后加入3 mL去离子水,再涡旋后以2000 r/min离心10 min;吸取1 mL稀释液用DNS法测定还原糖含量。
1.3.11 数据统计
使用 Excel对数据进行统计分析,利用 DPS Version 7.05软件进行显著性分析(p<0.05)。
2.1 淀粉基本组分分析
不同种类的淀粉的基本组分不同。普通玉米淀粉的水分、粗蛋白、粗脂肪、淀粉和灰分的含量分别为13.22%、0.47%、0.16%、98.43%和0.17%;糯玉米淀粉的水分、粗蛋白、粗脂肪、淀粉和灰分的含量分别为11.80%、0.15%、0.21%、98.11%和0.17%。
表1 普通玉米淀粉和糯玉米淀粉基本组分(干基)
Table 1 Basic components of normal and waxy corn starch (dry basis)
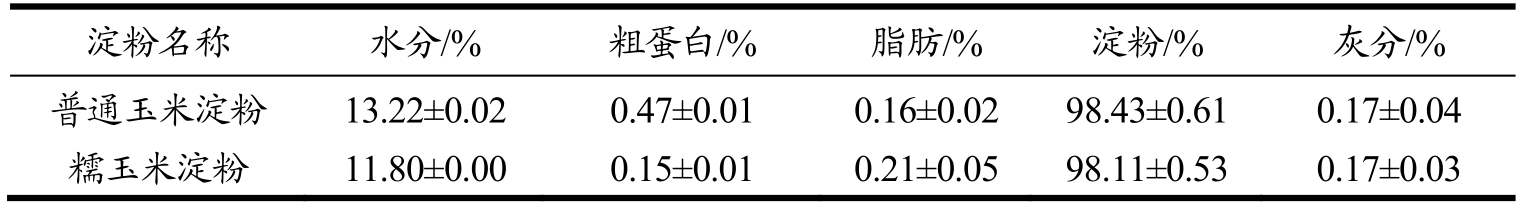
注:所有试验数据以平均值±标准差表示,试验重复三次,下同。
淀粉名称 水分/% 粗蛋白/% 脂肪/% 淀粉/% 灰分/%普通玉米淀粉 13.22±0.02 0.47±0.01 0.16±0.02 98.43±0.61 0.17±0.04糯玉米淀粉 11.80±0.00 0.15±0.01 0.21±0.05 98.11±0.53 0.17±0.03
2.2 淀粉凝胶微观结构
在冻融过程中,淀粉凝胶体系中形成淀粉富集区,富集区的密度越大越有助于淀粉分子链的缔合,从而形成厚丝结构,以单独相存在,在融化时,冰晶转化成液态水,容易从聚合的网络结构中溢出,这个过程被称为脱水收缩作用;直链淀粉分子间的距离影响脱水收缩作用,直链淀粉分子间距离越短,脱水收缩时溢出的水分越多[20]。
由图1观察,普通玉米淀粉凝胶呈现网络状结构,随冻融次数增加,孔径变小,但凝胶孔洞数量增多。与普通玉米淀粉凝胶结构不同的是,糯玉米淀粉在冻融2次后才开始形成凝胶结构,且凝胶呈现层状结构,整体结构疏松有序,随冻融次数增加,凝胶片层增多,但层距减小。孔径和层距的减小是由于脱水收缩作用导致的。
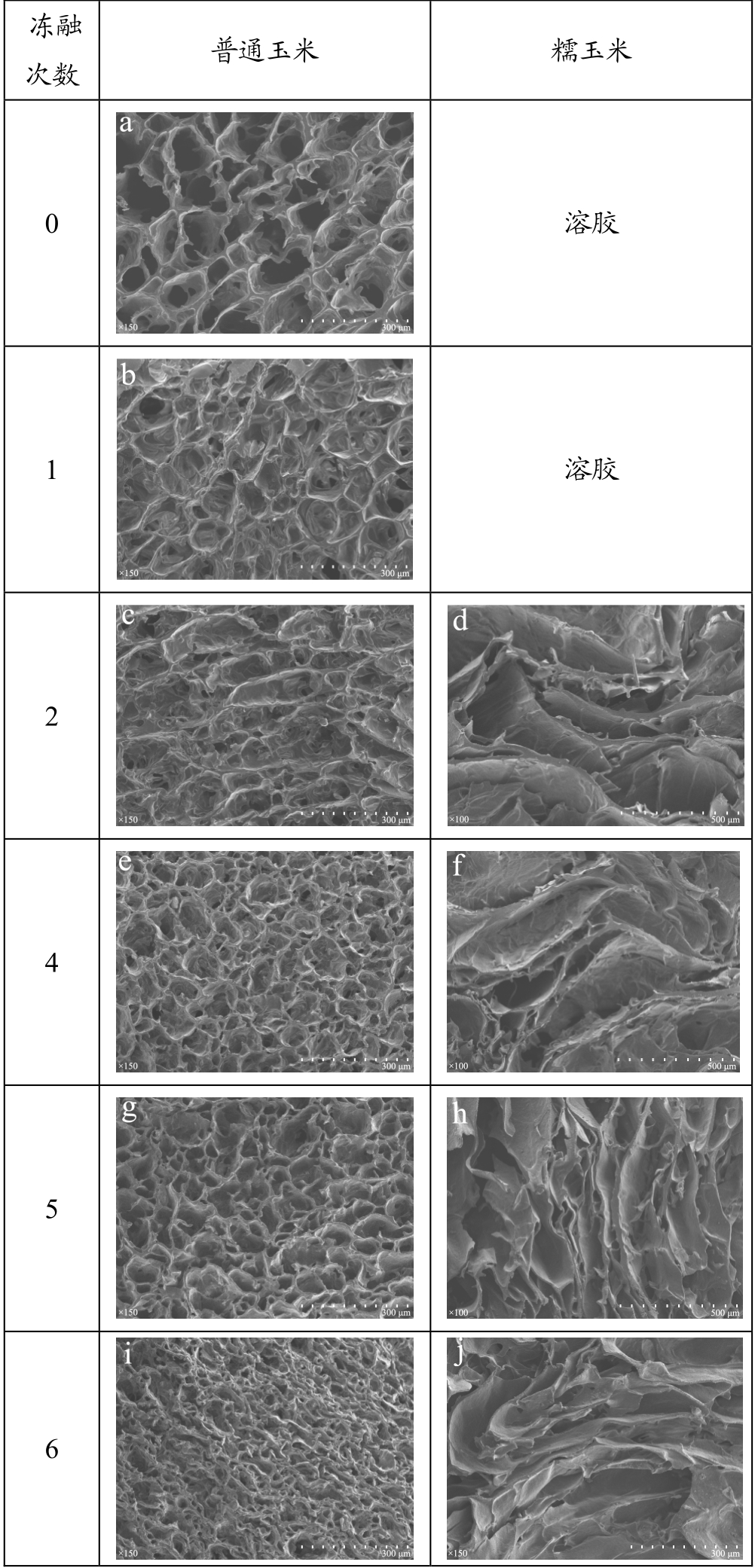
图1 冻融玉米淀粉凝胶的扫描电镜观察图
Fig.1 Scanning electron microscopy images of corn starch gels
with different numbers of FT cycles
注:普通玉米淀粉凝胶冻融次数 0~6(150×),糯玉米淀粉凝胶冻融次数2~5(100×)、冻融6次(150×)。
糊化淀粉在储藏过程中,因淀粉分子链间氢键的不断缔合,而产生的硬化现象称为淀粉的老化或回生。淀粉的老化分为短期老化和长期老化。短期老化是直链淀粉的重结晶,在淀粉糊化后较短时间内完成。而长期老化是支链淀粉分子侧链间发生结合而导致的淀粉重结晶,也是导致食品品质发生劣变的主要原因。淀粉凝胶是糊化后的淀粉分子发生老化形成的。普通玉米淀粉在糊化后冷却的过程中迅速形成淀粉凝胶,这是由于普通玉米淀粉中较高含量的直链淀粉发生短期老化导致的。而糯玉米淀粉中直链淀粉含量较少,在淀粉糊化后,不易发生老化,所以,只有在放置一段时间后,支链淀粉分子间才会缓慢发生老化,逐渐形成凝胶结构。
淀粉凝胶有序的结构表明淀粉分子在冻融过程中淀粉分子重排是有规律的,这可能与直链淀粉含量、链长和分支度有关[4]。本研究发现的普通玉米淀粉凝胶呈网络结构,糯玉米淀粉凝胶呈层状结构,这两种玉米淀粉凝胶结构不同的原因,是由于直链淀粉含量不同导致。本实验结果表明支链淀粉有助于淀粉凝胶层状结构的形成,直链淀粉可以在淀粉凝胶层间形成链桥,促进淀粉凝胶网络结构的形成,使凝胶结构更加稳定。在生产中可通过调控淀粉直支比,获得理想的淀粉凝胶结构。
2.3 碘蓝值与直链淀粉含量
碘蓝值是表示淀粉结合碘能力的一个指标,能比较直观反映直链淀粉含量和链长的变化。直链淀粉中较长的分子一般以螺旋结构存在,分子内氢键的相互作用使得分子链折叠进一步加强,当碘液与淀粉作用时,其中的直链淀粉分子能够固定较多的碘分子,形成蓝色配合物。而支链淀粉的支链多,纵横交错,所以直链淀粉与支链淀粉相比能够固定更多的I2[21]。直链淀粉-碘络合物在600~640 nm间呈现最大吸收,而支链淀粉-碘络合物的则为520~560 nm[22]。
从表2可知,普通玉米淀粉样品比糯玉米淀粉样品具有较高的碘蓝值、碘结合力和最大吸收波长,由于普通玉米淀粉中较高含量的直链淀粉固定较多碘的缘故。
与各自原淀粉相比,凝胶化普通玉米淀粉具有较大的碘蓝值、碘结合力、最大吸收波长和直链淀粉含量,而凝胶化糯玉米淀粉的这四个指标均无明显变化。由于糊化后的淀粉颗粒结构破裂并伸展开,冻融处理加剧了直链淀粉分子的溢出,使其更易与碘结合,导致凝胶化普通玉米淀粉的碘蓝值、碘结合力、最大吸收波长和直链淀粉含量变大,而糯玉米淀粉中直链淀粉含量相对较少,所以无显著性变化。
随着冻融次数增加,同一种类凝胶化玉米淀粉的碘蓝值、碘结合力、最大吸收波长和直链淀粉含量无显著性差异,表明冻融处理不会破坏淀粉分子的化学键。
表2 淀粉碘蓝值与直链淀粉含量
Table 2 Iodine blue values and amylose content of starch after different numbers of FT cycles
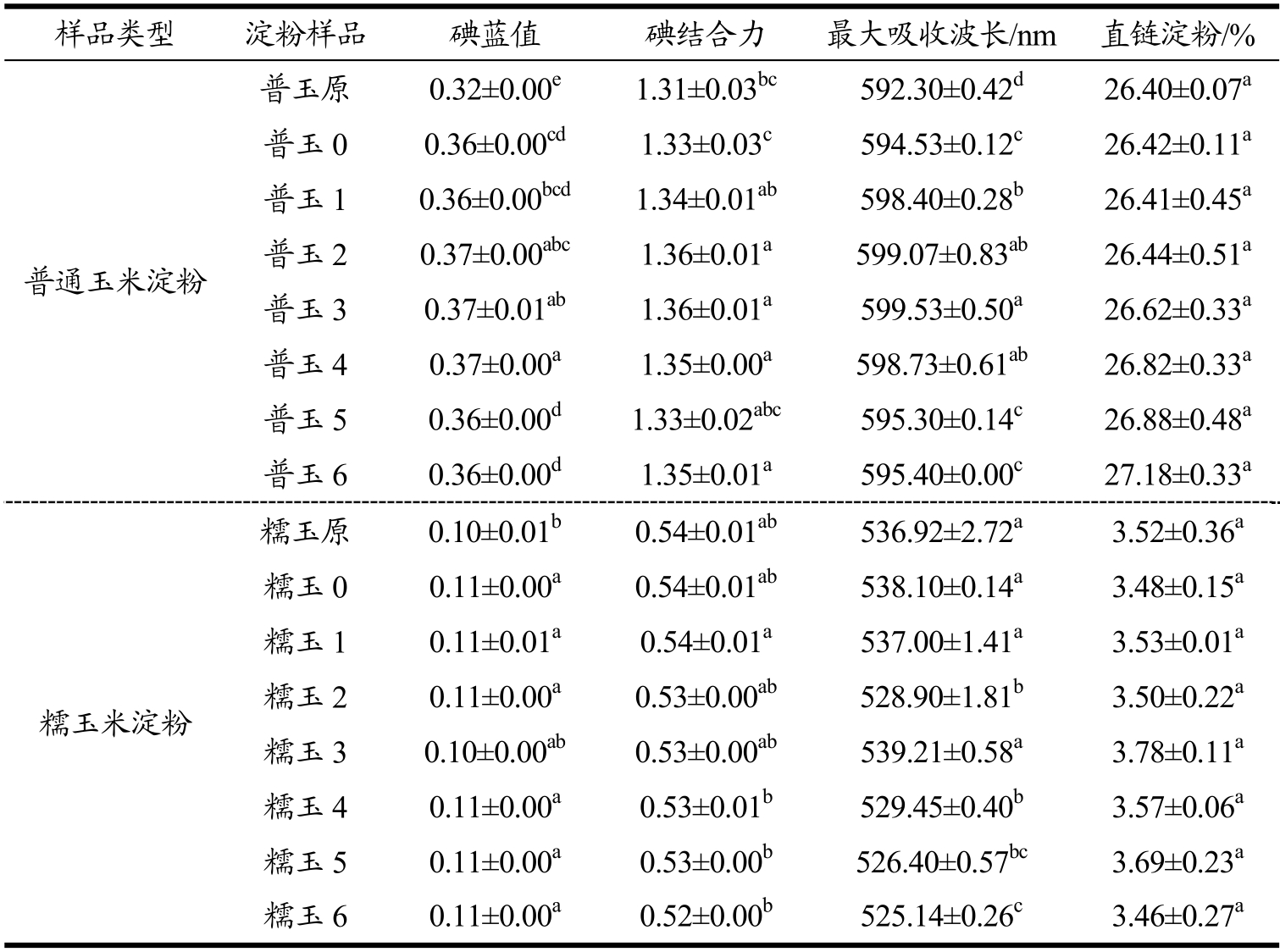
注:同一列中不同字母表示差异达显著水平(p<0.05),下同。
样品类型 淀粉样品 碘蓝值 碘结合力 最大吸收波长/nm 直链淀粉/%普玉原 0.32±0.00e1.31±0.03bc592.30±0.42d26.40±0.07a普通玉米淀粉普玉0 0.36±0.00cd1.33±0.03c594.53±0.12c26.42±0.11a普玉1 0.36±0.00bcd1.34±0.01ab598.40±0.28b26.41±0.45a普玉2 0.37±0.00abc1.36±0.01a599.07±0.83ab26.44±0.51a普玉3 0.37±0.01ab1.36±0.01a599.53±0.50a26.62±0.33a普玉4 0.37±0.00a1.35±0.00a598.73±0.61ab26.82±0.33a普玉5 0.36±0.00d1.33±0.02abc595.30±0.14c26.88±0.48a普玉6 0.36±0.00d1.35±0.01a595.40±0.00c27.18±0.33a糯玉米淀粉糯玉原 0.10±0.01b0.54±0.01ab536.92±2.72a3.52±0.36a糯玉0 0.11±0.00a0.54±0.01ab538.10±0.14a3.48±0.15a糯玉1 0.11±0.01a0.54±0.01a537.00±1.41a3.53±0.01a糯玉2 0.11±0.00a0.53±0.00ab528.90±1.81b3.50±0.22a糯玉3 0.10±0.00ab0.53±0.00ab539.21±0.58a3.78±0.11a糯玉4 0.11±0.00a0.53±0.01b529.45±0.40b3.57±0.06a糯玉5 0.11±0.00a0.53±0.00b526.40±0.57bc3.69±0.23a糯玉6 0.11±0.00a0.52±0.00b525.14±0.26c3.46±0.27a
2.4 透明度
淀粉糊化后其分子重新排列相互缔合的程度是影响淀粉糊透明度的重要因素,淀粉分子相互缔合的程度越高,淀粉糊透明度越低,表明淀粉老化程度越大。淀粉糊的透光率越大,表明其透明度越好。
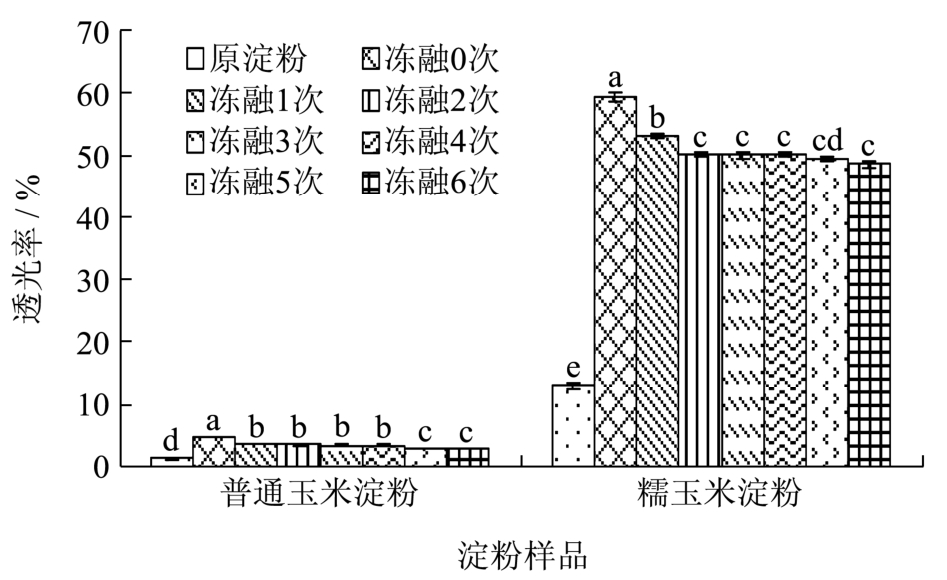
图2 不同冻融处理下玉米淀粉的透光率
Fig.2 Transparency of starch samples after different numbers of FT cycles
注:所有紧密相邻的柱形图上的不同字母表示差异达显著水平(p<0.05),下同。
从图2中看出,糯玉米淀粉样品的透明度显著高于普通玉米淀粉样品,这是由于糯玉米淀粉中的支链淀粉分子结构较大,相比于短的直链淀粉分子,糊化后的支链淀粉分子更难以缔合,使透明度较高。
两种凝胶化玉米淀粉的透光率均显著高于各自原淀粉透光率,因为与原淀粉相比,凝胶化淀粉样品已经经过预糊化过程,当再次在水中加热进行透明度测定时,淀粉分子会进一步分散,分子间更难以重排并缔合,导致凝胶化淀粉的透光率显著高于原淀粉透光率。并且冻融处理使糊化未完全的残存淀粉分子破裂,也会使淀粉透光率升高[23]。
随冻融次数增加,两种凝胶化淀粉的透光率下降。在冷冻-解冻过程中,凝胶体系中的凝胶相和水相发生相互作用,在冷冻过程中,冰晶形成并聚集,导致凝胶相的富集,在解冻过程中,冰晶逐渐融化成液态水,凝胶相中的淀粉分子在水分子的迁移下,发生重排,形成老化淀粉,导致结晶区增多,使淀粉糊的透光率降低。
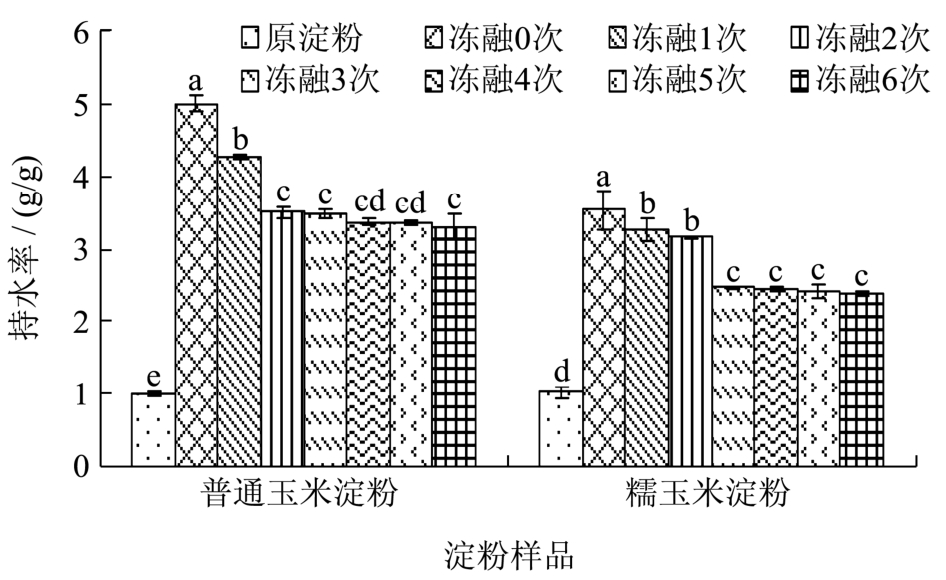
图3 不同冻融处理下淀粉的持水性
Fig.3 Water holding capacity of starch samples after different numbers of FT cycles
2.5 持水性
持水性反映淀粉在一定条件下保持水分的能力,持水性与淀粉链之间形成的氢键和共价键的程度有关。
从图3可知,两种凝胶化玉米淀粉的持水性均显著大于原淀粉。因为糊化破坏了淀粉分子结构,暴露出更多羟基,更易于结合较多的水分,使糊化后的淀粉持水率升高,所以两种玉米淀粉凝胶的持水性高于原淀粉。
随冻融次数增加,两种凝胶化玉米淀粉的持水性都先呈显著下降趋势,后结果间无显著性变化,但凝胶化普通玉米淀粉在冻融0~2次间,持水性显著下降,而凝胶化糯玉米淀粉在冻融0~1次间,持水性显著下降,可见凝胶化普通玉米淀粉的持水率下降较快。随冻融次数增加,淀粉分子重结晶越多,氢键减少,与水作用力减弱,使持水率下降。同时,由于直链淀粉分子老化速率大于支链淀粉分子,使直链淀粉含量较高的凝胶化普通玉米淀粉的持水率下降速率大于凝胶化糯玉米淀粉。
2.6 溶解度与膨胀力
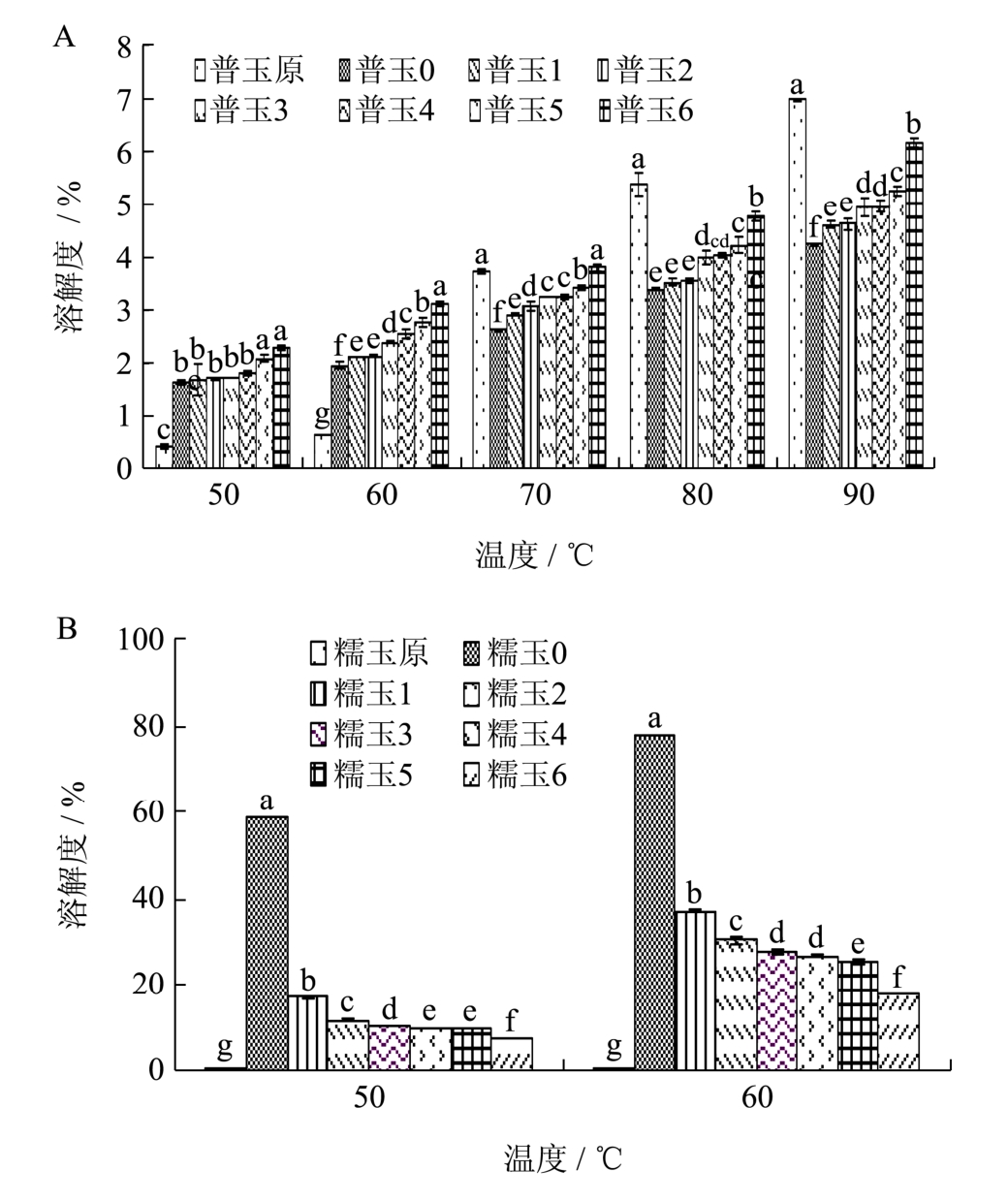
图4 不同冻融处理下普通玉米淀粉(A)和糯玉米淀粉(B)的溶解度
Fig.4 Solubility of normal starch (A) and waxy starch (B) after different numbers of FT cycles
淀粉的溶解度和膨胀力反映了淀粉颗粒内部结晶区与非结晶区的相互作用、结晶区内氢键的强弱及非结晶区淀粉分子间相互作用。淀粉的溶解度和膨胀力与淀粉形态、粒径大小、直链淀粉含量、直支比及颗粒内部非淀粉成分有关[24]。
由图4可知,淀粉样品溶解度均随温度升高而增加。因为在温度高的条件下,氢键更易断裂,使溶解度升高。
在50~60 ℃,两种凝胶化玉米淀粉的溶解度均显著大于原淀粉,而在70~90 ℃,凝胶化普通玉米淀粉的溶解度小于原淀粉,而凝胶化糯玉米淀粉未检出。糊化后的淀粉凝胶结构大部分处于无定型状态,在低温时就容易吸收水分,溶于水中,使溶解度高于原淀粉;但随温度升高,相比于原淀粉,凝胶化淀粉中的重结晶的淀粉分子之间的氢键更难断裂,从而使凝胶化淀粉的溶解度低于原淀粉[25]。糯玉米淀粉中的直链淀粉含量甚少,导致糊化后的淀粉中重结晶淀粉含量极少,在高温时,与原淀粉相比,已糊化的淀粉更易迅速吸水膨胀形成凝胶。
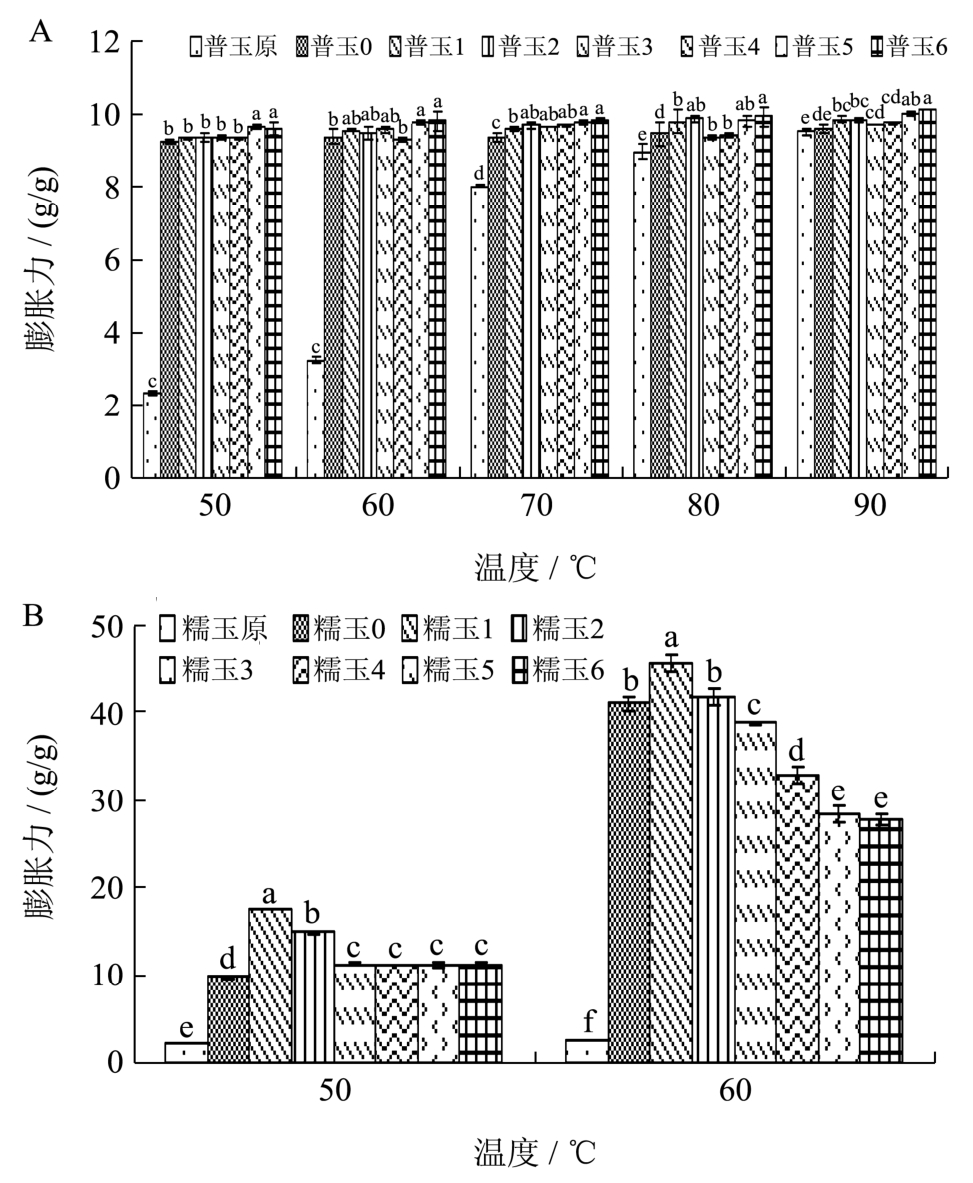
图5 不同冻融处理下普通玉米淀粉(A)和糯玉米淀粉(B)的膨胀力
Fig.5 Swelling degree of normal starch (A) and waxy starch (B) after different numbers of FT cycles
在相同温度下,随冻融次数增加,凝胶化普通玉米淀粉的溶解度呈逐渐升高趋势,而凝胶化糯玉米淀粉逐渐下降。一方面,由于淀粉在糊化的过程中,不会完全糊化,存在残存淀粉颗粒,在冻融交替处理下,残存淀粉颗粒破碎,释放出更多的淀粉分子,溶于水中,另一方面,冻融次数越多,淀粉凝胶结构破坏越严重,暴露出更多的羟基,更易于与水分子结合,使凝胶化普通玉米淀粉的溶解度升高。而凝胶化糯玉米淀粉的溶解度下降,表明冻融处理使糯玉米淀粉分子发生重结晶,形成了老化淀粉。
从图5可知,所有淀粉样品膨胀力均随温度的升高而增加;两种凝胶化淀粉的膨胀力均显著高于原淀粉,因为淀粉在糊化后,暴露出更多的羟基,能够结合更多的水分,使凝胶化玉米淀粉的膨胀力大于原淀粉。
随温度升高,凝胶化普通玉米淀粉的膨胀力随冻融次数增加无显著性变化;凝胶化糯玉米淀粉在50~60 ℃,随冻融次数增加,膨胀力呈现先增加后减小的趋势,而从 70 ℃开始,所有凝胶化糯玉米淀粉吸水迅速膨胀形成胶体。冻融破坏了残存淀粉颗粒结构,使膨胀力增大,但随冻融次数增多,淀粉中的老化淀粉越多,淀粉越难膨胀,导致淀粉的膨胀力减小。
2.7 体外消化性

图6 冻融循环处理对普通玉米淀粉(A)与糯玉米淀粉(B)消化性的影响
Fig.6 In vitro digestibility of normal starch (A) and waxy starch (B) after different numbers of FT cycles
根据淀粉在人体内消化速度,将淀粉分为快速消化淀粉(RDS)、慢速消化淀粉(SDS)和抗性淀粉(RS)。
由图6可见,与原淀粉相比,两种凝胶化玉米淀粉的RDS含量升高,SDS含量降低,凝胶化普通玉米淀粉的RS含量减小,凝胶化糯玉米淀粉无显著性变化。随冻融次数增加,凝胶化普通玉米淀粉的RDS含量呈平缓下降趋势,RS含量呈平缓上升趋势,SDS含量基本无显著性变化。凝胶化糯玉米淀粉的RSD、SDS和RS含量在冻融次数间均无显著性差异。
有研究表明,RS含量增加主要由于直链淀粉分子短期内重结晶引起的,而支链淀粉的重结晶则是引起淀粉体系中SDS含量增加的主要原因[26,27]。糯玉米淀粉中几乎不含有直链淀粉,所以不同冻融次数的凝胶化糯玉米淀粉的RS含量无显著性变化。在反复冻融作用下,水分子发生迁移,导致直链淀粉分子发生一定程度聚集,加剧了晶核的形成,促进了淀粉分子重结晶,使RS含量随冻融次数逐渐升高。
2.8 水解特性
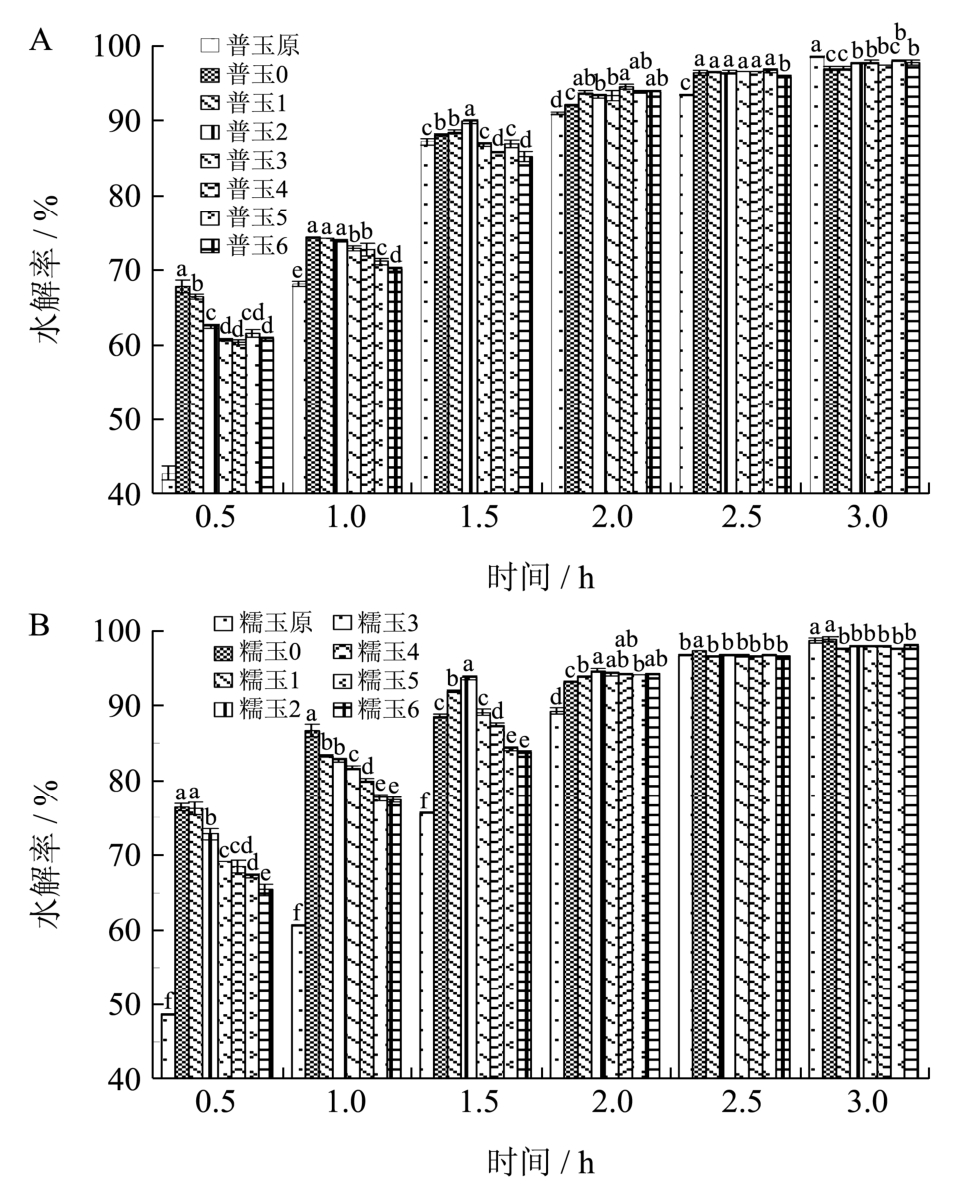
图7 不同冻融处理下普通玉米淀粉(A)和糯玉米淀粉(B)的水解率
Fig.7 Degree of hydrolysis of normal starch (A) and waxy starch (B) after different numbers of FT cycles
图7反映了所有淀粉样品在不同时间里的水解情况,冻融循环处理后的两种凝胶化玉米淀粉在水解初始阶段,水解率均远远高于原淀粉,凝胶化普通玉米淀粉从3.0 h开始水解率小于原普通玉米淀粉,而凝胶化糯玉米淀粉从2.5 h开始水解率小于原糯玉米淀粉。与原淀粉有序的分子结构相比,淀粉凝胶是由糊化的淀粉体系形成,结构处于无定型状态,易于与酶接触,使水解率较高,但随着水解时间的延长,酶溶液较难渗入已重结晶的淀粉分子体系,使水解率降低。
在0.5~1.0 h,随冻融次数的增加,两种凝胶化玉米淀粉的水解率均呈现降低趋势;在1.5~2.0 h,呈现先升高后降低的趋势;在2.5~3 h,水解率基本趋于平稳,结果间无显著性差异。冻融次数较少的凝胶化淀粉含有的老化淀粉含量较少,使水解初期,水解率较高;在酶解1.5 h后,水解率更多的受到了体积和内部结构的影响,冻融次数越多的凝胶化淀粉,内部结构破坏越严重,越易于水解,水解率逐渐升高;2.5 h后,大部分凝胶化淀粉水解结束,使所有样品的水解率趋于稳定。
普通玉米淀粉凝胶呈网络结构,而糯玉米淀粉凝胶在冻融2次后开始形成层状结构,并且网络孔洞和层距均随冻融次数增加而减小。由于一般淀粉难以完全糊化,会存在残存淀粉颗粒,其在冻融条件下被产生的冰晶进一步破坏,暴露出更多的羟基,同时,在冻融处理的过程中,淀粉分子发生重结晶,尤其是直链淀粉分子,形成老化淀粉,其分子间的氢键更难断裂,基于此原因导致凝胶化普通玉米淀粉理化特性的变化,而对凝胶化糯玉米淀粉的理化特性影响较小。冻融循环处理对两种凝胶化玉米淀粉的碘蓝值、碘结合力、最大吸收波长和直链淀粉含量均无显著性影响。随冻融次数增加,凝胶化普通玉米淀粉的透明度、持水性、RDS与SDS含量逐渐减小,而溶解度、膨胀力、水解率和RS含量逐渐升高;凝胶化糯玉米淀粉的透明度、持水性、溶解度和膨胀力逐渐减小,RDS、SDS和RS含量及水解率均无显著性变化。
参考文献:
[1] 叶晓枫,韩永斌,赵黎平,等.冻融循环下冷冻非发酵面团品质的变化及机理[J].农业工程学报,2013,29(21):271-278 YE Xiao-feng, HAN Yong-bin, ZHAO Li-ping, et al. Quality changes and mechanism of frozen non-fermented dough upon consecutive freeze-thaw cycles [J]. Transactions of the Chinese Society of Agricultural Engineering, 2013, 29(21): 271-278
[2] 汪星星,余小林,胡卓炎,等.冷冻面制品的研究现状及改良进展[J].粮食与油脂,2015,28(7):5-8 WANG Xing-xing, YU Xiao-lin, HU Zhuo-yan, et al. Research status and improvement advance on the frozen flour product [J]. Cereals and Oils, 2015, 28(7): 5-8
[3] 汪兰,程薇,乔宇,等.冻融循环处理对淀粉凝胶结构和性质的影响[J].食品科技,2010,2:177-182 WANG Lan, CHENG Wei, QIAO Yu, et al. The effect of freeze-thaw cycles on microstructure and physicochemical properties of starch gels [J]. Food Science and Technology, 2010, 2: 177-182
[4] Wang L, Yin Z, Wu J, et al. A study on freeze-thaw characteristics and microstructure of Chinese water chestnut starch gels [J]. Journal of Food Engineering, 2008, 88(2): 186-192
[5] Wang L, Xie B, Xiong G, et al. The effect of freeze-thaw cycles on microstructure and physicochemical properties of four starch gels [J]. Food Hydrocolloids, 2013, 31(1): 61-67
[6] 余世锋,杨庆余,刘军,等.反复冻融处理对大米RS3型抗性淀粉产率的影响[J].食品科技,2015,40(4):219-222 YU Shi-feng, YANG Qing-yu, LIU Jun, et al. Effects of freezing-thawing cycles on the resistant starch yield of rice RS3 [J]. Food Technology, 2015, 40(4): 219-222
[7] Srijunthongsiri S, Pradipasena P, Tulyathan V. Influence of heat-moisture modification in the presence of calcium compound on physicochemical properties of pigeon pea [Cajanus cajan (L.) Millsp.] starch [J]. Food Hydrocolloids, 2016, 53: 192-198
[8] Chen H, Fu X, Luo Z. Effect of gum arabic on freeze-thaw stability, pasting and rheological properties of tapioca starch and its derivatives [J]. Food Hydrocolloids, 2015, 51: 355-360
[9] Sun S, Zhang G, Ma C. Preparation, physicochemical characterization and application of acetylated lotus rhizome starches [J]. Carbohydrate Polymers, 2016, 135(2): 10-17
[10] Charles A L, Cato K, Huang T C, et al. Functional properties of arrowroot starch in cassava and sweet potato composite starches [J]. Food Hydrocolloids, 2016, 53: 187-191
[11] Majzoobi M, Kaveh Z, Blanchard C L, et al. Physical properties of pregelatinized and granular cold water swelling maize starches in presence of acetic acid [J]. Food Hydrocolloids, 2015, 51: 375-382
[12] Muadklay J, Charoenrein S. Effects of hydrocolloids and freezing rates on freeze-thaw stability of tapioca starch gels [J]. Food Hydrocolloids, 2008, 22(7): 1268-1272
[13] Sae-kang V, Suphantharika M. Influence of pH and xanthan gum addition on freeze-thaw stability of tapioca starch pastes [J]. Carbohydrate Polymers, 2006, 65(3): 371-380
[14] Varavinit S, Shobsngob S, Varanyanond W, et al. Freezing and thawing conditions affect the gel stability of differentvarieties of rice flour [J]. Starch-stärke, 2002, 54(1): 31-36
[15] Morrison W R, Laignelet B. An improved colorimetric procedure for determining apparent and total amylose in cereal and other starches [J]. Journal of Cereal Science, 1983, 1(1): 9-20
[16] 缪铭,江波,张涛,等.不同品种鹰嘴豆淀粉的理化性质研究[J].食品科学,2008,29(6):79-82 MIAO Ming, JIANG Bo, ZHANG Tao, et al. Physicochemical properties of starch from kabuli and desi chickpea cultivars [J]. Food Science, 2008, 29(6): 79-82
[17] 王晓艳,王宏兹,黄卫宁,等.高膳食纤维面团热机械学及面包的烘焙特性[J].食品科学,2011,32(13):78-83 WANG Xiao-yan, WANG Hong-zi, HUANG Wei-ning, et al. Termomechanical and baking characteristics of high dietary fiber dough [J]. Food Science, 2011, 32(13): 78-83
[18] Leach H W, McCowen L D, Schoch T J. Structure of the starch granule, swelling and solubility patterns of various patterns of various starches [J]. Cereal Chem., 1959, 36: 534-544
[19] Englyst H N, Kingman S M, Cummings J H. Classification and measurement of nutritionally important starch fractions [J]. European Journal of Clinical Nutrition, 1992, 46(2): 33-50
[20] Yuan R C, Thompson D B. Freeze-thaw stability of three waxy maize starch pastes measured by centrifugation and calorimetry [J]. Cereal Chemistry, 1998, 75: 571-573
[21] 赵思明,熊善柏,张声华.稻米淀粉的理化特性研究[J].中国粮油学报,2003,18(2):5-8 ZHAO Si-ming, XIONG Shan-bai, ZHANG Sheng-hua. Physicochemical properties of rice starch from different rice categories [J]. Journal of the Chinese Cereal and Oils Association, 2003, 18(2): 5-8
[22] Collonnier C, Schattner A, Berthier G, et al. Characterization and event specific-detection by quantitative real-time PCR of T25 maize insert [J]. Journal of AOAC International, 2005, 88(2): 536-546
[23] 洪静,郑学玲,刘翀,等.小麦总淀粉、A-淀粉及 B-淀粉的热损伤与其糊化度,糊化特性的关系[J].食品科学,2014, 35(15):38-42 HONG Jing, ZHENG Xue-ling, LIU Chong, et al. Relationship of thermally damaged starches of total starch, type-A Starch and type-B starch from wheat flour with gelatinization degree and gelatinization characteristics [J]. Food Science, 2014, 35(15): 38-42
[24] Sandhu K S, Singh N. Some properties of corn starches II: physicochemical, gelatinization, retrogradation, pasting and gel textural properties [J]. Food Chemistry, 2007, 101(4): 1499-1507
[25] 刘洁,刘亚伟.小麦原淀粉和预凝胶淀粉的糊化特性比较[J].中国粮油学报,2006,21(3):53-56 LIU Jie, LIU Ya-wei. Comparison on the pasting properties of the native and pre-gel wheat starches [J]. Journal of the Chinese Cereal and Oils Association, 2006, 21(3): 53-56
[26] 张根义,王明珠,彭善丽.慢消化淀粉的结构基础和机理[J].食品与生物技术学报,2010,29(4):481-487 ZHANG Gen-yi, WANG Ming-zhu, PENG Shan-li. Controlled glucose delivery in food for optimal health [J]. Journal of Food Science and Biotechnology, 2010, 29(4): 481-487
[27] Zhang L L, Hu X T, Xu X M, et al. Slowly digestible starch prepared from rice starches by temperature-cycled retrogradation [J]. Carbohydrate Polymers, 2011, 84(3): 970-974
Effect of Freeze-thawing Cycles on the Physicochemical Properties of Corn Starch Gels and Granules
Abstract:Normal and waxy corn starch gels were subjected to different numbers of freeze-thaw cycles (zero, one, two, three, four, five, and six times) and the changes in their physicochemical properties were analyzed. The scanning electron microscope (SEM) was used to analyze the microstructural properties of corn gels, and iodine blue value, iodine binding force, maximum absorption wavelength, transparency, water holding capacity, solubility, swelling degree, hydrolysis characteristics, and in vitro digestibility of the gelatinized starch were also determined. The results showed that normal corn starch gels had a porous structure after gelatinization, while waxy corn starch gels had a layered structure after two freeze-thawing cycles. The pore size and layer distance decreased with increasing number of freeze-thawing cycles. Freeze-thawing had no significant effect on the iodine blue value, the iodine binding force, the maximum absorption wavelength, and the amylose content of both gelatinized corn starch samples. As the number of freeze-thawing cycles increased, there was a decrease in the transparency, water holding capacity, and content of rapidly digestible starch (RDS) and slowly digestible starch (SDS) in the gelatinized normal corn starch, while there was an increase in the solubility, swelling degree, degree of hydrolysis, and resistant starch (RS) content. The gelatinized waxy corn starch showed decreased transparency, holding capacity, solubility, and swelling degree after freeze-thawing treatment, whereas there were no significant changes in RDS, SDS, and RS content as well as degree of hydrolysis after the treatment.
Key words:freeze-thawing cycles; gelatinized starch; physicochemical properties
文章篇号:1673-9078(2017)2-181-189
DOI:10.13982/j.mfst.1673-9078.2017.2.028
收稿日期:2016-01-20
基金项目:基本科研创新项目(Z109021423)