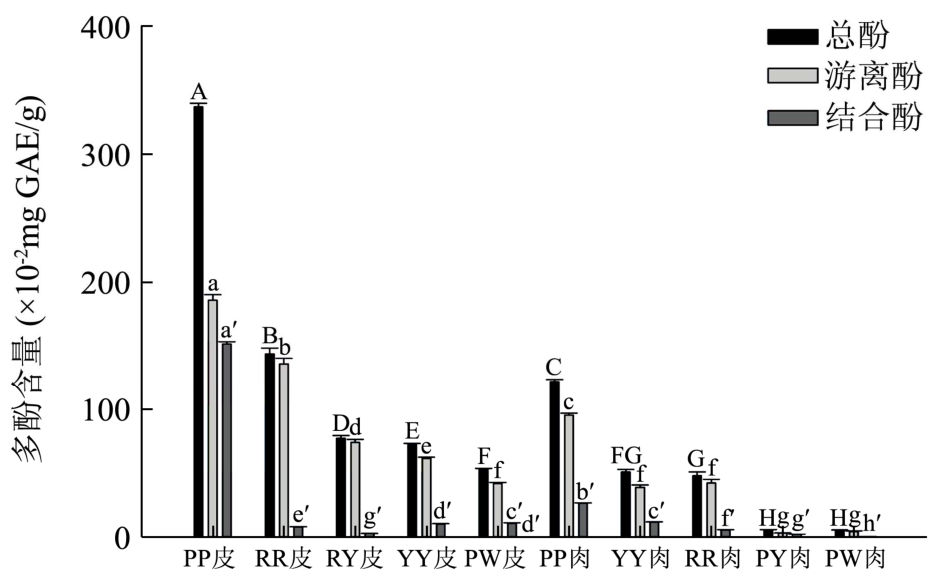
图1 不同品种番薯皮肉多酚含量比较
Fig.1 Comparison of the phenolic content from sweet potato skins and flesh
注:各组数据不同字母,表示其具显著性差异(p<0.05)。
摘要:为比较几种典型番薯品种的多酚含量及抗氧化活性,以冷冻丙酮和NaOH-乙酸乙酯分别提取番薯皮及番薯肉中游离态酚和结合态酚,并采用Folin-Ciocalteu比色法,亚硝酸钠-硝酸铝-氢氧化钠比色法分别测定提取物中多酚和黄酮的含量,以氧自由基吸收能力(ORAC)指征其抗氧化活性。发现番薯皮中总多酚、总黄酮含量及ORAC值均高于相应品种的番薯肉;而在不同品种中,以紫皮紫心番薯中皮、肉中总酚含量最高,分别为(336.87±2.83)×10-2和(121.79±1.68)×10-2mg GAE/g;紫皮紫心番薯皮ORAC值为(6917.79±672.70)×10-2μmol TE/g,高于其他品种,但不同品种薯肉ORAC值无显著性差异。探究了不同加热条件对紫皮紫心薯肉中多酚、黄酮和ORAC值的影响,与未经加热的生薯肉相比,100 ℃下加热30 min能使其提取物中多酚、黄酮和ORAC值分别提高2倍、2.6倍及5.7倍,表明热加工有利于提高番薯中多酚类物质的释放,提高其抗氧化活性。
关键词:番薯;多酚;抗氧化;热加工
番薯,又名甘薯、地瓜、白薯和红苕等,属旋花科一年生植物,原产于南美洲及大、小安的列斯群岛,目前在全世界的热带、亚热带地区以及中国大多数地区普遍栽培。番薯是一种高产而适应性强的粮食作物,也作为食品加工、淀粉和酒精制造工业的重要原料。番薯富含有膳食纤维、胡萝卜素和多种维生素,此外还含有丰富的多酚类物质。番薯中已经发现的酚类化合物包括:以绿原酸、咖啡酰奎宁酸及其衍生物为代表的酚酸类,以矢车菊素、芍药素衍生物及其糖苷为代表的花色苷类,以及以槲皮素及其糖苷为代表的类黄酮[1]。
机体氧化损伤是导致许多慢性病,如心血管病、癌症和衰老的重要原因。植物多酚抗氧化活性主要通过清除自由基以及抑制活性自由基的产生,从而防止自由基对脂质,蛋白质及核酸的氧化损伤[2]。张赟彬[3]等报道番薯多酚粗提液在体外对DPPH自由基,羟基自由基等具有较强清除能力。此外,番薯酚酸在体外对超氧阴离子自由基O2-·和羟基自由基·OH有较强清除作用,并能抑制由·OH引发的脂质氧化作用,同时能提高小鼠对于自由基的抵抗能力,对由 H2O2诱导的红细胞溶血反应有很好的保护作用[4]。
番薯在食用前一般要经过加热烹调,与生番薯相比较,加热处理会导致番薯中淀粉、Vc、还原糖和蛋白质等营养物质的损失。然而,Liu等在对甜玉米[5]和番茄[6]的研究中发现,加热过程有利于原料细胞基质中的结合性多酚的释放,从而提高其抗氧化活性。
本文对五个不同品种番薯食用块根部位的表皮和薯肉多酚含量进行测定,比较其抗氧化活性,同时探究热加工对番薯多酚含量及抗氧化活性的影响。我国是番薯种植大国,种植面积和产量居世界首位,年产量占世界总产量的85%左右。本研究对利用番薯作物资源、开发天然抗氧化剂和改善人们膳食习惯有重要指导意义。
1.1 原料及处理
取5个典型的番薯品种进行研究。以番薯的表皮和薯肉颜色区分的5个品种:黄皮黄心番薯(YY)、紫皮紫心番薯(PP)、红皮红心番薯(RR)、紫皮白心番薯(PW)和紫皮黄心番薯(PY),均购于广州本地农产品市场。
在热加工处理实验中,紫皮紫心番薯肉去皮后迅速用刀切成小块或搅拌机搅碎于试管中,分别处于不同温度(50~100 ℃)和不同时间条件下进行水浴加热,立即冷却后进行多酚类物质的提取。
1.2 主要试剂及仪器
福林酚试剂(Folin-Ciocalteu reagent),芦丁(rutin),没食子酸(gallic acid),2,2′-偶氮二异丁基脒二盐酸盐(2,2'-azobis(2-amidinopropane) dihydrochloride ,AAPH), 荧 光 素 钠 盐 (3',6'-dihydroxyspiro [isobenzofuran-1(3H),9'-(9H)xanthene]-3-one,disodium salt,FL),水溶性维生素E((±)-6-Hydroxy-2,5,7,8-tetramethylchromane-2-carboxylic acid,Trolox)购自Sigma-Aldrich公司(上海),其他试剂购于生工生物工程(上海)有限公司。所有试剂均为分析纯。
T-18均质机,德国IKA公司;RE-2000高速离心机,RE-1003旋转蒸发仪,德国Sartorious仪器有限公司;XW-80A分光光度计,上海棱光技术有限公司;DK-8D恒温水浴锅,广州富瑞仪器有限公司;FilterMax™ F5多功能酶标仪,美国Molecular Devices公司。
1.3 实验方法
1.3.1 酚类物质的提取
采用Liu等[7]的方法提取。
游离型多酚类物质的提取:称取10 g的番薯肉(或皮)与80%的冷丙酮(料液比1:2)混合捣碎,在冰水浴中均质3 min,真空抽滤得到滤液,滤渣继续用80%丙酮反复均质提取5次。合并滤液后,于45 ℃下真空旋转蒸发浓缩至原质量的10%,以去离子水定容并分装,-40 ℃冷藏待测。滤渣回收并烘干,-40 ℃冷藏待用。
结合型多酚类物质的提取:从游离酚提取中取出滤渣进行结合酚提取。滤渣用4 mol/L NaOH(1:8 m/V)在室温下震荡消化1 h,震荡过程中充氮气保护。用盐酸调节pH=2,用乙酸乙酯进行萃取,于4 ℃离心机中进行4000 r/min离心10 min,吸取上层清液(有机层),反复萃取至少5次。收集合并萃取液45 ℃旋转蒸发至干,以去离子水复溶并定容分装,-40 ℃冷藏待测。
1.3.2 多酚含量的测定
采用Folin-Ciocalteu比色法[7]测定各提取物的总酚含量。100 μL稀释后的提取物加入400 μL蒸馏水和100 μL的Folin-Ciocalteu试剂,反应6 min后依次加入1 mL、7%的Na2CO3溶液和0.8 mL蒸馏水,充分混匀后室温反应90 min,于760 nm测定其吸光值。各提取物酚含量以没食子酸为标准进行定量,结果以每100 g新鲜薯肉(皮)所含的没食子酸当量(Gallic Acid Equivalents)表示(×10-2mg GAE/g)。
1.3.3 黄酮含量的测定采用亚硝酸钠-硝酸铝-氢氧化钠比色法测定各提取物的黄酮含量。取1 mL稀释后的提取物,加入5%
亚硝酸钠溶液0.5 mL,摇匀后放置6 min,再加入10%
硝酸铝溶液0.5 mL,摇匀放置6 min。加入5%的氢氧化钠溶液2.5 mL,混匀,用95%乙醇定容至l0 mL,静置15 min,于波长510 nm处测吸光度。样品溶液中黄酮的含量以芦丁为标准进行定量,结果以每100 g新鲜薯肉(皮)所含的芦丁当量(Rutin Equivalents)表示
(×10-2mg RE/g)。
1.3.4 抗氧化能力的测定
抗氧化活性以氧自由基吸收能力(Oxygen Radical Absorbance Capacity,ORAC)为指标进行测定[6]。分别将待测样品和Trolox标准品用75 mM的磷酸缓冲液稀释,加入到荧光酶标仪96孔板中,每孔20 μL,同时加入200 μL、0.96 μM的荧光素钠盐(FL),37 ℃孵育20 min后,每孔加入119 μM的AAPH 20 μL,使用荧光分析仪在激发波长485 nm,发射波长520 nm连续测定各孔的荧光强度,每5 min测定一次,总测定时间为2.5 h。通过样品和Trolox标准品的荧光曲线下面积计算出各样品的ORAC值,结果以每100 g新鲜薯皮或薯肉样品中所含的 Trolox当量(Trolox Equivalents)表示(×10-2μmol TE/g)。
1.3.5 统计分析
所有实验三个重复。采用SPSS 21统计分析软件的 ANOVA方法对实验数据进行差异显著性检验分析,以p<0.05为差异显著,数据表示为平均值±标准差(Mean±SD)。
2.1 不同品种番薯多酚抗氧化活性比较

图1 不同品种番薯皮肉多酚含量比较
Fig.1 Comparison of the phenolic content from sweet potato skins and flesh
注:各组数据不同字母,表示其具显著性差异(p<0.05)。
五种番薯表皮和薯肉提取物中多酚含量如图1所示,不同品种番薯提取物中多酚含量差异较大;同一品种中,番薯皮中的游离酚、结合酚以及总酚含量均高于相应品种的番薯肉。其中以紫皮紫心番薯皮中总酚含量最高,达到(336.87±2.83)×10-2mg GAE/g,而其他品种番薯皮总酚含量在(143.67±4.47)×10-2mg GAE/g到(53.10±0.55)×10-2mg GAE/g之间,游离酚占总酚含量的79.0~96.0%,说明番薯皮多酚主要以游离酚形式存在,但紫皮紫心番薯皮中结合酚比例较其他品种高,占总酚含量44.9%。番薯皮中含有大量的多酚类物质,可能与其保护薯肉组织,防止昆虫采食的生理功能有关 。
薯肉是番薯的主要食用部分,在番薯整体中质量占比最大,在不同品种的番薯肉中,紫皮紫心番薯肉所含总酚为121.79±1.68 mg GAE/100 g,高于其他品种,是黄皮黄心番薯肉多酚含量的2.5倍,比多酚含量最低的紫皮白心番薯肉高24倍。紫皮紫心薯肉总酚中78.2%为游离酚,其他品种番薯肉游离酚占总酚含量的57.4~87.9%不等。在对其他常见富含淀粉的根茎类食物的研究中,马铃薯多酚含量为32 mg GAE/100 g[9],山药中为110 mg GAE/100 g[10],可见番薯,尤其是紫皮紫心番薯在同类食物中多酚含量更为丰富。

图2 不同品种番薯皮肉黄酮含量比较
Fig.2 Comparison of the flavonoid content from sweet potato skins and flesh
注:各组数据不同字母,表示其具显著性差异(p<0.05)。
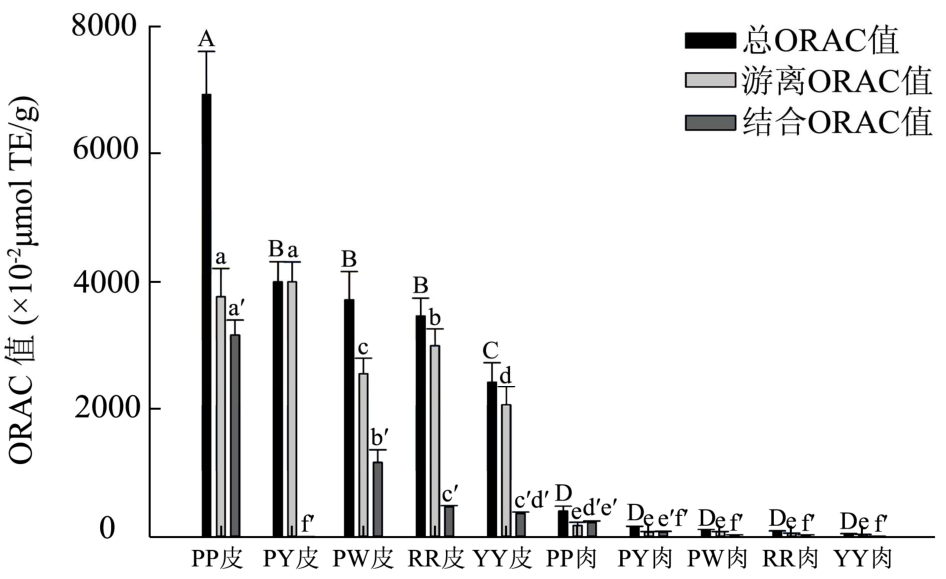
图3 不同品种番薯皮肉提取物ORAC值比较
Fig.3 Comparison of the ORAC values of the extracts of sweet potato skins and flesh
注:各组数据不同字母,表示其具显著性差异(p<0.05)。
不同品种番薯皮肉提取物中黄酮含量有很大差异,其中红皮红心番薯皮总黄酮含量最高达到(106.01±7.81)×10-2mg RE/g,是含量最低的紫皮白心番薯皮的 4倍,而紫皮紫心番薯皮的黄酮含量为(77.07±6.08)×10-2mg RE/g;番薯肉中紫皮紫心黄酮含量最高,为(37.14±1.16)×10-2mg RE/g,是其他品种的4.5倍以上。
与多酚含量类似,番薯皮中总黄酮含量均高于相应品种的番薯肉。除了紫皮黄心,黄皮黄心,红皮红心品种薯肉中结合黄酮比例较高外,各个样品中游离黄酮占总黄酮含量的71.6~95.4%,说明番薯皮肉中黄酮主要以游离形式存在。黄酮类化合物属于多酚类化合物的一种,黄酮苷元常与糖结合成黄酮苷。在番薯块根及番薯叶中已经发现的黄酮类化合物有槲皮素-3-O-β-D-半乳糖-吡喃糖苷,槲皮素-3-O-β-D-葡萄糖苷等[11],该类槲皮素衍生物糖苷在体外表现出较强的抗氧化活性[12]
不同品种番薯提取物的ORAC值如图2所示,五种番薯皮的总 ORAC值变幅在(2419.14±308.39)至(6917.79±672.70)×10-2μmol TE/g之间,均远高于相应品种的薯肉。游离多酚提取物ORAC值占总ORAC值的43.8~99.9%,说明番薯的总抗氧化能力主要源于游离酚提取物。抗氧化能力最强的是紫皮紫心薯皮提取物,紫皮紫心薯肉提取物 ORAC值为(402.39±71.99)×10-2μmol TE/g,与其他品种薯肉无显著差异。紫皮紫心番薯皮提取物抗氧化能力远高于薯肉,薯肉抗氧化能力仅为薯皮的6%。
番薯皮肉提取物中总多酚与提取物总 ORAC值呈极显著正相关(r2=0.785,p<0.01),总黄酮与ORAC值也具有显著相关性(r2=0.694,p<0.05),表明多酚可能是番薯中的一种主要的抗氧化物质。番薯皮抗氧化能力远高于番薯肉,可能是因为番薯皮中含有更多的多酚黄酮类物质。钟伟[13]等用ORAC法比较了不同品种番薯叶提取物的抗氧化活性,本文中各品种番薯皮提取物ORAC值均高于其报道值,说明番薯皮比番薯叶具有更强的抗氧化活性。
上述结果表明,番薯皮中的多酚、黄酮含量及抗氧化活性总体上都要比相应该品种番薯肉中要高或强,其中以紫皮紫心品种番薯皮中,多酚含量以及抗氧化活性最高,红皮红心番薯皮中黄酮含量最高;而番薯肉作为主要食用部分,紫皮紫心番薯肉具有高于其他品种的多酚、黄酮含量,但其抗氧化活性与其他品种薯肉相比没有显著性差异。番薯除了作为粮食作物,与其它类似作物相比,具有更高的多酚及黄酮含量及更强的抗氧化活性。同时,对番薯皮来说,虽然其多酚和黄酮含量远高于番薯肉,然而不宜直接食用;但由于其具有较强的抗氧活性,它具有被应用开发成功能性食品的潜力。
2.2 热加工对去皮紫皮紫心番薯多酚抗氧化活性的作用
番薯在食用前一般要经过加热烹饪,水煮法或油炸法容易使番薯中营养物质溶出或高温破坏,因此本研究选用易于控制时间及温度的水浴加热方式,考察不同加热温度下加热15 min和30 min对去皮后的紫皮紫心番薯(以下简称“去皮紫薯”)多酚、黄酮及其抗氧化性的影响。
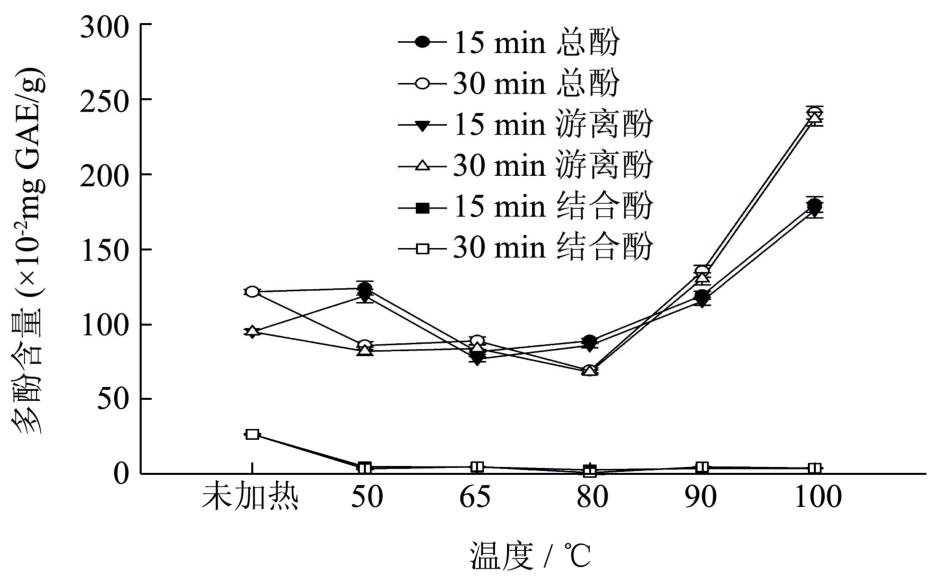
图4 不同加热条件对去皮紫薯多酚含量的影响
Fig.4 Effect of thermal treatment on the phenolic content of purple sweet potato flesh
不同温度下去皮紫薯多酚结果如图 4,由于总酚组成中以游离酚为主,因此总酚变化趋势与游离酚相近似。在50 ℃下加热15 min,样品游离酚含量略有增加;在65 ℃、80 ℃及90 ℃下加热15 min,样品总多酚含量与未经加热的生番薯(121.78±1.68)×10-2mg GAE/g)相比有不同程度下降。不同温度下加热30 min后多酚变化情况与加热15 min相似。然而当在100 ℃加热15 min和30 min,样品中多酚含量明显增加,分别达到(180.06±5.28)×10-2和(241.03±4.25)×10-2mg GAE/g,为生番薯多酚含量的1.5倍和2倍。
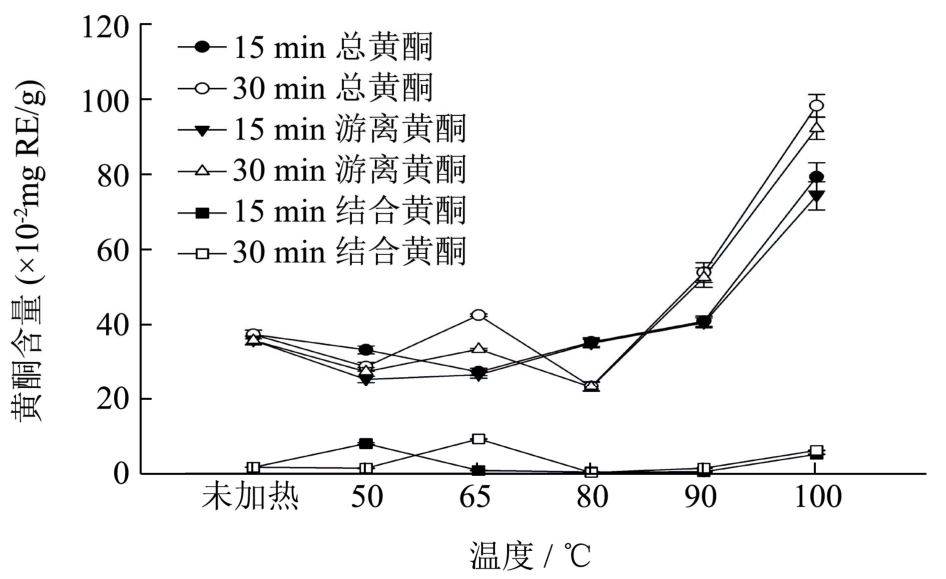
图5 不同加热条件对去皮紫薯黄酮含量的影响
Fig.5 Effect of thermal treatment on the flavonoid content of purple sweet potato flesh
总黄酮含量中,游离黄酮含量所占比例较大,因此总酚含量变化趋势与游离黄酮相近似。结合黄酮含量在不同条件下含量较低,范围在(0.33±0.05)~(9.09±0.09)×10-2mg RE/g之间。加热15 min的总黄酮量变化随温度升高呈稍下降后上升的趋势,其中100 ℃下的黄酮含量最高,为(79.15±3.79)×10-2mgRE/g,而在65 ℃下加热15 min的黄酮含量为最低的(27.14±0.99)×10-2mg RE/g。在不同温度下加热30 min的总黄酮含量变化趋势和15 min的相似,在90 ℃下加热 30 min,总黄酮含量为(53.67±2.63)×10-2mg RE/g,当加热温度为100 ℃时,样品中总黄酮含量明显增加,达到(98.16±3.00)×10-2mg RE/g,为未加热样品的2.6倍。
以上结果表明对去皮紫薯在100 ℃下进行加热处理,可以显著提高提取物中多酚黄酮含量,并且加热30 min比15 min效果更好。传统观点认为加热加工后的蔬果营养价值会降低,这一认识可能基于Vc等营养成分的热不稳定性。然而近年来研究发现,植物性食品经过热加工后,提取物中多酚含量有所增加,从而提高其抗氧化活性[5,6]。本研究中发现经100 ℃加热后,去皮紫薯提取物中多酚类物质含量显著增加,与Cipriano等[14]报道一致,可能是因为加热过程使番薯中多酚氧化酶(PPO)失活,在提取过程中能够保护多酚化合物不被迅速氧化;100 ℃下加热使番薯煮熟的过程中,细胞结构被破坏,细胞内容物释出,同时组织变得松软,有助于多酚被完全提取。同时可以发现结合多酚或结合黄酮在经加热后含量下降,说明加热过程可能伴随着酚类物质从结合态到游离态的转变。

图6 不同加热条件对去皮紫薯提取物ORAC值的影响
Fig.6 Effect of thermal treatment on the ORAC value of purple sweet potato flesh extract
去皮紫薯经不同温度加热15 min和30 min后抗氧化能力以ORAC值表示,不同加热条件下结合多酚提取物含量很低,其结合酚提取物 ORAC值在(0.72±0.08)×10-2μmol TE/g 到(225.75±21.12)×10-2μmol TE/g之间。在加热15 min条件下,加热50 ℃、65 ℃与未加热样品提取物ORAC值近似,在80 ℃下有一定下降,随后随温度上升,ORAC值在加热100 ℃时达到(1877.81±94.65)×10-2μmol TE/g,是未加热样品的4.7倍。而65 ℃加热30 min时,样品提取物ORAC值有一定提升,达到(981.56±79.39)×10-2μmol TE/g,这一趋势与图5中不同温度加热对黄酮含量的影响相似,说明该温度下ORAC值的增加可能与黄酮含量增加有关。通过统计比较去皮紫薯在不同加热条件下多酚含量、黄酮含量以及ORAC值的相关性,发现总黄酮含量与ORAC值相关性为r2=0.915(p<0.01),高于总酚与ORAC值相关性(r2=0.844,p<0.01),说明去皮紫薯中黄酮类物质可能对其抗氧化活性有重要贡献。在 100 ℃加热条件下其 ORAC值达到最大值(2311.90± 33.36)×10-2μmol TE/g,是未加热样品的5.7倍。去皮紫薯样品在100 ℃下加热30 min能够明显提高其提取物的抗氧化能力。高温对植物中抗氧化活性可能存在两重作用,一方面是高温会使得化学性质活泼的化合物降解或发生反应,降低其抗氧化活性;另一方面对于热稳定的化合物,高温有助于其从植物组织中解离,从而增加提取物中抗氧化物质的含量[12]。
上述结果表明,与未经加热的生番薯相比,去皮紫薯经100 ℃加热30 min后,其提取物中多酚、黄酮含量明显增加,从而提高其抗氧化活性,这一结果为紫皮紫心番薯作为保健食品与天然抗氧化剂来源的开发提供了加工工艺上的参考依据。
比较了5个不同品种番薯薯皮和薯肉中多酚、黄酮含量,发现番薯皮中多酚黄酮含量均高于相应品种的番薯肉;不同品种番薯皮、肉中多酚主要以游离酚形式存在。紫皮紫心薯皮与薯肉中总酚含量分别为(336.87±2.83)×10-2和(121.79±1.68)×10-2mg GAE/g,高于其他品种;红皮红心番薯皮中总黄酮含量最高,达到(106.01±7.81)×10-2mg RE/g,而在紫皮紫心薯肉总黄酮含量高于其他品种。以ORAC法评价不同品种番薯提取物的抗氧化性,结果显示番薯皮提取物抗氧化能力比相应品种番薯肉提取物更强,其中以紫皮紫心薯皮提取物ORAC值最高;但不同品种薯肉抗氧化能力无显著性差异。总体而言紫皮紫心番薯中多酚类物质含量最为丰富,具有最强的抗氧化活性。样品多酚含量与其抗氧化能力有显著相关性,说明样品中多酚类物质可能是其抗氧化活性的重要来源。加热处理对去皮紫薯中多酚、黄酮、抗氧化活性具有一定的影响,与未经加热的生薯肉相比,100 ℃下加热30 min能使其提取物中多酚、黄酮和ORAC值分别提高2倍、2.6倍及5.7倍,表明适当条件下的热加工有利于提高番薯中多酚类物质的释放,提高其抗氧化活性。
参考文献:
[1] 王金亭.三类甘薯活性物质及其生理效应[J].重庆工学院学报(自然科学版), 2007,21(10):145-148 WANG Jin-ting. Research on the active compositions and their physiological functions of three type of sweet-potatoes [J]. Journal of Chongqing Institute of Technology (Natural Science Edition), 2007, 21(10): 145-148
[2] Meyers K J, Watkins C B, Pritts M P, et al. Antioxidant and antiproliferative activities of strawberries [J]. Journal of Agricultural and Food Chemistry, 2003, 51(23): 6887-6892
[3] 张赟彬,龚钢明,戴妙妙.甘薯多酚粗提液的抗氧化活性研究[J].中国粮油学报,2007,22(5):76-80 ZHANG Yun-bin, GONG Gang-ming, DAI Miao-miao. Antioxidant activity of polyphenolic extract from Ipomoea batatas L [J]. Journal of the Chinese Cereals and Oils Association, 2007, 22(5): 76-80
[4] 黄洪光.甘薯抗氧化物质的分离提取及其生物活性的研究[D].大连:辽宁师范大学,2004 HUANG Hong-guang. Study on isolation, extraction and biological activity of antioxidant subtance of sweet potato [D]. Dalian: Liaoning Normal University, 2004
[5] Dewanto V, Wu X Z, Liu R H. Processed sweet corn has higher antioxidant activity [J]. Journal of Agricultural and Food Chemistry, 2002, 50(UNSP JF025593717): 4959-4964 [6] Dewanto V, Wu X Z, Adom K K, et al. Thermal processing enhances the nutritional value of tomatoes by increasing total antioxidant activity [J]. Journal of Agricultural and Food Chemistry, 2002, 50(10): 3010-3014
[7] Guo X, Li T, Tang K, et al. Effect of germination on phytochemical profiles and antioxidant activity of mung bean sprouts (Vigna radiata) [J]. Journal of Agricultural and Food Chemistry, 2012, 60(44): 11050-11055
[8] Verghese A, Soumya C B, Shivashankar S, et al. Phenolics as chemical barriers to female fruit fly, bactrocera dorsalis (hendel) in mango [J]. Current Science, 2012, 103(5): 563-566
[9] 李静,聂继云,毋永龙.Folin-Ciocalteus法测定马铃薯中的总多酚[J].中国马铃薯,2014,1:27-30 LI Jing, NIE Ji-yun, WU Yong-long. Determination of total polyphenols in potato using folin-ciocalteus method [J]. Chinese Potato Journal, 2014, 1: 27-30
[10] 赵一霖.原生贡寮山药多酚提取物抗氧化性质的研究[D].宁波:宁波大学,2014 ZHAO Yi-lin. Research of Dioscorea alata Extract Antioxidant Properties [D]. Ningbo: Ningbo University, 2014 [11] Li J Y, Dong G P, Li M L, et al. Efficient counter-current chromatographic isolation and structural identification of phenolic compounds from sweet potato leaves [J]. Journal of Liquid Chromatography & Related Technologies, 2012, 35(11): 1517-1527
[12] Juaniz I, Ludwig I A, Huarte E, et al. Influence of heat treatment on antioxidant capacity and (poly) phenolic compounds of selected vegetables [J]. Food Chemistry, 2016, 197(A): 466-473
[13] 钟伟.红薯叶中多酚类物质的抗氧化及抗肿瘤细胞增殖作用研究[D].广州:华南理工大学,2015 ZHONG Wei. Research evaluation of antioxidant and antitumour activities of Ipomoea batatas Leaves [D]. Guangzhou: South China University of Technology, 2015
[14] Cipriano P D A, Ekici L, Barnes R C, et al. Pre-heating and polyphenol oxidase inhibition impact on extraction of purple sweet potato anthocyanins [J]. Food Chemistry, 2015, 180: 227-234
Antioxidant Activities of Different Sweet Potato Cultivars and Their Thermal Stability
Abstract:To compare the phenolic contents and antioxidant activities of extracts from different sweet potato cultivars, cold acetone, and sodium hydroxide-ethyl acetate were used to extract the free and bound phenolics from sweet potato skin and flesh, respectively. Folin-Ciocalteu assay and the sodium nitrite-aluminum nitrate-sodium hydroxide colorimetric method were applied to measure the phenolic and flavonoid content, and the antioxidant activities were evaluated by the oxygen radical absorbance capacity (ORAC) method. It was found that total phenolic and total flavonoid content of peels were higher than those of corresponding flesh. Among different cultivars, the purple skin-purple flesh (PP) sweet potato had the highest phenolic content of (336.87±2.83)×10-2and (121.79±1.68)×10-2mg GAE/g in skin and flesh, respectively. The ORAC value of PP skin extract was the highest at (6917.79±672.70)×10-2μmol TE/g, while the ORAC values of flesh extracts from different cultivars showed no significant difference. The effects of heat treatment on the phenolic and total flavonoid content and the ORAC value of PP flesh were also investigated. The phenolic content, flavonoid content, and ORAC values of samples heated at 100 ℃ for 30 min were 2-fold, 2.6-fold, and 5.7-fold higher than those of the unprocessed sweet potato, respectively, indicating that heat treatment could favor the release of phenolic compounds in sweet potatoes and enhance their antioxidant activities.
Key words:sweet potato; polyphenol; antioxidant; heat treatment
文章篇号:1673-9078(2017)2-136-141
DOI:10.13982/j.mfst.1673-9078.2017.2.021
收稿日期:2016-03-25
基金项目:广东省科技计划项目(2013B090600129,2014A010107007);广州市科技计划项目(2012J5100024)