摘要:本论文从大连地区海产品消化腺中筛选产胞外多糖(EPS)的乳杆菌属菌株,并研究其所产EPS的功能特性,选出一株目标菌,对其EPS分离纯化,测定纯化后各多糖组分的相对分子量。获得EPS产量相对较高的菌株经16S rRNA序列测定鉴定为Lactobacillus plantarum subsp.plantarum-4,Lactobacillus plantarum-12,Lactobacillus plantarumsubsp. plantarum-49;对3株植物乳杆菌及其EPS进行清除DPPH自由基的测定,Lactobacillus plantarum-12的EPS浓度为0.5 mg/mL时,清除率为48.82±3.88%,显著高于另外2株菌(p<0.05);测定植物乳杆菌的EPS抑制E. coli ATCC25922在HT-29细胞上的粘附效果,Lactobacillus plantarum-12的EPS浓度为0.2 mg/mL时,抑制率为78.23%±2.46%,显著高于另外两株菌(p<0.05);Lactobacillus plantarum-12的EPS可显著抑制E·coli ATCC25922刺激HT-29细胞产生IL-8(p<0.05)。Lactobacillus plantarum-12的EPS经DEAE-Sepharose Fast Flow离子交换柱、Sepharose CL-6B凝胶柱和Sephacryl HR S200凝胶柱层析分离得到两组分,测定两组分的相对分子质量分别为8.5×104u和7.4×104u。
关键词:胞外多糖;抗氧化性;粘附性;IL-8;纯化
胞外多糖(exopolysaccharide,EPS)是细菌在生长代谢过程中分泌到细胞壁外的粘液或荚膜多糖[1]。乳酸菌胞外多糖是一种天然的高分子聚合物,具有诸多功能特性,如改善发酵乳的质构特性及对人体健康的益生作用等。从乳制品中筛选出的菌株,在乳品中所产多糖赋予了产品良好的稳定性等、使产品细腻均匀、口感顺滑、乳清析出少。许多学者对乳酸菌胞外多糖的结构和功能特性及其构效关系进行了广泛而深入的研究。产粘多糖的菌株提高发酵乳的粘度和质构与多糖的产量并非有直接的相关,而与多糖的分子量、链的长度、分支度以及多糖和酪蛋白之间的作用等有关[2]。LAB EPS的免疫调节活性与多糖的物化性质有关,比如分子量[3]。李伟等通过体外细胞模型研究了L. helveticus MB2-1的胞外多糖LHEPS对人胃癌细胞BGC-823的增殖情况,其粗多糖及其纯化组分均能抑制肿瘤细胞增殖[4]。
自然界中大量分布着产胞外多糖的乳酸菌,从发酵乳、酸奶和奶酪中都可筛选得到乳酸菌菌株。目前国内外产EPS的乳酸菌集中在乳杆菌属、球菌属、链球菌属、明串珠菌属及双歧杆菌属等[5]。已被研究过EPS的LAB有嗜热链球菌(S. thermophilus)、嗜酸乳杆菌(Lb. acidophilus)、乳酸乳球菌乳脂亚种(Lc. Lactis ssp.Cremoris)、乳酸乳球菌(Lc. lactis subsp. lactis)、嗜热链球菌(S. thermophilus)和植物乳杆菌(Lb.plantarum) 等[6]。产胞外多糖的乳酸菌有很多,可从婴幼儿粪便或哺乳动物肠道中分离获得。近年研究发现,鱼类肠道中也存在嗜酸乳杆菌和短乳杆菌等多种乳酸菌类群[7]。利用鱼肠或扇贝的消化腺分离出乳酸菌,将对产胞外多糖的乳酸菌菌种资源提供有力的支撑。
多糖有分子量较大,内部结构和构象较复杂等特点,多糖的纯化是其结构解析的基础。一般利用乙醇沉淀法得到粗多糖,再经色谱柱如离子交换柱或凝胶层析柱的层析进一步纯化。多糖的带电性质和分子量的差异性可作为根据来选择合适的分离介质,如DEAE-Sephadex、DEAE-Sepharose、Sepharose系列和Superdex系列等[8]。
本论文以海洋生物的消化道为原料,筛选出胞外多糖产量相对较高的目标菌株,同时对胞外多糖的功能特性进行初步研究,并对其进行提取纯化和分子量的测定。
1.1 材料与主要试剂
海产品:大连市甘井子区水产市场购买的活的夏威夷扇贝、鸦片鱼和多宝鱼,作为分离乳杆菌的样品。
MRS培养基(青岛高科园海博生物技术有限公司,产品编号HB0384)用于培养乳酸菌;LB培养基:酵母膏0.5%,蛋白胨1%,氯化钠1%,pH为7.0。
HT-29细胞:来自中国科学院上海典藏细胞库,用含10%胎牛血清(gibco)的RPMA1640细胞培养液(Therom Fisher Scientific Inc)培养;DPPH试剂,购于美国sigma公司;浓硫酸;三氯乙酸;Triton×100,上海生工生物公司;H2O2试剂;苯酚。
1.2 实验方法
1.2.1 菌落初筛
取新鲜鱼肠和夏威夷扇贝的消化腺用剪刀剪碎,放在研钵里进行研磨。加入生理盐水,进行适当稀释后,涂布于pH 6.0的MRS培养基上,置厌氧培养箱中37 ℃恒温培养48 h,获得单菌落培养物。
1.2.2 菌株复筛
将从平板上得到的单菌落,取其部分用5%的H2O2进行接触酶试验;用接种环挑取接触酶阴性单菌落,于MRS固体培养基上进行三区划线,37 ℃培养48 h,获得单菌落;观察菌株在平板上的菌落形态特征。挑取少量菌体于载玻片上进行涂片、革兰氏染色,然后在显微镜下观察菌体形态;保留接触酶阴性、革兰氏染色阳性的杆菌和球菌,进行后续试验。
1.2.3 产胞外多糖乳杆菌的筛选
选择从海产品中分离获得的杆菌,依据高产胞外多糖乳酸菌的筛选方法[9],筛选出胞外多糖产量相对较高的杆菌。将分离获得的杆菌,按2%(V/V)的接种量接种到10 mL的MRS液体培养基中37 ℃培养18 h。在10000 r/min、4 ℃条件下离心15 min得上清液,沸水浴10 min使分解多糖的酶类失活,冷却到室温。加入80%(m/V)的三氯乙酸至终浓度7%(m/V),恒温摇床(160 r/min,20 ℃)震荡2 h,在10000 r/min,4 ℃条件下离心15 min除去蛋白沉淀,得上清液。加入20 mL无水乙醇4 ℃静置12 h。在10000 r/min、4 ℃条件下离心15 min,收集多糖沉淀,加入10 mL超纯水溶解粗多糖,并装于透析袋(截留分子量8 ku~14 ku)中,超纯水透析3 d;透析结束后,采用苯酚–硫酸法测定透析后多糖溶液的浓度,筛选出胞外多糖产量相对较高的菌株,委托宝生物工程(大连)有限公司经16S rRNA基因序列测定,经BLAST比对进行菌株鉴定。
1.2.4 粗多糖的提取
选择胞外多糖产量相对较高的菌株进行培养,依据粗多糖的制备方法提取粗多糖[10]。将活化好的菌株按3~5%(V/V)的接种量接种到MRS液体培养基1000 mL中培养18 h。在10000 r/min、4 ℃条件下离心15 min除菌体沉淀得上清液,沸水浴10 min,使上清液中分解多糖的酶类失活,冷却到室温。60 ℃旋蒸浓缩至原体积的1/5,加TCA至终浓度为7%(m/V),置于层析柜中静置10 h,在10000 r/min、4 ℃条件下离心20 min除去蛋白沉淀,在上清液中加入3倍体积的无水乙醇,置于4 ℃层析冷柜中静置24 h,确保多糖能完全沉淀。在10000 r/min,4 ℃条件下离心10 min收集多糖沉淀。加入部分超纯水溶解多糖沉淀后,倒入透析袋(截留分子量8~14 ku)中,超纯水透析2 d且经常换水以便小分子物质的去除,冷冻干燥得到粗多糖样品,用保鲜膜包住并存放于干燥器中。
1.2.5 粗多糖中多糖和蛋白质含量的测定
提取的粗多糖,以葡萄糖(分析纯)为标准,采用苯酚–硫酸法进行多糖含量的测定。以牛血清白蛋白为标准,采用考马氏亮蓝法进行蛋白质含量的测定。
1.2.6 乳酸杆菌及胞外多糖清除DPPH自由基的测定
1.2.6.1 乳酸杆菌清除DPPH自由基的测定
产胞外多糖相对较高的3株菌进行清除DPPH自由基能力的测定[11]:1 mL菌液(107CFU/mL)中加入l mL的0.2 mmol/L DPPH试剂,强烈振荡后室温下避光反应30 min,3500 r/min离心10 min,在517 nm处测定上清液吸光度。平行测定3次。
其中,Ai为1 mLDPPH+1 mL样品的吸光度;Aj为1 mL PBS+1 mL样品的吸光度;Ac为1 mLDPPH+l mLPBS的吸光度。1.2.6.2 胞外多糖清除DPPH自由基的测定
胞外多糖清除DPPH自由基能力的测定:配制不同浓度的EPS溶液:0.10、0.30、0.50 mg/mL;向1 mL 的0.2 mmol/L DPPH试剂中加入1 mL上述样品,强烈振荡后室温下避光反应30 min,3500 r/min离心10 min,在517 nm处测定上清液吸光度。平行测定3次,计算方法与菌体抗氧化测定相同。
1.2.7 胞外多糖对E.coli的抑制黏附作用
采用在改良型RPMI-1640培养液(HyClone)中培养HT-29细胞,并添加10%(V/V)的胎牛血清(Gibco)。细胞置于37 ℃的CO2培养箱中培养,每24 h换一次液。将消化后的HT-29细胞接到12孔细胞培养板中,每孔加入2.5×105个细胞,于CO2培养箱中培养,待细胞达到80%~90%融合时,进行黏附实验。
用HT-29细胞模型研究乳酸菌胞外多糖抑制大肠杆菌的黏附作用[12]。配制不同浓度EPS溶液:0.05、 0.10、0.20 mg/mL,然后每孔加入100 μL的多糖样品到HT-29单层细胞中,在CO2培养箱中37 ℃培养1 h,然后用无菌PBS洗涤3次,移去未粘附的EPS,加入0.1 mL E·coliATCC25922悬液(108CFU/mL)反应1 h。然后用无菌PBS清洗细胞4次,加入0.5 mL、5% (V/V) Triton-100,吹打混匀后冰浴5 min,对照组只加入E·coliATCC25922处理,梯度稀释后平板计数实验组和对照组中E·coliATCC25922的菌落数。
式中Ce表示对照组E·coliATCC25922在HT-29细胞上的粘附数,C则表示实验组E·coliATCC25922在HT-29细胞上的粘附数。
1.2.8 胞外多糖对E.coli诱导HT-29细胞分泌IL-8和IL-10的影响
配制不同浓度EPS溶液:125、250、500 μg/mL。将0.1 mL 1×108CFU/mL E·coliATCC25922和0.1 mL不同浓度的多糖溶同时加入到细胞培养板中,在37 ℃的5% CO2培养箱中培养3 h。8000 r/min离心10 min收集上清液,存放于-80 ℃超低温冰箱中待测。按Human IL-8/IL-10试剂盒(Quantitative analysis Human IL-8 ELISA Research Reagent,Wuhan)说明书用酶联免疫吸附检测测定IL-8和IL-10[13]。
1.2.9 胞外多糖的纯化
1.2.9.1 多糖的离子柱的纯化
用Tris-HCl缓冲液(0.05 mol/L,pH 7.60)平衡DEAE-Sepharose Fast Flow 离子柱(D2.6×28 cm,GEHealthcare),流速为2 mL/min。粗多糖用Tris-HCl缓冲液溶解后过 0.45 μm滤膜上样,上样浓度为 3 mg/mL,上样量100 mL。先用Tris-HCl缓冲液洗脱,再用Tris-HCl与1.0 mol/L NaCl进行梯度洗脱;每管收集5 mL。采用苯酚-硫酸法逐管检测糖含量,绘制洗脱曲线。收集不同组分经透析、浓缩、冷冻干燥得到不同多糖组分。
1.2.9.2 多糖的凝胶柱纯化
(1)中性多糖的Sephacryl HR S200凝胶柱层析
离子柱纯化后,第一个峰形多糖组分进一步在Sephacryl HR S200凝胶柱(D1.6×60 cm,GEHealthcare)上进行分离。用含0.15 mol/L NaCl的Tris-HCl洗脱液(0.05 mol/L,pH 7.60)进行洗脱,上样浓度:2 mg/mL,上样体积:2 mL,流速:0.10 mL/min,每管收集体积:2.0 mL。检测收集管中多糖含量[14],合并收集峰组分,经透析、浓缩、冷冻干燥得到多糖组分。
(2)酸性多糖的Sepharose CL-6B凝胶柱层析
离子柱纯化后,第二个峰形多糖组分进一步在Sepharose CL-6B凝胶柱(D1.6×90 cm,GEHealthcare)上进行分离。用含0.15 mol/L NaCl的Tris-HCl缓冲液(0.05 mol/L,pH 7.60)进行平衡。上样浓度:1 mg/mL,上样量:2 mL,流速:0.40 mL/min,每管收集体积:5.0 mL。检测收集管中多糖含量,合并收集峰组分,经透析、浓缩、冷冻干燥得到多糖固样。
1.2.10 多糖的分子量测定
采用不同分子量(Gel Filtration Calibration Kit LMW/HMW)的标准品,高分子量标准品重均分子量Mw分别为158 ku、440 ku、75 ku、43 ku和669 ku,低分子量标准品重均分子量Mw分别为6500 u、13700 u、29 ku、43 ku和75 ku,使用蛋白纯化仪测定每个标准品在Sepharose CL-6B凝胶柱上的洗脱体积。用含0.15 mol/L NaCl的Tris-HCl缓冲液(0.05 mol/L,pH 7.60)进行平衡。上样浓度:1 mg/mL,上样量:2 mg,流速:0.40 mL/min,每管收集体积:5.0 mL。以标准品相对分子量的对数(LogWt)为纵坐标,以各标准品在峰值处的洗脱体积为横坐标,绘出标准曲线,得出二者的线性回归方程。
称取纯化后的两多糖组分各1.0 mg溶于2 mL的超纯水中,与标准品相同的条件在 Sepharose CL-6B凝胶柱上进行上样和洗脱,收集洗脱液,苯酚-硫酸法逐管检测多糖含量,记录洗脱体积,代入回归方程,得到两组分的相对分子量。
1.2.11 数据分析
所有实验重复三次,数据采用SPSS 20.0软件进行统计,差异显著性检验采用独立样本t检验和单因素方差分析(ANOVE,LSD)。所有数据均表示为平均值±标准误差,p<0.05表示差异显著。
2.1 乳酸杆菌的筛选
从海鱼及扇贝肠道中分离获得的菌落进行接触酶实验和革兰氏染色,镜检后,保留接触酶阴性,革兰氏阳性的菌株,共52株,分别编号。多宝鱼肠道分离获得40株菌(1号~40号),鸦片鱼肠道分离菌9株菌(41号~49号),夏威夷扇贝消化腺分离菌3株菌(50号~52号),如表1所示,将分离获得的接触酶阴性、革兰氏染色阳性的杆菌初步认为是乳杆菌属细菌。
表1 海产品肠道分离获得的菌株
Table 1 Results of physiological and biochemical tests on the strains isolated from the intestinal tract of seafood
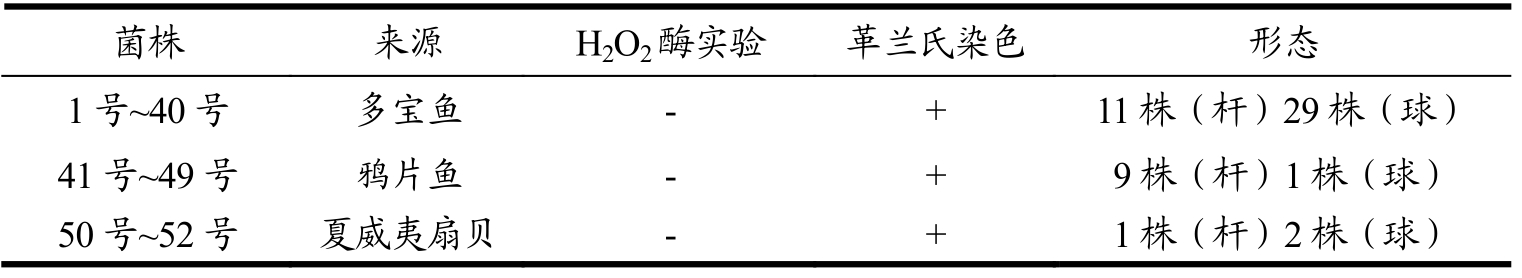
菌株 来源 H2O2酶实验 革兰氏染色 形态1号~40号 多宝鱼 - + 11株(杆)29株(球)41号~49号 鸦片鱼 - + 9株(杆)1株(球)50号~52号 夏威夷扇贝 - + 1株(杆)2株(球)
2.2 产胞外多糖乳酸杆菌的筛选
从分离获得的 20株疑似乳杆菌中筛选高产胞外多糖的菌株,21株菌株在MRS培养基中的EPS产量不尽相同。其中,4号菌、12号菌、37号菌、44号菌、49号菌和50号菌的EPS产量分别为(589.21±3) mg/L、(631.10±5) mg/L、(561.23±12) mg/L、(561.61±4) mg/L、 (617.32±10) mg/L和(531.40±11) mg/L,显著高于其它14株菌株(p<0.05);将产EPS量较高的这6株菌进行16SrRNA序列测定,经BLAST序列比对,鉴定为植物乳杆菌菌株,见表2;4号、12号和49号植物乳杆菌在培养 18 h后,EPS产量显著高于其它菌株(p<0.05)。因此,将4号、12号和49号作为出发菌株,用于后续研究。
表2 植物乳杆菌胞外多糖的产量
Table 2 EPS production of Lactobacillus plantarum in MRS medium

注:同一列数据右上角标示不同小写字母表示差异显著(p<0.05)。
菌株编号 菌株名称 菌株来源 EPS产量/(mg/L) 4号 Lactobacillus plantarum subsp. plantarum-4 多宝鱼的肠道 589.21±3c12号 Lactobacillus plantarum-12 多宝鱼的肠道 631.10±5e37号 Lactobacillus plantarum-37 多宝鱼的肠道 561.23±12b44号 Lactobacillus plantarum subsp. plantarum-44 鸦片鱼的肠道 561.61±4b49号 Lactobacillus plantarum subsp. plantarum-49 鸦片鱼的肠道 617.32±10d50号 Lactobacillus plantarum-50 夏威夷扇贝肠道 531.40±11a
2.3 粗多糖中多糖和蛋白含量的测定
多糖含量的测定回归方程为:y=0.0075x+9.2925 (R2=0.9991),测定粗多糖制品中的总糖含量为62.11%。蛋白质含量的测定回归方程为:y=8.4172x+ 0.0226(R2=0.9973)未检测到蛋白质的存在。分析胞外粗多糖另外的成分,可能存在一些小分子杂质或含有部分未除尽的水分。因此需要将粗多糖经离子交换柱和凝胶柱层析进行纯化。
2.4 菌株及其胞外多糖的清除DPPH自由基作用
2.4.1 菌体清除DPPH自由基测定

图1 受试植物乳杆菌清除DPPH自由基的能力
Fig.1 DPPH free radical scavenging abilities of the tested Lactobacillus plantarum strains using LGG as a control
注:LGG作为对照组,字母表示p<0.05。
以DPPH自由基清除率为指标,研究浓度为107CFU/mL的3株受试植物乳杆菌和标准菌株LGG的抗氧化能力。结果表明:受试的4株乳酸杆菌对DPPH均有一定的清除能力,清除率的范围为33%~45%,其中植物乳杆菌12号清除率较高,为44.78%左右,显著高于其他受试菌株(p<0.05),故选定其作为后续实验菌株。测定DPPH清除率虽然操作简单,但实验过程中发现其结果重现性较差,重复实验的结果往往有较大差异。不同来源的乳酸菌菌株对DPPH自由基的清除能力方面存在差异,且其发挥抗氧化作用的活性物质存在的部位也因菌株的不同而具有较大的差异性[15]。部分研究发现,乳酸菌具有抗氧化能力,但并没有明确其抗氧化作用机理。推测乳酸菌代谢产物EPS可能发挥一定的抗氧化能力,因此将乳酸菌的多糖,用于后续的清除DPPH自由基的研究。
2.4.2 胞外多糖清除DPPH自由基测定结果
采用DPPH·清除试验对产胞外多糖较高的3株乳杆菌胞外多糖进行抗氧化活性测定,并以LGG所产EPS为对照。如表3所示,当EPS为0.5 mg/mL时,Lactobacillus plantarum subsp. plantarum-4 ,Lactobacillus plantarum-12,LGG的多糖对DPPH自由基的清除率47%以上,与Lactobacillus plantarum subsp. plantarum-49之间有显著差别(p<0.05)。在EPS浓度为0.30 mg/mL时,其DPPH自由基清除能力为24%以上,不同EPS之间无显著性的差别(p>0.05);当EPS浓度达到0.1 mg/mL时,其清除能力较小;Ye等[16]体外研究了Pseudomonas PF-6产的酸性多糖对DPPH自由基(DPPH·)、羟自由基(·OH)和超氧自由基(O2-·)均有较强的清除作用,而且多糖对·OH的清除能力强于Vc,清除O2-·的能力与Vc相当,显示出较强的抗氧化能力。乳酸菌胞外多糖中很多都具有自由基清除能力的生物学活性,而其清除能力的大小与其一级结构如分子量大小或高级结构等有直接作用的关系[17]。根据DPPH清除能力,利用Lactobacillus plantarum-12和Lactobacillus plantarum subsp. plantarum-49的多糖,用于后续的抑制大肠杆菌粘附性的研究。
表3 植物乳杆菌胞外多糖的DPPH自由基清除能力Table 3 DPPH free radical scavenging ability of EPS produced by Lactobacillus plantarum strains using LGG as a control (p<0.05)
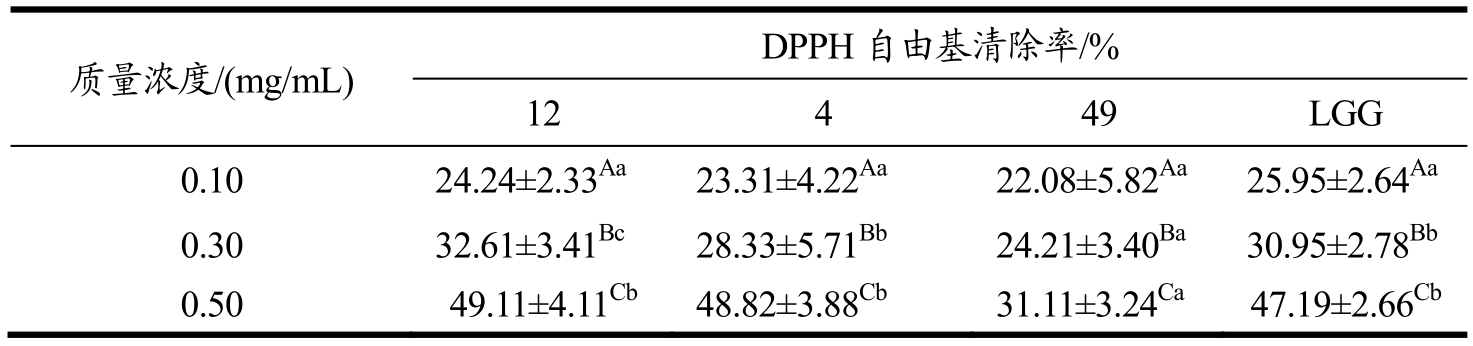
注:LGG作为对照组(p<0.05);同1行数据右上角标示不同小写字母表示差异显著(p<0.05);同1列数据右上角标示不同大写字母表示差异显著(p<0.05)。
质量浓度/(mg/mL) DPPH自由基清除率/% 12 4 49 LGG 0.10 24.24±2.33Aa23.31±4.22Aa22.08±5.82Aa25.95±2.64Aa0.30 32.61±3.41Bc28.33±5.71Bb24.21±3.40Ba30.95±2.78Bb0.50 49.11±4.11Cb48.82±3.88Cb31.11±3.24Ca47.19±2.66Cb
2.5 多糖抑制E.coli粘附作用
研究发现12号,49号及LGG菌株所产EPS具有很好的抑制E. coli ATCC25922对HT-29细胞粘附的效果,但是抑制效果各异。结果如表4所示,不同乳酸杆菌所产EPS对E.coli的抑制黏附作用具有浓度效应,随着多糖浓度的增加抑制粘附率升高,不同浓度的 EPS之间,抑制黏附作用存在显著性的差别(p>0.05);当浓度为0.2 mg/mL时,LGG菌株的EPS的抑制粘附率高于49号的EPS,小于12号的EPS,三者之间有显著差别(p<0.05)。由此可见,3者之间12号菌株的EPS的抑制E. coli ATCC25922在HT-29细胞上粘附的效果相对更好。一些研究表明一些Lactobacillus为益生菌,其代谢产物可以抑制E. coli的感染和粘附,初步推测EPS起到空间排阻的作用,通过屏蔽细胞表面黏附位点,增强了肠上皮细胞的屏障功能,减少了致病菌对细胞的粘附作用[18]。
表4 不同浓度EPS排除E·coli对HT-29细胞的粘附作用
Table 4 Inhibition of the adhesion of E. coli to HT-29 cells with different doses of EPS (p<0.05)

注:同 1行数据右上角标示不同小写字母表示差异显著(p<0.05);同1列数据右上角标示不同大写字母表示差异显著(p<0.05)。
质量浓度/(mg/mL)抑制粘附率/% LGG 49 12 0.05 4.63±0.60bA2.83±0.90aA12.97±2.36cA0.10 14.87±0.65aB30.33±0.60bB44.63±1.60cB0.20 57.93±6.45aC56.07±1.79bC78.23±2.46cC
2.6 多糖抑制E.coli诱导HT-29细胞分泌IL-8 和IL-10
将2种菌株中抑制粘附性更强的Lactobacillus plantarum-12作为出发菌株,研究其EPS抑制大肠杆菌刺激HT-29细胞产生IL-8和IL-10的作用。结果如表5所示,与对照组相比,Lactobacillus plantarum-12和LGG的不同浓度EPS显著抑制IL-8的产生(p<0.05)。当EPS作用浓度降低时,E.coli刺激HT-29细胞产生的IL-8逐渐增多。G. Moorthy研究表明,Lactobacillus的EPS与E. coli ATCC43889 同时加入细胞时,EPS也可以抑制E. coli ATCC43889对细胞的接触和刺激,从而减少细胞IL-8的表达[19]。对照组E.coli单独刺激HT-29细胞产生的IL-10的量为(49.77±1.38) pg/mL,Lactobacillus plantarum-12和LGG的EPS对E.coli刺激HT-29细胞分泌IL-10量影响效果不明显(p>0.05),既是2株乳酸杆菌的EPS没有刺激HT-29细胞产生IL-10的功能。
表5 Lactobacillus plantarum-12和LGG不同浓度EPS抑制E·coli刺激细胞产生IL-8和IL-10
Table 5 Inhibition of the E. coli-induced-production of IL-8 and IL-10 by various concentrations of EPS produced by Lactobacillus plantarum-12 and LGG
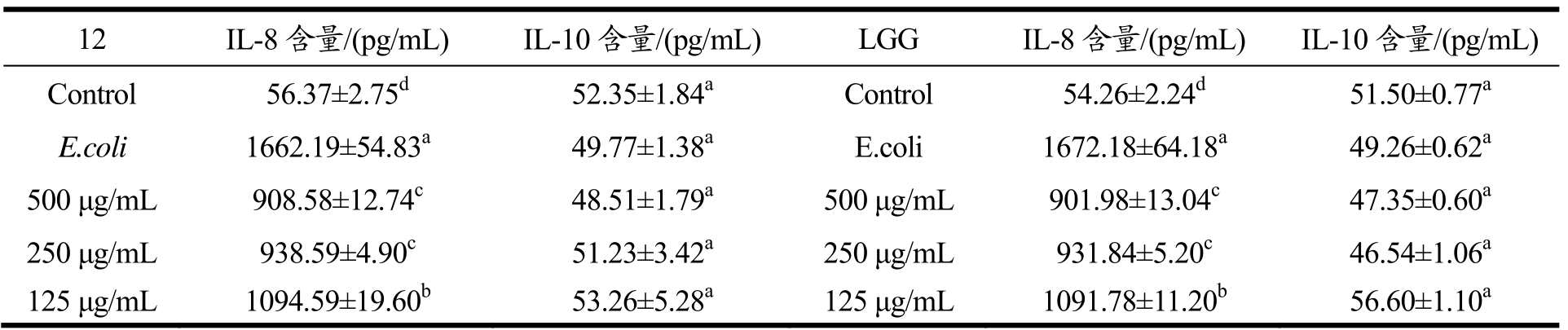
注:同一列数据右上角标示不同字母表示差异显著(p<0.05)。
12 IL-8含量/(pg/mL) IL-10含量/(pg/mL) LGG IL-8含量/(pg/mL) IL-10含量/(pg/mL) Control 56.37±2.75d52.35±1.84aControl 54.26±2.24d51.50±0.77aE.coli 1662.19±54.83a49.77±1.38aE.coli 1672.18±64.18a49.26±0.62a500 μg/mL 908.58±12.74c48.51±1.79a500 μg/mL 901.98±13.04c47.35±0.60a250 μg/mL 938.59±4.90c51.23±3.42a250 μg/mL 931.84±5.20c46.54±1.06a125 μg/mL 1094.59±19.60b53.26±5.28a125 μg/mL 1091.78±11.20b56.60±1.10a
2.7 多糖的分离纯化
粗多糖是由几种不同的多糖组分组成的,需要进一步分离纯化。胞外多糖经离子交换柱纯化洗脱时先用Tris-HCl洗脱液洗2个柱体积,把粗多糖中的中性多糖洗出,再用Tris-HCl洗脱液与NaCl溶液梯度洗脱5个柱体积,把粗多糖中酸性多糖洗出,最后用NaCl溶液走2个柱体积。如图2所示,粗多糖由于所带电荷的不同分离出两个组分EPS1和EPS2,梯度洗脱和Tris-HCl洗脱液洗出的多糖量接近,说明该粗多糖中两种组分含量接近。测定两种组分的质量分数分别为粗多糖的25.5%和37%。组分EPS1由pH 7.6的缓冲液洗脱出来,推测多糖成分为不带电荷的中性多糖。组分EPS2在含NaCl缓冲液中梯度洗脱下来,推测EPS2组分是带有负电荷,为酸性或带酸性基团多糖。
根据分离组分的分子大小不同,组分的洗脱体积不同,从而将不同分子量的组分分离。组分EPS2的洗脱曲线如图3所示。由此可以看出,在洗脱的大峰后面还有扁平的小峰,初步判断EPS2经离子柱分离纯化不够彻底,含有两个分子量大小不同的组分。由于小峰所占含量很低,透析冻干后称量,无法称出。收集大峰组分,透析和冻干后,作为组分EPS2的一个组分,并记录组分在峰值处的洗脱体积。
利用分子量大小不同,多糖组分 EPS1经Sephacryl HR S200凝胶柱层析纯化。洗脱曲线如图4所示。在一个大的主要吸收峰后面尾随一个较小的峰,说明组分EPS1是由主要的一个分子量组成,并夹带少量其它分子量的多糖。检测发现第二个小峰形的糖量较少,所以只对第一个大峰的组分进行收集,合并大峰处溶液,然后再上Sepharose CL-6B凝胶柱,检测其纯度,若洗脱曲线只出现单一的峰,即只有一种分子大小的组分,测其洗脱体积,确定其分子质量。
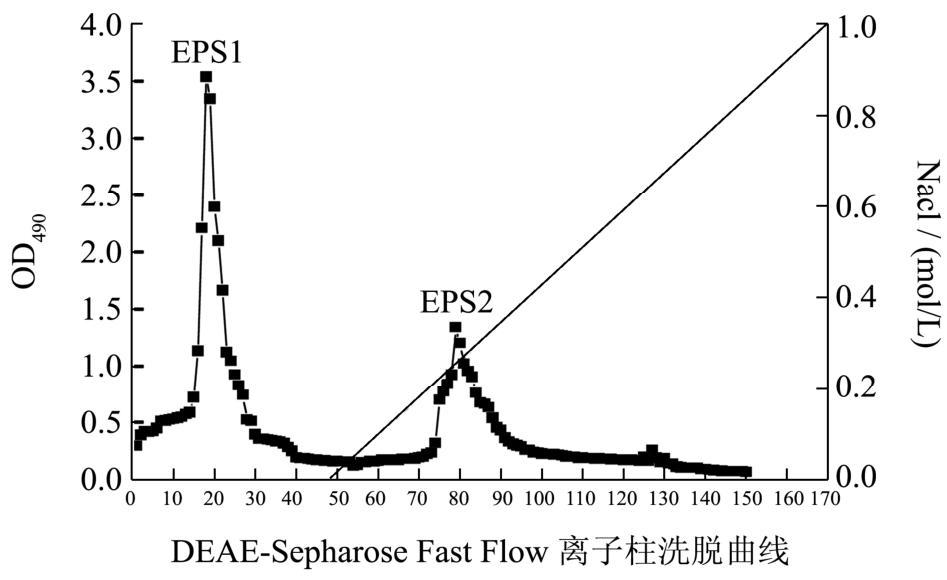
图2 EPS在离子柱上的洗脱曲线
Fig.2 Elution profile of EPS on anion-exchange chromatography column
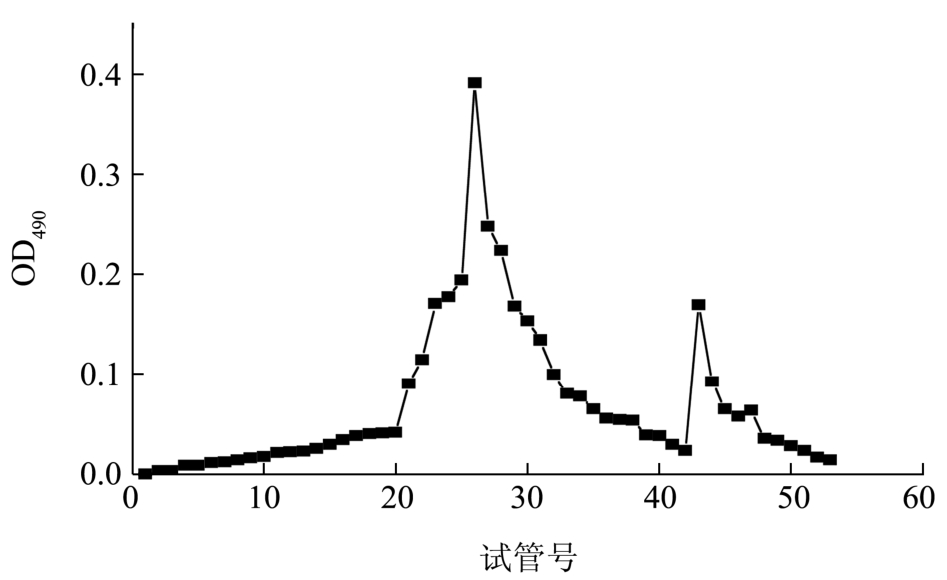
图3 EPS2在CL-6B凝胶柱洗脱曲线
Fig.3 Elution profile of EPS2 on CL-6B column
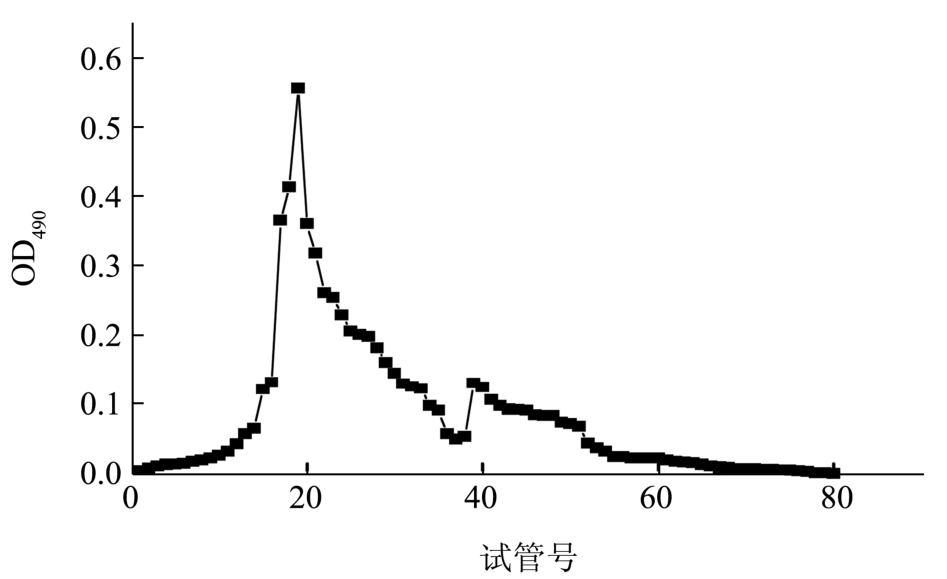
图4 EPS1在HR S200凝胶柱洗脱曲线
Fig.4 Elution profile of EPS1 on HR S200 column
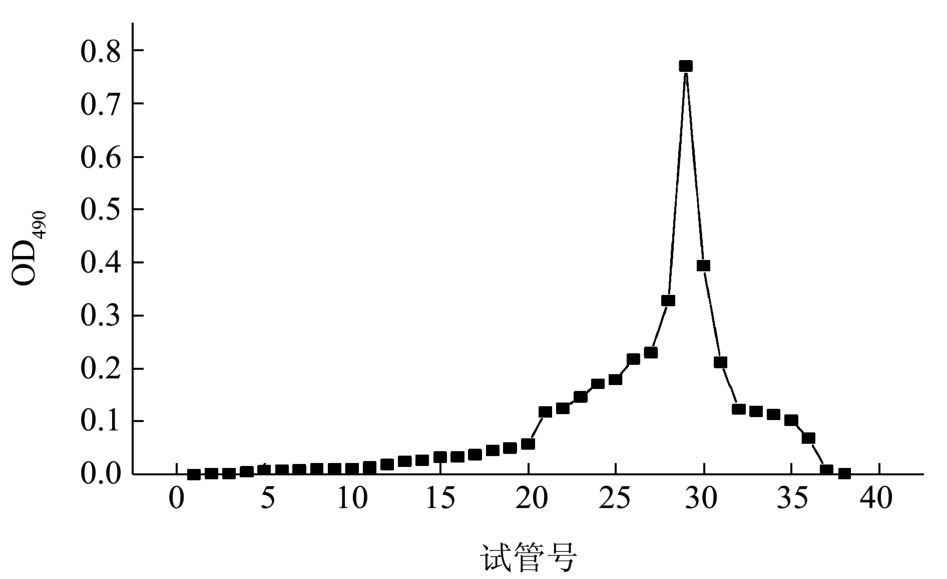
图5 EPS1在CL-6B凝胶柱的洗脱曲线
Fig.5 Elution profile of EPS1 on CL-6B column
把组分EPS1上Sephacryl HR S200凝胶柱纯化后的主要吸收峰,透析冻干后再经SepharoseCL-6B分子筛层析柱。洗脱曲线如图5所示,样品经洗脱只出现一个峰,则表明该多糖组分为分子量大小均一的组分。记录峰值处的洗脱体积145 mL,收集洗脱液透析、冻干后得到纯化多糖,为白色纤维状疏松固体。
2.8 多糖的分子量测定
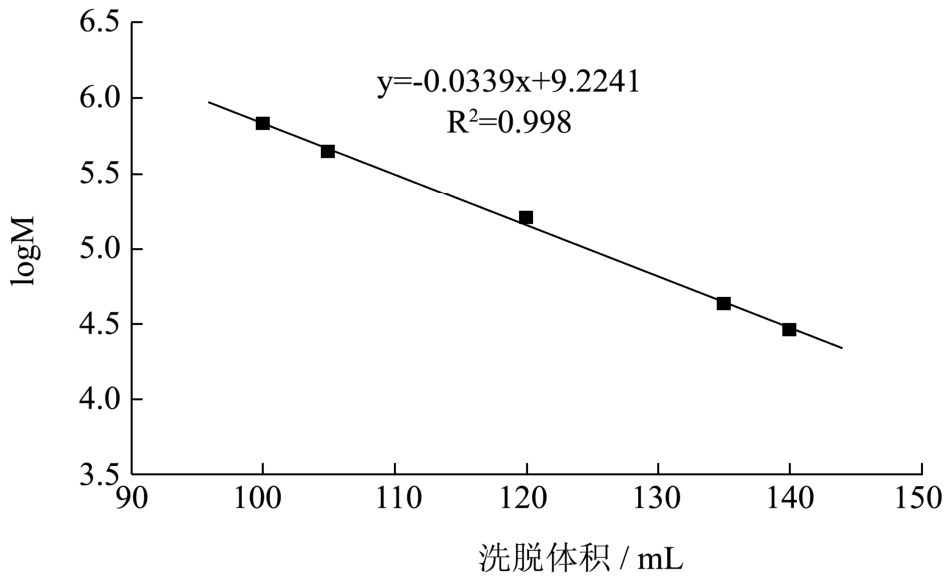
图6 多糖分子量与洗脱体积的标准曲线
Fig.6 Standard curve of polysaccharide Mw
高效凝胶渗透色谱(GPC)或高效体积排阻色谱(SEC)是常用的测定多糖分子量的方法。当多糖的结构与标准品的结构接近时,测定的结果才与实际值比较接近。因此,本实验采用在Sepharose CL-6B凝胶柱上测定标准品的洗脱体积与分子质量的标准曲线,进一步测定组分EPS2和组分EPS1的相对分子质量。
依据相对分子质量不同的标准品在 Sepharose CL-6B凝胶柱上的洗脱体积不同,求得回归方程:logM=-0.033x+9.224(R2=0.9981)。组分 EPS2在Sepharose CL-6B凝胶柱上的洗脱体积130 mL,则分子质量为8.5×104u。组分EPS1在Sepharose CL-6B凝胶柱上的洗脱体积为 145 mL,则分子质量为7.4×104u。组分EPS2的分子质量略大于组分EPS1的分子质量。此外,文献中报道的LAB EPS的分子量范围在 104~6×106u[20],两多糖组分的分子量均在其之间。
本论文从夏威夷扇贝、鸦片鱼和多宝鱼的肠道里分离获得21株疑似乳酸杆菌,不同菌株的EPS产量存在一定差异,初筛得到的3株乳杆菌胞外多糖产量显著(p<0.05)高于其它菌株,鉴定为Lactobacillus plantarum subsp. plantarum-4、Lactobacillus plantarum-12、Lactobacillus plantarum subsp. plantarum-49;根据菌株及胞外多糖对DPPH 的清除率,筛选到2株优良的菌株Lactobacillus plantarum-12和Lactobacillusplantarum subsp. plantarum-49 ; Lactobacillus plantarum-12不同浓度的粗多糖能抑制大肠杆菌在HT-29细胞上的粘附,当EPS浓度为0.2 mg/mL时,抑制率为78.23%±2.46%,显著高于另外2株菌(p<0.05);Lactobacillus plantarum-12的粗多糖能显著抑制E.coli刺激HT-29细胞产生IL-8(p<0.05)。Lactobacillus plantarum-12的胞外多糖经离子柱和凝胶柱纯化获得2组分,测得2组分的相对分子量分别为8.5×104u和7.4×104u。胞外多糖纯化后组分的功能特性仍需进一步研究,与粗多糖的功能特性进行对比,确定发挥生物学活性的主要成分。
参考文献:
[1] Sutherland I W. Bacterial exopolysaccharides [J]. Adv. Microb. Physiol., 1971, 8(8): 142-213
[2] Ruas-Madiedo P, Tuinier R, Kanning M, et al. Role of exopolysaccharides produced by Lactococcus lactis subsp. cremoris on the viscosity of fermented milks [J]. International Dairy Journal, 2002, 12(8): 689-695
[3] Lopez P, Monteserin D C, Gueimonde M, et al. Exopolysaccharide-producing Bifidobacterium strains elicit different in vitro responses upon interaction with human cells [J]. Food Research International, 2012, 46(1): 99-107
[4] Li W, Ji J, Tang W, et al. Characterization of an antiproliferative exopolysaccharide (LHEPS-2) from Lactobacillus helveticus MB2-1 [J]. Carbohydrate Polymers, 2014, 105(1): 334-340
[5] Bouzar F, Cerning J, Desmazeaud M. Exopolysaccharide production in milk by Lactobacillus delbrueckii ssp. bulgaricus CNRZ 1187 and by two colonial variants [J]. Journal of Dairy Science, 1996, 79(2): 205-211
[6] Feng Mei-Qin. The study of the fermentation, structural and characters of the plant Lactobacillus [D]. Nanjing: Nanjing Agricultural University, 2012
[7] Wang Lin-Jun. The separation of the fish intestinal lactobacillus acidophilus and its characters analysis [J]. Journal of Chinese Food, 2014, 5: 20-25
[8] Shao Li. Screening of Lactobacillus producing exopolysaccharide and the study of its separation, structural and biological characters [D]. Wuxi: Jiangnan University, 2015
[9] Yu Jing, Zeng Xiao-qun, Wang Hong-fei, et al. Screening of lactobacillus producing high yield exopolysaccharide and the optimize of its fermentation conditions [J]. Journal of Chinese Food, 2015, 15(2): 93-98
[10] Hamet M F, Piermaria J A, Abraham A G. Selection of EPS-producing Lactobacillus strains isolated from kefir grains and rheological characterization of the fermented milks [J]. LWT-Food Science and Technology, 2015, 63(1): 129-135
[11] Yin J Y, Nie S P, Zhou C, et al. Chemical characteristics and antioxidant activities of polysaccharide purified from the seeds of Plantago asiatica L [J]. Journal of the Science of Food and Agriculture, 2010, 90(2): 210-217
[12] Ren D, Li C, Qin Y, et al. Inhibition of Staphylococcus aureus adherence to Caco-2 cells by Lactobacilli and cell surface properties that influence attachment [J]. Anaerobe, 2012, 18(5): 508-515
[13] Bleau C, Monges A, Rashidan K, et al. Intermediate chains of exopolysaccharides from Lactobacillus rhamnosus RW-9595M increase IL-10 production by macrophages [J]. Journal of Applied Microbiology, 2010, 108(2): 666-675
[14] Wang Xi, Luo Xian, Xu Xiao-yang, et al. Comparative studies on antioxidant activities of different lactic acid bacterial strains [J]. Food Science, 2010, 31(1): 197-201
[15] Ye S, Liu F, Wang J, et al. Antioxidant activities of an exopolysaccharide isolated and purified from marine Pseudomonas PF-6 [J]. Carbohydrate Polymers, 2012, 87(1): 764-770
[16] Mende S, Peter M, Bartels K, et al. Addition of purified exopolysaccharide isolates from S. thermophilus to milk and their impact on the rheology of acid gels [J]. Food Hydrocolloids, 2013, 32(1): 178-185
[17] Melo M R S, Feitosa J P A, Freitas A L P, et al. Isolation and characterization of soluble sulfated polysaccharide from the red seaweed Gracilaria cornea [J]. Carbohydrate Polymers, 2002, 49(4): 491-498
[18] Ruas-Madiedo P, Gueimonde M, Margolles A, et al. Exopolysaccharides produced by probiotic strains modify the adhesion of probiotics and enteropathogens to human intestinal mucus [J]. Journal of Food Protection, 2006, 69(8): 2011-2015
[19] Huang Yi, Huang Qi, Li Wei-feng, et al. The antioxidant function of the Lactobacillus rhamnose against Caco-2 and the influence of the secretion of cytokines [J]. Journal of Animal Husbandry and Veterinary, 2012, 43(2): 250-254
[20] Hassan A N. ADSA foundation scholar award: possibilities and challenges of exopolysaccharide-producing lactic cultures in dairy foods [J]. Journal of Dairy Science, 2008, 91(4): 1282-1298
Screening of Exopolysaccharide-producing Lactobacillus Strains and Study of Exopolysaccharide Properties
Abstract:Exopolysaccharide (EPS)-producing Lactobacillus strains were screened from the digestive glands of seafood from the Dalian area, and the functional properties of the produced EPSs were studied. One target strain was selected, the corresponding EPS was isolated and purified, and the relative molecular weights of all purified polysaccharide components were measured. Strains with relatively high EPS-producing ability were identified as Lactobacillus plantarum subsp. plantarum-4, Lactobacillus plantarum-12, and Lactobacillus plantarum subsp. plantarum-49. The 2,2-diphenyl-1-picrylhydrazyl (DPPH) free radical scavenging abilities of the three Lactobacillus plantarum strains and their EPSs were measured. When the EPS produced by Lactobacillus plantarum-12 was at a concentration of 0.5 mg/mL, the DPPH free radical scavenging rate was 48.82±3.88%, significantly higher than those of other two strains (p<0.05). The effect of EPS produced by Lactobacillus plantarum strains on the inhibition of the adhesion of Escherichia coli ATCC 25922 to HT-29 cells was measured. When the EPS produced by Lactobacillus plantarum-12 was at a concentration of 0.2 mg/ml, the inhibitory rate was 78.23%±2.46%, significantly higher than those of other two strains (p<0.05). The EPS produced by Lactobacillus plantarum-12 could significantly inhibit IL-8 production by HT-29 cells stimulated by E. coli ATCC 25922 (p<0.05). The crude EPS produced by Lactobacillus plantarum-12 was purified by DEAE-Sepharose anion-exchange, Sepharose CL-6B, and Sephacryl HR S200 chromatography columns; two fractions were obtained, and their relative molecular weights were 8.5×104u and 7.4×104u.
Key words:exopolysaccharides; antioxidant activities; adhesion; interleukin 8; purification
文章篇号:1673-9078(2017)2-61-68
DOI:10.13982/j.mfst.1673-9078.2017.2.010
收稿日期:2016-02-18
基金项目:本课题由国家十二五科技支撑计划项目(2013BAD18B09);国家自然科学基金项目(31571813);国家海洋食品工程技术研究中心项目(2012FU125X03);辽宁省自然科学基金项目(2014026018)资助