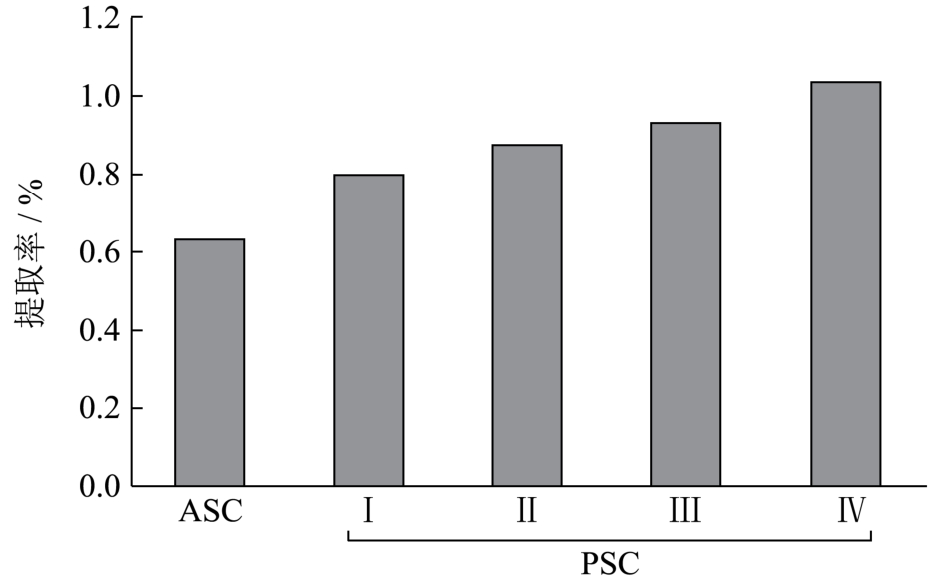
图1 鲍鱼肌肉胶原蛋白的提取率
Fig.1 Extraction yield of collagens from abalone muscle
摘要:提取了鲍鱼肌肉酸溶性胶原蛋白(ASC)和不同胃蛋白酶质量浓度下的酶溶性胶原蛋白(PSC),并对它们的理化性质进行研究和比较。结果发现,ASC的提取率只有0.63%,低于任一PSC。氨基酸组成结果显示,ASC和PSC的Gly含量都没有达到氨基酸总量的1/3,但都含有12.03~16.30个Cys残基和9.75~14.68个Tyr残基。根据SDS-PAGE图谱,发现鲍鱼肌肉ASC的α亚基是由160 ku的α1、140 ku的α2和130 ku的α3肽链组成,而PSC则是由3条α1肽链组成。ASC的最大紫外吸收峰出现在224 nm,而PSC却偏移至228 nm。ASC与PSC在粘度特性上存在明显的差异,结果表现为ASC的热变性温度高于任一PSC。Zeta电位测定结果表明,无论是ASC还是PSC,其等电点均在pH 4.90附近。pH和NaCl对ASC的溶解性影响趋势与PSC基本一致,但在同一pH或NaCl浓度下,PSC的溶解度高于ASC,且随着胃蛋白酶添加量的增加出现一定程度的上升。综上所述,鲍鱼肌肉ASC与PSC在理化性质上具有明显的区别。
关键词:鲍鱼肌肉;酸溶性胶原;酶溶性胶原;胃蛋白酶浓度;理化性质
鲍鱼,又名腹鱼,是一种单壳贝类,隶属软体动物门腹足纲鲍科。鲍鱼腹足肉质细嫩,营养丰富,味道鲜美,是中国传统的名贵食材,被誉为四大海味之首。随着人们生活水平的提高,鲍鱼的市场需求量也不断增加。2014年我国鲍鱼养殖总产量已经突破 11 万t,其中福建省的鲍鱼年产量达到9.1万t[1],经济产值已经超过100亿元。
腹足是鲍鱼的可食部分,主要由肌原纤维蛋白和胶原蛋白组成。日本早在60年代末就已经注重鲍鱼腹足肌肉的化学组分和胶原蛋白的研究[2,3],为鲍鱼加工积累基础数据。有研究表明,鲍鱼腹足胶原蛋白含量在2月份时最高,在7月份时最低[4]。鲍鱼不同部位的胶原蛋白含量也明显不同,生鲍鱼肌肉的质构性质与胶原蛋白含量具有一定的相关性,胶原蛋白含量越高肌肉硬度越大 。Gao等 研究发现鲍鱼肌肉胶原蛋白的明胶化会引起各项流变学指标的变化,表明胶原蛋白对鲍鱼加工制品的品质起到主要作用。鲍鱼肌肉胶原蛋白可能在端肽区形成高度交联,需要通过酶处理才能溶解,因此目前的研究主要集中在酶溶性胶原蛋白(PSC)。Yoneda等[9]从鲍鱼肌肉中提取获得 2种酶溶性胶原蛋白并通过克隆深入研究一级结构的特征,结果发现它们在羧基端肽区域含有6个Cys,只比脊椎动物来源的胶原蛋白少2个。然而,关于酸溶性鲍鱼胶原蛋白(ASC)的研究报道几乎还是空白。
因此,本研究主要考察了胃蛋白酶浓度对鲍鱼肌肉PSC提取率、以及氨基酸组成、蛋白组分分布和溶解性等性质的影响,并与ASC进行了比较,为进一步阐明鲍鱼肌肉胶原蛋白的特性提供基础数据。拌溶解,将离心(10000 g,30 min)获得的沉淀用蒸馏水洗至中性,再用0.5 mol/L乙酸溶液搅拌溶解48 h,离心(12000 g,30 min),将获得的上清通过盐析、透析、冻干,制备成酸溶性胶原蛋白(ASC),而沉淀利用含不同质量浓度胃蛋白酶(0.02%、0.10%、0.50%、2.50%,m/V)的0.5 mol/L乙酸溶液搅拌溶解48 h后,通过离心(12000 g,30 min)获得的上清液经过盐析、透析、冻干即为酶溶性胶原(PSC),分别记为PSC-Ⅰ、PSC-Ⅱ、PSC-Ⅲ和 PSC-Ⅳ。各种胶原蛋白提取率按以下公式(1)计算。
1.3.2 氨基酸组成
1.1 材料与试剂
皱纹盘鲍,厦门市岛之原生物科技有限公司;胃蛋白酶,国药集团化学试剂有限公司;羟脯氨酸测试盒,南京建成生物工程研究所;其它试剂均为国产分析纯。
胶原蛋白利用6 mol/L HCl在110 ℃真空条件下水解22 h后,通过自动氨基酸分析仪测定水解物的氨基酸组成,其羟脯氨酸含量利用试剂盒进行测定。1.3.3 SDS-PAGE
SDS-PAGE电泳参照 Laemmli[11]报道的方法进行。其中浓缩胶和分离胶的浓度分别为4%和8%。鲍鱼肌肉酶促溶性胶原蛋白利用含2% SDS、8 mol/L尿素、20 mmol/L Tris-HCl (pH 8.8)溶液进行溶解,配成蛋白含量为0.5% (m/V)的电泳样品,电泳结束后,利用考马斯亮蓝R-250进行染色。
1.3.4 紫外吸收光谱
1.2 主要仪器设备
Avanti J-25高速冷冻离心机,美国Beckman公司;UV-8000A紫外可见分光光度计,上海元析仪器有限公司;L-8900高效氨基酸分析仪,日本Hitachi公司;Nicolet iS10傅里叶红外变换光谱仪,美国Thermo公司;NanoZS Zeta电位仪,英国Marlvern公司。
取一定量的样品溶于0.1 mol/L乙酸溶液,调配成1 mg/mL胶原蛋白溶液,以0.1 mol/L乙酸溶液作为空白,在200~400 nm区间利用紫外分光光度计对胶原蛋白溶液进行扫描。
1.3.5 粘度特性
1.3 实验方法
1.3.1 胶原蛋白的提取
鲍鱼肌肉胶原蛋白参考Dong等[10]报道的方法进行提取,所有操作均在4 ℃以下进行。将鲍鱼肌肉清洗干净后切成小块,按料液比 1:10 (m/V)加入 20 mmol/L EDTA-0.1 mol/L Tris-HCl (pH 7.0)溶液进行匀浆,离心(10000 g,15 min)后,沉淀利用蒸馏水漂洗2次,再用10倍质量体积的0.6 mol/L KCl溶液搅拌12 h,通过离心(5000 g,15 min)去除盐溶性蛋白,并用0.6 mol/L KCl溶液漂洗2次,将所得的沉淀再用10倍质量体积0.45 mol/L NaCl溶液搅拌12 h,离心(5000 g,15 min)去除上清,利用蒸馏水漂洗2次;将所得的沉淀利用10倍质量体积的NaOH (0.1 mol/L)溶液搅
参考Nagai等[12]报道的方法对胶原蛋白的粘度进行测定。胶原蛋白样品利用0.1 mol/L乙酸溶解并调配成终浓度为0.1% (m/V)溶液,利用乌氏粘度计测定溶液在10~45 ℃下通过毛细管所用的时间。按照下列公式计算溶液的增比粘度:
增比粘度ηsp=(t-t0)/t0(2)
式中,t为胶原蛋白乙酸溶液通过毛细管所用的时间(s),t0为0.1 mol/L乙酸通过毛细管所用的时间(s)。胶原蛋白的热变性温度(Td)为增比粘度变化一半时所对应的温度。
1.3.6 Zeta电位
胶原蛋白Zeta电位的测定参考Nalinanon等[13]报道的方法并稍作修改。胶原蛋白用0.5 mol/L乙酸配成终浓度为0.05% (m/V)溶液,利用1.0 mol/L KOH进行调节胶原溶液至一定的pH (3~9),用Zeta电位分析仪测定胶原蛋白溶液在不同pH下的Zeta电位。提取率(%)=冻干后胶原蛋白质量/鲍鱼肌肉质量(湿重)×100% (1)相对溶解度(%)=(上清中蛋白含量/样品中蛋白含量)×100% (3)
1.3.7 胶原蛋白的溶解性
1.3.7.1 pH的影响
pH对胶原蛋白溶解性的影响参考Zhu等[14]报道的方法并稍作修改。胶原蛋白用0.5 mol/L乙酸调配成终浓度为0.2% (m/V)的溶液,利用2 mol/L NaOH调节胶原溶液至一定的pH (3~10),离心(10000 g,30 min,4 ℃)后,用Lowry法测定不同pH下上清中蛋白的含量。按照如上公式(3)计算溶液的相对溶解度:
1.3.7.2 NaCl的影响
NaCl对胶原蛋白的溶解性的影响参考Zhu等[14]报道的方法并稍作修改。溶解在0.5 mol/L乙酸中的胶原溶液(0.2%,m/V)用NaCl溶液调节至一定的NaCl浓度(0~6%,m/V),离心(10000 g,30 min,4 ℃)后,用Lowry法测定上清中蛋白的含量。按照公式(3)进行计算胶原在不同NaCl浓度下的相对溶解度。
1.3.8 数据统计与分析
所有数据采用SPSS 17.0软件进行ANOVA方差分析,显著性检验方法为Duncan多重检验,检测限为0.05。
2.1 提取率

图1 鲍鱼肌肉胶原蛋白的提取率
Fig.1 Extraction yield of collagens from abalone muscle
图1显示了鲍鱼肌肉酸溶性胶原(ASC)和酶溶性胶原(PSC)的提取率。由图可知,ASC的提取率为0.63%,低于任一PSC(0.80~1.03%),随着乙酸溶液中胃蛋白酶质量浓度的增加PSC的提取率呈上升趋势。这可能是ASC端肽中的Lys、Hyl与醛基形成高度交联[15],导致鲍鱼肌肉胶原蛋白在乙酸中不易溶解。当添加了胃蛋白酶,交联被部分切断,使胶原蛋白容易溶解到乙酸溶液中。
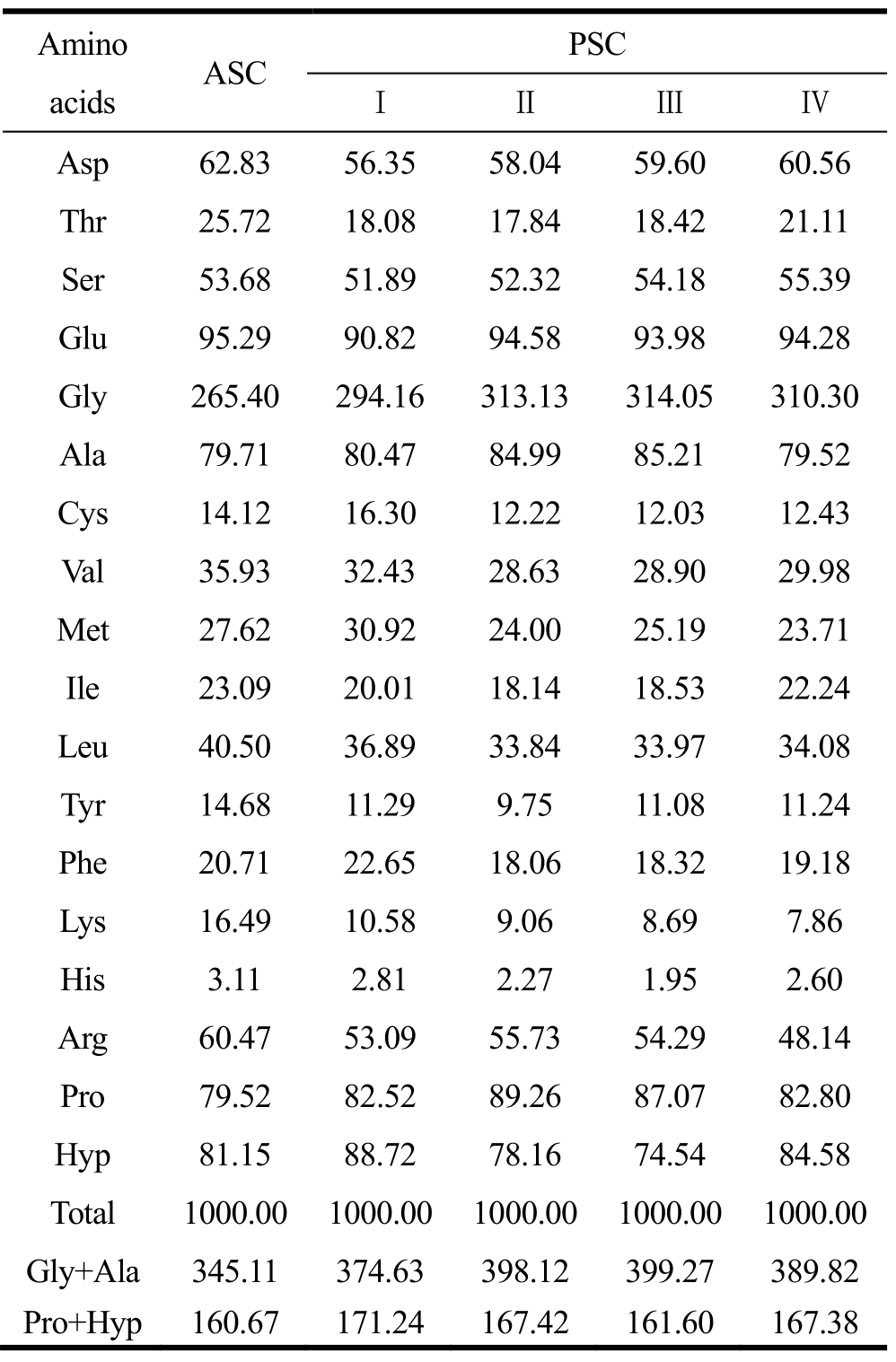
2.2 氨基酸组成
表1显示了鲍鱼肌肉ASC和PSC的氨基酸组成。不管是鲍鱼肌肉ASC还是PSC,Gly含量都是最高,其次是Glu,Pro,Hyp和Ala。通常,鱼皮ASC中Gly含量为33.02~33.51%,约占氨基酸总量的1/3[16]。然而,鲍鱼肌肉ASC中Gly含量仅达到26.54%(表1),类似于 Elango等[17]报道的白边真鲨头骨 ASC(Gly= 27.36%)和崔凤霞等[18]报道的仿刺参体壁 PSC(Gly= 26.50%)。当胃蛋白酶添加量为0.02%,提取的PSC-I 其Gly含量明显高于ASC,而且进一步提高胃蛋白酶的添加量,PSC中Gly含量出现一定程度的上升。然而,无论哪一种PSC,其Gly含量都低于氨基酸总量的1/3。从表1中还可看出,鲍鱼肌肉胶原蛋白中的Ala含量在7.95~8.52%之间,低于大眼鲷鱼皮(13.60%)和鱼骨(12.90%)来源的胶原蛋白[19]。类似于木村和久保的研究结果[3],鲍鱼肌肉胶原蛋白中Gly+Ala含量和 Pro+Hyp含量都显著低于脊椎动物胶原蛋白,而Cys和Tyr含量较高,表明Gly-Pro-Ala和Gly-Pro-Hyp氨基酸序列在鲍鱼肌肉胶原的一级结构中数量较少。
表1 鲍鱼肌肉酸溶性胶原(ASC)和酶溶性胶原(PSC)的氨基酸组成(个/1000个)
Table 1 Amino acid compositions of acid-soluble and pepsin-soluble collagens from abalone muscle (residues/1000 residues)
PSC Ⅱ Ⅲ Ⅳ58.04 59.60 60.56 17.84 18.42 21.11 52.32 54.18 55.39 94.58 93.98 94.28 Gly 265.40 294.16 3310.30 Ala 79.71 80.47 79.52 Cys 14.12 16.30 12.43 Val 35.93 32.43 29.98 Met 27.62 30.92 23.71 Ile 23.09 20.01 22.24 Leu 40.50 36.89 34.08 Tyr 14.68 11.29 9.75 11.08 11.24 Phe 20.71 22.65 18.06 18.32 19.18 Lys 16.49 10.58 9.06 8.69 7.86 His 3.11 2.81 2.27 1.95 2.60 Arg 60.47 53.09 55.73 54.29 48.14 Pro 79.52 82.52 89.26 87.07 82.80 Hyp 81.15 88.72 78.16 74.54 84.58 Total 1000.00 1000.00 1000.00 1000.00 1000.00 Gly+Ala 345.11 374.63 398.12 399.27 389.82 Pro+Hyp 160.67 171.24 167.42 161.60 167.38
2.3 SDS-PAGE
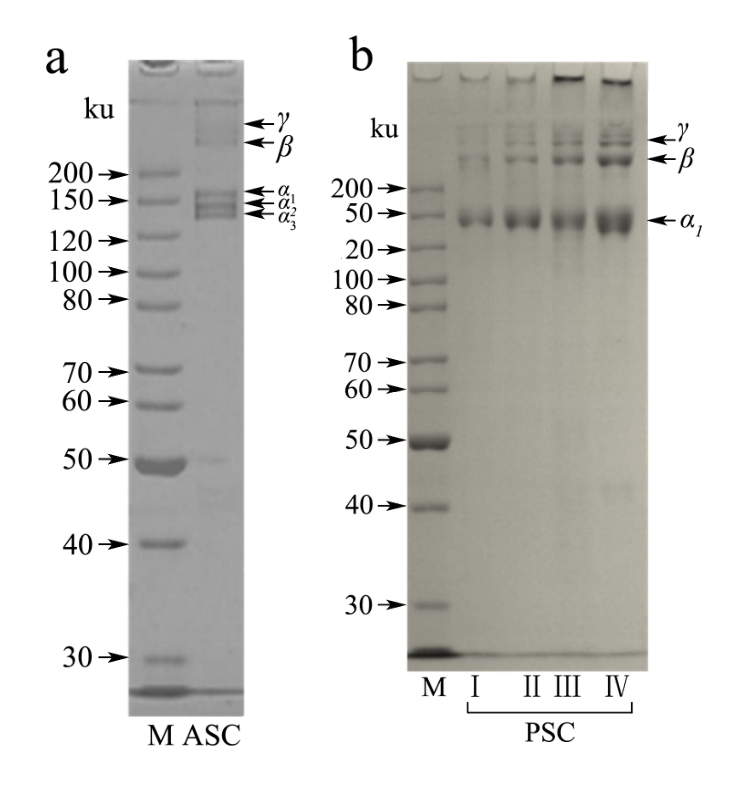
图2 鲍鱼肌肉酸溶性胶原蛋白(a)和酶溶性胶原蛋白(b)的SDS-PAGE图谱
Fig.2 SDS-PAGE analysis of acid-soluble (a) and pepsin-soluble (b) collagens from abalone muscle
注:M表示标准蛋白;M表示Standard molecular weight mixture。
由图2a可以看出,利用鲍鱼肌肉提取的ASC由分子量为160 ku的α1、140 ku的α2和130 ku的α3及其交联形成的β和γ等肽链组成。这与Rhods等[20]报道的人类胎盘胶原蛋白(V型)的α肽链的亚基构成类似。然而,在鲍鱼肌肉PSC中只发现α1肽链(图2b),表明PSC可能是由三条α1肽链及其交联物组成,类似于水产无脊椎动物胶原蛋白的特征[18],由 3条 α1肽链组成,与Yoneda等[21]报道的的鲍鱼肌肉PSC的结果一致。由图2b还可以发现随着胃蛋白酶添加量的增加,在提取的PSC中α、β和γ肽链以及未能进入浓缩胶的高分子聚合物的条带浓度呈上升趋势,表明胃蛋白酶可以促进鲍鱼肌肉胶原蛋白在乙酸溶液中的溶解。
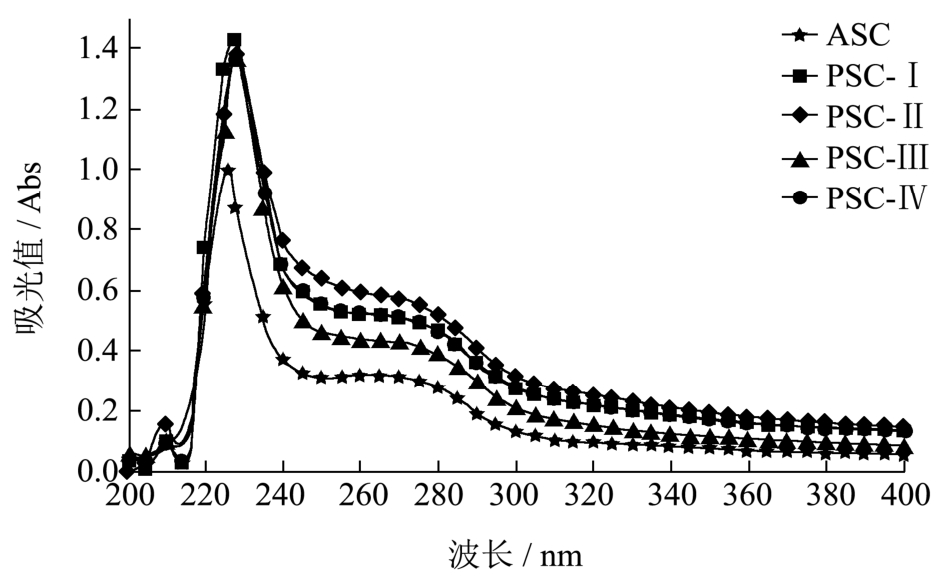
图3 鲍鱼肌肉胶原蛋白的紫外吸收光谱
Fig.3 Ultraviolet absorption spectra of acid-soluble and pepsin-soluble collagens from abalone muscle
2.4 紫外吸收光谱
图3显示了鲍鱼肌肉ASC和PSC的紫外吸收光谱。由于胶原分子中肽键C=O的n→π*跃迁,ASC在224 nm附近出现一个的特征吸收峰。然而,PSC的特征吸收峰却偏移至228 nm处,且不随酶添加量的变化而改变,这可能是端肽被胃蛋白酶酶切断的缘故。由于鲍鱼肌肉ASC和PSC都含有一定的芳香族氨基酸(表1),因此它们在250~290 nm区间都有一个隆起的平峰。
2.5 粘度特性
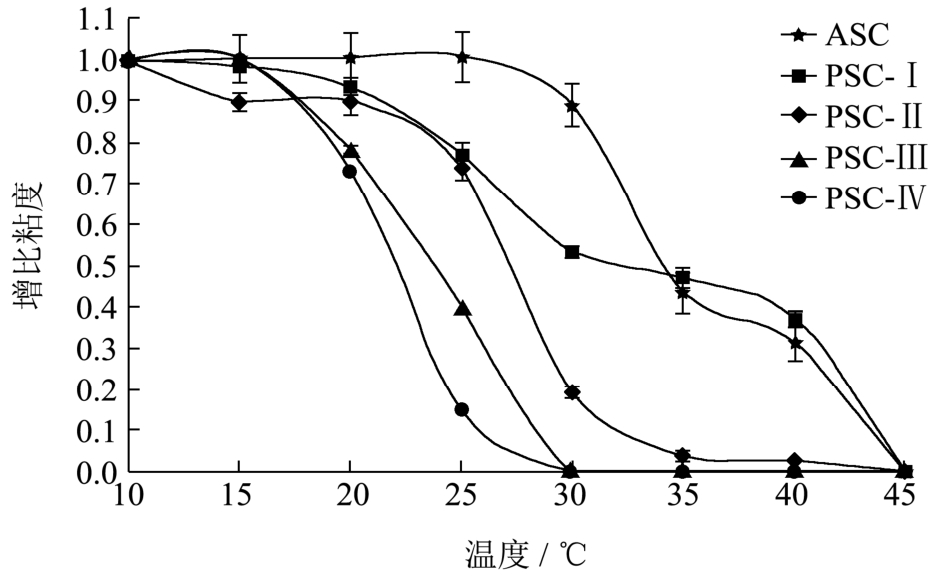
图4 鲍鱼肌肉胶原蛋白的热变性曲线
Fig.4 Thermal denaturation curve of collagens from abalone muscle
从图4中可以看出,ASC的增比粘度在温度超过25 ℃后,开始出现缓慢下降,而PSC-I的增比粘度却在 20 ℃附近就开始出现缓慢下降。随着胃蛋白酶添加量的增加,提取的PSC-Ⅱ、PSC-Ⅲ和PSC-Ⅳ在温度升高的过程中增比粘度会出现一个急剧下降的现象,表明端肽被切断后的PSC三股螺旋结构稳定性明显下降。根据图4结果还可以得出,ASC、PSC-Ⅰ、PSC-Ⅱ、PSC-Ⅲ以及PSC-Ⅳ的热变性温度(Td)分别为34.23 ℃、31.74 ℃、27.31 ℃、23.75 ℃和22.05 ℃,表明鲍鱼肌肉PSC的变性温度低于ASC,且随着酶添加量的增加逐渐下降。
2.6 Zeta电位
图 5显示了鲍鱼肌肉胶原蛋白在不同 pH下的Zeta电位。由图可知,ASC的Zeta电位随着pH的上升而降低,在pH 4.90左右达到0并开始转变为负电位,表明ASC的等电点在pH 4.90左右。pH对PSC Zeta电位的影响与ASC类似,但在pH 3时PSC的Zeta电位明显低于ASC,而且随着胃蛋白酶添加量的增加呈上升趋势。这可能是因为PSC中酸性氨酸含量(Glu+Asp,14.72~15.48%)低于ASC(Glu+Asp,15.81%)的缘故[22]。然而,PSC的等电点与ASC基本一致(图5),表明所提取的鲍鱼肌肉胶原蛋白酸性侧基和碱性侧基,α-氨基和α-羧基数量大致相同。
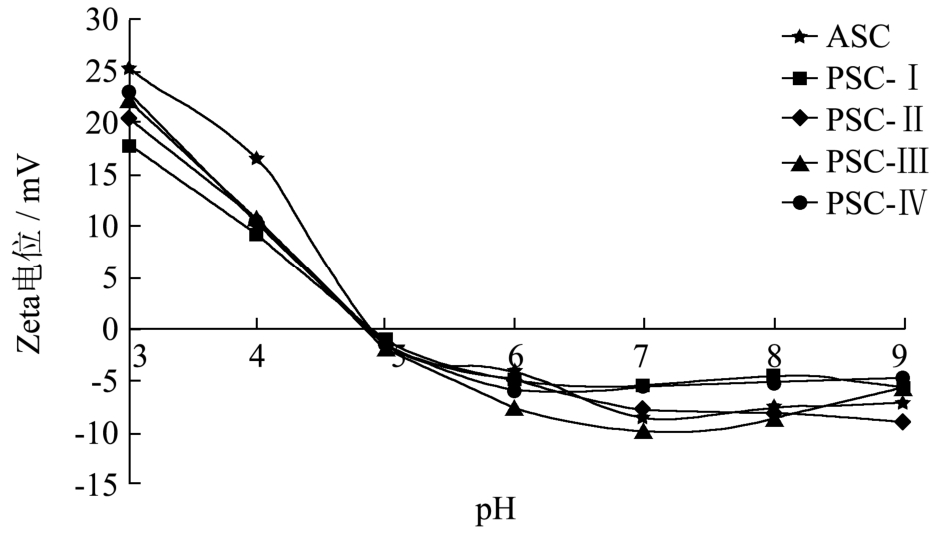
图5 鲍鱼肌肉胶原蛋白在不同pH下的Zeta电位
Fig.5 Zeta potential of collagens from abalone muscle at different pH values
2.7 pH和NaCl对胶原蛋白溶解性的影响
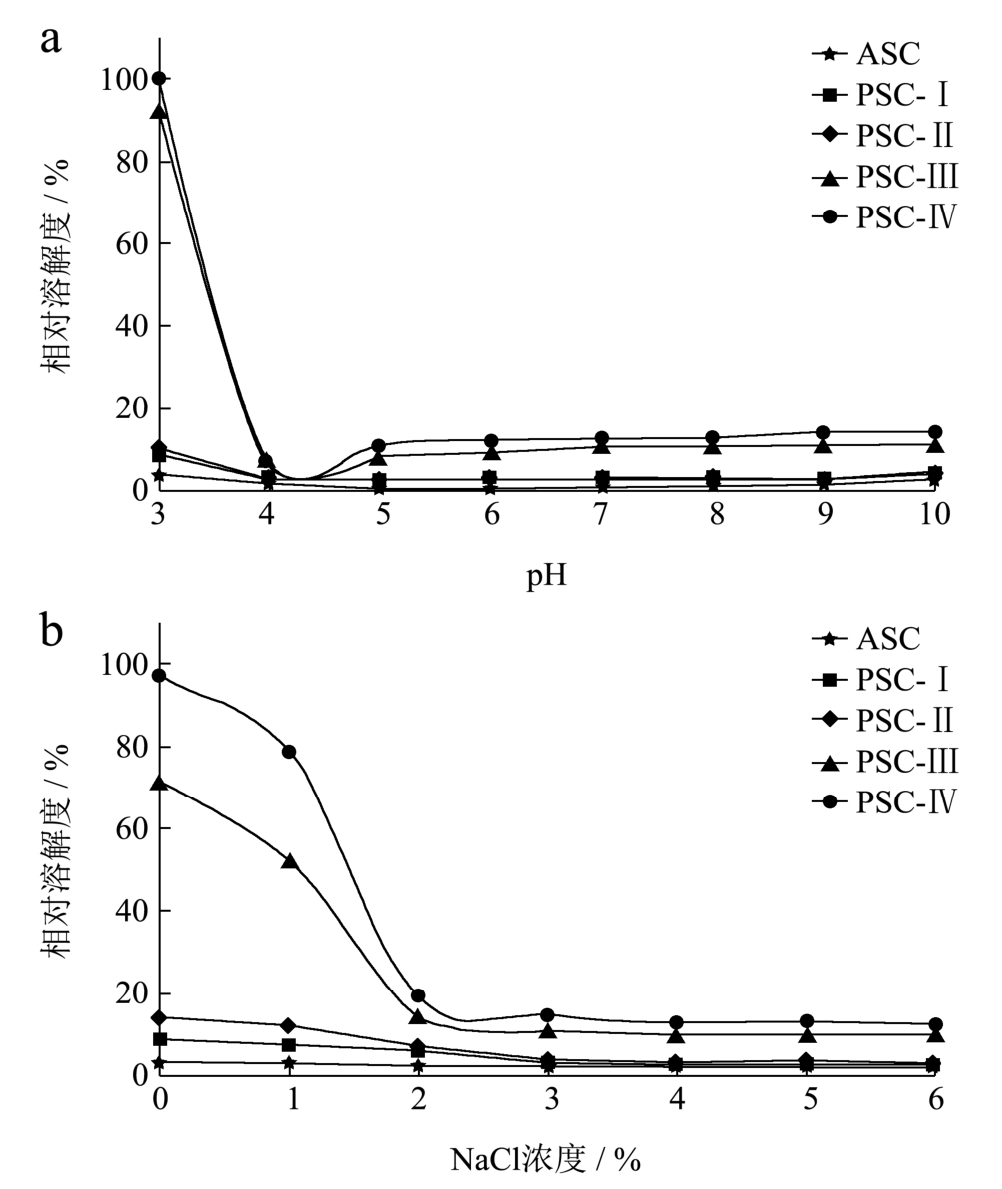
图6 pH(a)和NaCl(b)对鲍鱼肌肉胶原蛋白溶解性的影响
Fig.6 Effects of pH (a) and NaCl (b) on the solubility of collagens from abalone muscle
图6a显示了鲍鱼肌肉酸溶性胶原(ASC)和酶溶性胶原(PSC)在不同pH下的溶解性。由图可知,ASC在pH 3下的溶解性低于5%,而且随着pH的上升还呈下降的趋势。PSC的溶解性受pH的影响趋势与ASC类似,但在pH 3下的溶解性明显高于ASC。而且,随着胃蛋白酶添加量的增加PSC的溶解性出现上升,尤其PSC-Ⅳ在pH 3下的溶解性接近100%。这可能是ASC分子间的交联程度高于PSC[23]。不管是哪一种鲍鱼肌肉胶原蛋白,在pH 4附近溶解性都是最低,这与利用Zeta电位分析仪测定的等电点(图5)存在一定的差异,可能是因为两种方法的原理和精度不同。
图6b显示了NaCl浓度对鲍鱼肌肉胶原蛋白溶解性的影响。在任一NaCl浓度下ASC的溶解性都低于5%。在1% NaCl浓度下,PSC-Ⅲ和PSC-Ⅳ的溶解性明显高于PSC-Ⅰ和PSC-Ⅱ。当NaCl浓度从1%升高到2%,PSC的溶解性出现急剧下降,在NaCl浓度为2%左右就已经达到最低值,但进一步提高NaCl浓度PSC的溶解性不再出现明显的变化。值得注意的是,鲍鱼肌肉胶原蛋白的溶解性受NaCl浓度的影响比红鲷鱼鱼皮[23]、大眼鲷鱼皮和鱼骨[19]和绯鲵鲣鱼鳞[15]胶原蛋白显著。图6的结果再次表明,PSC的溶解性高于ASC,且与提取时的酶添加量呈正相关关系。
从鲍鱼肌肉提取了酸溶性胶原蛋白(ASC)和酶溶性胶原蛋白(PSC),结果发现ASC的提取率和溶解性都低于PSC,而热稳定性高于PSC。ASC的α亚基是由α1、α2和α3肽链组成,而PSC则是由3条α1肽链组成。同时,在氨基酸组成和紫外吸收光谱上ASC与PSC也存在一定程度的差异。在PSC的提取过程中还发现,随着胃蛋白酶添加量的增加,PSC的提取率、溶解性和Gly含量都出现增加,但热稳定性却出现下降,而胃蛋白酶添加量对亚基组成、紫外吸收和蛋白等电点等没有明显的影响。这些结果将为进一步研究鲍鱼肌肉胶原蛋白的特性提供基础数据。
参考文献:
[1] 中国渔业年鉴[M].北京:中国农业出版社,2015 China fisheries yearbook [M]. Beijing: China Agriculture Press, 2015
[2] Takayama Naoko, Yamamoto Yoshio, Kadowari Yodo, et al. Chemical components of abalone meat [J]. Journal of Home Economics of Japan, 1970, 21(4): 239-242
[3] Kimura Shigeru, Kubota Minoru. Some properties of collagen from the abalone [J]. Bulletin of the Japanese Society of Scientific Fisheries, 1968, 34(10): 925-929
[4] Yoneda C, Ahsan M, Nakaya M, et al. Abalone collagens: immunological properties and seasonal changes of their mRNA levels [J]. Comparative Biochemistry and Physiology Part B, 2000, 126(1): 59-68
[5] Porturas R O, Ushio H, Watabe S, et al. Toughness andcollagen content of abalone muscles [J]. Bioscience, Biotechnology, and Biochemistry, 1993, 57(1): 6-11
[6] Gao X, Ogawa H, Tashiro Y, et al. Rheological properties and structural changes in raw and cooked abalone meat [J]. Fisheries Science, 2001, 67: 314-320
[7] Gao X, Tashiro Y, Ogawa H. Rheological properties and structural changes in steamed and boiled abalone meat [J]. Fisheries Science, 2002, 68: 499-508
[8] Gao X, Tashiro Y, Ogawa H. The correlation rheological properties and characteristic values of structure for steamed abalone meat [J]. Food Science and Technology Research, 2002, 8: 304-310
[9] Yoneda C, Hirayama Y, Nakaya M, et al. The occurrence of two types of collagen pro α-chain in the abalone Haliotis discus muscle [J]. European Journal of Biochemistry, 1999, 261: 714-721
[10] Dong X, Yuan Q, Qi H, et al. Isolation and characterization of pepsin-soluble collagen from abalone (Haliotis discus hannai) gastropod muscle part II [J]. Food Science and Technology Research, 2012, 18(2): 271-278
[11] Laemmli U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4 [J]. Nature, 1970, 227(5259): 680-685
[12] Nagai T, Suzuki N, Tanoue Y, et al. Characterization of acid-soluble collagen from skins of surf smelt (Hypomesuspretiosus japonicas Brevoort) [J]. Food and Nutrition Sciences, 2010, 1: 59-66
[13] Nalinanon S, Benjakul S, Kishimura H. Collagens from the skin of arabesque greenling (Pleurogrammusazonus) solubilized with the aid of acetic acid and pepsin from albacore tuna (Thunnusalalunga) stomach [J]. Journal of the Science of Food and Agriculture, 2010, 90(9): 1492-1500
[14] Zhu B W, Dong X P, Zhou D Y, et al. Physicochemical properties and radical scavenging capacities of pepsin-solubilized collagen from sea cucumber Stichopus japonicas [J]. Food Hydrocolloids, 2012, 28(1): 182-188
[15] Matmaroh K, Benjakul S, Prodpran T, et al. Characteristics of acid soluble collagen and pepsin soluble collagen from scale of spotted golden goatfish (Parupeneusheptacanthus) [J]. Food Chemistry, 2011, 129(3): 1179-1186
[16] Tang L, Chen S, Su W, et al. Physicochemical properties and film-forming ability of fish skin collagen extracted from different freshwater species [J]. Process Biochemistry, 2015, 50(1): 148-155
[17] Jeevithan E, Wu W, Wang N, et al. Isolation, purification and characterization of pepsin soluble collagen isolated from silvertip shark (Carcharhinusalbimarginatus) skeletal and head bone and pepsin [J]. Process Biochemistry, 2014, 49(49): 1767-1777
[18] 崔凤霞,薛长湖,李兆杰,等.仿刺参胶原蛋白的提取及理化性质[J].水产学报,2006,30(4):549-553 CUI Feng-xia, XUE Chang-hu, LI Zhao-jie, et al. Extraction and the physical and chemical characterization of collagen in Stichopusjaponicas [J]. Journal of Fisheries of China, 2006, 30(4): 549-553
[19] Kittiphattanabawon P, Benjakul S, Visessanguan W, et al. Characterisation of acid-soluble collagen from skin and bone of bigeye snapper (Priacanthustayenus) [J]. Food Chemistry, 2005, 89(3): 363-372
[20] Rhodes R, Edward J. Evidence for the existence of an αl(V)α2(V)α3(V) collagen moleeulein human placental tissue [J]. Collagen and Related Research, 1981, 1(4): 337-343
[21] Chie T Y, Shugo W, Misako N, et al. Isolation and characterization of a 148 ku protein possibly participating in collagen metabolism of abalone adductor muscle [J]. Fisheries Sience, 1997, 63(1): 115-121
[22] 蒋挺大.胶原与胶原蛋白[M].北京:化学工业出版社,2006 JIANG Ting-da. Collagen and collagen protein [M]. Beijing: Chemical Industry Press, 2006
[23] Jongjareonrak A, Benjakul S, Visessanguan W, et al. Isolation and characterisation of acid and pepsin-solubilised collagens from the skin of brownstripe red snapper (Lutjanusvitta) [J]. Food Chemistry, 2005, 93(3): 475-484
Extraction and Characterization of Collagens from Abalone Muscle
Abstract:Acid-soluble collagen (ASC) and pepsin-soluble collagen (PSC) were extracted from abalone (Haliotis discus hannai) muscle, and their physicochemical properties were investigated and compared. The results showed that the extraction yield of ASC from abalone muscle was 0.63%, which was lower than that of any PSC extracted at different pepsin concentrations. Amino acid composition analysis showed that the Gly content of both ASC and PSC were less than one-third of the total amino acids; however, both ASC and PSC contained 12.03~16.30 Cys residues and 9.75~14.68 Tyr residues per 1000 residues. The results of sodium dodecyl sulfate polyacrylamide gel electrophoresis (SDS-PAGE) analysis indicated that the α subunits of ASC were composed of α1(160 ku), α2(140 ku), and α3(130 ku), but there were only three α1peptide chains found in PSC. The maximum ultraviolet absorption of ASC was observed at 224 nm, while that of PSC shifted to 228 nm. Significant differences were observed between the viscosity of ASC and PSC; thus, the denaturation temperature of ASC was higher than that of any PSC. Based on the results of zeta potential measurement, both PSC and ASC had a similar isoelectric point at approximately pH 4.90. The effects of pH and NaCl concentration on the solubility of ASC were similar to those of PSC. However, at the same pH or NaCl concentration, the solubility of PSC was higher than that of ASC, and it was further increased to a certain extent with increasing pepsin concentration. In conclusion, these results suggest that the physicochemical properties of ASC and PSC from abalone muscle differ significantly.
Key words:abalone muscle; acid-soluble collagen; pepsin-soluble collagen; pepsin concentration; physicochemical properties
文章篇号:1673-9078(2017)2-29-34
DOI:10.13982/j.mfst.1673-9078.2017.2.005
收稿日期:2016-01-31
基金项目:国家自然科学基金项目(31571835);海洋公益性行业科研专项(201405016);厦门市海洋经济发展专项资金(13CZP003HJ05)