表1 Plackett-Burman试验设计分析因素及水平
Table 1 Factors and levels of Plackett-Burman design
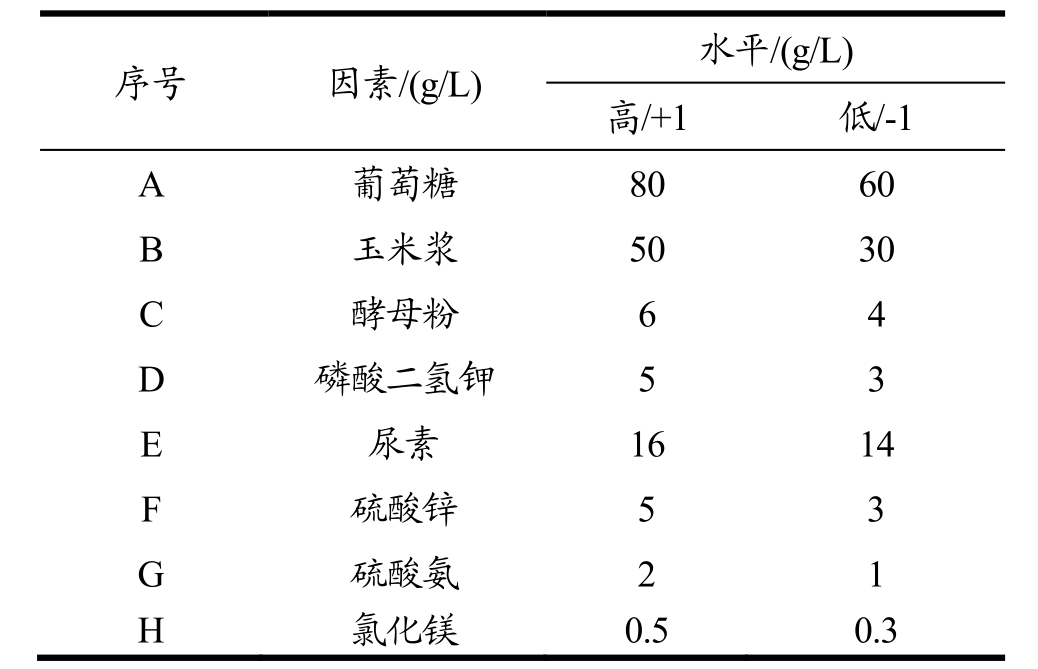
序号 因素/(g/L) 水平/(g/L)高/+1 低/-1 A 葡萄糖 80 60 B 玉米浆 50 30 C 酵母粉 6 4 D 磷酸二氢钾 5 3 E 尿素 16 14 F 硫酸锌 5 3 G 硫酸氨 2 1 H 氯化镁 0.5 0.3
摘要:凝乳酶可以专一地切割乳中κ-酪蛋白的Phe 105-Met 106之间的肽键,引起蛋白质凝聚,在乳制品加工中应用广泛。目前对牛凝乳酶的研究比较成熟,而对骆驼凝乳酶的研究报道较少。本研究为获得高效骆驼凝乳酶发酵培养基,在单因素实验的基础上,采用Plackett-Burman试验考察培养基中的8个成分对骆驼凝乳酶产量的影响。研究表明葡萄糖、玉米浆、尿素的对产酶影响显著。采用最陡爬坡试验逼近最大响应区间,利用Box-Behnken响应面法对3个主要影响因素进行分析,得到高效发酵培养基配方:葡萄糖86.6 g/L、玉米浆56.9 g/L、酵母粉4 g/L、磷酸二氢钾3 g/L、尿素18 g/L、硫酸锌3 g/L、硫酸氨1 g/L和氯化镁0.3 g/L。在该条件下凝乳酶活达到431.25 U/mL,较优化前的基础培养基(207.03 SU/mL)提高了2.08倍。再利用1L发酵罐进行发酵培养,凝乳酶活性达到530 SU/mL,约为摇瓶培养最高酶活性的1.22倍。
关键词:骆驼凝乳酶;培养;响应曲面法;培养基优化
奶酪作为一种古老的奶制品,一直享有乳品中的“黄金”之美誉,它不仅含有大量优质的蛋白质,还含有糖类、有机酸、钠、磷、钙、维生素、生物素、泛酸和烟酸等多种营养成分,奶酪中的蛋白质经发酵后分解成肽、氨基酸等小分子物质,更易被人体吸收[1]。在西方国家奶酪制备悠久历史,一直是一种大众化的食品,近年来,随着人们生活水平的不断提高,国内对奶酪的需求呈现出迅猛增长的趋势[1]。
凝乳酶能够对动物乳汁中 K-酪蛋白的 Phe 105-Met 106肽键进行专一性切割,经过凝乳酶切割后的酪蛋白,其原有的空间结构遭到破坏,从而造成乳品中的酪蛋白凝结,凝乳酶不仅是奶酪制备工艺中的关键因素,而且还对奶酪的质量和风味也起着至关重要的影响,因此被广泛地应用于奶酪生产工业中[4~7]。凝乳酶的来源多样,有不少植物和动物中均能够提取出凝乳酶,但该酶制剂普遍存在非特异性降解蛋白质活力强、凝乳酶活性不高等问题。近年来基因工程技术在酶制剂生产制备行业得到广泛的推广应用。鉴于基因工程菌株生产酶制剂具有周期短、成本低、产量高和提取方便等优点,可以满足大规模市场需求等优点[8~12],利用基因重组微生物生产凝乳酶日益受到人们重视。
目前针对牛凝乳酶的研究较为普遍,而对骆驼凝乳酶的研究还比较少,研究发现,骆驼凝乳酶与牛凝乳酶有85%的同源性,但骆驼凝乳酶的凝乳活性比牛凝乳酶高70%[13~15]。Wangoh等从骆驼和小牛皱胃中提取凝乳酶,研究发现骆驼凝乳酶凝固骆驼乳比凝固牛乳稍快一些。Bansal N等研究的结果表明,骆驼凝乳酶适合用于奶酪的制作,不仅对乳液中蛋白质的水解活性较低,而且制备出的奶酪苦味少、口感更好[16~18]。因此,对来源于骆驼的凝乳酶开展研究,将具有重要的基础和应用意义。
乳酸克鲁维酵母具有营养要求简单分泌蛋白能力强,不产生内毒素和对人类安全等优点。作为宿主系统表达食品用酶也已显示出巨大的潜力。本实验室将骆驼凝乳酶原基因与乳酸克鲁维酵母表达载体相结合形成重组质粒,并将其转化至工业菌株乳酸克鲁维酵母中,获得可表达重组基因的工程菌CPC。鉴于培养基组分对重组骆驼凝乳酶生产成本及质量的重要影响,本文通过响应面法对培养基进行优化,从而获得高产和经济的培养基配方,为推动骆驼凝乳酶的产业化及应用奠定基础。
乳酸克鲁维酵母工程菌由本实验室自行构建并保藏。
CT14RD11台式高速冷冻离心机,上海天美生化仪器设备有限公司;SGD-IV型还原糖测定仪,山东省科学院生物研究所;SSW-600-2S型恒温水浴锅,上海博讯实业公司医疗设备厂;EL20 pH计,赛多利斯股份有限公司;TU-1901紫外分光光度计,尤尼柯上海仪器有限公司;ZHWY-200B型全温摇床,上海智城分析仪器制造有限公司;GS-F2001-MM 1L四联体玻璃发酵罐,上海顾信生物科技有限公司。
斜面培养基(g/L):葡萄糖20、酵母粉10、蛋白胨20、琼脂20、pH自然。
种子培养基(g/L):葡萄糖20、酵母粉10、蛋白胨20、pH自然。
发酵基础培养基(g/L):葡萄糖50、玉米浆20、尿素15、酵母粉5、pH自然[18]。
挑选单菌落在斜面培养基上接种活化,28 ℃恒温培养3~4 d,长出饱满菌落后挑取适量接种于50 mL液体种子培养基中,220 r/min、28 ℃培养20~22 h;在总体积250 mL摇瓶装入液体发酵培养基45 mL,接入5 mL种子,200 r/min、28 ℃恒温发酵培养96 h。
首先对酶原进行活化,取15 mL用于凝乳酶活性检测的发酵液,在低温离心机中8000 r/min离心3~4 min,并收集离心上清液。将离心上清液以 1 mol/L H2SO4调整pH至2.0,并与室温静置2 h后,用以2 mol/L Tris将pH值调至5.5,用于凝乳酶活性检测[18]。
采用Arima等的方法进行测定凝乳酶活性[18]。首先用0.01 mol/L CaCl2溶液配制浓度为10%的脱脂乳,室温下静止放置 40 min,取 5 mL脱脂乳于试管中35 ℃水浴保温10~15 min,加入适量稀释到合适浓度的酶液,充分混合均匀并开始计时,观察到试管壁出现凝乳微粒为计时终点,凝乳时间记为t。将40 min凝结 1 mL浓度为 10%脱脂乳的酶量定义为一个Soxhlet单位(SU)。
根据 SGD-IV型全自动还原糖测定仪说明书步骤,对发酵液中葡萄糖含量进行测定。将离心过后的发酵上清液进行适当稀释,仪器根据氧化还原反应过程中所消耗标准葡萄糖含量,自动计算出样品中糖含量(g/L)。
发酵过程中取5 mL发酵液,8000 r/min,离心5 min,沉淀菌体用无菌水适当稀释,以无菌水做空白对照,在OD600nm波长下检测,以发酵时间作为横坐标,吸光值作为纵坐标作图,即可得到生长曲线。
1.8.1 单因素试验
根据前期试验筛选得到8种适宜重组菌株CPC发酵的培养基成分,以骆驼凝乳酶活性为依据,分别对葡萄糖(A)、玉米浆(B)、酵母粉(C)、磷酸二氢钾(D)、尿素(E)、硫酸锌(F)、硫酸氨(G)和氯化镁(H)等8个因素进行初步优化,确定适宜的质量浓度范围。
1.8.2 Plackett-Burman试验设计
在设计响应面分析方案之前,要在发酵基础培养基前提下,根据单因素试验确定取得各因素水平范围,选取葡萄糖(A)、玉米浆(B)、酵母粉(C)、磷酸二氢钾(D)、尿素(E)、硫酸锌(F)、硫酸氨(G)和氯化镁(H)等8个因素进行考察。借助Minitab16软件对每个因素取高低两水平,采用N=12的Plackett-Burman试验,比较各因素对骆驼凝乳酶活性影响的显著性,筛选出显著因素[19~21]。
1.8.3 最陡爬坡试验设计
依据Plackett-Burman设计及结果,找出培养基成分中的显著因素,根据拟合回归方程中各因素的系数设计最陡爬坡试验,找到各个显著因素的最陡上升路径,其它因素取值根据效应值的正负和大小,选取合适的浓度水平,使主要因素浓度朝着响应值增大的方向进行调整,逐步逼近响应区间[22]。
1.8.4 Box-Behnken试验设计与模型验证
在 Plackett-Burman试验和最陡爬坡试验的基础上,以骆驼凝乳酶活力为响应值对重组菌株CPC进行3因素3水平(-1、0、+1)的Box-Behnken试验。根据试验结果,借助Design Expert 8.0软件进行回归分析,预测得到凝乳酶活性的最大响应值,并通过摇瓶试验验证预测值的可靠性,确定最终发酵培养基成分。
1.8.5 发酵罐培养
根据优化过后的培养基配方,将重组基因的工程菌CPC在1 L发酵罐中进行发酵培养。装入优化后的培养基630 mL,接入70 mL种子,发酵条件为28 ℃,搅拌转速600 r/min,通气量2 vvm,每隔6 h取样3~5 mL,测定培养基中还原糖含量、菌体浓度以及骆驼凝乳酶活性。
每组实验均进行3次平行测定,用借助Minitab 16和Design Expert 8.0对数据进行统计分析。p<0.05则表明具有显著性,p>0.05则表明无显著性。
单因素试验结果表明,各单因素最佳质量浓度分别为(g/L):葡萄糖70、玉米浆40、酵母粉5、磷酸二氢钾4、尿素15、硫酸锌4、硫酸氨1.5和氯化镁0.4,根据单因素筛选出的水平进行 Plackett-Burman设计。
根据发酵基础培养基及前期单因素实验,对8个因素取高(+1)低(-1)两水平,实验设计见表 1。按照N=12的Plackett-Burman设计进行试验,试验设计结果见表2。各因素效应及显著性分析见表3。
表1 Plackett-Burman试验设计分析因素及水平
Table 1 Factors and levels of Plackett-Burman design

序号 因素/(g/L) 水平/(g/L)高/+1 低/-1 A 葡萄糖 80 60 B 玉米浆 50 30 C 酵母粉 6 4 D 磷酸二氢钾 5 3 E 尿素 16 14 F 硫酸锌 5 3 G 硫酸氨 2 1 H 氯化镁 0.5 0.3
表2 Plackett-Burman试验设计与结果
Table 2 Plackett-Burman design and corresponding results

转下页
序列 A B C D E F G H 酶活力/(SU/mL)1 1 1 1 -1 1 1 -1 1 300.03 2 -1 1 1 1 -1 1 1 -1 240.20 3 1 1 -1 1 1 -1 1 -1 313.35 4 1 1 -1 1 -1 -1 -1 1 305.31 5 -1 1 -1 -1 -1 1 1 1 243.05 6 1 -1 1 -1 -1 -1 1 1 223.00 7 -1 -1 -1 -1 -1 -1 -1 -1 247.08 8 -1 1 1 -1 1 -1 -1 -1 286.33 9 -1 -1 1 1 1 -1 1 1 235.17
接上页

10 -1 -1 -1 1 1 1 -1 1 240.08 11 1 -1 -1 -1 1 1 1 -1 270.16 12 1 -1 1 1 -1 1 -1 -1 241.81
表3 各因素影响的主效应分析
Table 3 Main effects analysis of medium components
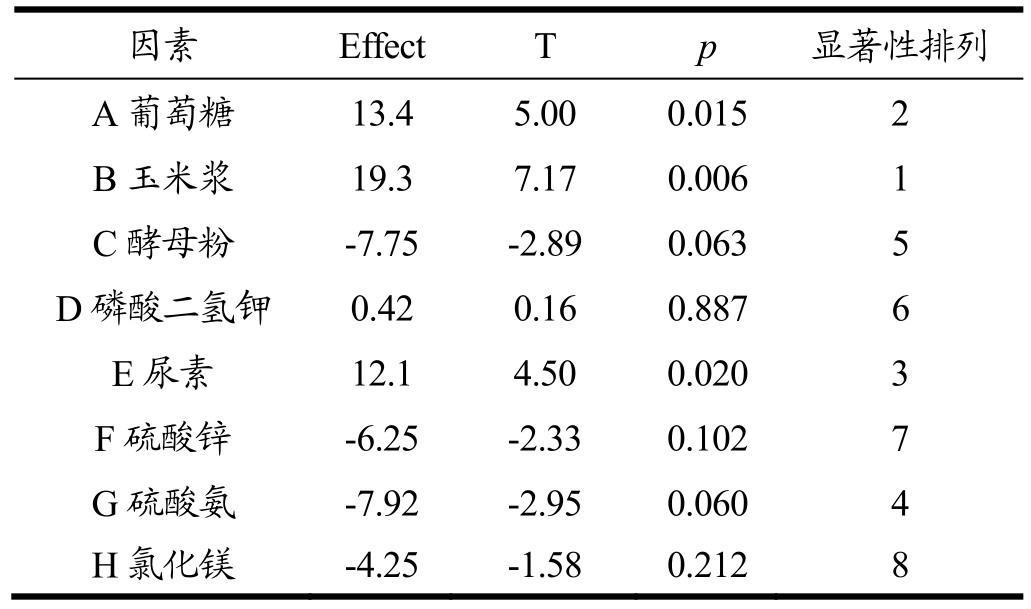
注:R2=97.6%,Adj R2=91.2%。
因素 Effect T p 显著性排列A葡萄糖 13.4 5.00 0.015 2 B玉米浆 19.3 7.17 0.006 1 C酵母粉 -7.75 -2.89 0.063 5 D磷酸二氢钾 0.42 0.16 0.887 6 E尿素 12.1 4.50 0.020 3 F硫酸锌 -6.25 -2.33 0.102 7 G硫酸氨 -7.92 -2.95 0.060 4 H氯化镁 -4.25 -1.58 0.212 8
由表3可看出,葡萄糖、尿素、玉米浆、磷酸二氢钾表现为正效应,酵母粉、硫酸锌、硫酸铵、氯化镁表现为负效应。若p值小于0.05则表明此因子具有显著性,因此确定葡萄糖、玉米浆、尿素为骆驼凝乳酶活性的主要影响因素,进行下一步最陡爬坡试验和响应面试验。得到的骆驼凝乳酶 Y1的多元回归方程为:Y1=262+13.4A+19.3B-7.75C+0.42D+12.1E-6.25F-7.92G-4.25H,此回归模型的复相关系数为 0.976,这表明97.6%的数据可以用该模型进行解释。
表4 最陡爬坡实验设计及结果
Table 4 Steepest ascent design and corresponding results

序号 A葡萄糖/(g/L)B玉米浆/(g/L)E尿素/(g/L)酶活力/(SU/mL)1 70 45 15 312.12 2 75 50 16 321.22 3 80 55 17 370.36 4 85 60 18 400.44 5 90 65 19 395.30 6 95 70 20 387.54
根据PB实验设计结果,针对葡萄糖、玉米浆和尿素三个显著因素进行最陡爬坡实验。最陡爬坡实验设计及结果见表4。由表4可以看出,随着葡萄糖、玉米浆和尿素质量浓度的增加,骆驼凝乳酶活性先增大后减小。凝乳酶活性在第4组最高,酶活性达400.44 U/mL,因此,以葡萄糖85 g/L、玉米浆60 g/L和尿素18 g/L作为响应面试验的中心点进一步进行优化。
以凝乳酶活性为目标,根据Placktt-Burman试验筛选的三个显著因子和最陡爬坡实验确定的中心点,运用Design Expert 8.0软件进行Box-Behnken试验设计,试验设计及结果见表5和表6。
表5 响应面试验因素水平表
Table 5 Factors and levels of response surface experiment
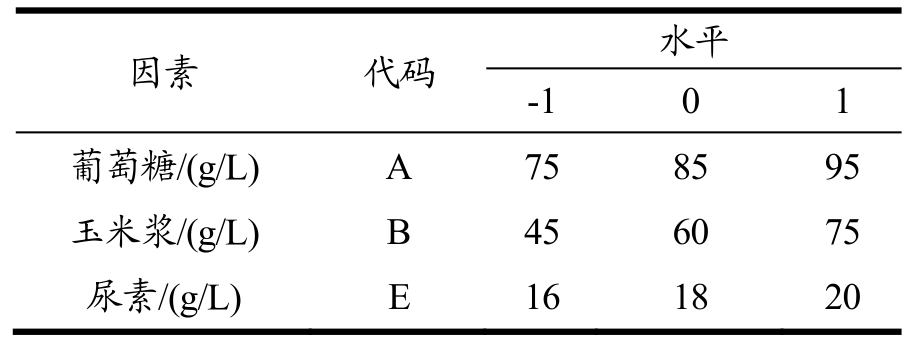
因素 代码 水平-1 0 1葡萄糖/(g/L) A 75 85 95玉米浆/(g/L) B 45 60 75尿素/(g/L) E 16 18 20
表6 响应面设计与结果
Table 6 Box-Behnken design and corresponding response values
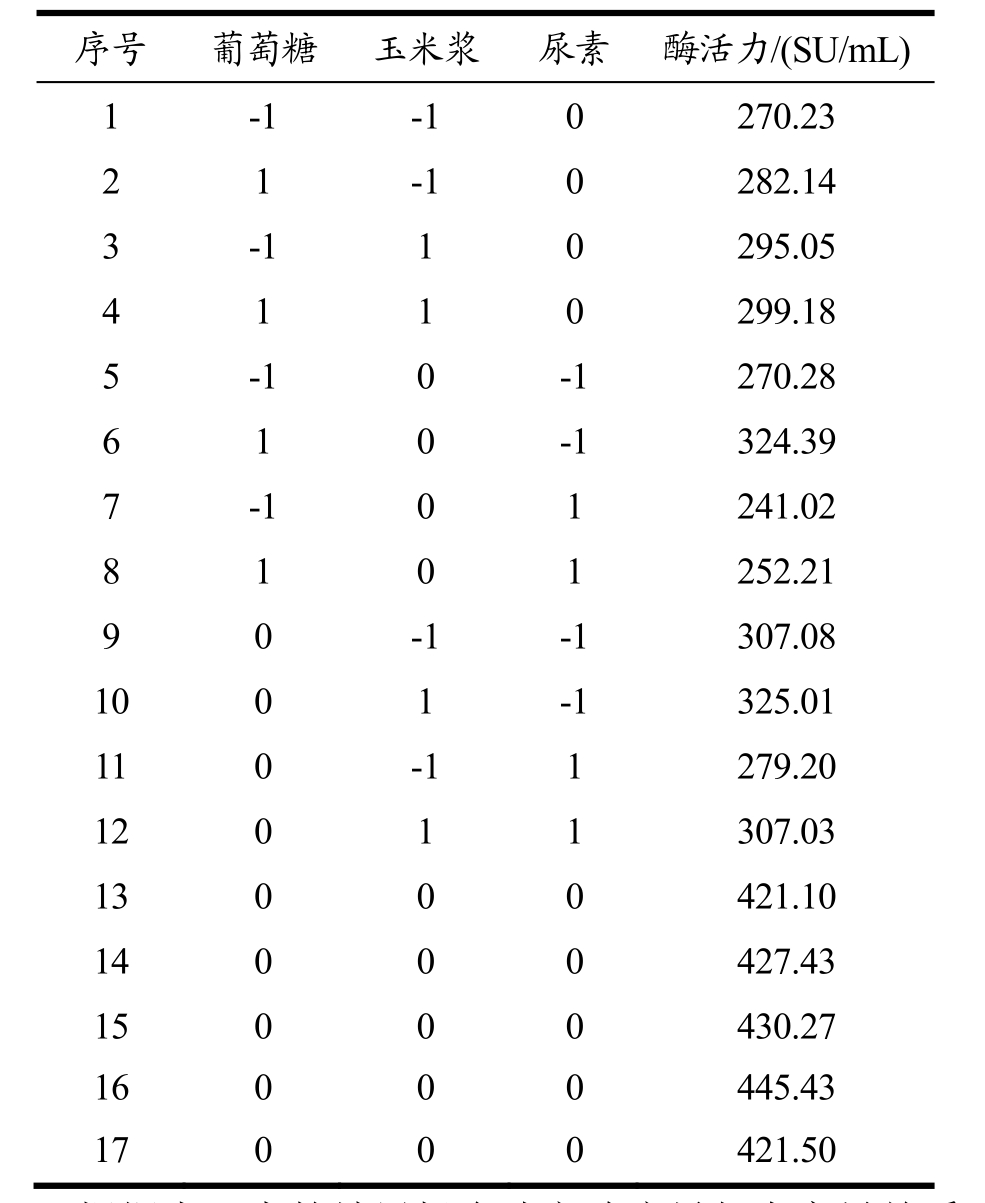
序号 葡萄糖 玉米浆 尿素 酶活力/(SU/mL)1 -1 -1 0 270.23 2 1 -1 0 282.14 3 -1 1 0 295.05 4 1 1 0 299.18 5 -1 0 -1 270.28 6 1 0 -1 324.39 7 -1 0 1 241.02 8 1 0 1 252.21 9 0 -1 -1 307.08 10 0 1 -1 325.01 11 0 -1 1 279.20 12 0 1 1 307.03 13 0 0 0 421.10 14 0 0 0 427.43 15 0 0 0 430.27 16 0 0 0 445.43 17 0 0 0 421.50
根据表6中的结果拟合建立响应量与自变量关系的多项式回归模型,运用Design Expert 8.0软件对实验结果回归拟合,得到二次多项回归方程:
Y2=428.80+10.13A+10.90B-18.45E-2.00AB-10.75 AE+2.66BE-87.62A2-54.68B2-69.43E2。对结果进行方差分析表见表7。
表7 Box-Behnken试验方差分析
Table 7 Variance analysis of Box-Behnken experiment
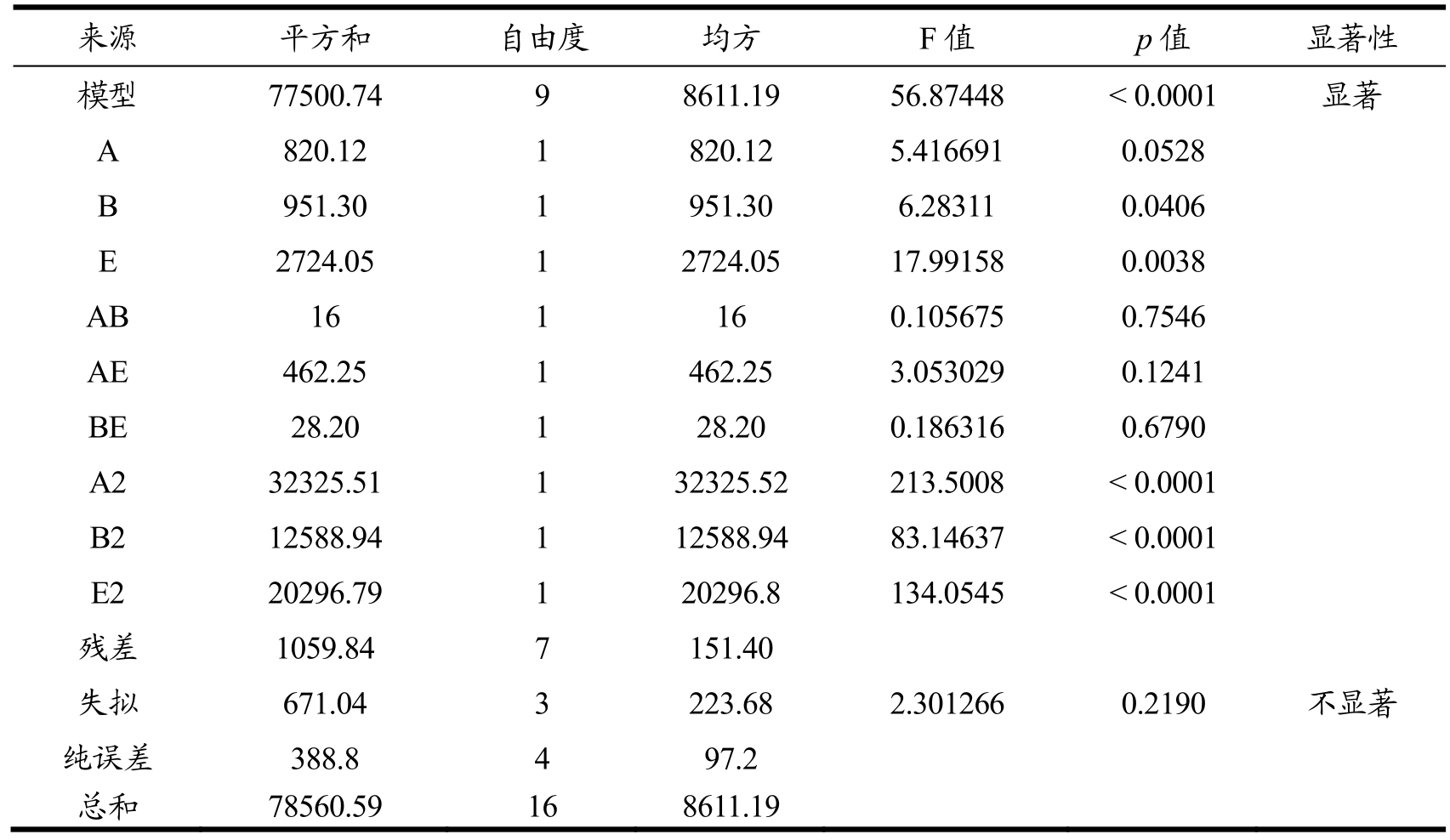
来源 平方和 自由度 均方 F值 p值 显著性模型 77500.74 9 8611.19 56.87448 < 0.0001 显著A 820.12 1 820.12 5.416691 0.0528 B 951.30 1 951.30 6.28311 0.0406 E 2724.05 1 2724.05 17.99158 0.0038 AB 16 1 16 0.105675 0.7546 AE 462.25 1 462.25 3.053029 0.1241 BE 28.20 1 28.20 0.186316 0.6790 A2 32325.51 1 32325.52 213.5008 < 0.0001 B2 12588.94 1 12588.94 83.14637 < 0.0001 E2 20296.79 1 20296.8 134.0545 < 0.0001残差 1059.84 7 151.40失拟 671.04 3 223.68 2.301266 0.2190 不显著纯误差 388.8 4 97.2总和 78560.59 16 8611.19
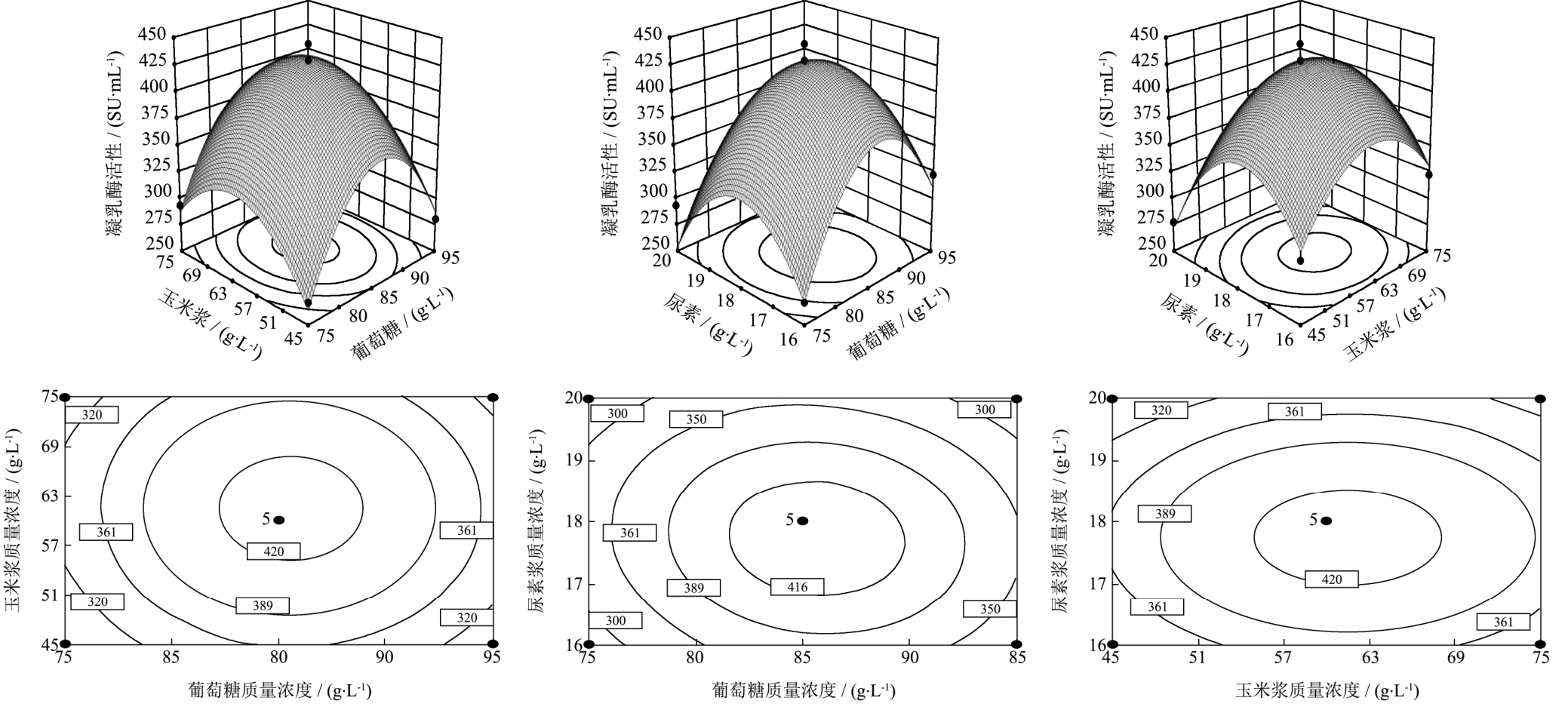
图1 响应面及等高线分析各因素对凝乳酶发酵水平的影响及其交互作用
Fig.1 Response surface and contour plots showing the effects of medium components on the production of chymosin of CPC and their interaction
由表7方差分析表可以看出:p<0.0001,说明该模型具有较高的显著性;失拟项p=0.219>0.05,不显著;该方程的决定系数R2=0.986,模型的校正决定系数Adj R2=0.969,说明该模型该模型拟合程度高,能较好的预测发酵培养基中添加的成分与凝乳酶活性的关系。
借助软件绘出各因素之间的响应面及等高线图,响应面和等高线图如图1所示,研究葡萄糖、玉米浆和尿素 3个因素及其相互作用对凝乳酶酶活性的影响。
该方程的抛物线图形开口均向下,葡萄糖、尿素、玉米浆均存在极值点,响应面覆盖了最大值所在的区域。由DesignExpert 8.0分析得到最适培养基中葡萄糖、玉米浆和尿素的实际值分别为86.6 g/L、56.9 g/L和18 g/L。因此,最适培养基组成为(g/L):葡萄糖86.6、玉米浆56.9、酵母粉4、磷酸二氢钾3、尿素18、硫酸锌3、硫酸氨1、氯化镁0.3。预测在此条件下,骆驼凝乳酶活力为430.90 SU/mL。
在最优培养基的基础上进行摇瓶发酵,重复3次实验,优化后平均值为431.25 SU/mL,实际酶活力与预测酶活力值相符。利用优化前基础培养基酶活力平均值206.31 SU/mL,经优化后凝乳酶酶活力较优化前的酶活力提高了2.08倍。
利用优化后的培养基配方,在1 L发酵罐中进行发酵培养,发酵过程中生长曲线和骆驼凝乳酶活性曲线以及葡萄糖含量变化如图2所示。
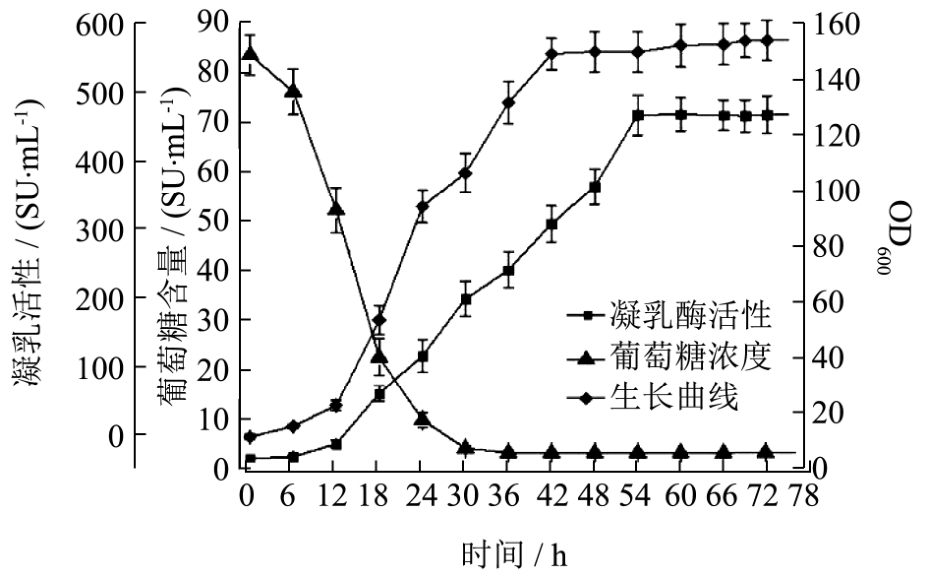
图2 菌株CPC残糖含量、产酶活力曲线以及生长曲线
Fig.2 Residual sugar content curve, growth curve and activity curve of strain CPC
由图2中葡萄糖浓度曲线可知:在0~6 h,酵母菌对还原糖消耗相对较慢,葡萄糖含量从 8%下降到7.5%左右,而在 6~30 h期间菌体对糖的消耗急剧增加,培养基残留葡萄糖含量为0.3 g/L,大约在28 h培养基里的葡萄糖被消耗完毕。由图2中菌体生长曲线可以知:在0~12 h菌体生长较为缓慢,从12 h开始菌体生长进入对数期,细胞生长速率大幅度提高,菌体生长在42 h后进入平稳期,基本不再变化。
如图2菌株CPC产酶活力曲线图可以看出,前期由于罐体内细胞浓度较低,产生的凝乳酶积累较少,0~12 h 所测得的酶活性较低,随着细胞密度的不断增加,18 h凝乳酶活性为100 SU/mL左右,18~54 h细胞所产生的凝乳酶逐渐积累,54 h后凝乳酶产量逐渐稳,达到峰值酶活力值530 SU/mL。以上结果表明,与普通摇瓶培养相比,菌株在1 L发酵罐中的凝乳酶产量更高,发酵时间也更短。这可能是由于发酵罐相对于摇瓶能为菌体提供更加优越的环境,更有利于菌体生长。
3.1 通过单因素试验确定各成分适宜浓度,结果显示最佳质量浓度分别为(g/L):葡萄糖70、玉米浆40、酵母粉5、磷酸二氢钾4、尿素15、硫酸锌4、硫酸氨1.5和氯化镁0.4。在此基础上,采用Plackett-Burman试验考察8个成分对骆驼凝乳酶产量的影响,结果表明葡萄糖、尿素和玉米浆对产酶影响显著。
3.2 通过响应面试验设计分析,对萄糖、尿素、玉米浆三个显著因素进一步优化,结果表明,骆驼凝乳酶工程菌最适发酵培养基为(g/L):葡萄糖86.6、玉米浆56.9、酵母粉4、尿素18、磷酸二氢钾3、硫酸锌3、硫酸氨1、氯化镁0.3。进行摇瓶发酵验证,酶活性达到431.25 SU/mL,与预测值(430.904 SU/mL)接近,表明该优化模型能准确预测实际发酵情况。使用1 L发酵罐进行发酵,凝乳酶活性达到530 SU/mL,在基础培养基配方下的凝乳酶活性为206.31 SU/mL,酶活力提升了2.56倍,发酵时间从96 h缩短到55 h左右。
3.3 结果证明,采用响应面实验优化发酵培养基效果理想,利用1 L发酵罐进行培养,骆驼凝乳酶活性显著提高。因此,本研究获得的骆驼凝乳酶原工程菌发酵培养基配方具有很高的应用价值,为骆驼凝乳酶的实际生产提供重要的参考依据。在以后实验中,还需对骆驼凝乳酶重组菌株 CPC的发酵条件及补料方式进行研究,进一步提高凝乳酶活性。
参考文献
[1] 蔡琳飞,李键,陈炼红.我国奶酪产品研究现状及分析[J].中国乳品工业,2015,43(7):42-44 CAI Lin-fei, LI Jian, CHEN Lian-hong. Research status and analysis of cheese products in China [J]. Chinese Dairy Industry, 2005, 43(7): 42-54
[2] 杨艺,普燕,张富春.骆驼凝乳酶凝乳特性的研究进展[J].中国乳业,2014,150:56-58 YANG Yi, PU Yan, ZHANG Fu-chun. Research progress of clotting milk characteristics of camel chymosin [J]. China Dairy, 2014, 150: 56-58
[3] Williams M G, Wilsher J, Nugent P, et al. Mutagenesis,biochemical characterization and X-ray structural analysis of point mutants of bovine chymosin [J]. Protein Eng., 1997,10(9): 991-997
[4] 刘佟,崔艳华,张兰威,等.凝乳酶的研究进展[J].中国乳品工业.2011,39(8):40-43 LIU Tong, CUI Yan-hua, ZHANG Lan-wei, et al. Research advancement of chymosin [J]. China Dairy, 2011, 39(8):40-43
[5] 普燕,马晓林,张富春,等.骆驼凝乳酶的分子结构与制备干酪的研究现状[J].食品与发酵工业,2016,10(38):234-242 PU Yan, MA Xiao-lin, ZHANG Fu-chun, et al. Research progress on molecular structure and cheese-making of the camel chymosin [J]. Food and Fermentation Industrie, 2016,10(38): 234-242
[6] Cullen D, Gray G L, Wilson L J, et al. Controlled expression and secretion of bovine in Aspergillus nidulans [J]. Nat Biotech, 1987, 5(3): 369-376
[7] Emtage J S, Angal S, Doel M T, et al. Synthesis of calf prochymosin (prorenmin) in Escherichia coli [J]. Proc. Natl.Acad. Sci. USA, 1983, 80(12): 3671-3675
[8] Ward M, Wilson L J, Kodama K H, et al. Improved production of chymosin in Aspergillus by expression as a glucoamylase-chymosin fusion [J]. Biotechnology, 1990, 8(5):435-440
[9] 张莉,姜媛媛,张健,等.牛凝乳酶基因在毕赤酵母中的重组表达[J].生物工程学报, 2009,25(8):1160-1165 ZHANG Li, JIANG Yuan-yuan, ZHANG Jian, et al.Recombinant expression of bovine chymosin in Pichia pastoris [J]. Chinese Journal of Biotechnology, 2009, 25(8):1160-1165
[10] J Mellor. Efficient synthesis of enzymatically active calf chymosin in Saccharomyces cerevisiae [J]. Gene, 1983, 24(1):1-14
[11] Vanden B J A. Kluyveromyces as a host for heterologous gene expression: expression and secretion of prochymosin [J].Biotechnology, 1990, 8(2): 135-139
[12] 周俊清,林亲录,赵谋明.产高效凝乳酶菌株获得方法的探讨[J].食品科学,2005,26(3):253-256 ZHOU Jun-qing, LIN Qin-lu, ZHAO Mou-ming. Discussion on method of yielding high effect chymosin-producing strain[J]. Food Science, 2005, 26(3): 253-256
[13] 何俊霞,哈斯苏荣,那仁巴图,等.驼乳医疗保健作用的研究进展[J].食品科学,2009,30(23):504-507 HE Jun-xia, Hasisurong, Narenbatu, et al. Research progress in health care function of camel milk [J]. Food Science, 2009,30(23): 504-507
[14] N Bansal, M A Drake, P Piraino, et al. Suitability of recombinant camel (Camelus dromedarius) chymosin as a coagulant for cheddar cheese [J]. International Dairy Journal,2009, 19(9): 510-517
[15] Wangoh J. Extraction of camel rennet and its comparison with calf rennet extract [J]. Milchwissenschaft, 1993, 48(6):322-325
[16] 袁伟,惠丰立,柯涛,等.均匀设计法优化廉价型牛凝乳酶工程菌发酵培养基[J].食品科学,2011,32(7):258-261 YUAN Wei, HUI Feng-li, KE Tao, et al. Optimization of fermentation medium for genetically engineered chymosin strain by uniform design methodology [J]. Food Science,2011, 32(7): 258-261
[17] Arima K, Yu J, Iwasaki S. Milk-clotting enzyme from Mucor pusillus var. Lindt [M]. New York and London: Academic Press, 1970
[18] 王普,孙立明,何军邀.响应面法优化热带假丝酵母104菌株产羰基还原酶发酵培养基[J].生物工程学报,2009,25(6):863-868 WANG Pu, SUN Li-ming, HE Jun-yao. Medium optimization for enhanced production of carbonyl reductase by Candida tropicalis 104 by response surface methodology[J]. Chinese Journal of Biotechnology, 2009, 25(6): 863-868
[19] Forde A, Fitzgerald G F. Biotechnological approaches to the understanding and improvement of mature cheese flavor [J].Current Opinion in Biotechnology, 2000, 11(5): 484-489
[20] 冯培勇,赵彦宏,张丽.响应面法优化黑曲霉产纤维素酶发酵条件[J].食品科学,2009,30(23):335-339 FENG Pei-yong, ZHAO Yan-hong, ZHANG Li.Optimization of cellulase production by Aspergillus niger using response surface methodology [J]. Food Science, 2009,30(23): 335-339
[21] K Adhikari. Textural characteristics of lowfat, fullfat and smoked cheeses: sensory and instrumental approaches [J].Food Quality and Preference, 2003, 14(3): 211-218
Optimization of Fermentation Medium for Genetically Engineered Strain with Camel Chymosin-producing capability
Abstract: Chymosin can specifically cleave the peptide bond between κ-casein Phe 105 and Met 106 in milk, cause milk-clotting and widely used in dairy products. Bovine chymosi has been deeply studied, but few research on camel chymosin were reported. According to the single-factor experiments design, Plackett-Burman design was used to evaluate the effects of 8 medium components on the production of chymosin to obtain a high-performance fermentation medium. The results showed that glucose, corn syrup, and urea concentrations had significant effects on the chymosin production. Box-Behnken experimental design was employed to optimize the three medium components furtherly. The optimal fermentation medium for antifungal substance production was composed of glucose 86.6 g/L, corn syrup 56.9 g/L, yeast extract 4g/L , KH2PO4 3 g/L, urea 18 g/L, ZnSO4 3 g/L, (NH4)2SO4 1 g/L and MgCl2 0.3 g/L. Under the optimal conditions, the activity of chymosin could reach 431.25 SU/mL, which were 2.08 folds higher than the original medium (207.03 SU/mL). The chymosin activity reached 530 SU/mL after fermentation in an 1Lfermentation tank with exact medium components, being 1.22 folds higher than the chymosin activity obtained by shake flask fermentation.
Key words: camel chymosin; cultivation; response surface methodology; medium optimization
文章篇号:1673-9078(2017)12-170-176
DOI: 10.13982/j.mfst.1673-9078.2017.12.026
收稿日期:2017-07-04
基金项目:国家自然科学基金项目(31370073);河南省基础与前沿技术研究计划(102300410146);南阳师范学院研究生创新基金项目(2017CX012)