表1 测定双酚A对线虫LC50的数据表格
Table 1 Data tables for the determination of LC50 of bisphenol A against nematode

浓度/mM 总数 存活数2 20 14 1 20 6 0.5 20 3 0.25 20 2 0.125 20 1 0.0625 20 0
摘要:双酚A(BPA)是一种普遍存在的内分泌干扰物,可以对人体健康产生不良影响。日常生活中,人们接触的BPA浓度较低,而低浓度下BPA毒性效应却并不明确。为了了解低浓度下BPA的毒性效应,我们以秀丽隐杆线虫为模式生物,以低浓度的BPA为研究对象,开展了急性毒性研究。研究结果表明BPA对秀丽线虫的LC50为440.16 mg/L,而低浓度的BPA对秀丽线虫的运动行为指标(头部摆动频率、身体弯曲频率)均具有显著的抑制作用,对头部摆动频率影响最为敏感,最低作用浓度为1 μmol/L。低浓度的BPA还会影响秀丽线虫的生长发育和子代数目,与对照组相比,BPA浓度为100 μmol/L时,体长和子代数目分别降低6.05%和15.24%。当BPA达到0.01 μmol/L时,能够显著抑制秀丽线虫的寿命并且提高ROS水平,引起氧化应激的伤害,加速秀丽线虫的衰老,缩短其寿命。总之,低浓度的BPA暴露可以影响秀丽线虫的运动、生长发育、生殖及寿命。
关键词:双酚A;秀丽隐杆线虫;内分泌干扰物;运动行为;生长发育;食品包装材料
双酚A(Bispheno1 A,BPA)是普遍存在的一种环境雌激素,是制造聚碳酸酯、环氧树脂等塑料制品的前体物,被广泛用于各种塑料制品的生产,可通过食物、饮水等途径进入人体[1,2]。BPA在19世纪90年代初合成并报道(Einhorn,1898年),目前是全球产量最高的内分泌干扰物之一[3,4]。传统毒理学观点认为日常生活环境中人们接触的BPA浓度很低,不足以构成对人体的危害,只有当双酚A的剂量远远高于当前人体内的含量时,才会损害人体健康[5]。然而有许多研究表明,BPA可以在环境相关的低剂量下对人体产生危害[6],因此许多国家都对这种化学物质的生产和使用进行了限制。早在2009年加拿大率先禁止了BPA在婴幼儿奶瓶产品中的使用,欧盟、中国、美国等也紧随其后出台相应政策,而法国甚至在2015年开始禁止BPA在食品包装材料中的使用[7]。广泛的毒理学研究和人群流行病学调查己经表明 BPA具有雌性激素的特性,对生殖系统、肝脏和乳腺有一定的损伤,同时 BPA与肥胖症、糖尿病以及胎儿畸形也存在关联[8~10]。
秀丽隐杆线虫是一种在土壤中自由生活的,相当常见的小型线虫。是全基因组已知的多细胞生物,具有周期短、繁殖能力强、培养容易及便于观察等优点[11~13]。近年来也被广泛的应用于环境污染物的毒理学研究中,相应的指标和生物标志物也已经发展的较为成熟。秀丽隐杆线虫用作模式生物几十年的研究显示,其拥有替代哺乳动物进行环境生物评价的特点和优势。本实验以BPA为研究对象,秀丽隐杆线虫为模式生物,研究BPA急性毒性暴露后对秀丽线虫的LC50、运动行为、体长、子代数目、寿命和ROS等影响,为BPA在食品包装材料中的应用提供参考。
BPA,美国Sigma公司;活性氧ROS试剂盒,南京生物建成生物有限责任公司;其他生化试剂,国药集团化学试剂有限责任公司。
体视显微镜,南京江南永新光学有限公司;多功能酶标仪,帝肯(上海)贸易有限公司。
本研究所用的秀丽隐杆线虫N2野生型,由东南大学王大勇实验室惠赠。
将大量处于产卵期的雌雄同体的秀丽隐杆线虫成虫从NGM固体培养基冲洗下来,加入1 mL的裂解液,裂解5 min,3000 r/min离心1.5 min,弃上清,得到沉淀的虫卵。反复清洗3次,以充分去除裂解液成分。最后将虫卵转移到涂有新鲜食物的NGM培养基上,在20 ℃培养箱中培养。
根据试验设计配制浓度分别为 100、10、1、0.1、0.01、0.001、0 mM的BPA染毒液,染毒液中乙醇的终浓度全部为0.1%。将处于L4期的秀丽隐杆线虫分别转移到含有不同浓度染毒液的培养基中,进行急性毒性爆露,24 h后进行各项指标测定。
配置2 mM、1 mM、0.5 mM、0.25 mM、0.125mM、0.0625 mM 的 BPA染毒液(乙醇终浓度为1%),在96孔板对L4期幼虫进行液体暴毒24 h,每个浓度设置 3个平行,计数死亡线虫条数,并利用SPSS软件计算LC50。
1.5.1 运动行为指标的测定[14]
1.5.1.1 头部摆动频率
头部摆动频率:滴取适量M9于载玻片上,挑取暴毒后的线虫于M9液滴中,在体式显微镜下观察,头部摆动频率的标准为1 min内头部从一侧摆到另一侧再摆回来的次数。
1.5.1.2 身体弯曲频率
将暴毒后的线虫依次挑起置于没有涂布大肠杆菌的NGM培养基上,在体式显微镜下观察。记线虫身体向前走过一个波长为一次身体弯曲,记录30 s内线虫的身体弯曲次数。
1.5.2 体长的测定
暴露结束后,将待测线虫转移到载玻片上,并用麻醉剂进行麻醉,在显微镜下测量其体长。
1.5.3 子代数目的测定
暴毒结束后,在涂有大肠杆菌OP50的NGM培养基上挑1只待产卵的线虫,并保证在产卵期内每天将线虫转移到新的NGM培养基上,含有虫卵的旧平板继续放置培养箱内培养24 h,然后对每个平板内的线虫的数目进行统计、相加。等到线虫的排卵期结束后,计算每条线虫总的子代数目。
1.5.4 寿命的测定
暴毒结束后,将秀丽隐杆线虫挑到新的培养基上,产卵期内每天将线虫转移到新的平板上,后期每两天转移一次。线虫的寿命是指从线虫的卵开始直到死亡的这段时间。
1.5.5 活性氧自由基[15]的测定
暴毒结束后,每个浓度挑取 50只待测线虫至Costar 24孔板内,然后每个孔内分别加入ROS试剂,使荧光探针CM-H2DCFDA的终浓度为1 μmol/L,在无菌生化培养箱内培养2 h后取出处理后的受试线虫,用M9缓冲液冲洗3次,以去除残留的ROS试剂。用多功能酶标仪来检测各个浓度的受试线虫的 ROS水平,激发波长和发射波长分别设置为485 nm和535 nm,读出ROS的平均荧光强度。ROS水平的单位定义为相对荧光强度/50条受试线虫。
利用origin 8.5对结果进行统计分析,并用SPSS做显著性分析,与对照组相比较,显著水平设定为*p<0.05 和**p<0.01。
表1 测定双酚A对线虫LC50的数据表格
Table 1 Data tables for the determination of LC50 of bisphenol A against nematode

浓度/mM 总数 存活数2 20 14 1 20 6 0.5 20 3 0.25 20 2 0.125 20 1 0.0625 20 0
如表1所示,利用SPSS软件中Probit模块来计算 LC50。Sig<0.05,说明线性拟合性良好。可以写出模拟方程为PROBIT(P)=-1.752+1.168x,当P=0.5时,LC50=(0.5+1.752)/1.168,LC50=1.93 mM/L,换算后为440.16 mg/L。所以BPA对秀丽线虫的半致死浓度为440.16 mg/L。

图1 BPA急性暴露对秀丽隐杆线虫运动行为的影响
Fig.1 Effects of acute exposure of BPA on the movement behavior of C. elegans
注:所有数据均表示为平均值±标准误差,*p<0.05,**p<0.01。
图1分别显示了不同浓度的BPA急性暴露对秀丽线虫的运动行为的影响。如图所示,与对照组相比,当BPA浓度达到1 μmol/L时,秀丽线虫的头部摆动频率显著性下降(p<0.01),而浓度达到10 μmol/L时,秀丽线虫的身体弯曲频率显著下降(p<0.05)。研究表明,BPA急性暴毒对秀丽线虫的运动行为能力产生显著性影响,BPA浓度越高,对秀丽线虫的运动行为抑制性越显著。秀丽线虫的头部摆动频率与身体弯曲频率相比,BPA急性暴毒对头部摆动频率影响更为敏感。
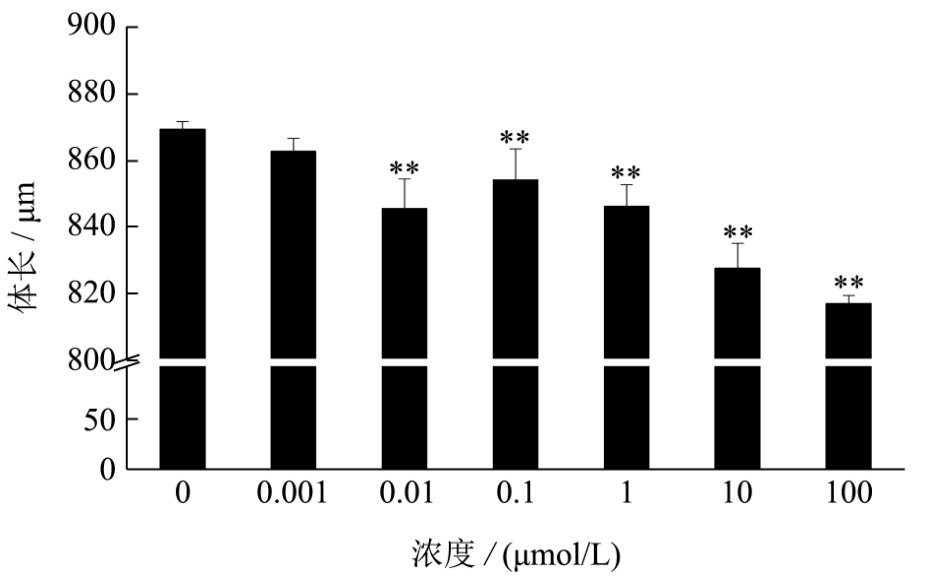
图2 BPA急性暴露对秀丽隐杆线虫体长的影响
Fig.2 Effects of acute exposure of BPA on the body length of C.elegans
注:所有数据均表示为平均值±标准误差,*p<0.05,**p<0.01。
图2显示了不同浓度的BPA对秀丽线虫的体长的影响,如图所示,与对照组相比,当浓度达到 0.001 μmol/L时,秀丽线虫的体长显著下降(p<0.01)。BPA浓度达到100 μmol/L时,与对照组相比,体长下降了6.05%。研究表明,BPA对秀丽线虫的体长有明显的负面影响,浓度越高,对体长的影响越显著。
图3显示了不同浓度的BPA急性暴露对秀丽线虫子代数目的影响,结果如图所示,与对照组相比,随着BPA浓度的升高,秀丽线虫的子代数目表现出下降趋势。当BPA浓度达到1 μmol/L时,子代数目下降21.34%,当BPA浓度达到100 μmol/L时,子代数目下降15.24%。实验证明,BPA可以降低秀丽线虫的子代数目。
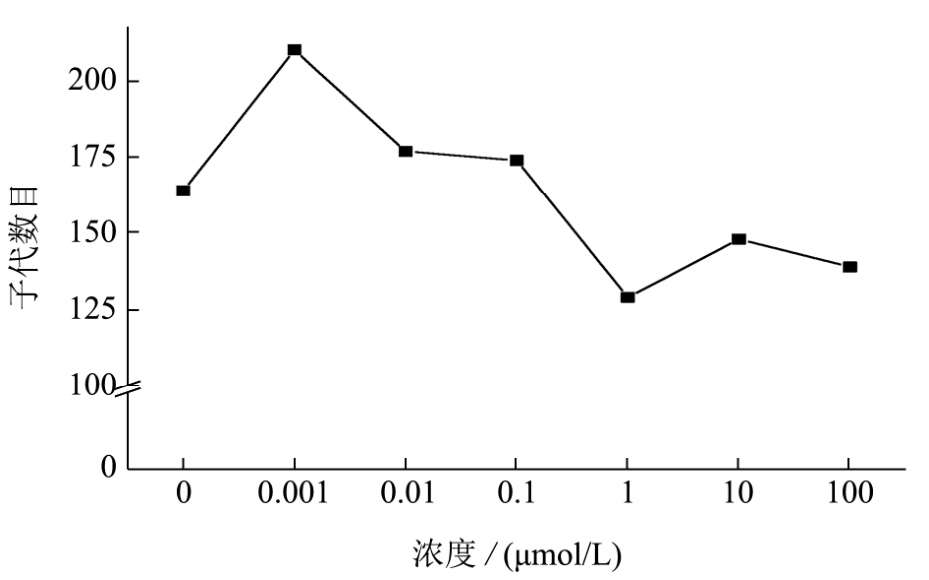
图3 BPA急性暴露对秀丽隐杆线虫子代数目的影响
Fig.3 Effects of acute exposure of BPA on the brood size of C.elegans
注:所有数据均表示为平均值±标准误差,*p<0.05,**p<0.01。
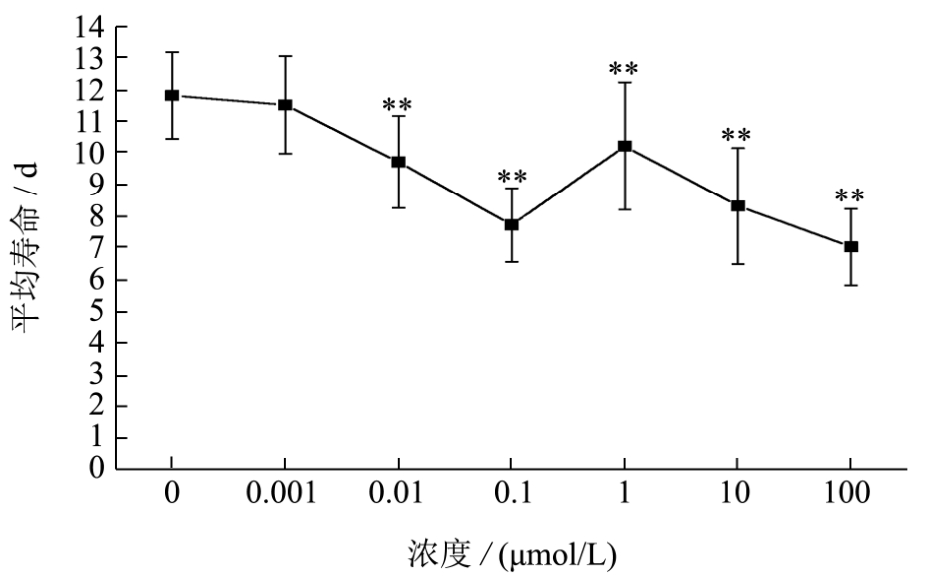
图4 BPA急性暴露对秀丽隐杆线虫寿命的影响
Fig.4 Effects of acute exposure of BPA on the Lifespan of C.elegans
注:所有数据均表示为平均值±标准误差,*p<0.05,**p<0.01。
不同浓度 BPA急性暴露对秀丽线虫的寿命影响如图4所示,当BPA浓度达到0.01 μmol/L时,秀丽线虫的寿命显著下降(p<0.01)。BPA浓度为0.1 μmol/L和100 μmol/L的寿命下降最为明显,与对照组相比,分别下降34.75%和40.68%。研究表明,BPA可以对秀丽线虫寿命产生负面影响。
ROS是一个可以反映机体是否受到氧化损伤的有效指标,而且有研究表明自由基是导致衰老的根本原因。所以测定氧自由基ROS很有必要。如图5所示,当浓度达到 0.01 μmol/L时,ROS水平显著升高(p<0.01),浓度越高,ROS水平越高。BPA浓度为100 μmol/L时,与对照组相比,ROS水平升高了475.50%。研究表明,BPA可以通过氧化应激途径对秀丽线虫产生损害,且浓度越高作用越显著。
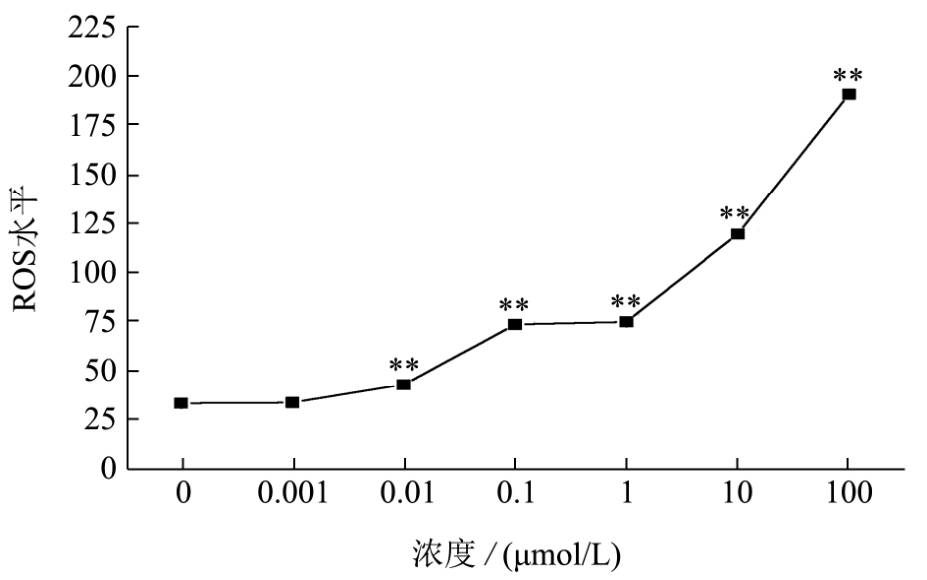
图5 BPA急性暴露对秀丽线虫ROS水平的影响
Fig.5 Effects of acute exposure of BPA on ROS level of C.elegans
注:所有数据均表示为平均值±标准误差,*p<0.05,**p<0.01。
3.1 研究表明,BPA急性暴露秀丽线虫的 LC50为440.16 mg/L,远高于日常生活中能够暴露的浓度。而低浓度的风险评估不可忽视,以LC50和日常生活中的暴露浓度为基础,我们设计了低浓度BPA急性暴露对秀丽线虫的影响,以此来评估低浓度BPA的危害。结果表明,当BPA浓度达到1 μmol/L时对秀丽线虫的运动行为有显著性影响,尤其是对头部摆动频率的差异性影响显著。因为秀丽线虫的神经系统非常敏感,这可能与 BPA通过影响秀丽线虫的神经系统从而抑制秀丽线虫的行为相关。作为典型的内分泌干扰物,BPA暴露可以导致发育毒性,而身体长度是生长发育的重要指标之一。实验数据表明,BPA可以显著抑制秀丽线虫的体长,最低检测限度为0.001 μmol/L。BPA急性暴露对秀丽线虫体长的影响证明了 BPA可能会影响线虫生长发育。大量研究表明,BPA对生殖具有显著毒性。BPA可以抵抗雌激素活性导致生殖力降低[16],显著地增加生殖细胞的死亡数,抑制秀丽隐杆线虫的胚胎大小。也有证据表明BPA暴露可以显著抑制卵子生成,导致不育水平和胚胎致死率升高[17,18]。实验发现,BPA可以显著降低子代数目,证明BPA对秀丽线虫生殖具有毒性效应。根据老龄化的自由基理论,过度产生ROS,特别是超氧化物阴离子及其衍生物,是老化的主要机制。BPA暴露下有助于ROS的生成从而加速衰老,氧化应激的诱导在调节这一过程中起着不可或缺的作用[19,20]。我们研究发现BPA对秀丽线虫的寿命和ROS都有显著性影响。BPA浓度为100 μmol/L时,秀丽线虫的寿命缩短最为明显,与对照组相比,缩短40.68%。但值得一提的是0.1 μmol/L的BPA同样显著抑制秀丽线虫的寿命,缩短 34.75%。BPA对秀丽线虫ROS的影响呈现出线性关系,BPA浓度越高ROS水平越高。这一结果表明,BPA可能通过氧化应激途径损伤秀丽线虫,从而影响秀丽线虫的寿命。影响寿命的主要因素有很多,例如环境因素、饮食因素、疾病因素和遗传因素等,ROS值与秀丽线虫的寿命并没有表现出相对应的浓度上一致性,所以对影响秀丽线虫寿命的因素还需进一步验证。
3.2 总而言之,本研究表明日常生活中通过饮食等途径暴露的低浓度BPA可以减弱秀丽线虫的运动行为,降低身体长度,损害生殖能力,减少子代数目,缩短寿命,提高ROS水平。低浓度的BPA仍然需要我们警惕。
参考文献
[1] Meeker J D, Calafat A M, Hauser R. Urinary bisphenol A concentrations in relation to serum thyroid and reproductive hormone levels in men from an infertility clinic [J].Environmental Science & Technology, 2010, 44(4):1458-1463
[2] Groff T. Bisphenol A: invisible pollution [J]. Current Opinion in Pediatrics, 2010, 22(4): 524
[3] Kim H K. Maternal and fetal exposure to bisphenol A in Korea [J]. Reproductive Toxicology, 2008, 25(4): 413
[4] Calafat A M, Ye X, Wong L Y, et al. Exposure of the U.S.population to bisphenol A and 4-tertiary-octylphenol:2003-2004 [J]. Environmental Health Perspectives, 2008,116(1): 39
[5] Shelby M. NTP-CERHR monograph on the potential human reproductive and developmental effects of bisphenol A [J].Ntp cerhr mon, 2008,(22): v, vii-ix, 1-64 passim
[6] Vandenberg L N, Colborn T, Hayes T B, et al. Hormones and endocrine-disrupting chemicals: low-dose effects and nonmonotonic dose responses [J]. Endocrine Reviews, 2012,33(3): 378-455
[7] Völkel W, Colnot T, Csanády G A, et al. Metabolism and kinetics of bisphenol a in humans at low doses following oral administration [J]. Chemical Research in Toxicology, 2002,15(10): 1281-1287
[8] Mielke H, Gundert-Remy U. Bisphenol A levels in blood depend on age and exposure [J]. Toxicology Letters, 2009,190(1): 32-40
[9] Vanlandingham M. Pharmacokinetics of bisphenol A in neonatal and adult CD-1 mice: inter-species comparisons with Sprague-Dawley rats and rhesus monkeys [J].Toxicology Letters, 2011, 207(3): 298
[10] Zhou D, Yang J, Li H, et al. The chronic toxicity of bisphenol A to Caenorhabditis elegans after long-term exposure at environmentally relevant concentrations [J]. Chemosphere,2016, 154: 546-551
[11] Benachour N, Aris A. Toxic effects of low doses of bisphenol A on human placental cells [J]. Toxicology & Applied Pharmacology, 2009, 241(3): 322-328
[12] Li D K, Miao M, Zhou Z J, et al. Urine bisphenol-A level in relation to obesity and overweight in school-age children [J].Plos One, 2013, 8(6): e65399
[13] Corsi A K, Wightman B, Chalfie M A Transparent window into biology: a primer on Caenorhabditis elegans [J].Genetics, 2015, 200(2): 387-407
[14] 孔璐,张婷,王大勇,等.纳米二氧化硅对秀丽线虫的毒性作用研究[J].生态毒理学报,2011,6(6):655-660 KONG Lu, ZHANG Ting, WANG Da-yong, et al. Toxicity of SiO2 nanoparticles to Caenorhabditis elegans [J]. Asian Journal of Ecotoxicolog, 2011, 6(6): 655-660
[15] Rosenfeldt E J, Linden K G. Degradation of endocrine disrupting chemicals bisphenol A, ethinyl estradiol, and estradiol during UV photolysis and advanced oxidation processes [J]. Environmental Science & Technology, 2004,38(20): 5476-5483
[16] Allard P, Colaiácovo M P. Bisphenol A impairs the double-strand break repair machinery in the germline and causes chromosome abnormalities [J]. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(47): 20405-20410
[17] Forbes V E, Calow P. Population growth rate as a basis for ecological risk assessment of toxic chemicals [J].Philosophical Transactions of the Royal Society of London,2002, 357(1425): 1299-1306
[18] Rezg R, Elfazaa S, Gharbi N, et al. Bisphenol A and human chronic diseases: current evidences, possible mechanisms,and future perspectives [J]. Environment International, 2014,64(3): 83[13] 谢新华,马红静,徐超,等.蔗糖和海藻糖对糯米淀粉凝胶冻融稳定性的影响[J].中国粮油学报,2016,31(12):29-32 XIE Xin-hua, MA Hong-jing, XU Chao, et al. Effect of Sucrose and trehalose on freeze-thaw stability of waxyrice starch gel [J]. Journal of the Chinese Cereals and Oils Association, 2016, 31(12): 29-32
[14] Khomutov L I. Temperature-composition phase diagram and gel properties of the gelatin-starch-water system [J].Carbohydrate Polymers, 1995, 28(4): 341-345
Study on Acute Toxicity of Bisphenol A to Caenorhabditis Elegans
Abstract: Bisphenol A (BPA) is a ubiquitous endocrine disrupter that can have side effect on human health. In daily life, people are exposed to low concentration of BPA, while the effect of BPA toxicity is not clear at low concentrations. In order to understand the toxic effects of BPA at low concentration, we used Caenorhabditis elegans (C. elegans) as a model organism to study the acute toxicity of low concentration of BPA. The results showed that the LC50 of BPA was 440.16 mg/L for C. elegans, while the low concentration of BPA had significant inhibitory effect on the movement behavior indexes (including head thrashing frequency and body bending frequency) of C. elegans. The most sensitive index was the head thrashing frequency and the lowest concentration was 1 μmol/L. Low concentration of BPA also affected the growth and development of C. elegans as well as the number of progenies. Compared with the control group, BPA at the concentration of 100 μmol/L reduced body length and progeny by 6.05% and 15.24%, respectively. When the concentration of BPA reached 0.01 μmol/L, it could significantly inhibit the life span of C. elegans and increase the level of ROS, causing oxidative stress injury, accelerating the senescence of C.elegans and shortening its life span. In conclusion, low concentration of BPA exposure could affect the movement, growth, reproduction and longevity of C. elegans.
Key words: bisphenol A; Caenorhabditis elegans; endocrine disruptor; movement behavior; growth and development; food packaging materials
文章篇号:1673-9078(2017)12-1-5
DOI: 10.13982/j.mfst.1673-9078.2017.12.001
收稿日期:2017-09-26
基金项目:国家自然科学基金资助项目(31501569);江苏大学高级专业人才专项(13JDG037)