摘要:为比较刺五加及短梗五加样品中主要活性成分差异,选取吉林、黑龙江及辽宁等三省刺五加及短梗五加样品,利用薄层层析(TLC)法进行鉴别,并利用HPLC法测定了紫丁香苷、刺五加苷E及异嗪皮啶含量。结果表明:利用紫外灯(365 nm)显示的刺五加TLC图谱中异嗪皮啶特征条带均非常明显,短梗五加TLC图谱中异嗪皮啶特征条带不明显但存在痕迹,因此该鉴别方法可增加定量指标以保证鉴别结果的确定性。HPLC测试结果显示刺五加样品中三种功效成分含量总体较高,且紫丁香苷及异嗪皮啶平均含量均高于短梗五加样品。个别短梗五加中紫丁香苷含量达到近0.1%,而《药典》中规定紫丁香苷含量不低于0.05%,因此为防止短梗五加的混入,可在进一步深入研究基础上适当提高刺五加中紫丁香苷含量标准。
关键词:刺五加;短梗五加;紫丁香苷;刺五加苷E;异嗪皮啶;HPLC;TLC;鉴别
刺五加为五加科植物刺五加(Acanthopanax sentcosus (Ruper.et Maxim.) Harms)的干燥根及根茎或茎[1]。刺五加根和根茎做刺五加药材入药,并列入中华人民共和国药典,其树皮做五加皮入药,叶、茎和果实亦可供药用[2]。具有补肾健脾、扶正固本和益智安神等功效。临床主要用于脾肾阳虚、体虚乏力、食欲不振和腰膝酸软等[3]。临床已用于治疗心脑血管疾病、白细胞减少症、低血压、风湿性关节炎和肿瘤等[4]。原卫生部于2002年发布《关于进一步规范保健食品原料管理的通知》(卫法监发[2002]51号),规定刺五加被列入《可用于保健食品的物品名单》[5],因此不能做普通食品使用。刺五加在我国主要生长在东北地区。其中以中国黑龙江省流域产量最大。吉林、辽宁和河北等地也有分布[6]。刺五加主要含有刺五加总苷,包括紫丁香苷、异嗪皮啶和刺五加苷E等成分[7,8]。短梗五加 Acanthopanax sessiliflorus是五加科灌木植物,与人参为同科植物,与刺五加、细柱五加为同科同属植物,其别名无梗五加。短梗五加2008年被(原卫生部和国家卫生计生委2008年12号公告)批准为新资源食品[9]。短梗五加未被我国药典列为药品名录,应当做食品对待。其开发的食品包括用叶片制作的茶,嫩枝或芽可做蔬菜,果实可做饮料或酒等。本项目组在东北三省刺五加产地及药材集散地进行调研时发现,目前市场上经常将短梗五加与刺五加混淆,很多短梗五加产品被当做刺五加进行功效宣传和销售。紫丁香苷、刺五加苷E及异嗪皮啶是刺五加的重要功效成分[7,8],这些成分在刺五加及短梗五加中含量的比较研究鲜见报道。本研究选取黑龙江、吉林及辽宁东北三省的刺五加及短梗五加样品,测试二者所含上述三种功效成分含量的差异,并进行了薄层层析(TLC)鉴定,以明确二者在主要功效成分含量上的差异,并对刺五加鉴定方法的适用性进行评价。
本次测试样品分别采自黑龙江、吉林、辽宁三个省份的林场,从每个省份分别采挖刺五加及短梗五加小株(1~5年生)、中株(5~10年生)及大株(生长期10年以上)各三个样本,每个样品三株。样品经晒干装入塑料自封袋,常温密封保存。
刺五加标准药,该品规格5 g,为粉末状,购自中国食品药品检定研究院,批次号120991-201109。
刺五加苷E(Eleutheroside E),CAS 39432-56-9,Sigma-Aldrich公司,批次号BCBQ7879V;紫丁香苷(Eleutheroside B),CAS 118-34-3,Sigma-Aldrich公司,批次号WXBC2823V;异嗪皮啶(Isofraxidin),CAS 486-21-5,Sigma-Aldrich公司,批次号BCBN9268V。
对照品溶液配制:精密称取刺五加昔E对照品,加甲醇制成55.6 μg/mL的刺五加苷E对照品溶液;精密称取紫丁香苷对照品适量,加甲醇制成 24 μg/mL的紫丁香苷对照品溶液;精密称取异嗪皮啶对照品适量,加甲醇制成100 μg/mL的异嗪皮啶对照品溶液。
甲醇,色谱纯 Sigma-Aldrich;乙腈,色谱纯,Sigma-Aldrich公司;乙酸钠、冰醋酸和乙醇及三氯甲烷等试剂均为优级纯。
LC-20A岛津高效液相仪器,岛津公司;FW-400A倾斜式高速万能粉碎机,北京科伟仪器有限公司;KQ-500DE数控超声波清洗器,昆山市超声仪器有限公司;Neofuge15R高速冷冻离心机,上海力申科学仪器有限公司;CP213电子天平,奥豪斯仪器(常州)有限公司;P-7薄层色谱展开缸,上海信谊仪器厂有限公司。
1.5.1 薄层色谱(TLC)分析
取5 g样品粉末,加入75%乙醇50 mL,加热回流1 h,过滤,蒸干滤液,残渣加入10 mL水溶解,用三氯甲烷振摇提取2次,每次5 mL,合并三氯甲烷液,蒸干,残渣加入1 mL甲醇溶解,作为供试品溶液;取5 g刺五加对照药材,同法制成对照药材溶液。取上述三种溶液各10 μL,分别点于同一硅胶G薄层色谱板上,以三氯甲烷-甲醇(19:1)为展开剂,展开,去除,晾干,置于紫外灯(365 nm)下视检。供试品色谱中,与对照药材色谱相应的位置上,显示相同颜色的荧光斑点,在对照品色谱相应位置上,显示相同的蓝色荧光斑点。
1.5.2 高效液相色谱(HPLC)法测定刺五加苷E、紫丁香苷及异嗪皮啶含量
参照《药典》刺五加颗粒中上述三种物质的HPLC法,在检测波长上进行了改进。
(1)色谱条件
色谱柱:C18色谱柱(4.6×150 mm);流动相:乙酸钠溶液(10 mmol/L、以磷酸调节pH 6.2,A):乙腈(B),采用梯度洗脱,洗脱程序为:0~25 min 10%~30% B,25~30 min 30%~40% B,30~31 min 40%~50% B。扫描标准品最大吸收峰,确定检测波长:刺五加苷E 210 nm,紫丁香苷265 nm,异嗪皮啶344 nm。柱温30 ℃,流速1.0 mL/min。
(2)样品处理制备
分别精确吸取刺五加苷E对照品溶液4 mL、紫丁香苷对照品溶液 4 mL和异嗪皮啶对照品溶液 1 mL,混匀,用微孔滤膜(0.45 μm,有机系)过滤即得混合标准对照品溶液。
供试品溶液制备:称取样品粉末2.00 g(过40目筛),置于50 mL离心管中,加入15 mL 50%甲醇,超声提取(功率300 W、30 min、30 ℃),离心(4000 r/min、5 min),将上清液倒入另一离心管中,向沉淀加入50%甲醇15 mL,超声提取(功率300 W、30 min、30 ℃),离心(4000 r/min、5 min),合并上清液,用微孔滤膜(0.45 μm,有机系)过滤即得刺五加原料供试品溶液。
(3)测定
分别精密吸取混合标准对照品溶液40 μL与供试品溶液10 μL,进样测定。
(4)计算
供试品中某功效成分含量按公式(1)计算。
式中:M 表示干物质质量(g);Vi表示待测样品上样量(mL);Ai表示样品中此物质的峰面积;C表示混标中此物质标准品的浓度(mg/mL);Vs表示混标上样量(mL);As表示混标中此物质的峰面积;30表示甲醇提取液体积。
对采自三个省份的刺五加及短梗五加进行 TLC分析,分别用紫外灯及凝胶成像仪的紫外摄像功能成像,得到图谱见图1。对于紫外灯的TLC图谱,异嗪皮啶标准品有一个条带(B1),标准药及其它样品有两个明显条带(B1及 B2),均为蓝色。很显然,B1为异嗪皮啶特征条带。2、4和6号样品及刺五加标准药均显示出明显的异嗪皮啶蓝色特征条带。而 1、3及5号样品的异嗪皮啶特征条带不明显。因此刺五加与短梗五加在异嗪皮啶特征条带的含量差异还是非常明显的,但短梗五加并不是没有异嗪皮啶条带,只是特征条带比刺五加要浅。除了异嗪皮啶特征条带,所有刺五加及短梗五加样品均显示了与标准药相同条带B2。其中1和3号样品条带B2浓度比其它条带低。
根据2015版药典中关于刺五加TLC鉴定描述如下:“供试品色谱中,在与对照药材色谱相应的位置上,显相同颜色的荧光斑点;在与对照品色谱相应的位置上,显相同的蓝色荧光斑点”。该规定是定性的,显然按照此规定 TLC法并不能将短梗五加与刺五加区分开来。从TLC条带特征来看,短梗五加及刺五加异嗪皮啶条带在浓度(含量)上存在明显差异。因此,如利用紫外灯显色应增加异嗪皮啶定量TLC分析,以便能准确将二者鉴别开来。
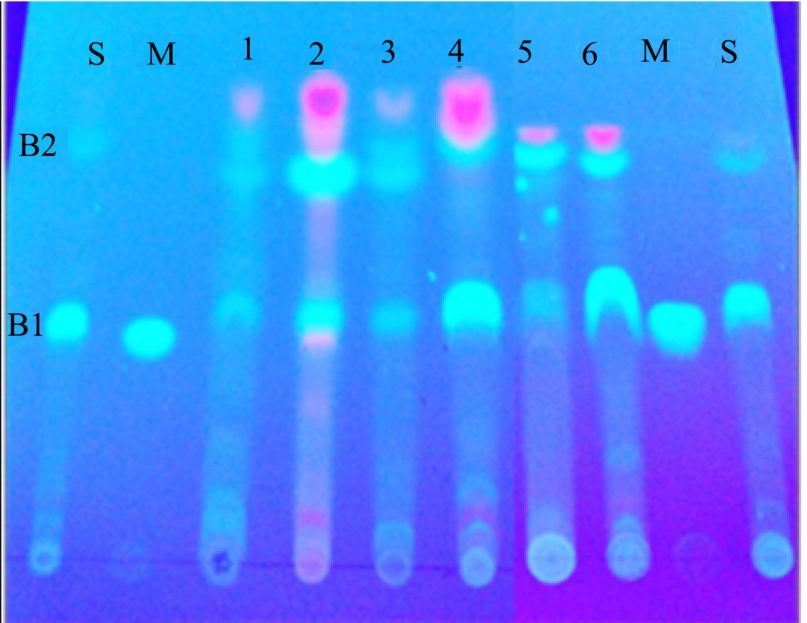
图1 刺五加及短梗五加样品薄层色谱(TLC)图谱
Fig.1 TLC pattern of ASR and AS
注:S为刺五加标准药;M为异嗪皮啶标准品;1、3和5号样品分别为吉林、黑龙江和辽宁短梗五加,2、4和6号样品分别为吉林、黑龙江和辽宁刺五加。
2.2.1 测试方法
以药典方法为基础,根据标准物质吸收峰扫描结果,对三种物质分别用不同波长进行检测,并进行了下列方法学验证试验。
(1)标准物质图谱
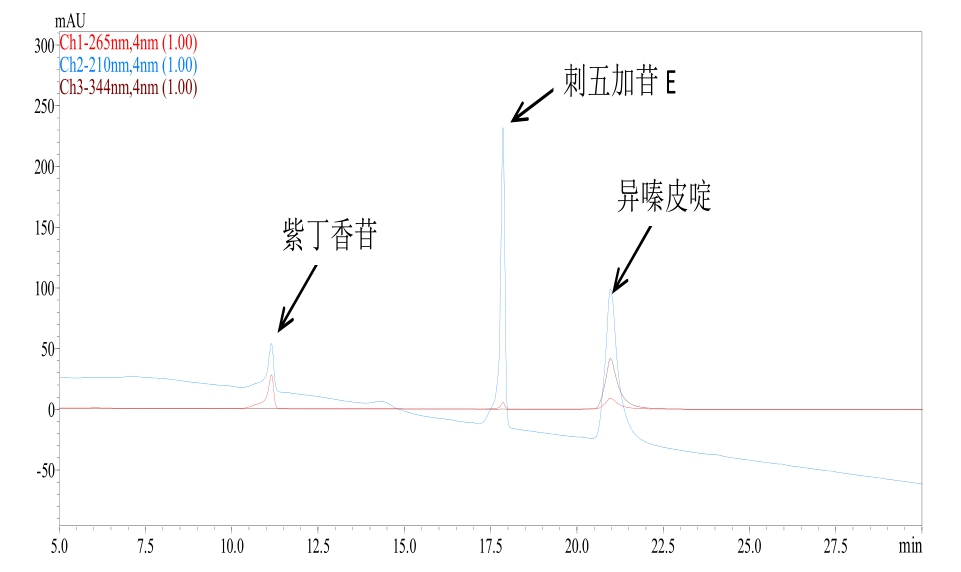
图2 刺五加苷E、紫丁香苷和异嗪皮啶混标HPLC图谱
Fig.2 HPLC chromatogram of the mixed standards of Eleutheroside E, Eleutheroside B, and Isofraxidin
将配置的刺五加苷 E、紫丁香苷和异嗪皮啶按4:4:1混合制成混合标准溶液。混合标准溶液的液相色谱见图 2。刺五加苷 E、紫丁香苷和异嗪皮啶出峰时间分别为17.800 min、11.120 min和21.000 min左右,可以很好的将三者分开。
(2)标准曲线
分别配置浓度为 10 μg/mL、20 μg/mL、30 μg/mL、40 μg/mL和50 μg/mL的刺五加苷E、紫丁香苷和异嗪皮啶溶液,测定其峰面积,绘制标准曲线。其结果见图3。三个标准曲线R2均大于0.99,说明有很好的线性关系。刺五加及短梗五加样品中上述三种物质的含量范围很宽,但基本在线性范围之内。
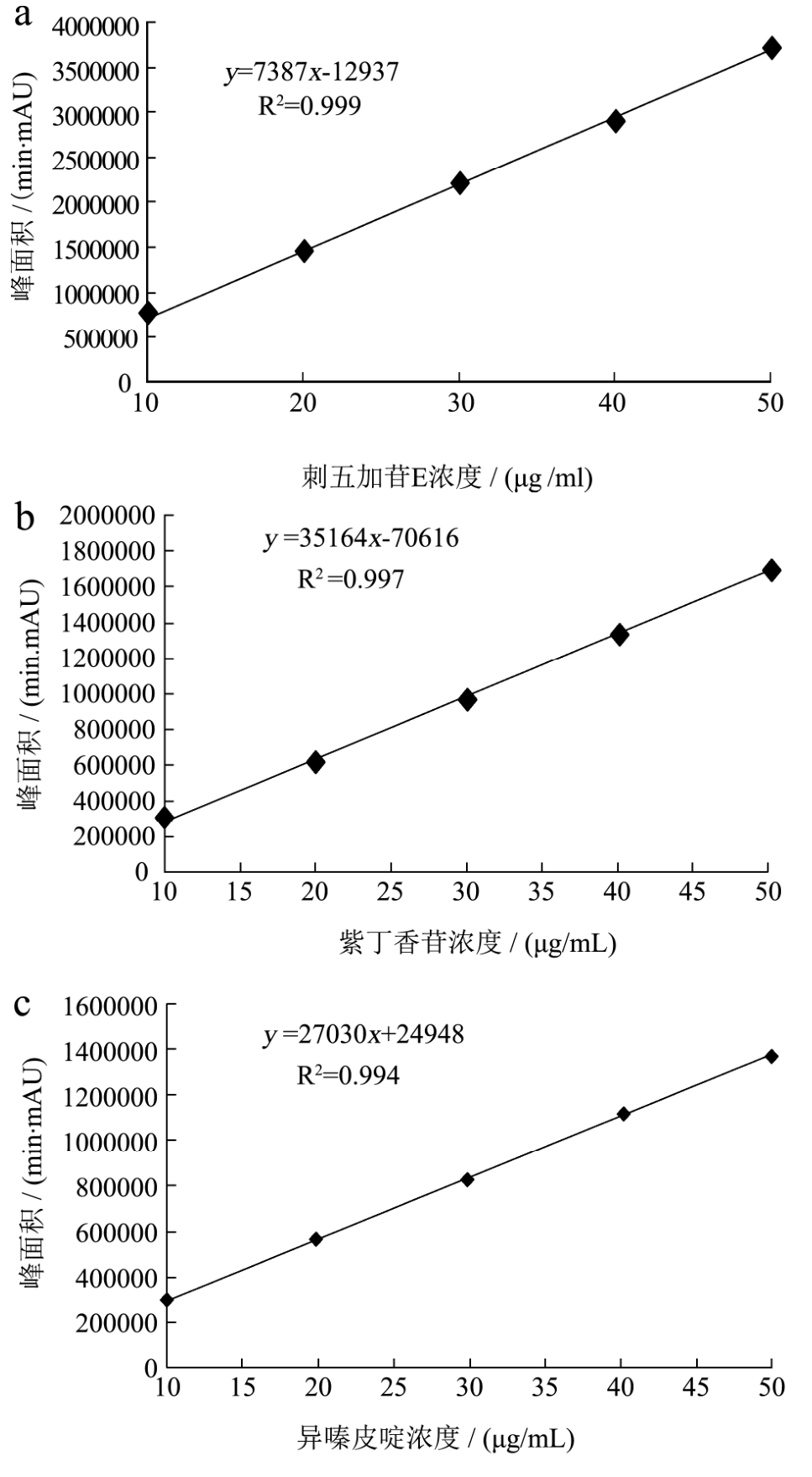
图3 刺五加苷E(a)、紫丁香苷(b)及异嗪皮啶(c)标准物质的线性关系
Fig.3 Standard curves of Eleutheroside E(a), Eleutheroside B(b),and Isofraxidin(c)
(3)刺五加标准药测定结果
刺五加标准药品图谱见图 4。刺五加苷 E、紫丁香苷和异嗪皮啶的检测波长分别是 210 nm、265 nm和344 nm。标准刺五加药品在这3个波长下均出现峰,但异嗪皮啶峰较小,这可能是因为其含量较低的原因。
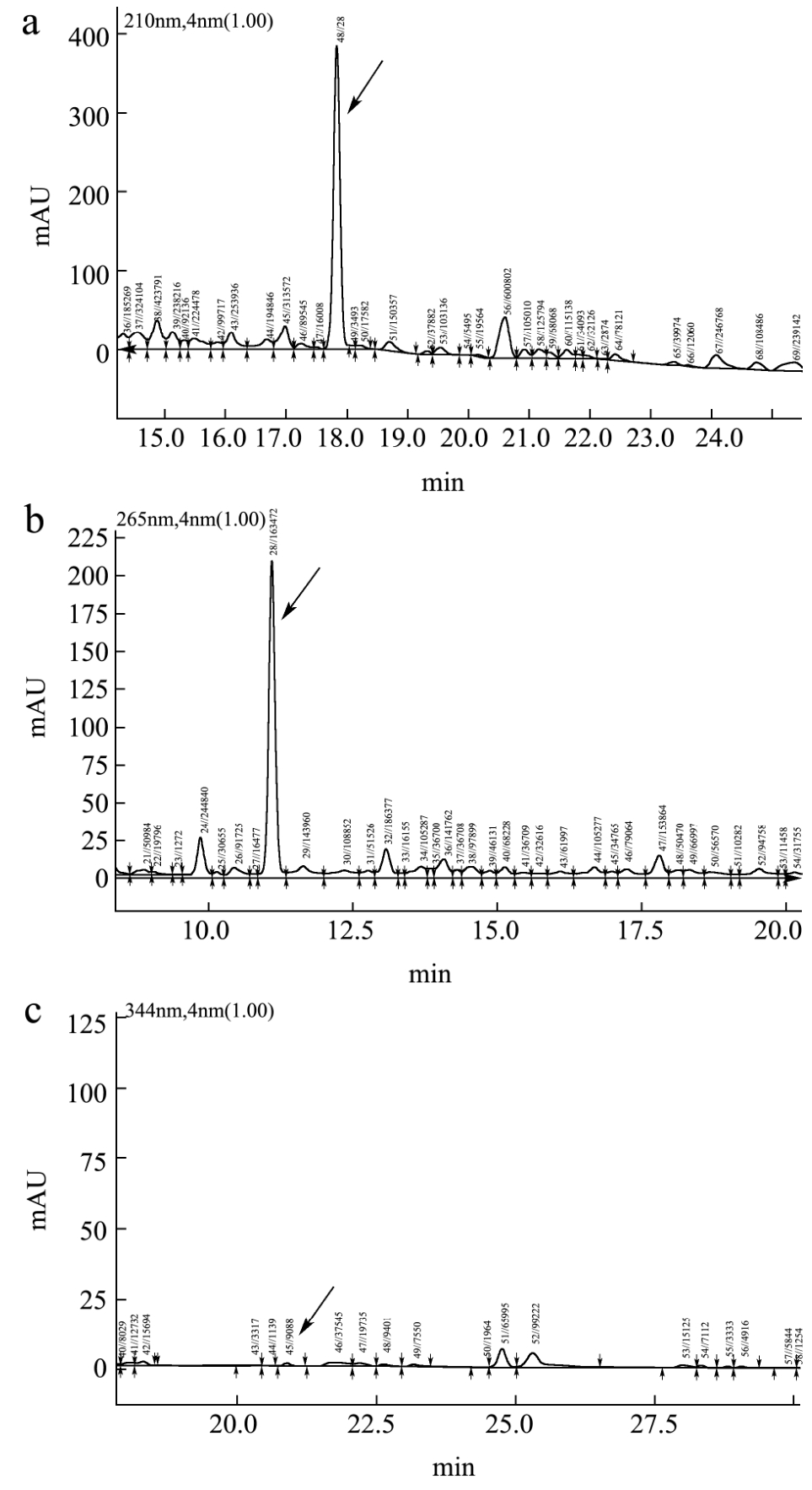
图4 刺五加标准药品HPLC图谱
Fig.4 HPLC spectra of the ASR standards
2.2.2 各基地样品中紫丁香苷、刺五加苷E及异嗪皮啶含量比较
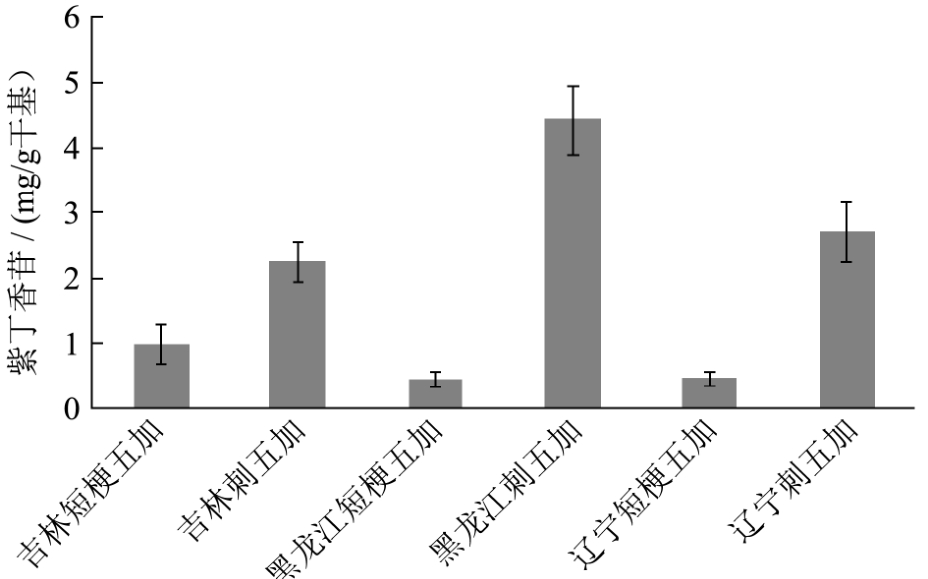
图5 各基地样品中紫丁香苷含量
Fig.5 Content of Eleutheroside B from various region samples

图6 各基地样品中刺五加苷E含量
Fig.6 Contents of Eleutheroside E from various region samples
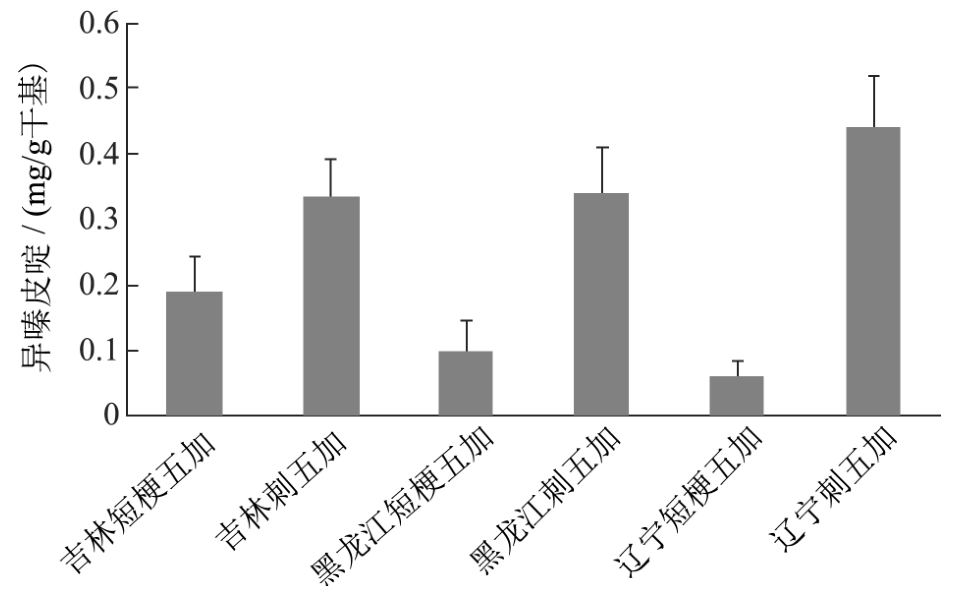
图7 各基地样品中异嗪皮啶含量
Fig.7 Content of Isofraxidin from various region samples
各基地中紫丁香苷、刺五加苷E及异嗪皮啶的含量图见图5、图6及图7。
从图6可以看到,刺五加样品中紫丁香苷平均含量均超过2 mg/g。辽宁、吉林及黑龙江短梗五加样品平均含量均低于1 mg/g。2015版药典规定,刺五加中紫丁香苷含量不应低于0.05%。刺五加样品含量均远超过该值。短梗五加中两个样品低于该值,但吉林短梗五加含量达到近0.1%,超过了该值。结合前面TLC鉴定情况,则该短梗五加样品无法与刺五加样品区分。因此,适当提高紫丁香苷含量标准可能有利于防止短梗五加的混入。但具体提高到什么水平还需进行更大规模样本的研究。
黑龙江及吉林刺五加样品中刺五加苷E含量均高于其它短梗五加样品,但辽宁刺五加样品中刺五加苷E含量低于吉林短梗五加。因此刺五加苷E含量在刺五加及短梗五加中可能存在交叉,不适合作为刺五加及短梗五加鉴定物质。
所有刺五加样品中异嗪皮啶含量均超过 0.3 mg/g,所有短梗五加样品含量均小于0.2 mg/g。因此异嗪皮啶是进行鉴别的良好指标。但该物质在短梗五加中依然少量存在,在TLC图谱中也能显示痕迹,因此,增加定量TLC方法对鉴别刺五加及短梗五加更为可靠。
3.1 通过对吉林、黑龙江及辽宁省刺五加及短梗五加样品中紫丁香苷、刺五加苷E及异嗪皮啶含量的检测及TLC图谱分析,得到以下结论:1)刺五加TLC鉴别图谱中异嗪皮啶特征条带浓度远大于短梗五加。短梗五加TLC图谱中存在异嗪皮啶条带,不利于做出明确鉴别结论。2)所测刺五加样品中紫丁香苷及异嗪皮啶平均含量均高于短梗五加样品,可作为鉴别刺五加及短梗五加的指标。3)短梗五加中紫丁香苷含量可能超过药典的要求。4)短梗五加样品中刺五加苷 E含量可能会高于刺五加,不适合作为鉴别刺五加及短梗五加的指标。
3.2 通过上述结论对当前药典TLC鉴别方法及对紫丁香苷含量要求的规定讨论如下:1)目前药典中刺五加TLC鉴别方法可能存在无法给出明确结论的可能,鉴于刺五加及短梗五加在异嗪皮啶条带浓度上的明显差异,可增加异嗪皮啶定量指标以保证鉴别结果的确定性。2)个别短梗五加中紫丁香苷含量达到 0.1%,超过了药典规定的0.05%,因此为防止短梗五加的混入,可在进一步深入研究基础上适当提高刺五加中紫丁香苷含量标准。
以上结论是基于三个省份6个林场刺五加及短梗五加样品得出的结论。为了进一步确认上述结论,有必要进行更大规模采样或从相关刺五加或短梗五加历史检测数据中进行分析和研究。
参考文献
[1]国家药典委员会.中华人民共和国药典,2015年版[M].北京:中国医药科技出版社,2015 China Pharmacopoeia Committee. China Pharmacopeia 2015 Edition [M]. Beijing: China Medical Science and Technology Press, 2015
[2]赵敏,王炎,康莉.刺五加果实及种子内源萌发抑制物质活性的研究[J].中国医药杂志,2001,26(8):534-537 ZHAO Min, WANG Yan, KANG Li. Study on activity of inner inhibitory substances of Acanthopanax senticosus(Rupr .et Maxim) harms fruits and seeds [J]. China Journal of Chinese Materia Medica, 2001, 26(8): 534-537
[3]孟庆艳,李莹,刘圆,等.共有峰率和变异峰率双指标序列法分析藏药材红毛五加与濒危药材刺五加的亲缘相似性[J].西南民族大学学报(自然科学版), 2008,34(2):290-293 MENG Qing-yan, LI Ying, LIU Yuan, et al. Common and variant peak ratio relative similarity between the Tibetan medicine cortex Acanthopanacis giraldii and cortexAcanthopanacis senticosus by dual-index sequence analysis[J]. Journal of Southwest University for Nationalities Natural Science Edition, 2008, 34(2): 290-293
[4]中国药材公司.中国中药资源志要[M].北京:科学出版社,1994 China Corporation of Medical Material. Annals of Chinese Medical Material [M]. Beijing: Science Press, 1994
[5]中华人民共和国卫生部.卫生部关于进一步规范保健食品原料管理的通知[html]. 2002-03-11. http://www.nhfpc.gov.cn/zwgk/wtwj/201304/e33435ce0d894051b15490aa3219 cdc4.shtml Ministry of Health of the People's Republic of China.MOH Notice on the Further Regulating on the management of materials of Health Food. [html]. 2002-03-11.http://www.nhfpc.gov.cn/zwgk/wtwj/201304/e33435ce0d894 051b15490aa3219cdc4.shtml
[6]李庆勇,祖元刚,付玉杰,等.高效液相色谱法测定刺五加超临界提取物中异嗪皮啶的含量[J].植物研究,2004,24(4):460-461 LI Qing-yong, ZU Yuan-gang, FU Yu-jie, et al.Determination of isofraxidin in the extract by supercritical CO2 from Acanthopanax senticosus by HPLC [J]. Bulletin of Botanical Research, 2004, 24(4): 460-461
[7]杨晓丹,井月娥,卢芳.刺五加的化学成分研究进展[J].中华中医药学,2015,33(2):316-318 YANG Xiao-dan, JING Yue-e, LU Fang. Research progress on chemical components of Acanthopanax senticosus [J].Chinese Archives of Traditional Chinese Medicine, 2015,33(2): 316-318
[8]高菲,王伟明,姚琳,等.复方刺五加颗粒的质量标准研究[J].中华中医药学刊,2012,20(11):2571-2573,2599 GAO Fei, WANG Wei-ming, YAO Lin, et al. Studies on quality standard of compound Acanthopanax senticosus granules [J]. Chinese Archives of Traditional Chinese Medicine, 2012, 20(11): 2571-2573, 2599
[9]中华人民共和国卫生部.有关新食品原料、普通食品名单汇总[html].2014-08-06. http://www.nhfpc.gov.cn/sps/spgg/201408/dc45891b39194f6d9091fc38096e1d42.shtml Ministry of Health of the People's Republic of China.Aggregated Name List of New Food Materiasl and Normal Foods [html]. 2014-08-06. http://www.nhfpc.gov.cn/sps/spgg/201408/dc45891b39194f6d9091fc38096e1d42.shtml
Comparison of Eleutheroside B , Eleutheroside E, and Isofraxidin between Acanthopanax sentcosus (Ruper.et Maxim.) Harms and Acanthopanax sessiliflorus
Abstract: Thin Layer Chromatography (TLC) was used to identify the differences of main active components between Acanthopanax sentcosus (Ruper.et Maxim.) Harms (ASR) and Acanthopanax sessiliflorus (AS), which were obtained from Jilin, Heilongjiang and Liaoning.The content of Eleutheroside B, Eleutheroside E and Isofraxidin were determined by High Performance Liquid Chromatography (HPLC). The results showed that the Isofraxidin characteristic band of ASR displayed on TLC chromatogram was obvious using a ultraviolet lamp (365 nm).While the Isofraxidin characteristic band of AS was not obvious, it still existed on TLC chromatogram. Consequently, the identification method could improve quantitative indicator that was to give a definite conclusion. The HPLC results showed that the content of three functional components in ASR samples were high, and the average content of Eleutheroside B and Isofraxidin of ASR samples were higher than that of AS samples. The content of Eleutheroside B of several AS samples was nearly 0.1%, which was higher than the level regulated by Chinese Pharmacopoeia (0.05%). The content standard of Eleutheroside B could be improved for further study to avoid the adulterant of ASR.
Key words:Acanthopanax sentcosus (Ruper.et Maxim.) Harms; Acanthopanax sessiliflorus; Eleutheroside B; Eleutheroside E;Isofraxidin; HPLC; TLC; identification
文章篇号:1673-9078(2017)10-302-307
DOI:10.13982/j.mfst.1673-9078.2017.10.042
收稿日期:2017-05-08
基金项目:西北农林科技大学横向课题(HPG/2016/08/1613)