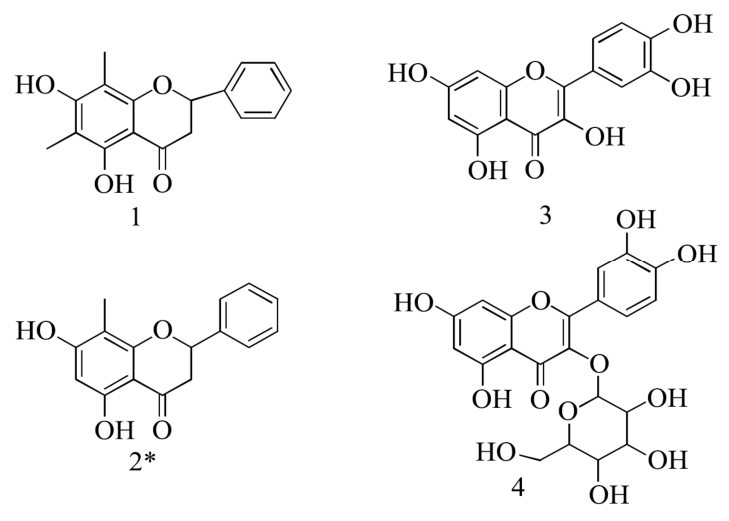
图1 化合物1~4的结构式
Fig.1 Structures of compounds 1~4
注:图中右上标*表示该化合物首次从番石榴叶中分离得到。
摘要:本文研究了番石榴叶乙酸乙酯萃取物的体外抗氧化活性及活性物质基础。采用95%乙醇溶液浸泡提取、正己烷和乙酸乙酯萃取后得到粗提物,首先分析了乙酸乙酯萃取物的体外抗氧化活性,然后通过硅胶柱色谱、Sephadex LH-20凝胶柱色谱、质谱和核磁共振等技术对乙酸乙酯萃取物的化学成分进行了分离和鉴定。结果表明,乙酸乙酯萃取物对 DPPH自由基、超氧阴离子、羟自由基具有较强的体外抗氧化活性,清除能力随着浓度的增大而增强,当浓度为1 mg/mL时,对DPPH自由基、超氧阴离子和羟自由基的清除率分别达94.15%、87.88%和67.3%,清除效果接近或强于同浓度的Vc。通过硅胶柱色普、Sephadex LH-20凝胶柱色谱等技术从番石榴叶乙酸乙酯萃取部位中分离纯化得到5个化合物,通过MS和NMR等波谱数据和结合文献,最终确定了4个化合物,分别为:去甲氧基荚果蕨(1)、胶藤素(2)、槲皮素(3)和异槲皮苷(4),其中化合物2为首次从番石榴属植物中分离得到的二氢黄酮类化合物。
关键词:番石榴;乙酸乙酯提取物;抗氧化活性;化学成分;二氢黄酮
番石榴叶,又名鸡矢茶、番桃叶、吗桂香拉、那拔叶和番石榴心,为桃金娘科番石榴属番石榴(Psidium guajava Linn)的干燥叶及带叶嫩茎,具有燥湿健脾、清热解毒的功效,是一种传统的植物药,原产于南美洲,现广泛分布于热带和亚热带地区,我国广东、广西、福建、海南和台湾等地均有分布[1]。中医认为:番石榴叶,性平、味甘涩,入脾、胃、大肠和肝经,具有生津止渴、收敛止泻、消炎止血、止痒和驱虫的功效。我国民间常用番石榴叶及其提取物来治疗肠胃炎、痢疾和糖尿病等疾病,鲜叶还可外用于跌打损伤、外伤出血和臁疮久不愈合等[2~4]。现代研究表明,番石榴叶具有明显的降血糖、降血脂、抗病毒、抗腹泻、抗菌、抗炎、抗肿瘤和抗伤害感受等活性[5~8],含有萜类、黄酮类、鞣质、多糖、酚类和挥发油类等化学成分[5~8]。
高血糖是糖尿病的一个显著病症指标,持续的高血糖可产生大量的活性氧(ROS),诱导脂质过氧化、破坏核酸、蛋白质和DNA等生物大分子而导致细胞衰老或死亡。因此,清除过量生成的ROS,将成为防治糖尿病发生发展的新靶点,这已成为当今一大研究热点。研究发现,中医药在抗氧化治疗糖尿病方面具有独特的优势。番石榴叶作为一种传统中药,具有较好的抗糖尿病作用[2~8],但其作用的物质基础研究较少。因此,为了阐述番石榴叶的抗糖尿病作用物质基础,需要先研究番石榴叶的体外抗氧化作用物质基础。故本文通过DPPH自由基、超氧阴离子和羟自由基这3个指标的测定结果与分析来探索番石榴叶的中等极性部位–乙酸乙酯萃取物的体外抗氧化活性,同时利用色谱分离手段,对乙酸乙酯萃取物中的化学成分进行分离纯化,进一步了解番石榴叶乙酸乙酯萃取物中化学成分与体外抗氧化活性的关系,为探索番石榴叶开发利用的新途径提供思路和参考。通过多种色谱分离手段,从番石榴叶乙酸乙酯萃取物中分离得到5个化合物,利用MS和NMR等波谱分析技术确定了4个化合物,分别为:去甲氧基荚果蕨素(1)、胶藤素(2)、槲皮素(3)和异槲皮苷(4),其中化合物2为首次从番石榴属植物中分离得到的二氢黄酮类化合物。
番石榴叶(Psidium guajava leaves):2015年4月采自广东省湛江市河唇镇,风干后粉碎备用。
无水乙醇、石油醚、乙酸乙酯、甲醇、氯仿、正己烷、丙酮、正丁醇、氢氧化钠、盐酸、冰醋酸、三氯乙酸、磷酸二氢钠、硫酸亚铁、双氧水、邻二氮菲、三氯化铁、邻苯三酚、TRIS(三羟甲基氨基甲烷)、DPPH(1,1-二苯基-2-三硝基苯肼)、抗坏血酸(分析纯):湛江康百医疗器械有限公司。
DHG-9145A电热鼓风干燥箱,上海一恒科学仪器有限公司;UV-3000紫外可见分光光度计,上海美谱达仪器有限公司;RE-52-99旋转蒸发仪,上海亚荣生化仪器厂;SHB-3循环水多用真空泵,郑州杜甫仪器厂;D2KW-C仪表恒温水浴锅,广州市德科生物科技有限公司;XT5显微熔点测定仪(温度计未校正),上海光学仪器厂;Bruker Avance 500 MHz型核磁共振波谱仪,Bruker公司;HR-ESI-MS maxis impact质谱仪,Bruker公司;薄层色谱硅胶GF254、柱层析硅胶(100~200,200~300目),青岛海洋化工有限公司;Sephadex LH-20:Pharmacia公司。
番石榴干叶9 kg,将其粉碎,用95%乙醇浸泡提取3次,每次7 d,合并提取液,减压浓缩得浸膏115 g,浓膏先用5倍水混悬,然后依次用正己烷、乙酸乙酯、正丁醇进行萃取,萃取液浓缩分别得正己烷部分40.0 g、乙酸乙酯部分25.0 g、正丁醇部分45.0 g。
1.5.1 DPPH自由基清除能力的测定[11]
分别取5个不同浓度乙酸乙酯萃取物乙醇溶液各2 mL和2 mL 1.0×10-4 mol/L的DPPH自由基溶液,充分混匀后避光反应30 min,于517 nm处测定吸光度Ai;以无水乙醇代替DPPH,测定吸光度Aj;空白组以无水乙醇代替乙酸乙酯萃取物,测定吸光度A0。同时以Vc做阳性对照,各组平行测定3次,取平均值计算清除率S:
S(%)=[1-(Ai-Aj)/A0]×100%
1.5.2 超氧阴离子自由基清除能力的测定[11]
取50 mmol/L pH 8.2 的Tris-HCl缓冲液2.25 mL于试管中,于25 ℃下预热20 min,分别加入终质量浓度为0.2、0.4、0.6、0.8和1.0 mg/mL的乙酸乙酯萃取物乙醇溶液,接着加入25 mmol/L的邻苯三酚0.2 mL混匀,25 ℃水浴中反应30 s后,立即滴加0.5 mL 10 mmol/L的盐酸终止反应,于320 nm下测定吸光度Ai,无水乙醇代替样品测定吸光度A0。以Vc做阳性对照,各组平行测定3次,取平均值计算清除超氧阴离子自由基的清除率Y:
Y(%)=[(A0-Ai)/A0]×100%
1.5.3 羟自由基清除能力的测定[12]
取0.75 mmol/L的邻二氮菲乙醇溶液1.5 mL置于试管中,加入3 mL 150 mmol/L pH 7.4磷酸盐缓冲液,混合均匀后依次加入0.75 mmol/L的FeSO4溶液1.0 mL,不同浓度的样品溶液3.0 mL,0.01%的双氧水1.0 mL,混合均匀,37 ℃保温1 h,于536 nm处测定吸光值A样品;无水乙醇代替样品,测定A损伤;双蒸水代替双氧水,无水乙醇代替样品,测定A未损伤。各组平行测定3次,取平均值计算羟自由基的清除率E:
E(%)=[(A 样品-A 损伤)/(A 未损伤-A 损伤)]×100%
实验数据采用SPSS 18专业版进行统计分析,各项指标采用平均值±标准偏差表示,t检验法比较差异,p<0.05为差异显著。

图1 化合物1~4的结构式
Fig.1 Structures of compounds 1~4
注:图中右上标*表示该化合物首次从番石榴叶中分离得到。
乙酸乙酯部分 25.0 g经硅胶柱层析,以正己烷:乙酸乙酯(10:1~0:1)梯度洗脱,TLC检测,合并相似馏分,得到6个馏分Fr.e 1~6。0.25 g馏分Fr.e 2上正相硅胶(200~300目)(氯仿:甲醇=1:3),再反复Sephadex LH-20(氯仿:甲醇=1:3),得化合物 1(6.0 mg)。0.52 g馏分Fr.e 3上正相硅胶(200~300目)(正己烷:乙酸乙酯=5:1~1:3),再Sephadex LH-20(氯仿:甲醇=1:1),得化合物2(5.4 mg)。1.01 g馏分Fr.e 4上正相硅胶(200~300目)(正己烷:丙酮=5:1~0:1),再经 Sephadex LH-20(氯仿:甲醇=1:1),得化合物 3(5.21 mg)。0.23 g馏分Fr.e 6反复Sephadex LH-20(氯仿:甲醇=1:3),再上正相硅胶(200~300目)(正己烷:丙酮=2:1~0:1),得化合物 4(6.01 mg)。
化合物质谱采用正离子模式,在 Bruker HR-ESI-MS maxis impact质谱联用仪上测定;化合物核磁共振谱用Bruker Avance 500 MHz共振波谱仪完成,以TMS为内标分别在CDCl3、C5D5N和CD3OD等氘代试剂中测定。
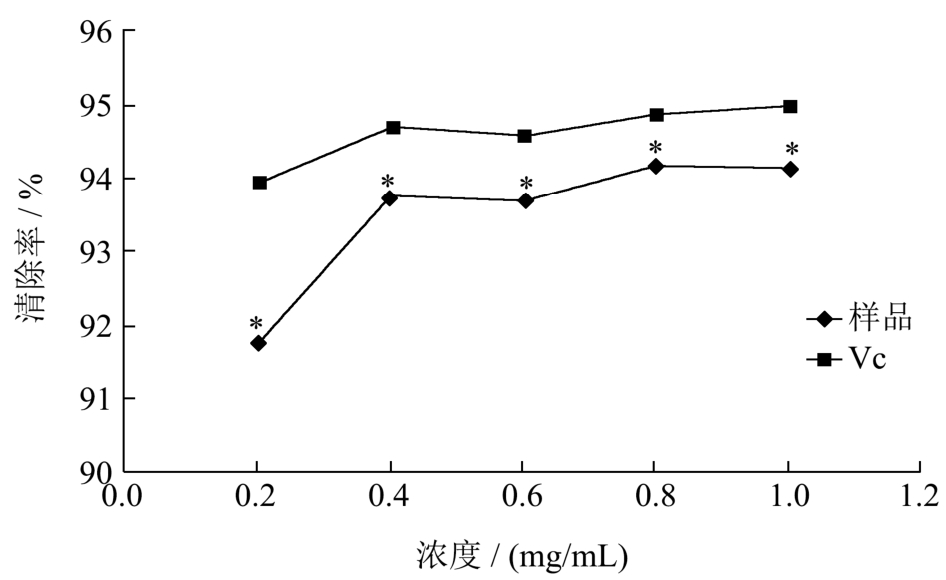
图2 番石榴叶乙酸乙酯萃取物对DPPH自由基的清除作用
Fig.2 The scavenging effect of the ethyl acetate extracts of
Psidium guajava leaves on the DPPH radical
注:n=3,*p<0.05。
由图2可知,番石榴叶乙酸乙酯萃取物表现出较强的DPPH自由基清除活性,在0.2~1.0 mg/mL的浓度下,番石榴叶乙酸乙酯萃取物对DPPH自由基的清除能力随着浓度的增加而增强,并呈现出一定的量效关系,清除率均超过90%,当浓度为1 mg/mL时,对DPPH自由基的清除率高达94.18%,由此推测番石榴叶乙酸乙酯萃取物中含有较多的可以提供氧原子的化合物,能够有效清除 DPPH自由基。但与同浓度的Vc相比,其对DPPH自由基的清除能力较弱,差异显著(p<0.05)。
由图3可知,番石榴叶乙酸乙酯萃取物对超氧阴离子具有较强的清除活性,在0.2~1.0 mg/mL的浓度下,番石榴叶乙酸乙酯萃取物清除超氧阴离子的能力随着浓度的增加而增强,并呈现出一定的浓度依赖关系,当浓度为1.0 mg/mL时,清除率为88.59%,由此推测番石榴叶乙酸乙酯萃取物含有较多可以提供电子和质子的化合物,能够抑制超氧阴离子的产生。与同浓度的Vc相比,其对超氧阴离子的清除能力更强,差异极显著(p<0.01)。

图3 番石榴叶乙酸乙酯萃取物对超氧阴离子自由基的清除作用
Fig.3 The scavenging effect of the ethyl acetate extracts of Psidium guajava leaves on the superoxide anion radical
注:n=3,**p<0.01。

图4 番石榴叶乙酸乙酯萃取物对羟基自由基的清除作用
Fig.4 The scavenging effect of the ethyl acetate extracts of Psidium guajava leaves on the hydroxyl radical
注:n=3,*p<0.05。
羟基自由基是一种活性强的自由基,具有极强的得电子能力,可介导许多病理变化。由图4可知,在测试浓度0.2~1.0 mg/mL下,番石榴叶乙酸乙酯萃取物和对照品Vc对羟基自由基均表现出一定程度的清除活性,且随着浓度的增加,清除能力均随着增强;但在0.2~0.66 mg/mL下,番石榴叶乙酸乙酯萃取物对羟基自由基的清除能力强于同浓度下的Vc,在0.2、0.4和0.6 mg/mL的浓度下,差异显著(p<0.05);当浓度为0.66 mg/mL,二者的清除效果相当;当浓度超过0.66 mg/mL时,番石榴叶乙酸乙酯萃取物对羟基自由基的清除效果弱于Vc,当浓度为0.8 mg/mL,番石榴叶乙酸乙酯萃取物对羟基自由基的清除率已超过50%。可见,番石榴叶乙酸乙酯萃取物中含有能提供电子的化合物,可以提供电子给羟基自由基被氧化而表现出抗氧化作用。
由图2、图3和图4可知,番石榴叶乙酸乙酯萃取物具有清除DPPH自由基、超氧阴离子和羟基自由基等自由基的活性,由此推测出番石榴叶乙酸乙酯萃取物中含有提供电子或氧原子的化合物,为了进一步从化学角度探索番石榴叶乙酸乙酯萃取物的抗氧化活性,本研究还通过硅胶柱层析、凝胶柱层析等现代色谱技术,联合MS和NMR等现代波谱技术,从番石榴叶乙酸乙酯萃取物中分离鉴定了 4个黄酮类化合物,化合物结构鉴定如下:

图5 化合物1的HR-ESI-MS质谱图
Fig.5 HR-ESI-MS mass spectrum of compound 1
化合物 1:淡黄色针晶,mp 201~202 ℃,HR-ESI-MS m/z(图 5):285.1085 [M+H]+, 149.0119;1H-NMR (500 MHz, CDCl3) δ:12.31(1H, s, 5-OH), 7.50(2H, d, J = 7.5 Hz, H-2', 6'), 7.46 (3H, t, J = 7.5 Hz, H-3',4', 5'), 5.40 (1H, dd, J = 13.0, 3.3 Hz, H-2), 3.05 (1H, dd,J = 17.5, 13.0 Hz, H-3a), 2.85 (1H, dd, J = 17.5, 3.3 Hz,H-3b), 2.07 (6H, s, 6-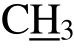 , 8-
, 8- ); 13C-NMR (125 MHz,CDCl3) δ:196.4 (C-4), 160 (C-7), 159.3 (C-5), 157.6(C-9), 139.0 (C-1'), 128.9 (C-5'), 128.8 (C-3'), 128.5(C-4'), 126.0 (C-6'), 125.9 (C-2'), 103.2 (C-6), 102.8(C-8), 102.0 (C-10), 78.2 (C-2), 43.5 (C-3), 7.6 (
); 13C-NMR (125 MHz,CDCl3) δ:196.4 (C-4), 160 (C-7), 159.3 (C-5), 157.6(C-9), 139.0 (C-1'), 128.9 (C-5'), 128.8 (C-3'), 128.5(C-4'), 126.0 (C-6'), 125.9 (C-2'), 103.2 (C-6), 102.8(C-8), 102.0 (C-10), 78.2 (C-2), 43.5 (C-3), 7.6 (  ),6.9 (8-
),6.9 (8-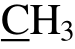 )。通过查阅文献,发现其与报道的 5,7-二羟基-6,8-二甲基二氢黄酮(即去甲氧基荚果蕨素)波谱数据一致[13,14],因此确定化合物1为去甲氧基荚果蕨素。
)。通过查阅文献,发现其与报道的 5,7-二羟基-6,8-二甲基二氢黄酮(即去甲氧基荚果蕨素)波谱数据一致[13,14],因此确定化合物1为去甲氧基荚果蕨素。
化合物2:黄色针晶,mp 202~203 ℃;1H-NMR(500 MHz, C5D5N) δ:12.30 (1H, s, 5- ), 7.62 (2H, d, J= 7.5 Hz, H-2', 6'), 7.41 (2H, t, J = 7.5 Hz, H-3', 5'), 7.35(1H, t, J = 7.5 Hz, H-4'), 6.47 (1H, s, H-6), 5.53 (1H, dd,J = 13.0, 3.3 Hz, H-2), 3.15 (1H, dd, J = 17.5, 13.0 Hz,H-3a), 2.95 (1H, dd, J = 17.5, 3.3 Hz, H-3b), 2.28 (3H, s,8-
), 7.62 (2H, d, J= 7.5 Hz, H-2', 6'), 7.41 (2H, t, J = 7.5 Hz, H-3', 5'), 7.35(1H, t, J = 7.5 Hz, H-4'), 6.47 (1H, s, H-6), 5.53 (1H, dd,J = 13.0, 3.3 Hz, H-2), 3.15 (1H, dd, J = 17.5, 13.0 Hz,H-3a), 2.95 (1H, dd, J = 17.5, 3.3 Hz, H-3b), 2.28 (3H, s,8- ); 13C-NMR (125 MHz, C5D5N) δ:196.6 (C-4),166.8 (C-7), 163.1 (C-5), 160.8 (C-9), 139.5 (C-1'), 129.4(C-3', 5'), 129.1 (C-4'), 126.9 (C-2', 6'), 104.6 (C-8),103.1 (C-10), 96.7 (C-6), 79.3 (C-2), 43.6 (C-3), 8.5(8-
); 13C-NMR (125 MHz, C5D5N) δ:196.6 (C-4),166.8 (C-7), 163.1 (C-5), 160.8 (C-9), 139.5 (C-1'), 129.4(C-3', 5'), 129.1 (C-4'), 126.9 (C-2', 6'), 104.6 (C-8),103.1 (C-10), 96.7 (C-6), 79.3 (C-2), 43.6 (C-3), 8.5(8- )。通过查阅文献,发现其与文献报道的cryptostrobin(胶藤素)一致[15~17],且与胶藤素对照品共薄层,Rf值相同,因此确定化合物2为胶藤素。
)。通过查阅文献,发现其与文献报道的cryptostrobin(胶藤素)一致[15~17],且与胶藤素对照品共薄层,Rf值相同,因此确定化合物2为胶藤素。
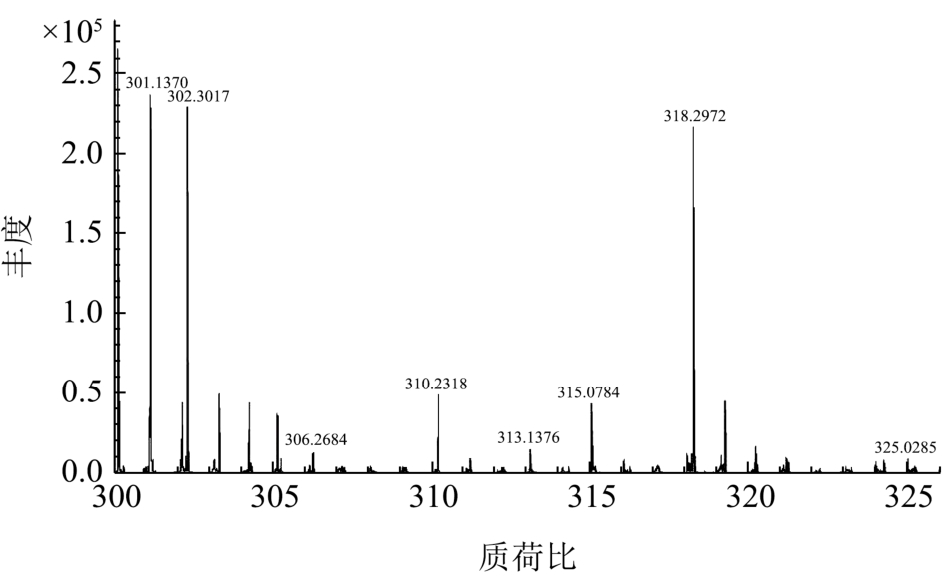
图6 化合物3的HR-ESI-MS质谱图
Fig.6 HR-ESI-MS mass spectrum of compound 3
化合物3:黄色粉末,mp 315 ℃,HR-ESI-MS m/z(图 6):325.0285 [M+Na]+, 318.2972, 310.2318,302.3017, 301.1370;盐酸-镁粉反应呈阳性,显示该化合物为黄酮类化合物;1H-NMR (500 MHz, CD3OD) δ:7.72 (1H, d, J = 2.0 Hz, H-2'), 7.66 (1H, dd, J = 8.4, 2.0 Hz, H-6'), 6.90 (1H, d, J = 8.4 Hz, H-5'), 6.40 (1H, d, J =2.0 Hz, H-8), 6.20 (1H, d, J = 2.0 Hz, H-6); 13C-NMR(125 MHz, CD3OD) δ:177.6 (C-4), 163.5 (C-7), 158.3(C-5), 157.0 (C-9), 148.2 (C-4'), 147.3 (C-2), 145.3 (C-3'),136.0 (C-3), 122.4 (C-1'), 120.6 (C-6'), 116.1 (C-5'),115.5 (C-2'), 103.4 (C-10), 98.6 (C-6), 93.4 (C-8)。通过查阅文献,发现其与文献报道的槲皮素一致[18,19],因此最终确定化合物3为槲皮素。
化合物4:黄色粉末,盐酸-镁粉反应呈阳性,提示该化合物为黄酮类化合物;HR-ESI-MS m/z(图7):951.1869[2M+Na]+, 487.0867[M+Na]+, 437.1934,274.2701;1H-NMR (500 MHz, CD3OD) δ:7.79 (1H, d,J = 2.4 Hz, H-2'), 7.61 (1H, dd, J = 2.4, 8.6 Hz, H-6'),6.90 (1H, d, J = 8.6 Hz, H-5'), 6.42 (1H, d, J = 2.0 Hz,H-8), 6.24 (1H, d, J = 2.0 Hz, H-6), 5.19 (1H, d, J = 7.6 Hz, H-1''), 3.86 (1H, dd, J = 12.0, 2.4 Hz, H-6''a), 3.81(1H, dd, J = 12.0, 5.2 Hz, H-6''b), 3.44-3.67 (4H, m, H-2'',3'', 4'', 5'') ; 13C-NMR (125 MHz, CD3OD) δ:178.2 (C-4),164.73 (C-7), 161.7 (C-5), 157.5 (C-9), 157.1 (C-2),148.6 (C-4'), 144.4 (C-3'), 134.4 (C-3), 123.7(C-6'), 123.6(C-1'), 116.4 (C-5'), 114.7 (C-2'), 104.2 (C-10), 103.9(C-1''), 98.5(C-6), 93.3 (C-8), 75.8 (C-3''),73.7 (C-2''),71.8 (C-4''), 68.6 (C-5''), 60.5 (C-6'')。通过查阅文献,发现其与文献报道的异槲皮苷数据一致[20~22],因此确定化合物4为异槲皮苷。
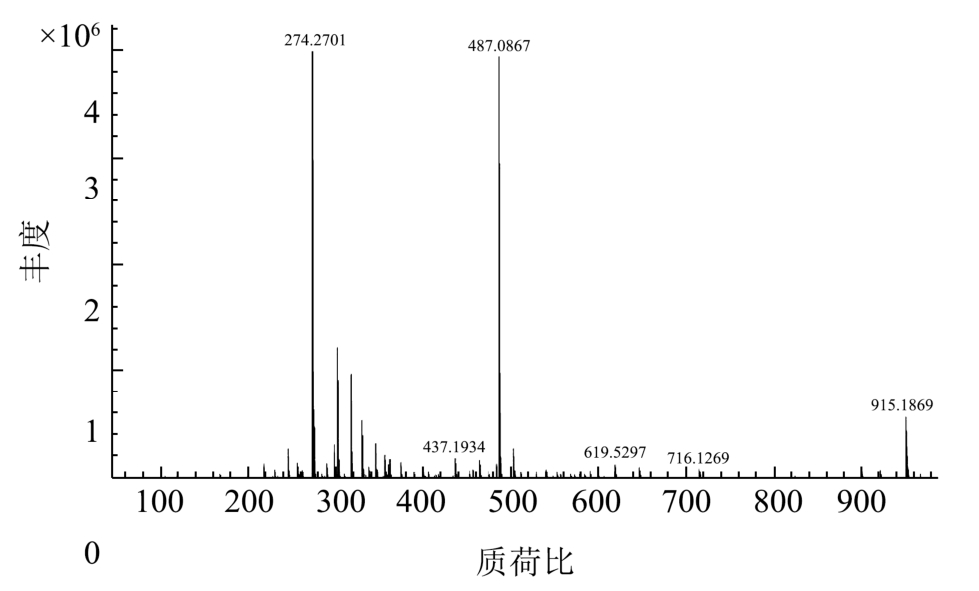
图7 化合物4的HR-ESI-MS质谱图
Fig.7 HR-ESI-MS mass spectrum of compound 4
3.1 本研究采用乙醇提取,正己烷、乙酸乙酯、正丁醇萃取得到萃取物,番石榴叶乙酸乙酯萃取物的抗氧化活性试验表明:番石榴叶乙酸乙酯萃取物和Vc对DPPH自由基都具有较强的清除能力,相同浓度下,二者的清除能力接近,清除率均为90%以上,但番石榴叶乙酸乙酯萃取物对 DPPH自由基的清除能力比Vc稍弱;在测试浓度0.2~1.0 mg/mL下,番石榴叶乙酸乙酯萃取物对超氧阴离子的清除能力比Vc效果更好,在1 mg/mL时,清除率可达87.88%;在0.2~0.66 mg/mL浓度下,番石榴叶乙酸乙酯萃取物对羟基自由基的清除能力比Vc效果更好,在0.66 mg/mL时,二者清除能力相当,当浓度超过0.66 mg/mL时,Vc对羟基自由基的清除能力反而比番石榴叶乙酸乙酯萃取物效果好。可见,番石榴叶乙酸乙酯萃取物具有较好的抗氧化活性,是一种潜在的天然抗氧化剂,可为新型天然抗氧化剂的开发提供一定的理论参考。
3.2 为进一步探索番石榴叶乙酸乙酯萃取物抗氧化活性的物质基础,本研究还通过硅胶柱层析、凝胶柱层析等方法,从番石榴叶乙酸乙酯萃取物中分离到 5个化合物,确证了其中4个化合物,另外1个化合物初步认定为萜类二倍体,有待于进一步确证。已确证的4个化合物均为黄酮类化合物,其中化合物2为首次从番石榴属植物中分离得到的二氢黄酮类化合物。
参考文献
[1]郭刚军,何美莹,邹建云,等.番石榴叶的化学成分与药理作用研究动态[J].热带农业科技,2009,32(4):12-15 GUO Gang-jun, HE Mei-ying, ZOU Jian-yun, et al. A review of chemical composition and pharmacology in Psidium guajava leaf [J]. Tropical Agricultural Science & Technology,2009, 32(4): 12-15
[2]符春丽,彭燕,陈紫云,等.番石榴叶化学成分的研究[J].中药材,2016,39(12):2783-2786 FU Chun-li, PENG Yan, CHEN Zi-yun, et al. Chemical constituents from Psidium guajava leaves [J]. Journal of Chinese Medicinal Materials, 2016, 39(12): 2783-2786
[3]El-Ahmady S H, Ashour M L, Wink M. Chemical composition and anti-inflammatory activity of the essential oils of Psidium guajava fruits and leaves [J]. The Journal of Essential Oil Research, 2013, 25(6): 1-7
[4]Deguchi Y, Osada K, Uchida K, et al. Effects of extract of guava leaves on the development of diabetes in the db/db mouse and on the postprandial blood glucose of humansub-ject [J]. Nippon Nogeikagaku Kaishi, 1998, 72(8):923-931
[5]汪梅花,魏文浩,吴振强.番石榴叶的生物活性研究进展[J].中药材,2015,38(10):2215-2219 WANG Mei-hua, WEI Wen-hao, WU Zhen-qiang. Advance in bioactivities of Psidium guajava leaves [J]. Journal of Chinese Medicine Materials, 2015, 38(10): 2215-2219
[6]张玉英,陈艳芬,杨超燕,等.番石榴叶调节小鼠血糖血脂作用的研究[J].中国民族民间医药,2014,23(1):14-16 ZHANG Yu-ying, CHEN Yan-fen, YANG Chao-yan, et al.Study on effects of Psidium guajava leaves on blood sugar and blood lipid in mice [J]. Chinese Journal of Ethnomedicine and Ethnopharmacy, 2014, 23(1): 14-16
[7]吴艳,曲玮,梁敬钰.番石榴叶的研究进展[J].海峡药学,2013,25(12):14-19 WU Yan, QU Wei, LIANG Jing-yu. Advances in research of Psidium guajava leaves [J]. Strait Pharmaceutical Journal,2013, 25(12): 14-19
[8]邵萌,范春林,王英,等.番石榴叶的化学成分及药理活性研究进展[J].天然产物研究与开发,2009,21(3):525-528,534 SHAO Meng, FAN Chun-lin, WANG Ying, et al. Advances on chemical constituents and pharmacological effects of Psidium guajava [J]. Natural Product Research and Development, 2009, 21(3): 525-528, 534
[9]Giugliano D, Periello A, Paolisso G. Oxidative stress and diabetic vascular complication [J]. Diabetes Care, 1996, 19:257-267
[10]Baynes R W. Role of oxidative stress in development of complications in diabetes [J]. Diabetes, 1991, 40(4): 405-412
[11]彭燕,蔡文凝,肖生鸿,等.香根草油的化学成分及抗氧化、抑菌活性研究[J].食品工业,2017,38(1):167-170 PENG Yan, CAI Wen-ning, XIAO Sheng-hong, et al. Study on chemical composition, antioxidant and antibacterial activities of Vetiveria zizanioides oil [J]. The Food Industry,2017, 38(1): 167-170
[12]金鸣,蔡亚欣,李金荣.邻二氮菲-Fe2+氧化法检测 H2O2/Fe2+产生的羟自由基[J].生物化学与生物物理进展,1996,23(6):553-555 JIN Ming, CAI Ya-xin, LI Jin-rong, et al. 10-phenanthroline-Fe2+ oxidative assay of hydroxyl radical produced by H2O2/Fe2+ [J]. Progress in Biochemistry and Biophysics,1996, 23(6): 553-555
[13]Purusotam B, Shigetoshi K, Mineo S, et al.2-Hydroxymatteucinol, a new C-methyl flavanone derivative from Matteuccia orientalis; potent hypoglycemic activity in streptozotocin (STZ) -induced diabetic rat [J]. Chemical &Pharmaceutical Bulletin, 1993, 41(10): 1790
[14]蒋建勤,周荣汉,王磊,等.中华荚果蕨化学成分研究[J].中国药科大学学报,1994,25(5):265-266 JIANG Jian-qin, ZHOU Rong-han, WANG Lei, et al. Studies on the chemical constituents of Matteuccia intermedia C. Chr.[J]. Journal of China Pharmaceutical University, 1994, 25(5):265-266
[15]Matsuura S. The structure of cryptostrobin and strobopinin,the flavanones from the heartwood of Pinus strobes [J].Pharmaceutical Bulletin, 1957, 5(3): 195-198[16]Byrne L T, Cannon J R, Gawad D H, et al. The crystal structure of (S)-(-)-6-bromo-5,7-dihydroxy-8-methyl-2-phenyl-2,3-dihydro-4H-1-benzopyran-4-one[(-)-6-bromocryp tostrobin]and a 13C N.M.R study of (±)- cryptostrobin and related substances. Revision of the structures of the natural products (±)-lawinal, unonal, 7-O-methylunonal and isounonal [J]. Australian Journal of Chemistry, 1982, 35(9):1851-1858
[17]Massaro C F, Katouli M, Grkovic T, et al.Anti-staphylococcal activity of C-methyl flavanones from propolis of Australian stingless bees (Tetragonula carbonaria)and fruit resins of Corymbia torelliana (Myrtaceae) [J].Fitoterapia, 2014, 95(2): 247-257
[18]Kim S M, Kang K, Jho E H, et al. Hepatoprotective effect of flavonoid glycosides from Lespedeza cuneata against oxidative stress induced by tert-butyl hyperoxide [J].Phytotherapy Research, 2011, 25(7): 1011-107
[19]翟广玉,朱玮,渠文涛,等.槲皮素的光谱分析[J].光谱实验室,2012,29(4):2443-2449 ZHAI Guang-yu, ZHU Wei, QU Wen-tao, et al. Spectrum analysis of quercetin [J]. Chinese Journal of Spectroscopy Laboratory, 2012, 29(4): 1011-107
[20]王玲玲,刘斌,石任兵,等.荷叶黄酮类化学成分研究[J].北京中医药大学学报,2008,31(2):116-118 WANG Ling-ling, LIU Bin, SHI Ren-bing, et al. Flavonoid chemical compositions of Folium nelumbinis [J]. Journal of Beijing University of Traditional Chinese Medicine, 2008,31(2): 116-118
[21]张忠立,左月明,徐璐,等.三白草黄酮类化学成分的研究[J].中草药,2011,42(8):1490-1493 ZHANG Zhong-li, ZUO Yue-ming, XU Lu, et al. Studies on chemical components of flavonoids in aerial part of Saururus chinensis [J]. Chinese Traditional and Herbal Drugs, 2011,42(8): 1490-1493
[22]姚士.乌饭树叶的化学成分研究[D].苏州:苏州大学,2013 YAO Shi. Studies on the chemical constituents from leaves of Vaccinium bracteatum Thunb [D]. Suzhou: Soochow University, 2013
Isolation and Identification of Chemical Constituents and In Vitro Antioxidant Activity of Ethyl Acetate Extracts from Psidium guajava Linn Leaves
Abstract: The invitro antioxidant activity and the material basis for its antioxidant activity of the ethyl acetate extracts from Psidium guajava leaves were investigated in this study. The antioxidant ability of ethyl acetate extracts was first analyzed in vitro after 95% ethanol percolating, n-hexane and ethyl acetate extraction from Psidium guajava leaves, and then the chemical compounds were isolated and identified by combing column chromatography (such as silica gel column chromatography, Sephadex LH-20) and spectrometry (such as mass spectrometry, nuclear magnetic resonance spectroscopy). The results showed that the ethyl acetate extracts had strong antioxidant activity in vitro to scavenge DPPH radicals, superoxide anion free radicals, and hydroxyl radicals in a dose-dependent manner, and when the concentration was 1 mg/mL, the scavenging abilities for 1,1-diphenyl-2-picrylhydrazyl (DPPH) radicals, superoxide radicals and hydroxyl radical were 94.15%, 87.88%, 67.3%, respectively, which were close to or better than those of Vc. Five compounds were isolated and purified from the ethyl acetate extracts of Psidium guajava leaves by silica gel column chromatography and Sephadex LH-20 column chromatography, four of which were identified as demethoxymatteucinol (1), cryptostrobin (2), quercetin (3), and isoquercitri (4), respectively, by comparison of their mass spectrometry (MS) and nuclear magnetic resonance (NMR) spectroscopic data with those in literatures. Furthermore, compound 2 was the first flavanone isolated from the genus Psidium Linn.
Key words:Psidium guajava; ethyl acetate extract; antioxidant activity; chemical constituents; flavanone
文章篇号:1673-9078(2017)10-52-57
DOI:10.13982/j.mfst.1673-9078.2017.10.008
收稿日期:2017-04-07
基金项目:广东省大学生创新创业训练计划项目(201510579215);广东省自然科学基金项目(2014A030307036);湛江市科技计划项目(2016A03025、2013A01024);湛江师范学院人才引进项目(2L1312)