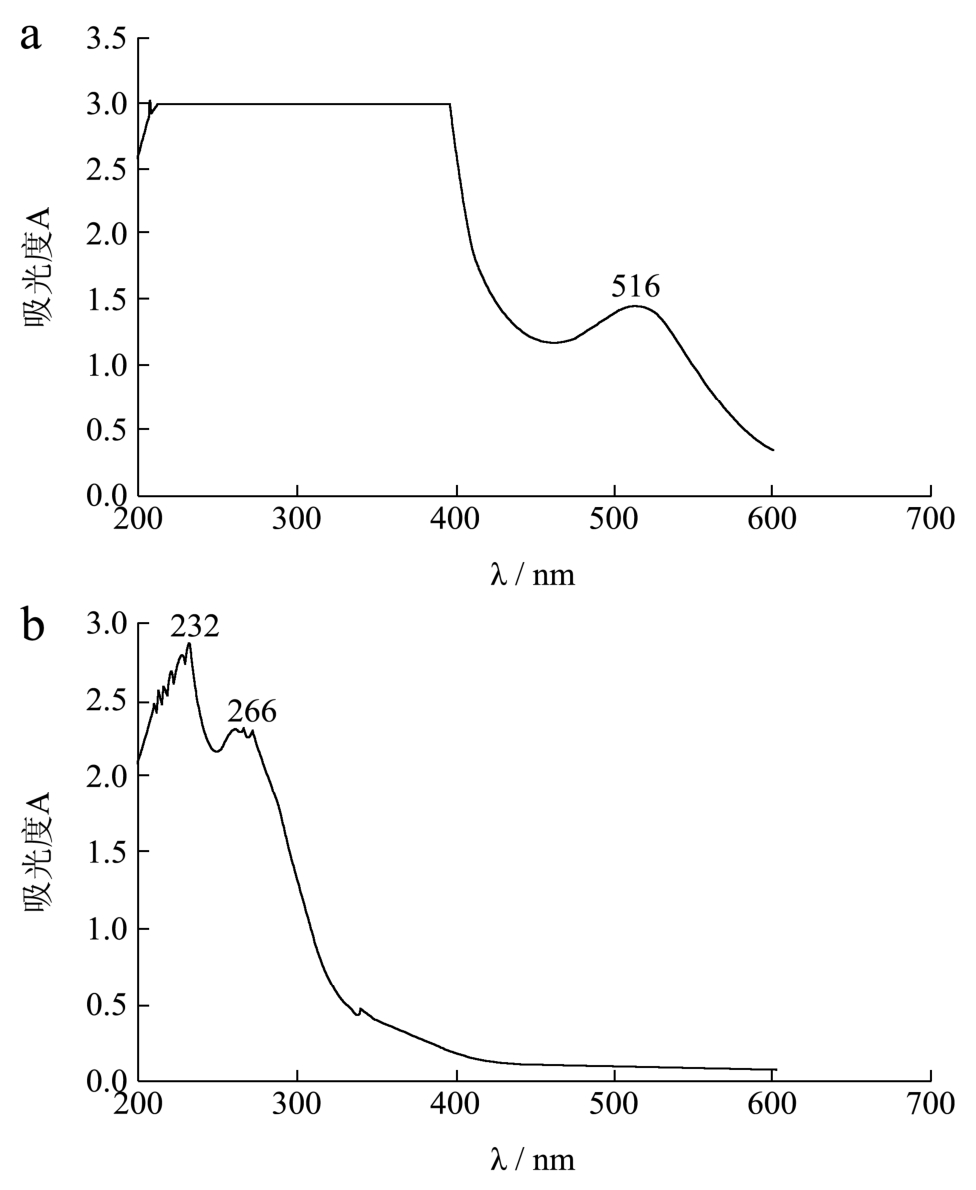
图1 石榴糖苷前体物的特征吸收光谱
Fig.1 Characteristic absorption spectra of the pomegranate glycosidic precursor
注:a,糖苷粗提物原液;b,25倍稀释液。
摘要:本文运用紫外可见光谱初步确定石榴汁糖苷键合态香气前体物质的特征吸收峰;利用高效液相色谱法和气相色谱-质谱联用法测定石榴汁酶解前后的糖基部分和配体部分,通过石榴汁酶解前后理化指标的测定来分析石榴汁中糖苷键合态香气前体物质。研究表明:紫外可见光谱分析得到糖苷键合态香气前体物质的特征吸收峰;理化指标测定中发现石榴汁酶解液TSS和还原糖含量增加较明显;HPLC检测到石榴汁中糖苷键合态香气前体物质的糖基主要以葡萄糖和果糖为主;GC-MS分析在酶解后的石榴汁中共检测出36种挥发性芳香化合物,其中石榴汁键合态物质有芳香醇类、萜烯类和醛类等,主要以正己醇、叶醇、四氢芳樟醇和苯乙醇等芳香醇类物质为主。本实验结果为进一步阐明石榴汁中糖苷键合态香气前体物质的结构提供依据。
关键词:石榴汁;键合态芳香物质;酶解
糖苷键合态香气前体物质(glycosidically bound aroma precursors)是以糖苷的形式存在于植物中的香气前体物质,不具有挥发性,稳定性强;在酸或酶的作用下可以释放出游离态芳香物质[1]。
国外学者对不同水果中的糖苷键合态香气前体物 质进行了大量的研究,陆续对葡萄、石榴和黑莓等水果中的糖苷类键合态香气前体物质进行了结构鉴定[2~4]。其所含的糖苷键合态香气前体物质的配基主要有萜烯类物质、C13-降异戊二烯类物质、苯的衍生物、羟基酯类以及一些C6醇类物质。其所含的糖苷键合态香气前体物质的糖基部分一般是β-D-葡萄糖苷或者是双糖苷,如果只有β-D-葡萄糖,则形成的是单糖苷;如果葡萄糖上结合一个或多个其他糖基,则形成的是二糖苷或多糖苷。通过对糖苷类香气前体物质的分离和结构鉴定,陆续确定了多种芳香物质的呈香成分及其与糖苷类香气前体的关系,从而对香气的形成和转化途径有了全面和深入的了解。
国内对水果中糖苷键合态香气前体物质的研究工作起步较晚,报道文献也不多:任婧楠和董曼[5]对树莓汁中的键合态香气物质和糖基部分进行了分析鉴定;王林等人[6]研究了不同酶制剂对烤烟上部叶化学成分、游离态和糖苷结合态中性香气成分的影响。
糖苷的种类繁多,难以获得完整的标准品,因而给糖苷类香味前体物质的分析造成了一定的困难。文献[7,8]报道了较多的分析糖苷类香气前体物质的方法,主要有以下三种:(1)先衍生化处理再使用气相色谱-质谱联用的方法进行分析;(2)先将糖苷粗提物酶(水)解,然后用气相色谱法或气相色谱-质谱联用法分析糖苷酶(水)解后的苷元,对糖苷键合态香气物质进行定性定量分析;(3)分离纯化,结合核磁分析和超高效液相色谱-电喷雾串联四级杆质谱进行定性定量分析。
本文通过紫外-可见光谱信息对石榴汁中的糖苷键合态香气前体物质进行初步定性分析,并通过HPLC和GC-MS比较石榴汁酶解前后的单糖和挥发性风味物质的变化,结合理化指标的测定,从而确认糖苷类风味前体物质的存在,为进一步研究糖苷类香气前体物质的结构奠定了基础。
1.1 原料
石榴:品种为大籽甜石榴(Dazi Tian),购自新疆喀什某农贸市场。石榴果实采摘后贮藏在-18 ℃的冰柜中待用。
1.2 试剂与仪器
C6-C20正构烷烃(色谱纯)、海藻糖、鼠李糖、阿拉伯糖、半乳糖、葡萄糖、甘露糖、果糖、半乳糖醛酸、葡萄糖醛酸、木糖标准品和β-葡萄糖苷酶均购自美国Sigma公司;戊烷和甲醇均为色谱醇,购自国药集团化学试剂有限公司。
ICS2500型离子色谱仪,CarboPac PA-20阴离子交换分析柱,美国Dionex公司;Allegra 25 R高速冷冻离心机,美国Beckman公司;Allegra 25 R高速冷冻离心机,美国Beckman公司;RE-52A旋转蒸发仪,上海亚荣生化仪器厂;HWS28型电热恒温水浴锅,上海一恒科学仪器有限公司;Milli-Q超纯水设备,美国Ultra公司;SPE小柱(Amberlite XAD-2),美国Supelco公司;吹扫捕集器,自制;Gerstel TDS3半自动热脱附进样器,TC-20型热脱附管老化器,德国Gerstel公司;Tenax TA吸附剂,美国Camsco公司;梅特勒FE20K型pH计,Mettler Toledo仪器(上海)有限公司;PAL-1数字手持折光仪,日本Atago公司;BRIX-ACIDITY METER GMK-706R糖酸测定仪,韩国G-WON公司;754N紫外可见分光光度计,上海精密科学仪器厂。
1.3 试验方法
1.3.1 样品制备方法
1.3.1.1 石榴汁的制备
取1 kg果实洗净、去皮,用组织捣碎机匀浆,粗纱布过滤去皮渣,再经冷冻离心机离心10 min(12000 r/min,4 ℃),取上清液备用。
1.3.1.2 石榴汁酶解液
选用100 g 1.3.1.1的上清液置于200 mL顶空瓶中,用Na2HPO4水溶液(0.1 M)调整pH=5,加入5‰的β-葡萄糖苷酶制剂(Sigma 30 kU/20 mg),用聚四氟乙烯隔垫密封,在 40 ℃的水浴温度条件下,酶解16 h后,-18 ℃保存待用。
1.3.1.3 石榴汁糖苷粗提物的制备
参考Bisotto等人[9]的方法并稍作调整。活化与平衡:依次用500 mL甲醇、500 mL水过柱,流速为3 mL/min;上样:将100 mL 1.3.1.1上清液以1.0 mL/min的流速过柱;洗涤:用300 mL蒸馏水淋洗小柱,除去糖和酸等水溶性化合物流速为2.0 mL/min;洗脱:以400 mL戊烷洗脱除去游离态芳香物质,流速2.0 mL/min;用400 mL甲醇洗脱键合态芳香物质,流速为1.0 mL/min,收集键合态洗液。将收集的甲醇洗脱液在旋转蒸发仪中浓缩至干(水浴温度40 ℃真空度0.8 MPa),用20 mL柠檬酸-磷酸氢二钠缓冲液(0.06 M,pH 5.0)溶解,再用100 mL戊烷萃取2次,除去可能存在的游离态香气成分,收集水相。
1.3.2 石榴汁糖苷前体物的紫外吸收光谱特征
取适量1.3.1.3的石榴汁糖苷粗提物,在200~700 nm波长范围内进行紫外可见全扫描,从而得出石榴汁糖苷键合态香气前体物质的特征吸收峰。
1.3.3 石榴汁酶解前后部分理化指标的测定
取适量1.3.1.1的石榴汁和1.3.1.2的石榴汁酶解液进行理化指标测定:pH值采用FE20K型pH计测定;总酸和总可溶性固形物(TSS)分别采用BRIX-ACIDITY METER糖酸测定仪与PAL-1数字手持式折光仪测定;还原糖的测定采用DNS法按文献[10]测定。
1.3.4 石榴汁酶解前后单糖的HPLC测定方法
可溶性糖的提取参考 Ajlouni等人[11]的方法。精确称取100 mg 1.3.1.1的石榴汁上清液和1.3.1.2的石榴汁酶解液,加入50 mL、80%乙醇,摇匀后于30 ℃摇床震摇45 min,抽滤。将滤渣用80%乙醇冲洗3次,取滤液于 55 ℃真空旋转蒸发去除乙醇,超纯水定容至10 mL。将样品12000 r/min离心10 min后进行一定浓度的稀释,上清液过0.22 μm混合纤维素酯(MCE)微孔滤膜上机测试,所用设备为ICS 2500型离子色谱仪。
可溶性糖的检测条件:单糖:CarboPac PA20阴离子交换分析柱(150 mm×3 mm i.d);柱温30 ℃;流动相为纯水和0.25 M NaOH,流速为0.45 mL/min,进样量25 μL;每个样品做3次平行试验。
1.3.5 石榴汁酶解前后挥发性香气物质的GC-MS测定
1.3.5.1 挥发性风味物质的提取-热脱附技术
取1.3.1.1上清液和1.3.1.2的石榴汁酶解液各50 mL装入特制的样品管(置于恒温水浴中)内,一端通纯净氮气(流速60 mL/min),另一端接装有Tenax TA吸附剂的吸附管(事先老化至无色谱杂峰),吸附一定时间后直接置热脱附仪上进样。热脱附(Thermal Desorption System,TDS)条件:采用标准加热模式;氦气流速:30 mL/min;不分流进样;初始温度为40 ℃,延迟运行1 min,以180 ℃/min 速率升温至260 ℃,保持10 min;传输线温度为280 ℃;热脱附完成后快速冷却至预备温度 50 ℃;冷进样(Cold Injection System,CIS)条件:采用标准加热模式;液氮冷却,初始温度为-90 ℃,以12 ℃/s的速率升温至260 ℃,保持1 min。
1.3.5.2 GC-MS分析
色谱条件:色谱柱:HP-INNOWAX(60 m×0.25 mm(i.d)×0.25 μm(d.f));载气为高纯He;载气流量为1.0 mL/min;进样口温度250 ℃。升温程序:40 ℃保留3 min,以12 /min℃ 速率升温至60 ℃,然后以6 /min℃ 速率升温至140 ℃,再以12 /min℃ 速率升温至250 ℃,保留15 min;溶剂延迟3 min。
质谱条件:离子源为EI,电离电压70 eV,离子源温度230 ℃,接口温度250 ℃,质量扫描范围m/z 20~350,扫描方式:全扫描(SCAN)。
1.3.5.3 香气物质的定性定量分析
定性分析:正构烷烃(C7-C30)进样量为0.2 μL,分流比为10:1,再按照上述升温程序步骤进行色谱分析;后对石榴汁的分析数据进行 Kovats保留指数计算,通过RIs比较并结合数据库Wiley7n.l对石榴汁的香气成分进行定性分析。
定量分析:石榴汁中挥发性物质的含量可以根据内标计算,内标物为2-辛醇(262 mg/L),计算公式如下:
ms=(mi×As)/(Ai×m0)
式中ms为挥发性物质含量,μg/g;mi为内标物含量,μg;m0为实验所用石榴汁质量,g;As为挥发性物质峰面积;Ai为内标物峰面积。
1.3.6 感官评定
取1.3.1.1上清液和1.3.1.2的石榴汁酶解液各取20 mL样品,置于50 mL玻璃杯中。感官评价方法选用定量描述性感官评价,10名感官评价人员(5男5女,年龄在20~30岁之间)评价样品的风味和口感。
1.3.7 数据分析
实验的数据结果用 Excel 2007统计,HPLC及GC-MS结果(平均值以及标准偏差)由SAS软件分析。
2.1 石榴汁糖苷键合态香气前体物质的紫外-可见光谱特征

图1 石榴糖苷前体物的特征吸收光谱
Fig.1 Characteristic absorption spectra of the pomegranate glycosidic precursor
注:a,糖苷粗提物原液;b,25倍稀释液。
石榴汁糖苷类粗提物的紫外可见吸收光谱如图1,该糖苷粗提物的最大吸收波长在516 nm左右,吸收峰宽,同时在320 nm左右有不明显吸收带;除此之外,紫外可见吸收图谱中在232 nm 和266 nm左右也有明显的吸收峰。根据文献[12],吸收波长在516 nm左右处也可能是石榴汁花色苷的特征吸收峰,而花色苷也属于糖苷类物质,因此确定糖苷键合态香气前体物质的紫外-可见光谱特征需进一步分离纯化后再行分析。
2.2 酶解对石榴汁理化特性的影响
表1 酶解对石榴汁理化性质的影响
Table 1 Effect of enzymatic hydrolysis treatment on the physicochemical properties of pomegranate juice

注:数据结果为:均值±标准差(n=3);同一列中具有不同上标者表示差异显著(p<0.05)。
样品 pH值 TSS /°Brix 总酸 /(g/kg) 还原糖 /(mg/mL) 酶解前 3.93±0.03a12.2±0.13a13.17±0.25a137.90±0.08b酶解后 3.73±0.01a17.0±0.04b15.66±0.18a228.44±0.12b
由表1可知,酶解石榴汁虽然使其pH和总酸含量略有变化,但与对照样差异不显著;而其中的TSS和可溶性糖与对照样差异显著;造成TSS和还原糖与对照样的差异,主要是由于酶解使石榴汁中糖苷类物质不同程度的释放、分解成糖类物质和游离态的芳香物质,从而导致酶解液中可溶性固形物含量和还原糖含量的增加。
2.3 石榴汁糖苷类香气前体糖基部分的研究

图2 可溶性糖混合标准品的HPLC图
Fig.2 Chromatogram of mixed soluble sugar standard
注:1表示海藻糖;2表示鼠李糖;3表示阿拉伯糖;4表示半乳糖;5表示葡萄糖;6表示木糖;7表示甘露糖;8表示果糖;9表示半乳糖醛酸;10表示葡萄糖醛酸。
由样品的液相色谱图(图3)和表2可知,石榴汁中的可溶性糖有2类,保留时间分别为12.3 min、18.27 min,与混合标品中葡萄糖和果糖的保留时间基本一致;石榴汁中游离单糖以葡萄糖和果糖为主[13],由表2可以看出,石榴汁经过酶解后,葡萄糖和果糖的含量都有所增加,分别增加了16.21%和18.51%,可见,在酶解过程中石榴汁中的糖苷类香气前体可能发生水解释放出相应的糖基。检测结果显示,石榴汁中糖苷键合态香气前体物质的糖基部分有果糖和葡萄糖两种单糖。由于分析方法的局限性,与香气物质结合的糖苷也有可能是果糖基-β-D-葡萄糖形成的二糖苷,需要进行下一步的分析。同时本研究中采用酶水解的方法分析糖基部分时,由于酶水解可能会把先水解得到的二糖或三糖再进一步水解成单糖,这样就很难把握糖基部分的真实组成,只能获得其单糖组成;因此结合后述的糖苷类香气前体酶解的GC/MS分析结果来进一步验证在石榴汁的酶解过程中存在相应的糖苷类香气前体。
表2 石榴汁酶解前后可溶性糖含量
Table 2 Content of soluble sugars in pomegranate juice before and after enzymatic hydrolysis

注:数据结果为:均值±标准差(n=3);同一列中具有不同上标者表示差异显著(p<0.05)。
糖基 酶解前/(mg/mL) 酶解后/(mg/mL) 葡萄糖 53.16±0.11b*61.78±0.31a果糖 54.99±0.01a65.17±0.17b

图3 石榴汁酶解前(a)和酶解后(b)的可溶性糖的HPLC图
Fig.3 Chromatograms obtained from HPLC analysis of pomegranate juice before (a) and after (b) enzymatic hydrolysis
注:5表示葡萄糖;8表示果糖。
2.4 石榴汁糖苷类香气前体配基部分的研究
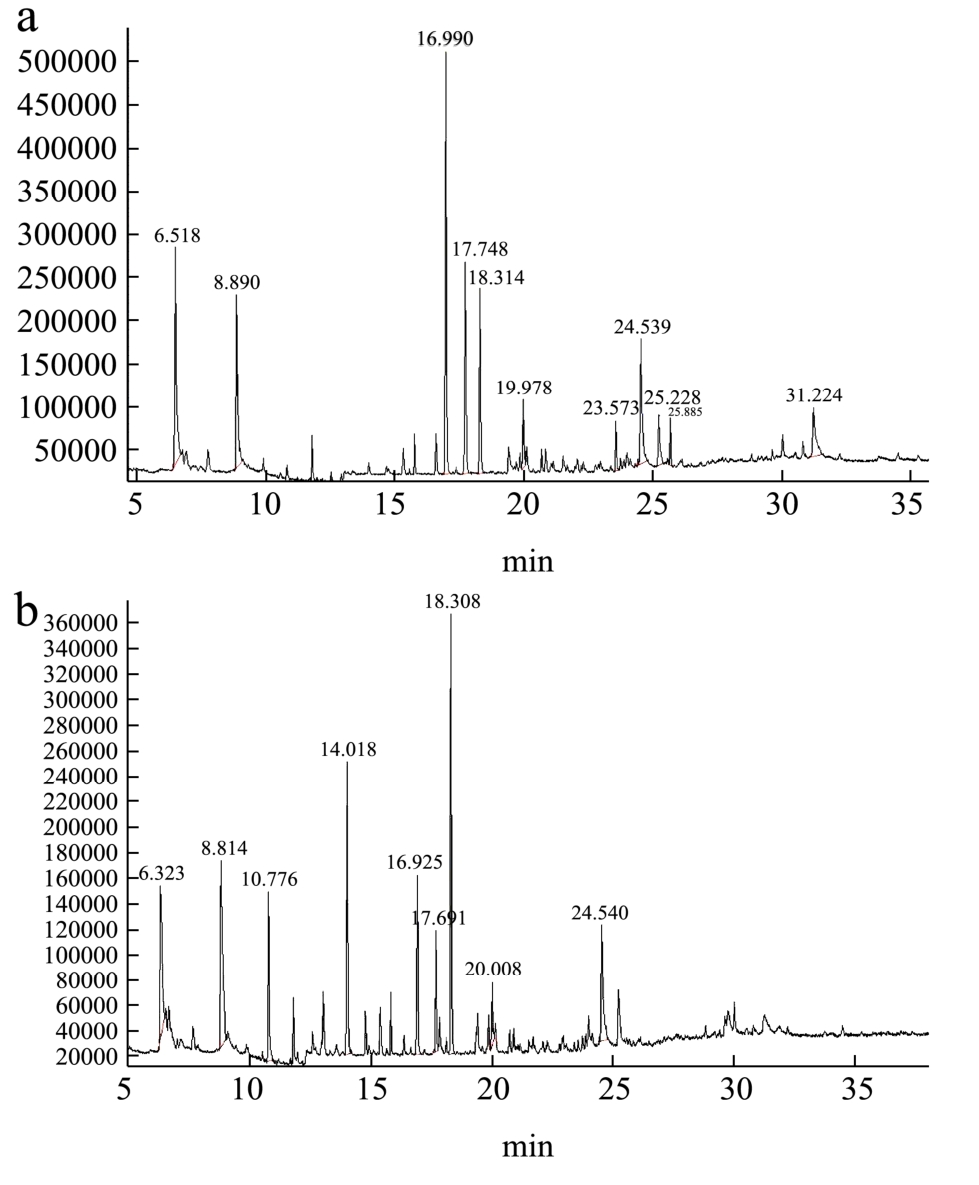
图4 石榴汁酶解前(a)和酶解后(b)的挥发性物质GC-MS图
Fig.4 Total ion chromatogram of volatile compounds in pomegranate juice before (a) and after (b) enzymatic hydrolysis
石榴汁的呈香物质主要包括各种酯类、醇类、醛类、酸类、酮类及萜烯类等物质。它们含量的多少对于石榴汁风味的形成有着重要的意义。然而糖苷键合态香气前体与其他糖苷及寡糖、果胶等杂质性质非常接近,难以分离;水解后的游离糖部分也难以精确定性。因此,对糖苷键合态香气前体的研究可以从分析糖苷水解后产生的挥发性配基入手,实现香气前体的初步定量。本试验运用GC/MS分析糖苷配基,检测结果通过统计分析得到风味物质的色谱图见图4,平均值及标准偏差结果见表3和表4。
由表3可知,石榴汁中共检测到风味物质36种,主要包括萜烯类、醛类、酸类、醇类、烷烃类、酯类以及酮类。其中萜烯类7种、醛类7种、酸类2种、醇类8种、烷烃类5种、酯类4种和酮类3种,主要香气物质与文献[14]报道相类似。
经感官评价,酶解后的石榴汁香气更显浓郁、饱满及圆润。由表3和表4可知,酶解前共检测出30种风味化合物,包括萜烯类7种、醛类5种、酸类1种、醇类6种、烷烃类4种、酯类4种和酮类3种。而从酶解后的石榴汁中共检测出36种挥发性芳香化合物,酶解前、后主要香气成分比较中可看出,酶解后许多香气成分的含量显著增加,酶解产生的键合态挥发性物质以芳香醇类物质含量最高,但还有羟基酯类物质,醇类和萜烯类物质,这些物质都是植物中键合态香气物质的主要构成成分[1],对整体香气的贡献作用很大。
酶解后含量增加较明显物质为正己醇(脂肪,水果似香气)、叶醇(青香,药草香)、四氢芳樟醇(花香)和苯乙醇(玫瑰香)等。酶解后萜烯类物质的含量也增加了,如柠檬烯等。表3中的己醛和壬醛在酶解前后含量变化不大,但由于这两种物质阈值相对较低,含量的较小变化对石榴汁酶解后的风味影响也较大。这些物质不存在于或微量存在于未酶解的石榴汁中,由此可见,导致酶解前后风味物质种类和数量上的差异是由于β-葡萄糖苷酶酶解石榴汁中的“香味前驱体”释放出潜在的香气物质。同时也发现,酶解后有些香气成分含量减少,如己酸乙酯和庚酸乙酯等酯类化合物。
表3 石榴汁酶解前后风味成分的GC-MS检测结果
Table 3 Aroma compounds in pomegranate juice identified by GC-MS before and after enzymatic hydrolysis

?

注:a表示HP-INNOWAX色谱柱上的保留指数;b表示MS,通过质谱鉴定;RI表示通过保留指数的文献值鉴定;c表示未检出;d表示痕量检出。
?
表4 酶解前后主要香气成分变化
Table 4 Main aroma components before and after enzymatic hydrolysis

注:a表示未检出;b表示痕量检出;数据结果为:均值±标准差(n=3);同一列中具有不同上标者表示差异显著(p<0.05)。
样品 正己醇/(μg/g) 叶醇/(μg/g) 四氢芳樟醇/(μg/g) 苯乙醇/(μg/g) 己醛/(μg/g) 壬醛/(μg/g) 糠醛/(μg/g)酶解前 Trb0.39±0.11 -a0.05±0.19 0.82±0.11 0.73±0.18 - 酶解 1.09±0.23 1.49±0.32 1.72±0.15 0.45±0.09 0.99±0.26 0.93±0.11 0.21±0.09
本试验采用紫外,HPLC技术,GC-MS结合理化指标的测定对石榴汁糖苷键合态芳香物质进行分析研究。紫外-可见光谱扫描初步获得石榴汁糖苷键合态香气前体的特征吸收峰;通过理化指标的测定,发现经过β-葡萄糖苷酶水解后的石榴汁中的TSS和还原糖含量增加明显;同时HPLC分析检测结果表明石榴汁中的糖基主要以葡萄糖、果糖2种单糖为主;GC-MS检测到石榴汁酶解后,香气物质的数量和含量都有所增加,作为苷元的石榴汁键合态物质有芳香醇类、萜烯类和醛类等,主要以正己醇、叶醇、四氢芳樟醇和苯乙醇等芳香醇类物质为主。从而对石榴汁中糖苷类香气前体的分子结构进行了初步判断,为进一步定性定量分析石榴中糖苷键合态香气前体奠定了基础。
参考文献:
[1] 林雯雯,楼舒婷,孙玉敬,等.柑橘汁中糖苷键合态香气物质的研究进展[J].食品工业科技,2014,35(17):395-399 LIN Wen-wen, LOU Shu-ting, SUN Yu-jing, et al. Advances in research of glycosidically bound aroma compounds of citrus juice [J]. Science and Technology of Food Industry, 2014, 35(17): 395-399
[2] Schievano E, D'Ambrosio M, Mazzaretto I. Identification of wine aroma precursors in Moscato Giallo grape juice: a nuclear magnetic resonance and liquid chromatography-mass spectrometry tandem study [J]. Talanta, 2013, 116(22): 841- 851
[3] Tripathi J, Chatterjee S, Gamre S, et al. Analysis of free and bound aroma compounds of pomegranate (Punica granatum L.) [J]. Lebensmittel-Wissenschaft und-Technologie, 2014, 59(1): 461-466
[4] Du X F, Finn C H, Qian M C. Bound volatile precursors in genotypes in the pedigree of ‘marion’ blackberry (Rubus Sp.) [J]. Food Chemistry, 2010, 58: 3694-3699
[5] 任婧楠,董曼,杨子玉,等.树莓汁中键合态香气物质提取方法及糖基组成的研究[J].现代食品科技,2015,31(8):316-322 REN Jing-nan, DONG Man, YANG Zi-yu, et al. Extraction of bound aroma compounds in raspberry juice and analysis of the sugar moieties [J]. Modern Food Science and Technology, 2015, 31(8): 316-322
[6] 王林,朱金峰,许自成,等.不同酶制剂对烤烟上部叶化学成分、游离态和糖苷结合态中性香气成分的影响[J].生物技术进展,2015, 5(6):455-46 WANG Lin, ZHU Jin-feng, XU Zi-cheng, et al. Influence of spraying different enzyme preparations on chemical composition, free and glycosidic neutral aroma components in upper leaves of flue-cured tobacco [J]. Current Biotechnology, 2015, 5(6): 455-460
[7] D'Ambrosio M, Harghel P, Guantieri V. Isolation of intact glycosidic aroma precursors from grape juice by hydrophilic interaction liquid chromatography [J]. Australian Journal of Grape & Wine Research, 2013, 19(2): 189-192
[8] Hampel D, Robinson A L, Johnson A J, et al. Direct hydrolysis and analysis of glycosidically bound aroma compounds in grapes and wines: comparison of hydrolysis conditions and sample preparation methods [J]. Australian Journal of Grape & Wine Research, 2014, 20(3): 361-377
[9] A Bisotto, A Julien, P Rigou, et al. Evaluation of the inherent capacity of commercial yeast strains to release glycosidic aroma precursors from Muscat grape must [J]. Australian Journal of Grape & Wine Research, 2015, 21(2): 194-199
[10] 王俊丽,聂国兴,李素贞,等.DNS法测定还原糖含量时最适波长的确定[J].河南农业科学,2010,4:115-118 WANG Jun-li, NIE Guo-xing, LI Su-zhen, et al. Optimal wavelength for determining the content of reducing sugar by DNS method [J]. Journal of Henan Agricultural Sciences, 2010, 4: 115-118
[11] Ajlouni S O, Beelman D B, Thompson D B, et al. Changes in soluble sugars in various tissues of cultivated mushrooms, Agaricus Bisporus, duribg postharvest storage [C]// Food flavors.: Generation, Analysis and Process Influence, Proceedings of the 8th International Flavor Conference. Amsterdam, Netherlands: Elsevier Sci. Publ, 1995: 1865- 1880
[12] Özge Turfan, Türkyilmaz M, Yemiş O, et al. Effects of clarification and storage on anthocyanins and color of pomegranate juice concentrates [J]. Journal of Food Quality, 2012, 35(35): 272-282
[13] Néjib Hasnaoui, Rania Jbir, Messaoud Mars, et al. Organic acids, sugars, and anthocyanins contents in juices of tunisian pomegranate fruits [J]. International Journal of Food Properties, 2011, 14(4): 741-757
[14] Antonio J, Andreu-Sevilla, Pedro Mena, et al. Volatile composition and descriptive sensory analysis of pomegranate juice and wine [J]. Food Research International, 2013, 54(1): 246-254
Preliminary Study on the Glycosidically Bound Aroma Compounds from Pomegranate Juice
Abstract:The characteristic absorption peaks of glycosidically bound aroma precursors from pomegranate juice were initially identified from UV-visible spectra. The aglycones and the glycones were determined by HPLC and GC-MS analysis before and after enzymatic hydrolysis. The glycosidically bound aroma precursors were analyzed by monitoring the evolution of thephysicochemical properties of pomegranate juice without or with enzymatic hydrolysis. Characteristic absorption peaks of the glycosides were obtained using UV-visible spectra. The total soluble solid and reducing sugar content of the pomegranate juice showed significant differences for the samples treated with and without enzymatic hydrolysis. Glucose and fructose were determined as sugar moieties of the glycosides in pomegranate juice by HPLC analysis. A total of 36 volatile compounds were identified by GC-MS, and the bound aromas detected in the juice were mostly aromatic alcohols, terpenes, and aldehydes, which mainly included 1-hexyl alcohol, cis-3-hexen-1-ol, tetrahydrolinalool, and phenethyl alcohol. The results provide evidence to further explain the structure of glycosidically bound aroma precursors from pomegranate juice.
Key words:pomegranate juice; bound aroma compounds; enzymatic hydrolysis
文章篇号:1673-9078(2017)1-221-227
DOI:10.13982/j.mfst.1673-9078.2017.1.034
收稿日期:2015-10-30
基金项目:市农业科研攻关专项(20150432B55)