摘要:以梅鱼鱼糜为原料,研究不同电子束辐照剂量(0~9 kGy)对鱼糜肌原纤维蛋白结构及其凝胶特性的影响,确定提高鱼糜凝胶品质的最适剂量。结果表明:低剂量(≤5 kGy)组总巯基和活性巯基含量下降不明显,但7 kGy和9 kGy组下降明显;随辐照剂量的增加,Ca2+-ATPase活性明显下降,而表面疏水性先增大后减小,5 kGy组表面疏水性值达到最大。SDS-PAGE和DSC分析显示,随辐照剂量的增加,尤其在7 kGy和9 kGy组,肌球蛋白重链、肌球蛋白和肌动蛋白的热稳定性下降明显;鱼糜凝胶特性结果表明,经5 kGy电子束处理,梅鱼鱼糜的凝胶强度、白度值和持水性均高于对照及其它剂量组。综上所述,5 kGy辐照剂量可有效改善梅鱼鱼糜的凝胶特性,且相比于高剂量(≥7 kGy)组,低剂量辐照对梅鱼鱼糜肌原纤维蛋白结构的影响不显著。电子束辐照处理可以成为改善梅鱼鱼糜凝胶品质的一种有效手段,合适剂量为5 kGy。
关键词:电子束辐照;梅鱼鱼糜;肌原纤维蛋白;结构;凝胶特性
鱼糜是基于肌原纤维蛋白胶凝性能所形成的弹性凝胶体,其中凝胶强度、持水性和白度等是衡量其品质的重要指标,如何有效改善鱼糜肌原纤维蛋白的凝胶性能,是鱼糜及鱼糜制品加工所面临的焦点问题。有“冷杀菌”之称的电子束辐照是近年发展起来的一种新型食品加工技术,在控制食源性疾病的发生、降低农产品产后损耗、延长食品货架期、提高食品加工品质等方面具有明显的优越性[1],与传统的60Co-γ射线相比,电子束的产生以电能为能源,不需要借助任何放射性元素,因此电子束辐照凭借其技术优势和安全性,已被越来越多的国家应用于食品保鲜、质量和安全控制及品质提高等领域。
自上世纪50年代以来,有关肌原纤维蛋白的胶凝作用、形成凝胶的机制和凝胶特性等方面的研究一直方兴未艾。研究表明在杀菌的同时,辐照处理对食品蛋白质等生物大分子具有独特的改性作用,能引起肌肉蛋白生化特性、化学作用力及结构的改变,导致蛋白质变性、聚集或凝胶化[2]。因此利用电子束辐照处理鱼糜,有望成为改善鱼糜凝胶品质的一种有效手段。目前辐照在肉品中的研究和应用主要集中在杀菌保鲜及对其营养价值影响方面,而对肌肉蛋白的变性聚集或凝胶化等研究甚少[3]。梅鱼(Colichthys lucidus)为近海小型经济鱼类,资源丰富、价格低廉,年捕获量已达30万吨。除鲜销或加工成鱼干外,梅鱼也是鱼糜加工的重要原料[4],但在生产中往往因原料鲜度不足而影响鱼糜的凝胶品质。为此,本文以梅鱼鱼糜为原料,研究电子束辐照对肌肉纤维蛋白生化指标、结构以及热稳定性的影响,分析蛋白结构的改变与肌肉凝胶形成的关系,确定有利于改善凝胶特性的最适辐照剂量,进而为合理的采用辐照技术提高肌肉及其制品的凝胶性能提供理论指导。
1.1 材料
梅鱼Collichthys lucidus鱼糜,由浙江兴业集团有限公司提供,冻藏待用。食盐,宁波市盐业有限公司。PVDC塑料肠衣:食品级,南通皇佳肠衣有限公司。
1.2 主要仪器
NBL1010电子直线加速器,宁波超能科技股份有限公司;FWT-60薄膜剂量计,美国远西公司;UMC-5真空斩拌机,德国Stephan Machinery公司;SpectraMax i3多功能酶标仪(美国 Molecular Devices公司);XHF-D高速分散器(宁波新芝生物科技公司);TA.XT.plus质构分析仪,英国Stable Micro System公司;Biofuge Stratos台式高速冷冻离心机,德国Thermo Scientific SORVALL公司;DYY-12型电脑三恒多用电泳仪,北京市六一仪器厂;GS-800 Calibrated Densitometer扫描仪,上海研域仪器设备有限公司;200F3差示热量扫描仪,德国Netzsch公司。
1.3 实验方法
1.3.1 电子束辐照处理
取冷冻鱼糜,按250 g/包(厚度1.2 cm),PE袋真空包装。随机分组,采用NBL-1010型电子直线加速器(能量10 MeV)进行电子束辐照,剂量率1 kGy/s,平均电流强度1128 μA,剂量分别为0、1、3、5、7和9 kGy,其中0剂量的为对照组。采用FWT-60薄膜剂量计,通过分光光度法标定吸收剂量,该剂量计经中国计量科学院比对,剂量测量误差<±3%。辐照时鱼糜单包排列,不重叠,以保证辐照均匀。对照组及辐照后的鱼糜用于鱼糜肌原纤维蛋白的提取及肌原纤维蛋白巯基含量、Ca2+-ATPase活性、表面疏水性和十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)、差示热量扫描(DSC)分析。
1.3.2 梅鱼鱼糜凝胶的制备
取对照组及各辐照组鱼糜,空斩2 min,再添加2.5%的食盐斩拌8 min,斩拌温度4 ℃左右。斩拌后的鱼糜溶胶灌入肠衣(直径25 mm),两头扎紧,进行二段式加热凝胶化:40 ℃加热30 min(低温段)后进一步90 ℃加热30 min(高温段),冰浴冷却后制得鱼糜凝胶,4 ℃储藏,鱼糜凝胶用于凝胶强度、白度及其持水性的测定。
1.3.3 鱼糜肌原纤维蛋白提取及含量测定
参考Xiong[5]等方法。取2 g鱼糜样品于离心管中, 加 10倍量 20 mmol/L Tris-maleate 缓冲液(含 0.05 mol/L KCl,pH 7.0),充分匀浆,离心(10000 r/min,10 min),沉淀加入10倍量20 mmol/L Tris-maleate缓冲液(含0.6 mol/L KCl,pH 7.0),充分匀浆,静置提取1 h后10000 r/min离心10 min,上清液即为梅鱼鱼糜肌原纤维蛋白溶液。所有操作均在2~4 ℃下进行。采用双缩脲法测定肌原纤维蛋白含量。
1.3.4 肌原纤维蛋白巯基及活性巯基含量的测定
按Benjakul[6]方法并稍作修改。取1 mL肌原纤维蛋白溶液,加入9 mL、0.2 mol/L的Tris-HCl缓冲液(包括8 mol/L尿素,2% SDS和10 mmol/L EDTA,pH 6.8),充分混合后取4 mL,加入0.4 mL、0.1%的DTNB,25 ℃水浴25 min,测A412 nm,即总巯基的吸光度。
在不含尿素的条件下,反应混合液在4 ℃反应1 h,测 A412 nm,即为活性巯基的吸光度。以 13600 M-1·cm-1摩尔消光系数计算巯基含量见式(1)。
1.3.5 肌原纤维蛋白Ca2+-ATPase活性测定
参考 Thanonkaew等[7]并稍作修改。取1 mL蛋白溶液(1 mg/mL),依次加入0.6 mL的Tris-HCl缓冲液(0.5 mol/L,pH 7.0)、7.9 mL CaCl2(10 mmol/L)和0.5 mL ATP溶液(20 mmol/L),摇匀后25 ℃下反应8 min,加5 mL 15% TCA终止反应,6000 r/min离心15 min,取上清液,采用钼酸铵比色法定磷。以每分钟每毫克肌原纤维蛋白酶分解ATP所释放的无机磷量(μmol·Pi/ mg·pro/min)表示Ca2+-ATPase活性,见式(2)。
式中,m:生成无机磷量(μmol);t:反应时间(min);M:肌原纤维蛋白含量(mg)。
1.3.6 肌原纤维蛋白表面疏水性测定
参考Chelh等[8]方法并稍作修改。取1 mL肌原纤维蛋白溶液,90 ℃水浴加热30 min,冰浴冷却后加200 μL溴酚蓝(1 mg/mL),4000 r/min离心15 min,取上清液稀释10倍,测A595 nm值。空白为不加肌原纤维蛋白溶液的反应液,见式(3)。
1.3.7 肌原纤维蛋白SDS-PAGE分析
根据Laemmli[9]方法进行。电泳胶厚度为1 mm,进样量10 μL,进样浓度1 mg/L,电泳开始时电压80 V,当样品进入分离胶后调高至 120 V,考马斯亮蓝R250染色后脱色。
1.3.8 肌原纤维蛋白DSC测定
鱼糜肌原纤维蛋白冷冻干燥,准确称取15 mg置于铝坩埚内,液压密封,以空铝坩埚作为对照。差示量热扫描范围5~95 ℃,升温速率10 ℃/min。
1.3.9 鱼糜凝胶特性的测定
1.3.9.1 凝胶强度的测定
取鱼糜凝胶样品,厚度约25 mm,用TA.XT.plus凝胶强度测试。测定参数为:压缩力模式,P/0.5S球形探头,测试速率均为1.0 mm/s,压缩比50%。
1.3.9.2 凝胶白度的测定
利用CR-400便携式色差仪进行测定。色度分析前,用标准白板(X=70.3,Y=74.0,Z=80.3)校正色差仪。每个样品测量3个不同部位,结果取平均值,白度为L*、a*和b*的综合指标。
1.3.9.3 凝胶持水性的测定
参照Carmona[10]等方法并稍作修改。先将离心管称重(m),凝胶样品切成厚度约2 mm的薄片,8等份后取1.5 g~2.0 g样品,平摊在滤纸上并包裹好放入离心管底部,称重(M1),离心(3000 r/min,15 min),离心后去除滤纸,称重(M2),见式(4)。
1.4 数据分析
实验平行次数3~5次,结果取平均值。应用origin 8.0软件作图,方差分析采用SAS 8.0软件的ANOVA过程处理,显著性检验采用Duncan多重比较。图中不同小写字母表示差异显著(p<0.05)。
2.1 肌原纤维蛋白总巯基和活性巯基含量的变化
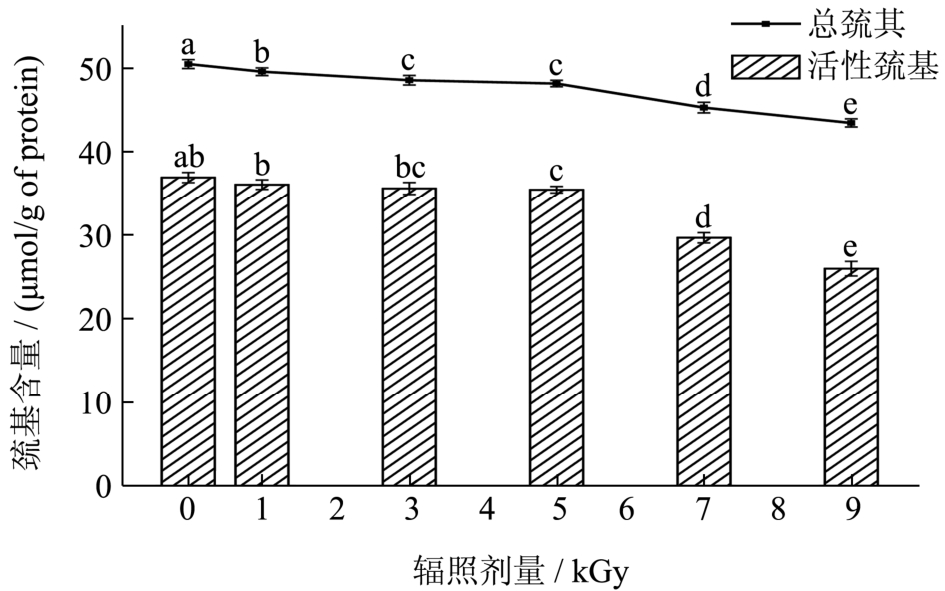
图1 辐照对鱼糜肌原纤维蛋白总巯基、活性巯基含量的影响
Fig.1 Effect of irradiation on total and active sulfhydryl group content in surimi myofibrillar protein
注:图中不同小写字母表示差异显著(p<0.05)。
不同剂量电子束处理后,梅鱼鱼糜肌原纤维蛋白总巯基和活性巯基含量的变化如图1所示,辐照后巯基和总巯基含量下降,且随着辐照剂量的增加,下降程度增大。当辐照剂量≤5 kGy时,总巯基和活性巯基含量下降并不显著,其中5 kGy组的总巯基和活性巯基含量分别由空白组的50.47 μmol/g pro和36.93 μmol/g pro下降至48.14 μmol/g pro和35.47 μmol/g pro;当辐照剂量≥7 kGy时,总巯基和活性巯基含量均出现明显的下降(p<0.05),这可能是由于高剂量辐照会促使肌原纤维蛋白降解或空间构象的改变,一些埋藏在分子内部的巯基暴露而被氧化,且辐照剂量越高这种作用越明显。
巯基是肌肉蛋白中最具反应活性的基团之一,容易发生氧化形成二硫键,降低蛋白质分子中的巯基含量[6],因此通过测定总巯基和活性巯基含量可以反映辐照处理对鱼肉蛋白变性程度的影响。Shi等[11]采用0~10 kGy的γ射线辐照鱼肉肌原纤维,发现0~4 kGy时总巯基含量并无明显变化,而活性巯基的含量明显减少;当辐射剂量>4 kGy时总巯基和活性巯基含量均显著减少,并推测辐照导致活性巯基暴露促使其氧化。在鱼糜的凝胶化过程中,二硫键是维持鱼糜凝胶网络结构的主要化学作用力之一[12],辐照引起巯基氧化而形成二硫键,在一定程度上有利于鱼糜的凝胶化作用,以形成更好的凝胶网络结构;但巯基含量的下降幅度越大,表示蛋白的变性程度越高,对有利于形成二硫键的最适辐照剂量还需结合反映凝胶特性的指标而定。
2.2 肌原纤维蛋白Ca2+-ATPase活性的变化
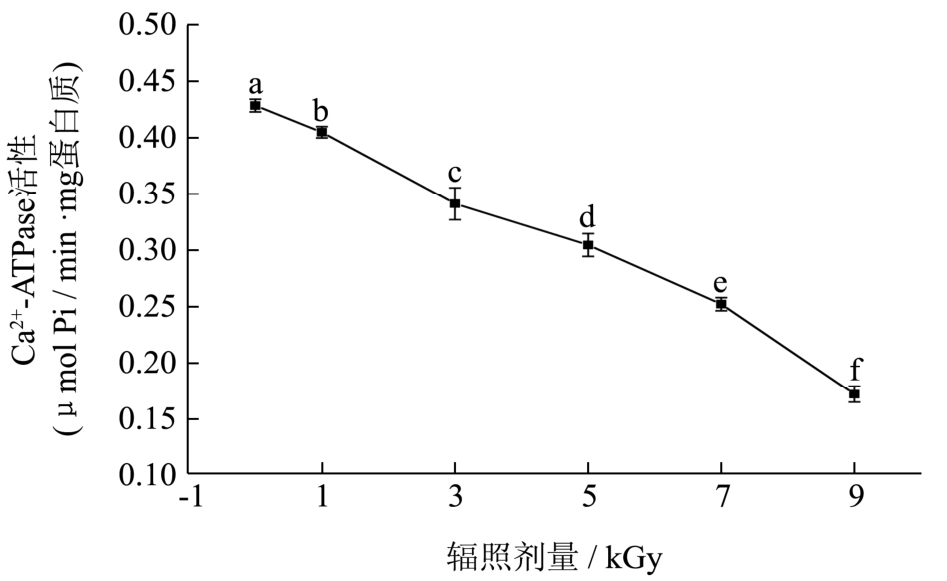
图2 辐照对鱼糜肌原纤维蛋白Ca2+-ATPase活性的影响
Fig.2 Effect of irradiation on Ca2+-ATPase activity of surimi myofibrillar protein
注:图中不同小写字母表示差异显著(p<0.05)。
Ca2+-ATPase活性的大小,反映了肌球蛋白的生化活性,与肌球蛋白的生物功能、凝胶形成有一定的关系。由图2可知,与对照组相比,辐照处理可明显降低鱼糜肌原纤维蛋白Ca2+-ATPase活性(p<0.05),且随着辐照剂量的增加,降低的程度增大。总巯基数和活性巯基数的下降伴随着Ca2+-ATPase活性的降低,这可能是由于肌动球蛋白头部Ca2+-ATPase活性下降导致蛋白结构发生变化,致使巯基暴露被氧化形成二硫化合物。Li等[13]研究发现高剂量辐照处理会使肌原纤维蛋白Ca2+-ATPase活性发生不同程度的下降,破坏肌球蛋白的完整性,致使其变性。结合图1和图2,与巯基含量相比,梅鱼鱼糜肌原纤维蛋白的Ca2+-ATPase活性更易受到辐照剂量的影响,推测Ca2+-ATPase活性除了与巯基有关,还可能与辐照产生的氧自由基促使Ca2+-ATPase活性下降有关。
2.3 肌原纤维蛋白表面疏水性的变化
一些疏水性氨基酸残基通常埋藏于蛋白分子内部,当蛋白质构象发生变化时,这些疏水性氨基酸残基将暴露于分子表面,使蛋白质的表面疏水性增加。不同电子束辐照剂量对梅鱼鱼糜肌原纤维蛋白表面疏水性的影响如图3。随着辐照剂量的增加,蛋白质的表面疏水性先增大后减小,并且在5 kGy时达到最大值。Yan等[11]采用0~10 kGy的γ射线辐照鱼肉蛋白,同样发现表面疏水性先增大后减小,且在6 kGy时达到最大值;An等[14]也得出类似的结果,5 kGy时过氧化物酶蛋白的表面疏水性达到最大。结合图3,推测电子束辐照引起梅鱼鱼糜肌原纤维蛋白表面疏水性的变化,在低剂量条件下辐照促使肌原纤维蛋白质分子伸展,一些疏水性氨基酸残基暴露在蛋白分子表面,表面疏水性增大,但随着辐照剂量的继续增大,蛋白质发生交联,这些暴露在蛋白分子表面的疏水基团又被重新包埋,以至于表面疏水性下降。在鱼糜的凝胶化过程中,疏水相互作用也是维持凝胶网络结构的主要化学作用力之一[11],对鱼糜而言,表面疏水性的增加有利于疏水基团的相互作用,以促进形成更好的凝胶网络结构。
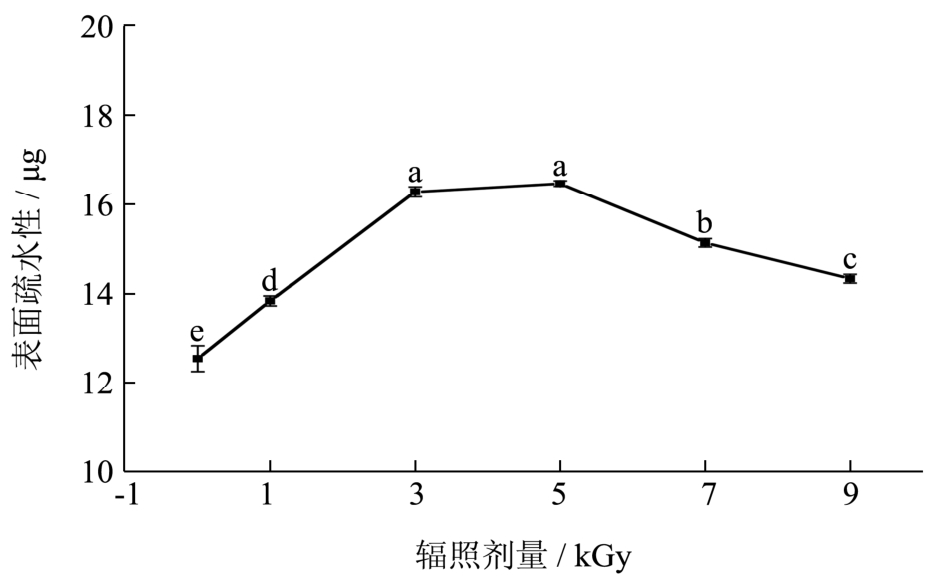
图3 辐照对鱼糜肌原纤维蛋白表面疏水性的影响
Fig.3 Effect of irradiation on surface hydrophobicity of surimi myofibrillar protein
注:图中不同小写字母表示差异显著(p<0.05)。
2.4 肌原纤维蛋白的SDS-PAGE分析
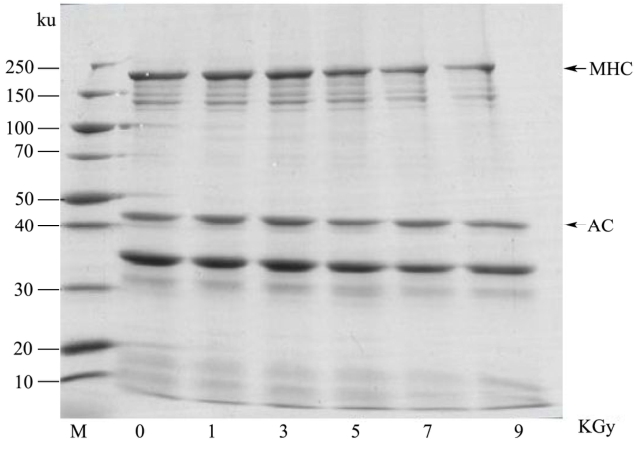
图4 鱼糜肌原纤维蛋白SDS-PAGE谱图
Fig.4 SDS-PAGE pattern of surimi myofibrillar protein
注:MHC代表肌球蛋白重链;AC代表肌动蛋白。
经电子束辐照处理后,鱼糜肌原纤维蛋白的电泳谱图如4所示。各组样品200 ku处均有一明显条带,为肌球蛋白重链(MHC),在43 ku左右的明显条带为肌动蛋白(AC)。不同辐照剂量下肌原纤维蛋白条带的数目没有变化,表明辐照对不同蛋白条带的分子量影响不大。但随着辐照剂量的增加,肌球蛋白重链略有下降,尤其是在7 kGy和9 kGy剂量下较为明显。Zhen[15]采用10 MeV电子束辐照大西洋鲑鱼片时同样发现了肌原纤维蛋白MHC的下降;Jaczynski[16]在研究电子束辐照处理对鱼糜和鱼糜凝胶肌原纤维蛋白的影响时,也观察到了MHC的降解。可见肌球蛋白重链比肌动蛋白更容易受到高剂量电子束辐照的降解。
2.5 肌原纤维蛋白的DSC分析
蛋白质在热变性过程中,吸收热量从有序变为无序,多肽链展开,分子间相互作用破坏当达到某种蛋白质的变性温度时,就会在热分析图谱中出现一个吸热峰,根据峰值温度可以确定蛋白质变性温度。
图5为鱼糜肌原纤维蛋白的热变化图。可以看出,梅鱼鱼糜肌原纤维蛋白有两个明显变性峰,说明在加热过程中样品结构发生了变化,变性峰范围为40~80 ℃。Hassan等[17]认为40~80 ℃间的吸热转变主要跟蛋白变性有关,Debusca[18]指出肌球蛋白的变性温度比肌动蛋白低,可推测图5中第一峰为鱼糜肌球蛋白热变性温度,第二峰则为肌动蛋白的热变性温度。
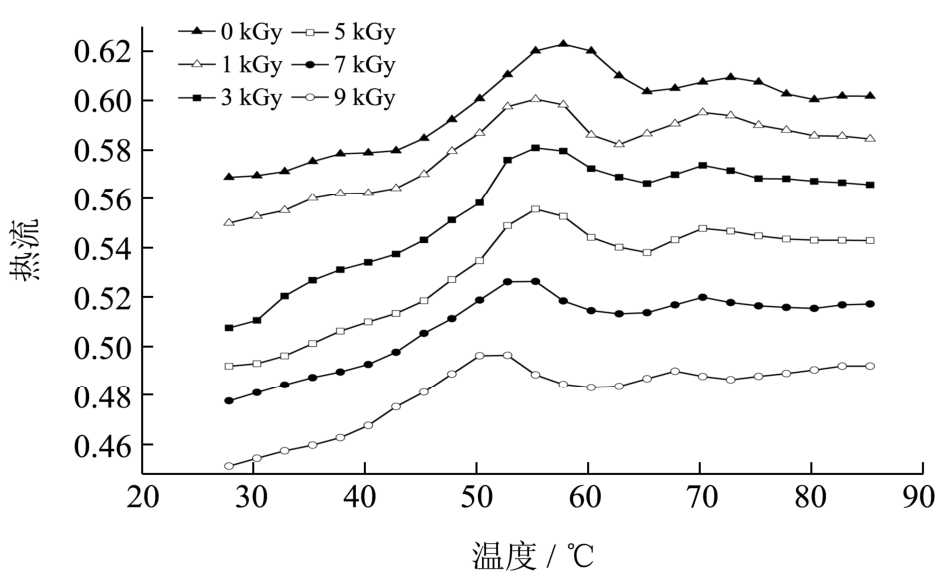
图5 鱼糜肌原纤维蛋白的DSC扫描曲线
Fig.5 DSC profiles of surimi myofibrillar protein
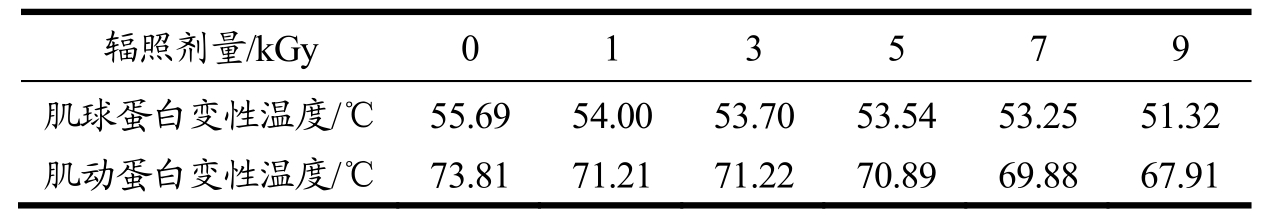
表1 不同电子束辐照剂量处理后鱼糜肌原纤维蛋白热变性温度
Table 1 Denaturation temperature of surimi myofibrillar proteins under different irradiation doses
?
表 1为辐照处理后鱼糜肌原纤维蛋白的热变温度,与对照组相比,辐照组鱼糜的肌球蛋白和肌动蛋白变性温度均有下降,且随着辐照剂量的增加变性温度下降越明显,说明电子束辐照处理在一定程度上破环了鱼肉蛋白的热稳定性,当辐照剂量大于7 kGy时热稳定性的下降尤为显著。
2.6 鱼糜凝胶特性分析
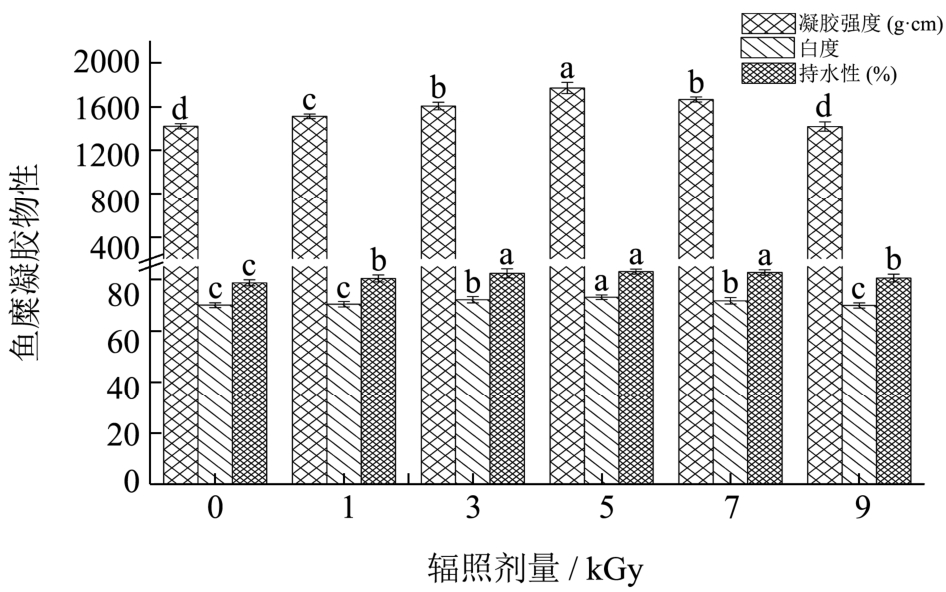
图6 辐照对鱼糜凝胶特性的影响
Fig.6 Effect of irradiation on properties of surimi gel
注:图中不同小写字母表示差异显著(p<0.05)。
凝胶强度是凝胶性能较为重要的指标,图6为辐照对梅鱼鱼糜凝胶强度、白度及其持水性的影响。由图6所示,除9 kGy组外,电子束辐照后梅鱼鱼糜凝胶强度比对照组显著上升(p<0.05),在5 kGy达到最高值。Lin[3]等通过1~9 kGy电子束辐照带鱼鱼糜,发现7 kGy可以显著提高鱼糜凝胶强度及水分活度,促进鱼糜凝胶网络结构的形成;Jaczynski[16]等认为 6~8 kGy的电子束辐照可提高鳕鱼鱼糜凝胶强度。可见适当剂量的电子束辐照可有效提高鱼糜的凝胶强度,这可能是由于辐照处理导致蛋白巯基转变形成二硫键,一定数量的疏水性氨基酸暴露于分子表面,而二硫键和蛋白质之间的疏水相互作用作为维持鱼糜凝胶网络结构的主要作用力,促使蛋白质间的交联度增加从而使鱼糜凝胶强度上升。
随着辐照剂量的增加,鱼糜凝胶白度和持水性均先增加后减小,在5 kGy时达最大值。与对照组相比,3 kGy、5 kGy和7 kGy组白度变化显著(p<0.05),但1 kGy和9 kGy组变化不明显;辐照后鱼糜的持水性显著提高(p<0.05)。Montgomery[19]等用2 kGy剂量辐照牛肉糜时同样发现白度值的升高,可见一定剂量的电子束辐照可有效改善鱼糜凝胶白度。就梅鱼鱼糜而言,3~7 kGy的辐照剂量可以提高其凝胶白度及其持水性,这与该剂量范围内梅鱼鱼糜凝胶强度的增加相一致。随着鱼糜凝胶强度的增加,凝胶网状结构更加致密,凝胶持水能力增强,而鱼糜凝胶的白度则随含水量的增加而增大。合适的电子束辐照剂量有利于提高鱼糜的凝胶强度,从而改善其白度及持水性。
梅鱼鱼糜的肌原纤维蛋白容易受到电子束辐照处理的影响,导致蛋白生化指标、结构以及热稳定性的改变。经电子束辐照,梅鱼鱼糜肌原纤维蛋白的总巯基、活性巯基含量及Ca2+-ATPase活性随辐照剂量的增加而减少,当辐照剂量大于7 kGy时影响更为显著;表面疏水性随辐照剂量的增加先增大后减小,至 5 kGy时达到最大。电子束辐照后,肌球蛋白重链含量、肌球蛋白和肌动蛋白的热变性温度均有所下降,且在高剂量(≥7 kGy)组中下降更为明显。经5 kGy辐照,梅鱼鱼糜凝胶强度、白度值和持水性均高于其它组,可能是由于适当剂量的辐照处理导致鱼糜肌原纤维蛋白巯基的氧化以及疏水性氨基酸的暴露,由此所形成的二硫键以及蛋白间的疏水相互作用成为维持鱼糜凝胶网络结构的主要作用力,促进了鱼糜蛋白的胶凝化作用。可见,适当剂量的电子束辐照可使鱼糜肌原纤维蛋白的结构发生一些变化而有利于鱼糜蛋白的凝胶形成。电子束辐照处理可以作为一种改善鱼糜凝胶品质的有效手段,就梅鱼鱼糜而言,合适的电子束处理剂量为5 kGy。
参考文献:
[1] Sommers C H, Niemira B A. Inactivation of a virulent yersinia pestis in beef bologna by gamma irradiation [J]. Journal of Food Protection, 2011, 74(4): 627-630
[2] Lin X P, Yang W G, Xu D L, et al. Effect of electron irradiation and heat on the structure of hairtail surimi [J]. Radiation Physics and Chemistry, 2015, 114(5): 50-54
[3] Lin X P, Yang W G, Xu D L, et al. Improving gel properties of hairtail surimi by electron irradiation [J]. Radiation Physics and Chemistry, 2015, 110(1): 1-5
[4] 胡飞华,陆海霞,陈青,等.超高压处理对梅鱼鱼糜凝胶特性的影响[J].水产学报,2010,34(3):329-335 HU Fei-hua, LU Hai-xia, CHEN Qing, et al. Effects of ultra-high pressure on gel properties of big head croaker (Collichthys lucidus) surim [J]. Journal of Fisheries of China, 2010, 34(3): 329-335
[5] Xiong G Q, Cheng W, Li X, et al. Effects of konjac glucomannan on physicochemical properties of myofibrillar protein and surimi gels from grass carp (Ctenopharyngodon idella) [J]. Food Chemistry, 2009, 116(2): 413-418
[6] Benjakul S, Visessanguan W, Thongkaew C, et al. Comparative study on physicochemical changes of muscle proteins from some tropical fish during frozen storage [J]. Food research International, 2003, 36(8): 787-795
[7] Thanonkaew A, Benjakul S, Visessanguan, et al. The effect of metal ions on lipid oxidation, colour and physicochemical properties of cuttlefish (Sepia pharaonis) subjected to multiple freeze-thaw cycles [J]. Food Chemistry, 2006, 95(4): 591-599
[8] Chelh I, Gatellier P, Santé-Lhoutellier V. Technical note: A simplified procedure for myofibril hydrophobicity determination [J]. Meat Science, 2006, 74(4): 681-683
[9] Laemmli U K. Cleavage of structural protein during the assembly of the head of bacteriophage T4 [J]. Nature 1970, 277(5259): 680-685
[10] Carmona P, Ignacio Sánchez-González, Moreno P, et al. Protein and water structural changes in fish surimi during gelation as revealed by isotopic H/D exchange and Raman pectroscopy [J]. Food Chemistry, 2008, 106(1): 56-64
[11] Yan Shi, Ruyi Li, Zongcai Tu, et al. Effect of γ-irradiation on the physicochemical properties and structure of fish myofibrillar proteins [J]. Radiation Physics and Chemistry, 2015, 109(10): 70-72
[12] 刘海梅,熊善柏,谢笔钧.鲢鱼糜凝胶形成过程中化学作用力及蛋白质构象的变化[J].中国水产科学,2008,15(3):469- 475 LIU Hai-mei, XIONG Shan-bo, XIE Bi-jun, et al. Changes of chemical interactions and protein conformation during forming of silver carp surimi gel [J]. Journal of Fishery Sciences of China, 2008, 15(3): 469-475
[13] Li Y, Kong B, Xia X, et al. Structural changes of the myofibrillar proteins in common carp (Cyprinus carpio) muscle exposed to ahydroxyl radical generating system [J]. Process Biochem., 2013, 48(5): 863-870
[14] An B C, Lee S S, Lee J T, et al. Change in the enzymatic dual function of the peroxiredoxin protein by gamma irradiation [J]. Radiation Physics and Chemistry, 2012, 81(8): 1136-1140[15] YANG Zhen, WANG Hai-yan, WANG Wei, et al. Effect of 10 MeV E-beam irradiation combined with vacuum-packaging on the shelf life of Atlantic salmon fillets during storage at 4 ℃ [J]. Food Chemistry, 2014, 145: 535-541
[16] Jaczynski J, Park J W. Physicochemical changes in alaska pollock surimi and surimi gel as affected by electron beam [J]. Journal of Food Science, 2004, 69(1): 53-57
[17] Hassan L, Meszaros A, Simon E, et al. Comparative studies on gamma radiation and high pressure induced effects on minced beef [J]. Acta Aliment, 2002, 31(3): 253-264
[18] Debusca A, Tahergorabi R, Beamer S K, et al. Physicochemical properties of surimi gels fortified with dietary fiber [J]. Food Chemistry, 2014, 148(2): 70-76
[19] Montgomery J L, Parrish F C, Olson D G. Irradiation and storage effects on aroma and color of raw beef patties in anaerobicor aerobic packaging [J]. Muscle Foods, 2000, 11(1): 19-33
Effects of Electron Beam Irradiation on the Myofibrillar Protein Structure and Gel Properties of Collichthys lucidus Surimi
Abstract:s: To determine the optimal radiation dose, the effects of electron beam irradiation (0~9 kGy) on the myofibrillar protein structure and gel properties of Collichthys lucidus surimi were evaluated. The results showed that at radiation doses of 7 kGy and 9 kGy, the total sulfhydryl group and active sulfhydryl group content decreased significantly, compared to those treated with lower doses (≤5 kGy). With increasing doses of radiation, the activity of calcium ATPase decreased significantly, while the surface hydrophobicity of surimi myofibrillar proteins increased initially and then decreased. The highest surface hydrophobicity was reached at 5 kGy. Sodium dodecyl sulfate-polyacrylamide gel electrophoresis (SDS-PAGE) and differential scanning calorimetry (DSC) revealed that the thermal stability of myosin heavy chains (MHC), myosin, and actin decreased significantly with the increase in radiation doses, especially in the 7 kGy and 9 kGy groups. The gel strength, whiteness, and expressible water content of surimi gel were the highest when 5 kGy of electron beam irradiation was performed. Compared to the high-dose groups (≥7 kGy), the low-dose groups did not significantly affect the structure of surimi myofibrillar proteins. Thus, irradiation with 5 kGy could effectively improve the gel properties of Collichthys lucidus surimi.
Key words:electron beam irradiation; Collichthys lucidus surimi; myofibrillar protein; structure; gel properties
文章篇号:1673-9078(2017)1-139-144
DOI:10.13982/j.mfst.1673-9078.2017.1.022
收稿日期:2016-01-25
基金项目:国家自然科学基金资助项目(31371793);宁波大学学科项目(XKl15D241)