 D表示。
D表示。摘要:从石斛中分离得到一株内生真菌DO-1,该菌株经鉴定为禾谷镰刀菌(Fusarium graminearum),其菌体在去离子水中浸泡后分泌的代谢产物与硝酸银作用后,能还原银离子产生具有抗菌作用的纳米银粒子。以440~450 nm范围内纳米银的特征性等离子吸收峰以及产物抑菌活性为指标,研究光照条件、温度以及pH条件对制备纳米银粒子的影响。黑暗条件和适当高温有助于纳米银粒子的生成及其抑菌活性的增强。随着pH的增加,纳米银特征性吸收峰不断增强,但抑菌活性呈现先增强再减弱的趋势,pH 7~8范围内得到的纳米银粒子的抑菌活性较高。调节F.graminearum DO-1菌体浸泡液的pH为7,与终浓度为1 mM的AgNO3溶液于80 ℃、黑暗条件下反应3 h,获得纳米银粒子,透射电镜分析显示制备的纳米银粒子为球形,直径范围2~50 nm。应用该内生真菌代谢产物制备具有抑菌功能的纳米银粒子,方法简单,条件温和,复合绿色生态的发展趋势。
关键词:内生真菌;禾谷镰刀菌;纳米银;抑菌
近年来,关于合成金属纳米粒子的研究很多。纳米粒子是指尺寸在1~100 nm间的粒子,处在原子簇和宏观物体交界的过渡区域,具有独特的物化性能和光电性能,在电子学、光学、化工陶瓷、生物和医药等诸多领域都得到了广泛的应用[1,2]。人类很早就认识到银具有广谱杀菌作用,并用来杀菌消毒,因此在众多的纳米材料中,纳米银(AgNPs)的研究最为广泛和深入,有关纳米银抗菌活性的报道层出不穷[3,4],除此之外纳米银还具有抗病毒[5]和抗肿瘤[6]等生物活性,而 且经细胞毒性实验和动物实验,证明纳米银基本属无生物毒性的材料,使用安全[7],可用以解决食品工业中普遍存在的保鲜防腐问题。Fayaz等[8]采用Trichoder maviride分泌的还原酶将硝酸银溶液转化生成AgNPs,所产生的多分散度的纳米银粒子大小为5~40 nm,能同时抑制革兰氏阳性和革兰氏阴性细菌,与传统的抗生素如氨卞青霉素结合具有协同效应,固定于海藻酸钠薄膜上用于果蔬保鲜,可显著延长萝卜和梨的货架期[9]。
AgNPs制备方法多种多样,主要有物理法、化学法和生物法三大类。物理或化学还原法因为所需实验条件简单、成本低及节能等优点而得到很好的应用,目前在商业性规模生产中也大多采用这些方法,但其中所涉及到的产物稳定性和毒性试剂残留的问题很受争议[10],而采用生物材料体系合成纳米微粒,具有很多优点,如在生物合成过程中控制温度和pH等简单操作就可以控制产物的物理特性,如大小和单分散度等[11],是实现生态友好及安全可靠目标的一种良好途径。
关于纳米银粒子的生物合成机理有两种推测:生物酶催化机理和非酶还原机理。生物酶催化机理认为:微生物体所产生的生物酶作为电子传递体将还原性物质(如还原酶、还原糖和常用作电子供体的H等)的电子转移给金属离子,使之被还原。非酶还原机理则认为体系中的萘醌、蒽醌类的奎宁衍生物也可作为氧化还原中心[12]。目前国内在利用微生物制备AgNPs方面的研究还不多,本研究从石斛中分离得到一株内生真菌,其代谢产物能有效制备具有抗菌作用的纳米银粒子。本文就该内生真菌的分离和鉴定、其代谢产物制备纳米银粒子的条件,以及纳米银粒子的表征和抗菌作用进行阐述和分析。
1.1 材料
1.1.1 生物材料
铁皮石斛,采集自安徽省霍山县。新鲜无病害石斛样品,去除根系和叶子,取茎秆置于冰盒中,24 h内带回实验室用于内生真菌的分离。
抑菌实验指示菌,金黄色葡萄球菌(Staphylocous aureus subsp. aureus CGMCC 1.1861)、志贺氏菌(Shigella dysenteriae CGMCC 1.1869)、沙门氏菌( Salmonella enterica subsp. Enterica CGMCC 1.1859),由江苏省农业科学院农产品加工研究所食品生物工程研究室提供。
1.1.2 主要仪器设备
PHS-2F型紫外-可见分光光度计(上海光谱仪器有限公司);DYY-2C型电泳仪(北京六一仪器厂);JEM-2100透射显微镜(日本)。
1.2 实验方法
1.2.1 内生真菌的分离培养
采用水琼脂法[13]进行内生菌的分离。新鲜石斛茎秆经自来水清洗干净,以70%酒精溶液浸泡1 min,无菌水冲净,用无菌刀片切去茎秆两端约0.5 cm,中间部分切割成1~2 cm长的小段,置于水琼脂分离平板上,25 ℃黑暗培养。待样品表面或边缘出现菌丝生长,挑取菌丝转接到新鲜YPD培养基(1%酵母膏、2%蛋白胨和2%葡萄糖)上培养,待纯化后制成斜面4 ℃保存。
1.2.2 内生真菌的分子生物学鉴定
YPD平板上的新鲜菌丝,接种于YPD液体培养基,120 r/min、25 ℃培养4~5 d。过滤分离得到菌体,菌体用去离子水洗涤至滤过液无颜色。采用真菌基因组DNA提取试剂盒(BioFlux)提取菌株DNA,以引物NS1(GTA GTC ATA TGC TTG TCT C)和NS8(TCC GCA GGT TCA CCT ACG GA)进行18S Rdna序列的扩增,50 mL PCR扩增反应体系为:模板DNA 2 mL、10×PCR buffer (50 mM KCl, 15 mM MgCl2,100 mM Tris-HCL, pH 9.0) 5 mL、Taq DNA聚合酶(Biotech) 2.5 unit、Dntp (2.5 mM) 4 mL、引物各3 mL,补充去离子水至50 mL。于94 ℃预变性5 min后,反应程序为94 ℃变性40 s、50℃退火40 s 、72 ℃延伸40 s,共34个循环,于72 ℃最终延伸5 min。PCR产物用1%凝胶电泳进行检测,送交上海生工生物工程技术服务有限公司测序,序列提交到GenBank核酸序列数据库并得到登陆号。通过blastn程序与GenBank中核酸序列进行比对分析,筛选同源性较高的典型菌株,采用Mega5.0软件用于系统发育分析,构建系统进化树。
1.2.3 纳米银粒子的制备
内生真菌新鲜菌丝,接种于YPD液体培养基,120 r/min、25 ℃培养4~5 d。过滤分离菌体和发酵液,菌体用去离子水洗涤至滤过液无颜色后,浸泡于与原发酵体系相同体积的去离子水中,静置48 h。过滤菌体浸泡液,滤液中加入终浓度为1 mM的AgNO3溶液,室温静置。以产物特征吸收光谱及抑菌活性为指标,考察不同光照(黑暗和自然光照)、pH(2~13)、温度(40、60和80 ℃)条件对纳米银产生的影响。
1.2.4 体外抑菌实验
采用平板孔阱扩散法研究纳米银的抗菌活性[13]。将活化好的试验指示菌种用冷却的肉汤培养基稀释至106cfu/mL以上,倒平板。待培养基冷凝后,用直径为7 mm的打孔器于平板上均匀打出三个孔,吸取纳米银溶液50 μL注入孔中,37 ℃下分别培养24 h后测量抑菌圈大小,计算平均值。
1.2.5 纳米银特性表征
1.2.5.1 紫外-可见(UV-Vis)光谱扫描
制备所得的纳米银溶液置于石英比色皿中,采用分光光度计进行紫外-可见光谱扫描,扫描波长范围为210~700 nm,带宽2 nm。
1.2.5.2 透射电镜
吸取制备所得的纳米银溶液滴到碳膜覆盖的铜网上,室温条件下自然晾干,采用透射电镜观察纳米银粒子的大小和形貌。
1.2.6 数据统计分析
试验重复3次,数据分析采用SPSS 11.0统计软件进行分析,结果以 D表示。
D表示。
2.1 内生真菌的分离和鉴定
石斛样品经表面消毒后,转移至YPD平板并接触3 min后取出,平板于25 ℃培养7 d后无任何微生物生长,说明表面消毒处理彻底。置于水琼脂平板上的新鲜石斛样品中分离得到一株内生真菌,图1a为该菌株在石斛宿主分离平板上的状态,该菌株自样品切口处长出。转移至YPD新鲜培养基上进一步纯化,将其编号为DO-1,菌株生长初期为白色菌丝,随着培养时间的延长,菌丝转化为红色,尤其是培养基背面,呈深紫红色(图1b和c)。显微镜下观察可见明显的具有隔膜的长椭圆形或镰刀形分生孢子,顶端钝圆或略尖,大小为(3~10)μm×(2~4)μm(图1d),符合镰刀菌属真菌的特征。
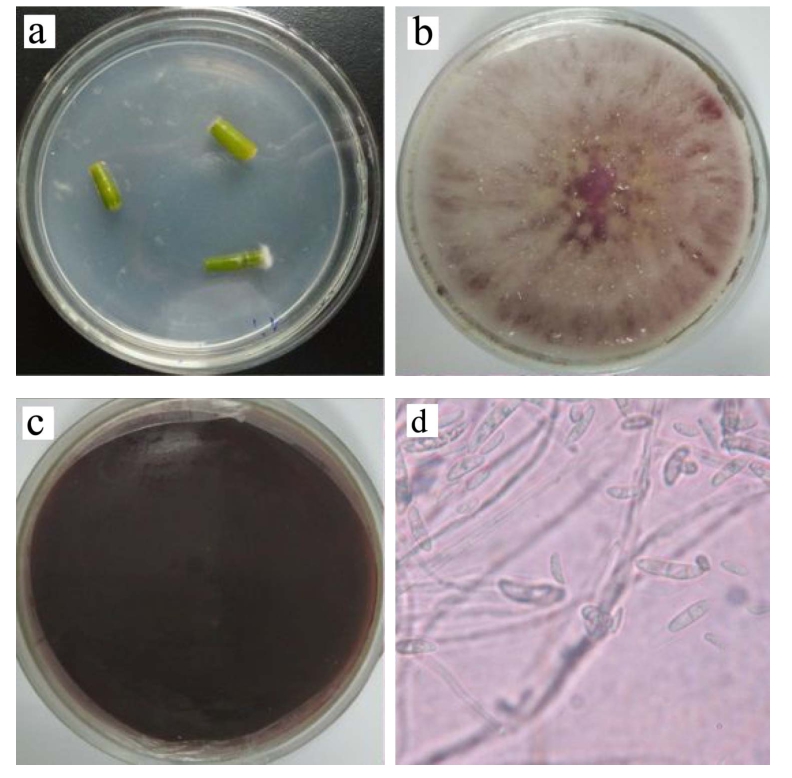
图1 石斛内生真菌菌落和显微形态
Fig.1 Colony and microscopic characteristics of the endophytic fungus isolated from Dendrobium candidum
对DO-1进行18S rDNA序列的扩增,并测序,得到1716 bp的序列。序列提交到Genbank,得到Accession number为KU215418。通过blastn程序与GenBank中核酸序列进行比对分析,筛选与DO-1同源性较高的典型菌株用于系统发育分析,构建系统进化树,如图2,可以看出DO-1与禾谷镰刀菌Fusarium graminearum(有性态Gibberella zeae)具有相当高的亲缘关系,处于同一分支中。
植物内生真菌是一类生长于健康活体植物组织中的特殊的真菌,具有独特的分类学和生物学特性,近年来的研究发现内生真菌代谢产物具有丰富多样的新颖的生物活性[14]。用于制备纳米粒子的生物材料中,镰刀菌是一类应用较多的真菌。Mukherjee等[15]首次报道了利用尖孢镰刀菌胞外合成金纳米颗粒,胞外还原的关键在于该菌能够释放出大量以辅酶NADH为主的还原性蛋白质,将[AuCl4]-还原。随后,镰刀菌被广泛报道应用于胞外制备CdS、Ag、Au-Ag、TiO2、SiO2和Fe3O4等纳米颗粒[12,16,17]。
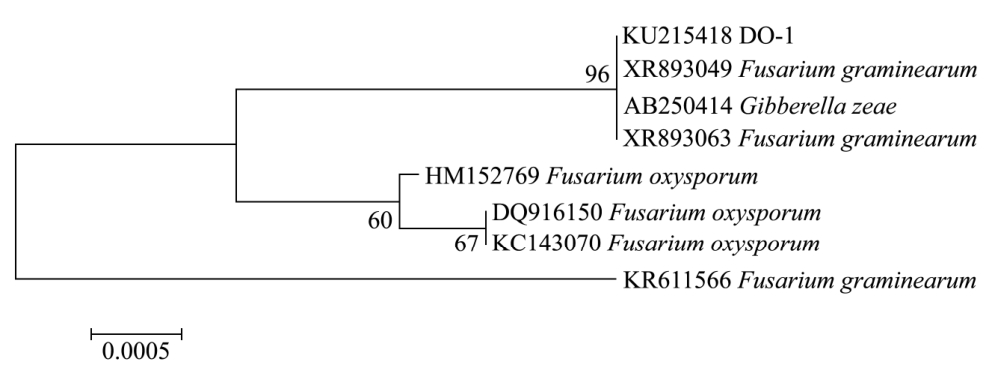
图2 内生真菌的系统进化树
Fig.2 Phylogenetic tree of the endophytic fungus
2.2 内生菌功能因子的定位
研究发现,AgNO3溶液在特定体系中被还原成纳米银粒子后产生红棕至棕褐色的纳米银溶胶,在410~450 nm范围内产生特征性等离子吸收峰,利用这一特性可快速检测纳米银粒子的产生[12,18,19]。

图3 AgNO3溶液与不同反应体系作用后的UV-Vis扫描光谱
Fig.3 UV-visible spectroscopy of the mixture of AgNO3and different filtrate
注:1代表AgNO3溶液;2代表发酵液;3代表发酵液+AgNO3溶液;4代表菌体浸泡液;5代表菌体浸泡液+AgNO3溶液。
本研究过滤分离F.graminearum DO-1培养物得到菌体和发酵液,去离子水洗涤菌体至滤过液无颜色后,浸泡于相同体积的去离子水中48 h,得到菌体浸泡液。发酵液和菌体浸泡液中分别加入终浓度为1 mM的AgNO3溶液,室温静置48 h后观察,发酵液无显著变化,菌体浸泡液由无色变为红棕色,紫外-可见光谱扫描显示,菌体浸泡液与AgNO3溶液作用后在440~450 nm范围内有显著的等离子吸收峰,而发酵液与AgNO3溶液作用后无明显的特征吸收峰(图3)。两种产物体系的抑菌实验结果显示(表1),1 mM AgNO3溶液、未添加AgNO3溶液的发酵液以及菌体浸泡液对照均无抑菌活性,菌体浸泡液与AgNO3溶液反应后的混合液对受试的三种常见食品腐败菌具有明显的抑制活性,而发酵液与AgNO3溶液反应后仍无活性。UV-Vis光谱结合抑菌实验的结果,验证了菌体浸泡液体系中可能存在催化银离子发生还原变化产生纳米银的成分,而发酵过程中的胞外代谢产物并不具有还原纳米银粒子的作用,这也许是因为营养缺陷的去离子水环境可以刺激菌体细胞分泌某些具有还原作用的功能因子。进一步的研究采用菌体浸泡液为对象。
表1 AgNO3溶液与不同反应体系作用后产物的抑菌效果
Table 1 Antibacterial activities of the mixture of AgNO3and different filtrate

注:“-”表示无抑菌圈。图中数值为抑菌圈直径?。
?
2.3 光照条件对纳米银粒子产生的影响
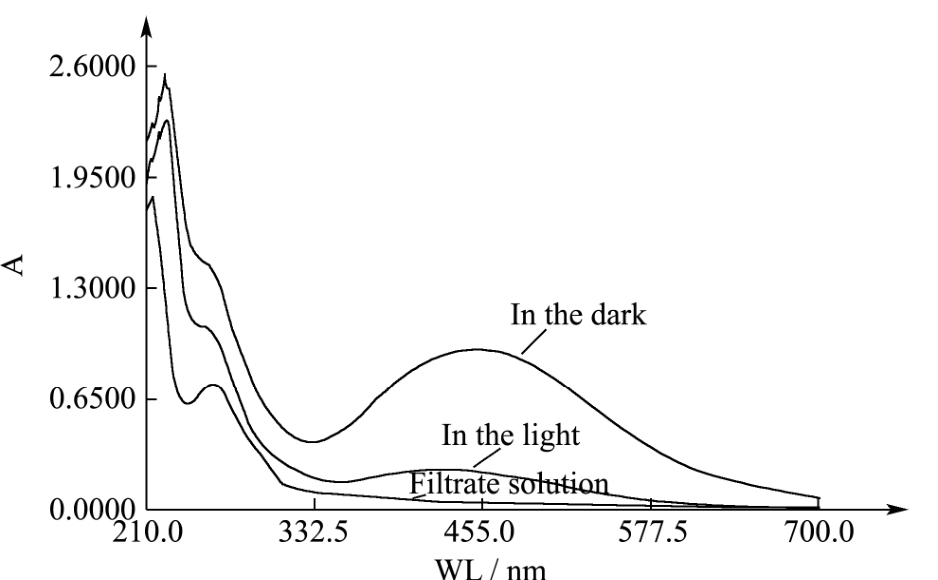
图4 不同光照条件下制备的纳米银粒子的UV-Vis扫描光谱
Fig.4 UV-visible spectroscopy of AgNPs under different light conditions
表2 不同光照条件下纳米银粒子的抑菌实验结果
Table 2 Antibacterial activities of AgNPs under different light conditions

将菌体浸泡液与终浓度为1 mM的AgNO3溶液混合后分别在锡箔纸包裹的黑暗条件以及自然光照条件下放置48 h,结果显示黑暗条件下反应体系的颜色变化显著高于光照条件。图4为两种条件下混悬液的UV-vis扫描光谱图,黑暗条件下440~450 nm范围内的特征吸收峰信号显著高于光照条件。黑暗条件有助于纳米银粒子的生成。抑菌实验结果(表2)显示黑暗条件下反应产物的抑菌活性显著高于光照条件下的反应产物。
关于纳米阴离子生物合成的机理研究得很少,部分报道推测生物反应体系中存在酶或非酶类物质作为氧化还原中心,使银离子被还原[12]。目前有不少研究采用植物提取物或没食子酸等还原剂来制备纳米银[20~22],这些还原性物质或体系大多具有在光照条件下易氧化的特定。因此根据结果推断,本研究中菌体浸泡液中所含有的还原性活性组分在光照条件下不稳定,而黑暗条件更适宜纳米银的生成。
2.4 pH对纳米银合成及抑菌活性的影响

图5 不同pH菌体浸泡液与AgNO3溶液反应体系的UV-Vis扫描光谱
Fig.5 UV-visible spectroscopy of AgNPs at different pH levels
表3 不同pH条件下纳米银粒子的抑菌实验结果
Table 3 Antibacterial activity of AgNPs at different pH

F.graminearum DO-1菌体浸泡液的初始pH为6.81±0.06,以HCl或NaOH调节菌体浸泡液至不同pH,与AgNO3溶液反应,结果显示不同pH对纳米银的产生影响非常显著。pH 2条件下反应体系几乎不变色,维持原菌体浸泡液的无色,随着pH的增加,反应体系逐渐变为红棕色并加深,当pH达到9时,体系颜色已成为棕褐色。图5为不同pH菌体浸泡液与AgNO3溶液反应体系的UV-vis扫描光谱,pH 2和3反应体系的纳米银特征吸收峰很小,pH 4~8条件下特征吸收峰差异不显著,pH达到9以上纳米银特征吸收峰的峰值快速上升。Nayak等[21]在采用两种植物树皮提取物制备纳米银粒子的研究中也得到了类似的结果,pH为10的碱性条件 下纳米银产生的速率显著高于低pH环境。但很少有报道同时检测不同pH条件得到的纳米银的生物活性。
为了消除pH对抑菌实验的影响,本研究将不同pH条件下的反应混合液在10000 r/min、4 ℃条件下离心20 min,沉淀用去离子水洗涤2次后重新悬浮,进行抑菌实验,结果见表3。不同pH条件下得到的纳米银粒子的抑菌活性存在显著差异,pH 7~8范围内得到的纳米银粒子的抑菌活性相比之下较高。F.graminearum DO-1菌体浸泡液的初始pH为6.81±0.06,接近pH 7,因此选择最佳反应体系pH为7。
目前国内外关于纳米银的制备的研究中,一般仅根据UV-vis光谱中吸收峰的强弱判断纳米银的产生效率。本研究结合UV-vis扫描光谱和抑菌实验结果,可以推断吸收峰的峰值与抑菌活性之间不存在完全的正相关性。而且由图5可见,随着pH的升高,吸收峰的位置逐渐向低波长变化,碱性条件反应体系呈现的强吸收峰现象并非生成纳米银粒子的结果,而可能是由于菌体浸泡液的某些组分在碱性pH条件下结构不稳定,发生了氧化或其他变化,从而引起了吸收峰的峰值剧增。因此需要进一步采用其他手段验证纳米银粒子形态特性与抑菌活性之间的关系。
2.5 温度对纳米银合成及抑菌活性的影响
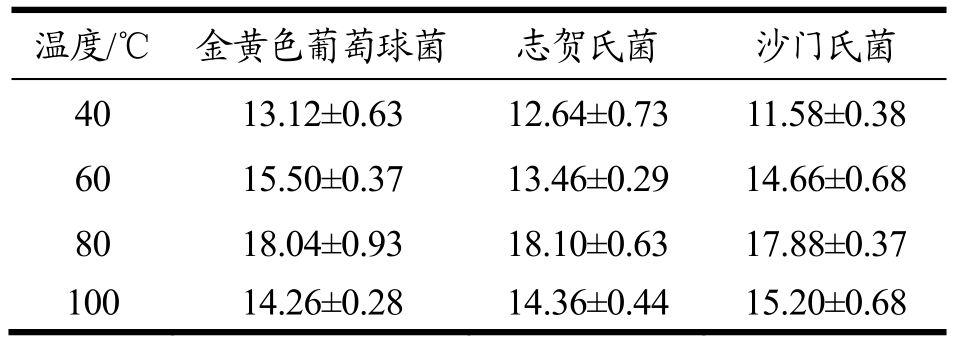
菌体浸泡液与AgNO3溶液混合体系分别置于40、60、80和100 ℃水浴中,反应过程中观察高温下混合溶液的颜色迅速变为红棕色,3 h后检测,80 ℃条件下混合溶液在440~450 nm处的特征吸收峰信号显著高于其他温度条件下的产物(图6)。适当的高温有助于纳米银粒子的快速生成,但温度过高又会抑制纳米银粒子产生。抑菌实验结果(表4)显示80 ℃条件下的反应产物的抑菌活性也显著高于其他温度条件下的反应产物。由此可见,菌体浸泡液中的活性组分能耐受一定的高温,制备纳米银的最适温度为80 ℃,适度高温不仅提高了纳米银的生成速率,甚至对纳米银的粒径形貌也有一定影响,从而增强了产物的抗菌活性。

图6 不同温度条件下制备的纳米银粒子的UV-Vis扫描光谱
Fig.6 UV-visible spectroscopy of AgNPs at different temperatures
表4 不同温度条件下纳米银粒子的抑菌实验结果
Table 4 Antibacterial activities of AgNPs at different temperatures
?
2.6 纳米银粒子的形貌特性表征

图7 纳米银粒子的透射电镜图像
Fig.7 Transmission electron micrograph of the AgNPs
根据上述制备条件优化的结果,将F.graminearum DO-1菌体浸泡液调节pH至7,与终浓度为1 mM的AgNO3溶液于80 ℃、黑暗条件下反应3 h,获得纳米银粒子,进行透射电镜分析。图7为纳米银粒子的透射电镜图像,制备的纳米银粒子为球形,直径范围2~50 nm。调节放大倍数至一定程度,可见纳米银粒子表面的晶格条纹(图7)。
3.1 近年来有不少生物法合成AgNPs的报道,微生物材料是目前最常见的生物还原材料,但是采用细菌制备的纳米材料大多数分布在菌体细胞内部,给纳米颗粒的下游纯化加工带来了一定的困难,从而限制了它的应用。真菌具有较高的金属离子耐受性、能高效分泌水溶性蛋白和其他还原性组分、易于扩大培养和容易后处理等优点,因而在胞外合成纳米粒子方面具有较大的潜力。
3.2 本研究分离得到一株石斛内生真菌,鉴定为禾谷镰刀菌,其菌体的去离子水浸泡液具有制备纳米银粒子的功能,在pH 7、80 ℃黑暗条件下反应3 h,得到的纳米银粒子为球形,直径范围2~50 nm,对金黄色葡萄球菌、志贺氏菌和沙门氏菌均有很好的抑制作用。应用该内生真菌代谢产物制备具有抑菌功能的纳米银粒子,方法简单,条件温和,符合现代绿色生态的发展趋势。对F.graminearum DO-1代谢产物中具有还原制备纳米银的功能因子的研究在进一步研究中。
参考文献:
[1] Lloyd J R, Byrne J M, Coker V S. Biotechnological synthesis of functional nanomaterials [J]. Current Opinion in Biotechnology, 2011, 22(4): 509-515
[2] Xiao X, Ma X B, Yuan H, et al. Photocatalytic properties of zinc sulfide nanocrystals biofabricated by metal-reducing bacterium Shewanella oneidensis MR-1 [J]. Journal of Hazardous Materials, 2015, 288: 134-139
[3] El-Rafie M H, Mohamed A A, Shaheen T I, et al. Antimicrobial effect of silver nanoparticles produced by fungal process on cotton fabrics [J]. Carbohydrate Polymers, 2010, 80(3): 779-782
[4] Gopinath V, MubarakAli D, Priyadarshini S, et al. Biosynthesis of silver nanoparticles from Tribulus terrestris and its antimicrobial activity: a novel biological approach [J]. Colloids Surf B Biointerfaces, 2012, 96(1): 69-74
[5] Shing C Y , Whiteley C G, Lee D J. HIV protease: Multiple fold inhibition by silver nanoparticles-spectrofluorimetric, thermodynamic and kinetic analysis [J]. Journal of the Taiwan Institute of Chemical Engineers, 2014, 45(4): 1140-1148
[6] Mytych J, Pacyk K, Pepek M, et al. Nanoparticle-mediated decrease of lamin B1 pools promotes a TRF protein-based adaptive response in cultured cells [J]. Biomaterials, 2015, 53: 107-16
[7] Arora S, Jain J, Rajwade J M, et al. Cellular responses induced by silver nanoparticles: In vitro studies [J]. Toxicology Letters, 2008, 179(2): 93-100
[8] Fayaz A M, Balaji K, Girilal M, et al. Biogenic synthesis of silver nanoparticles and their synergistic effect with antibiotics: a study against gram-positive and gram-negative bacteria [J]. Nanomedicine, 2010, 6(1): 103-109
[9] Mohammed Fayaz A, Balaji K, Girilal M, et al. Mycobased synthesis of silver nanoparticles and their incorporation into sodium alginate films for vegetable and fruit preservation [J]. Journal of Agricultural and Food Chemistry, 2009, 57(14): 6246-6252
[10] Rao C N R, Cheetham A K. Science and technology of nanomaterials: current status and future prospects [J]. Journal of Materials Chemistry, 2001, 11(12): 2887-2894
[11] Sathishkumar Y, Devarayan K, Ki C, et al. Shape-controlled extracellular synthesis of silver nanocubes by Mucor circinelloides [J]. Materials Letters, 2015, 159(159): 481-483
[12] Duran N, Marcato P D, Alves O L, et al. Mechanistic aspects of biosynthesis of silver nanoparticles by several Fusarium oxysporum strains [J]. J. Nanobiotechnology, 2005, 3(1): 1-7
[13] Liu X L, Huang K H, Zhou J Z, et al. Identification and antibacterial characteristics of an endophytic fungus Fusarium oxysporum from Lilium lancifolium [J]. Letters in Applied Microbiology, 2012, 55(6): 399-406
[14] Strobel G, Daisy B. Bioprospecting for microbial endophytes and their natural products [J]. Microbiology and Molecular Biology Reviews, 2003, 67(4): 491-502
[15] Mukherjee P, Senapati S, Mandal D, et al. Extracellular synthesis of gold nanoparticles by the Fungus fusarium Oxysporum [J]. Chem. Bio. Chem., 2002, 3(5): 461-463
[16] Sogra Fathima B, Balakrishnan R M. Biosynthesis and optimization of silver nanoparticles by endophytic fungus Fusarium solani [J]. Materials Letters, 2014, 132(10): 428-431
[17] Husseiny S M, Salah T A, Anter H A. Biosynthesis of size controlled silver nanoparticles by Fusarium oxysporum, their antibacterial and antitumor activities [J]. Beni-Suef University Journal of Basic and Applied Sciences, 2015, 4(3): 225-231[18] Mohapatra B, Kuriakose S, Mohapatra S. Rapid green synthesis of silver nanoparticles and nanorods using Piper nigrum extract [J]. Journal of Alloys and Compounds, 2015, 637(3): 119-26
[19] Singh D, Rathod V, Ninganagouda S, et al. Biosynthesis of silver nanoparticle by endophytic fungi Pencillium sp. isolated from Curcuma longa (turmeric) and its antibacterial activity against pathogenic gram negative bacteria [J]. Journal of Pharmacy Research, 2013, 7(5): 448-53
[20] Saravanakumar A, Ganesh M, Jayaprakash J, et al. Biosynthesis of silver nanoparticles using Cassia tora leaf extract and its antioxidant and antibacterial activities [J]. Journal of Industrial and Engineering Chemistry, 2015, 28: 277-81
[21] Nayak D, Ashe S, Rauta P R, et al. Bark extract mediated green synthesis of silver nanoparticles: Evaluation of antimicrobial activity and antiproliferative response against osteosarcoma [J]. Materials Science and Engineering: C, 2016, 58(30): 44-52
[22] Kim D Y, Suk Sung J, Kim M, et al. Rapid production of silver nanoparticles at large-scale using gallic acid and their antibacterial assessment [J]. Materials Letters, 2015, 155: 62-64
Green Biosynthesis of Silver Nanoparticles Using an Endophytic Fungus
Abstract:DO-1, an endophytic fungus, was isolated from Dendrobium candidum and identified as Fusarium graminearum. The fungal biomass was immersed in distilled water, and the filtrate solution containing the metabolites was obtained. Silver nanoparticles (AgNPs) with antimicrobial activity were biosynthesized by mixing the filtrate solution with silver nitrate. The plasma absorption peak of UV-visible spectroscopy and antibacterial activity were measured to assess the effects of light, temperature, and pH on AgNP biosynthesis. Darkness and suitable high temperatures were beneficial to the biosynthesis and antibacterial activity of AgNPs and absorbance at 440~450 nm increased with increasing pH. The highest antibacterial activity was observed at pH 7~8, and it decreased at higher pH levels. AgNPs synthesized from F. graminearum DO-1 filtrate solution and 1 mM silver nitrate at pH 7 and 80 ℃ for 3 h in the darkness, were spherical shaped with the diameter range of 2~50 nm. The method of AgNPs biosynthesis used herein is simple, uses mild conditions, and is eco-friendly.
Key words:endophytic fungus; Fusarium graminearum; silver nanoparticles; antibacterial activity
文章篇号:1673-9078(2017)1-119-124
DOI:10.13982/j.mfst.1673-9078.2017.1.019
收稿日期:2016-02-02
基金项目:国家自然科学基金青年科学基金项目(31401534);江苏省农业科学院基本科研业务专项项目(ZX(15)4044)